双荧光素酶报告基因分析promega
dual-luciferase

双荧光素酶报告系统作者:windyrain 2008-05-29 21:54:33标签:杂谈双荧光素酶报告基因测试∶结合萤火虫和海洋腔肠荧光素酶先进的共报告基因测试技术在用萤火虫荧光素酶定量基因表达时,通常采用第二个报告基因来减少实验的变化因素。
但传统的共报告基因(比如CAT,β-Gal,GUS)不够便利,因为各自的测试化学,处理要求,检测特点存在差异。
Promega提供一种先进的双报告基因技术,结合了萤火虫荧光素酶测试和海洋腔肠荧光素酶测试。
双荧光素酶报告基因测试系统,结合pRL载体系统,表达第二个报告基因海洋腔肠荧光素酶,在单管中进行双荧光素酶报告基因测试,快速,灵敏,简便。
系统还提供PLB裂解液,用来裂解在多孔板中培养的哺乳细胞,不需操作单个样品。
对于正在使用萤火虫荧光素酶报告基因载体的研究人员。
双荧光素酶报告基因测试系统将使他们立即体会到该系统的便利。
介绍有内参照双报告基因用于实验系统中作相关的或成比例的检测, 通常一个报告基因作为内对照, 使另一个报告基因的检测均一化。
检测基因表达时双报告基因通常用来瞬时转染培养细胞,带有实验报告基因的载体共转染带有不同的报告基因作为对照的第二个载体。
通常实验报告基因偶联到调控的启动子, 研究调控基因的结构和生理基础。
报告基因表达活力的相对改变与偶联调控启动子转录活力的改变相关,偶联到组成型启动子的第二个报告基因,提供转录活力的内对照, 使测试不被实验条件变化所干扰。
通过这种方法, 可减少内在的变化因素所削弱的实验准确性, 比如, 培养细胞的数目和活力的差别, 细胞转染和裂解的效率。
使用萤火虫荧光素酶,结合氯霉素乙酰转移酶(CAT), β-半乳糖苷酶(β-Gal), 或葡萄醛酸糖苷酶(GUS)的双报告基因,近几年已普遍使用。
但这些双报告基因组合削弱了荧光素酶操作的优势, 比如荧光素酶测试和定量可在几秒钟内进行, 但CAT, β-Gal和GUS测试法, 则在定量前需要长时间的保温。
双荧光素酶报告基因实验步骤

双荧光素酶报告基因实验步骤实验目的:本实验采用双荧光素酶(Dual-Luciferase)报告系统,探究基因调控机制。
通过构建表达报告基因的质粒,研究不同因素对基因转录的影响。
实验材料:1. 双荧光素酶检测试剂盒(Promega)2. 293T细胞系3. Lipofectamine 2000转染试剂4. 培养基(DMEM + 10% FBS)实验步骤:1. 构建表达报告基因的质粒。
选择含有目标基因启动子区域的DNA片段,与质粒载体pGL3-基因报告载体连接,形成表达质粒pGL3-目标启动子-火萤酶(Luciferase)。
2. 细胞培养。
将293T细胞接种于6孔板中,培养至70-80%的稳定生长。
注意,细胞仅用到2×105个,否则检测结果会受内源性酶的影响。
3. 细胞转染。
将转染试剂与质粒混合,加入到细胞培养皿中。
注意,Lipofectamine 2000转染试剂与质粒的比例应按照转染试剂说明书进行调整。
4. 点亮荧光素酶(Luciferase)。
在细胞转染后48小时,加入荧光素酶检测试剂和积木酶抑制剂,使细胞产生发光,并通过微量板阅读器记录荧光值。
5. 关闭荧光素酶(Luciferase)。
在荧光素酶检测试剂作用后加入积木酶检测剂,称为“阻滞液”,使细胞发出的光信号被阻断。
加入Renilla荧光素酶检测试剂,使细胞重新产生新的发光信号,并通过微量板阅读器记录荧光值。
6. 数据统计。
按照公式计算相邻荧光信号的比值(荧光素酶/Renilla荧光素酶),以此作为表达目标启动子的相对活性。
(注意,双荧光素酶检测试剂盒中已包含此项标准)实验结果:通过双荧光素酶报告系统,研究了不同生物因素对基因转录的影响。
在细胞实验中,通过记录不同重复单元(replicate)的相对活性,为科研人员提供基因调控机制的新思路。
(数据统计请参照附表)结论:本实验采用双荧光素酶报告系统,通过构建表达报告基因的质粒,检测对基因转录的影响。
Promega--双萤光素酶报告基因

SEAP(分泌性碱 性磷酸酶) CAT(氯霉素转乙 酰基酶) GFP(绿色荧光蛋 白)
•分泌性报告基因 (不需裂 解) -真核细胞没有背景表达 -易于使用 -设备现成(液闪仪,层析) •显微镜: 亚细胞定位 •不需底物
萤光素酶报告基因的主要优点
• • • • 非放射性 检测快(比CAT等) 灵敏度高(可比CAT检测灵敏度高100倍) 半衰期短(在理想条件下,可检测到10-20 摩尔的萤光素酶 分子。在哺乳动物细胞中半衰期3小时,在植物细胞中半衰 期3.5小时。而CAT在哺乳动物细胞中的半衰期约50小时)
•细菌,血清等内源活性高 •需要底物
GUS(葡糖醛酸糖 苷酶)
•灵敏度好 •植物中内源活性低
• 90% 的 E.coli, 人/动物细胞中 有内源活性 •酶的扩散可引起 “过度报告” •需要底物
•在 HeLa , 癌 和其它细胞类型 中有高的内源活性 •需要底物 •放射性的 •灵敏度底 •50h半衰期 •背景可能高 •折叠 “情形” 可导致信号差别
荧光计(Fluorometer)
液闪仪(Scintilation Counter) 电荷耦合装置光学成像系统 (CCD opitical imaging system)
荧光显微镜
各种报告基因的优点和缺点
报告基因 萤光素酶 优点
•优越的灵敏度 –高信号值 –无内源活性
•灵敏度好
缺点
•需要底物
ß-gal
0.76 0.71 0.79 0.74
第二天处理C计算如下:
1.00
1
2 3
处理D
Δ 活性倍数 (791,021/19,154) =
41,30 55,81
(16,062/21,631)
美谷分子酶标仪:如何用注射器卡盒在酶标仪上进行双荧光素酶报告基因实验(DLR)

美谷分子酶标仪:如何用注射器卡盒在酶标仪上进行双荧光素酶报告基因实验(DLR)简介报告基因实验一般用来研究真核生物的基因表达。
在双报告基因实验中,细胞都转染了两种质粒,一种含有的目的基因调控的启动子,另一种包含一个质控基因的组成型启动子。
将目的报告基因与质控报告基因共转染,最小程度减少实验误差。
生物发光报告系统广泛联合使用萤火虫和海肾荧光素酶,因为它们都很容易操作且极其灵敏。
Promega公司的双报告基因实验(DLR)系统允许使用者在一个微孔板孔中分别检测萤火虫和海肾荧光素酶活性,其中萤火虫作为实验报告,海肾作为质控基因。
Figure 1展示了两个酶促反应,按顺序发生在相同的实验孔中。
萤火虫荧光素酶催化的荧光素的氧化会伴随着光的释放。
反应需要ATP, Mg2+ 和O2。
海肾荧光素酶催化氧气依赖型腔肠动物荧光素,但是不需要ATP或Mg2+。
酶有着不同的底物要求,所以它们可以在一个反应体系中完成。
双报告基因实验需求两种不同的试剂含有不同的底物,每次都需要进行化学发光读数。
这种实验流程可以轻松在SpectraMax i3x多功能酶标仪的注射器卡盒上进行,这套体系已通过DLReady体系认证。
我们在这篇应用文章中向大家展示了重组萤火虫荧光素酶和海肾荧光素酶的6个数量级的线性范围检测,同时进行了每孔195到25000个被转染细胞的线性检测。
Figure 1. Reactions catalyzed by firefly and Renilla luciferases. Firefly and Renillaluciferasehave different substrate requirements.优势•6数量级线性范围的高灵敏度荧光素酶定量检测•利用SoftMax Pro软件自动分析和计算数据,实现报告基因规范化检测•智能加样技术优化试剂混匀结果材料双报告基因实验系统(Promega cat.#E1960),包括:•荧光素酶检测试剂II•荧光素酶检测底物•Stop & Glo 缓冲液•Stop & Glo 底物•5X Passive 裂解缓冲液纯化重组荧光素酶:•萤火虫荧光素酶: QuantiLum® Recombinant Luciferase (Promega cat. #E1701)•海肾荧光素酶: Recombinant Renilla Luciferase (RayBiotech cat. # RB-15-0003P-10) CHO-K1 细胞(ATCC cat.#CCL-61)质控荧光素酶质粒:•pGL4.13[luc2/SV40] 萤火虫荧光素酶质粒(Promega cat. #E6681)•pGL4.74[hRluc/TK] 海肾萤火虫酶质粒(Promega cat. #E6921)Fugene高效转染试剂(Promega cat.#E2311)6孔组织培养板(Corning cat. #3516)96孔平底底透白色TC处理板(Corning cat. #3610)光学放大的封膜(Genesee cat.#12-639)白色96和384孔微孔板(Greiner cat.#655075 and #781075)SpectraMax i3x 多功能微孔板读板机SpectraMax 注射器卡盒方法酶标准曲线制备萤火虫荧光素酶贮存液,用含有1mg/mL BSA的1X Passive 裂解缓冲液(PLB,一种双荧光素报告实验系统)将贮存液从12.4mg/ml稀释到1mg/ml。
双荧光素酶系统实验操作步骤及方法-

3. Stop & Glo® Reagent配制:现用现配,先将Stop & Glo® Buffer放在37度温箱中平衡至室温(15-30min),再 将1倍体积的50X Stop & Glo® Substrate加入49倍体积的将 Stop & Glo® Buffer中。
B.样品制备
1. 仔细地将生长培养基从待检细胞孔中吸出。用1XPBS漂洗 细胞2-3次。此过程必须仔细,并尽量将漂洗用PBS 吸尽
6. 测量完毕后,请将最后检测的EP管取出后,关闭仪器。 7. 实验结果的处理与分析:采用双样本等方差t检验进行处
理,P<0.05为差异显著,P<0.01为差异极显著。
四、注意事项
由于温度对酶反应有影响,所以测定时样品和试剂均需达 到室温后再进行测定。
Renilla荧光素酶检测工作液后需配制后立即使用,不可配 制成工作液后长期保存。
刺激物处理 转染细胞 启动子-Luc
未处理对照
LUC
细胞内目的基因 的转录被激活
启动子
测得的荧光值
启动子-Luc的 启动子被激活
Luc的转录 Luc表达量
同时,为了减少内在的变化因素(如:培养细胞的数目 和活力的差别,细胞转染和裂解的效率等)对实验准确 性的影响,将带有海肾荧光素酶基因(Rinilla luciferase) 的质粒(phRL-TK)作为对照质粒与报告基因质粒共转 染细胞,提供转录活力的内对照,使测试结果不受实验 条件变化的干扰。
率,因而非常灵敏。另外,在宿主细胞及检测试剂中均检 测不到背景发光。 检测快速,每个样品只需几秒钟。
二、实验原理
利用荧光素酶与底物结合发生化学发光反应的特性,把感兴趣 的基因转录的调控元件克隆在萤火虫荧光素酶基因(firefly luciferase)的上游,构建成荧光素酶报告质粒。然后转染细胞, 适当刺激或处理后裂解细胞,测定荧光素酶活性。通过荧光素酶 活性的高低判断刺激前后或不同刺激对感兴趣的调控元件的影响。
Dual-Luciferase 双荧光素酶报告基因检测系统
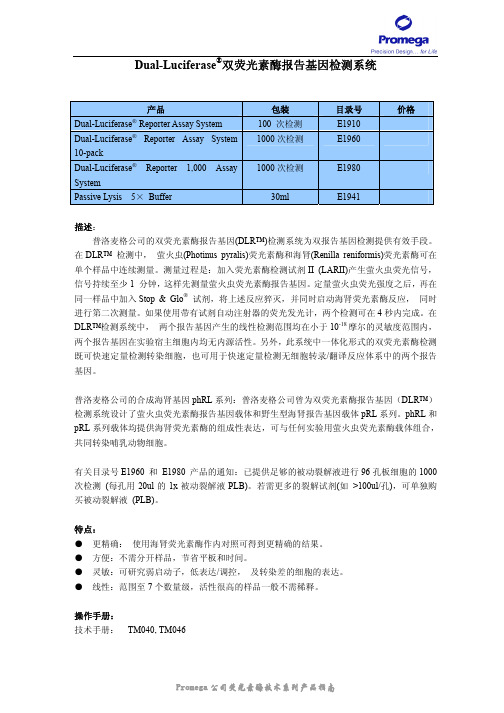
Dual-Luciferase®双荧光素酶报告基因检测系统产品包装目录号价格Dual-Luciferase® Reporter Assay System 100 次检测E19101000次检测E1960Dual-Luciferase® Reporter Assay System10-pack1000次检测E1980Dual-Luciferase® Reporter 1,000 AssaySystemPassive Lysis 5× Buffer 30ml E1941描述:普洛麦格公司的双荧光素酶报告基因(DLR™)检测系统为双报告基因检测提供有效手段。
在DLR™ 检测中,萤火虫(Photinus pyralis)荧光素酶和海肾(Renilla reniformis)荧光素酶可在单个样品中连续测量。
测量过程是:加入荧光素酶检测试剂II (LARII)产生萤火虫荧光信号,信号持续至少1 分钟,这样先测量萤火虫荧光素酶报告基因。
定量萤火虫荧光强度之后,再在同一样品中加入Stop & Glo®试剂,将上述反应猝灭,并同时启动海肾荧光素酶反应,同时进行第二次测量。
如果使用带有试剂自动注射器的荧光发光计,两个检测可在4秒内完成。
在DLR™检测系统中,两个报告基因产生的线性检测范围均在小于10-18摩尔的灵敏度范围内,两个报告基因在实验宿主细胞内均无内源活性。
另外,此系统中一体化形式的双荧光素酶检测既可快速定量检测转染细胞,也可用于快速定量检测无细胞转录/翻译反应体系中的两个报告基因。
普洛麦格公司的合成海肾基因phRL系列:普洛麦格公司曾为双荧光素酶报告基因(DLR™)检测系统设计了萤火虫荧光素酶报告基因载体和野生型海肾报告基因载体pRL系列。
phRL和pRL系列载体均提供海肾荧光素酶的组成性表达,可与任何实验用萤火虫荧光素酶载体组合,共同转染哺乳动物细胞。
双荧光素酶报告基因

双荧光素酶报告基因启动子活性分析(双荧光素酶报告基因实验)一、实验目的:分析启动子活性二、实验原理:荧光素酶报告基因的活性用Dual-Luciferase?Reporter AssaySystem(Promega)试剂盒来检测。
利用单通道多标记荧光检测仪测定荧光素酶活性。
在双荧光素酶系统中,除了用于检测启动子活性的萤火虫荧光素酶外,另外一种组成型表达的Renilla荧光素酶质粒PRL-TK也被同时转染入细胞内作为内参。
三、实验材料:Dual-Luciferase?Reporter Assay System (Promega)试剂盒,PBS,细胞裂解液,96孔,四、实验设备:单通道多标记荧光检测仪五、实验方法及步骤:1)启动子萤光素酶报告载体与共转染质粒按照质量等比例、总量0.8μg的原则转染细胞,36h后收获细胞;2)96孔板吸弃细胞培养基,PBS冲洗细胞一次,加入1×PLB细胞裂解液20μl,置于室温震荡裂解20min;3)轻轻吹打细胞,取10μl细胞裂解液加入50μl Luciferase Assay Reagent,轻轻震荡混匀,立刻置于单通道多标记荧光检测仪中测定Firefly Luciferase活性;4)读数后立即加入50μl Stop & Glo?Reagent轻轻震荡混匀,读取Renilla Luciferase活性;5)所得的结果为各个实验样品的Firefly Luciferase活性与Renilla荧光素酶活性的比值。
每个实验组重复3-4孔,整个实验独立重复3次。
实验结果均为3次独立的实验结果的平均值。
所有的结果均以平均值±标准差(mean±S.D.)表示。
六、注意事项1.做好对照。
2.多做几个复孔,求平均值。
七、补充知识点双荧光素酶报告基因实验1.试剂盒:Dual-Glo TM Luciferase Aassy System(promega E2920)组成如下:? Dual-Glo?萤光素酶缓冲液Dual-Glo?萤光素酶底物(冻干粉)Dual-Glo?Stop-Glo?缓冲液Dual-Glo?Stop-Glo?底物2.报告基因的作用细胞信号转导途径启动子/增强子受体结合病毒/细胞相互作用转录因子药物诱导作用或“效果”3.原理–制备含有luc/ R luc的DNA–转染–提供刺激–测量荧光–用海肾萤光素酶作对照归一实验变化归一反应=实验的(萤火虫萤光素酶)/ 对照的(海肾萤光素酶)4.载体- 萤火虫萤光素酶载体pGL3 家族pGL3-BasicpGL3-ControlpGL3-EnhancerpGL3-Promoter海肾萤光素酶报告基因载体pRL-TK5.试剂制备–将Dual-Glo? 萤光素酶缓冲液倒入Dual-Glo? 萤光素酶底物中,Dual-Glo? 萤光素酶试剂,分装后-70℃保存,避免反复冻融–用Dual-Glo? S top &Glo? 缓冲液按1:100 稀释Dual-Glo? Stop &Glo? 底物(现用现配)–所有的缓冲液存于室温, 所有的底物存于–20°C两步加入试剂:加,读,加,读6.检测步骤:实验前,将Dual-Glo? 萤光素酶试剂平衡到室温1.确认使用的细胞板可以用于荧光检测2.测萤火虫荧光素酶活性:向待测细胞板每孔中加入与培养基等体积的Dual-Glo? 萤光素酶试剂,混匀。
promega双荧光素酶说明书

promega双荧光素酶说明书
Promega双荧光素酶说明书
一、简介
Promega双荧光素酶系统是一种灵敏的报告基因检测工具,用于检测细胞
或组织中荧光素酶的表达水平。
该系统包括荧光素酶基因报告质粒、荧光素酶活性检测试剂和荧光检测仪。
通过将荧光素酶基因报告质粒转染到细胞中,可以监测荧光素酶的表达水平,从而了解基因的表达情况。
二、主要特点
1. 高灵敏度:可检测低至 pg荧光素酶的活性。
2. 快速:可在短时间内完成检测。
3. 简便:无需特殊设备,只需一台荧光检测仪即可完成检测。
4. 稳定:荧光素酶基因报告质粒可在细胞内稳定表达,提供可靠的检测结果。
三、使用方法
1. 转染荧光素酶基因报告质粒:将荧光素酶基因报告质粒转染到细胞中,按照说明书操作。
2. 培养细胞:在适宜条件下培养细胞,使荧光素酶表达。
3. 收集细胞:离心收集细胞,并洗涤去除培养基中的荧光素酶抑制剂。
4. 检测荧光素酶活性:将细胞悬浮在检测缓冲液中,加入荧光素酶活性检测试剂,充分混匀后进行荧光检测。
5. 数据分析:通过荧光检测仪获取数据,并使用相关软件进行数据分析。
四、注意事项
1. 请在专业人员的指导下操作。
2. 避免直接接触试剂,以免对皮肤和眼睛造成刺激。
3. 试剂应存放在阴凉干燥处,避免阳光直射和高温。
4. 转染荧光素酶基因报告质粒时,应遵循无菌操作原则,避免交叉污染。
双荧光素酶报告基因分析promega

双荧光素酶报告基因分析1. 介绍荧光素酶报告基因表达的转录调控常被用来研究培养细胞的生物学特性。
荧光素酶是理想的报告基因,因为哺乳动物细胞中不含内源性荧光素酶,一旦转录完成立刻就生成功能性的荧光素酶。
Dual-Luciferase®双荧光素酶报告基因检测系统中含有在同一细胞中同时表达的两种荧光素酶。
通常,报告基因实验中往往会受到各种实验条件的影响,共转染的“对照”报告基因会作为内对照,为试验提供一基准线。
实验报告基因经过内参照的处理可以减小细胞活性和转染效率对实验的影响,因此双报告系统减少了外部干扰,使得实验数据更可信。
实验中报告基因和对照基因的酶没有种源同源性,萤火虫荧光素酶和海肾荧光素酶对应不同的反应底物,反应中没有任何的交叉干扰。
萤火虫荧光素酶底物和海肾荧光素酶底物分别与检测试剂反应可以使灵敏度最大化。
由于超强的光信号和超高的信噪比,本系统被广泛用于制药和生物技术产业中。
双荧光素酶报告基因检测系统适配于各种培养哺乳细胞的培养基,如1640,MEM,DMEM,F12等。
这些试剂与被动裂解液所附带的试剂盒,可以从Promega试剂盒中分开,单独使用。
具有超高灵敏度和超宽线性范围的Veritas™微孔板发光检测仪特别适合DLR 报告基因检测系统,Veritas™软件中预装了DLR 的检测程序使得安装更为方便,内置自动加样器使得应用更为简单。
Veritas™微孔板发光检测仪使用荧光素酶检测试剂II (LAR II)最低可以检测到1X10-19 mol 荧光素酶分子,使用Stop & Glo®试剂可以检测到1X10-18 mol 海肾荧光素酶分子,检测线性范围分别为8 和6 个数量级。
所有的检测均采用纯化的重组萤火虫荧光素酶(E1701)和纯化的重组海肾荧光素酶。
图1-3 使用Promega 公司Dual-Luciferase®双荧光素酶报告基因检测系统,萤火虫荧光素酶(1x10-19 到1x10-11 mol)和海肾荧光素酶(1x10-14 mol)在Modulus™仪上测量结果。
双荧光素酶报告实验

13
03
参考案例
1
案例一
分别构建靶基因CADM1双荧光素酶报告基因载体以及与miR-XX结合位点突变的突变体:PGLOCADM1 WT和PGLO-CADM1 MUT。将两种报告质粒与过表达质粒miR-XX mimic和阴性对照质粒分别 共转染至肝癌细胞Huh7中,转染24 h后裂解细胞,12000 rpm离心1 min,收集上清。使用双荧光素酶 报告基因检测系统 (Dual-Luciferase® Reporter Assay System,E1910,Promega) 检测荧光素酶活性 。每个细胞样品中加入100 μL萤火虫荧光素酶工作液检测萤火虫荧光素酶 (Firely lueiferase),加入100 μL海肾荧光素酶工作液检测海肾荧光素酶 (Renilla lueiferase),以萤火虫荧光素酶与海肾荧光素酶作为 相对荧光素酶活性。实验重复3次。
报告基因检测系统 (Dual-Luciferase® Reporter Assay System,E1910,Promega) 检测荧光素酶活性
。每个细胞样品中加入100 μL萤火虫荧光素酶工作液检测萤火虫荧光素酶 (Firely lueiferase),加入100
Step2:共转染 μL海肾荧光素酶工作液检测海肾荧光素酶 (Renilla lueiferase),以萤火虫荧光素酶与海肾荧光素酶作为
14
03
参考案例
1
案例一
分别构建靶基因CADM1双荧光素酶报告基因载体以及与miR-XX结合位点突变的突变体:PGLOCADM1 WT和PGLO-CADM1 MUT。将两种报告质粒与过表达质粒miR-XX mimic和阴性对照质粒分别
Step1:构建载体 共转染至肝癌细胞Huh7中,转染24 h后裂解细胞,12000 rpm离心1 min,收集上清。使用双荧光素酶
双荧光素酶报告基因检测原理

双荧光素酶报告基因检测原理双荧光素酶报告基因检测,这个听起来像科幻电影里的术语,其实在生物医学研究中可是个大热门。
想象一下,在实验室里,科学家们像侦探一样,利用这些小小的荧光素酶,追踪细胞里的各种动态,简直就像在进行一场神秘的探险!那么,今天我们就来聊聊这个有趣的原理,保证让你听了后对科学有新的认识,甚至还会有点儿“小惊喜”哦。
1. 什么是双荧光素酶报告基因?首先,我们得搞清楚“双荧光素酶报告基因”到底是个什么玩意儿。
简而言之,这是一种检测工具,用来观察细胞内部的某些过程,比如基因表达、信号传导等。
就像一个聪明的“小侦探”,它能告诉我们细胞里发生了什么事情。
这种方法利用了荧光素酶的特性,简单地说,就是当有特定的反应发生时,它就会发出光亮,像烟花一样闪烁。
哇,想想都觉得酷炫!1.1 荧光素酶的角色那荧光素酶究竟是啥呢?其实,它是一种酶,可以催化某些反应,产生荧光。
在我们的实验中,科学家们常用的就是萤火虫里的荧光素酶和海洋生物中的荧光素酶。
这两者都有各自的特点,前者发出的光亮比较稳定,后者的光亮则更为强烈。
听起来是不是有点像在选择超级英雄?不同的“能力”,用得好的话,就能让实验如虎添翼!1.2 双荧光素酶的优势双荧光素酶的厉害之处在于,咱们可以同时监测两个不同的信号。
这就好比是把两个侦探派去同一案件,分别观察不同的线索。
比如,一个探员监测基因A的表达,另一个则关注基因B的情况。
这种方法的好处是,能够提供更全面的信息,减少误差,毕竟有多个“眼睛”看总比一个好嘛!2. 检测原理接下来,让我们深入到这个神奇的检测原理。
其实,双荧光素酶报告基因的工作流程,就像是烹饪一道美食,步骤分明,缺一不可。
2.1 基因构建首先,科学家们要把荧光素酶的基因放进细胞中,这就像是在给细胞注入了一剂“特效药”。
在实验室里,这个过程可以通过转染技术来实现,就是把荧光素酶基因和其他相关基因一起放进去,让细胞开始表达这些荧光素酶。
2.2 信号检测然后,一旦细胞开始工作,荧光素酶就会被激活。
机制研究的利器——双萤光素酶报告基因检测实验

机制研究的利器——双萤光素酶报告基因检测实验想验证miRNA与靶基因的作⽤? --双萤光素酶报告基因检测想了解miRNA和lncRNA/circRNA的靶向互作?--双萤光素酶报告基因检测想知道转录因⼦对下游基因的作⽤? --双萤光素酶报告基因检测。
⽂章中经常看到、研究中经常⽤到、平时经常听到。
不过很多⼩伙伴有时还会⼀脸懵,今天我们就来详细说说双萤光素酶报告基因检测实验。
1双萤光素酶报告系统介绍Dual-Luciferase®双萤光素酶报告基因检测系统:在细胞中同时表达萤⽕⾍萤光素酶(Firefly Luciferase简称F-Luc)和海肾萤光素酶(Renilla Luciferase简称R-Luc),其中F-Luc作为报告基因反应⽬的基因表达的改变,R-Luc作为内参基因,为实验提供统⼀基准线(减少内在变化因素如培养细胞的数⽬,细胞转染和裂解的效率对实验准确性的影响)。
所构成的报告系统⼴泛⽤于基因调控、⾮编码RNA靶向互作等研究领域。
F-Luc表达框的上游启动⼦区域插⼊不同功能序列,通过转录起始条件改变造成其报告萤光的变化。
F-Luc的3’UTR区域替换成靶基因的3’UTR,过表达microRNA(降解mRNA或者翻译抑制),可以反映是否存在靶向互作。
2 应⽤介绍2.1miRNA靶基因验证实验原理miRNA主要通过作⽤于靶基因的3’UTR起作⽤(降解或抑制翻译),将⽬的基因3’UTR(野⽣型和结合位点突变型)序列构建⾄载体中报告基因F-Luc的3’端,通过⽐较过表达miRNA后,报告基因表达的改变(萤光素酶的活性下降还是不变),来确定miRNA与靶基因3’UTR的作⽤位点。
案列介绍题⽬: Tumor-derived exosomal miR-1247-3p induces cancer-associated fibroblast activation tofoster lung metastasis of liver cancer期刊: Nature Communications⼩结:验证B4GALT3(β-1,4-半乳糖基转移酶III)基因具有miR-1247-3p的靶向结合位点。
双荧光素酶报告基因检测系统-promega

Dual-Luciferase® Reporter Assay试剂准备Luciferase Assay Buffer II 10mlLuciferase Assay Substrate 1vialStop & Glo® Buffer 10mlStop & Glo® Substrate, 50X 200ulPassive Lysis Buffer (PLB), 5X 30ml1.1X PLB: 加1体积的5X Passive Lysis Buffer (PLB)到4体积的dH0中,40C2保存(一个月)。
R II:将Luciferase Assay Substrate重悬于10ml Luciferase Assay BufferII 中(-200C保存1个月,-700C保存1年)。
3.1X Stop & Glo 试剂:1体积50X Stop & Glo® Substrate加入49体积的Stop& Glo® Buffer中(-200C保存15天)。
(每次试验需要100ul)细胞处理1. 吸除细胞培养液2. 1X PBS轻柔的冲洗细胞3. 加入1X PLB(推荐用量)4.细胞溶解室温条件下,轻摇细胞15min,瞬时转染和报告基因实验采用脂质体介导技术转染。
重组质粒分别为p-629/+100,p-401/+100,p-238/+100,p-80/+100,p-25/+100。
pGL3- basic为阴性对照;同时以转染phRL-tk(海肾荧光素酶)作内对照。
具体转染方法参照转染(Polifectamine Reaent)说明书进行。
1. 将质粒DNA(3.2µg)与phRL-tk (0.8µg)按1:4混合后为A液,混匀30s,PolyFect(QIAGEN)与无血清无抗生素的DMEM按1:50混匀后为B液,混匀30s;2. A+B混匀(B加入A)15s,室温下孵育5-10 min;3. 吸出六孔板中的培养液,用无血清无抗生素的DMEM洗3遍,然后加入AB混合液,每孔0.8mL;4. 6h后,加入2mL完全DMEM;5. 24h后,倒出旧培养液,换为完全DMEM;6. 100µg H2O2或B(a)P处理lh或24h;(200 µM MMS,24h-溶解于Me2SO, Sigma);(H2O2不引起OGG1升高)7. 采用Promega公司的双报告基因检测试剂盒检测荧光素酶活性,检测仪器为化学发光仪(30IOC化学发光测定仪),所有实验严格平行操作。
双荧光素酶报告实验

14
03
参考案例
1
案例一
分别构建靶基因CADM1双荧光素酶报告基因载体以及与miR-XX结合位点突变的突变体:PGLOCADM1 WT和PGLO-CADM1 MUT。将两种报告质粒与过表达质粒miR-XX mimic和阴性对照质粒分别
Step1:构建载体 共转染至肝癌细胞Huh7中,转染24 h后裂解细胞,12000 rpm离心1 min,收集上清。使用双荧光素酶
相对荧光素酶活性。实验Ti重p复:3次此。处使用的是实验中相应的肿瘤细胞
16
03
参考案例
1
案例一
分别构建靶基因CADM1双荧光素酶报告基因载体以及与miR-XX结合位点突变的突变体:PGLO-
CADM1 WT和PGLO-CADM1 MUT。将两种报告质粒与过表达质粒miR-XX和阴性对照质粒分别共转染
载体以及与目标分
子结合位点突变的
突变体。
2 共转染
将两种报告质粒、过 表达质粒以及阴性对 照质粒分别共转染至 细胞中,转染24 h后 裂解细胞,12000 rpm离心1 min,收 集上清。
3 检测荧光素酶活性
每个细胞样品中加入 100 μL萤火虫荧光素 酶工作液检测萤火虫 荧光素,加入100 μL 海肾荧光素酶工作液 检测海肾荧光素酶 , 实验重复3次。
19
03
参考案例
2
案例二
生物信息学进行LINC01082和miR-XX结合关系的分析,利用荧光素酶报告法验证miR-XX是 LINC01082的直接靶点,人工合成LINC01082 基因片段利用内切酶位点SpeI 和Hind III 引入pMIRreporter (北京华越洋生物科技有限公司) 中,在LINC01082野生型上设计种子序列的互补序列突变位点 ,通过限制性内切酶酶切后使用T4 DNA 连接酶将目的片段插入到pMIR-reporter 报告质粒中。将测序 正确的荧光素酶报告质粒WT和MUT分别与miR-XX共转染至细胞HEK-293T (上海北诺生物科技有限公司) 中。转染48 h后收集并裂解细胞,使用荧光素酶检测试剂盒 (K801-200,Biovision 公司) Glomax20/20
promega双荧光素酶说明书

promega双荧光素酶说明书摘要:I.引言- 介绍Promega 双荧光素酶报告基因检测系统- 说明该系统的应用领域和实验流程II.实验原理- 介绍荧光素酶报告基因检测技术的基本原理- 阐述Promega 双荧光素酶报告基因检测系统的技术优势III.实验操作- 详细介绍实验操作步骤,包括实验材料、实验方法等- 强调实验过程中需要注意的事项IV.实验结果分析- 介绍实验结果的检测方法和分析流程- 阐述实验结果的可靠性和准确性V.应用案例- 分享几个Promega 双荧光素酶报告基因检测系统在实际应用中的成功案例- 说明这些案例证明了该系统在研究中的重要性和可靠性VI.结论- 总结Promega 双荧光素酶报告基因检测系统的优点和应用价值- 展望该系统在未来的发展和应用前景正文:Promega 双荧光素酶报告基因检测系统是一种广泛应用于生物学、医学等领域的检测工具,它可以帮助研究人员快速、准确地检测基因表达和调控。
该系统采用了荧光素酶报告基因技术,通过荧光信号的强度来反映基因表达的水平,从而实现对基因表达的定量分析。
该系统的应用领域非常广泛,可以用于检测基因表达、基因调控、药物筛选、生物学通路研究等。
在实验流程上,首先需要将待检测的基因与荧光素酶报告基因构建成报告基因质粒,然后将质粒转染到目标细胞中,最后通过检测荧光信号的强度来定量分析基因表达水平。
Promega 双荧光素酶报告基因检测系统的技术优势在于,它采用了两种荧光素酶,可以同时检测两个基因的表达水平,从而提高了检测的准确性和可靠性。
此外,该系统还具有灵敏度高、检测速度快、操作简单等优点,深受广大研究人员的青睐。
在实验操作过程中,需要注意的事项包括:正确选择实验材料、准确设置实验条件、严格控制实验操作等。
只有做好这些细节,才能保证实验结果的可靠性和准确性。
实验结果的分析是整个实验的重要环节。
通过荧光信号的检测和分析,可以得到基因表达水平的数据,这些数据可以用于进一步的研究和分析。
双荧光酶报告实验报告

一、实验背景双荧光素酶报告基因检测实验是一种常用的分子生物学技术,用于研究基因表达调控、蛋白-DNA互作以及非编码RNA的靶向互作等生物学过程。
该实验利用荧光素酶的发光特性,通过检测荧光强度来评估目的基因或蛋白的表达水平以及与DNA的结合情况。
二、实验目的本实验旨在通过双荧光素酶报告基因检测技术,研究特定转录因子对目的基因的调控作用。
三、实验材料与试剂1. 细胞株:HEK293细胞2. 载体:pGL3基本载体(含萤火虫荧光素酶基因)、pCMV- Renilla荧光素酶载体(内参基因)3. 试剂:胎牛血清、DMEM培养基、转染试剂、荧光素酶底物、荧光素酶测定仪、DNA序列分析软件等四、实验方法1. 构建报告基因质粒:将目的基因的启动子序列克隆到pGL3基本载体中,构建报告基因质粒。
2. 细胞培养:将HEK293细胞接种于6孔板,待细胞贴壁后进行转染。
3. 转染:按照转染试剂说明书,将报告基因质粒和pCMV-Renilla荧光素酶载体共转染细胞。
4. 细胞培养:转染后继续培养细胞,收集细胞并进行裂解。
5. 荧光素酶活性检测:将裂解液加入荧光素酶底物,在荧光素酶测定仪上检测萤火虫荧光素酶和海肾荧光素酶的活性。
6. 数据分析:计算萤火虫荧光素酶活性与海肾荧光素酶活性的比值,分析特定转录因子对目的基因的调控作用。
五、实验结果1. 成功构建了报告基因质粒,并进行了转染。
2. 通过荧光素酶活性检测,获得了萤火虫荧光素酶和海肾荧光素酶的活性值。
3. 计算萤火虫荧光素酶活性与海肾荧光素酶活性的比值,分析了特定转录因子对目的基因的调控作用。
六、实验讨论本实验成功构建了报告基因质粒,并通过双荧光素酶报告基因检测技术,研究了特定转录因子对目的基因的调控作用。
实验结果表明,该转录因子能够显著提高目的基因的表达水平。
七、实验结论本实验通过双荧光素酶报告基因检测技术,成功研究了特定转录因子对目的基因的调控作用,为后续相关研究提供了实验依据。
双荧光报告实验步骤

双荧光报告实验步骤:荧光步骤实验报告荧光酶报告实验植物写物理实验报告的步骤实验报告模板篇一:双荧光报告系统报告基因Promega中文通讯第2期2002荧光素酶双荧光素酶报告基因测试∶结合萤火虫和海洋腔肠荧光素酶先进的共报告基因测试技术在用萤火虫荧光素酶定量基因表达时,通常采用第二个报告基因来减少实验的变化因素。
但传统的共报告基因(比如CAT,β-Gal,GUS)不够便利,因为各自的测试化学,处理要求,检测特点存在差异。
Promega提供一种先进的双报告基因技术,结合了萤火虫荧光素酶测试和海洋腔肠荧光素酶测试。
双荧光素酶报告基因测试系统,结合pRL载体系统,表达第二个报告基因海洋腔肠荧光素酶,在单管中进行双荧光素酶报告基因测试,快速,灵敏,简便。
系统还提供PLB裂解液,用来裂解在多孔板中培养的哺乳细胞,不需操作单个样品。
对于正在使用萤火虫荧光素酶报告基因载体的研究人员。
双荧光素酶报告基因测试系统将使他们立即体会到该系统的便利。
介绍双报告基因用于实验系统中作相关的或成比例的检测, 通常一个报告基因作为内对照, 使另一个报告基因的检测均一化。
检测基因表达时双报告基因通常用来瞬时转染培养细胞,带有实验报告基因的载体共转染带有不同的报告基因作为对照的第二个载体。
通常实验报告基因偶联到调控的启动子, 研究调控基因的结构和生理基础。
报告基因表达活力的相对改变与偶联调控启动子转录活力的改变相关,偶联到组成型启动子的第二个报告基因,提供转录活力的内对照, 使测试不被实验条件变化所干扰。
通过这种方法, 可减少内在的变化因素所削弱的实验准确性, 比如, 培养细胞的数目和活力的差别, 细胞转染和裂解的效率。
使用萤火虫荧光素酶,结合氯霉素乙酰转移酶(CAT), β-半乳糖苷酶(β-Gal), 或葡萄醛酸糖苷酶(GUS)的双报告基因,近几年已普遍使用。
但这些双报告基因组合削弱了荧光素酶操作的优势, 比如荧光素酶测试和定量可在几秒钟内进行, 但CAT, β-Gal和GUS测试法, 则在定量前需要长时间的保温。
双荧光素酶报告基因

双荧光素酶报告基因双荧光素酶报告基因及其应用双荧光素酶报告基因是一种经常用于生物学研究中的功能基因,它在研究细胞内转录调控、蛋白质相互作用、酶活性等方面具有广泛的应用。
本文将介绍双荧光素酶报告基因的特点、原理以及其在生物学研究中的应用。
首先,我们来了解一下双荧光素酶报告基因的特点。
双荧光素酶报告基因是通过核酸序列工程手段将双荧光素酶基因(Luciferase)与报告基因的表达序列融合而成。
这种融合基因可以在转染至细胞后,通过测定荧光素酶的活性来间接反映报告基因的表达水平。
双荧光素酶报告基因具有高灵敏度、高稳定性和广泛的线性范围等特点,使其成为现代生物学研究中非常重要的工具。
其次,我们来介绍一下双荧光素酶报告基因的原理。
双荧光素酶报告基因的原理基于荧光素酶的催化反应。
荧光素酶是一类酶,它在存在特定底物(如荧光素)和辅因子(如ATP和Mg2+)的情况下,可以催化荧光素氧化产生光。
荧光素酶报告基因利用这种酶催化反应的特性,将荧光素酶与报告基因融合,使得报告基因的表达水平可以通过测定荧光素酶的活性来间接确定。
双荧光素酶报告基因在生物学研究中有许多应用。
首先,它常被用于研究基因的转录调控。
研究人员可以将感兴趣的启动子区域与双荧光素酶报告基因融合,通过测定荧光素酶的活性来评估该启动子区域的转录活性。
这种方法可以帮助我们了解基因的调控机制以及某些转录因子的作用。
其次,双荧光素酶报告基因也可以用于研究蛋白质的相互作用。
研究人员可以将目标蛋白与双荧光素酶报告基因的不同片段融合,通过测定荧光素酶的活性来评估蛋白质相互作用的强度和稳定性。
这种方法可以帮助我们了解蛋白质的功能以及蛋白质网络的调控机制。
另外,双荧光素酶报告基因还可以被用于研究酶活性和信号传导通路。
比如,在药物筛选中,可以将双荧光素酶报告基因与药物靶点融合,通过测定荧光素酶的活性来评估药物对靶点的抑制效果。
这种方法可以帮助我们筛选出有效的药物并研究其作用机制。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
双荧光素酶报告基因分析
1. 介绍
荧光素酶报告基因表达的转录调控常被用来研究培养细胞的生物学特性。
荧光素酶是理想的报告基因,因为哺乳动物细胞中不含内源性荧光素酶,一旦转录完成立刻就生成功能性的荧光素酶。
Dual-Luciferase®双荧光素酶报告基因检测系统中含有在同一细胞中同时表达的两种荧光素酶。
通常,报告基因实验中往往会受到各种实验条件的影响,共转染的“对照”报告基因会作为内对照,为试验提供一基准线。
实验报告基因经过内参照的处理可以减小细胞活性和转染效率对实验的影响,因此双报告系统减少了外部干扰,使得实验数据更可信。
实验中报告基因和对照基因的酶没有种源同源性,萤火虫荧光素酶和海肾荧光素酶对应不同的反应底物,反应中没有任何的交叉干扰。
萤火虫荧光素酶底物和海肾荧光素酶底物分别与检测试剂反应可以使灵敏度最大化。
由于超强的光信号和超高的信噪比,本系统被广泛用于制药和生物技术产业中。
双荧光素酶报告基因检测系统适配于各种培养哺乳细胞的培养基,如1640,MEM,DMEM,F12等。
这些试剂与被动裂解液所附带的试剂盒,可以从Promega试剂盒中分开,单独使用。
具有超高灵敏度和超宽线性范围的Veritas™微孔板发光检测仪特别适合DLR 报告基因检测系统,Veritas™软件中预装了DLR 的检测程序使得安装更为方便,内置自动加样器使得应用更为简单。
Veritas™微孔板发光检测仪使用荧光素酶检测试剂II (LAR II)最低可以检测到1X10-19 mol 荧光素酶分子,使用Stop & Glo®试剂可以检测到1X10-18 mol 海肾荧光素酶分子,检测线性范围分别为8 和6 个数量级。
所有的检测均采用纯化的重组萤火虫荧光素酶
(E1701)和纯化的重组海肾荧光素酶。
图1-3 使用Promega 公司Dual-Luciferase®双荧光素酶报告基因检测系统,萤火虫荧光素酶(1x10-19 到1x10-11 mol)和海肾荧光素酶(1x10-14 mol)在Modulus™仪上测量结果。
2. 所需器材
•Veritas™微孔板发光检测仪
(/equip/GloMax/Veritas .asp)(P/N 9100-002)
•96 孔白板(E&K Scientific EK-25075)
•Dual-Luciferase Reporter®荧光素酶检测系统
(E1980)
•P200 移液器和枪头
3.实验方案
3.1试剂制备
荧光素酶检测缓冲液II 和荧光素酶检测底物:使用所提供产品,-20℃储存,可以稳定保存6 个月,荧光素酶检测底物可以4℃保存1 个月。
将荧光素酶检测缓冲液II 加入荧光素酶检测底物中,配制DLR 工作液,颠倒混合,直到底物彻底溶解。
配好试剂最好当天使用,也可以将配好试剂分装,-20°C 储存1 月,-70℃储存1 年。
Stop & Glo®底物和Stop & Glo®底物缓冲液:使用所提供产品,-20℃储存。
Stop & Glo®底物溶解缓冲液:使用所提供产品,低于25℃储存。
在玻璃管或者硅化聚丙烯酸树脂管中将
50×Stop & Glo®底物稀释成1×Stop & Glo®工作液。
颠倒混合,工作液最好当天使用,也可以将工作液分装,-20°C 储存2 周。
被动裂解缓冲液:用去离子水将5x 被动裂解缓冲液稀释成1x 的,低于25°C 保存。
注:因为荧光素酶活性受温度影响,在定量发光检测过程中Dual-Luciferase®荧光素酶缓冲液II 和Stop & Glo®缓冲液应始终保持室温。
混合试剂冻存后再次使用,为确保试剂性能,应在低于25℃条件下溶解。
溶解后充分混匀,最简单的方法是室温水浴溶解。
3.2仪器安装
3.2.1 双击Veritas图标运行软件;
3.2.2 从"Welcome to Veritas"对话框中点击"Run Promega Protocol";
3.2.3 浏览"DLR"文件夹,选择合适的检测程序,例如DLR检测中使用的是单注射器那就选择"DLR with one injection.";
3.2.4 点击"Options"选择需要检测的孔,默认值是预置了Promega 操作方案的最佳测量值。
但也可以根据自己需要在"Other Options"面板中进行检测时间,延迟时间和加样体积的调整。
修改结束,点击"Apply Changes"
确认修改,或者点击"Save Protocol As"保存修改方案。
另外也可以点击"Options"返回"Main Dialog Box";3.2.5 在"Main Dialog Box".中输入个人信息,例如"Experiment", "Operator", "Plate No.", and "Notes"。
3.3样品分析
3.3.1 准备含有裂解细胞培养物的96 孔板;
注:为了保证数据良好的重现性。
加入试剂前,室温下平衡细胞培养基;
3.3.2 准备注射器。
将注射器1 进样口放入LAR II,将注射器2 进样口放入Stop & Glo®试剂瓶,在"Main Dialog Box"上用"Prime"键对注射器进行初始化;
注:不能混用注射器。
Stop & Glo®试剂对萤火虫荧光素酶活性有猝灭作用。
建议一个注射器专门吸入Stop & Glo®,另一个专门吸入LAR II;
3.3.3 样品板放入Veritas™微孔板发光检测仪中,点击“Start”开始检测。
检测结束后,所有需要检测的样品检测结果会以Excel 表格形式显示,如检测中遇到其他问题,请参考问题导读获取更多信息;
3.3.4 检测结束就可以通过Excel 进行数据分析;
3.3.5 检测结束取出检测板。
选择"Reverse Purge"将管路中剩余试剂回收到试剂瓶,而后彻底清洗注射器。
4. 相关文献
1. Ow, D.W. et al. (1986) Transient and stable expression of the firefly luciferase gene in plant cells and transgenic plants. Science 234, 856—9.
2. De Wet, J.R. et al. (1987) Firefly luciferase gene: structure and expression in mammalian cells, Mol. Cell. Biol. 7, 725—37.。
