(工艺技术)夏桑菊颗粒(颗粒)工艺规程

夏桑菊颗粒工艺规程
1.产品名称及剂型
1.1.产品名称:夏桑菊颗粒
1.2.产品剂型:颗粒
2.产品概述
2.1.产品名称
夏桑菊颗粒
汉语拼音名:Xiasangju Kelii
2.2.产品特点
2.2.1.性状本品为棕褐色颗粒;味甜。
2.2.2.规格每袋装10g
2.2.3功能与主治清肝明目,疏风散热,除湿痹,解疮毒。用于风热感冒,目赤头痛,高血压,头晕耳鸣,咽喉肿痛,疔疮肿毒等症,并可作清凉饮料。
2.2.4用法用量开水冲服,一次10—20g,一日3次。
2.2.5贮藏密封。
2.2.6有效期2年。
3.处方和依据
3.1.法定处方
夏枯草500g 野菊花80g 桑叶175g
3.2 制法:
以上三味,加水煎煮二次,每次1.5小时,合并煎液,滤过,滤液浓缩至生药量1/2(V/W),加2倍量的95%乙醇,充分搅拌,静置过夜,滤过,滤液回收乙醇,减压浓缩至相对密度为1.25~1.26(30℃),加入适量蔗溏粉,混匀,制成颗粒,干燥,制成1000g,即得。
3.3 投料处方
夏枯草80 kg
桑叶28kg
野菊花12.8kg
95%乙醇约120L
蔗糖152kg
制成制成1.6万包
3.4 执行标准:《部颁标准》中药成方制剂第十五册《WS3-B-2967-98》。
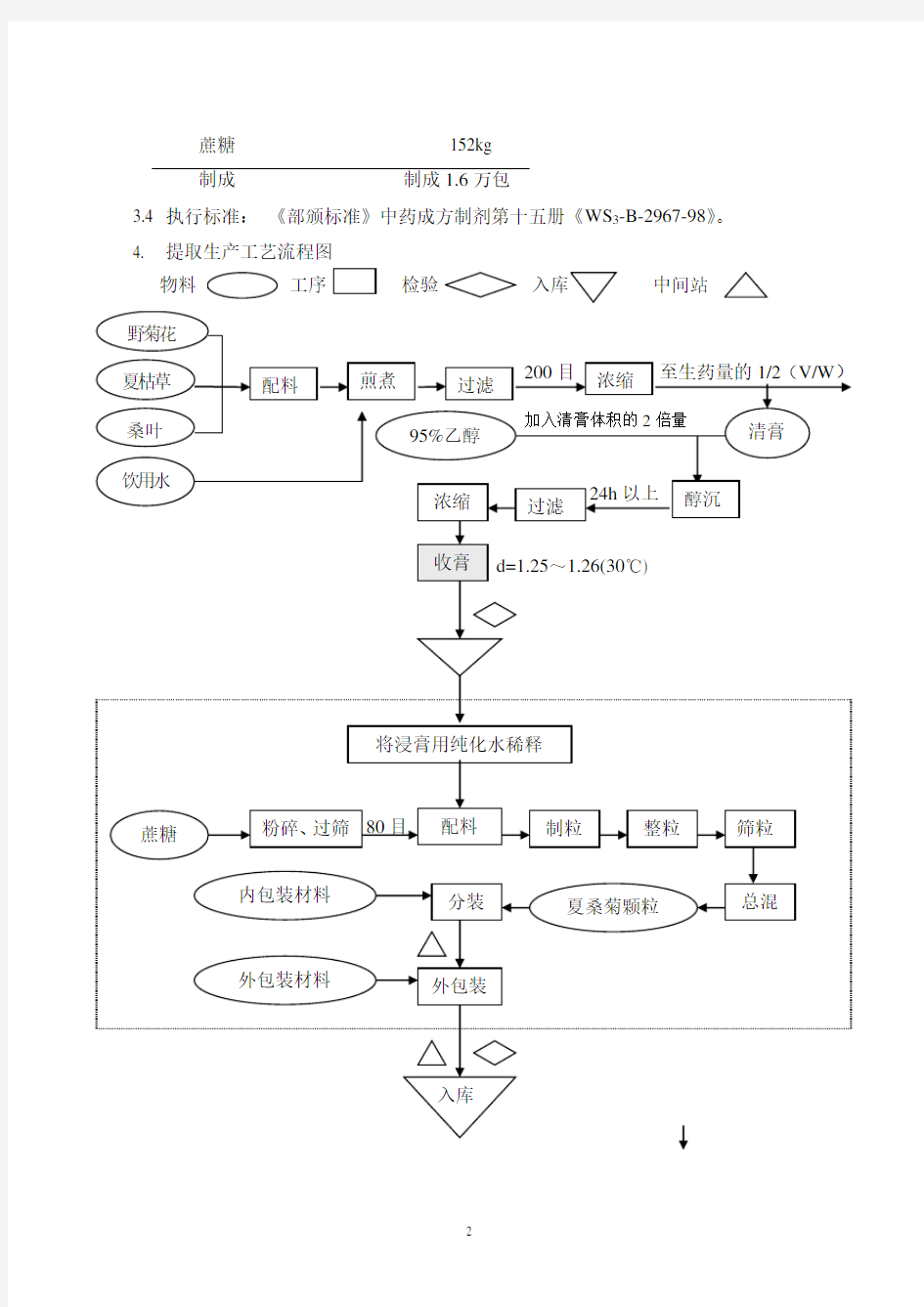
4. 提取生产工艺流程图
物料
工序检验中间站
按洁净区管理
虚线框内为十万级洁净区
5.生产操作过程及工艺条件
5.1提取
5.1.1领料、配料
按生产指令单从药材库领取各种净药材核对品名、数量。按生产指令逐一称取各味药材并存放于药材周转箱内,贴上《桶笺》,转入药材暂存间。
5.1.2提取过滤
5.1.2.1 煎煮
将提取的3味药材投入提取罐,分别加饮用水10倍量、8倍量,煎煮2次,每次保持微沸煎煮1.5小时,200目不锈钢过滤网滤过至储液罐,合并两次煎煮液。将煎煮滤液吸入三效浓缩器中浓缩至生药量的1/2。
5.1.3醇沉
将准确计量的浓缩液抽入醇沉周转罐中,搅拌下加入浓缩液2倍量的95%乙醇,搅拌均匀,转入醇沉罐中静置24小时。
5.1.4乙醇回收、浓缩
将醇沉液用板框过滤器过滤,滤液吸入三效浓缩器中,浓缩同时回收乙醇,浸膏浓缩至相对密度1.25~1.26(30℃测)。
5.1.5收膏
浸膏泵入洁净区收膏间,装桶,贴上《桶笺》,抽检,检验合格后,将浸膏入冷库。
5.2 制剂
5.2.1备料
5.2.1.1领料从库房领取合格原辅料,送入车间称量暂存间。
5.2.2制粒
5.2.2.1配浸膏液取95%乙醇加入提取浓缩后的全部稠膏中,搅拌使稠膏分散使均匀,备用。
5.2.2.2制软材每槽76kg蔗糖粉及上述1/2浸膏液加入槽形混合机中,混合成色泽均一的适宜制粒的软材。
5.2.2.3制粒将上述软材加入制粒机,通过12目筛网,制成湿颗粒。
5.2.2.4干燥先设定好沸腾制粒机工艺参数(进风温度120±5℃,干燥温度70±℃,出风温度30±5℃),开引风,先将湿颗粒吸入沸腾制粒机中,开进风加热,在引风拉动下物料呈流化态干燥约20-30分钟,出料,水份控制在小于5%。
5.2.2.5整粒将干燥后的颗粒转入快速整粒机中,用10筛网整粒。
5.2.2.6筛粒将整粒后的颗粒转入振荡筛中用10目和60目不锈钢筛网筛粒。
5.2.3总混将筛粒后的颗粒投入三维运动混合机中,混合5分钟,装入无毒塑料袋中,称量,贴上桶签,转入中间站待验。
5.2.3包装
5.2..3.1内包装规格20袋×50中袋/件
5.2.3.2领料从库房领取检验合格的内包装材料,并仔细核对品名、数量。
5.2.3.4内包装
5.2.3.4.1将检验合格的颗粒用颗粒包装机进行包装,冲切速度60~80次/分,横封温度105~110℃,纵封温度110~115℃;每隔30分钟测装量一次,装量差异为±5%。药袋成型好,
封口严密,批号等打印清晰、正确。
5.2.3.4.2 将内包装好的药袋经传递窗送入外包装间。
5.2.3.5外包装
5.2.3.5.1领料从库房领取检验合格的外包装材料,专人领取,计数发放。
5.2.3.5.2 打码按《批生产指令》要求在无毒塑料袋或纸盒上打印批号、生产日期、有效期;在纸箱上打印出批号、生产日期及有效期。
5.2.3.5.3包装规格:10g/小袋×20小袋/中袋×50中袋/件
检查合格的小袋,每20小袋放入已经打印好批号、有效期、生产日期的无毒塑料袋中(中袋),放入一张夏桑菊颗粒说明书,于多功能薄膜封口机上热合封口,温度150+10℃,速度适宜,批号清晰、正确,密封好;每50中袋装入纸箱中,上下各垫一纸板,放入一张装箱单,用不干胶带封箱成件。将所有成品全部移入待检品暂存间,待检验合格后,入库。
6.质量监控
6.1按生产工序设置监控点,不得遗漏。各监控点如下:
提取配料、提取、三效浓缩、醇沉、浓缩收膏、制剂配料过筛、制粒、内包装、外包装。
6.2监控方法
6.2.1开工前及生产结束后,重点监控人、机、料、环,要求符合工艺标准。清洁状态达到要求;物料数量、质量、标记、贮存条件及管理符合要求;设备及计量器具须处于完好状态,并有状态标记,计量器具有“检定合格证”;相应的生产记录须齐全。达到规定要求,方可签字允许生产或判定清场合格。
6.2.2生产过程重点监控工艺规程和岗位SOP的贯彻执行情况,生产现场管理须有序规范,状态标记须齐全、正确,批生产记录须及时填写,各工序中间体的质量须达到标准。对物料放行作出判定,为批产品审核提供依据。
8.物料.技术经济指标的计算及原料、辅料、包装材料的消耗定额
8.1单耗
单耗=上批余量+实际领用量-本批结存量
本批实际产量
8.2原辅包材的消耗定额及技术经济指标
原辅包材的消耗定额以厂订夏桑菊颗粒相应规格的单耗为基准;若消耗出现异常,应分析找出具体原因所在,作好记录以便为以后修订提供依据。
8.2.1原辅包材的消耗定额
8.3偏差处理
生产中若出现偏差,则按《偏差处理程序》进行处理。生产中产生的零头物料,按《零头处理SOP》进行处理。
9.物料平衡
9.1计算公式
物料平衡率=(实际产量+ 抽样量+ 损耗量)/ 理论产量×100%
理论值:按照所用的原料(包装材料)量在生产中无任何损失或差错的情况下得出的最大量。
实际值:为生产过程实际产出量。包括:本工序产出量、收集的废品、生产中取样量(检
品以及丢弃的其他不合格物料(如捕尘系统、真空系统、管道系统中收集的废弃物)等。
10.主要设备一览表
11.卫生工艺
生产开始前和生产结束后,人员、物料、设备、环境均须符合相关卫生管理程序要求,清场按《清场管理程序》及相关清洁SOP进行。
12.技术安全及劳动保护
12.1技术安全
12.1.1车间一般生产区及洁净区应有应急灯及紧急出口。
12.1.2生产区的人行道和车行道必须平坦、畅通,夜间要有足够的照明设施。
12.1.3劳动场所必须符合防火要求,并配备符合规定的消防设施和器材。
12.1.4防爆区的人员、物料进出和设备操作必须符合《消防安全管理程序》的规定。
12.1.5生产设备不准超温、超压、超负荷和带故障运行。
12.1.6凡发散大量热量的设备和蒸汽管道,必须要有保温或隔热层。
12.1.7为防止和消除生产过程中的伤亡事故,应采取相应安全措施,进行安全培训。
12.2 劳动保护
12.2.1根据工种需要,应供给生产岗位人员工作衣、帽、鞋、手套、口罩、肥皂等劳动保护品,并适当配备防尘设施。
12.2.2机器和工作台等设备、设施的布置应便于工人安全操作,通道宽度不得小于1米。
12.2.3操作间温度、相对湿度应适宜,通风设备良好。
12.2.4洁净室内主要工作室照度不低于300lax。
12.2.5保证洁净室内人均每小时新鲜空气量不少于40m3。
13.动组织定员定岗、生产周期
注:1、工序生产周期以在岗人员完成一批料(2万包)所需的时间计。[工序生产周期=工序实际生产一批料所需的时间(小时)]
2、产品批生产周期:指从原料投入到成品合格入库所需的时间。即和工序生产周期总和加上检验周期。
14.环境保护
14.1废水的管理和处理生产过程中产生的废水经处理符合国家排放标准后,排放入下水道。
14.2废渣的管理和处理生产过程中产生的废料转运到规定垃圾站倾倒。
14.3锅炉房及生产中产出的废气经处理符合国家排放标准后,排入大气。
14.4对于粉尘较大的工序,车间应备有相应捕吸尘设施。
附录:
颗粒剂的实用工艺流程和车间设计
2016–2017 学年第一学期 制药设备与工艺设计实验报告 学号: 姓名: 专业: 指导教师:
第一部分概述 1.1设计任务 年产量为2千万袋颗粒剂的生产工艺流程和车间设计 1.2设计条件 原料为刚采收的中药药材,药用部位为小直径的种子、果实,不含挥发油,炮制粉碎后经过水提,浓缩为浸膏,再干燥后粉碎,加入辅料后制粒包装。 1.3颗粒剂的特点 颗粒剂是指将药物与适宜的辅料制成具有一定粒度的干燥颗粒状制剂;粉末状或细粒状称细粒剂。颗粒剂系口服剂型,既可吞服,又可分散于水中服用。 根据颗粒剂在水中的分散情况,可将其分为可溶性颗粒剂、混悬性颗粒剂以及泡腾性颗粒剂。 颗粒剂具有以下特点: 1.飞散性、附着性、团聚性、吸湿性等均较少; 2.服用方便,根据需要可制成色、香、味俱全的颗粒剂; 3.必要时对颗粒进行包衣,根据包衣材料的性质可使颗粒具有防潮性、缓释性或肠溶性等,但包衣时需要注意颗粒大小的均匀性以及表面光洁度,以保证包衣的均匀性; 4.注意多种颗粒的混合物,如各种颗粒的大小或粒密度差异较大时医学教育`网搜集整理易产生离析现象,从而导致剂量不准确。
第二部分颗粒剂生产工艺流程 2.1前言 颗粒剂的工艺流程包括的主要工序有:称量、配料、制软材、制粒、干燥、整粒与总混、分装和包装等。其中配料、制软材、制粒干燥、整粒与总混、分装等是在30万级的洁净区进行的,原料材前处理、提取浓缩和包装等在一般生产区。 本工艺的药材药用部位为小直径的种子、果实,不含挥发油,可以采用炮制后水溶液提取有效成分,粗滤后精滤,利用醇溶液浓缩得到原料。将原料和辅料按照一定比例配料混合,添加适量相应的黏合剂和润湿剂,制备软材。采用湿法制粒,转入沸腾干燥制粒机中干燥,整粒加入芳香性挥发油后转入总混机,按照5g每一小袋分装后包装转入仓库中。 2.2原药材前处理 1、挑选:分别领取刚采收的药材,复核重量及标签容与实物是否相符。按照《选、洗、润、切岗位标准操作规程》要求进行挑选。 2、洗药:把选好的药材分味置洗药机中,按《洗药机标准操作规程》要求操作,以低于30℃的饮用水清洗洁净后放出,置周转容器中,贴上物料标签,标明洗药结束时间,洗完的药在8小时进入润药和干燥操作过程中。 3、润药:将清洗洁净的各味药材,分别置润药机中,加饮用水将药材润透,做到药透水尽,软化至指甲能掐入药材表面为宜。 4、切药:将润好的药材置切药机中切成5-9mm长的段,置洁净周转容器中,贴上物料标签备用。切制后的药材应在8小时进入干燥操燥盘中,厚度为4-5cm,置热风循环蒸汽烘箱中,按操作,干燥温度控制在75-80℃。干燥后的净药材晾凉后,装入带衬的编织袋中,封好口,称重,贴物料标签,转入净料库。 5、干燥:将切好的药材装入干燥盘中,厚度为4-5cm,置热风循环蒸汽烘箱中,取样检验。 2.3提取浓缩 1、药材提取:取药材药用部位,复核重量及标签容与实物是否一致,无误后,投入到提取罐中进行提取,提取二次,分别加5倍、4倍于药材总量的饮用
中药配方颗粒生产工艺技术
中药配方颗粒生产工艺技术 1、中药配方颗粒是如何生产的? 中药配方颗粒的生产是依据传统中药汤剂的煎煮要求,根据不同品种分别制定生产工艺规程,其基本工艺路线是:优选中药材,炮制加工、提取、浓缩,干燥、制粒、包装、检验。 2、中药配方颗粒与传统汤剂煎煮方法一样吗? 中药配方颗粒和传统汤剂煎煮方法相似,是在继承传统汤剂煎煮方法的基础上,结合采用现代科学技术研究生产。主要表现为:(1)中药配方颗粒的提取工艺是按照传统汤剂的煎药的要求,如加水量、浸泡时间、煎煮次数、先煎、后下、包煎、烊化、溶化、另煎、冲服等。结合采用现代科学技术手段,研究优化不同中药品种的提取技术参数。 (2)结合现代中药化学、中药药理、中药制药最新研究成果,对研究明确的脂溶性有效成分,采用水提取结合乙醇提取、超临界二氧化碳萃取等技术,充分提取有效成分。 (3)对于传统药材粉末入药的品种,采用超微粉碎技术,达到了细胞破壁,快速发挥药效。 (4)在颗粒制造过程中,采用浸膏粉直接干法造粒,不加赋型剂,部分品种确实需要加入赋型剂的,也是尽量少加。因此中药配方颗粒和其他冲剂不同,现在临床上使用的冲剂和颗粒剂都是含有较多的糖和辅料,而配方颗粒不含糖,部分品种含辅料也是少量的,保证了中药原有的药性和药效。
3、生产上如何体现“先煎”? 先煎是要求增加药物的煎煮时间,目的是为了增加有效成分在水中的溶出,降低药物的毒性,充分发挥药效。 如石膏、煅自然铜等矿石类;石决明、牡蛎等贝壳类;龟甲、鳖甲等角甲类药物;乌头、附子等有毒的药物;石斛、天竹黄等。该类配方颗粒的生产工艺研究,是通过正交实验的方法优化工艺参数,如石斛需要煎煮2次,共4小时,龟甲砂炒破碎,加水煎煮2次,共10小时,这是家庭煎煮无法做到的。 4、那些品种“先煎”? 先煎的品种主要有:龟甲、鳖甲、石膏、煅自然铜、代赭石、寒水石、龙骨、紫石英、牡蛎、石决明、川乌、草乌、附子、石斛、天竹黄、滑石、磁石、珍珠母、阳起石、赤石脂等。 5、生产上如何体现“后下”? 后下是要求减少药物的煎煮时间,目的是为了减少挥发油的损耗和免于有效成分分解破坏。 气味芳香,含挥发油多的药物,如薄荷、荆芥、砂仁、广藿香、豆蔻、青蒿等,先蒸馏收集挥发油或采用超临界CO2萃取挥发油,,再加水提取,挥发油经处理后包裹加入到颗粒中。 不易久煎的药物,如钩藤、大黄等,采用冷提法萃取。 6、那些品种“后下”?
年产2亿袋板蓝根颗粒剂车间工艺设计
课程设计论文 题目:年产2亿袋板蓝根颗粒剂车间工艺设计 学院轻工化工学院 专业班级 12制药工程(1)班 组员姓名马展鹏 3112001673 (组长) 吴健辉 3112001677 陈少茹 3212001684 韩冬秀 3212001687 韦增晖 3212001696 叶芷欣 3212001700 指导老师谭伟 2015年12月
目录 一、设计任务与分工 (5) 二、产品概述 (6) 三、生产处方 (6) 3.1 所用原辅材料清单 (6) 3.2 生产处方 (6) 四、生产工艺规程与物料衡算图表 (6) 五、生产操作过程及工艺条件 (9) 5.1药材炮制 (9) 5.2药材炮制收率 (9) 5.3 提取: (9) 5.3.1 领料 (9) 5.3.2 煎煮 (9) 5.3.3 醇沉 (9) 5.3.4 回收乙醇并浓缩 (9) 5.3.5制粒 (10) 六、生产过程的质量监控要求: (10) 七、原辅料、包装材料、中间体(半成品)、成品质量标准 (11) 7. 1原辅料质量标准及检验规程 (11) 7.2中间体(半成品)质量标准及检验规程 (12) 7.3成品质量标准及检验规程 (12) 八、消耗定额和物料平衡 (12) 8.1. 物料消耗定额计算及损耗率 (12) 8.2 各工序物料平衡 (13) 九、设备选型 (15) 9.1提取罐设备 (15) 9.2醇沉罐 (15) 9.3浓缩罐 (16) 9.4粉碎设备 (16) 9.5制粒设备 (16) 9.6干燥设备 (18) 9.7制粒机选型 (18) 9.8 包装设备的选型 (19) 十、主要设备和生产能力 (21) 十一、工艺管道的选择 (21) 11.1 中国的GMP对于管道设计安装要求 (21) 11.2中国的GMP对于管道材质要求 (22) 11.3管道的连接 (22) 11.4阀门的选择 (23) 11.5 各工艺设备材质的选择 (23) 十二、工艺卫生要求 (24)
华润三九---工艺规程样板TS-G-GPC-0001-001阿胶配方颗粒工艺规程
1 目的:本标准规定了阿胶配方颗粒的生产工艺、流程、设备、卫生及原辅料、待包装产品、成品质量标准等。 2 范围:本标准适用于阿胶配方颗粒生产的全过程。 4 内容: 4.1 引用标准和文件 《中华人民共和国药典》(现行版) 国家药品监督管理局:《药品生产质量管理规范》(现行版) 4.3批量(按联袋包装计): 4.3.1 15万小袋 4.3.2 30万小袋 4.4处方 4.4.1 15万小袋,阿胶配方颗粒提取物164.25kg,乳糖60.75kg,合计22 5.0kg。 4.4.2 30万小袋,阿胶配方颗粒提取物328.5kg,乳糖121.5kg,合计450.0kg。
4.5工艺流程图:详见附件一《阿胶配方颗粒生产工艺流程图》。 4.6详细的生产步骤和工艺参数说明:在每个工序开始前,按《生产前准备工作程序》(编号:SOP-S-TY-0003)相关项目进行检查。 4.6.1称量配料: 操作人员按照当日生产计划表的安排顺序以及生产指令的内容称量阿胶配方颗粒提取物以及乳糖备用。配料过程执行《配方颗粒称量配料岗位标准操作程序》(编号:SOP-S-FS-0001)。如果在实际操作时发现提取物有轻捏即散的结块,则需要过40目筛后再配料。 4.6.2 混合: 把称量好的阿胶配方颗粒提取物加入到混合罐内。混合参数设置见下表,混合结束后将药粉装于洁净的药用低密度聚乙烯袋内,扎好袋口,贴好标签,注明品名、批号、生产日期、数量等信息。混合执行《配方颗粒混合岗位标准操作程序》(编号:SOP-S-FS-0002)。生产完毕后,设备清洁执行《颗 4.6.3制粒、整粒: 操作人员按照当日的生产计划表的安排顺序取混合后的物料进行干法制粒,参数按照下表设置,开机后操作人员根据压片情况对制粒参数进行调整直至最佳参数点。制好的颗粒用洁净药用低密度聚乙烯袋装好、密封,并贴上有品名,批号和数量的标签送中间站待用。制粒过程执行《配方颗粒制粒岗位标准操作程序》(编号:SOP-S-FS-0003)。生产完毕后清洁设备执行《颗粒二车间干法制粒岗位设 4.6.4 复合膜印字: 操作人员按照生产安排先制作芯片,然后将芯片装到喷码机上,打开喷码机在面板上输入每袋装量值1.5、颗粒相当于临床使用饮片的当量值2、批号、有效期、生产日期,信息输完试喷检查无误后开始喷印,印字过程中要随时检查印字质量情况,印好的复合膜经复卷机复卷后置于印字内包材间待用,印字执行《配方颗粒喷码岗位标准操作程序》(编号:SOP-S-FS-0004)。生产完毕后,设备清洁执行《颗粒剂二车间喷码岗位设备清洁标准操作程序》(编号:SOP-S-FI-0004)。 4.6.5内包装 4.6. 5.1联袋包装: 4.6. 5.1.1包装规格:1.5克/袋 4.6. 5.1.2颗粒包装机操作工按照分配的任务从中间站领用合格待包颗粒和相应的印好字的复合膜进行内包装,包装机加热温度设置:横封220±40℃;纵封200±40℃。产品包装执行《配方颗粒内包装岗位标准操作程序》(编号:SOP-S-FS-0005)。生产完毕后,设备清洁执行《颗粒剂二车间颗粒
板蓝根颗粒工艺规程介绍
目录: 1、产品名称及剂型 2、产品概述 3、处方和依据 4、生产工艺流程图 5、原药材的整理炮制 6、提取生产操作过程和工艺条件 7、制剂生产操作过程和工艺条件 8、成品放行 9、质量监控 10、原辅料质量标准和检查方法及复检前最长储存期 11、半成品质量标准、成品法定标准和企业内控标准及依据 12、包装材料质量标准、检验方法及内包材包装前的最长贮存时间 13、成品放行依据 14、工艺卫生要求 15、各设备标准操作程序 16、技术安全及劳动保护 17、劳动组织、岗位定员、工时定额、产品生产周期 18、原辅料消耗定额 19、包装材料消耗定额 20、动力消耗定额 21、物料平衡 22、成品容器、包装材料 23、综合利用和环境保护 1.产品名称及剂型
1.1产品名称:板蓝根颗粒 1.2汉语拼音:Banlangen Keli 1.3产品代码:01 1.4剂型:颗粒剂 1.5批准文号:国药准字Z+数字(8个) 2.产品概述 2.1性状:本品为浅棕黄色至棕褐色的颗粒;味甜,微苦。 2.2功能主治:清热解毒,凉血利咽。用于肺胃热盛所致的咽喉肿痛,口咽干燥;急性扁桃体炎见上述证候者。 2.3用法用量:开水冲服,一次5-10g,一日3-4次。 2.4规格:每袋装10g。 2.5 贮藏:密封。 2.6有效期:36个月 3.处方和依据 3.1处方: 理论产量222袋(每袋10g) 板蓝根 3.1kg 蔗糖2kg 糊精55g 制成颗粒 2.22kg 3.2处方依据:《中国药典》2010年版第二增补本
4.
5.原药材的整理炮制: 6. 提取生产操作过程和工艺条件: 6.1药材称量:领料称量人员按生产指令领取所需药材。在领取时,应先核对物料品名是否与指令相符,在称量前应先检查衡器的定期校验证是否在有效期内,并调整至零位平衡后方可称量。称量时,应1人称量,另1人独立复核,及时填写称量记录、复核记录,并由称量人、复核人签字确认。 6.2提取、浓缩:取处方量净制后的板蓝根药材,投入多功能提取罐内,第一次加药材5倍量水,煎煮2小时,第二次加药材5倍量水,煎煮1小时,煎液滤过,滤液合并,浓缩至相对密度为1.20(50℃测),置沉淀罐中,加乙醇使含醇量达60%,搅拌均匀,静置沉淀8小时,取上清液,回收乙醇,浓缩至相对密度1.30(80℃),得浸膏,装入洁净容器内,称重,挂标签,检验合格后入冷库。 7.制剂生产操作过程和工艺条件: 7.1称配:按生产指令领取所需板蓝根浸膏、蔗糖、糊精,并核对品名、批号、数量是否与指令相符,执行称量岗位标准操作程序,及时记录。 7.2粉碎:蔗糖按粉碎岗位标准操作程序进行粉碎,全部通过80目筛,98%通过100目。 7.3混合、制粒:取蔗糖粉、糊精置槽型混合机内,混合均匀,加入浸膏搅拌均匀,用14目尼龙筛网,按摇摆式颗粒机标准操作程序进行制粒。 7.4干燥:按沸腾干燥机标准操作规程进行干燥,进风温度控制在90-100℃,出风温度55-65℃,干颗粒水分控制在≤3.0%。 7.5整粒:用10目和40目筛网,按方型振动筛标准操作程序进行整粒,将合格颗粒置洁净容器内,密封,并标明品名、批号、数量、操作人。 7.6混合:将合格颗粒置多项运动混合机中混合90分钟,挂标签,入中转站,执行中转站管理规程。 7.7分装:按岗位生产指令,领取检验合格的颗粒,并核对品名、批号、数量是否和指令相符。按指令领取并核对复合膜品名、规格、数量是否与指令相符。按颗粒分装机标准操作程序进行分装。在分装过程中及时自检,装量范围±4%。半成品及时传入外包间。 7.8外包装:按生产指令领取说明书、印有批号的中袋(小盒)、大箱,并核对品名、数量及检验单后,按外包装岗位SOP进行操作。QA按取样标准取样,按成品项下标准要求进行全检。 7.9入库:将检验合格的药品登记品名、数量后,入常温成品库。批与批之间,不同品种之间应有明显界限,不得混放。按该品种的贮存条件进行贮存。
(工艺技术)TS复方板蓝根颗粒颗粒工艺验证方案(审)
1. 2. 3.(工艺技术)TS复方板蓝根颗粒颗粒工艺验证方案(审) 4.
复方板蓝根颗粒工艺验证方案文件形成: 文件控制: 变更记载:
复方板蓝根颗粒工艺验证方案 1.主题内容: 本方案规定了复方板蓝根颗粒生产工艺的验证方法及标准。 2.适用范围: 本方案适用于复方板蓝根颗粒生产工艺验证。 3.简介: 3.1. 概述: 根据四川广元蓉成制药有限公司工艺验证管理规程有关规定,在变更生产场地和设备时需要对其生产工艺进行全面的验证,确保现行的工艺流程可以持续稳定的生产出合格的产品。公司新建提取车间、口服固体制剂车间,其生产线目前试生产品种为复方板蓝根颗粒,为确认按制订的复方板蓝根颗粒生产工艺规程进行操作,能始终生产出质量稳定可靠的合格产品,特制订本验证方案对复方板蓝根颗粒生产工艺进行验证。我们对复方板蓝根颗粒的生产过程中提取、浓缩、制粒、分装(内包装)等生产关键工序进行验证。 把每一操作工序段作为一个验证小节,每项小节包括单元项目、执行文件、取样及检验方法、可接受标准、验证记录等几个方面。本次复方板蓝根颗粒试生产在我公司提取车间、口服固体制剂车间进行,验证批次为三批。具体验证时间以生产部实际生产时间为准。 3.2.验证产品基本信息: 3.2.1.产品名称和产品代码: 3.2.1.1.产品名称:复方板蓝根颗粒 汉语拼音名:汉语拼音: Fufang Banlangen Keli
3.2.1.2.产品代码:C-010 3.2.2.产品概述 3.2.2.1.剂型:颗粒剂 3.2.2.2.规格:每袋装15g 3.2.2.3.批量:720kg 3.2.2. 4.产品特点 3.2.2. 4.1.性状:本品为棕色的颗粒;味甜、微苦。 3.2.2. 4.2.功能与主治:清热解毒,凉血。用于温病发热,出斑,风热感冒,咽喉肿烂,流 行性乙型脑炎,肝炎,腮腺炎。 3.2.2. 4.3.用法用量:口服,一次15g,一日3次,重症加倍;小儿酌减。预防流感、乙脑,一日15g,连服5日。 3.2.2. 4.4注意事项:糖尿病患者慎用。 3.2.2. 4. 5.贮藏:密封,防潮。 3.2.2. 4.6.有效期:二年 3.2.2. 4.7.批准文号:国药准字Z51022154 3.2.3批生产记录编号:SC-SRD-09-028-00 4.验证目的: 4.1.本次验证旨在证明在生产场地和设备变更的情况下,按复方板蓝根颗粒生产工艺规程、 有关GMP管理规程、标准操作程序及验证文件的要求,连续进行三批试生产,证明设计的工艺过程的实用性,设计的生产工艺和设计产品质量能够符合复方板蓝根颗粒的质量标准。确认本生产工艺稳定、操作程序合理、设备与生产能力相匹配、质量监控点合理,具有可靠性和重现性,保证生产处于受控状态,确保能连续地生产出合格的产品。 4.2.本方案确定了在实际操作条件下需要监控的关键工艺参数和变量,概括了对中间品样品 的取样与检测要求,并规定工艺监控及产品检测的可接受标准。 4.3.为避免记录重复,批生产记录作为原始记录备查,验证方案中只记录重点控制项目、重 点结果和数据。 5.实施验证人员及主要职责:
板蓝根颗粒工艺规程
1 产品名称及剂型 ...... . 2. 产品概述 ..... 3. 处方和依据 ..... 4. 生产工艺流程图 ...... 5. 生产操作过程及工艺条件 ....... 6. 工序质量监控 ...... 7. 原辅料、包装材料、中间体、成品质量标准......... 8. 消耗定额及物料平衡 ...... 9. 主要设备一览表 ...... 10 工艺卫生要求 ...... . 11 技术安全及劳动保护 ...... . 12 劳动组织、定岗定员、生产周期 (10) . 13 环境保护 (11) . 14.附录 (11)
1. 产品名称及剂型 1.1. 产品名称:板蓝根颗粒 产品剂型:颗粒剂 2. 产品概述: 2.1. 品名:板蓝根颗粒 22产品特点: 用法用量:开水冲服,一次 5?10g , —日3?4次。 包装规格:20袋/包X 80包/箱。贮藏:密封保存。有效期:2年 3. 处方和依据 3.1.提取处方 基准处方产量:210-252g 左右(为1000g 颗粒所用的清膏量) 批生产处方产量:136-163kg 左右(为650kg 颗粒所用的清膏量) 3.2.制剂处方 处方说明: 基准处方理论产量:100袋(1000g 颗粒) 批生产处方理论产量:65000袋(650kg 颗粒) 3.3处方依据:《中国药典》2010年版一部 3.4批准文号:国药准字Z34020384 4. 生产工艺流程图 4.1提取工艺流程图 2.2.1. 性状:本品为棕色或棕褐色颗粒;味甜、微苦。 2.2.2. 功能主治:清热解毒。用于病毒性感冒,咽喉肿痛。 2.2. 3. 2.2. 4. 规格:每袋装10克或5克。 2.2.5.
中药配方颗粒政策解读02
【原创】中药配方颗粒=大蓝海?政策和机会解读 002 2016年8月 转载于中国先进制药网,https://www.360docs.net/doc/a314612015.html, 2 《中药配方颗粒管理办法(征求意见稿)》逐条解读 第一章总则 第一条为加强对中药配方颗粒的管理,引导产业健康发展,更好满足中医临床需求,根据《中华人民共和国药品管理法》《中华人民共和国药品管理法实施条例》,制定本办法 第二条对在中华人民共和国境内生产、使用的中药配方颗粒实施管理,适用本办法。 第三条中药配方颗粒是由单味中药饮片经水提、浓缩、干燥、制粒而成,在中医临床配方后,供患者冲服使用。中药配方颗粒是对传统中药饮片的补充。--------- 国家进一步明确了配方颗粒的定义、管理和适用范围。 第二章生产企业 第四条中药生产企业生产中药配方颗粒,应向企业所在地省级食品药品监督管理部门提出《药品生产许可证》的变更申请,须在生产范围中增加中药配方颗粒。 ------ 明确配方颗粒的生产仅需备案即可,看似降低门槛,会配方颗粒市场更加混乱,但现在的中药配方颗粒经过15年试点以后,6个生产厂家仍然标准不一,工艺不一,当量不一。医生使用完全取决于生产厂家市场推广人员的建
议,新管理办法的诞生会通过市场化促进中药配方颗粒的标准统一,从而缓解这一现象。 第五条生产中药配方颗粒的中药生产企业应当具备以下条件: (一)在中国境内依法设立,能够独立承担责任(包括具备药品质量安全责任承担能力); (二)已获得颗粒剂生产范围,具有中药饮片炮制、提取、浓缩、干燥、制粒等完整生产能力,符合《药品生产质量管理规范》(药品GMP)要求;(三)设立药品质量检验、管理专门机构及专职人员,制定质量管理规章制度,具备完善的药品质量保证体系,具备产品放行、召回等质量管理能力;(四)设立药品监测与评价专门机构及专职人员,建立药品监测与评价体系,具备对药品实施风险管理的能力,依法承担药品不良反应监测、风险效益评估、风险控制义务,负责建立并维护药品不良反应监测系统,对药品监测与评价进行管理。 第六条生产企业应当配合药品监督管理部门的监管工作,对药品监督管理部门组织实施的检查予以配合,不得拒绝、逃避或者阻碍。 第七条生产企业应当履行因上市产品缺陷对患者造成损害的侵权赔偿义务。------- 对已过2010年版GMP的数据跟踪发现,同时拥有提取和颗粒剂GMP的生产厂家有628家;但另一方面,增加药品监测与评价体系的建设大大加强了中药配方颗粒的监管要求,以前的中药配方颗粒在不良反应监测、风险评估、系统评价方面的要求近乎于零。
TS-7352-00复方板蓝根颗粒颗粒工艺验证方案(审)
复方板蓝根颗粒工艺验证方案文件形成: 文件控制: 变更记载:
复方板蓝根颗粒工艺验证方案 1.主题内容: 本方案规定了复方板蓝根颗粒生产工艺的验证方法及标准。 2.适用范围: 本方案适用于复方板蓝根颗粒生产工艺验证。 3.简介: 3.1. 概述: 根据四川广元蓉成制药有限公司工艺验证管理规程有关规定,在变更生产场地和设备时需要对其生产工艺进行全面的验证,确保现行的工艺流程可以持续稳定的生产出合格的产品。公司新建提取车间、口服固体制剂车间,其生产线目前试生产品种为复方板蓝根颗粒,为确认按制订的复方板蓝根颗粒生产工艺规程进行操作,能始终生产出质量稳定可靠的合格产品,特制订本验证方案对复方板蓝根颗粒生产工艺进行验证。我们对复方板蓝根颗粒的生产过程中提取、浓缩、制粒、分装(内包装)等生产关键工序进行验证。 把每一操作工序段作为一个验证小节,每项小节包括单元项目、执行文件、取样及检验方法、可接受标准、验证记录等几个方面。本次复方板蓝根颗粒试生产在我公司提取车间、口服固体制剂车间进行,验证批次为三批。具体验证时间以生产部实际生产时间为准。 3.2.验证产品基本信息: 3.2.1.产品名称和产品代码: 3.2.1.1.产品名称:复方板蓝根颗粒 汉语拼音名:汉语拼音: Fufang Banlangen Keli
3.2.1.2.产品代码:C-010 3.2.2.产品概述 3.2.2.1.剂型:颗粒剂 3.2.2.2.规格:每袋装15g 3.2.2.3.批量:720kg 3.2.2. 4.产品特点 3.2.2. 4.1.性状:本品为棕色的颗粒;味甜、微苦。 3.2.2. 4.2.功能与主治:清热解毒,凉血。用于温病发热,出斑,风热感冒,咽喉肿烂,流 行性乙型脑炎,肝炎,腮腺炎。 3.2.2. 4.3.用法用量:口服,一次15g,一日3次,重症加倍;小儿酌减。预防流感、乙脑,一日15g,连服5日。 3.2.2. 4.4注意事项:糖尿病患者慎用。 3.2.2. 4. 5.贮藏:密封,防潮。 3.2.2. 4.6.有效期:二年 3.2.2. 4.7.批准文号:国药准字Z51022154 3.2.3批生产记录编号:SC-SRD-09-028-00 4.验证目的: 4.1.本次验证旨在证明在生产场地和设备变更的情况下,按复方板蓝根颗粒生产工艺规程、 有关GMP管理规程、标准操作程序及验证文件的要求,连续进行三批试生产,证明设计的工艺过程的实用性,设计的生产工艺和设计产品质量能够符合复方板蓝根颗粒的质量标准。确认本生产工艺稳定、操作程序合理、设备与生产能力相匹配、质量监控点合理,具有可靠性和重现性,保证生产处于受控状态,确保能连续地生产出合格的产品。 4.2.本方案确定了在实际操作条件下需要监控的关键工艺参数和变量,概括了对中间品样品 的取样与检测要求,并规定工艺监控及产品检测的可接受标准。 4.3.为避免记录重复,批生产记录作为原始记录备查,验证方案中只记录重点控制项目、重 点结果和数据。 5.实施验证人员及主要职责:
(生产制度表格)新生化颗粒生产工艺规程
第 1 页 共 20 页 新生化颗粒生产工艺规程 目 录 1.目的:建立新生化颗粒工艺规程,确保生产出合格的新生化颗粒。 2.依据:新生化药品标准;2010版药典;我公司生产设备;销售态势。 3.范围:本规程适用于新生化颗粒生产全过程(供应、生产、质量)的管理。 4.责任:生产技术部负责按本规程组织生产并严格按此过程实行监控,质量部按本规 程进行质量控制和检验,物控部按本规程进行物料供应。 5.内容: 5.1 产品概述 5.2 处方和依据 5.3 工艺流程图 5.4 操作过程及工艺条件 5.5 工艺卫生和环境卫生 5.6 质量标准和检查方法 5.7 质量监控 5.8 物料消耗定额、技术经济指标、物料平衡及各项指标计算公式 5.9 主要设备一览表 5.10 技术安全及劳动保护 文件类别:技术标准 文件名称:新生化颗粒生产工艺规程 文件编码: 制订部门:生产技术部 起 草: 日期: 审 核: 日期: 批 准: 日期: 执行日期: 签字: 分发清单 总 经 理 [ ]份 生 产 副 总 [ ]份 行政人事部 [ ]份 物 控 部 [ ]份 生产技术部 [ ]份 质 量 部 [ ]份 文件版本:02 文件密级:机密,禁止复印。
5.11 劳动组织、岗位定员、工时定额及生产周期 5.12 综合利用及环境保护 5.1 产品概述 5.1.1 产品名称: 5.1.1.1 新生化颗粒 5.1.1.2 汉语拼音:XinShengHua Keli 5.1.2 剂型:颗粒剂 5.1.3 性状:本品为黄棕色至黄褐色的颗粒;味甘、微苦。 5.1.4 功能与主治: 活血、祛瘀、止痛。用于产后恶露不行,少腹疼痛,也可试用于上节育环后引起的阴道流血,月经过多。 5.1.5 用法与用量:热水冲服,一次2袋,一日2-3次。 5.1.6 规格:(1)6g/袋,相当于原药材9g (2)9g/袋,相当于原药材18g 5.1.7 包装规格: 复合膜包装。(1)6g/袋×12袋/盒×120盒/箱; (2)6g/袋×18袋/盒×80盒/箱; (3)9g/袋×9袋/盒×120盒/箱。 5.1.8 贮藏:密封。 5.1.9 有效期:24个月 5.1.10 批准文号: 国药准字Z19983169 5.2 处方和依据: 5.2.1 执行标准:新生化冲剂质量标准WS3-B-1056-91 国家食品药品监督管理局标准YBZ 15532006 5.2.2 处方依据:中华人民共和国卫生部药品标准中药成方制剂第五册,及国家食 品药品监督管理局标准YBZ15532006
红花配方颗粒提取物生产工艺规程
1目的:本标准规定了红花配方颗粒提取物生产工艺及原辅料、提取物质量标准等。 2范围:本标准适用红花配方颗粒提取物生产工艺执行。 3职责:车间主管、工艺监督员、岗位操作工、质量监督员。 4 内容: 4.1 引用标准和文件 《中华人民共和国药典》(2010年版) 《药品生产质量管理规范》(2010年版) 《红花配方颗粒提取物质量标准》(企业标准) 加水保温浸泡三次,合并提取液,滤过,滤液浓缩成清膏,加辅料适量,混匀,干燥,粉碎,混匀,分装,即得。 4.4 批量:每料150kg,每批8料,合计1200kg药材。
4.5 工艺流程图(后附) 4.6详细的生产步骤和工艺参数说明 4.6.1 在每个工序开始前,按生产前准备工作程序进行相关项目检查。 4.6.2称量配料 投料规格:符合《中华人民共和国药典》(2010年版)标准项下规定的净饮片。 4.6.3提取 取投料品种的净饮片,投入到多功能提取罐中,加入热水,保温浸泡三次,第一次加12倍量水,保温浸泡1小时后,过120目筛网过滤放出药液;第二次加7 倍量水,保温浸泡0.5小时后,过120目筛网过滤放出药液,第三次加6倍量水,保温浸泡0.5小时后,过120目筛网过滤放出药液,滤液转移至贮液罐,静置1-2小时。 4.6.4浓缩 药液过200-300目滤布,取过滤后药液于浓缩器中,蒸汽压力控制在0.04~0.1Mpa,真空度控制在-0.08~-0.04Mpa,浓缩温度控制在65~75℃,浓缩至相对密度为1.06~1.14 g/ml(60℃)的流浸膏;200-300目滤过,放入洁净桶中。 4.6.5干燥 上述合格的浸膏用喷雾干燥法干燥,喷雾干燥前根据投料药材总量,折算单位浸膏量所需加的辅料量(加入辅料量=投料饮片总量×15%),将辅料加入浸膏中,搅拌均匀。进风温度控制在:200~205℃,出风温度控制在105~110℃,进行喷雾干燥。 4.6.6粉碎 将干膏于粉碎机组过100 目筛粉碎成细粉。 4.6.7混合 将粉碎后的细粉和喷干粉经混合机充分混合均匀,混合时间为50 分钟; 4.6.8包装: 内包装:双层PVC袋包装,每袋重4-16kg,两层包装袋分别贴好标签,标签内容应当包含品名、批号、重量等信息;内包装过程中取样送检,入库待检。 中包装:铝箔袋包装,贴标签,标签内容同内包装标签要求。 外包装:瓦楞纸箱包装,贴标签,标签内容应当包含品名、批号、规格、净重、原料产地、生产日期、贮存条件等信息,每箱装1包,每箱4-16kg。 4.6.9全程收率40%~50%。以上生产过程中产生的质量偏离的中间产品、废品、工序残留物、不合格物料等按照相应规定处理。 4.7关键工序控制点
(完整版)板蓝根工艺规程
目的:建立板蓝根颗粒工艺规程,指导生产,确保产品质量。 范围:板蓝根颗粒生产的全过程。 责任:生产部、固体制剂车间、供应部、储运部。 内容: 1. 药品名称 1.1 商品名:板蓝根颗粒 1.2 汉语拼音:BANLANGEN KELI 2. 药品剂型:颗粒剂 3. 药品概述 3.1 性状:本品为棕色或棕褐色的颗粒;味甜、微苦。 3.2 功能主治:清热解毒,凉血利咽,消肿。用于热毒壅盛,咽喉肿痛;扁桃腺炎、腮腺炎见上述证候者。 3.2 规格:每袋装10g 3.3 用法与用量:开水冲服,一次5~10g,一日3~4次。 3.4有效期:二年。 3.5贮藏:密封。 4. 药品处方 4.1 处方依据:中华人民共和国药典2005年版一部 4.2 标准处方:1000g 板蓝根:1400g 5.颗粒剂生产工艺流程示意图及环境区域划分
图标: 物料 检验 质量检验 质量检验 质量检验
6.操作过程及工艺方法 6.1 备料: 6.1.1车间领料员根据批生产指令填写领料单,按照车间领料操作规程(编号:SOP-A0-023-00 )从仓库领取各种需要的原辅料,进行外包装的清洁处理。 6.1.2按照《粉碎、过筛工序标准操作规程》(编号:SOP-A1-021-00 )操作,过80目筛。 6.1.3清场:按照生产部制定的清场管理规程要求,对备料、粉碎操作涉及的工作场所、操作台面和环境进行清场; 6.1.4及时填写批生产记录。 6.2称量: 6.2.1校正衡器、检查原辅料外观质量、核对品名及检验报告书、按处方准确称取符合细度要求的原料和辅料; 6.2.2按照称配工序操作规程(编号:SOP-A1-022-00 )分别进行生产板蓝根颗粒各原辅料的称量。 6.2.3 称量容器的重量要记录; 6.2.4 往容器中加所称量的物料时,要轻拿轻放,防止产生灰尘。直到达到所需要的重量为止并记录; 6.2.5第二个操作者进行全过程的复核,包括:所称量物料的名称、批号和数量,称量操作经双人复核无误后转入下一生产工序。
板蓝根颗粒工艺处理制度
.
. 目录 1.产品名称及剂型 (3) 2.产品概述 (3) 3.处方和依据 (3) 4.生产工艺流程图 (3) 5.生产操作过程及工艺条件 (5) 6.工序质量监控 (6) 7.原辅料、包装材料、中间体、成品质量标准 (7) 8.消耗定额及物料平衡 (7) 9.主要设备一览表 (8) 10.工艺卫生要求 (9) 11.技术安全及劳动保护 (9) 12.劳动组织、定岗定员、生产周期 (10) 13.环境保护 (11)
14.附录 (11) 1.产品名称及剂型 1.1.产品名称:板蓝根颗粒 产品剂型:颗粒剂 2.产品概述: 2.1.品名:板蓝根颗粒 2.2.产品特点: 2.2.1.性状:本品为棕色或棕褐色颗粒;味甜、微苦。 2.2.2.功能主治:清热解毒。用于病毒性感冒,咽喉肿痛。
2.2. 3.用法用量:开水冲服,一次5~10g,一日3~4次。 2.2.4.规格:每袋装10克或5克。 2.2.5.包装规格:20袋/包×80包/箱。贮藏:密封保存。有效期:2年 3.处方和依据 3.1.提取处方 处方说明: 基准处方产量:210-252g左右(为1000g颗粒所用的清膏量) 批生产处方产量:136-163kg左右(为650kg颗粒所用的清膏量)3.2.制剂处方 处方说明: 基准处方理论产量:100袋(1000g颗粒) 批生产处方理论产量:65000袋(650kg颗粒) 3.3处方依据:《中国药典》2010年版一部 3.4批准文号:国药准字Z34020384 4.生产工艺流程图 4.1提取工艺流程图 板蓝根饮用水
煎煮 (第一次2h,第二次1h) 回收乙醇 并浓缩 浸膏 4.2制剂工艺流程图
颗粒剂生产工艺规程
制药有限公司颗粒剂工艺规程颁发单位:GMP办公室
工艺规程批准程序
目录 1、剂型及规格 (3) 2、处方和依据 (3) 3、生产过程质控要点 (3) 4、生产的工艺流程图 (4) 5、操作过程及工艺条件 (5) 6、工艺过程中所需SOP名称及要求 (8) 7、工艺卫生及环境卫生 (8) 8、工艺验证及具体要求 (9) 9、设备一览表及主要设备生产能力 (9) 10、物料平衡及经济技术指标计算 (9) 11、技术安全及劳动保护 (10) 12、劳动组织与岗位定员 (11)
1.剂型及规格 剂型:颗粒剂。 2.处方和依据 2005版《中华人民共和国兽药典》第一部;2003版《兽药质量标准》。3.生产过程质控要点:
4.生产的工艺流程图 注:加粗部分为主要控制点5.操作过程及工艺条件5.1 生产前准备:
5.1.1上一批次是否进行清场。清场者、检查者是否签字,将“清场合格证” 副件归入本批生产记录。未取得清场合格证不得进行下一批次的生产。 5.1.2检查生产场所的环境、设施卫生是否符合该区域清洁卫生要求。不得 有上批生产遗留物。 5.1.3检查设备有“已清洁”标牌,并进行试运转,检查合格后,挂上“运 行中”标牌后才能使用。所有工具、容器、设备是否已按清洗规程完成并符合标准。 5.1.4对计量容器、衡器要进行检查、校正以后才能使用。 5.1.5检查与生产相适应的相关文件,记录等是否齐全。 5.1.6对所用物料、半成品核对品名、规格、批号、数量,准确无误后方可 使用。 5.2 指令的下达: 由生产部提前一天下达批生产指令单与批包装指令单,质管部审核后工艺员将批生产指令一份送西药原辅料仓库管理员,另一份送生产部粉剂车间班长,准备生产。 5.3 备料 仓库管理员根据批生产指令,按《原辅料备料、称量岗位操作规程》准备所需原料、辅料,按包装指令和《标签、包装、使用说明书管理制度》准备规定数量的包装材料。并由质量监督员复核品名、数量、规格、编号、检验报告单,复核无误后,通知生产部领料。 5.4 领料 5.4.1由领料员接收物料,领料时严格按《领料岗位操作规程》操作,并由 质量监督员进行监督复核,复核物料的品名、规格、编号、数量、供货单位及检验合格证明,核对无误后由领料员在领料单及批生产指令单上签字。领料员将物料送到车间,在拆包间将周转桶及辅料袋外灰尘用抹布擦试干净后,通过传递门传入原辅料暂存间,将领料单及批生产指令一块传入原辅料暂存间。包装材料除去外表灰尘后通过传递门送入暂存间。 5.4.2不合格的物料拒绝接收。 5.5:称量、配料
滑石配方颗粒提取物生产工艺规程
1目的:本标准规定了滑石配方颗粒提取物生产工艺及原辅料、提取物质量标准等。2范围:本标准适用滑石配方颗粒提取物生产工艺执行。 3职责:车间主管、工艺监督员、岗位操作工、质量监督员。 4 内容: 4.1 引用标准和文件 《中华人民共和国药典》(2010年版) 《药品生产质量管理规范》(2010年版) 《滑石配方颗粒提取物质量标准》(企业标准) 加水煎煮三次,合并煎液,滤过,加辅料适量,干燥,粉碎,混匀,分装,即得。 4.6详细的生产步骤和工艺参数说明 4.6.1 在每个工序开始前,按生产前准备工作程序进行相关项目检查。
4.6.2称量配料 投料规格:符合《中华人民共和国药典》(2010年版)标准项下规定的净饮片。 4.6.3提取 取投料品种的净饮片,投入到多功能提取罐中,提取三次,第一次加3.5倍量水,加热至沸腾后煎煮1小时,煎煮完成后,过120目筛网过滤放出药液;第二次加3 倍量水,加热至沸腾后煎煮1小时,煎煮完成后,过120目筛网过滤放出药液;第三次加2倍量水,加热至沸腾后煎煮1小时,煎煮完成后,过120目筛网过滤放出药液;滤液转移至贮液罐,过400目滤布。 4.6.4喷雾干燥 滤液用喷雾干燥法干燥。喷雾干燥前根据投料药材总量,折算单位浸膏量所需加的辅料量(加入辅料量=投料药材总量×10%),将辅料加入浸膏中,进风温度控制在:195~200℃,出风温度控制在90~100℃,进行喷雾干燥。 4.6.5粉碎 将干膏于粉碎机组过100 目筛粉碎成细粉。 4.6.6混合 将粉碎后的细粉和喷干粉经混合机充分混合均匀,混合时间为50 分钟。 4.6.7包装: 内包装:双层PVC袋包装,每袋重4-16kg,两层包装袋分别贴好标签,标签内容应当包含品名、批号、重量等信息;内包装过程中取样送检,入库待检。 中包装:铝箔袋包装,贴标签,标签内容同内包装标签要求。 外包装:瓦楞纸箱包装,贴标签,标签内容应当包含品名、批号、规格、净重、原料产地、生产日期、贮存条件等信息,每箱装1包,每箱4-16kg。 4.6.8全程收率10.5~11%。以上生产过程中产生的质量偏离的中间产品、废品、工序残留物、不合格物料等按照相应规定处理。
板蓝根颗粒 说明书翻译
板蓝根颗粒说明书 〖Product name〗 Radix Isatidis Granule 【Ingredients】Radix Isatidis. Excipients: sucrose, dextrine. 【Discription】Brownish or tan granule with sweet flavor and slight bitter taste. 【Actions and Indications】Action: to clear heat and detoxicate, cool the blood and relieve sore-throat. Indication: Swelling and pain of throat, xerostomia and pharyngoxerosis caused by extreme heat in the lung and stomach; acute tonsillitis with symptoms above. 【Usage and dosage】Take medicine after mixing with boiled water, 5-10 g per time (including sucrose), 3-4 times a day. 【Storage】Preserve in closed container. Manufacturer: Guangzhou Baiyunshan Hutchison Whampoa Traditional Chinese Medicine Co., Ltd. Approval Number:Medical Product Registration Certificate No. Z44023485
夏桑菊颗粒(颗粒)工艺规程
夏桑菊颗粒(颗粒)工艺规程
夏桑菊颗粒工艺规程 1. 产品名称及剂型 1.1.产品名称:夏桑菊颗粒 1.2. 产品剂型:颗粒 2. 产品概述 2.1. 产品名称 夏桑菊颗粒 汉语拼音名:Xiasangju Kelii 2.2. 产品特点 2.2.1.性状本品为棕褐色颗粒;味甜。 2.2.2. 规格每袋装10g 2.2.3 功能与主治清肝明目,疏风散热,除湿痹,解疮毒。用于风热感冒,目赤头痛, 高血压,头晕耳鸣,咽喉肿痛,疔疮肿毒等症,并可作清凉饮料。 224用法用量开水冲服,一次10—20g, —日3次。 2.2.5 贮藏密封。 2.2.6有效期2年。 3. 处方和依据 3.1. 法定处方 夏枯草500g 野菊花80g 桑叶175g 3.2制法: 以上三味,加水煎煮二次,每次1 .5小时,合并煎液,滤过,滤液浓缩至生药量 1/2(V/W) ,加2 倍量的95%乙醇,充分搅拌,静置过夜,滤过,滤液回收乙醇,减压浓缩至相对密度为1.25~1.26 (30C),加入适量蔗溏粉,混匀,制成颗粒,干燥,制成1000g,即得。 3.3投料处方 夏枯草 桑叶野菊花95%乙醇 80 kg 28kg 12.8kg 约120L
蔗糖 152kg 制成 制成1.6万包 3.4执行标准: 《部颁标准》中药成方制剂第十五册《 WS 3-B-2967-98》。 4.提取生产工艺流程图 ____ 按洁净区管理 /I ■-SI-T- 虚线框内为十万级洁净区 检验?] 入库^~ 中间站 200目』浓缩|至生药量的 $2( V/W ) 加入清膏体积的?清膏咅量 24h 以上 V ----- 醇沉 收膏 d=1.25?1.26(30C ) 物料:工序 煎煮 T 过滤 浓缩 将浸膏用纯化水稀释
中药配方颗粒管理办法
中药配方颗粒管理 办法
中药配方颗粒管理办法 (征求意见稿) 第一章总则 第一条为加强对中药配方颗粒的管理,引导产业健康发展,更好满足中医临床需求,根据《中华人民共和国药品管理法》《中华人民共和国药品管理法实施条例》,制定本办法。 第二条对在中华人民共和国境内生产、使用的中药配方颗粒实施管理,适用本办法。 第三条中药配方颗粒是由单味中药饮片经水提、浓缩、干燥、制粒而成,在中医临床配方后,供患者冲服使用。中药配方颗粒是对传统中药饮片的补充。 第二章生产企业 第四条中药生产企业生产中药配方颗粒,应向企业所在地省级食品药品监督管理部门提出《药品生产许可证》的变更申请,须在生产范围中增加中药配方颗粒。 第五条生产中药配方颗粒的中药生产企业应当具备以下条件: (一)在中国境内依法设立,能够独立承担责任(包括具备药品质量安全责任承担能力); (二)已获得颗粒剂生产范围,具有中药饮片炮制、提取、浓
缩、干燥、制粒等完整生产能力,符合《药品生产质量管理规范》(药品GMP)要求; (三)设立药品质量检验、管理专门机构及专职人员,制定质量管理规章制度,具备完善的药品质量保证体系,具备产品放行、召回等质量管理能力; (四)设立药品监测与评价专门机构及专职人员,建立药品监测与评价体系,具备对药品实施风险管理的能力,依法承担药品不良反应监测、风险效益评估、风险控制义务,负责建立并维护药品不良反应监测系统,对药品监测与评价进行管理。 第六条生产企业应当配合药品监督管理部门的监管工作,对药品监督管理部门组织实施的检查予以配合,不得拒绝、逃避或者阻碍。 第七条生产企业应当履行因上市产品缺陷对患者造成损害的侵权赔偿义务。 第三章生产管理 第八条生产企业是中药配方颗粒生产和质量保证的责任主体,应当严格执行药品GMP。质量管理部门应负责溯源管理及质量监控,应当制定控制产品质量的生产工艺规程和标准操作规程,应当建立完整的批生产记录。 第九条生产企业应当对所用中药材进行资源评估并实行完全溯源。应当固定中药材产地,落实具体生产地点、种植/养殖企业或农
