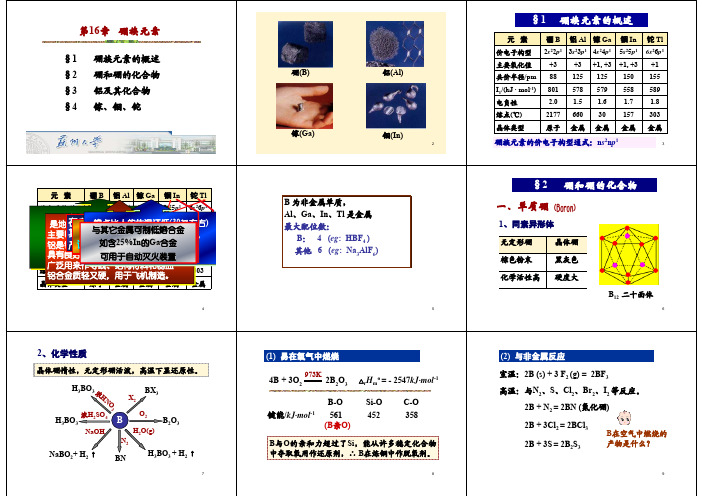
无机化学第十六章 硼族元素
第16章 硼族元素
Hmө = - 2547kJ·mol-1 C-O 358
室温:2B (s) + 3 F2 (g) = 2BF3 高温:与N2、S、Cl2、Br2、I2 等反应。 2B + N2 = 2BN (氮化硼) 2B + 3Cl2 = 2BCl3 2B + 3S = 2B2S3
B在空气中燃烧的 产物是什么?
H3BO3
乙醚 乙醚
H H
均裂 异裂
空气中允许的最高浓度
2B2H6 + 3LiF + 3AlF3 2B2H6 + 3NaBF4
均裂
B2H6
2L 异裂
2BH3L [BH2L2]+ + [BH4]34 35
36
3、硼氢配合物
硼氢配合物是含有 BH4- 的化合物。 2LiH + B2H6 = 2LiBH4 4NaH + BF3 = NaBH4 + 3NaF 4NaH + B(OCH3)3 = NaBH4 + 3NaOCH3 硼氢配合物是由于含有 H- ,所以是极强的还原剂。 BH4- + 8OH- = H2BO3- + 5H2O +8e ϕӨ = -1.24 V
2B + 2NaOH + 2H2O △ 2NaBO2 + 3H2↑
3、制 备
工业上用碱法分解硼镁矿制取单质硼:
Mg2B2O5 · H2O + 2NaOH = 2NaBO2 + 2Mg(OH)2 4NaBO2 + 10H2O + CO2 = Na2B4O7 ·10H2O + Na2CO3
有氧化剂存在与强碱共熔: 2B + 2NaOH + 3KNO3 △ 3KNO2 + 2NaBO2+ H2O
chapter 16 第16章 硼族

NaOH 滴定。多基化合物(如甘露醇、甘油等)与 H3BO3 反应生成稳定的配合物并使显示强酸性,从 而使滴定法可用于测定硼含量:
Ka值表明 H3BO3 的酸性极弱,不能直接用
•与多羟基化合物加合,加入甘露醇、甘油 等酸性增强
H H
B(OH) + 2
4
R C
C
OH OH
H H
R C
C
O O
B
O O
② 正常的B-B σ 键(2c-2e bond )
③ 开放的B 桥键(3c-2e bond ):
B B B
H
④ 氢桥键(3c-2e bond ):
B
B
B
⑤ 闭合的B 桥键(3c-2e bond ):
B B
例1:B5H9
H H H B H B B H H B B H H H
例2:B6H10
H H H B H B H H B B H B B H H H
与外部B12 成键共用去4e + 6e = 10 e
2. B12 单元内部成键 :
由“多面体顶角规则”确定:
多面体顶点数 n=12 成键轨道数 =n+1=13 成键电子数=2n+2=26 总的价电子数:10 + 26 = 36 与B12价电子数一致。
2. 硼的性质√
(1) B易在空气燃烧(与氧的亲和力超Si)
(3) 与酸的作用:它不与盐酸作用, 仅与氧化性酸作用。
B + 3HNO 3 H 3 BO 3 + 3NO 2 2B + 3H 2 SO4 2H 3 BO 3 + 3SO2
(4) 有氧化剂存在时与强碱共融生成偏硼酸盐:
无机化学第十六章 硼族元素

第十六章硼族元素1.硼 单质 硼烷 硼的含氧化合物 硼与硅的相似性2.铝 Al2O3的两种变体 铝盐 §本章摘要§3.镓铟铊Tl(III)的氧化性§1.硼 一.单质 黄棕色固体,高硬度,高沸点1. 制备和Si制备相比较 用Mg或Al 还原B2O3,相当于用C还原SiO2 B2O3 + 3Mg --- 3MgO + 2B (高温) 用H2还原三溴化硼,相当于用H2还原SiCl4 2BBr3 + 3H2 --- 2B + 6HBr (W丝, 高温) 2. 硼的反应 常温下不活泼,高温下活泼 4B + 3O2 --- 2B2O3 2B + 3Cl2 --- 2BCl3与硅相似 2B + N2 --- 2BN (均在高温下进行) 和氧化性酸起反应,比硅活泼些 B + 3HNO3(浓) --- H3BO3 + 3NO2 和强碱起反应 2B + 2NaOH(浓) + H2O ---2NaBO2 + 3H2(气体) (偏硼酸钠) 二硼烷 硼氢化合物虽没有碳氢化合物种类多, 但远比硅烷多. 其结构比烷烃、硅烷复杂.1. 结构 最简单的硼烷,理应是BH3, 但结构研究表明它的分子式是B2H6, 分子间键联关系: 2. 乙硼烷制备质子置换法: 相当于Mg2Si和盐酸反应制备SiH4。
还原法: 4BCl3 + LiAlH4 --- 2B2H6 + 3LiCl + 3AlCl3相当于SiCl4和LiAlH4反应制SiH4。
端基上的H和B之间形成σ键(sp3-s). 四个端H和两个B形成分子平面,中间两个H不在分子平面内,其连线垂直于分子平面,上下各一个, 上面的H所成的键共用价电子44个3. 乙硼烷的性质1°稳定性 B2H6 ----B + H2 B2H6要在100℃以下保存,稳定性不如硅烷。
2 °还原性 B2H6 + 3O2 --- B2O3 + H2O 自燃 属高能燃料,但毒性极大,不易储存。
16.第十六章 硼族元素

T13、何为“对角线关系”?哪几对元素具有对角线相似性? 、何为“对角线关系” 哪几对元素具有对角线相似性? 一种元素与其左上方或右下方元素性质的相似性, 一种元素与其左上方或右下方元素性质的相似性, 称为对角斜线规则。 称为对角斜线规则。 原因是由于具有相似的半径和离子势。 原因是由于具有相似的半径和离子势。 主族: 主族: ⅠA ⅡA ⅢA ⅣA Li Be B C Na Mg Al Si
7
硼烷的五种键型( 硼烷的五种键型(P778-779) ) H B—H
2c-2e键 键
B B B—B 2c-2e键 键 B B B
3c-2e 开口硼桥键
B B
3c-2e 闭合硼键
B
3c-2e氢桥键 氢桥键
B B B
丁硼烷B 丁硼烷 4H10的结构(巢状) 的结构(巢状)
8
癸硼烷B 癸硼烷 10H14的笼状结构
15
硼酸溶液中加入甘油,酸性增强: 硼酸溶液中加入甘油,酸性增强:
R R R
H
H 3 BO3 + 2
H H
C C
R'
OH OH
H
H
C
C
R'
O
O
B
O O
C C
R'
+ H + + 3H 2 O H
R
R
硼酸酯,易电离。 硼酸酯,易电离。
பைடு நூலகம்
过程: 过程: 硼酸受热易分解
H
H
C
C
R'
O
O
H HO
H HO
B
OH H
△
B O
△
两个B以 杂化成键 两个 以sp杂化成键
第16章 硼族元素..

第十六章硼族元素§16-1 硼族元素的通性硼族元素:B、Al、Ga、In、Tl价电子层结构:ns2np1主要氧化数: B Al Ga In Tl+3 +3 +3,(+1) +1,+3 +1,(+3)从Al开始为金属,但成键时表现为极性共价键+3氧化态化合物特点:缺电子,易聚合,易与路易斯碱形成稳定化合物元素电势图(P769):所有单质都具有还原性,无氧化性,碱性条件下还原性更强。
酸性条件下Tl3+具有较强氧化性,Ga2+、In2+、In+易歧化。
§16-2 硼族元素的单质及其化合物一、硼族元素在自然界中的分布二、硼族元素的单质2Al3.镓、铟、铊Ga: 银白色光泽的软金属。
熔、沸点相差最大,m.p.=302.78K,b.p.=2343K。
凝固时体积膨胀。
在干燥的空气中不起变化。
两性金属。
In: 银白略带淡蓝色金属,比铅还软。
在干燥的空气中不起变化。
不与碱作用。
Tl:灰白色,重而软的金属,在空气中生成一层Tl2O膜。
不与碱作用。
化学性质:M+O2(或S) 灼热M2O3(或M2S3)(M=Ga,In,Tl)M+X2= MX3(M=Ga,In,Tl)(X=Br,Cl; Tl无三溴化物)M+IMI3(或MI)(M=Ga,In)2In(粉末)+6H2O=2In(OH)3+3H2↑M+HCl MCl3(或MCl)+H2↑M+HNO3(稀)M(NO 3)3(或MNO3)+NO↑+H2O2Ga+2NaOH+6H2O=2Na[Ga (OH)4]+3H2↑4.单质的提取和冶炼B的制备:碱法:Mg2B2O5.H2O+2NaOH=2NaBO2+2Mg(OH)24NaBO2+CO2+10H2O=Na2B4O7.10H2O+Na2CO3Na2B4O7+H2SO4+5H2O=4H3BO3+Na2SO42H3BO3O3+3H2OBB2O3+3Mg=2B+3MgO酸法:Mg2B2O5.H2O+2H2SO4=2H3BO3+2MgSO499.95%单质B的制备:2BI3 1000-1300K,钽丝2B+3I2Al的制备:Al2O3+2NaOH+3H2O=2Na[ Al(OH)4]2Na[Al(OH)4]+CO2=2Al(O H)3↓+Na2CO3+H2O2Al(OH)Al2O3+3H2O2Al2O3Na3AlF6, 电解4Al+3O2 Ga的制备:Ga(OH)3OH-Ga(OH)4-电解GaGaCl3+HCl TBP萃取HGaCl4 OH-, 电解Ga三、硼的氢化物(硼烷)两类:B n H n+4:B2H6, B5H9, B6H10……B n H n+6:B3H9,B4H10,B5H11……B2-B4 为气体,B5-B8为液体B2H6制备:质子置换法2B2H6加压B4H10+H2B2H6+2LiH=2LiBH4硼烷中的五种成键情况:端侧的2中心-2电子硼氢键B-H;3中心-2电子氢桥键HB B2中心-2电子硼-硼键B-B开放的3中心-2电子硼桥键 BB B闭合的3中心-2电子硼键 BB B四、卤化物1.B、Al的三卤化物BX3制备:置换法B2O3+6HF=2BF3↑+3H2OB2O3+3CaF2+3H2SO4(浓)=2BF3↑+3H2O+3CaSO4BF3(g)+AlCl3=AlF3+B Cl3↑B2O3+3C+3Cl2=2BCl3+ 3CO2B+3X2=2BX3BX3性质:加合性及水解性4BF3+6H2O=3H3O++3BF4 -+B(OH)3BCl3+3H2O=B(OH)3+3H Cl无水AlCl制备:2Al+3Cl2(g)2AlCl32Al+6HCl(g) 2AlCl 3+3H2↑Al 2O3+3C+3Cl22AlCl3+3COAlX3中AlF3为离子型,其它为共价型。
教学课件第16章硼族元素

共价键B:2s22p1受到激发→2S12Px12Py12Pz0
硼单质是由B12二十面体对称体为结构单元, B-B相互间如果只形成3个传统的共价键, 达不到稳定的电子结构;缺少电子,不 稳定。折中的办法形成了,三中心2电子 的特殊的键。
P772反应: 无定型硼:B+O2→ B+Cl2→ B+N2→
赤热 B+6H2O(g)→2B(OH)3+3H2↑ 热 B+3HNO6(浓)→B(OH)3+NO2↑ 碱中 B+NaOH+3KNO3→NaBO2+KNO2+H2O
NiO+B2O3→Ni(BO2)2
16-3惰性电子对效应
斜对角线规则
Li-Mg Be-Al B-Si 碳酸及其盐热分解 易 H2CO3>HCO3-->NaCO3- 难 Li2CO3>Na2CO3>K2CO3 MgCO3>CaCO3>BaCO3
Li2CO3~MgCO3 Na2CO)3++H2O→B(OH)4-+H+ P780卤化物 B2O3+HF→BF3(g)
BF3+AlCl3→AlF3+BCl3(g) BF3+H2O→H3O++BF4-+B(OH)3 P783氧化物 B2O3+H2O(g)→HBO2(g) B2O3+H2O(l)→H3BO3 硼珠试验:CuO+B2O3→Cu(BO2)2 兰
C2H6+O2→CO2+H2O ΔH=-1559KJ•mol-1 除硼以外,均为金属
硼族元素单质
自 然 界 存 在 : Na2B4O7•10H2O,Al2O3 铝 矾 土
《硼族元素教学》PPT课件

36
⑵ 硼珠实验
熔融态的B2O3溶解金属氧化物 得到有特征 颜色的偏硼酸盐玻璃。
B2O3+CuO=Cu(BO2)(蓝色) B2O3+NiO=Ni(BO2)(绿色) ⑶ 与NH3反应
1/2xB2O3+XNH3→(BN)x+H2O(873K)
B
B
N
N
N
B
B
B
N
N
氮化硼,结构 与石墨相同 37
38
补充:无机苯(环硼氮烷)
3NH4CI+3LiBH4=B3N3H6+3LiCI+9H2
环硼氮烷的电子结构式和几何形状都与苯相似,化学
性质也相似,但更活泼,易加成、取代。
H
H CI
H N B N H HCI
HBH HN N H
H B BH N
CI B B H
HN
CI 39
H
HH
硼酸H3BO3
偏硼酸 (正)硼酸 多硼酸 HBO2 H3BO3 xB2O3·yH2O
蒸气的单分子构型
O 136pm
B
B 120pm
O
90-125°
O
35
制法
2H3BO3 △ B2O3+3H2O
4B(s)+3O2(g) 高温 2B2O3(s)
性质
⑴ 易溶于水
B2O3(晶状)+H2O(g)→2HBO2(g)(易挥发)
B2O3(无定形)+3H2O(l)→2HBO3(aq)
白色粉末状B2O3可用作吸水剂。
CI
AI
AI
CI
CI
CI
32
氯桥
AICI3:路易士酸,有机催化剂。易水解放 热,潮湿空气中冒烟。干法制。
第16章 硼族元素-1

后一种用途基于硼吸收中子的能力.
(2)酸法制备单质硼
Mg2B2O5•H2O + 2H2SO4 == 2H3BO3 + 2MgSO4 (3)热还原法 BBr3(g) + 3/2 H2(g)_1373~1573K B(s) + 3HBr(g)
16 - 1 - 2 硼的氢-2 硼的氢化物 物(硅烷)相似,所以硼的氢化物称为硼烷
有时称为土族元素,其中Al2O3为黏土的主 要成分,既难溶又难熔
0、+3 0、+3 0、+1 0、+1 0、+1 自然界没有游离硼, 在自然界没有独立的矿物,分散在 主要以铝矾土矿 (Al2O3· x H O) 存在 主要氧化数 熔点比人的体温还低 (30℃左右 2 +3 +3 (+3) ) 主要矿有 : 其它矿物中 , 都是软金属, 可用于生 原子半径 铝是银白色、有光泽的轻金属 液态镓的熔点、沸点相差大, 88 143 122 163 170 硼砂矿 (Na B O · 10H O) 、 /pm 产新型半导体材料 2 4 7 2 具有良好的导电性和延展性 可作高温温度计,与其它金属 离子半径 Tl 及其化合物均有毒 硼镁矿 (Mg B O · H O) 、 与其它金属可制低熔合金 27 50 80 88.6 3+ 2 2 5 2 r(M 广泛用来作导线、结构材料和器皿 )/pm 可制低熔合金62 方硼矿 (2Mg B O · MgCl ) 误食少量铊盐可使毛发脱落 -1 3 8 15 2 如含 25%In 的 合金 589 铝合金质轻又硬,用于飞机制造 I1/(kJ · mol ) 801 578 579 Ga 558 1.5 1.6 1.7 1.8 电负性( p ) 2.0 可用于自动灭火装置
16 无机化学 第十六章 硼族元素

④硼酸可溶合为链状或环状多硼酸xB2O3· 2O、酸 H 根(BO2)nn- 。在多硼酸结构中,有两种基本结构单 元:BO3 (平面三角形)、BO4 (四面体)。
二、硼酸盐
硼酸盐类似于硅酸盐,大多数难溶,可溶的硼酸盐讨 论的较多的是四硼酸钠,即硼砂。Na2B4O7· 2O也 10H 可写成: Na2B4O5(OH)4 · 2O ------见p787 8H
2Al+2OH-+6H2O=2Al(OH)4-+3H2↑
二、镓单质
Ga具有熔点与沸点相差甚远这一特点,302.8~2676K,即 液态温度范围很宽(拿到水中就可熔化,像水银),可用 来制高温温度计。 镓的另一特点是“热缩冷胀”,从液 体到固体,体积膨胀3%。 制铅字合金,使字更为清晰。
Ga、In多用于电子工业,作P型半导体的掺杂剂。 也可制 Ⅲ—Ⅴ族半导体化合物,如GaAs等,可用于 光电管中。
三、性质:
1、强还原性:
硼烷燃烧热很大,在空气中易燃,易水解,有剧毒, 制备时要注意保持反应处于无氧,无水气状态,做好 安全防护工作。
想一想:硼烷燃 烧的高能量,是 否可以用硼烷来 做火箭的燃料? 为什么?
B2H6(g)+3O2(g)=B2O3(s)+3H2O(g) △H = -2166KJ· -1 mol B2H6+6H2O=2H3BO3↓+6H2↑
+3价的Al有两种存在形式Al3+(酸性)、(AlO2)-或 Al(OH)4-(碱性) Al3+在水溶液中以八面体水合离子[Al(H2O)6]3+的 形式存在,在水中发生水解,溶液显酸性:
[Al(H2O)6]3++H2O==[Al(H2O)5(OH)]2+ + H3O+ [Al(H2O)5(OH)]2+ +H2O==[Al(H2O)4(OH)2]+ + H3O+ [Al(H2O)4(OH)2]+ +H2O==[Al(H2O)3(OH)3] + H3O+
无机化学(4)硼族元素

三、硼的重要化合物 1. 乙硼烷 2H6) 乙硼烷(B 硼氢化合物称为硼烷(与碳氢化合物称为烷烃 与碳氢化合物称为烷烃, 硼氢化合物称为硼烷 与碳氢化合物称为烷烃 硅氢 化合物称为硅烷类似), 已合成出20多种硼烷 多种硼烷, 化合物称为硅烷类似 已合成出 多种硼烷 最简单的 是乙硼烷(B2H6)。 是乙硼烷 。 (1) B2H6的结构 根据气体密度实验证明, 根据气体密度实验证明 最简单的硼烷是乙硼烷 (B2H6), 不存在 3。为什么呢 不存在BH 为什么呢? • 这是由硼原子的缺电子特征所决定的 这是由硼原子的缺电子特征所决定的: • 乙硼烷中每个硼原子采取 3杂化,形成4个不等 乙硼烷中每个硼原子采取sp 杂化,形成 个不等 硼原子采取 杂化轨道。每个B原子中的 原子中的2个 杂化轨道与2个 性sp3杂化轨道。每个 原子中的 个sp3杂化轨道与 个 氢原子s轨道形成 个正常的σ键 轨道形成2个正常的 氢原子 轨道形成 个正常的 键;而一个硼原子含电子 杂化轨道与另一个硼原子不含电子的sp 的sp3杂化轨道与另一个硼原子不含电子的 3杂化轨道 同时与氢原子1s轨道重叠 形成三中心两电子键 轨道重叠, 三中心两电子键。 同时与氢原子 轨道重叠,形成三中心两电子键。
Al
Ga
In
Tl
└(稀散元素 稀散元素)┘ 稀散元素 1. 价层电子构型: 价层电子构型: ns2np1 2. 存在惰性电子对效应 存在惰性电子对效应: B ─→ Tl +1氧化态稳定性 ; 氧化态稳定性↑; 氧化态稳定性 +3 氧化态稳定性↓ 氧化态稳定性 B Al Be C Si H NPOSX 缺电子原子 等电子原子 多电子原子 价电子数 < 价层轨道数 价电子数 = 价层轨道数 价电子数 > 价层轨道数
16-硼族元素概述PPT课件

BF3+HF===HBF4
BF3+H2O===H3BO3+HF
HF+BF3===HBF4
BF3+H2O===H3BO3+HBF4
HBF4是氟硼酸,是一种强酸,与H2SiF6相近。
第16章 硼族元素
硼铝的成键特征
硼铝的结构与性质
硼
烷
硼铝含氧化合物
卤化物和氟硼酸
对角关系
.
1
硼的成键特征
硼及其化合物结构上的复杂性和键型上的多样性,丰富 和扩展了现有的共价键理论,因此,硼及其化合物的研究在近 年来获得了迅速发展。
无定形硼为棕色粉末,它比晶态硼活泼。几乎所有制备硅 的方法都适用于制硼。例如用H2还原硼的卤化物可以制得纯的 晶态硼,晶态硼不光有灰黑色,且有黄色、亮红色的同素异形 体,其颜色随结构含杂质不同而异。
电子构型nS2nP1 (缺电子性) 主要氧化数:+3 键能见表16-2 B-O键561Kj/mol最大
.
4
16-2硼族元素的单质和化合物
2-1 单质硼 晶态硼有多种变体,它们都以B12正二十
面体为基本结构单元,属于原子晶体。因此,硼的硬度大, 熔点、沸点高,化学性质也不活泼。
无定形和粉末状硼的性质 (1)它易在氧中燃烧:
B2H6与LiH反应,将得到一种比B2H6的还原性更 强的还原剂硼氢化理LiBH4。让过量的NaH与BF3反 应,可得到硼氢化钠NaBH4。
2LiH+B2H6=2LiBH4
4NaH+BF3==NaBH4+3NaF NaBH4、LiBH4都是白色盐型化合物晶体,能溶 于水或乙醇,无毒,化学性质稳定。由于其分子中有
武汉大学、吉林大学《无机化学》(第3版)笔记和课后习题(含考研真题)详解-第16~24章【圣才出品】

4.卤化物
(1)硼、铝的三卤化物
①三卤化硼均为共价化合物,熔沸点很低,并随分子量增大而递增,其挥发性随分子量
的增大而降低。
三氟化硼是无色、有窒息气味的气体,不能燃烧。
②三卤化铝中,出 AlF3 为离子性化合物外,其余为共价化合物。在气相或非极性溶剂
中,AlCl3、AlBr3、AlI3 为二聚的。
4 / 140
脱水产物或高温熔融产物为 NaAlO2
(3)镓、铟、铊
①Ga:具有银白色金属光泽的软金属,熔点 302.78 K(29.6 ℃),沸点 2343 K,是所
有金属中熔沸点差值最大(2042.22 K)的。凝固时体积膨胀,硬度与铅相近。
②常温下,镓和铟在干燥的空气中不起变化,但铊表面会生成一层灰色的氧化物膜。
5.含氧化合物 (1)硼氧化合物具有很高的稳定性。B2O3 易溶于水,生成硼酸 H3BO3,但在热的水 蒸气中或遇潮时则生成挥发性的偏硼酸 HBO2。 (2)硼珠实验:熔融的 B2O3 溶解金属氧化物得到有特征颜色的偏硼酸盐玻璃:
(2)铝
铝是一种银白色有光泽的金属,有良好的延展性和导电性。
①虽是活泼金属,但表面覆盖致密的氧化膜,故常温下稳定
②高温与氧等非金属反应
铝热还原法:冶炼难熔金属 Fe、Ni、Mn、V 等
③与稀酸反应,在浓 H2SO4、浓 HNO3 中发生钝化
④与强碱反应:2Al + 2NaOH + 6H2O = 2NaAl(OH)4 + 3H2↑
2.缺电子 价电子数 < 价层轨道数 +3 氧化态的化合物(如:BF3)为缺电子化合物,有较强的继续接受电子的能力。表 现在分子的自聚(2BH3→B2H6)及同电子对给予体形成稳定配合物(HBF4)等方面。
第十六章 硼族元素..

BnHn+m硼烷半拓扑图中键型与键数的确定(P779)
通式为BnHn+m硼烷分子的参数 m、n、s、t、y、x 的 联立方程: x = m s
t = ns
2 y = s x
B6H10
styx=4220
此外,还有6个 外向B—H键。
B5H11、 B5H9的三中心键及半拓扑图式
H H H H B H
§16-2 硼及其化合物
2-1 硼在自然界的存在
——以硼酸盐的形式存在
主要矿有:
硼砂—— Na2B4O7· 10H2O 方硼矿—— 2Mg3B8O15 · MgCl2 白硼钙石——Ca2B6O11· 3H2O 等
我国西部地区的内陆盐湖和吉林、辽宁等省有硼矿。
2-2 硼的成键特征
(硼的化学主要表现在缺电子性质上)
(1) 基态B的价层结构
B是缺电子原子
B
2s2
2p1
(2) 硼化合物中激发态B的价层电子分布
B可采取sp2、sp3 杂化轨道成键
B
2s1
2p2
(3) 硼原子成键的三大特征
① 共价性——B以形成共价化合物为特征
B的原子半径小,I1、I2、I3 大,B在形成化合物时: 可以采取sp2杂化成键,例如:BX3、B(OH)3 也可以采取sp3杂化成键,例如:BF4-、 BH4-、 B(OH)4-
Si-F 565
Si-Si 222
C-F 485
C-C 346
而C 的自相 成键能力最 强
键能(kJ· mol-1)
铝热反应:4Al + 3O2 == 2Al2O3 rHm = -3339 kJ· mol-1 冰晶石矿Na3[AlF6]的存在,说明Al也是亲O、F的元素。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十六章硼族元素
§本章摘要§1.硼
单质硼烷硼的含氧化合物硼与硅的相似性2.铝
Al
2
O
3
的两种变体铝盐
3.镓铟铊
单质氧化物及氢氧化物盐类Tl(III)的氧化性
§1.硼
一.单质
二硼烷
2. 乙硼烷制备
质子置换法:
相当于
Mg
2Si和盐酸反应制备SiH
4。
研究表明它的分子式是B
2H
6
, 分子间键联
关系:
端基上的H和B之间形成σ键
(sp3-s). 四个端H和两个B形成分子平面,中间两个H不在分子平面内,其连线垂直于分子平面,上下各一个, 上面的H 所成的键
共用价电子44个还原法:
4BCl
3
+ LiAlH
4
--- 2B
2
H
6
+ 3LiCl
+ 3AlCl
3
相当于SiCl
4
和LiAlH
4
反应
制SiH
4。
3. 乙硼烷的性质
1°稳定性
B
2
H
6
----B + H
2
B
2
H
6
要在100℃以下保存,稳定性不如硅烷。
2 °还原性
B
2
H
6
+ 3O
2
--- B
2
O
3
+ H
2
O 自燃属高能燃料,但毒性极大,不易储存。
3 °水解性
B
2
H
6
+ 6H
2
O--- 2B(OH)
3
+ 6H
2
(气体)
4 °路易斯酸的反应,缺电子反应
B
2
H
6
+ 2LiH --- 2Li(BH
4
) 白色固体,火箭推进剂
三硼的含氧化合物1. 三氧化二硼
单质硼燃烧或硼酸脱水得B
2O
3
,无
色晶体。
B
2O
3
和SiO
2
的性质差别较大。
B 2O
3
+ 3H
2
O ---2H
3
BO
3
硼酸酐
B 2O
3
和水蒸气反应生成易挥发的偏
硼酸:
B 2O
3
+ HH
2
O --- 2HBO
2
B 2O
3
和许多种金属氧化物在熔融时
生成有特征颜色的硼珠,可用于鉴定。
CoO + B
2O
3
--- Co(BO
2
)
2
深蓝色
Cr
2O
3
的硼珠绿色 CuO的硼珠蓝
色
MnO的硼珠紫色 NiO的硼珠绿色
Fe
2O
3
的硼珠黄色
2. 硼酸 H
3BO
3
在H
3
BO
3
中加入甘油(丙三醇),酸性
可增强,原因是显酸性的机理发生了变
化:
H
3
BO
3
遇到某种比它强的酸时,有显
碱性的可能:
B(OH)
3
+ H
3
PO
4
-- BPO
4
+ 3H
2
O (中
和反应)
3°硼酸的鉴定反应
点燃时: 硼酸三乙酯燃烧显绿色火
焰
3. 硼砂
硼砂是硼的最主要的含氧酸盐, 白
色, 玻璃光泽.
2 °弱酸性
缺电子结构造成的:因此硼砂和过渡金属氧化物Cr
2O
3 ,
CuO, MnO, NiO, Fe
2O
3
等也发生硼珠反
应, 而实际上的硼珠反应是用硼砂来
做.
2°硼砂的水解
生成等摩尔的弱酸和弱酸盐, 形成
缓冲溶液. 0.01的硼砂溶液pH=
9.24。
四硼与硅的相似性
2. 对角线规则
向下金属性加强,向右非金属性加
强,向右向下金属性非金属性相近. 实质
是原子或离子的电场力引起的, 电场力
相近, 对外层电子的约束力相近
所以, Li-Mg, Be-Al, B-Si的性质
相近
§2.铝
一.Al
2O
3
的两种变体
-Al
2O
3
: 由Al(OH)
3
脱水制得, 是我们讲过的那种既可溶于
酸,又可溶于碱的Al
2O
3 .
-Al
2O
3
: 若将-Al
2
O
3
高温灼烧, 则变成-Al
2
O
3
. -Al
2
O
3
既
不溶于酸也不溶于碱. 和KHSO
4
共熔时转变为可溶物. 其实相当于
K 2S
2
O
7
的熔矿作用.
二铝盐
向溶液中滴加Na
2CO
3
得Al(OH)
3
沉淀, 不能得Al
2
(CO
3
)
3
;
加Na
2S也得Al(OH)
3
沉淀, 不能得Al
2
S
3
. (由于水解严重,
Al
2(CO
3
)
3
和Al
2
S
3
在水溶液中不存在)
水溶液中不能结晶出AlCl
3
无水盐, 制无水AlCl
3
要用干法
2Al + 3Cl
2
---- 2AlCl
3
或
Al
2
O
3
+ 3Cl
2
+ 3C ---- 2AlCl
3
+ 3CO(气体)
除了铝的氟化物是离子晶体外, 其余卤化物共价性强, 所以熔
点沸点较低.
气相AlCl
3
, 有双聚分子, 有配位键, 或认为中央是形成三中心四电子的氯桥键.
Tl有(III)和(I)的盐及化合物, Ga(I)和In(I)难生成, 而Al(I)不存在. MF
3
为离子型化合物, 其余卤化物为共价型, b.p.低, 由于惰性电子对效应, Tl(III)有较强的氧化性.
TlX与AgX相似, 难溶, 光照分解; Tl(I)与变形性
小的阴离子成盐时, 与K+、Rb+等相似, 如Tl
2SO
4
易溶于
水, 易成矾.。
