化学奥赛无机元素化学习题硼族元素含答案
无机化学总结硼族元素

一硼单质及其化合物制作成员:摆宫泽贾震韦仕富(1) 硼单质硼单质可以分为晶体和无定形两大类。
晶体硼呈灰黑色,硬度极高,导电性差,但它的电导率却随着温度的升高而增大,从而显示出与金属导体的不同。
不太纯的无定形硼为棕色粉末。
晶体硼单质的化学反响活性较低,无定形硼相对活泼。
①硼单质的晶体构造晶体硼单质根本构造单元为正二十面体,12个硼原子占据着多面体的顶点。
α—菱形硼:B12构造单元间的硼硼化学键属于三中心二电子键。
由片层间B12构造单元按面心立方最密堆积方式形成晶体,其中所以硼原子间均形成共价键,使单质硬度大,导热能力强,导电能力弱。
β—菱形硼:构造更复杂,其中含B84构造单元。
②硼单质的化学性质1 常温下与F2化合:2B+3F2=2BF32 在空气中燃烧,放出大量热:4B+3O2=2B2O33 由于硼氢键的键能很大,所以硼能从许多稳定的氧化物如SiO2,P2O5中夺取氧。
硼在炼钢过程中可以作为去氧剂。
4 赤热下,无定形硼与水蒸气反响:2B+6H2O(g)=2B(OH)3+2H25 在高温下硼能同N2,S,*2等非金属单质反响2B+N2=2BN2B+3Cl2=2BCl22B+3S=B2S36 在高温下硼也能同金属反响生成金属硼化物,如NbB4,ZrB2,LaB6等。
硼化物一般具有高硬度高熔点。
7 无定形硼不与非氧化性酸作用,但可以与热浓H2SO4,热的HNO3反响:B+3HNO3(浓〕=B(OH)3+3NO2↑2B+3H2SO4(浓〕=2B(OH)3+3SO2↑8 有氧化剂存在时,硼和强碱共熔可得到偏硼酸盐:2B+2NaOH+3KNO3=2NaBO2+3KNO2+H2O③硼单质的制备工业上用碱法分解硼镁矿制取单质硼。
Mg2B2O5•H2O+2NaBO2=2NaBO2+2Mg(OH)24NaBO2+CO2+10H2O=NaB4O7•10H2O+Na2CO3NaB4O7+H2SO4+5H2O=4H3BO3+Na2SO42H3BO3=B2O3+3H2OB2O3+Mg=2B+3MgO用硫酸与硼镁矿反响一步制得硼酸:Mg2B2O5•H2O+2H2SO4=2H3BO3+2MgSO4●(2) 硼氢化合物称为硼烷,的有:B2H6,B4H10,B5H9,B8H16,B8H18等,BnHn+4和BnHn+6共20 多种。
大学无机化学第13章 硼族元素

硼化物一般具有高的硬度和熔点。
25
二、金属铝
1.物理性质和用途 (1)物理性质 • Al、Ga、In、Tl均为银白色,质软、轻而富有延
展性的金属。 • 铝是一种银白色有光泽的金属,密度2.7g·cm-3,
熔点为930K,沸点为2740K。它具有良好的延展性 和导电性,能代替铜用来制造电线、高压电缆、 发电机等电器设备。
2
§13.1 硼族元素的通性
0
ⅢA Ⅳ硼AB :以Ⅴ硼A酸盐Ⅵ矿物A存在Ⅶ。A He 氦
2B 3 Al
硼 铝
SC(Ai 铝l2O碳硅A除 属3)l最硼。:NP为以由为广A磷氮于非泛l-O镓金,S键O、属第存3铟外在氧硫位,, 、。CF矿其铊l物余的氟氯以均性铝NA为质矾er 土氩氖金十
4 Ga 镓 Ge镓锗G分a相A:似s与砷Z,n,常SFe称e, A这硒l,三CB种rr等元溴矿素共K生为r 。氪镓
Ga存在于铝矾土和煤中,In和Tl存在于闪锌矿中。 • 地球元素含量(%):O(46.4)、Si(28.2)、Al(8.3)、
Fe(5.6) 、 Ca(4.2) 、 Na(2.4) 、 Mg(2.3) 、 K(2.1) 、 Ti(0.57)、H(0.14)
14
13-2-1 硼族元素在自然界中的分布
价价原••••I电主1层离 r电/子价缺缺例注((负要特原kM电3子半电电电如意子J3氧子性·+半m径子子子::数)轨化点子/(po径/数原化BH价m道l数pF-p1合子[m)3)B数层,:物F0缺8电H4、228]有:价0不.387电0子+B14空成电∧3是O子轨轨键子03缺5原。1、15道道电数74.电0子5+38子数3<子等对价化为形配 05电116、数层+缺 多72合位.‖缺成2+子3629轨电中1<物键电缺原价道子心。0(子子电51、1如8层数原键+56.有多037原子+H38轨子(1如孤电[子化B道可0∨8B对子F51、1(,合数形28+487H.]电原3.8+)069成6可物))1子子
中学化学竞赛试题资源库——硼族及其化合物

中学化学竞赛试题资源库——硼族及其化合物A组1.已知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似,如右图:则硼氮苯的二氯取代物B3N3H4Cl2的同分异构体的数目为A 2B 3C 4D 62.无机苯B3N3H6(B、N原子在环中交替排列)的三氯取代物的几何异构体数目为A 4B 6C 8D 103.1998年,中国十大科技成果之一是合成纳米氮化镓,其化学式应当是A GaNB Ga2N3C Ga3N2D Ga5N34.铊(Tl)是某超导材料的组成元素之一,与铝同族,位于第6周期。
Tl3+与Ag在酸性介质中发生反应:Tl3++2Ag=Tl++2Ag+。
下列推断正确的是A Tl+的最外层有1个电子B Tl3+的氧化性比Al3+弱C Tl能形成+3价和+1的化合物D Tl+的还原性比Ag强5.铊(Tl)是某超导材料的组成元素之一,与铝同族,位于第6周期。
已知Tl3+在酸性介质中可与Ag发生反应生成Tl+。
据此,从理论上看,下列推断不正确的是A Tl3++2Ag=Tl++2Ag+B Tl3++Cu=Tl++Cu2+C 2Tl3++3Zn=2Tl+3Zn2+D 3Tl3++2Al=3Tl++2Al3+6.氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述不正确的是A 氯化硼液态时能导电而固态时不导电B 氯化硼加到水中使溶液的pH降低C 氯化硼分子呈正三角形,属非极性分子D 氯化硼遇水蒸气会产生白雾7.铝和镓的性质相似,如M(OH)3都是难溶的两性氢氧化物。
在自然界镓常以极少量分散于铝矿,如Al2O3中。
用NaOH溶液处理铝矿(Al2O3)时,生成NaAlO2、NaGaO2;而后通入适量CO2,得Al(OH)3沉淀,而NaGaO2留在溶液中(循环多次后成为提取镓的原料)。
发生后一步反应是因为A 镓酸酸性强于铝酸B 铝酸酸性强于镓酸C 镓浓度小,所以不沉淀D Al(OH)3是难溶物8.第ⅢA族的Al、Ga均为两性元素,Al(OH)3与Ga(OH)3相比,后者酸性比前者强。
无机化学p区元素习题

⽆机化学p区元素习题P区元素习题⽬录⼀判断题;⼆选择题;三填空题;四完成⽅程式;五计算并回答问题⼀判断题 (返回⽬录)1 硼在⾃然界主要以含氧化合物的形式存在。
()2 在硼与氢形成的⼀系列共价型氢化物中,最简单的是BH3。
()3 硼酸是三元酸。
()4 硼是⾮⾦属元素,但它的电负性⽐氢⼩。
()5 由于B-O键键能⼤,所以硼的含氧化合物很稳定。
()6 硼砂的化学式为Na2B2O7。
()7 B2H6为平⾯形分⼦。
()8 硼是缺电⼦原⼦,在⼄硼烷中含有配位键。
()9 三卤化硼熔点的⾼低次序为BF310 三卤化硼沸点的⾼低次序为BF3>BCl3>BBr3>BI3。
()11 地壳中丰度最⼤的⾦属元素是铝。
()12 Al2O3是两性氧化物,因⽽各种晶型的Al2O3既可溶于酸,⼜可溶于碱。
()13 只有在强酸性溶液中才有Al(H2O)63+存在。
()14 在⽓相中三氯化铝以双聚分⼦Al2Cl6的形式存在。
()15 AlX3都是共价型化合物。
()16 KAl(SO4)2·12H2O与KCr(SO4)2·12H2O属于同分异构体。
()17 在氯化氢⽓流中加热⾦属铝可制得⽆⽔AlCl3。
()19 因AlCl3分⼦中Al为缺电⼦原⼦,所以AlCl3中有多中⼼键。
()20 碳酸盐的溶解度均⽐酸式碳酸盐的溶解度⼩。
()21 Na2CO3⽐NaHCO3的溶解度⼤,同理,CaCO3⽐Ca(HCO3)2的溶解度也⼤。
()22 硅在地壳中的含量仅次于氧。
()23 分⼦筛是⼈⼯合成的硅铝酸盐,具有吸附和催化作⽤。
()24 活性炭具有吸附作⽤,它是颗粒状的⽯墨。
()25 ⾦刚⽯⽐⽯墨更稳定,即使在纯氧⽓中,⾦刚⽯也不能燃烧。
()26 ⼀般情况下,CO2不能助燃,但是镁在⼆氧化碳⽓体中能燃烧。
()27 ⾼纯度的硅和锗是良好的半导体。
()28 ⾦刚⽯与⽯墨是同素异形体,由⾦刚⽯转变为⽯墨的△r H>0。
第12章 氮族碳族和硼族元素 习题参考答案

第12章氮族、碳族和硼族元素习题参考答案1. (1)解:3 + HClNH4Cl NH 3 + NH4HSO4(NH4)2SO4 NH 2O3 + N2 + 4H2O (NH4)2Cr2O7 Cr(2)解:2KNO3 2KNO2 + O2 2Cu(NO3)2 2CuO + 4NO2 + O22AgNO3 2Ag + 2NO2 + O25NO3- + 2Mn2+ + 3H2O2.解:(1) 5NO2-+ 2MnO4- + 6H+2? 3NO2-+ Cr2O7+ 8H+ →3NO3- +2Cr3++7H2O(2) 2NO2- + 2I- + 4H+(3) HNO2+NH33.解:(1) NH4Cl (NH4)2SO4(2)KNO2H2SO4 2NO↑+ I2 + 2H2O N2+ 2H2OBaCl2无现象产生白色沉淀(BaSO4)产生蓝色溶液(N2O3)、红棕色气体(NO2)无现象产生黄色沉淀(As2S3) KNO3(3)AsCl3SbCl3H2S产生橙红色沉淀(Sb2S3)产生黑色沉淀(Bi2S3) BiCl34.解:(1)S +2HNO3(浓) (2)4Zn + 10HNO3(很稀) (3)3CuS + 8HNO3 (4)PCl5+4H2OH2SO4 + 2NO↑4Zn(NO3)2 + NH4NO3 + 3H2O3Cu(NO3)2 + 3S↓ + 2NO↑ + 4H2OH3PO4+ 5HCl(5)2AsO33- + 3H2S + 6H+(6)AsO43- + 2I- + 5H+(8)Sb2S3 + 3S2-5.解:(1)NH4+NaOHH2SO4NH3O2Pt As2S3↓ + 6H2O H3AsO3 + I2 + H2O2MnO4- + 5Bi3+ + 5Na+ + 7H2O(7)2Mn2+ + 5NaBiO3 + 14H+ 2SbS33-NOO2 H2(Fe)纯O2高温高压燃烧N2NH3NO2Cu(浓HOHNO3)2Zn(稀HNO3)HNO3NH3N2OKIHNO2Cu(稀HNO3)NH4NO3H2SO4H2SO4(浓)NaOHO2NaNO2NaNO3H3AsO4H2S(HCl)As2S5Na2SHClNa3AsS4(2)AsCl3H2SNa3AsS3HClNa2SAs2S3H2O浓HClH3AsO3I2(pH=5~9)KI(pH<0.5)(3)Na3SbO3HCl(适量)NaOHSb(OH)3HClNaOH(过量)SbCl3H2SH2OHClNa2SHClSbOCl (4)Cl2(NaOH)NaBiO3Sb2S3Na3SbS3(NaOH)MnSO4 Cl2(HNO3)Bi(OH)3HNO3NaOHBi(NO3)3H2OHNO3BiONO36.解:A是AsCl3,B是AgCl,C是[Ag(NH3)2]Cl,D是As2S3,E是(NH4)3AsS4,F是As2S5,G是H2S。
大学无机化学第17章 硼族元素习题解答
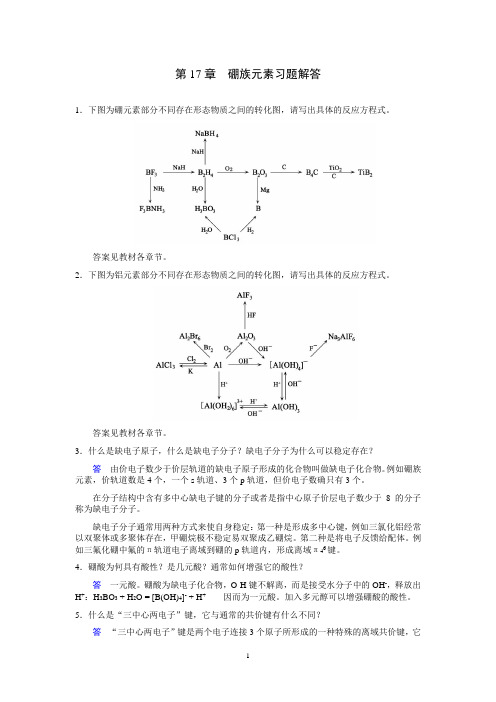
第17章硼族元素习题解答1.下图为硼元素部分不同存在形态物质之间的转化图,请写出具体的反应方程式。
答案见教材各章节。
2.下图为铝元素部分不同存在形态物质之间的转化图,请写出具体的反应方程式。
答案见教材各章节。
3.什么是缺电子原子,什么是缺电子分子?缺电子分子为什么可以稳定存在?答由价电子数少于价层轨道的缺电子原子形成的化合物叫做缺电子化合物。
例如硼族元素,价轨道数是4个,一个s轨道、3个p轨道,但价电子数确只有3个。
在分子结构中含有多中心缺电子键的分子或者是指中心原子价层电子数少于8的分子称为缺电子分子。
缺电子分子通常用两种方式来使自身稳定:第一种是形成多中心键,例如三氯化铝经常以双聚体或多聚体存在,甲硼烷极不稳定易双聚成乙硼烷。
第二种是将电子反馈给配体。
例如三氟化硼中氟的π轨道电子离域到硼的p轨道内,形成离域π46键。
4.硼酸为何具有酸性?是几元酸?通常如何增强它的酸性?答一元酸。
硼酸为缺电子化合物,O-H键不解离,而是接受水分子中的OH-,释放出H+:H3BO3 + H2O = [B(OH)4]- + H+因而为一元酸。
加入多元醇可以增强硼酸的酸性。
5.什么是“三中心两电子”键,它与通常的共价键有什么不同?答“三中心两电子”键是两个电子连接3个原子所形成的一种特殊的离域共价键,它是缺电子原子的一种成键特征。
它与通常的共价键的区别,在于它是一种缺电子的桥键,而一般的共价键是由两个原子共用两个电子所形成的。
6.铝在什么情况下生成致密的钝化膜,其应用如何?钝化膜又在什么情况下容易被破坏?答铝在空气中由于表面会生成致密的氧化膜而阻止进一步的反应,不易受到腐蚀,常被用来制造化学反应器、医疗器械、冷冻装置、石油精炼装置、石油和天然气管道等。
铝但遇到冷的浓硝酸或浓硫酸时,由于在金属表面生成薄而极其致密的氧化物薄膜,而发生钝化。
食盐可腐蚀铝表面的氧化膜,因此铝制器皿不宜长期存放咸的菜品等。
铝置于水中会生成紧密而很难溶解的氢氧化铝层。
大学无机化学第十二章试题(卷)与答案解析

⼤学⽆机化学第⼗⼆章试题(卷)与答案解析第⼗三章硼族元素总体⽬标:1.掌握硼单质、氢化物、卤化物和含氧化物的性质、⽤途和制备⽅法2. 通过硼及其化合物的结构和性质,掌握缺电⼦化合物的成键特征3.掌握铝及其化合物的结构、性质和制备4. .认识铍和铝的相似性各节⽬标:第⼀节硼单质及其化合物1.掌握硼单质的结构、化学性质、⽤途和制备⽅法2.掌握⼄硼烷、硼酸(H3BO3)、硼砂和三卤化硼的性质、结构和制备⽅法3.通过硼及其化合物的结构和性质,掌握缺电⼦化合物的成键特点和桥键的形成第⼆节铝单质及其化合物1.掌握铝及其化合物的主要性质和AlCl3的结构,了解铝的提取和冶炼2.认识铍和铝的相似性,如⾦属单质、⽆⽔卤化物、⽔合卤化物、氢氧化物第三节镓、铟、铊了解镓、铟、铊单质及其重要化合物的性质习题⼀、选择题⒈下列有关硼、铝性质的叙述,错误的是( )A.都是缺电⼦原⼦B.B(OH)3是弱酸,Al(OH)3是两性偏碱性C.其三卤化物分⼦都是平⾯三⾓形结构D.都是亲氧元素⒉在下列a—Al2O3的制备⽅法中,不妥的是( )A.灼烧Al(OH)3B.灼烧Al(NO3)3C.⾼温电解Al2(SO4)3D.⾦属铝在氧中燃烧⒊下列铝的化合物不能⽤湿法制得的是( )A. Al2(CO3)3B.Al2(SO4)3C.AlCl3D.Al(Ac)3D.⽅铅矿5. 下列化合物属于缺电⼦化合物的是( ) (吉林⼤学《⽆机化学例题与习题》)A.BCL3B. H[BF4]C. B2O3D. Na[Al(OH)4]6. 在硼的化合物中,硼原⼦的最⾼配位数不超过4,这是因为( )A .硼原⼦半径⼩ B.配位原⼦半径⼤C.硼与配位原⼦电负性差⼩D. 硼原⼦⽆价层d轨道7. 下列关于BF3的叙述中,正确的是( )A.BF3易形成⼆聚体B.BF3为离⼦化合物C. BF3为路易斯酸D. BF3常温下为液体8. 下列⾦属单质中,熔点最低的是( ) (吉林⼤学《⽆机化学例题与习题》)A. CuB. ZnC. NaD. Ga9. 下列化合物中,熔点最低的是( ) (吉林⼤学《⽆机化学例题与习题》)A. BCl3B. CCl4C. SiCl4D. SnCl410. 下列物质中⽔解并能放出H2的是( ) (吉林⼤学《⽆机化学例题与习题》)A. B2H6B. N2H4C. NH3D. PH311. 下列化合物中不能稳定存在的是( ) (吉林⼤学《⽆机化学例题与习题》)12 . 下列含氧酸中属于⼀元酸的是( ) (吉林⼤学《⽆机化学例题与习题》)A .H3AsO3 B.H3BO3 C.H3PO3 D .H2CO313.下列物质中,酸性最弱的是( ) (吉林⼤学《⽆机化学例题与习题》)A.. H3PO3 B . H2S C. H3BO3 D. H5IO614.下列⾦属中,与硝酸反应得到产物的氧化数最低是( )A .In B. Tl C. Fe D . Bi15.下列⾦属中,氧化能⼒最强的是( ) (吉林⼤学《⽆机化学例题与习题》)A. NO2B.SO3 C .B2O3 D. Tl2O316.下列分⼦中,偶极矩最⼩的是( ) (吉林⼤学《⽆机化学例题与习题》)A .B2H6 B. SO2 C. NCl3 D. SF417.下列化合物中,氧化性与惰性电⼦对效应有关的是( )A .I2O5 B. Tl2O3 C . Mn2O7 D. CrO318.与NaCO3溶液反应⽣成碱式盐沉淀的离⼦是( )A.Al3+B.Ba2+C.Cu2+D.Hg2+19.氧化性最强的是( )A. Al2O3B. Ga2O3C. In2O3D. Tl2O320.⽔解性最强的是( )A. AlCl3B. AlBr3C. NaClD. KNO321.下列物质熔点最⾼的是( )A.单质硼B.⾦属铝22. ⽤电解法制备⾦属铅时,在Al2O3中加⼊Na3AlF6的作⽤是( )A.使Al2O3的熔化温度降低B.作为原料C.防⽌⾦属铝氧化D.加快反应速度23.下列关于⼄硼烷的叙述中,不正确的是( )A.它是缺电⼦化合物B.围绕B—B键可⾃由旋转C.分⼦中存在三中⼼⼆电⼦氢桥键D.它最终⽔解产物是氢⽓和硼酸24.硼酸与多元醇反应,⽣成配位酸,使其酸性( )A.减弱B.增强C.不变D.变化不定⼆、填空题1. 最简单的硼氢化合物是,B原⼦的杂化⽅式为;由于它属于化合物,B与B存在碱。
2017-2018高中化学竞赛辅导(试题、讲解及答案)--碳、硼及其化合物

(2)根据陈教授的科研成果,试分析研究天然金刚石矿的成因;
(3)如果把陈教授合成金刚石的压力拆除,置于真空状态之下,其他条件都不变,化学 反应的方程式也不会改变你认为,还原的碳会以怎样的结构形式出现?
元素化学 16:碳、硼及其化合物
(时间:2.5 小时 满分:100 分) 第一题(9 分)硼的化合物选粹 硼是硬而脆及相对不活泼的元素,只能溶于热浓 HNO3、热浓 H2SO4,在空气中燃烧生成 + B2O3 和 BN,但却无 B3 离子,BN 的结构和石墨相似,硼能形成原酸 H3BO3 及偏酸 HBO2,其 盐存在于自然界,B 和 H 形成一系列具有高燃烧热值的化合物,其通式为 BnH(n+4)(不稳定) 、 。最简单气态氢化物在标准状态下密度为 1.235g/L。 BnH(n+6)(稳定) 1.写出 XN 的结构式。 2.写出最简单氢化物的电子结构。
3.最简单氢化物的燃烧热,ΔHocomb=-2020kJ/mol,基于此性 质,请考虑氢化物有何种用途?
4.硼酸晶体属于离子晶体、原子晶体、分子晶体、混合型晶体中的哪一种?指出硼酸中 的硼采取的杂化形式,以及硼酸中的大 B 键类型;
5.硼酸常温下为白色片状晶体,溶于水(273K 时溶解度为 6.35) ,在热水中溶解度明显 增大(373K 时为 27.6) 。请分析其中原因。
2.中国科学技术大学陈乾旺教授领导的研究组最近在人工合成金刚石研究中取得重大突 破,他们用自制的高压反应釜做实验,以二氧化碳为原料,用金属钠作还原剂,在 440℃和 800 个大气压的条件下,首次实现了从二氧化碳到金刚石的转变。2003 年 8 月 3 日,陈教授的论文 发表在国际权威刊物(美国化学会志)上。 (1)请写出陈教授合成金刚石的反应方程式;
3.用绿色化学的观念给出用 CO2 代替一氧化碳和光气的 2 个理由。与以 CO 或 COCl2 为 反应物对比,再给出用 CO2 为反应物的 1 个主要障碍(除必须对二氧化碳进行压缩外) 。
化学竞赛无机化学试题及答案

化学竞赛无机化学试题及答案一、选择题(每题2分,共20分)1. 以下哪种元素是地壳中含量最多的元素?A. 氧B. 硅C. 铝D. 铁2. 元素周期表中,第IA族元素的代表性特征是什么?A. 非金属性B. 金属性C. 稀有气体D. 放射性3. 根据元素周期律,同一主族元素的原子半径从上到下的变化趋势是什么?A. 逐渐减小B. 逐渐增大C. 先增大后减小D. 无规律变化4. 以下化合物中,哪一个是共价化合物?A. NaClB. CaOC. H2OD. FeS5. 金属晶体中,金属原子之间通过什么相互作用?A. 离子键B. 共价键C. 金属键D. 范德华力二、填空题(每空2分,共20分)6. 元素周期表中的第_______周期被称为长周期。
7. 原子序数为17的元素是_______。
8. 离子键通常存在于_______和_______之间。
9. 金属晶体的导电性是由于_______的存在。
10. 一个典型的离子晶体是_______。
三、简答题(每题10分,共30分)11. 描述什么是离子晶体,并给出一个例子。
12. 解释什么是配位数,并给出一个常见的配位化合物的例子。
四、计算题(每题15分,共30分)13. 已知某化合物的化学式为Fe2O3,计算其摩尔质量。
14. 假设有1.0摩尔的NaCl溶解在1升水中,计算溶液的摩尔浓度。
答案一、选择题1. A2. B3. B4. C5. C二、填空题6. 四7. 氯(Cl)8. 金属非金属9. 自由电子10. NaCl三、简答题11. 离子晶体是由正负离子通过静电吸引力结合形成的晶体。
例如,NaCl(氯化钠)就是一个典型的离子晶体。
12. 配位数是指一个中心原子或离子周围所连接的配体数量。
例如,[Fe(H2O)6]3+中,铁离子的配位数是6。
四、计算题13. Fe2O3的摩尔质量= 2 × 55.845(Fe的摩尔质量)+ 3 × 15.999(O的摩尔质量)= 159.688 g/mol。
无机化学教学资料——碳族和硼族元素练习

碳族和硼族元素练习一、选择题( 共17题34分)1. (7643)与Na2CO3溶液作用全部都生成碱式盐沉淀的一组离子是……………………()(A) Mg2+,Al3+,Co2+,Zn2+ (B) Fe3+,Co2+,Ni2+,Cu2+(C) Mg2+,Mn2+,Ba2+,Zn2+ (D) Mg2+,Mn2+,Co2+,Ni2+2. (7462)下列说法不正确的是……………………………………………………………()(A) SiCl4在与潮湿的空气接触时会冒“白烟”(B) NF3因会水解,不能与水接触(C) SF6在水中是稳定的(D) PCl5不完全水解生成POCl33. (3718) 铅蓄电池在充电时,阳极反应是……………………………………………()(A) PbSO4 + H2O = PbO2 + 4H+ + SO-24+ 2e-(B) Pb + SO-24= PbSO4 + 2e-(C) PbSO4 + 2e-= Pb + SO-24(D) PbO2 + 4H+ + SO-24+ 2e-= PbSO4 + 2H2O4. (0545) 已知在一定温度下SnO2(s) + 2H2(g)Sn(s) + 2H2O(g) K c= 21.0CO(g) + H2O(g)CO2(g) + H2(g) K c= 0.0340因此下列反应SnO2(s) + 2CO(g)Sn(s) + 2CO2(g) 的K c值………………………()(A) 21.0 (B) 0.714 (C) 0.0243 (D) 21.15. (7476)分离SnS和PbS,应加的试剂为…………………………………………………()(A) 氨水(B) 硫化钠(C) 硫酸钠(D) 多硫化铵6. (7475)鉴别Sn4+和Sn2+离子,应加的试剂为……………………………………………()(A) 盐酸(B) 硝酸(C) 硫酸钠(D) 硫化钠(过量)7. (7466)下列分子中,C与O之间键长最短的是…………………………………………()(A) CO (B) Ni(CO)4(C) CO2(D) CH3COOH8. (7363)将过量SiF4通入NaOH溶液中,主要产物是……………………………………()(A) H4SiO4,NaF (B) Na2SiO3,NaF (C) Na2SiO3,Na2SiF6(D) SiO2,HF9. (4370)下列说法不正确的是…………………………………………………………()(A)HCO3-可通过氢键形成双聚离子(B) NaHCO3的热稳定性不如NaCO3高(C) BeCO3在热水中就可发生分解(D) 所有碱金属碳酸盐都是易溶于水的10. (4308) CO32-的几何构型是………………………………………………………()(A) 平面三角形(B) 三角锥形(C) T形(D) 直线形11. (1460) 下列硫化物,能溶于Na2S溶液生成硫代酸盐的是…………………………()(A) SnS (B) SnS2(C) PbS (D) Bi2S312. (1456) 试判断Ge、Sn、Pb 分别与浓HNO3作用时,正确的说法是………………()(A) 三元素都被氧化成+2价(B) 三元素都被氧化成+4价(C) Ge和Sn被氧化成+4价,但Pb却被氧化成+2价(D) Ge被氧化成+4价,但Sn和Pb只却被氧化成+2价13. (1451) IV A族元素从Ge到Pb;下列性质随原子序数的增大而增加的是…………()(A) +2氧化态的稳定性(B) 二氧化物的酸性(C) 单质的熔点(D) 氢化物的稳定性14. (7354)从分子轨道理论出发,可以认为在B2分子中存在的化学键是………………()(A) 三中心二电子键(B) 一个σ键(C) 二个单电子π键(D) 一个σ键和一个π键15. (4403) BF 3通入过量的Na 2CO 3溶液,得到的产物是……………………………( ) (A) HF 和H 3BO 3 (B) HBF 4和B(OH)3 (C) NaBF 4和NaB(OH)4 (D) HF 和B 4O 3 16. (4333) 下列含氧酸中属于三元酸的是…………………………………………… ( ) (A) H 3BO 3 (B) H 3PO 2 (C) H 3PO 3 (D) H 3AsO 4 17. (1478) 铝在空气中燃烧时,生成……………………………………………………( ) (A) 单一化合物Al 2O 3 (B) Al 2O 3和Al 2N 3 (C) 单一化合物Al 2N 3 (D) Al 2O 3和AlN二、填空题 ( 共18题 36分 )18. (1509)将适量的SnCl 2溶液加入HgCl 2溶液中,有____________产生,其化学反应方程式为:__________________________________________________________。
第16章-硼族元素习题

第16章硼族元素习题1.选择题16-1硼族元素最重要的特征是…………………………………………………( ) (A) 共价性特征 (B) 缺电子性特征(C) 共价性和缺电子性特征 (D) 易形成配合物和自身聚合的特征16-2 硼成键为sp2杂化,且含三个单键, 1 个π46键的化合物是………….. ( )(A) B2O3(B) BF4-(C) BO33-(D) B2H616-3硼的独特性质表现在………………………………………………………( )(A) 能形成正氧化态化合物,如BN ,其它非金属则不能(B) 能生成大分子(C) 能形成负氧化态化合物,其它金属则不能(D) 在简单的二元化合物中总是缺电子的16-4在 菱形硼的B12单元中,表现硼原子是缺电子原子性质的原子个数是( )(A) 3个(B) 6个(C) 9个(D) 12个16-5 下列关于单质硼性质的描述,错误的是………………………………..( )(A) 常温下不活泼,但高温下可与许多非金属反应(B) 与碳相似,炽热的硼可与水蒸气反应(C) 可与盐酸反应 (D) 可与碱反应16-6 硼与浓NaOH反应,所得的含硼产物是………………………………..( )(A) NaBO2(B) Na3BO3(C) B2O3(D) H3BO316-7 硼与浓硝酸反应,所得的含硼产物是…………………………………( )(A) B(NO3)3(B) H3BO3(C) BN (D) B2O316-8 下列对硼酸性质的描述不正确的是…………………………………( )(A) 硼酸是三元酸(B) 硼酸是一元路易斯酸(C) 硼酸与多元醇反应,生成配合物,使酸性增强(D) 硼酸的溶解度小16-9 硼砂的水溶液呈…………………………………………………….( )(A) 碱性(B) 中性(C) 酸性(D) 弱酸性16-10用盐酸滴定硼砂水溶液至恰好中和时,溶液呈……………………( )(A) 中性(B) 弱酸性(C) 弱碱性(D) 强碱性16-11下列关于硼酸结构的叙述错误的是……………………………….( )(A) 硼酸为白色片状晶体,其结构单元为B(OH)3三角形(B) 硼原子通过sp3杂化轨道与氧原子成键(C) 分子间通过氢键形成接近于六角形的对称层状结构(D) 层与层间以范德华力联系16-12在分析化学中,硼砂被用来作标准溶液是因为它………………………( )(A) 易水解(B) 在干燥空气中易风化(C) 溶融态时可溶解金属氧化物(D) 稳定,易提纯16-13 CO2泡末灭火器的反应原理是…………………………………………..( )(A) HCO3-离子的水解(B ) Al3+水解(C) HCO3-Al3+双水解,相互促进(D) 反应生成Al(HCO3)3,然后水解16-14 下列物质中水解并放出H2的是………………………………………()(A) B2H6(B) N2H4(C) NH3 (D) PH316-15 硼的缺电子性表现在……………………………………………………( )(A) 易形成缺电子多中心键及配合物(B) 易形成含桥键的化合物(C) 易形成不同类型杂化,形成化合物(D) 易形成共价化合物16-16 可形成下面几种类型化合物的X元素是………………………………( ) (XH3)2;X2O3;XCl3;XO2-;XF3·HF(A) P (B) Al (C) B (D) S16-17铝在空气中燃烧时,生成……………………………………………….( )(A)单一化合物Al2O3 (B) Al2O3和Al2N3(C)单一化合物Al2N3 (D) Al2O3和AlN16-18下列含氧酸中属于三元酸的是…………………………………………. ( )(A) H3BO3(B) H3PO2(C) H3PO3(D) H3A s O416-19BF3通入过量的Na2CO3溶液,得到的产物是………………………()(A) HF和H3BO3(B) HBF4和B(OH)3(C) NaBF4和NaB(OH)4(D) HF 和B2O316-20 BF3,B2H6,Al2Cl6都是稳定的化合物,BH3,AlCl3则相对不稳定,其原因是……………………………………………………………………….( )(A) 前者形成大π键,后者缺电子(B) 前者通过大π键、多中心键、配位键补偿了缺电子,后者缺电子(C) 前者缺电子,后者有多中心键(D) 前者有配位键,后者缺电子16-21 铊可以生成氟化铊、氯化铊和碘化铊,Tl在这三种化合物中的氧化态是( )(A) 与F 结合为Tl(+III) (B)与Cl 结合为Tl(+III)(C) 与I 结合为Tl(+I)与F,Cl结合为Tl(+III) (D) 全部为Tl(+III)16-22 InCl2为反磁性化合物,其中In 的氧化数为…………………………….()(A) +1 (B) +2 (C) +3 (D) +1和+316-23三氯化铝经常以(AlCl3)2 形式存在。
无机化学第三版下册答案第二十一章第十六章硼族元素习题解答(1)

第十六章 硼族元素1. 下表中给出第二、三周期元素的第一电离能数据(单位kJ·mol 1 )试说明B,Al 的第一电离能为什么比左右两元素的都低? 答:因为B ,Al 元素基态原子的价电子层结构为:ns 2np 1,最外层np 轨道上的一个电子容易失去而形成np 0空轨道稳定状态。
所以B 和Al 的I 1比左右两元素都低。
2. 在实验室中如何制备乙硼烷,乙硼烷的结构如何? 答:实验室中制备乙硼烷:质子置换法: 2BMn + 6H + = B 2H 6 + 2Mn 3+氢化法: 2BCl 3 + 6H 2 = B 2H 6 + 6HCl氢负离子置换法 3LiAlF 4 + 4BF 3 2B 2H 6 + 3LiF +3AlF 3乙醚或 3NaBH 4 + 4BF 32B 2H 6 + 3NaBF 4乙醚C 2H6的结构:BBHHHHHH分子中的 2个B 原子采取sp 3杂化,C2H 6分子中有4条B-H σ键,2条 氢桥键。
3. 说明三卤化硼和三卤化铝的沸点高低顺序,并指出蒸汽分子的结构。
答:三卤化物的熔沸点顺序见课本P780。
三卤化硼的蒸气分子均为单分子,AlF 3的蒸气为单分子。
而AlCl 3的蒸气为二聚分子,其中Al 采取sp 3杂化。
其结构:4. 画出B 3N 3H 6(无机苯)的结构。
答:NB NB N B HHHHHB 和N 原子都采取sp 2杂化,分子中有3条N -H σ键(sp 2-s ),3条B ―H σ键(sp2-s ),6条B ―N σ键(sp 2-sp 2),一个66π离域键(N 原子提供电子对,B 原子提供空p 轨道)5.B 10H 14的结构中有多少种形式的化学键?各有多少个?答:B 10H 14有5种化学键:有10条B -H σ键(2C -2e 键),2条B -B σ键(2C -2e 键),4条 桥键(3C-2e 键),2条开口硼桥键(3C-2e 键),4条闭合硼桥键(3C-2e 键)。
第16章-硼族元素习题

第16章硼族元素习题1.选择题16-1硼族元素最重要的特征是…………………………………………………( ) (A) 共价性特征 (B) 缺电子性特征(C) 共价性和缺电子性特征 (D) 易形成配合物和自身聚合的特征16-2 硼成键为sp2杂化,且含三个单键, 1 个π46键的化合物是………….. ( )(A) B2O3(B) BF4-(C) BO33-(D) B2H616-3硼的独特性质表现在………………………………………………………( )(A) 能形成正氧化态化合物,如BN ,其它非金属则不能(B) 能生成大分子(C) 能形成负氧化态化合物,其它金属则不能(D) 在简单的二元化合物中总是缺电子的16-4在 菱形硼的B12单元中,表现硼原子是缺电子原子性质的原子个数是( )(A) 3个(B) 6个(C) 9个(D) 12个16-5 下列关于单质硼性质的描述,错误的是………………………………..( )(A) 常温下不活泼,但高温下可与许多非金属反应(B) 与碳相似,炽热的硼可与水蒸气反应(C) 可与盐酸反应 (D) 可与碱反应16-6 硼与浓NaOH反应,所得的含硼产物是………………………………..( )(A) NaBO2(B) Na3BO3(C) B2O3(D) H3BO316-7 硼与浓硝酸反应,所得的含硼产物是…………………………………( )(A) B(NO3)3(B) H3BO3(C) BN (D) B2O316-8 下列对硼酸性质的描述不正确的是…………………………………( )(A) 硼酸是三元酸(B) 硼酸是一元路易斯酸(C) 硼酸与多元醇反应,生成配合物,使酸性增强(D) 硼酸的溶解度小16-9 硼砂的水溶液呈…………………………………………………….( )(A) 碱性(B) 中性(C) 酸性(D) 弱酸性16-10用盐酸滴定硼砂水溶液至恰好中和时,溶液呈……………………( )(A) 中性(B) 弱酸性(C) 弱碱性(D) 强碱性16-11下列关于硼酸结构的叙述错误的是……………………………….( )(A) 硼酸为白色片状晶体,其结构单元为B(OH)3三角形(B) 硼原子通过sp3杂化轨道与氧原子成键(C) 分子间通过氢键形成接近于六角形的对称层状结构(D) 层与层间以范德华力联系16-12在分析化学中,硼砂被用来作标准溶液是因为它………………………( )(A) 易水解(B) 在干燥空气中易风化(C) 溶融态时可溶解金属氧化物(D) 稳定,易提纯16-13 CO2泡末灭火器的反应原理是…………………………………………..( )(A) HCO3-离子的水解(B ) Al3+水解(C) HCO3-Al3+双水解,相互促进(D) 反应生成Al(HCO3)3,然后水解16-14 下列物质中水解并放出H2的是………………………………………()(A) B2H6(B) N2H4(C) NH3 (D) PH316-15 硼的缺电子性表现在……………………………………………………( )(A) 易形成缺电子多中心键及配合物(B) 易形成含桥键的化合物(C) 易形成不同类型杂化,形成化合物(D) 易形成共价化合物16-16 可形成下面几种类型化合物的X元素是………………………………( ) (XH3)2;X2O3;XCl3;XO2-;XF3·HF(A) P (B) Al (C) B (D) S16-17铝在空气中燃烧时,生成……………………………………………….( )(A)单一化合物Al2O3 (B) Al2O3和Al2N3(C)单一化合物Al2N3 (D) Al2O3和AlN16-18下列含氧酸中属于三元酸的是…………………………………………. ( )(A) H3BO3(B) H3PO2(C) H3PO3(D) H3A s O416-19BF3通入过量的Na2CO3溶液,得到的产物是………………………()(A) HF和H3BO3(B) HBF4和B(OH)3(C) NaBF4和NaB(OH)4(D) HF 和B2O316-20 BF3,B2H6,Al2Cl6都是稳定的化合物,BH3,AlCl3则相对不稳定,其原因是……………………………………………………………………….( )(A) 前者形成大π键,后者缺电子(B) 前者通过大π键、多中心键、配位键补偿了缺电子,后者缺电子(C) 前者缺电子,后者有多中心键(D) 前者有配位键,后者缺电子16-21 铊可以生成氟化铊、氯化铊和碘化铊,Tl在这三种化合物中的氧化态是( )(A) 与F 结合为Tl(+III) (B)与Cl 结合为Tl(+III)(C) 与I 结合为Tl(+I)与F,Cl结合为Tl(+III) (D) 全部为Tl(+III)16-22 InCl2为反磁性化合物,其中In 的氧化数为…………………………….()(A) +1 (B) +2 (C) +3 (D) +1和+316-23三氯化铝经常以(AlCl3)2 形式存在。
无机化学反应式-硼族元素
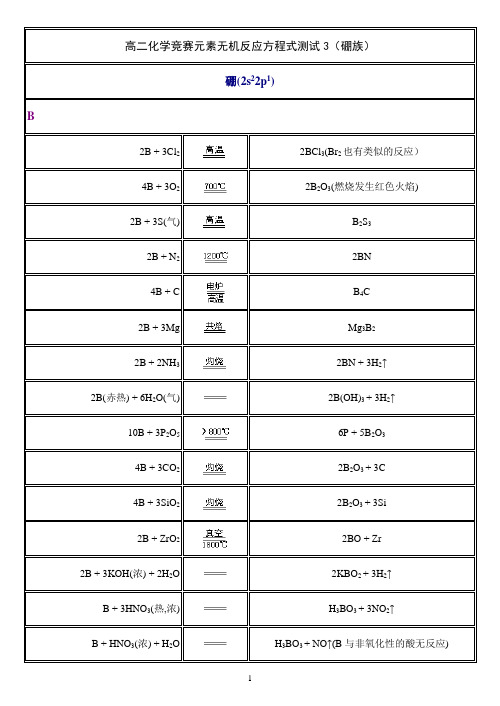
高二化学竞赛元素无机反应方程式测试3(硼族)硼(2s22p1)B2B + 3Cl22BCl3(Br2也有类似的反应)4B + 3O22B2O3(燃烧发生红色火焰)2B + 3S(气) B2S32B + N22BN4B + C B4C2B + 3Mg Mg3B22B + 2NH32BN + 3H2↑2B(赤热) + 6H2O(气) 2B(OH)3 + 3H2↑10B + 3P2O56P + 5B2O34B + 3CO22B2O3 + 3C4B + 3SiO22B2O3 + 3Si2B + ZrO22BO + Zr2B + 3KOH(浓) + 2H2O 2KBO2 + 3H2↑B + 3HNO3(热,浓) H3BO3 + 3NO2↑B + HNO3(浓) + H2O H3BO3 + NO↑(B与非氧化性的酸无反应)2B + 3KNO3 + 2KOH 3KNO2 + 2KBO2(偏硼酸钾) + H2OB2H6(乙硼烷)B2H6 + X2B2H5X + HX(X2代表F2、Cl2、Br2、I2)B2H6 + 6X22BX3 + 6HXB2H6 + 3O2(空气) B2O3 + 3H2OB2H6 + 2NH32[H3B·NH3]2[H3B·NH3] NH4[H3B·NH2·BH3]B2H6 + 6H2O 2B(OH)3 + 6H2↑B2H6 + 2CO 2[H3BCO]B2H6 + 2KOH K2[B2H6O2] + H2B2H6 + HI B2H5I + H22B2H5I + 2Na B4H10 + 2NaIB2O32B2O3 + 4C B4C + 3CO2↑B2O3 + 3C + 3Cl22BCl3 + 3CO↑B2O3 + 6Na 3Na2O + 2B(其它碱金属也有类似的反应)B2O3 + 3Mg 3MgO + 2BB2O3 + 2NH32BN + 3H2OB2O3(固) + H2O(热,气) 2HBO2↑B2O3 + 3H2O(液) 2H3BO3(溶液)B2O3(固) + CuO(固) Cu(BO2)2(热时产物显绿色、冷时显兰色) B2O3 + 4KOH K4B2O5 + 2H2OB2O3 + 6NaOH 2Na3BO3 + 3H2OB2O3 + 6HCl(热,浓) 2BCl3 + 3H2O(溶于无水醇)B2O3 + 6HBr(气) 2BBr3 + 3H2O(溶于无水醇)B2O3 + 2H4P2O72HBP2O7 + 3H2O B2O3 + 3H2SO4(100%) + 3CaF22BF3 + 3CaSO4 + 3H2O2B2O3 + Na2CO3Na2B4O7 + CO2↑2B2O3 + KBF4K[B4O6F] + BF3↑B2O3 + 3H2SO4(热,浓)+ 6KBF43K2SO4 + 8BF3 + 3H2OBO2BO B2O3 + BHBO24HBO2H2B4O7 + H2OHBO2 + NaOH NaBO2 + H2O HBO2 + H2SO4(发烟) + SO3B(OH)SO4·SO3 + H2O6HBO2 + 5KI + KIO36KBO2 + 3I2 + 3H2O 6HBO2 + 2C4H6O6BC4O6H3·C4O6H6 + 2H2O H3BO32H3BO3B2O3 + 3H2OH3BO3HBO2 + H2O4H3BO34HBO2H2B4O7(硼酸)2B2O3H3BO3 + Na2O2NaBO3 + NaOH + H2O2H3BO3 + 3CaO Ca3(BO3)2 + 3H2OCa3(BO3)2B2O3 + 3CaO4H3BO3 + 2NaOH Na2B4O7 + 7H2O H3BO3 + NaOH(过量) NaBO2 + 2H2OH3BO3 + Ca(OH)2Ca(BO2)2 + 4H2O H3BO3 + NaOH + H2O2NaBO3 + 4H2OH3BO3 + Ba(OH)2BaB4O7 + 7H2OH3BO3 + 3HF(48%) BF3 + 3H2OBF3 + HF H[BF4]H3BO3 + H3PO4BPO4 + 3H2O4H3BO3 + 2NaCl Na2B4O7 + 2HCl + 5H2O4H3BO3 + 2NaCl + 2NH3Na2B4O7 + 2NH4Cl + 5H2O2H3BO3 + CaCl2CaO·B2O3 + 2HCl + 2H2O(NaCl,KCl参与)H3BO3 + 2NaHF2NaBF4 + NaOH + 2H2O4H3BO3 + Na2SO4Na2B4O7 + H2SO4 + 5H2O 4H3BO3 + Na2CO3(过量) Na2B4O7 + CO2↑+ 6H2O 2H3BO3 + Ca(HCO3)2Ca(BO2)2↓+ 2CO2 + 4H2OH3BO3 + 3CH3OH (CH3O)3BO2(硼酸三甲酯) + 3H2OH3BO3 + C3H5(OH)3(甘油)+ 2H2OC3H5(OH)·NaBO3 + H2O+ NaOHH3BO3 + 3C2H5OH B(C2H5O)3 + 3H2OLiBO2Li2B2O5↓(白色) + 9H2O 2LiBO2·8H2O + H2O2(过量)(0℃,无水乙醇,然后在40℃真空蒸发) KBO2KBO2 + H2C2O4(BO)KC2O4 + H2OKBO2 + 2KC4O6H5KB(C4O6H4)2↓(络盐) + 2KOH NaBO2NaBO2 + 2H2O H3BO3 + NaOH(在稀溶液中进行)4NaBO2 + CO2 + 10H2O Na2B4O5(OH)4·8H2O + Na2CO3 Na2B4O5(OH)4·8H2O B2O3 + 2NaBO2 + 10H2ONa2B4O5(OH)4·8H2O Na2B4O7 + 10H2ONaBO2 + 3NaF + 4H2O NaBO2·3NaF·4H2O NaBO2 + 2C4H6O6 + 2NaOH NaBC4O6H2·NaC4O6H4 + 4H2O NaBO2 + 2NaC4O6H5Na2C4O6H4·NaC4O6H5·HBO2NaBO2 + Na2C4O6H4Na3BOC4O6H2(络盐) + H2O 4NaBO2 + 2Cu(BO2)2 + 2C 2Na2B4O7 + 2CO↑+ 2Cu铝(3s23p1)Al2Al(粉) + 3Br22AlBr2(卤素元素均有类似的反应)4Al + 3O22Al2O32Al + N22AlNAlN + 3H2O Al(OH)3 + NH3(反应较慢)Al(粉) + P AlPAlP + 3H2O Al(OH)3 + PH32Al + 2NH32AlN + 3H2↑2Al + 6H2O 2Al(OH)3↓+ 3H2↑(去掉Al2O3以后的Al)4Al + 3MnO22Al2O3 + 3Mn8Al + 3Mn3O44Al2O3 + 9Mn2Al + Cr2O32Cr + Al2O34Al + 3TiO2 + 3C 2Al2O3 + 3TiC注:铝热剂焊接钢轨的主要化学反应方程式:2Al + 3FeO Al2O3 + 3Fe(主要发生的反应)2Al + Fe2O3Al2O3 + 2Fe8Al + 3Fe3O44Al2O3 + 9Fe(要求FeO含量达60%,Fe2O3和Fe3O4少量,S和P含量在0.05%以下)2Al + 6NaOH(浓) 2Na3AlO3 + 3H2↑2Al + 2NaOH + 6H2O 2NaAl(OH)4 + 3H2↑2NaAl(OH)42NaAlO2 + 4H2O总式:2Al + 2NaOH + 2H2O 2NaAlO2 + 3H2↑(即Al与稀NaOH溶液反应)2Al + 6HCl(稀) 2AlCl3 + 3H2↑(浓HCl与Al反应很慢,加HgCl2溶液时能促进反应。
09-18年化学奥林匹克竞赛初赛试题分类-硼

硼
(10年) 第6 题(8分)在我国青海、西藏等地有许多干涸盐湖盛产一种钠盐Q。
Q为一种易溶于水的白色固体。
Q的水溶液用硫酸酸化,得到弱酸X。
X为无色小片状透明晶体。
X和甲醇在浓硫酸存在下生成易挥发的E。
E在空气中点燃呈现绿色火焰。
E和NaH反应得到易溶于水的白色固态化合物Z(分子量37.83)。
6-1写出由Q得到X的离子方程式。
6-2 写出X在水中的电离方程式。
6-3 写出X和甲醇在浓硫酸存在下生成E的化学方程式。
6-4 写出E燃烧反应的化学方程式。
6-5 写出由E和NaH制备Z的化学反应方程式。
6-6 Z在水溶液里的稳定性与溶液pH有关,pH越大越稳定。
为什么?
6-7近年来,用Z和过氧化氢构建一种新型碱性电池已成为热门的研究课题。
该电池放电时,每摩尔Z释放8摩尔电子,标准电动势大于2 V。
写出这种电池放电反应的离子方程式。
答案
(10年) 第6 题6-1
B4O5(OH)42 + 3 H2O + 2 H+=4 H3BO3写B4O72-配平的方程式也得满分。
) 6-2
B(OH)3 + H2O =B(OH)4+ H+ (1分)
6-6
BH4 + 4 H2O2=B(OH)4 + 4 H2O (2分)。
化学奥赛无机元素化学习题 硼 族 元 素(含答案)

【高中化学奥林匹克竞赛辅导】无机元素化学习题第十一章硼族元素1.下列为有关硼酸的一些反应的图解,试写出其反应方程式,并指出反应条件。
B 2H 6 ?Mg 2B 2O 5·H 2O ?Na 2B 4O 7·10H 2O ?BF 3?H[BF 4] ?H 2SO 4B 2O 3?HBO 2?H 3BO 3?BPO 4 CH2-HO -CB -CH 2-O2.(1)3.B 2H 64.为什么5.6.硼酸H 37.×10-10)8.9.10.11.12.已知-1672(1)(2)若用(3)13.,如何解释?14.为什么不能制得TlI 3和Tl 2S 3?15.虽然TlI 与KI 是同晶型的,但为什么TlI 不溶于水?16.铊的化学性质,在某些方面相似于铝,在一些方面相似于IA 金属,试用化学事实来说明上述叙述。
17.今有K 2SO 4、Pb(NO 3)2、SnC12、SbC13、A12(SO 4)3和Bi(NO 3)3等六瓶溶液,如何用最方便的化学方法来区别它们?写出现象及有关离于方程式。
18.一单质A 难溶于浓硝酸,与NaOH 溶液作用放出气体B ,得到溶液C ,C 用盐酸酸化后得到白色沉淀D ,D 溶于过量的盐酸,若将A 与盐酸反应也能放出气体B ,同时生成溶液E ,用NaOH 将E 小心碱化,也能得到沉淀D ,D 溶于过量的NaOH ,如果在E 中加入Na 2CO 3或(NH 4)2S 也能得到沉淀D ,问A ?E 各是何物?写出有关反应式。
19.已知气态化合物(HNBCl)3(环状)的?H ?f =-1012kJ ?mol -1,气态单原子的B 、Cl 、N 和H 的标准生成焓分别为590kJ ?mol -1,122kJ ?mol -1,472kJ ?mol -1和218kJ ?mol -1,E (B-Cl)=456kJ ?mol -1,E (N-H)=390kJ ?mol -1,试计算此化合物中E (B-N)值。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【高中化学奥林匹克竞赛辅导】无机元素化学习题第十一章硼族元素1. 下列为有关硼酸的一些反应的图解,试写出其反应方程式,并指出反应条件。
B2H6↑Mg2B2O5·H2O→Na2B4O7·10H2O→BF3→H[BF4]↓H2SO4B2O3←HBO2←H3BO3→BPO4CH2-O (CH3)3BO3HO-C B-OHCH2-O2. 试解释下列各术语:(1)缺电子化合物(2)三中心键3. B2H6的结构怎样?此分子中呈现出什么类型的键?4. 为什么BN和BP都能形成石墨型的结构?5. 硼酸晶体为什么呈鳞片状?晶体中硼酸分子是怎样结合在一起的?6. 硼酸H3BO3有没有象磷酸那样的碱式盐?为什么?7. 用盐酸可以溶解难溶的碳酸盐(如碳酸钙),但如用醋酸(K=1.8×10-5)或硼酸(K=7.8×10-10)能溶解碳酸钙吗?为什么?8. 在焊接金属时,使用硼砂的原理是什么?用反应方程式表示硼砂和下列各氧化物共熔时所发生的化学反应:CaO,Fe2O3,NiO。
9. 为什么不能用AlC13·6H2O加热脱水制备无水的AlCl3?10. 铝与硫混合,当加热时会剧烈的反应,生成硫化铝,但是此硫化铝不能从混有铝离子和硫离子的溶液中得到,如何解释?写出硫化铝与水的化学反应方程式。
11. 按金属的电极电位,铝的还原性远大于氢,但它不能将水中的H+还原为H2,可是在氢离子浓度比水小得多的碱性溶液中,铝反而可以容易地取代出氢气来,为什么?12. 已知A12O3(s),Fe2O3(s),MnO2(s)和MgO(s)的标准生成焓分别为:-1672,-823.5,-518.3,-601.9kJ⋅mol-1(1) 试求生成1mol铁,铝热剂反应的热效应?(2) 若用MnO2来代替Fe2O3,要得到lmol Mn反应的热效应如何?(3) 如果用MgO来代替Fe2O3,此反应是放热还是吸热,Al能否把MgO还原到Mg?13. 铟能显示+l和+3价态,但没有+2价态,但是它的氯化物中有一种分子式为InCl2,如何解释?14. 为什么不能制得TlI3和Tl2S3?15. 虽然TlI与KI是同晶型的,但为什么TlI不溶于水?16. 铊的化学性质,在某些方面相似于铝,在一些方面相似于IA金属,试用化学事实来说明上述叙述。
17. 今有K2SO4、Pb(NO3)2、SnC12、SbC13、A12(SO4)3和Bi(NO3)3等六瓶溶液,如何用最方便的化学方法来区别它们?写出现象及有关离于方程式。
18. 一单质A难溶于浓硝酸,与NaOH溶液作用放出气体B,得到溶液C,C用盐酸酸化后得到白色沉淀D,D溶于过量的盐酸,若将A与盐酸反应也能放出气体B,同时生成溶液E,用NaOH将E小心碱化,也能得到沉淀D,D溶于过量的NaOH,如果在E中加入Na2CO3或(NH4)2S也能得到沉淀D,问A→E各是何物?写出有关反应式。
19. 已知气态化合物( HNBCl )3(环状)的∆Hөf =-1012kJ⋅mol-1,气态单原子的B、Cl、N和H的标准生成焓分别为590kJ⋅mol-1,122kJ⋅mol-1,472kJ⋅mol-1和218kJ⋅mol-1,E(B-Cl)=456kJ⋅mol-1,E(N-H)=390kJ⋅mol-1,试计算此化合物中E(B-N)值。
20. 分离下列各组离子并恢复到原来离子状态:(1) Ba2+、Al3+和Fe3+(2) Mg2+、Al3+和Zn2+(3) Al3+、Pb2+和Bi3+21. 计算:(1) Al3+完全沉淀为A1(OH)3时,溶液的pH值;(2) 10mmol A1(OH)3为20cm3NaOH溶液完全溶解时,溶液的最低pH值和所用NaOH 溶液的最低浓度为多少?(不考虑偏铝酸根水解)22. 写出下列各反应的化学方程式:(1)固体Na2CO3和Al2O3一起熔烧,然后放入水中;(2) NaAlO2溶液中加NH4Cl溶液;(3) BF3通入Na2CO3溶液;(4)向硼砂溶液中加入浓硫酸。
23. 下列化学反应方程式均与事实不符,请说明原因并改正:(1) H3BO3+NH3⋅H2O=NH4BO2+2H2O(2) AlC13⋅6H2O=AlC13+6H2O↑(3) 2TlC13+3Na2S=Tl2S3↓+6NaCl(4) T12O3+3H2SO4=Tl2(SO4)3十3H2O24. 试写出B2Cl4和B4C14的结构式25. 试写出下列各盐中阴离于的结构式并指出阴离子的负电荷数与什么因素有关?(1) K3B3O6(环状阴离子)(3) CaB2O4(链状阴离子)(3) KB5O8⋅4H2O (4) Na2B4O7⋅10H2O26. 给出三种硼氢化合物的溶沸点:NaBH4 Be(BH4)2 Al(BH4)3 熔点(℃)505 123 -64.5沸点(℃)—在1atm下91.3℃升华44.5(1) 讨论存在于这些硼氢化合物中的键型(2) 推测LiBH4和Al(BH4)3的结构式答案1. Mg 2B 2O 5·H 2O (7)−−→Na 2B 4O 7·10H 2O (8)−−→BF 3(10)−−→H[BF 4] (6) (9)B 2O 3(5)←−−HBO 2(4)←−−H 3BO 3(1)−−→BPO 4 B 2H 6(3) (2)CH 2-O (CH 3)3BO 3 HO -C B -OH CH 2-O (1) H 3BO 3 + HPO 3HAc(浓)BO(PO 3) (2) 3CH 3OH + B(OH)3(CH 3)3BO 3 + 3H 2O(3) + B(OH)3(4) H 3BO 3100℃HBO 2 + H 2O(5) 4HBO 2140-160℃H 2B 4O 7 + H 2O H 2B 4O 7△2B 2O 3 + H 2O(6) Mg 2B 2O 5·H 2O + 2H 2SO 42MgSO 4 + 2B(OH)3(7) 2Mg 2B 2O 5·H 2O + 4NaOH + CO 2 + 10H 2ONa 2B 4O 5(OH)4·8H 2O + Na 2CO 3 + 4Mg(OH)2(8) Na 2B 4O 7·10H 2O + 12HF Na 2O(BF 3)4 + 6H 2O Na 2O(BF 3)4 + 2H 2SO 44BF 3 + 2NaHSO 4 + H 2O (9) BF 3 + HF H[BF 4] (10) 4BF 3 + 3LiAlH 42B 2H 6 + 3LiF2. (1)缺电子化合物:对于IIIA 族元素,形成+3氧化态的共价化合物时,原子的外层电子结构为(n s)2(n p x )2(n p y )2(n p z )0,即为6电子结构,如BF 3、AlCl 3等,有一个空的n p z 轨道,象这样的共价化合物称为缺电子化合物。
(2)三中心键:a. 3c -2e 键:例如 中的氢桥键,是两个B 原子的sp 3杂化轨道与H 原子的1s 轨道重叠,形成3c -2e 键。
b. 3c -4e 键:如XeF 2中Xe 与2个F 原子形成(σ)2(σnon )2(σ*)0的超共价键。
c. 三中心离域π键:例如CO 2中有两个43∏。
3. B 2H 6的结构式为 ,B 原子采取sp 3杂化,分子中有B -H σ键和氢桥键。
4. ∵BN 和BP 都可以看作C 2的等电子体,∴B 原子、N 原子、P 原子都可以采取sp 2杂化,形成层状结构,N 原子、P 原子上的孤电子对占有B 原子的2p 空轨道,形成π键,该π电子与石墨中的π电子不同,不是离域的,∴BN 、BP 不导电。
5. 硼酸晶体形成鳞片状是由于H 3BO 3中的B 原子采取sp 2杂化,每个B 原子与三个氧原子连接,∠OBO =120o ,每个氧原子与另一个H 3BO 3中的H 原子以氢键连接起来,成为片状CH 2OHCHOH CH 2OHCH 2OHO C B(OH) CH 2O结构。
晶体中的硼酸分子是用氢键和分子间的作用力结合在一起的。
6. 硼酸没有象磷酸那样的酸式盐,∵硼酸为一元弱酸,H3BO3 + H2O B(OH)4-+ H+,∴NaOH + H3BO3NaB(OH)4 + H2O,即硼酸与碱只形成正盐而不形成酸式盐。
7. 由于盐酸和醋酸的酸性强于碳酸,∴它们能把碳酸盐中的H2CO3置换出来,但硼酸的酸性弱于H2CO3,不能置换出H2CO3,故不能溶解难溶的碳酸盐。
8.硼砂在高温情况下可以熔解金属表面的氧化物,以清洗金属的表面:Na2B4O7 + CuO共熔Cu(BO2)2·2NaBO2Na2B4O7 + NiO共熔Ni(BO2)2·2NaBO23Na2B4O7 + Fe2O32Fe(BO2)3·6NaBO29. AlC13·6H2O加热时会发生水解:2[AlC13·6H2O](s)Al2O3(s) + 6HCl(g) + 9H2O(g),∴不能用AlC13·6H2O加热脱水制备无水AlCl3。
10. Al2S3一遇水会发生强烈水解,∴当Al3+与S2-离子在溶液中相遇时发生双水解,分别生成Al(OH)3和H2S,而不能获得Al2S3。
Al2S3 + 6H2O2Al(OH)3 + 3H2S↑11. 通常情况下,铝表面有一层致密的氧化层,阻碍金属铝与水的反应,而在碱溶液中,此层氧化膜可溶于碱,然后Al与H2O反应,很容易取代出氢气来。
12. (1) -423.84 kJ⋅mol-1;(2) -596.64 kJ⋅mol-1;(3) + 44.77 kJ⋅mol-1,此反应是吸热反应,且Δr S m →0,∴Al不能把MgO还原到Mg。
13. 铟的氯化物中有一种分子式为InCl2,其实质为2InCl2−−→In(I)[In(III)Cl4],∴InCl2中含有In(I)和In(III)的混合氯化物。
14. Tl的原子核外电子构型为[Xe]4f145d106s26p1,∴形成Tl(III)不仅失去6p1上一个电子,还失去6s2上2个电子,6s2是惰性电子对,失去它需要很高的能量,∴Tl(III)不稳定,是强氧化剂,而I-、S2-都是还原剂,它们之间发生氧化还原反应,生成TlI、Tl2S而不能制得TlI 和Tl2S3。
15. 虽然TlI与KI是同晶型,Tl+和K+有类似的离子半径,预期TlI和KI有相近的水合能和溶解熵,但由于Tl+和I-之间的极化和附加极化作用强于K+和I-离子之间的极化和附加极化作用,∴TlI很难以Tl+和I-离子状态溶于水中。
