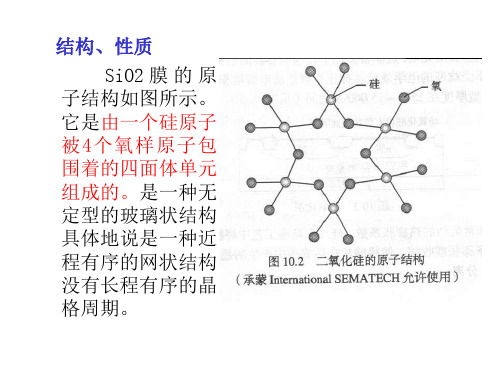
二氧化硅各种转化示意图
集成电路工艺原理 第二章 氧化

氧化杂质 特定的杂质,特别是氯化氢(HCl)中的氯, 若氧化环境中含有氯,它将影响氧化生长速率, 实践证明在有氯化氢的情况下,生长速率可提 高1%~5%。 多晶硅氧化 与单晶硅相比,多晶硅可以更快、更低或 相似,主要取决于多晶硅的生长方法,若用化 化 学气相淀积法生长多晶硅,则与淀积温度、淀 学气相淀积 积压力、掺杂的类型和浓度有关。
快速热氧化 高压 炉管反应炉 化学氧化 阳极氧化 电解槽
化学的
2.4 水平炉管反应炉 最早使用也一直延续至今。主要用在氧化、扩 散、热处理及各 装载区 源区 中央区 种淀积工艺中。 水平炉管反应炉 消声器 的截面图如下: 氧化 炉管 整个系统包含 反应室、 反应室、温度 控制系统、 控制系统、反 比例 控制器 应炉、 应炉、气体柜 清洗站、 、清洗站、装 平区 片站等 片站 温度
进入或落在硅片表面,在氧化过程中, 污染 物在表面形成新的氧化层,是污染物远离了电 子活性的硅表面。也就是说污 染物被禁锢在二氧化硅 膜中,从而减小了污染 物对器件的影响。 2.1.2 掺杂阻挡层 器件制造过程中的掺杂是定域(有选择的 区域)掺杂,那么不需要 掺杂的区域就必须进行 保护而不被掺杂。如图 所示。
第二章 氧 化
概述 硅表面SiO2的简单实现,是硅材料被广泛 应用的一个重要因素。本章中,将介绍SiO2的 生长工艺及用途、氧化反应的不同方法,其中 包括快速热氧化工艺。另外,还简单介绍本工 艺中最重要的部分---反应炉,因为它是氧化、 扩散、热处理及化学气相淀积反应的基本设备。 2.1 二氧化硅的性质、用途 二氧化硅的性质、 在半导体材料硅的所有优点当中,SiO2 的极 易生成是最大的有点之一。当硅表面暴露在氧 气当中时,就会形成SiO2。(有良好的化学稳定 性和电绝缘性,能对某些杂质起到掩蔽作用)
二氧化硅 PPT

服务特 权
共享文档下载特权
VIP用户有效期内可使用共享文档下载特权下载任意下载券标价的文档(不含付费文档和VIP专享文档),每下载一篇共享文
档消耗一个共享文档下载特权。
年VIP
月VIP
连续包月VIP
享受100次共享文档下载特权,一次 发放,全年内有效
赠每的送次VI的发P类共放型的享决特文定权档。有下效载期特为权1自个V月IP,生发效放起数每量月由发您放购一买次,赠 V不 我I送 清 的P生每 零 设效月 。 置起1自 随5每动 时次月续 取共发费 消享放, 。文一前档次往下,我载随时随地彰显尊贵身份。
专属客服
VIP专属客服,第一时间解决你的问题。专属客服QQ:800049878
路漫部权益:1.海量精选书免费读2.热门好书抢先看3.独家精品资源4.VIP专属身份标识5.全站去广告6.名
VIP有效期内享有搜索结果页以及文档阅读页免广告特权,清爽阅读没有阻碍。
知识影响格局,格局决定命运! 多端互通
抽奖特权
VIP有效期内可以无限制将选中的文档内容一键发送到手机,轻松实现多端同步。 开通VIP后可以在VIP福利专区不定期抽奖,千万奖池送不停!
福利特权
开通VIP后可在VIP福利专区定期领取多种福利礼券。
服务特 权
共享文档下载特权
VIP用户有效期内可使用共享文档下载特权下载任意下载券标价的文档(不含付费文档和VIP专享文档),每下载一篇共享文
档消耗一个共享文档下载特权。
年VIP
月VIP
连续包月VIP
享受100次共享文档下载特权,一次 发放,全年内有效
赠每的送次VI的发P类共放型的享决特文定权档。有下效载期特为权1自个V月IP,生发效放起数每量月由发您放购一买次,赠 V不 我I送 清 的P生每 零 设效月 。 置起1自 随5每动 时次月共续 取发享费 消放文, 。一档前次下往,载我持特的续权账有,号效-自
高一化学必修一 二氧化硅和硅酸精品PPT课件

三、硅酸
1物理性质 _____难__溶______于水的白色胶状物质。 2 化学性质 (1)弱酸性: 向Na2SiO3溶液中通入CO2,反应的化学方程式为
. Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3
结论:H2SiO3酸性比H2CO3酸性 弱.
(2)不稳定性 H2SiO3受热易分解,反应方程式为 H2SiO3==△===SiO2+H2O .
偶尔来给自己一点喘息的余地和放松的空间吧,只为回归纯粹。 于是,我选择了一个周五的傍晚,住进了“花筑”民宿,来到了位于迪士尼周边2km的小镇。
算是给自己放一个小假,只为圆一场童话梦。 穿梭回到童年,就为简单、不知所谓的快乐一番。
我选择了一家名叫“花筑“的客栈,热情友善体贴的老板会在上海地铁11号线的终点站迪士尼和客栈之间,往返接送你的整个行程。
• A.①②③④⑤
B.②③④
• C.②④⑤
D.①②④
3、A、B、C、D、E代表单质或化合物,它们之间的 相互转换关系如图所示.A为地壳中含量仅次于氧 的非金属元素的单质.
• 请填空:
• (1)形成单质A的原子
• 的结构示意图为________, • 它的最高化合价为__+.4 • (2)B的化学式(分子式)为__S_i_O_2___.
从这个意义上讲,距离就等于理解,就是温情,就是关心。 带着对自己思考后肯定的回答,我安稳的睡去。
当心平和了,睡眠也就踏实了,也就能为第二天的童话镇“漫游”提供力量了。
第二天早八点,民宿老板娘准时敲门,在简单收拾过后,就出发前往迪士尼乐园了。
迪士尼乐园,在这片最神奇而真实的土地上,总有一些属于你自己的magic moment,我们虽然知道它不是生活的避难所,但总还是想让这份美好永驻。
二氧化硅的性质
经常采用方法。因为温度越高时间越长越会引起其
它负面影响,比如,晶园表面层中“错位”和温
度及高温下的时间密
不锈钢套
石英 反应 管
切相关,而这种错位
对器件特性是很不利 高压惰性气体 的。高温氧化系统如 高压氧化气体
图所示。
和普通水平反应炉相似,不同的是炉管 是密封的,氧化剂被用10~25倍大气压的压力 泵入炉管。在这种压力下,氧化温度可降到 300~700℃而又能保证正常的氧化速率。在这 种温度下晶园的错位生长可降到最小。
不均匀的氧化率及氧化步骤
经过一些制作工艺后,晶园表面的条件会 有所不同,有的是场氧化区,有些是掺杂区, 有些是多晶硅区等等。每个区上面氧化层厚度 不同,氧化层厚度的不同被称为不均匀氧化。
不同的氧化率导致了在晶
园表面形成台阶(见图) 。
硅晶片
图中显示的是与比较厚的
再氧化之前
场氧化区相邻的氧化区形
(a)
7.2.1 影响氧化速率的 因素
晶格方向
因为不同晶向其
原子密度不同,所以
在相同的温度、氧化
气压等条件下,原子
密度大的晶面,氧化
生长速率要大,而且 在低温时的线性阶段
1000 û C
更为明显。如图所示。10
<111> 硅 <100> 硅
11120000
û û
C C
900 û C 800 û C 700 û C
成了一个台阶,在暴露区
台阶
的氧化反应较快。
硅晶片
再氧化之后 (b)
7.3 热氧化方法
从氧化反应方程式可以看出,氧和硅的反应 似乎很简单,但是要达到硅技术中的氧化必须 附加条件,那就是加热,给反应过程足够的能 量是其满足要求,所以常称之为热氧化。
二氧化硅课件28页

二氧化硅
透过图片思考: 二氧化硅具有哪些物理性质? 化学稳定性如何? 你的根据是什么? SiO2的这些性质是由什么决定的? 物理性质:
二氧化硅
透过图片思考: 二氧化硅具有哪些物理性质? 化学稳定性如何? 你的根据是什么? SiO2的这些性质是由什么决定的? 物理性质: 难溶于水, 熔点高, 硬度大。
——利用氢氟酸和SiO2 反应的原理
SiO2 + 4HF == SiF4 + 2H2O
作为酸性氧化物的SiO2,氢氟酸( HF)是 唯一可以与之反应的酸。
(五)二氧化硅的用途
由于SiO2具有优良的物理化学性能,加上 SiO2在自然界的广泛O2是由Si原子和O原子以1 2的比例结合形成 的立体网状结构,并不以分子的形式存在。
因为玻璃中含有SiO2,而SiO2可 以跟HF酸发生反应,所以HF酸可 以腐蚀玻璃,从而不可用玻璃来盛 氢氟酸;而用塑料瓶。
(四)化学性质—性质稳定, 不活泼
① 是酸性氧化物
SiO2 + 2NaOH == Na2SiO3 + H2O 高温
SiO2 + CaO === CaSiO3
② 难溶于水,不与水反应
二氧化硅 (SiO2)
硅石
硅矿山
二氧化硅广泛存在 于自然界中, 与其他 矿物共同构成了岩 石。天然二氧化硅 也叫硅石, 是一种坚 硬难熔的固体。
(一)二氧化硅存在形态:
水晶
硅石(12%)
结晶形:石英 无定形:硅藻土
玛瑙 ……
沙子
沙子
玛瑙
沙子 石英
玛瑙
二氧化硅
透过图片思考: 二氧化硅具有哪些物理性质? 化学稳定性如何? 你的根据是什么? SiO2的这些性质是由什么决定的?
SiO2系统晶相图
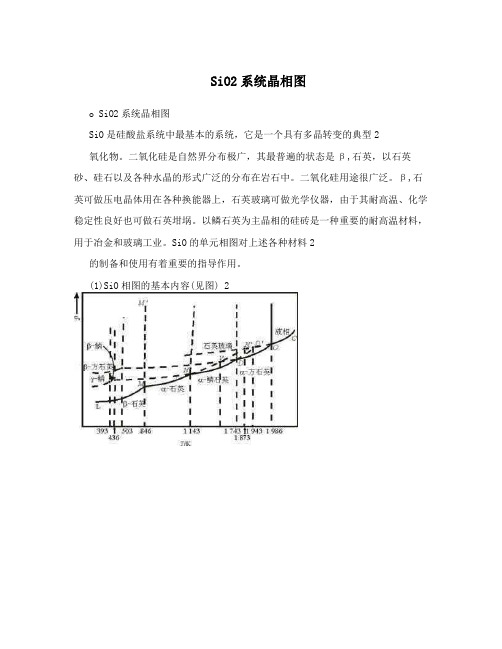
SiO2系统晶相图o SiO2系统晶相图SiO是硅酸盐系统中最基本的系统,它是一个具有多晶转变的典型2氧化物。
二氧化硅是自然界分布极广,其最普遍的状态是β,石英,以石英砂、硅石以及各种水晶的形式广泛的分布在岩石中。
二氧化硅用途很广泛。
β,石英可做压电晶体用在各种换能器上,石英玻璃可做光学仪器,由于其耐高温、化学稳定性良好也可做石英坩埚。
以鳞石英为主晶相的硅砖是一种重要的耐高温材料,用于冶金和玻璃工业。
SiO的单元相图对上述各种材料2的制备和使用有着重要的指导作用。
(1)SiO相图的基本内容(见图) 2SiO2在常压下的相图是由芬奈研究后于1913年发表的。
这个相图所标温度实际都是在101(325kPa下的各转变温度。
也就是说实验工作是在常压下进行的。
各变体的蒸气压极小,压力轴(纵轴)并不表示真正的压力数值,画出来的曲线仅仅表示温度变化时压力变化的趋势。
从图中可知SiO2在常压下当温度变化时可以有七种晶相,一种液相,一种气相。
实线表示稳定状态,虚线表示亚稳状态。
通过基本类型的学习我们可以看出实线代表的变体之间的转变是可逆的,同温度下,虚线代表的变体向实线代表的变体的转变是不可逆的。
相图中表示出α,石英的稳定范围在575,870?之间,故在自然界中是没有α,石英的。
在870?时,在有强的助熔矿化剂存在下,并粉碎成足够的细度,α,石英才转变成α,磷石英。
据实验证明,α,石英的转变并不按相图上的理想状态进行,而是过热到1300,1450?(也认为是1600?)缓慢进行的,而且经过中间相棗偏方石英转变成为α,方石英,虽然在这个温度范围内稳定态是α-鳞石英。
在急速加热石英到稍高于1420?(又说是1600?)时,就可以不转变为其他变体而熔化成粘度很大的液体(在自然界中同样也不存在有α-鳞石英,因为它的稳定范围在870,1470?,在1470?时缓慢转变为α,方石英,而在冷却时,它转变成β,鳞石英,接着迅速地转变为γ,鳞石英。
二氧化硅简介演示

化学性质
酸性氧化物:二氧化硅是一种酸性氧化物,在一 定条件下可以与碱反应生成盐和水。这个性质在 化学实验和工业生产中都有广泛应用。
水解反应:二氧化硅在潮湿环境中可发生水解反 应,生成硅酸(H4SiO4)和氢气(H2)。这个 性质使得二氧化硅在某些地质环境中具有重要意 义,如硅藻土的形成。
稳定性:二氧化硅在常温下化学性质相对稳定, 不易与其他物质发生反应。但在高温条件下,它 可能与某些氧化物、酸等物质发生反应。
通过以上针对二氧化硅的安 全与环保问题的详细介绍和 相应措施,我们可以更全面 地了解和应对与二氧化硅相 关的问题,确保人类和环境 的安全。
06 结论与展望
二氧化硅的重要性总结
工业原料
二氧化硅是许多重要工业产品的 关键原料,如玻璃、陶瓷、水泥 等,对于推动工业发展具有重要
作用。
电子产品
在电子产品中,二氧化硅作为半 导体材料广泛应用于集成电路、 晶体管、太阳能电池等领域,是
高纯度的二氧化硅可用于制造半导体 材料,如集成电路、晶体管等,其优 异的绝缘性能和稳定性是电子工业的 重要基础材料。
光导纤维
二氧化硅光导纤维是通信领域的重要 基础材料,具有传输损耗小、带宽大 、抗干扰能力强等优点,广泛应用于 现代通信网络中。
在陶瓷和玻璃工业的应用
陶瓷原料
二氧化硅作为陶瓷原料,可以降低陶瓷的烧结温度、提高陶瓷的硬度、耐磨性和耐腐蚀性。
THANKS FOR WATCHING
感谢您的观看
通过以上物理和化学性质的介绍,我们可以看出 二氧化硅是一种非常重要和多功能的化合物,在 各个领域都有广泛应用。
03 二氧化硅的生产和制备方 法
天然提取法
石英砂提取
二氧化硅可以从天然石英砂中提取。通过破碎、研磨、洗涤 等步骤,可以得到不同纯度的二氧化硅产品。这种方法原料 丰富,成本较低,但纯度可能受到原料中杂质的影响。
6.2.3 SiO2系统相图

160℃
268℃
加热 急冷
位
β-石英
β鳞石英
β方石英
石英玻璃
移 型
117℃
转
变
γ鳞石英
有缘学习更多驾卫星ygd3076或关注桃报:奉献教育(店铺)
变体之间的转变
转变类型 结构变化 体积变化
转变速度
对生产影响
重建型转变 高温型
石英、鳞石英、方石英和熔体间
大 大 慢
表面逐渐向内部进行 介稳态在常温下存在
使用时
烤窑过程
120℃、163℃、230℃、573℃ 注意缓慢进行。 573℃以后可加快升温速度。
温度范围
870~1430℃ 范围内较适宜
大
位移型转变 高低温型
同系列中α、β、γ间
小 小
快
全部晶体内发生
不大
多晶转变时的体积效应在材料制备和使用中需特别注意。
SiO2系统相图
平衡状态下
6个单相区 9个二相平衡状态
3条晶型转变线 4个三相点
一级变体间的转变(石英、方石英、鳞石英) 二级变体间的转变(α、β、γ)
பைடு நூலகம்
介稳状态下
<573℃,β石英 573℃,β石英→α石英
材料科学基础
第6 章
化学必修一元素转换关系图

高中化学必修一元素转换关系图1、钠及其化合物的转化关系①Na 2O +2HCl=2NaCl +H 2O ②2Na +2HCl=2NaCl +H 2↑Na 2O +2H +=2Na ++H 2O 2Na +2H +=2Na ++H 2↑ ③2Na 2O 2+4HCl=4NaCl +O 2↑+2H 2O ④4Na +O 2=2Na 2O2Na 2O 2+4H +=4Na ++O 2↑+2H 2O ※⑥2Na +2H 2O=2NaOH +H 2↑ ※⑤2Na +O 2△Na 2O 2 2Na +2H 2O=2Na ++2OH -+H 2↑⑦Na 2O +H 2O=2NaOH ※⑧2Na 2O 2+2H 2O=4NaOH +O 2↑Na 2O +H 2O=2Na ++2OH - 2Na 2O 2+2H 2O=4Na ++4OH -+O 2↑ ⑨Na 2O +CO 2=Na 2CO 3 ※⑩2Na 2O 2+2CO 2=2Na 2CO 3+O 2⑾2NaOH +CO 2=Na 2CO 3+H 2O ⑿Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH2OH -+CO 2=CO 32-+H 2O CO 32-+Ca 2+=CaCO 3↓⒀NaOH +CO 2=NaHCO 3 ※⒁Na 2CO 3+H 2O +CO 2=2NaHCO 3OH -+CO 2=HCO 3- CO 32-+H 2O +CO 2=2HCO 3-※⒂2NaHCO 3△Na 2CO 3+H 2O +CO 2↑ 或 ※NaHCO 3+NaOH=Na 2CO 3+H 2OHCO 3-+OH -=CO 32-+H 2O⒃Na 2CO 3+2HCl=2NaCl +H 2O +CO 2↑ ⒄NaHCO 3+HCl=NaCl +H 2O +CO 2↑CO 32-+2H +=H 2O +CO 2↑ HCO 3-+H +=H 2O +CO 2↑补充:①石灰水中加入少量NaHCO 3 : Ca(OH)2+NaHCO 3=CaCO 3↓+NaOH +H 2OCa 2++OH -+HCO 3-=CaCO 3↓+H 2O②石灰水中加入过量NaHCO 3 : Ca(OH)2+2NaHCO 3=CaCO 3↓+Na 2CO 3+2H 2OCa 2++2OH -+2HCO 3-=CaCO 3↓+CO 32-+2H 2O 2、铝及其化合物的转化关系NaCl Na NaOH Na 2CO 3 NaHCO 3 NaCl Na 2O Na 2O 2 ① ② ③ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑾ ⑿ ⒀ ⒁ ⒂⒃ ⒄ ④ Al Al 2O 3 A l (O H )3 KAl(SO 4)2 AlCl 3① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑾⑿①2Al +6HCl=2AlCl 3+3H 2↑ ②4Al +3O 2△2Al 2O 32Al +6H +=2Al 3++3H 2↑※③2Al +2NaOH +2H 2O=2NaAlO 2+3H 2↑ ④Al 2O 3+6HCl=2AlCl 3+3H 2O2Al +2OH -+2H 2O=2AlO 2-+3H 2↑ Al 2O 3+6H +=2Al 3++3H 2O ※⑤Al 2O 3+2NaOH=2NaAlO 2+H 2O ⑥AlCl 3+3NH 3·H 2O=Al(OH)3↓+3NH 4ClAl 2O 3+2OH -=2AlO 2-+H 2O Al 3++3NH 3·H 2O = Al(OH)3↓+3NH 4+⑦Al(OH)3+3HCl=AlCl 3+3H 2O ⑧2Al(OH)3△Al 2O 3+3H 2OAl(OH)3+3H +=Al 3++3H 2O☆⑨NaAlO 2+HCl +H 2O =Al(OH)3↓+NaCl 或NaAlO 2+2H 2O +CO 2=Al(OH)3↓+NaHCO 3AlO 2-+H ++H 2O=Al(OH)3↓ AlO 2-+2H 2O +CO 2=Al(OH)3↓+HCO 3-※⑩Al(OH)3+NaOH = NaAlO 2+2H 2O ☆⑾Al 3++3H 2O Al(OH)3胶体+3H +Al(OH)3+OH -= AlO 2-+2H 2O 明矾净水⑿AlCl 3+4NaOH = NaAlO 2+3NaCl +2H 2O Al 3++4OH -= AlO 2-+2H 2O 3、铁及其化合物的转化关系①Fe 3O 4+4CO△3Fe +4CO 2 ※② 3Fe +4H 2O(g)高温Fe 3O 4+4H 2 ③ Fe +2HCl=FeCl 2+H 2↑ 或3Fe +2O 2点燃Fe 3O 4Fe +2H +=Fe 2++H 2↑ ④2Fe +3Cl 2点燃2FeCl 3※⑤2FeCl 2+Cl 2 = 2FeCl 3 ※⑥Fe +2FeCl 3 = 3FeCl 22Fe 2++Cl 2 = 2Fe 3++2Cl - Fe +2Fe 3+= 3Fe 2+⑦FeCl 2+2NaOH = Fe(OH)2↓+2NaCl ⑧Fe(OH)2+2HCl = FeCl 2+2H 2OFe 2++2OH -= Fe(OH)2↓ Fe(OH)2+2H += Fe 2++2H 2O※⑨4Fe(OH)2+O 2+2H 2O = 4Fe(OH)3 ⑩FeCl 3+3NaOH = Fe(OH)3↓+3NaCl白色沉淀迅速变成灰绿色,最后变成红褐色 Fe 3++3OH -= Fe(OH)3↓⑾Fe(OH)3+3HCl = FeCl 3+3H 2O Fe 3++3H 2O Fe(OH)3胶体+3H +(净水) Fe(OH)3+3H += Fe 3++3H 2O ⑿2Fe(OH)3△Fe 2O 3+3H 2O⒀Fe 2O 3+6HCl = 2FeCl 3+3H 2O ※⒁FeCl 3+3KSCN = Fe(SCN)3+3KClFe 2O 3+6H += 2Fe 3++3H 2O Fe 3++3SCN -= Fe(SCN)3Fe 3O 4 Fe FeCl 2 Fe(OH)2 Fe(SCN)3 FeCl 3 Fe(OH)3 Fe O 3 ①② ③ ④⑤ ⑥ ⑦ ⑧ ⑨⑩ ⑾⑿ ⒁ ⒀①Si +O 2△SiO 2②SiO 2+2C 高温 Si +2CO ↑※③SiO 2+4HF = SiF 4↑+2H 2O (刻蚀玻璃)④Si +4HF = SiF 4↑+2H 2↑ ⑤SiO 2+CaO高温CaSiO 3※⑥SiO 2+2NaOH = Na 2SiO 3+H 2O SiO 2+CaCO 3高温CaSiO 3+CO 2↑SiO 2+2OH -= SiO 32-+H 2O ※⑦Na 2SiO 3+2HCl = H 2SiO 3↓+2NaCl SiO 2+Na 2CO 3高温Na 2SiO 3+CO 2↑ SiO 32-+2H += H 2SiO 3↓※⑦Na 2SiO 3+H 2O +CO 2=H 2SiO 3↓+Na 2CO 3或Na 2SiO 3+2H 2O +2CO 2=H 2SiO 3↓+2NaHCO 3SiO 32-+H 2O +CO 2=H 2SiO 3↓+CO 32-或SiO 32-+2H 2O +2CO 2=H 2SiO 3↓+2HCO 3-⑧H 2SiO 3+2NaOH = Na 2SiO 3+2H 2O ⑨H 2SiO 3 △H 2O +SiO 2H 2SiO 3+2OH -= SiO 32-+2H 2O 5、氯及其化合物的转化关系①2Fe +3Cl 2 点燃2FeCl 3 ②Cu +Cl 2 点燃CuCl 2 ③2FeCl 3+Cu = 2FeCl 2+CuCl 22Fe 3++Cu = 2Fe 2++Cu 2+④H 2+Cl 2 2HCl※⑤MnO 2+4HCl(浓) △MnCl 2+Cl 2↑+2H 2OMnO 2+4H ++2Cl - △ Mn 2++Cl 2↑+2H 2O ※⑥Cl 2+H 2O = HCl +HClO ※⑦2HClO 2HCl +O 2↑Cl 2+H 2O = H ++Cl -+HClO 2HClO 2H ++2Cl -+O 2↑※⑧Cl 2+2NaOH = NaCl +NaClO +H 2O ※⑨2Cl 2+2Ca(OH)2 = CaCl 2+Ca(ClO)2+2H 2OCl 2+2OH -= Cl -+ClO -+H 2O 工业制漂白粉※⑩Ca(ClO)2+H 2O +CO 2 = CaCO 3↓+2HClO 或Ca(ClO)2+2HCl = CaCl 2+2HClOCa 2++2ClO -+H 2O +CO 2= CaCO 3↓+2HClO 或ClO -+H += HClO 漂白粉的漂白原理向漂白粉溶液中通入过量的CO 2:Ca(ClO)2+2H 2O +2CO 2 = Ca(HCO 3)2+2HClOClO -+H 2O +CO 2 = HCO 3-+HClONa 2SiO 3 SiF 4 Si SiO 2 H 2SiO 3 CaSiO 3 ①②③ ④ ⑤⑥ ⑦ ⑧⑨ CuCl 2 HClO HCl Cl 2 FeCl 3NaClO Ca(ClO)2① ② ③ ④⑤ ⑥ ⑦ ⑧ ⑨ ⑩ 点燃或光照 光照光照①S +O 2 点燃SO 2②2H 2S +SO 2=3S +2H 2O※③SO 2+O 2 催化剂加热 2SO 3 ④SO 3+H 2O = H 2SO 4 ⑤SO 2+CaO△CaSO 3 或 SO 2+Ca(OH)2 = CaSO 3↓+H 2O⑥SO 3+CaO = CaSO 4 SO 2+Ca 2++2OH -=CaSO 3↓+H 2O SO 3+Ca(OH)2 = CaSO 4+H 2O ⑦2CaSO 3+O 2△2CaSO 4※⑧SO 2+Cl 2+2H 2O = H 2SO 4+2HCl ※⑨Cu +2H 2SO 4(浓) △CuSO 4+SO 2↑+2H 2OSO 2+Cl 2+2H 2O = 4H ++SO 42-+2Cl -Cu +2H 2SO 4(浓) △Cu 2++SO 42-+SO 2↑+2H 2O※⑩C +2H 2SO 4(浓)△CO 2↑+2SO 2↑+2H 2O7、氮及其化合物的转化关系 ※①N 2+O 22NO※②2NO +O 2 = 2NO 2※③3NO 2+H 2O = 2HNO 3+NO 3NO 2+H 2O =2H ++2NO 3-+NO以上三个反应为“雷雨发庄稼”原理 扩展反应有:4NO 2+O 2+2H 2O = 4HNO 3 4NO +3O 2+2H 2O = 4HNO 3 ※④Cu +4HNO 3(浓) = Cu(NO 3)2+2NO 2↑+2H 2O 上面两个反应主要用于气体溶于水时的计算Cu +4H ++2NO 3-=Cu 2++2NO 2↑+2H 2O 或 4HNO 3 4NO 2↑+ O 2↑+ 2H 2OC +4HNO 3(浓)△CO 2↑+2NO 2↑+2H 2O 浓硝酸见光易变黄的原因※⑤3Cu +8HNO 3(稀) = 3Cu(NO 3)2+2NO ↑+4H 2O ⑥N 2+3H 2催化剂 高温高压2NH 33Cu +8H ++2NO 3-=3Cu 2++2NO ↑+4H 2O 合成氨反应是人工固氮的主要途径 ⑦NH 3+HCl = NH 4Cl ⑧NH 4Cl△NH 3↑+HCl ↑NH 3+H += NH 4+(水溶液中) 补充:NH 4HCO 3 △NH 3↑+H 2O+CO 2↑氨气与酸均能反应生成铵盐,且与挥发性酸 铵盐受热都易分解,但并不是所有的铵盐 (如浓HCl 、浓HNO 3)相遇时空气中有白烟 都分解出氨气,如NH 4NO 3、(NH 4)2SO 4※⑧NH 4Cl +NaOH△NaCl +NH 3↑+H 2O NH 4++OH-△NH 3↑+H 2O所有的铵盐都能与碱作用放出氨气,可利用此反应鉴别铵离子。
常见物质的转化关系网络图

常见物质的转化关系网络图常见物质的转化关系网络图一、钠及其化合物之间的相互转化SO2(20)HCl(13)/Cl2(19) CO2(12)H2O(10) C a(O H)2(11)NaOHH2O(8) H2O(9)O2 (1) O2 (2) CO2(3) CO2(6)Na Na2O Na2O2Na2CO3NaHCO3NaOH/△(7)O2点燃(4)HCl(14) HCl(15)Cl2(17) CO2(5)NaCl电解(18) 先通NH3再通CO2 (16)粗盐提纯(含有泥沙、Ca2+、Mg2+、SO42-)涉及的化学方程式:(1)4Na+O2=2Na2O(白色固体)(2)2Na2O+O2=2Na2O2(淡黄色固体)(3)2Na2O2+2CO2=2Na2CO3+O2(作为潜水艇供氧剂的原理)(4)2Na+O2Na2O2(5)Na2O+ CO2= Na2CO3(6)Na2CO3+CO2+H2O=2NaHCO3(除去NaHCO3溶液中的少量Na2CO3)(7)NaHCO3+NaOH=Na2CO3+H2O(除去Na2CO3溶液中...的少量NaHCO3)2 NaHCO3Na2CO3+ CO2 +H2O(除去Na2CO3固体中...的少量NaHCO3)(俗名:碳酸钠-纯碱碳酸氢钠-小苏打)(8)Na2O+H2O= 2NaOH(9)2Na2O2+2H2O =4NaOH +O2(10)2Na+2H2O=2NaOH+H2 [现象:浮、熔、游、响、红(滴加酚酞的溶液)] (11)Na2CO3+C a(O H)2=CaCO3 +2NaOH (土法炼碱原理)(12) 2NaOH+CO2(少量)= Na2CO3+H2O(13) NaOH+HCl=NaCl+H2O(14) Na2CO3+2HC l(足量)=2NaCl+CO2 +H2O 可用互相滴加的方法鉴别(15) NaHCO3+HCl(少量)=NaCl+CO2 +H2O 盐酸和碳酸钠溶液(16)NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3(2 NaHCO3Na2CO3+ CO2 +H2O )(侯氏制碱法原理)(17)2Na+Cl22NaCl(现象:白烟)(18) 2NaCl(熔融)2Na+Cl2 (工业制金属钠的方法)(19)Cl2+2NaOH=NaCl+NaClO+H2O(氯气的尾气处理原理)(20) SO2+2NaOH=Na2SO3+H2O(二氧化硫尾气的处理原理)二、镁及其化合物之间的转化(6)CO2MgO(5)O2(7)HCl (8)△(10)N2 (1)HCl (3) Ca(OH)2Mg3N2Mg MgCl2Mg(OH)2(11)H2O (2)通电(4)HCl(9)H2O、△涉及的化学方程式:(1)Mg+2HCl=MgCl2+H2 (典型的放热反应)(2) MgCl2Mg+Cl2 (工业上制取金属镁的方法)(3)MgCl2+Ca(OH)2=Mg(OH)2 +CaCl2(从海水中提取镁的第一步反应)(4) Mg(OH)2 +2HCl= MgCl2+2H2O(5) 2Mg+O22MgO(现象:耀眼的白光用途:提供光照条件)(6) 2Mg+CO22MgO+C(说明二氧化碳也可以支持燃烧)(7) MgO+2HCl=MgCl2+H2O(8) Mg(OH)2MgO+H2O(9) Mg+2H2O Mg(OH)2 +H2(2Na+2H2O=2NaOH+H2 剧烈反应Al+H2O不反应,利用三者与水反应的差异比较金属性强弱)(10) 3Mg+N2Mg3N2(说明氮气也可以支持燃烧)(11) Mg3N2+6H2O=3Mg(OH)2 +2NH3三、硫及其化合物之间的相互转化(16)O2(13)SO2Na2SO43(12) NaOH (5)O2 (6)H2OSO3(1)H2(2)O2(9)Na2SO3H2S S SO2H2SO4(3)O2(10)Cu(11)C(14)CaO H2SO3(19)H2SO4(18)Fe (17)Hg (18)O2CaCO3 (7)H2O (8)O2(15)O2CaSO423涉及到的化学方程式(1)S+H2H2S(2)S+O2SO2(现象:空气中-淡蓝色火焰;纯氧中-蓝紫色火焰) (3)2H2S+O2(不足) 2S+2H2O(4)2H2S+SO2=3S +2H2O(体现二氧化硫氧化性的)(5)2SO2+O22SO3(空气中催化剂可以为灰尘,工业上采用V2O5作为催化剂)(6)SO3+H2O=H2SO4(7)SO2+H2O=H2SO3 酸雨形成的两条途径(8)H2SO3+O2= H2SO4(9)Na2SO3+H2SO4Na2SO4+SO2 +H2O(实验室制SO2的方法,由于SO2的溶解度较大,所以使用Na2SO3固体和浓硫酸在加热条件下反应,体现硫酸的强酸性)(10)Cu+2H2SO4(浓) CuSO4+SO2 +2H2O(硫酸体现酸性和强氧化性)思考一:1、实验现象?2、如何检验产物(CuSO4和SO2))3、硫酸体现什么性?4、被还原和未被还原硫酸的物质的量之比为多少?5、含溶质2mol的浓硫酸与足量的铜反应,被还原的硫酸为多少?(11)C+2H2SO4(浓) CO2 2 +2H2O(硫酸体现强氧化性)思考二:1、如何设计实验依次检验出此反应的产物?2、蔗糖里加浓硫酸,再加少量水,不断的搅拌,现象?体现硫酸的什么性质?(12)SO2(少量)+2NaOH= Na2SO3+H2O(含二氧化硫尾气的处理方法)(13)Na2SO3+SO2+H2O=2NaHSO3(14)SO2+CaO CaSO3(15)2CaSO3+O2=2CaSO4 (钙基固硫原理,将二氧化硫最终变为石膏)(16)2Na2SO3+O2= 2Na2SO4思考三:1、暴露在空气中亚硫酸钠固体可能含有什么杂质?2、如何检验亚硫酸钠是否变质?3、如何设计定量测定已部分变质的亚硫酸钠固体的纯度?(17)S+Hg=HgS(实验室处理洒落水银的方法)(18)S+Fe Fe+2S 说明氯气的氧化性比硫单质强(3Cl2+2Fe2Fe+3Cl3)(19)FeS+H2SO4(稀)=FeSO4+H2S (实验室制备H2S的方法,体现硫酸的强酸性)(20)4FeS2+11O22Fe2O3+8SO2(2SO2+O22SO3 SO3+H2O=H2SO4))工业制硫酸的原理。
高一化学必修1硅和二氧化硅课件

想一想
1、实验室盛装NaOH 溶液的试剂瓶为什么 用橡胶塞而不用玻璃塞?
图 4-6 实验室盛放NaOH溶液的试剂瓶
2 实验室用什么来盛装氢氟酸,为什么
●活学巧练 1.下列叙述中,正确的是( ) A.自然界中存在大量的游离态的硅 B.石英、水晶、玛瑙的主要成分都是二氧化硅 C.二氧化硅的化学性质活泼,能跟酸或碱的溶液发生化 学反应 D.二氧化硅与水反应可制备硅酸
(2)酸性太弱,只能与强碱发生中和反应 H2SiO3 + 2NaOH == Na2SiO3 + 2H2O
(3)不稳定(比H2CO3稳定),受热易分解
∆ H2SiO3 == H2O + SiO2
讨论:
CO2通入下例各溶液中,不可能产生沉淀的是( ) A、氯化钙溶液
B、石灰水
C、饱和碳酸钠溶液
A
D、硅酸钠溶液
一、硅酸(H2SiO3) H2SiO3是SiO2的对应水化物( SiO2 是H2SiO3的酸酐)。它不溶于水,是一种白色粉末状的固体。
思考:二氧化硅难溶于水,那么,如何制得硅酸呢?
1. H2SiO3的制法
实验探究:向饱和Na2SiO3溶液中滴入酚酞,再滴入稀盐酸
现象
滴入酚酞后溶液变为红色,再滴入稀盐酸,溶液红色变浅至无色,同时有白色胶状沉淀 产生
在玻璃表面涂上一层石蜡
在石蜡上雕刻出花纹,向挖空部分加少量氢氟酸
洗掉酸并去掉石蜡
(3)弱氧化性
二氧化硅中硅元素的化合价为+4 价,这是硅元素的最高
正化合价,因此具有一定的氧化性,如在高温下 SiO2 能被 C、
高温
高温
Mg 等还原。SiO2+2C=====Si+2CO↑,SiO2+2Mg=====Si
SiO2系统晶相图

o SiO2系统晶相图是硅酸盐系统中最基本的系统,它是一个具有多晶转变的典型SiO2氧化物。
二氧化硅是自然界分布极广,其最普遍的状态是β-石英,以石英砂、硅石以及各种水晶的形式广泛的分布在岩石中。
二氧化硅用途很广泛。
β-石英可做压电晶体用在各种换能器上,石英玻璃可做光学仪器,由于其耐高温、化学稳定性良好也可做石英坩埚。
以鳞石英为主晶相的硅砖是一种重要的耐高温材料,用于冶金和玻璃工业。
SiO的单元相图对上述各种材料2的制备和使用有着重要的指导作用。
(1)SiO相图的基本内容(见图)2SiO2在常压下的相图是由芬奈研究后于1913年发表的。
这个相图所标温度实际都是在101.325kPa下的各转变温度。
也就是说实验工作是在常压下进行的。
各变体的蒸气压极小,压力轴(纵轴)并不表示真正的压力数值,画出来的曲线仅仅表示温度变化时压力变化的趋势。
从图中可知SiO2在常压下当温度变化时可以有七种晶相,一种液相,一种气相。
实线表示稳定状态,虚线表示亚稳状态。
通过基本类型的学习我们可以看出实线代表的变体之间的转变是可逆的,同温度下,虚线代表的变体向实线代表的变体的转变是不可逆的。
相图中表示出α-石英的稳定范围在575~870℃之间,故在自然界中是没有α-石英的。
在870℃时,在有强的助熔矿化剂存在下,并粉碎成足够的细度,α-石英才转变成α-磷石英。
据实验证明,α-石英的转变并不按相图上的理想状态进行,而是过热到1300~1450℃(也认为是1600℃)缓慢进行的,而且经过中间相棗偏方石英转变成为α-方石英,虽然在这个温度范围内稳定态是α-鳞石英。
在急速加热石英到稍高于1420℃(又说是1600℃)时,就可以不转变为其他变体而熔化成粘度很大的液体.在自然界中同样也不存在有α-鳞石英,因为它的稳定范围在870~1470℃,在1470℃时缓慢转变为α-方石英,而在冷却时,它转变成β-鳞石英,接着迅速地转变为γ-鳞石英。
β-鳞石英只是稳定范围很小(117~163℃)的中间变体,从相图看,γ-鳞石英是亚稳态晶体,能长期存在于常温下.鳞石英各变体的密度相差极小,故在晶型转变的同时,其体积膨胀作用相当小,这是硅砖的工艺技术上所需要的特性。
二氧化硅晶型转变温度

二氧化硅晶型转变温度
二氧化硅(SiO2)的晶型转变温度是指在不同温度下,SiO2从一种晶体结构转变为另一种晶体结构的温度。
以下是关于SiO2晶型转变温度的一些信息:
1. SiO2的晶型转变温度与其晶格结构密切相关。
在常温下,SiO2大部分以非晶态存在,即无规则排列的硅氧键网络。
在一定温度范围内,SiO2会发生晶型转变,形成不同的有序晶体结构。
2. α-Quartz晶型是最常见的SiO2晶型。
它的晶格结构是由四面体型SiO4单元组成的,其中一个Si原子被四个O原子所包围。
α-Quartz的转变温度约为573°C。
3. β-Quartz晶型也是一种常见的SiO2晶型。
它的晶格结构与α-Quartz相似,但是β-Quartz的晶胞参数略有不同。
β-Quartz的转变温度约为846°C。
4. Tridymite晶型是另一种SiO2的晶型,其晶格结构由六角柱型SiO6单元组成。
Tridymite的转变温度约为870°C。
5. Cristobalite晶型是SiO2的最高温晶型,具有立方晶格结构。
其转变温度约为1470°C。
需要注意的是,以上转变温度值只是大致数值,具体数值可能会因样品纯度、压力、形态等因素而有所变化。
2021年高考化学专题复习:二氧化硅

2021年高考化学专题复习:二氧化硅1.石英()2SiO 系列光纤已广泛应用于有线电视和通信系统。
2SiO 属于( )A .盐B .酸C .单质D .氧化物2.中国是全球光伏发电安装量增长最快的国家。
制造太阳能电池板的主要材料是( )A. 锂B. 硅C. 铜D. 硫3.我国成功地发射了“嫦娥一号”探测卫星,对月球土壤中14种元素的分布及含量进行探测等。
月球的矿产资源极为丰富,仅月球表层5cm 厚的沙土就含铁单质有上亿吨,月球上的主要矿物有辉石(26CaMgSi O )、钾长石(38KAlSi O )和橄榄石(2-4Mg Fe SiO x x )等,下列说法或分析不正确的是( )A.辉石、钾长石及橄榄石均属于硅酸盐矿B.钾长石的氧化物形式可表示为:2232K O Al O 6SiO ⋅⋅C.橄榄石中铁为+2价D.月球上有游离态铁是因为月球上铁的活动性比地球上铁的活动性弱4.光导纤维的主要成分是( )A .单晶硅B .石墨C .硅酸钠D .二氧化硅5.下列哪种物质不是制造玻璃的原料( )A 、纯碱(23Na CO )B 、烧碱(NaOH )C 、石灰石(3CaCO )D 、石英(2SiO )6.下列物质中,可用来制造光导纤维的材料是( )A.硅单质B.铝单质C.铜单质D.二氧化硅7.在一定条件下,下列物质不能与二氧化硅反应的是( )①焦炭;②纯碱;③碳酸钙;④氢氟酸;⑤高氯酸;⑥氢氧化钾;⑦氧化钙;⑧氮气A.③⑤⑦⑧B.⑤⑦⑧C.⑤⑧D.⑤⑦8.下列物品的主要成分不为SiO的是( )2A.石英坩埚B.玛瑙饰物C.砖瓦D.水晶花瓶9.实验室储存固体试剂可以放在广口瓶中,液体试剂放在细口瓶中,但是有些试剂必须储存在具有橡胶塞的玻璃试剂瓶中。
以下物质必须储存在具有橡胶塞的玻璃试剂瓶中的是()①KOH溶液②Na2CO3溶液③盐酸④氢氟酸⑤澄清石灰水⑥硝酸⑦NaOH溶液A.①②⑤B.①②④⑤C.①②④⑤⑦D.①②⑤⑦10.下列说法正确的是( )A.生产水泥时,在熟料中加入适量的石膏可以调节水泥的硬化速度B.水泥在水中能硬化,但在空气中不会硬化C.水泥和水拌和后生成水合物,要吸收一定的热量D.水泥是一种化合物11.在航天飞机返回地球大气层时,为防止其与空气剧烈摩擦而被烧毁,需要在航天飞机外表面安装保护层。
同质多晶

SiO2的各种晶型变体在外界条件作用下, 将进行互相转化 ,转化过程是很复杂的,可 以划分为迟钝型转变和迅速型转变。由于 SiO2变体之间晶体结构的差异,其真比重不
同,因而在晶型转变过程中有体积效应产 生。一般迅速型转变所产生的体积效应比迟 钝型转变时要小。
SiO2系统的蒸气压与温度关系示意图
SiO2的同质多晶变体及其 转变
潘陈 郑东青
2013-12-15
简介
二氧化硅广泛存在于自然界中。二氧化 硅用途很广泛,主要用于制工艺品、装饰品、 化学仪器、光学仪器、精密轴承、耐火材料、 石英钟表、光导纤维、石英玻璃、普通玻璃、 建筑材料。
概念
• 同质多晶(polymorphism):相同的化学组成, 在不同的热力学条件下却能形成不同的晶体结构, 表现出不同的物理、化学性质。我们把同一种化 学组成在不同的热力学条件下(温度、压力、pH 等),可以结晶成为两种以上不同结构的晶体的 现象称为同质多晶(同质多象)。由此而产生的 化学组成相同、结构不同的晶体称为变体。如纯 炭物质中的钻石和石墨,碳酸氢钙中的石粉和牦 蛎粉,碱式氯化铜中的α-晶体和β-晶体等等。
二氧化硅变体的性质
变体名称 α-石英 β-石英 α-鳞石英 β-鳞石英 γ-鳞石英 稳定温度 /℃ 573-870 <573 870-1470 117-163 20-117 晶系 六方 三方 六方 六方 斜方 矛头状双晶 柱状 蜂窝状结构 结晶习性 常温下真比 熔点/℃ 重 2.533 2.651 2.228 2.24 2.26-2.35 1670 1713
研究意义
同质多象的形成与外界条件密切相关 ,因此同质多象的研究有助于确定晶体形 成时的物理化学条件及所经历的变化。如 SiO2等物质的同质多象,被广泛用作所谓的 地质温度计和地质压力计。在工业上,用 石墨制备人造金刚石;运用淬火、退火等 手段控制加工件的某些物性;通过先升温 至573℃以上,然后在严格控制的条件下降 温,藉以消除水晶中对工业利用有害的道 芬双晶等,都是利用了同质多象转变的特 性。
SiO2的晶体及转化

SiO2的晶体及转化SiO2在常压下有七个变体(modification) 和一个非晶型变体,即β-石英,α-石英,γ-鳞石英(tridymite) ,β-鳞石英,α-鳞石英,β-方石英(cristobalite),α-方石英和石英玻璃。
上述各变体间的转变可分为两类:第一类是石英、鳞石英、方石英之间的转变,属重建型转变。
由于所需活化能大,转变温度高而缓慢,转变温度通常是由晶体表面逐渐向内部进行,并伴随有较大的体积效应。
有矿化剂存在时可显著加速转变,无矿化剂时实际上不能转变。
有时可通过急冷使高温中稳定的晶型在室温下也能存在。
第二类是上述变体的亚种α、β、γ型的转变,属于位移型转变。
由于它们在结构上差别很小,因此转变是在一个确定温度下一定要发生的,转变快,而且是可逆的。
并伴随有比重建型转变小的体积效应。
α-石英在870℃较慢地转变为α-鳞石英。
研究表明,此种慢转变必须在长时间缓慢加热,原料经细粉碎,有强的助熔矿化剂(如钨酸钠Na2WoO4)存在的条件下才能实现。
这表明鳞石英的生成和存在必须有杂质离子(或矿化剂)存在。
由于SiO2各种变体的晶体结构不同,其密度不同,它们在转变过程中有体积效应产生。
在某些方面完全转变时体积变化值如表2-6所示。
从表2-6中看出快速转变时所发生的体积变化比慢速转变时所发生的体积变化小,其中以鳞石英型转变时体积变化较小,方石英型较大。
方石英的熔点1713℃,鳞石英是1670℃,而石英是1600℃,但鳞石英具有较高的体积稳定性。
硅砖中鳞石英具有矛头状双晶相互交错的网络状结构,因而使砖具有较高的荷重软化点及机械强度。
当硅砖中有残余石英存在时,由于在使用中它会继续进行晶型转变,体积膨胀较大,易引起砖体结构松散,综上所述,一般希望烧成后硅砖中含大量鳞石英,方石英次之,而残余石英愈少愈好。
在硅砖生产中石英的转变程度用密度衡量,硅砖的密度一般小于2.38g/cm3,优质硅砖的密度在2.32~2.36g/cm3之间。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
结石的检验方法
肉眼鉴定
肉眼鉴定是指用肉眼手标本直接观察或利用10~20倍放大镜观察.
肉眼分析的内容:观察结石的外貌特点,颜色,周围环境及存在部位.
一般粉料结石在玻璃中以未熔颗粒形成疙瘩,常为乳白色,结石边缘由 于不断熔蚀而变圆.且由于未熔石英聚集成团继之缓慢溶解,使周围玻璃相 的粘度大大超过了其他部位,在此即会形成以结石未中心的圈形条纹或玻 筋.有时在白疙瘩周围会聚集有较大的气泡.乳白色的椭圆形的结石在放大 镜下有时可以看到水花样的条纹,则是未熔的芒硝颗粒聚集而成的芒硝结 石.析晶结石也常呈乳白色,但多处于制品的表面.耐火材料结石因组分不同 结石的形态.颜色各不相同.粘土结石一般呈浅灰白色.莫来石常具有青灰色 或暗棕色,且常伴有一些气泡,在粘土质耐火材料表面侵蚀带的玻璃釉质层 中,肉眼可见针状结晶矿物即为莫来石晶体.碹滴多为硅质耐火材料结石,其 表面的针状结晶物质则为鳞石英.且因硅质耐火材料中含有铁,结石常呈黄 绿色,伴有条纹和结瘤,常为滴状.特征的结石肉眼分析是准确的,但一般情况 下它只能作为进一步分析的参考
Ng’
B
Np’
C
D
E Hα
ALeabharlann G K1 OK2 FA
Np’
Ng’
P
干涉色色谱图
偏光的原理
偏光显微镜 产生干涉的原理
反光显微镜
为什么要用反光显微镜来研究岩相?
1.要测不透明的晶体(其厚度在0.03mm时也不透明)的光学性质. 2.有些透明晶体也用这种方法检测,因为这种方法制片简单,光片受侵蚀后
钠钙质结石
主要结石如下:
(以下均为析晶结石,硅灰石有时也出现在耐火材料结石中但常与鳞石英共生)
结石名称 失透石 α -硅灰石 β -硅灰石
透辉石
结石来源
钠钙玻璃析晶
1180℃以上稳定的玻 璃析晶产物
在显微镜可观察到的 现象
鉴别主要依据
扇羽状,放射状,针状 或柱状,突起中等,正 延性
晶形常呈扇状,集束纤 维状,柱状,突起
该组分的析晶物质条件如:
CaO→硅灰石(CaO.SiO2) MgO →透辉石(CaO.MgO.2SiO2) NaO →失透石(Na2O.3CaO.6SiO2) SiO2→鳞石英方石英析晶 此外,在冷却阶段,由于设计的冷却温度.成型温度不适当, 恰好造成某种物相的析晶温度条件,则会出现该组分的大量析 晶.所以要避免析晶结石除严格控制配合料组分外,还应采取 相应的工艺措施,如熔化池尽量避免死角;提高成形速度,使制 品迅速的越过各组分的析晶区等.
以C轴为旋转轴的长形旋
转椭球体。(Ng代表最
大的折射率值:Np代
表最小的折射率值)
双折射:当光入射非均质体时,就要产生两条折
射光线,这种现象叫双折射
常光:当光波射入一轴晶矿物,除光轴外,每一
个方向的入射线均发生双折射分解成两种偏光,均 有两个折射率。其中一个偏光的光波振动方向永远 垂直光轴其传播速度及折射率值不变称为常光,以符 号“o”表示。常光折射率不随入射光波振动方向改 变而改变,其折射率用No表示。
偏光显微镜分析
以岩相学的分析方法是对玻璃结石的分析鉴定是最有效 的方法.
分析的步骤如下:
1.在肉眼分析的基础上大致确定结石的来源进而根据玻璃的 组分.结石的来源, 初步判断可能有的结石矿物
2.将结石部位切割下来,制成0.03mm薄片,以备观察.
3.在单偏光镜下浏览全薄片,观察结石及玻璃相的颜色.多色 性.各种不同晶体的形态的完善程度,晶体的分布情况及晶 体的解理,突起等级.折射率值范围等.这对玻璃的来源分析 很有意义的. 4.正交镜观察结石矿物的干涉色.消光类型.消 光角.延性.双晶等.
六方片状,柱状或针状, 由延性符号与β 型区
突起与干涉色均较高, 别,由折射率与鳞石英,
负延性
失透石区
1180℃以下稳定的玻 璃析晶产物,常与失透 石在一起
α石英2.53
700~900 ℃开始
1200~1400
1300~1400 ℃显著
℃显著 亚稳方石英
α鳞石英2.27
1470 ℃强烈
α方石英2.229 >1713
快冷
熔体
石英玻璃2.2
1200~1470 ℃显著
1400~1470
-16.0% ℃强烈
1000开始,1200~1300℃强烈
-15.4% 亚稳方石英
OD=OB.Sinα OE=OB.Sinα OG=OB.Sinα.Cosα OF=OB.Cosα.Sinα
OG和OF两者大小相同但符号相反
而产生干涉的条件是:1.频率相同2.有固定的光程差3.在同一个平面内振动
(光程差)R=d(Ng’-Np’)
(振幅)A+2
p
=OB2
Sin2
2αSin[---d--(-N--g--’--N---p-’-)-.π] λ
产生结石的几方面原因: (1)配合料混合不均匀
(2)原料质量不高
(3)操作不当
极不充分的未熔粉料结石
不充分的未熔粉料结石
二氧化硅各种转化示意图
γ鳞石英2.27
-0.14 %
117 ℃快
β石英2.65
β鳞石英2.24
β方石英2.32
2.80 %
+0.2 %
180~290快
163 ℃快
0.82
573℃ (快)
晶体轮廓清晰,便于镜下定量测定,适宜生产控制.
明视场:使用它时视域中矿物表面整个是明亮的.因矿物反光能力不同
而造成明暗差.
暗视场:使用它时矿物表面基本上是黑暗的,只有不同矿物交界线,
半透明及透明矿物裂纹,交接面等反射的光线,因为方向适合而有一部 分射入物镜,而成明亮。
反射色:专指矿物表面选择反射色光而产生的颜色,有称表色.有许多矿
物有很显著的特征反射色,所以它是鉴定不透明矿物的重要特征.
岩相分析在玻璃生产上的应用
一.对原料的分析研究
二.对玻璃缺陷的检验
玻璃缺陷包括有:气泡.条纹.结瘤和结石
三.对应力分布的检查
四.对玻璃显微结构的研究
结石的来源
1.来源于粉料的结石
由于配合料没有充分溶化而残留在玻璃液中,冷却后进入 成型部而形成的结石。
片 的椭圆半径是同名轴平行,则总光程差为R=R1+R2 若两进体切片重叠时,Ng1//Np2.Np1//Ng2,即两切片
的椭圆半径是异名轴平行,则总光程差为R=R1-R2
附件补色器:就以知光率体椭圆半径轴名的晶体切片,
利用他们与未知椭圆半径轴名的晶体切片重叠,根据 干涉色的升降,就可测定未知晶体切片上光率体椭圆 半径的名称.
非常光:另一种偏光的光波振动方向是在光波的
传播方向与光轴所构成的平面上,其传播速度与折 射率值随着光波振动方向不同而改变,称为非常光。 以符号“e”表示。非常光折射率是随着入射光波振 动方向的改变而变化,其折射率用Ne表示。
正光性:当Ne>No·称为一轴晶正光性光率
体
负光性:当Ne<No称为一轴晶负光性光率
5.对于某些个别矿物可作轴性.光性测定.
6.依据分析结果定出结石矿物名称,结合生产情况提出结石 来源分析意见,进而制定调整措施.
结石的分类及显微镜鉴定
一.硅质结石
主要矿物有:未熔石英,鳞石英 方石英
结石来源
在显微镜可观察到的现象
鉴别是的主要依 据
未熔石英
料粉未熔透,硅 质耐火材料交代 作用而产生
粒状,正突起低, 不规则粒状,有裂纹,正突起低, 正光性,常与
>1470
无矿化剂存在时
矿物名称下的数字为其相对密度,百分率数字表示变化 的体积改变:快表示快速转变;(.鳞石英的熔点较高 (1670℃),在液相中溶解度低,是高温下硅砖最稳定的晶 相)
二氧化硅变体转化时的膨胀率
转化温度(℃) 结晶形态转化
线膨胀(%) 体积膨胀
117~163 γ 鳞石英→α 鳞石英
粒状,短柱状,正突起低,负延性, 接近玻璃相处,常呈梯状,羽 状生长
含锆玻璃析晶或耐火 直角相交树枝状,突起双折射率都
材料熔蚀变产物
很高
粉料中的夹杂物,含 锆耐火材料蚀变 产物
细小粒状或针状,突起双折射率都 很高
鉴别主要依据
晶形呈六方片状, 折射率很高, 常与莫来石霞 石伴生
六方片状晶形,常 与霞石伴生
无解理,边缘可能呈负突起 鳞石英,方石 英伴生
鳞石英
由石英转化而来的鳞石英在碹
粉料碹滴,析晶 硅质浮渣,硅砖 受侵蚀
滴和硅砖中常呈矛头状双 晶;经由玻璃相析晶而成的, 呈六方骨架(主干和分支成 60度角)状或羽毛状,有时
晶形特点,负突起, 矛头双晶,负 延性
呈六方片状或管柱状
方石英
析晶,硅质浮渣, 石英转化产物, 碹滴,硅质耐火 材料
溶化部高温区碹顶使用的优质硅砖的内部结构
用于下游胸墙,后脸墙,卡脖碹顶澄清区胸墙碹顶的 96Ⅰ级硅砖
1#小炉碹砖
4#南侧碹砖
方石英向鳞石英转化的景象
硅质碹顶“钟乳石”状悬垂物落入玻璃后形成由鳞石 英,方石英和玻璃相组成的结构
三.来源于析晶的结石
它是一种反玻璃化现象,使玻璃失去澄清的本性,它大多数 聚集成脉状斑点出现在玻璃表面部位,它的形成往往是由于配 合料中某种组分过量或混合不均,使局部某种组分过量,造成
0.86~1.30 14.4 17.4
——
—— 0.1
二.来源于耐火材料的结石
(1)温度条件 (2)化学侵蚀 (3)物理侵蚀 耐火材料的侵蚀无外乎以下三种情况:
1.耐火材料的本身的的晶化或气孔 2.耐火材料的物相与玻璃反应后生成的变质 矿物 3.耐火材料被熔化后重新析晶的矿物.
