国内熊果酸衍生物相关专利结构修饰技术的研究进展
熊果酸的生物活性及其提取工艺的研究进展

而且有很好的触摸感 ,因此 , 在美容 、护肤等领域
应 用潜 力 巨大 。 1 对肝 炎 的作用 . 3
熊果酸对急性实验性肝损伤有 明显 的保护作 用 ,临床表现为血清谷丙转氨酶含量下降、肝细胞
变性 、坏死 等 生理 现象 明显减轻 ;对 于恢 复肝功 能
刘柯 彤 ,陶 亮 亮,马 雄 ,刘 军 海
( 陕西理工学院化学与环境科学学院 ,陕西 汉 中 730 ) 2 01
摘
要: 介绍 了熊果酸的生物活性 , 综述 了近年来 熊果酸提取工艺 的研究进展 ,重点讨论 了提取工艺的研究热点及存在
的问题 ,探讨 了其今后 的发展趋势 。 关键词 :熊果 酸; 生物活性 ; 提取工艺 中图分类号 :R 2 4 8 . 2 文献标识码 :A 文章编号 :17 .9 52 1)80 4 -4 6 19 0 (0 00-0 1 0
第3 9卷
第 8期
化
工
技
术
与
开
发
V l 9 No 8 o 3 _- .
Au 2 0 g. 01
21 0 0年 8月
Te h l g c no o y& De l pme to m ia n usDr veo n fChe c l d t I
熊果 酸 的生物活性及其提取工艺 的研究进展
明显 降低 , 光镜下肝细胞脂肪变性 , 水样变性明显 减轻 , 明熊果 酸对 I- 半乳 糖( - I ) 导 的 表 ) 氨基 D GaN 诱
急性 肝 细胞损 伤 的保护 作用 与其 阻止肝 细胞 坏死 、
作用 ,对多种肿瘤细胞体 内、外均有抑制作用 , 对
熊果酸衍生物的合成与活性研究进展

熊果酸衍生物的合成与活性研究进展孟庆国;王朝明;王文智;刘娟;王慧云【摘要】熊果酸属五环三萜类化合物,广泛存在于食物和药用植物中,具有抗炎、抗病毒、抗肿瘤、抗氧化和保肝等多种药理活性.近年来,熊果酸的结构修饰与活性研究逐渐成为该领域的研究热点.本文对熊果酸的提取分离,C-3、C-28、A环的结构修饰以及相关药理活性研究进展作一综述.【期刊名称】《济宁医学院学报》【年(卷),期】2017(040)004【总页数】7页(P245-250,255)【关键词】熊果酸;衍生物;合成;药理活性【作者】孟庆国;王朝明;王文智;刘娟;王慧云【作者单位】烟台大学新型制剂与生物技术药物研究山东省高校协同创新中心、分子药理和药物评价教育部重点实验室(烟台大学), 烟台 264005;烟台大学新型制剂与生物技术药物研究山东省高校协同创新中心、分子药理和药物评价教育部重点实验室(烟台大学), 烟台 264005;烟台大学新型制剂与生物技术药物研究山东省高校协同创新中心、分子药理和药物评价教育部重点实验室(烟台大学), 烟台 264005;烟台大学新型制剂与生物技术药物研究山东省高校协同创新中心、分子药理和药物评价教育部重点实验室(烟台大学), 烟台 264005;济宁医学院药学院, 日照 276800【正文语种】中文【中图分类】R285孟庆国,教授,理学博士,博士生导师,药物化学与制药工程方向带头人。
2001年毕业于中国协和医科大学微生物与生化药学专业,获理学博士学位。
2001年11月至2004年3月,军事医学科学院毒物药物研究所,药物化学专业博士后流动站。
2004年至今烟台大学药学院。
主要从事具有抗心肌缺血、抗菌、抗肿瘤、抗炎、抗病毒等活性天然药物修饰以及全合成。
Chemical Biology & Drug Design、Chinese Chemical Letter、Bioorganic Medicinal Letter及中国新药杂志审稿人,国家自然科学基金通讯评审专家、山东省自然科学基金结题/评审专家、山东省重点科技发展计划、重大新药创制评审专家、中国药学会老年药学专业委员会委员、山东省药物化学专业委员会委员。
齐墩果酸与熊果酸结构修饰物的药理活性和构效关系研究进展_刘丹

齐墩果酸与熊果酸结构修饰物的药理活性和构效关系研究进展刘丹1,2 孟艳秋23 赵娟2(1天津大学药物科学与技术学院 天津 300072; 2沈阳化工学院制药工程教研室 沈阳 110142)刘丹 女,35岁,副教授,主要从事天然活性成分的结构修饰和医药中间体的合成工作。
3联系人,E 2mail :myq6581@ 辽宁省自然科学基金资助项目(20042009)2005-12-12收稿,2006-08-15收稿摘 要 齐墩果酸(OA )和熊果酸(UA )均属于五环三萜类化合物,广泛存在于自然界中,具有多种显著的生物活性。
本文综述了近年来齐墩果酸及熊果酸结构修饰物的药理活性和构效关系的研究进展。
关键词 齐墩果酸 熊果酸 结构修饰 药理活性R ecent Advance in the Study on Derivatives ofOleanolic Acid and U rsolic AcidLiu Dan1,2,Meng Y anqiu 23,Zhao Juan 2(1C ollege of Pharmaceuticals &Biotechnology ,T ianjin University ,T ianjin 300072;2Faculty of Pharmaceutical Engineering ,Shenyang Institute of Chemical T echnology ,Shenyang 110142)Abstract Oleanolic acid and urs olic acid belong to triterpene acids which having numerous pharmacological activitiesand widely presenting in food ,medicinal herbs and other plants.Here a brief introduction of the recent progresses on pharmacological activities and the structure-activity relationship of derivatives of olean olic acid and urs olic acid are given out.K ey w ords Oleanolic acid ,Urs olic acid ,M odification ,Pharmacological activities齐墩果酸(oleanolic acid ,OA ,1)和熊果酸(urs olic acid ,UA ,2)为结构类似物,均属于五环三萜类化合物,在自然界分布十分广泛,且具有多种生物活性。
国内熊果酸衍生物相关专利结构修饰技术的研究进展

国内熊果酸衍生物相关专利结构修饰技术的研究进展熊果酸衍生物可抑制多种肿瘤细胞的生长,并因其细胞低毒性而日益成为抗肿瘤药物领域的研究热点。
本文对通过中国专利数据库进行检索获得的熊果酸衍生物在中国的相关专利申请进行了分析,总结了目前国内专利申请中熊果酸衍生物主要结构修饰位置及其活性,并结合目前国内雄果酸衍生物相关专利申请的现状给出了今后专利申请的建议。
标签:熊果酸衍生物;抗肿瘤;专利熊果酸(ursolic acid)又称乌索酸或乌苏酸,属于α-香树脂醇型五环三萜类化合物(图1),是一种具有较好生物活性的天然产物。
1996年,日本学者神藏美枝子等人从杜鹃花科越桔属植物越桔(Vaccinicum vitis-idaca L.)叶中提取了具有较高熊果酸浓度的熊果酸产品,其中实际上只含有25%的熊果酸。
随着对熊果酸研究的深入,已证实熊果酸能在体内外抑制多种肿瘤细胞生长,并且对正常细胞毒性较低,同时,熊果酸还具有抗氧化、抗炎、抑制HIV、降血糖、护肝等生物活性[1],已成为近期国内外研究开发的热点。
熊果酸在我国自然资源丰富[2],为了进一步开发熊果酸的药物用途并改善其理化性质,研究人员对其展开了大量的结构修饰及构效关系研究[3-4],并取得了很多可喜的成果。
由于获得知识产权保护已成为新药研发至关重要的一个环节,随着对新的熊果酸衍生物及其药理活性研究的逐步展开,国内申请人针对熊果酸衍生物的专利申请数量也日益增多。
针对熊果酸衍生物结构改进的专利申请热点主要集中在2-位、3-位、23位、28-位、针对这些位置使用不同的基团取代可以获得具有不同药物活性的化合物,其中绝大部分结构修饰为对C3-位羟基和(或)C28-位羧基的改造,而有关其他位置改造的专利申请量相对较少。
下面按照国内专利申请中雄果酸结构修饰位置不同导致活性的差异进行分类介绍。
1 在C3-位和C28-位进行修饰1.1 对C-3位酰氧化,C-28位酰胺化沈阳化工大学(或沈阳化工学院)的三份专利申请CN101157715A[5],CN101161670A[6]和CN102180939A[7]对熊果酸C-3位酰氧化,C-28位酰胺化获得的修饰物(图2)对人子宫颈癌细胞株HeLa、卵巢癌SKOV3细胞、人肝癌HepG2细胞或胃癌BGC-823细胞抑制作用明显。
《新型熊果酸衍生物的合成及其抗肿瘤活性的研究》

《新型熊果酸衍生物的合成及其抗肿瘤活性的研究》摘要:本文旨在研究新型熊果酸衍生物的合成方法及其抗肿瘤活性。
通过化学合成技术,成功合成了一系列熊果酸衍生物,并对其结构进行了表征。
随后,通过体外和体内实验,对合成的新型熊果酸衍生物的抗肿瘤活性进行了评估。
结果表明,新型熊果酸衍生物具有良好的抗肿瘤活性,为抗肿瘤药物的研究提供了新的思路。
一、引言熊果酸是一种天然的有机化合物,具有广泛的生物活性,包括抗肿瘤、抗炎、抗氧化等作用。
近年来,熊果酸的衍生物在药物研究和开发中受到了广泛关注。
本文旨在研究新型熊果酸衍生物的合成方法及其抗肿瘤活性,以期为抗肿瘤药物的研究提供新的思路。
二、材料与方法1. 合成方法通过化学合成技术,以熊果酸为原料,引入不同的官能团,合成了一系列新型熊果酸衍生物。
具体合成步骤如下所述。
2. 结构表征利用红外光谱、核磁共振等手段,对合成的新型熊果酸衍生物进行了结构表征。
3. 抗肿瘤活性评估通过体外和体内实验,对合成的新型熊果酸衍生物的抗肿瘤活性进行了评估。
具体方法包括细胞毒性实验、肿瘤抑制实验等。
三、结果与讨论1. 合成与结构表征成功合成了一系列新型熊果酸衍生物,其结构通过红外光谱、核磁共振等手段得到了确认。
与原始的熊果酸相比,新型衍生物的分子结构中引入了不同的官能团,有望提高其生物活性。
2. 抗肿瘤活性评估(1)体外实验通过细胞毒性实验,发现新型熊果酸衍生物对多种肿瘤细胞株具有显著的抑制作用。
与原始的熊果酸相比,新型衍生物的抑制效果更为显著。
此外,通过流式细胞术等手段,初步探讨了新型熊果酸衍生物的作用机制。
(2)体内实验通过肿瘤抑制实验,发现新型熊果酸衍生物在体内也具有显著的抗肿瘤活性。
与对照组相比,治疗组动物的肿瘤生长得到了有效抑制。
同时,新型熊果酸衍生物对动物的体重、主要脏器等无明显影响,表明其具有良好的安全性。
3. 讨论新型熊果酸衍生物的抗肿瘤活性可能与其分子结构中的官能团有关。
这些官能团的引入可能改变了熊果酸的分子构象,从而提高了其与肿瘤细胞的亲和力。
熊果酸及其衍生物抗肿瘤作用的研究进展

头人(生物医药)ꎬ昆明市科技创新团队领军人才( 中药健康饮 品) ꎬ任中国中医药研究促进会内分泌专业委员会常委ꎬ中国中西 医结合学会内分泌学会委员、中国中西医结合学会老年病学会委 员ꎬ中国医师协会中西医结合医师分会内分泌代谢专家委员会委 员ꎮ 云南省中西医结合学会甲状腺专业委员会主任委员、云南省 糖尿病学会副主委、云南省医师协会内分泌学副主委、云南省内 分泌学会常委、云 南 省 中 西 医 结 合 学 会 内 分 泌 学 会 常 务 副 主 委ꎬ 云南省中医药学会糖尿病专业委员会副主任委员、云南省中医药 文化宣教专家ꎮ 主持国家级、省级、市级科研项目 10 项、获省级
Advances in anti-tumor effects of ursolic acid and its derivatives XIANG Runqing1ꎬFAN Yuan2
(1.Traditional Chinese Medicine CollegeꎬYunnan University of Chinese MedicineꎬKunming 650500ꎬChinaꎻ 2.School of Clinical MedicineꎬYunnan University of Chinese MedicineꎬKunming 650500ꎬChina)
������������������������������������������������������������������������������������������������������������
摘要:熊果酸( ursolic acidꎬUA) 是一种
《新型熊果酸衍生物的合成及其抗肿瘤活性的研究》

《新型熊果酸衍生物的合成及其抗肿瘤活性的研究》摘要:本研究主要探讨新型熊果酸衍生物的合成过程以及其抗肿瘤活性的表现。
我们首先设计并合成了一系列熊果酸衍生物,通过多种生物学实验方法对其抗肿瘤活性进行了深入探究。
我们的实验结果显示,新型熊果酸衍生物对某些肿瘤细胞系有显著的抑制作用,显示出潜在的治疗应用前景。
一、引言近年来,随着对天然药物成分的研究不断深入,越来越多的药物候选物被挖掘出来,其中,熊果酸作为具有重要药用价值的化合物,其在抗肿瘤、抗炎等方面的潜在作用引起了广泛的关注。
为了寻找具有更强抗肿瘤活性的化合物,我们设计并合成了新型的熊果酸衍生物。
二、新型熊果酸衍生物的合成本部分主要描述了新型熊果酸衍生物的合成过程。
我们根据已知的化学反应原理和合成步骤,设计并成功合成了一系列新型熊果酸衍生物。
通过改变反应条件、原料比例等因素,我们成功得到了目标化合物,并通过各种谱学手段对其进行了表征和确认。
三、抗肿瘤活性的研究我们采用多种生物学实验方法,对新型熊果酸衍生物的抗肿瘤活性进行了深入研究。
我们选择了多种不同类型的肿瘤细胞系进行实验,通过MTT法测定其细胞增殖抑制率,同时使用流式细胞术和Western Blot等手段对其作用机制进行了研究。
实验结果显示,我们的新型熊果酸衍生物在低浓度下就能显著抑制肿瘤细胞的增殖,而且其效果优于原始的熊果酸。
同时,我们还发现这些化合物在诱导肿瘤细胞凋亡、抑制肿瘤细胞迁移等方面也有显著的效果。
此外,我们还通过Western Blot等手段初步探讨了其作用机制,发现这些化合物可能通过影响肿瘤细胞的信号传导通路来发挥其抗肿瘤作用。
四、结论本研究成功设计并合成了一系列新型的熊果酸衍生物,并通过多种生物学实验方法对其抗肿瘤活性进行了深入研究。
我们的实验结果显示,这些新型的熊果酸衍生物在抗肿瘤方面具有显著的活性,对某些肿瘤细胞系的增殖有显著的抑制作用,同时也可能通过影响肿瘤细胞的信号传导通路来发挥其抗肿瘤作用。
熊果酸的结构修饰物及其抗肿瘤活性

熊果酸的结构修饰物及其抗肿瘤活性
白育军;杨小生;康文艺;郝小江;徐筱杰;宋宝安
【期刊名称】《华西药学杂志》
【年(卷),期】2003(18)2
【摘要】目的结构修饰熊果酸 ,制备其衍生物以观察抗肿瘤活性。
方法对熊果酸的 1、2位和 3位进行氧化 ,制备其衍生物 ,并以Hela和HL - 6 0为模型进行了生物活性测试。
结果制备了 6个衍生物 ,其中 4个化合物为新化合物 ;熊果酸结构修饰物的活性均较熊果酸弱。
结论熊果酸经过结构修饰、改造后 ,生物活性受到影响。
【总页数】4页(P87-90)
【关键词】熊果酸;衍生物;抗肿瘤活性;A环碳原子;结构修饰物
【作者】白育军;杨小生;康文艺;郝小江;徐筱杰;宋宝安
【作者单位】贵州省,中国科学院天然产物化学重点实验室;北京大学化学与分子工程学院;贵州大学精细化工中心
【正文语种】中文
【中图分类】R730.52
【相关文献】
1.齐墩果酸和熊果酸结构修饰物抗HIV活性的构效关系研究 [J], 朱楠;罗骏
2.齐墩果酸与熊果酸结构修饰物的药理活性和构效关系研究进展 [J], 刘丹;孟艳秋;赵娟
3.熊果酸的结构修饰与抗肿瘤活性研究进展 [J], 李家庆
4.人参皂苷结构修饰物对人肝癌SMMC-7721细胞体外抗肿瘤活性研究 [J], 朱雷;赵凤丽;袁野;孙婷婷;吴海宴;刘墨祥;李吉萍
5.熊果酸类似物的结构改造及其体外抗肿瘤活性研究 [J], 佟思淼;孟艳秋
因版权原因,仅展示原文概要,查看原文内容请购买。
熊果酸研究热点与前沿的文献计量学分析
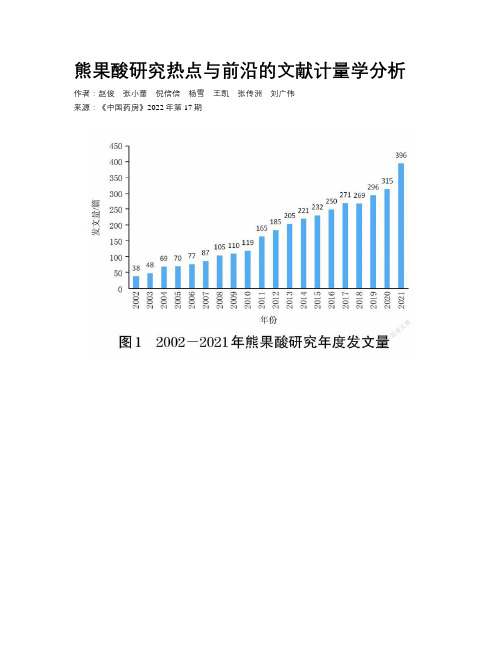
熊果酸研究热点与前沿的文献计量学分析作者:赵俊张小蕾倪倍倍杨雪王凯张传洲刘广伟来源:《中国药房》2022年第17期摘要目的探讨近20年熊果酸的研究热点与前沿,为该领域的研究者提供参考。
方法搜集Web of Science数据库中与熊果酸的相关研究文献,检索时限设定为2002年1月1日至2021年12月31日,采用科学计量学软件CiteSpace对文献中涉及的国家或地区、研究机构、作者、期刊和关键词等进行可视化分析,获取熊果酸的时空分布、研究前沿,通过分析关键词共现、关键词突现、关键词聚类等进一步分析熊果酸的研究现状和发展前沿。
结果与结论最终纳入有效文献3 528篇,发文量前3位的国家为中国、印度和美国;发文机构分析显示,中国科学院、卡拉奇大学、中国医科大学为发文量排名前3位的研究机构;发文期刊分析显示,Molecules(127 篇)、Journal of Ethnopharmacology(90篇)、Journal of Agricultural and Food Chemistry(75 篇)是研究發文量较高的3个期刊;关键词分析显示,熊果酸的抗肿瘤活性、抗氧化活性、抗菌活性、抗炎活性等药理作用一直是研究的重点,熊果酸诱导细胞凋亡、氧化应激、自噬等作用机制以及熊果酸纳米颗粒等药物输送方式的研究是未来一段时间的研究方向。
关键词熊果酸;文献计量学;研究热点;研究前沿;抗肿瘤活性;抗氧化活性;抗炎活性;抗菌活性中图分类号 R932 文献标志码 A 文章编号 1001-0408(2022)17-2102-06DOI 10.6039/j.issn.1001-0408.2022.17.11Bibliometric analysis for research hotspot and frontier of ursolic acidZHAO Jun ZHANG Xiaolei NI Beibei YANG Xue WANG Kai ZHANG Chuanzhou LIU Guangwei(1. Dept. of Pharmacy,the Affiliated Hospital of Qingdao University,Shandong Qingdao 266003,China;2. Dept.of Gastrointestinal Surgery,the Affiliated Hospital of Qingdao University,Shandong Qingdao 266003,China)ABSTRACT OBJECTIVE To explore the research hotspots and development frontiers of ursolic acid in recent 20 years,and toprovide reference for researchers in this field. METHODS Research literatures related to ursolic acid in Web of Science from Jan., 1,2002 to Dec. 31,2021 were collected,and visualization analysis was performed on countries or regions,research institutions,authors,journals and keywords involved in the literatures using CiteSpace software,to obtain the spatial and temporal distribution ofursolic acid and research frontiers. The research status and development frontier of ursolic acid were further analyzed by analyzingkeywords co-occurrence,keyword emergence,keyword clustering,etc. RESULTS & CONCLUSIONS Totally 3 528 valid paperswere included in this study,and the top three countries were China,India and the United States. Analysis of publishing institutionsshowed that Chinese Academy of Sciences,Univisity of Karachi and China Medical University were the top 3 research institutionsin the list of publication amount. Analysis of published journals showed that Molecules (127 articles),Journal ofEthnopharmacology(90 articles),Journal of Agricultural and Food Chemistry(75 articles)had high number of literatures onursolic acid. The analysis of keyword analysis showed that pharmacological effects,such as antitumor activity of ursolic acid,antioxidant activity,antibacterial activity and anti-inflammatory activity,are always the focus of the research;the mechanism ursolicacid induced apoptosis,oxidative stress and autophagy,the research on ursolic acid signaling pathway,drug delivery of ursolic acidnanoparticles were the research direction in the future.KEYWORDS ursolic acid;bibliometrics;research hotspot;development frontier;antitumor activity;antioxidant activity;anti-inflammatory activity;antibacterial activity熊果酸(ursolic acid)属于乌苏烷型五环三萜类化合物,存在于熊果、女贞子、野蔷薇果、白花蛇舌草、车前草等自然界广泛分布的天然植物中,具有抗氧化、抗炎、抗病毒、抗肿瘤等多种功效,因其价格低廉、疗效稳定且不良反应少而备受关注,并且已有多年的应用历史[1]。
《新型熊果酸衍生物的合成及其抗肿瘤活性的研究》

《新型熊果酸衍生物的合成及其抗肿瘤活性的研究》摘要:本文研究了新型熊果酸衍生物的合成方法及其抗肿瘤活性。
通过化学合成技术,成功制备了多种熊果酸衍生物,并对其抗肿瘤活性进行了体外和体内实验研究。
实验结果表明,新型熊果酸衍生物具有良好的抗肿瘤活性,为肿瘤治疗提供了新的药物选择。
一、引言熊果酸是一种天然存在的有机酸,具有广泛的药理作用,其中包括抗肿瘤、抗炎、抗氧化等作用。
近年来,随着对熊果酸研究的深入,其衍生物的合成及其药理作用也成为了研究的热点。
本文旨在研究新型熊果酸衍生物的合成方法及其抗肿瘤活性,以期为肿瘤治疗提供新的药物选择。
二、材料与方法1. 合成方法本实验采用化学合成技术,以熊果酸为原料,通过引入不同的取代基团,成功制备了多种新型熊果酸衍生物。
具体合成步骤如下:……(此处省略具体合成步骤,根据实际情况补充)2. 抗肿瘤活性实验(1)体外实验:采用MTT法,测定新型熊果酸衍生物对多种肿瘤细胞的抑制作用。
(2)体内实验:建立肿瘤动物模型,观察新型熊果酸衍生物对肿瘤生长的抑制作用及对动物体重的影响。
三、结果与分析1. 合成结果通过化学合成技术,成功制备了多种新型熊果酸衍生物。
其结构经红外光谱、核磁共振等手段进行表征,确认了其化学结构。
2. 抗肿瘤活性结果(1)体外实验结果:新型熊果酸衍生物对多种肿瘤细胞表现出显著的抑制作用,其抑制率与药物浓度呈正相关。
与熊果酸相比,新型衍生物的抑制作用更为显著。
(2)体内实验结果:建立肿瘤动物模型后,给予新型熊果酸衍生物治疗,发现其对肿瘤生长具有明显的抑制作用,同时对动物体重无明显影响。
与对照组相比,治疗组动物的生存期得以延长。
3. 结果分析新型熊果酸衍生物的抗肿瘤活性可能与其分子结构、药物代谢等方面有关。
首先,引入的取代基团可能影响了药物的溶解度、亲脂性等物理化学性质,从而影响了药物与肿瘤细胞的相互作用。
其次,新型熊果酸衍生物在体内的代谢过程可能产生了具有抗肿瘤活性的代谢产物,从而增强了其抗肿瘤作用。
熊果酸的研究进展

熊果酸的研究进展
孟艳秋;陈瑜;王趱;刘丹
【期刊名称】《中国新药杂志》
【年(卷),期】2007(16)1
【摘要】熊果酸是存在于植物中的一种三萜类化合物,具有抗肿瘤、抗菌、降血脂等药理作用,现综合国内外文献报道,对熊果酸提取分离方法和含量测定及药理作用等方面进行综述.熊果酸具有广阔的应用前景,亟待开发.
【总页数】4页(P25-28)
【作者】孟艳秋;陈瑜;王趱;刘丹
【作者单位】沈阳化工学院制药工程教研室,沈阳,110142;沈阳化工学院制药工程教研室,沈阳,110142;沈阳化工学院制药工程教研室,沈阳,110142;沈阳化工学院制药工程教研室,沈阳,110142
【正文语种】中文
【中图分类】R284.1;R979.1
【相关文献】
1.熊果酸抑制肝纤维化的研究进展 [J], 江家鹏;黄菊芳;张扬武
2.齐墩果酸和熊果酸的测定方法与药理作用研究进展 [J], 李美雎;卢婷;赵建云;张俊焱;刘力宽;李锦萍
3.齐墩果酸和熊果酸调血脂、抗肥胖药理作用研究进展 [J], 刘晓娟;孙福佳;宋艳玲;刘海洋
4.熊果酸对代谢综合征的作用研究进展 [J], 马素丽;刘冉;王继红
5.熊果酸美白功能性研究进展 [J], 刘亚男;许有瑞
因版权原因,仅展示原文概要,查看原文内容请购买。
熊果酸衍生物的合成与表征及其抑菌活性研究

熊果酸衍生物的合成与表征及其抑菌活性研究赵龙铉;杨君微;郑昌吉;唐尧;王志伟;赵春晖【摘要】Ursolic acid belongs to pentacyclic triterpenoid of natural products. It widely distributed in nature and showed many bioactivities such as hepatoprotective, anti-inflammatory, anti-cancer activity, antiviral pharmacological. In order to develop novel ursolic acid derivatives with high efficiency, low toxicity, we take the natural product ursolic acid which with biological activity as the lead compound for modifying their structures. In this paper, ten novel ursolic acid derivatives were designed and synthesized through modification at C-28 of ursolic acid and introducing amino acid at C-3. Structures of all target compounds were confirmed by1H NMR, IR and HRMS. These compounds were tested antibacterial activity, which were Staphylococcus aureus, Methicillin-resistant staphylococcus aureus, Quinolone staphylococcus aureus cultured on MHB and E. Coli were cultured on BHI. The results showed that their anti-bacterial activities for Staphylococcus aureus, Methicillin-resistant staphylococcus aureus, Quinolone-resistant staphylococcus aureus were improved compared to ursolic acid.%熊果酸属于五环三萜类配合物,在自然界中分布广泛,并显示出多种生物活性,如保肝、抗炎、抗病毒、抗癌等多种药理作用.为寻找高效、低毒的熊果酸衍生物,以具有一定生物活性的熊果酸为先导配合物,通过对其C-28位进行结构修饰及C-3位引入氨基酸,共设计合成了10种未见报道的熊果酸衍生物.目标配合物的结构经1 H NMR、IR和HRMS表征确证,并以其对培养于高铁血红蛋白的金黄色葡萄球菌、耐甲氧西林金黄色葡萄球菌、耐喹诺酮金黄色葡萄球菌和培养于脑心浸液培养基中的大肠杆菌进行抑菌活性测试.结果表明,经修饰后的熊果酸衍生物对金黄色葡萄球菌、耐甲氧西林金黄色葡萄球菌、耐喹诺酮金黄色葡萄球菌的抗菌活性较母体配合物有不同程度的提升.【期刊名称】《辽宁师范大学学报(自然科学版)》【年(卷),期】2012(035)003【总页数】6页(P358-363)【关键词】熊果酸;衍生物;合成;表征;抑菌活性;氨基酸【作者】赵龙铉;杨君微;郑昌吉;唐尧;王志伟;赵春晖【作者单位】辽宁师范大学化学化工学院,辽宁大连116029;辽宁师范大学化学化工学院,辽宁大连116029;延边大学长白山生物资源与功能分子教育部重点实验室,吉林延吉133002;辽宁师范大学化学化工学院,辽宁大连116029;辽宁师范大学化学化工学院,辽宁大连116029;辽宁师范大学生命科学学院,辽宁大连116029【正文语种】中文【中图分类】O624.33熊果酸(ursolic acid,UA)属于五环三萜类配合物,主要存在于杜鹃科植物熊果,木樨科植物女贞叶,玄参科植物毛泡桐叶,冬青科冬青属铁冬青的叶,蔷薇科植物枇杷叶,唇形科植物夏枯草等中.研究显示,UA 具有抗癌[1]、抗炎[2-4]、抗病毒[5]、保肝[6-7]、抑菌[8-9]、降糖[10]、抗疟[11-13]等多种药理作用.UA的急性、亚急性毒性实验表明,UA毒性低[14],服用安全[15],已经广泛应用于医药及化妆品行业.虽然UA药用开发前景广阔,但是对UA及其衍生物的构效关系的研究报道较少.为了进一步研究UA的构效关系,我们以UA为起始物,根据活性结构拼接原理,在C-3位引入氨基酸,设计合成了一系列UA衍生物.并对金黄色葡萄球菌(Staphylococcus aureus 4220)株、金黄色葡萄球菌(Staphylococcus aureus 209)株、耐甲氧西林金黄色葡萄球菌(Methicillin-resistant staphylococcus aureus 3506)株、耐甲氧西林金黄色葡萄球菌(Methicillin-resistant staphylococcus aureus 3167)株、耐喹诺酮金黄色葡萄球菌(Quinolone-resistant staphylococcus aureus 3505)株、耐喹诺酮金黄色葡萄球菌(Quinolone-resistant staphylococcus aureus 3519)株、大肠杆菌(E.coli 1682)株、大肠杆菌(E.coli 1356)株8种菌种进行了抑菌活性测试.合成路线如图1所示.1 实验部分1.1 主要仪器和试剂WGH-30双光束红外分光光度计(中国天津港东公司),KBr压片;Varian-400Hz核磁共振仪(美国 Varian公司)和Bruker-500Hz核磁共振仪(瑞士Bruker公司),CDCl3,DMSO-d6为溶剂;GC-TOF型质谱仪(英国Micromass公司);X-5显微熔点测定仪(控温型),温度未经校正;Sunrise酶标仪(奥地利Tecan公司).所用的试剂均为国产分析纯或化学纯.细胞株:金黄色葡萄球菌(Staphylococcus aureus)株和大肠杆菌(E.coli)株[来自Korean Collection for Type Cultures(KCTC,Daejeon,Korea)];耐甲氧西林金黄色葡萄球菌(Methicillin-resistant staphylococcus aureus)株和耐喹诺酮金黄色葡萄球菌(Quinolone-resistant staphylococcus aureus)株[来自Culture Collection of Antimi-crobial Resistant Microbes(CCARM,Seoul,Korea)].图1 熊果酸衍生物的合成Fig.1 Synthesis of ursolic acid derivatives试剂和条件:(i)CH3I,K2CO3,DMF;(ii)R1OH,DMAP,EDCI,CH2Cl2;(iii)Et2NH,CH2Cl2or TFA,CH2Cl21.2 3-羟基熊果烷-12-烯-28-羧酸甲酯(U-1)的合成与表征将 UA(10g,21.90mmol)溶于 N,N-二甲基甲酰胺(100mL)中,加入无水碳酸钾(7.56g,57.75mmol)搅拌,向其中慢慢滴加2.74mL(43.80mmol)碘甲烷.室温搅拌6h.用乙酸乙酯提取反应混合物,有机相依次用水和饱和氯化钠溶液洗涤.分出有机相,用无水硫酸镁干燥.经过滤、减压蒸馏后得浅黄色固体.再用乙酸乙酯/石油醚(V∶V=1∶5)作洗脱剂进行加压柱层析得白色粉末U-1.产率:95.1%,mp 170~172.5℃;1 H NMR(400MHz,CDCl3):5.25(t,1H,J =3.6Hz,H-12),3.60(s,3H,-OCH3),3.20(dd,1H,J=10.4Hz,5.2Hz,H-3),2.22(d,1H,J=11.2Hz,H-18),0.93(d,3H,J =6.4Hz),0.85(d,3H,J =6.4Hz),1.13,1.06,1.00,0.92,0.78,0.73(s,each 3H);IR(KBr):3 455,2 920,1 720,1 457cm-1.1.3 3-O-(N-芴甲氧羰基)-苯丙氨酰基熊果酸甲酯(U-2a)的合成与表征将U-1(174mg,0.37mmol)、Fmoc-phe-OH(175mg,0.45mmol)、DMAP(55mg,0.45mmol)和CH2Cl2(5mL)依次加入100mL圆底烧瓶中,将反应液冷却至0℃,再将EDCI(86mg,0.45mmol)溶于CH2Cl2(3mL)中,在搅拌下逐滴加入反应瓶中,滴加完毕后再在0℃下搅拌5min,室温搅拌1h,反应完毕后,用CH2Cl2提取,并用水和饱和NaCl溶液洗涤,有机相用无水硫酸镁干燥,过滤,减压蒸馏除去溶剂得粗产物,再用乙酸乙酯/石油醚(V∶V=1∶10)作洗脱剂进行加压柱层析,分离得到白色固体91mg.产率:49.3%,mp 171~172.3 ℃;1 H NMR(500MHz,CDCl3):7.76 (d,2H,J=7.6Hz,Fluorenyl H-4,H-5),7.53(d,2H,J=7.7Hz,Fluorenyl H-1,H-8),Fluorenyl H-2,H-7),7.28~7.17(m,5H,Ph-),5.67(t,1H,J=3.4Hz,H-12),5.18(d,1H,J=8.5Hz,NH),4.66(dd,1H,J=6.4Hz,14.4Hz,N-CH-CO),4.53(dd,1H,J=11.1Hz,3.6Hz,H-3),4.40-4.27(m,2H,CH2OCO-N),4.18(t,1H,J =7.1Hz,OCH2-CH),3.60(s,3H,OCH3),3.22-3.04(m,2H,Ph-CH2),2.24(d,1H,J =11.3Hz,H-18),1.08,0.95,0.93,0.87,0.86,0.81,0.75(s,each3H);IR(KBr):3 440,2 952,2 716,1 728,1 510,1 452cm-1.1.4 3-O-(N-芴甲氧羰基)-亮氨酰基熊果酸甲酯(U-2b)的合成与表征以U-1及Fmoc-Leu-OH 为反应物,按照合成 U-2a的方法合成白色粉末 U -2b.产率:41.3%,mp 150.5~152.6℃;1 H NMR(500MHz,CDCl3):7.76(d,2H,J=7.6Hz,Fluorenyl H-4,H-5),7.59(d,2H,J=7.4Hz,Fluorenyl H-1,H-8),7.40(t,2H,J=7.3Hz,Fluorenyl H-3,H-6),7.31(t,2H,J=7.5Hz,Fluorenyl H-2,H-7),5.25(t,1H,J=3.5Hz,H-12),5.15(d,1H,J=8.8Hz,NH),4.54(dd,1H,J=10.1、8.2Hz,H-3),4.22(t,1H,J=7.1Hz,OCH2-CH),4.12(dd,1H,J=14.3Hz,7.2Hz,CHCO),3.60(s,3H,OCH3),1.08,0.95,0.93,0.87,0.86,0.81,0.75(s,each 3H);IR(KBr):3 404,3 336,2 956,2 876,1 732,1 602,1 458cm-1.1.5 3-O-(N-芴甲氧羰基)-甘氨酰基熊果酸甲酯(U-2c)的合成以U-1及Fmoc-Gly-OH 为反应物,按照合成 U-2a的方法合成 U-2c白色粉末.产率:49.3%,mp 180~181.7℃;1 H NMR(500MHz,CDCl3):7.76(d,2H,J=7.6Hz,Fluorenyl H-4,H-5),7.60(d,2H,J=7.4Hz,Fluorenyl H-1,H-8),7.40(t,2H,J =7.5Hz,Fluorenyl H-3,H-6),H-12),5.28(d,1H,J=8.7Hz,NH),4.59(dd,1H,J=8.6、7.0Hz,H-3),4.40(d,1H,J=7.2Hz,N-CH2-CO),4.24(t,1H,J=7.0Hz,OCH2-CH),3.99(d,2H,J=5.3Hz,CH2OCO-N),3.61(s,3H,OCH3),1.08,0.95,0.93,0.87,0.86,0.81,0.75(s,each 3H);IR (KBr):3 400,2 872,2 948,1 734,1 510,1 450cm-1.1.6 3-O-(N-芴甲氧羰基)-丙氨酰基熊果酸甲酯(U-2d)的合成与表征以U-1及Fmoc-Ala-OH为反应物,按照 U-2a的合成方法合成 U-2d白色粉末.产率:48.8%,mp 162~163.3℃;1 H NMR(500MHz,CDCl3):7.76(d,2H,J=7.6Hz,Fluorenyl H-4,H-5),7.60(d,2H,J=7.4Hz,Fluorenyl H-1,H-8),7.40(t,2H,J=7.5Hz,Fluorenyl H-3,H-6),7.31(t,2H,J=7.5Hz,Fluorenyl H-2,H-7),5.38(d,1H,J=7.4Hz,NH),5.25(t,1H,J=3.5Hz,H-12),4.57(t,1H,J=7.3Hz,H-3),4.21~4.39(m,1H,N-CH-CO),4.39(d,2H,J=7.0Hz,CH2OCO-N),4.23(t,1H,J=7.1Hz,OCH2-CH),3.61(s,3H,OCH3),2.24(d,1H,J=11.1Hz,H-18),1.08,0.95,0.93,0.87,0.86,0.81,0.75(s,each 3H);IR(KBr):3 390,3 370,2 920,2 860,1 605,1540cm-1.1.7 3-O-(N-叔丁氧羰基)-缬氨酰基熊果酸甲酯(U-2e)的合成与表征以U-1及Boc-Val-OH等为原料,按照合成U-2a的方法合成U-2e白色粉末.产率:40.3%,mp 228.1~229.9℃;1 H NMR(500MHz,CDCl3):5.24(t,1H,J=3.5Hz,H-12),4.99(d,1H,J=9.0Hz,NH),4.53(1H,H-3),4.12(dd,1H,J=14.0、7.0Hz,N-CH-CO),3.60(s,3H,OCH3),2.23(d,1H,J=11.45Hz,H-18),1.44(s,9H,-CH3×3),0.97(d,3H,J=6.9Hz,CH3CH),0.88(d,3H,J=8.7Hz,CH3CH),1.07,0.96,0.87,0.75(s,each 3H);IR(KBr):3 452,2 976,2 928,1 726,1 498,1 458cm-1.1.8 3-O-苯丙氨酰基熊果酸甲酯(U-3a)的合成与表征将U-2a(120mg,0.143mmol)、二乙胺(3mL)、CH2Cl2(3mL)加入100mL圆底烧瓶中,在常温下搅拌2h,反应完毕后,减压蒸馏除去溶剂,再用乙酸乙酯/石油醚(V∶V=2∶1)作洗脱剂进行加压柱层析,分离得到白色粉末状固体76mg.产率:86.1%,mp 59.4~59.9℃;1 H NMR (500MHz,CDCl3):7.31~7.21(m,5H,Ph-),5.25(t,1H,J=3.5Hz,H-12),4.54(dd,1H,J=10.1Hz,4.9Hz,H-3),4.4-4.27(m,2H,CH2OCO-N),4.18(t,1H,J=7.1Hz,OCH2-CH),3.60(s,3H,OCH3),3.22~3.04(m,2H,Ph-CH2),2.24(d,1H,J=11.3Hz,H-18),1.08,0.95,0.93,0.87,0.86,0.81,0.75(s,each 3H);IR(KBr):3 392,3 436,1 732,1 606,1 456cm-1.HRMS calcd for C40H59NO4617.900 8,found 617.900 9.1.9 3-O-亮氨酰基熊果酸甲酯(U-3b)的合成与表征按照U-3a的合成方法打掉氨基保护基得到白色粉末 U-3b.产率:75.0%,mp 44.6~46.2℃;1 H NMR(500MHz,CDCl3):5.24(t,1H,J=3.6Hz,H-12),4.52(dd,1H,J=10.1Hz,8.2Hz,H-3),3.60(s,3H,OCH3),3.44(dd,1H,J=8.8、5.5Hz,N-CH-CO),2.22(d,1H,J=11.2Hz,H-18),1.08,0.95,0.93,0.87,0.86,0.81,0.75(s,each 3H);IR (KBr):3 360,2 956,2 872,1 732,1 516,1 452cm-1.HRMS calcdfor C37H61NO4583.884 5,found 583.884 4.1.10 3-O-甘氨酰基熊果酸甲酯(U-3c)的合成与表征按照U-3a的合成方法打掉氨基保护基得到白色粉末 U-3c.产率:72.3%,mp 69.0~71.5℃;1 H NMR(500MHz,CDCl3):5.24(t,1H,J=3.6Hz,H-12),4.56(dd,1H,J=8.6Hz,7.0Hz,H-3),3.60(s,3H,OCH3),3.43(s,2H,N-CH2-CO),2.23(d,1H,J=11.2Hz,H-18),1.06,0.95,0.93,0.87,0.86,0.81,0.75(s,each 3H);IR(KBr):3 408,3 350,2 936,2 876,1 730,1 616,1 542,1 466cm-1.HRMS calcd forC33H53NO4527.778 2,found 527.778 3.1.11 3-O-丙氨酰基熊果酸甲酯(U-3d)的合成与表征按照U-3a的合成方法打掉氨基保护基得到白色粉末 U-3d.产率:59.3%,mp 120.4~122.0℃;1 H NMR(500MHz,CDCl3):5.24(t,1H,J=3.6Hz,H-12),4.56(dd,1H,J=8.0、6.4Hz,H-3),3.60(s,3H,OCH3),1.36(t,3H,J=7.0Hz,CH3-CH-NH2),1.06,0.95,0.93,0.87,0.86,0.81,0.75(s,each 3H);IR(KBr):3 380,3 270,2 936,2 876,1 734,1 460cm-1.HRMS calcd for C34H55NO4541.413 1,found 541.413 0.1.12 3-O-缬氨酰基熊果酸甲酯(U-3e)的合成与表征将U-2e(140mg,0.208mmol)溶于CH2Cl2(3mL)中,在冰浴条件下搅拌,逐滴加入 TFA(2mL),再在室温下搅拌2h.反应完毕后,减压蒸馏除去溶剂,剩余液体用氨水中和至碱性,然后用CH2Cl2提取,用水和饱和NaCl洗涤,有机层用无水硫酸镁干燥,用乙酸乙酯/石油醚(V∶V=2∶1)作洗脱剂进行加压柱层析,分离得到白色粉末状固体86mg.产率:72.3%,mp 125.0~126.2℃;1 H NMR (500MHz,CDCl3):5.24(t,1H,J=3.6Hz,H-12),4.56(dd,1H,J=10.9、4.9Hz,H-3),3.60(s,3H,OCH3),3.29(d,1H,J=4.5Hz,N-CH-CO),2.23(d,1H,J=11.2Hz,H-18),1.01(d,3H,J=6.9Hz,CH3CH),0.94(s,6H,CH3×2),0.91(d,3H,J =5.8Hz,CH3CH),1.07,0.88,0.87,0.85,0.75(s,each 3H);IR(KBr):3 396,3 340,2 948,2 880,1 734,1 596,1 454,1 432cm-1.HRMS calcd for C36H59NO4569.8580,found 569.8581.1.13 抗菌活性将培养于 MHB的 S.a 4220、S.a 209、MRSA 3167、MRSA 3506、QRSA 3505、QRSA 3519和培养于BHI中的E.coli 1356、E.coli 1682用培养液稀释1 000倍,然后将稀释后的菌种分别均匀接种于8个96孔微滴定板上,放回培养仪器中,恒温(37℃)培养24h后,向96孔微滴定板上分别加入0.05% 的待测试样品的DMSO溶液.继续培养24h,通过酶联免疫吸收测定仪检测吸光度,进而求得配合物的最小抑菌浓度.作为对照实验,我们采用同样的方法对UA、苯唑西林(oxacillin,Sigma)和诺氟沙星(norfloxacin,Sigma)做了以上活性测试. 表1 实验用菌种及菌种培养条件Table 1 Experimental strains and culture conditions培养条件高铁血红蛋白培养,温度37℃WHB脑心浸液培养,温度37℃BHI菌种名称金黄色葡萄球菌4220金黄色葡萄球菌209耐甲氧西林金黄色葡萄球菌3506耐甲氧西林金黄色葡萄球菌3167耐喹诺酮金黄色葡萄球菌3505耐喹诺酮金黄色葡萄球菌3519大肠杆菌1682大肠杆菌1356在对8种菌种的抑菌活性测试表明,配合物U-3d对S.a 4220、S.a 209、MRSA 3167、MRSA 3506、QRSA 3505、QRSA 3519六种菌种的抑制作用明显优于先导配合物UA(见表2);配合物对E.coli 1682、E.coli 1356两种菌种的抑制作用均大于64μg/mL;配合物对MRSA 3167、MRSA 3506的抑制作用明显大于oxacillin,对MRSA 3167的抑制作用大于norfloxacin.表2 目标配合物的抑制作用Table 2 Inhibition effect of the target compounds最小抑菌浓度 MIC/(g/mL)64 U-2a >64 >64 >64 >64 >64 >64 >64 >64 U-2b >64 >64 >64 >64 >64 >64 >64 >64 U-2c>64 >64 >64 >64 >64 >64 >64 >64 U-2d >64 >64 >64 >64 >64 >64 >64 >64 U-2e >64 >64 >64 >64 >64 >64 >64 >64 U-3a >64 >64 >64 >64 >64 >64 >64 >64 U-3b >64 >64 >64 >64 >64 >64 >64 >64 U-3c >64 >64 >64 >64 >64 >64 >64 >64 U-3d 4 4 4 4 4 4 >64 >64 U-3e >64 >64 >64 >64 >64 >64 >64 >64 oxacillin 0.25 0.25 500 500 0.5 0.5 0.12 64菌种样品 S.a S.a MRSA MRSA QRSA QRSA E.coli E.coli 4220 209 3167 3506 3505 3519 1682 1356 UA 32 32 32 32 32 32 >64 >norfloxacin 1 0.25 8 1 250 125 8 162 结论笔者通过对UA的结构修饰和改造,共合成了10个UA的氨基酸衍生物.对所合成的衍生物已通过1 H NMR、IR和HRMS进行确证,配合物1 H NMR谱呈现出正常的耦合裂分,IR谱也呈现出官能团的特征吸收峰.UA具有一定的抑菌活性,经过与氨基酸的拼合,有望起到协同作用,并提高其抑菌活性.本文的抑菌活性结果表明,在所合成的配合物中U-3d对S.a 4220、S.a 209、MRSA 3167、MRSA 3506、QRSA 3505、QRSA 3519六种菌种的抑制作用明显,较母体配合物 UA的抑菌效果好,对MRSA 3167、MRSA 3506的抑制作用明显大于oxacillin,对MRSA 3167的抑制作用大于norfloxacin.由此可知,当UA连接脂肪族的氨基酸时,其活性与连接芳香族的氨基酸相比,活性更高.以上结果为五环三萜类配合物的结构修饰以及对此类配合物进一步开发提供了科学参考.参考文献:[1] MA C,NAKAMURA N,HATTORI M.Chemical modification of oleanane type triterpenes and their inhibitory activity HIV-1 protease dimerization[J].Chem Pharm Bull,2000,48(11):1681-1688. [2] SOHN K H,LEE H Y,CHUNG H Y,et al.Antiangiogenesis activity oftriterpene acids[J].Cancer Lett,1995,94(2):213-217.[3] MIURA N,MATSUMOTO Y,MIYAIRI S,et al.Protective effects of triterpene compounds against the cytotoxicity of cadmium in HepG2Cells [J].Mol Pharmacol,1999,56(6):1324-1328.[4] JEONG H G.Inhibition of cytochrome P450 2El expression by oleanolic acid:hepatoprotective effects against carbon tetrachlorideinduced hepatic injury[J].Toxicol Lett,1999,105(3):215-222.[5]陈国宝,陈宝田.番石榴叶提取物体外抗轮状病毒的实验研究[J].中国医药报,2002,17(8):502-504.[6]马学惠,赵元昌,尹镭,等.乌索酸对实验性肝损伤的防治作用[J].药学学报,1986,21(5):332-335.[7]樊明文,王茜,边专,等.熊果酸对人舌鳞癌细胞株TSCCa的抑制作用及其机制探讨[J].武汉大学学报:医学版,2004,25(1):1-3.[8] ACHIWA Y,HASEGAWA K,KOMIYA T,et al.Ursolic acid induces bax-dependent apoptosis through the caspase-3pathway in endometrial cancer SNG-II cells[J].Oncol Rep,2005,13:51-57.[9]赵龙铉,赵德千,郑昌吉,等.熊果烷-12-烯-2β,3α-二醇-28β-酸的合成与表征及抗菌活性的研究[J].辽宁师范大学学报:自然科学版,2010,33(1):82-85.[10] YOSHIKAWA M,MATSUDA H.Antidiabetogenic activity of oleanolic acid glycosides from medicinal foodstuffs[J].Bio Factors,2000,13:231-237.[11] TRAORE K F,GASQUET M,GIORGIO C D,et al.Antimalalarialactivity of four plants used in traditional medicine in mail[J].Phytother Res,2000,14(1):45-47.[12] STEELE J C P,WARHURST D C,KIRBY G C,et al.In vitro and in vivo evaluaiton of betulinic acid as an antimalarial[J].Phytother Res,1999,13(2):115-119.[13] KAWAGUCHI N,SHIMADA S,KOSHIMIZU K,et al.Remedy for pancreatitis.Janpan-patent:application number 02-083037[P].1991-12-18.[14]熊筱娟,陈武,李开泉,等.乌索酸毒性实验研究[J].宜春医专学报,2001,13(1):54.[15]李开泉,陈武,熊筱娟,等.乌索酸的化学、药理及临床应用进展[J].中成药,2002,24(9):709-711.。
熊果酸的研究进展

作者:肖坤福郑云法刘成左张春牛【关键词】熊果酸;,,,检测方法;,,,提取方法;,,,动物实验;,,,临床研究熊果酸是广泛存在于白花蛇舌草、女贞子、乌梅、夏枯草等天然植物中的一种五环三萜类化合物,有研究表明熊果酸具有镇静、抗炎、抗菌、抗糖尿病、降血糖等多种生物学效应,早在1996年,日本学者神藏美枝子等人从杜鹃花科越桔属植物越桔叶中提取了具有较高熊果酸浓度的熊果酸产品,产品中除含有25%的熊果酸外,尚含有大量的熊果酸衍生物、熊果苷和其它三萜类化合物等,具有多种活性成分,用于增强机体免疫力、预防心血管系统疾病、稳定肝功能等。
现在人们对其研究越来越多,并在很多方面取得了可喜的研究进展。
1 提取方法对三萜类化合物的分离提纯是其研究起点,没有较好的提取工艺,就更谈不上对其进一步研究。
近年来,许多科研工作者在这方面做出了突出的贡献。
有些科研工作者[1~5],通过正交实验确定85%~95%的乙醇提取熊果酸效果最佳。
崔星明等[6]采用超临界流体萃取得到的芦笋提取物,用甲醇溶解,采用液相色谱-质谱联用仪检测,得到了56个组分。
发现有保留时间和熊果酸基本一致的峰。
其质谱分子离子峰和特征碎片峰都与熊果酸的一致,确定该化合物为熊果酸。
2 检测方法在检测方法方面,有不少科研工作者对其进行了较深入的研究。
熊慧敏[7]全面地论证了薄层层析-双波长扫描法测定大山楂咀嚼片中熊果酸含量的检测限的线性范围可行性,并考查了此方法的测定熊果酸的稳定性和重复性,从而证明薄层层析-双波长扫描法测定熊果酸精密度、稳定性、重现性、回收率均都达有关规定的要求,本方法操作简单方便,结果可靠,可作为检验产品质量的一个快速而实用的定量方法。
朱玉琴等[8]在采用薄层扫描检测保驾胶囊中熊果酸的含量时首次对显色剂进行了改进,并验证了醋酸-浓硫酸 (9∶1)比10%硫酸乙醇显色要好,检测限低等优点。
与此同时,杨云等[9]在采用薄层层析检测牙周康泰胶囊熊果酸的含量验证了10%磷钼酸乙醇液比10%硫酸乙醇显色要好。
熊果酸衍生物在制备治疗神经系统疾病药物中的应用[发明专利]
![熊果酸衍生物在制备治疗神经系统疾病药物中的应用[发明专利]](https://img.taocdn.com/s3/m/6ff01905cdbff121dd36a32d7375a417866fc129.png)
专利名称:熊果酸衍生物在制备治疗神经系统疾病药物中的应用
专利类型:发明专利
发明人:陈广通,陆游佳,徐天怡,储呈娇,宋开南,宋妍
申请号:CN202110416785.0
申请日:20210419
公开号:CN113101293B
公开日:
20220201
专利内容由知识产权出版社提供
摘要:本发明属于医药领域,公开了一类熊果酸衍生物在制备治疗神经系统疾病药物中的应用。
本发明利用微生物转化技术,对熊果酸成功地进行了结构修饰,获得了4个具有母核结构修饰的新型的化合物,通过体外神经细胞损伤保护试验和神经小胶质细胞炎症试验证实,这些化合物具有较好的神经细胞保护活性和抗神经炎症活性,可以作为治疗神经退行性疾病、创伤性脑损伤、中风药物的活性成分,具有广泛的用途。
申请人:南通大学
地址:226019 江苏省南通市啬园路9号
国籍:CN
更多信息请下载全文后查看。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【 文 献 标识 码] A
[ 文 章编 号] 1 6 7 3 — 7 2 1 0 ( 2 0 1 3 ) 0 9 ( c ) 一 0 0 3 3 — 0 4
S t u d y d e v e l o p e me n t 0 f d o me s t i c p a t e n t s t a t u s q u o 0 f u r s o l i c a c i d d e r i v a t i v e s
针 对 熊 果 酸 衍 生 物 结 构 改 进 的 专 利 申请 热 点 主 要 集
树 脂 醇 型 五 环 三 萜 类 化合 物 ( 图1 ) , 是 一 种具 有较 好 生 物
活性 的天然 产 物 。 1 9 9 6年 , 日本学 者 神藏 美 枝 子等 人从 杜
中在 2 一 位、 3 一 位、 2 3位 、 2 8 一 位 、针对 这 些位 置 使用 不 同 的 基 团取 代 可 以获 得具 有 不 同药 物 活性 的化合 物 , 其 中绝 大 部 分结 构修 饰 为对 C 3 一 位羟 基 和 ( 或) C 2 8 一 位 羧基 的改造 , 而 有关 其他 位 置改 造 的专 利 申请量 相对 较 少 。 下 面按 照 国
内专 利 申请 中雄 果 酸 结 构修 饰 位 置 不 同导 致 活性 的差 异
进行 分 类介 绍 。 1在 C 3 一 位 和 C2 8 一 位 进 行 修 饰
1 . 1对 C一 3位 酰 氧 化 . C- 2 8位 酰 胺 化
[ Ke y w o r d s ]U r s o l i c a c i d d e r i v a t i v e ; A n t i — t u mo r ; P a t e n t
熊果酸( u r s o l i c a c i 属 于 一 香
『 Ab s t r a c t 1 U r s o l i c a c i d d e i r v a t i v e s h a v e b e e n t h e r e s e a r c h f o C U S o f a n t i — t u mo r d r u g s f o r t h e c a p a b i l i t y o f i n h i b i t i o n o n
t h e p r o l i f e r a t i o n o f a v a r i e t y o f t u mo r c e l l wi t h l o w c y t o t o x i t y .Ba s e d O i l t h e s e a r c h r e s u l t o f CNP AT .t h e r e l a t i o n s h i p
b e t we e n s t r u c t u r e mo d i ie f d u r s o l i c a c i d d e r i v a t i v e s a n d t h e i r a c t i v i t i e s a r e i n t r o d u e e d a n d a n a l y z e d b y t h i s P a D e r .
鹃花 科 越 桔 属 植 物越 桔 ( V a c c i n i c u m v i t i s — i d a c a L . ) 叶 中提
取 了具 有较 高 熊 果 酸浓 度 的 熊果 酸产 品 , 其 中实 际 上 只含 有 2 5 %的 熊果 酸 。 随着 对 熊 果 酸研 究 的 深入 , 已证 实熊 果 酸 能 在 体 内外 抑 制 多种 肿 瘤 细胞 生 长 , 并且 对 正 常 细胞 毒 性较低 , 同时, 熊 果 酸还 具 有 抗 氧化 、 抗炎 、 抑制 H I V、 降血 糖、 护 肝等生 物活 性l 1 l , 已成为 近期 国内外研 究开 发 的热点 。
X / A F e n g j u a n ‘ 1 l N Y i n g ‘
P a t e n t E x a mi n a t i o n C o o p e r a t i o n C e n t e r o f t h e P a t e n t O me e o f S I P O . B e i j i n g 1 0 0 0 8 3 . C h i n a
内专 利 申请 中熊 果酸 衍 生物 主要结 构 修饰 位 置及 其 活 性 ,并 结合 目前 国 内雄 果酸 衍 生物 相 关专 利 申请 的现状
给 出 了今 后专 利 申请 的 建议 。
『 关 键 词 1熊 果 酸 衍 生 物 ; 抗肿瘤; 专 利
[ 中 图分 类号】 R 2 8 4
2 0 1 3 年 9 月 第 1 0 卷 第 2 7 期
・ 综
述 ・
国 内熊果酸衍 生物相 关专利结构修饰 技术 的 研 究 进 展
夏 凤 娟 金 英
国家 知识 产 权 局专 利 局专 利 审查 协 作北 京 中心 , 北 京 1 0 0 0 8 3
[ 摘要】熊果 酸 衍生 物 可抑 制 多 种 肿瘤 细 胞 的生 长 , 并 因其 细 胞低 毒 性 而 日益 成 为抗 肿瘤 药 物领 域 的研 究 热 点 。 本文 对 通 过 中 国专利 数 据库 进 行检 索 获得 的熊果 酸 衍 生 物在 中国 的相 关专 利 申请 进 行 了分 析 ,总 结 了 目前 国
