电位分析及离子选择电极.
化学实验中的常见电化学分析方法

化学实验中的常见电化学分析方法电化学分析是一种常见的化学分析方法,通过应用电化学原理,利用电流、电势、电解质溶液等参数来进行物质的检测和分析。
它能够快速、灵敏地检测出微量物质,并且具有较高的准确性和重现性。
本文将介绍几种在实验室中常见的电化学分析方法。
一、电解电位法电解电位法是最常见的电化学分析方法之一,它通过测量电极在电解质溶液中产生的电位变化来分析物质。
在实验中,通常采用参比电极和工作电极的组合,参比电极用于提供一个标准的电势参考,而工作电极用于与待测物质发生反应。
主要包括极谱法、库仑分析法和电势滴定法等。
1. 极谱法极谱法是通过控制电解质溶液中的电流,测量电极的电势变化来分析物质。
常见的极谱法包括阳极极谱和阴极极谱。
阳极极谱常用于有机化合物的分析,如药物、农药等,而阴极极谱常用于金属、合金等无机物质的分析。
2. 库仑分析法库仑分析法是通过测量电解质溶液中的电流大小和时间,计算出反应物质的含量。
它常用于分析氧化还原反应、电沉积和电解等过程中的物质。
3. 电势滴定法电势滴定法是利用电解电位的变化来进行滴定分析的方法。
它常用于测定银离子、溶氧量、氟离子等物质的含量。
二、电化学传感器法电化学传感器法是基于电化学原理的一种常见的快速检测方法,它通过改变电极电位来检测待测物质。
电化学传感器的结构一般由工作电极、参比电极和引用电极(或对电极)组成。
1. 离子选择电极离子选择电极通过选择性地与某种特定离子发生反应,从而改变电极电位来检测离子的浓度。
常见的离子选择电极包括氢离子选择电极、钠离子选择电极等。
2. 气体传感器气体传感器是使用气敏电极或半导体电极来检测气体成分的一种电化学分析方法。
它广泛应用于环境监测、工业安全等领域,能够快速、灵敏地检测气体的浓度。
三、电化学阻抗法电化学阻抗法是通过测量电化学电路中的阻抗变化来分析物质。
它主要用于表征电极界面的电化学过程,包括界面电容、界面电导、界面电阻等参数。
电化学阻抗法常用于金属腐蚀、电池性能评价、涂层质量检测等领域。
电位分析法(离子选择性电极)

参比电极 Ag/AgCl参比电极 电极套管 0.1mol/LNH4Cl溶液 溶液 透气膜
气敏氨电极结构示意图
以Ca 2+离子选择性电极为例
液膜 二癸基磷酸钙的苯基磷
酸二辛酯溶液
内 参 比 溶 液
Ca2+
| | | |
CaR | | | | | | ++++ +
Ca2+ 待 测 溶 液
++++++
X-
X-
带电荷流动载体膜作用示意图 X- 非响应离子 R 载体 CaR 离子型 缔合物
气敏电极
pH玻璃电极 玻璃电极
电位分析法
RT aM,内 RT aM,外 膜电位的产生ln 若敏感膜仅对阳离子 n+有选 若敏感膜仅对阳离子M ln E道 ,内 = k 2 + E道 ,外 = k1 + nF 择性相应 a′ ,内 nF a′ ,外 M M
E道内 E扩内 E扩外 E道外 内参 比溶 液
a内 a内/
待测 溶液 膜
a外/ a外
晶体膜电极 以F-选择性电极为例
内参比电极 Ag-AgCl
塑料管 内参比溶液 NaF-NaCl
RT EF = k − ln a F − 掺EuF 的LaF 单晶片 F F 电极电极结构示意图 = k − 0.059 lg a F −
2 3 −
流动载体电极: 流动载体电极:
• 其关键部分 是液体敏感 膜,它由三 部分组成: 部分组成: 载体 有机溶剂 惰性微孔膜。 惰性微孔膜。
RT aM,外 E膜 = E道 ,外 − E道 ,内 = ln nF aM,内
E膜 = k 3 +
电位分析法

电位分析法一、概论:电位分析法是通过化学电池的电流为零的一类方法二、电位分析法指示电极分类1、第一类电极:金属及其离子溶液2、第二类电极:金属及其难溶盐(或络合离子)3、第三类电极:金属与具有两种共同阴离子的难溶盐或难解离的络合离子4、第零类电极:惰性金属Pt 、Au 、C 等三、参比电极与盐桥1、参比电极1标准氢电极:在任何温度下电位值都为零,但一般不使用,因为操作麻烦又贵。
2甘汞电极和银-氯化银电极:电极电位可从P362查表获得甘汞电极:)/(|)(),(22L xmol KCl s Cl Hg l Hg 银-氯化银电极:)/(|)(),(L xmol KCl s AgCl s Ag 2、盐桥1作用:联通电路,消除或减小液接电位2使用条件:不含被测离子、正负电子迁移率基本相等、离子浓度尽可能大,减少液接电位。
四、离子选择电极1、膜电电位E 膜=in Dd out D E E E ++=l in l out a a nF RT k ln '±(d E :扩散电位,D E :界面电位,a :活度)2、离子选择电极电位:l out ISE a nF RT const E ln '±=(负离子➕,正离子➖)l out ISE SCEBattery a nFRT K E E E ln ±=-=(负离子➖,正离子➕)ISE :离子选择电极,SCE :参比电极3、离子选择电极类型及其相应机理1玻璃电极:玻璃在纯水或稀酸中浸泡时,玻璃中的+Na 与溶液里的+H 发生交换,在玻璃表面形成水化胶层。
此时玻璃的结构为:内外水化胶层+中间干玻璃层;干玻璃层靠+Na 导电,而水化胶层靠+H 扩散导电。
2晶体膜电极A 、氟离子单晶电极:敏感膜为3LaF 的单晶薄片,氟离子能扩散进入膜相的缺陷空穴,膜中的氟离子也可以进入溶液,因而在两相界面上产生了膜电位。
B 、硫、卤素离子电极。
电化学分析方法之一电位分析法

)
(K2
0.0592
lg
aH 内 aH 内表面
)
K
0.0592
lg
a H
外
K
0.0592
pH
C、PH玻璃电极的电极电位:
E玻 E内参 E膜 E内参 K 0.0592 pH试
E玻 K玻 0.0592 pH试
D、电位法测定溶液pH的基本原理 电位法测定溶液的pH,是以玻璃电
极作批示电极,饱和甘汞电极作参比电 极,浸入试液中构成原电池: E = E甘 – E玻
电位滴定法中拟定终点的办法重 要有下列几个:
第一种办法:以测得的电动势和 对应的体积作图,得到E~V曲线, 由曲线上的拐点拟定滴定终点。
第二种办法:作一次微商曲线, 由曲线的最高点拟定终点。具体 由△E/△V对V作图,得到△E/△V 对V曲线,然后由曲线的最高点拟 定终点。
第三种办法:由二次微商求终点
其中,批示电极是看待测离子的 浓度变化或对产物的浓度变化有 响应的电极,参比电极是含有固 定电位值的电极。
在滴定过程中,随着滴定剂的加 入,待测离子或产物离子的浓度 要不停地变化,特别是在计量点 附近,待测离子或产物离子的浓 度要发生突变,这样就使得批示 电极的电位值也要随着滴定剂的 加入而发生突变。
惯用的有Ag/AgCl、甘汞电极 (Hg/Hg2Cl2电极)。
对于甘汞电极,其电极反映为: Hg2Cl2+2e=2 Hg+2Cl-
3. 第三类电极:它由金属,该金属 的难溶盐、与此难溶盐含有相似阴离 子的另一难溶盐和与此难溶盐含有相 似阳离子的电解质溶液所构成。表达 为M (MX,NX,N+)。如: Zn| ZnC2O4(s),CaC2O4(s),Ca2+ Ca2+ + ZnC2O4 +2e CaC2O4+ Zn
电位分析及离子选择性电极分析

高选择性,需要在pH5~7之间使用,
pH高时:溶液中的OH-与氟化镧晶体膜中的F-交换; pH较低时:溶液中的F -生成HF或HF2 - 。
电位分析及离子选择性电极分析
2.玻璃膜电极
非晶体膜电极,玻璃膜的组成不同可 制成对不同阳离子响应的玻璃电极。
(敏感膜)
内参比电极的电位值固定,且内充溶液中离 子的活度也一定,则膜电极电位为:
IS E 内 参 膜 kR ZlF T n M
电位分析及离子选择性电极分析
离子选择电极的电位
导线
对MZ+产生响应时,
电极腔体 内参比电极 内参比溶液
内k2R ZFTln 'M M((内 内 )) 外k1R ZFTln 'M M((外 外))
电位分析及离子选择性电极分析
玻璃膜电位:
将浸泡后的玻璃电极放入待测溶液,水合硅胶层表面与溶液
中的H+活度不同,形成活度差,H+由活度大的一方向活度小的一 方迁移, 平衡时:
H+溶液==
H+ 硅胶
E内 = k1 + 0.059 lg( a2 / a2’ )
E外 = k2 + 0.059 lg(a1 / a1’ )
由于玻璃膜内、外表面的性质基本相同, 则: k1=k2 , a’1 = a’2
电极电位与溶液中给定离子活度的对数 呈线性关系。
电位分析及离子选择性电极分析
一、电极的基本构造
电极腔体――玻璃或高分子聚 合物材料做成
内参比电极――通常为 Ag/AgCl电极
内参比溶液――由氯化物及响 应离子的强电解质溶液组成
第12章_电位分析及离子选择性电极分析法

三、离子选择性电极的主要类型
通常依敏感膜材料分为原电极和敏化离子选择电极两大类。
如F-,Cl-,Cu2+离子选择电极
如pH,pNa等玻璃电极
如氨气敏电极等
如氨基酸酶电极等
6
1、非晶体膜电极
pH玻璃电极
pH 玻璃电极是最早出现的 ISE 。是 电位法测定溶液 pH 的指示电极。 pH玻璃电极的结构如图3.3所示。
2、电位滴定法:
向试液中滴加能与被测物质发生化学反应的已知浓度的试 剂,观察滴定过程中指示电极电位的变化,以确定滴定的 终点,根据所需滴定剂的量计算出被测物的含量。 非平衡体系,测得的是物质的总量。如: Ag 电极测 Cl(用AgNO3滴定)
2
§12.2 离子选择电极及其主要性能参数
一、离子选择电极(Ion selective electrode, ISE)
酸差—测定强酸溶液,测得的pH值比实际数值偏高的现象。
由于在强酸溶液中,水分子活度减小,而H+以H3O+形式传递, 结果到达电极表面的H+减少,pH值增加。
15
2、晶体膜电极
晶体膜电极的构造如图3.6所示。 敏感膜是用难溶盐的晶体制 成,厚约 1 ~ 2mm ,这些晶 体具有离子导电的功能。
均相膜电极的敏感膜是由单 晶或由一种化合物和几种化 合物均匀混合的多晶压片制 成;
D,外
=常数+ 0 . 0592 lg a M 外 , H
=常数- 0 .0592 pH
( =常数 0 . 0592 lg a ) M 外 , F
pH玻璃电极的电位由 M ,内参比电极电位 D ,内 以及不对称 电位 不对称 等组成。pH玻璃电极的电位为它们的代数和:
23
电位分析及离子选择性电极分析法

第十二章
12.2 离子选择性电极 与膜电位
电位分析及离子选 12.3 离子选择性电极的
择性电极分析法
主要性能参数
12.4 离子选择性电极
的分析仪器
12.5 电位分析及离子
选择性电极分析
方法与应用
电位分析及离子
2021/3/6
选择性电极分析
法
1
12-1 概述
一、电位分析法 1.定义 利用电极的电极电位与待测试液中某种 离子的活度(或浓度)之间的关系,确定出 待测组分含量的电化学分析方法。
2021/3/6
电位分
析及离
子选择
性电极
分析法
10
2021/3/6
H+ + N电a位G分 I(固)
析及离
子选择
性电极
分析法
11
Na+ + HGI(固) (水合硅胶)
(4)玻璃膜电位的形成 玻璃电极在水溶液中浸泡,形成一个三
层结构,即中间的干玻璃层和两边的水化硅 胶层。
玻璃膜电位的产生是H+在玻璃内、外溶液和水化层 电位分
界间没有发生电子交换过程。表现为离子在 相界上的扩散。
2021/3/6
电位分
析及离
ห้องสมุดไป่ตู้
子选择
性电极
分析法
6
离子选择性电极(又称“膜电极”)组成: ★薄膜(敏感膜或传感膜)
—对特定离子有选择性响应。 ★内参比溶液
—含有与待测离子相同的离子 ★内参比电极
—Ag/AgCl电极。
2021/3/6
电位分
析及离
子选择
ln
α2 α 2
外
k2
第12章 电位分析法

RT a( 2) ED E1 E2 ln zF a(1)
负离子扩散:
RT a( 2) ED E1 E2 ln zF a(1)
三、膜电位 由于带电粒子(如离子、电子、双极 分子等)在两相中的不均匀分布在界面上形成的 电位差,称为膜电位。
若膜仅对M+选择性响应,则
第12章 电位分析法
Potentiometric analysis
概述 §12-1 §12-2 §12-3 §12-4 §12-5 §12-6 §12-7
金属基指示电极 膜电位与离子选择电极 离子选择电极的类型及响应机理 离子选择电极的性能参数 定量分析方法 离子选择电极的特点及应用 电位滴定
概述
IUPAC的定义 静态响应时间:离子选择电极与参比电极 一起从接触试液开始到电池电动势达到稳定值 (变化<1mV)所需的时间。
§12-5 定量分析方法
一、参比电极
对参比电极的要求要: 可逆性 有电流流过(μ A)时,反转变号时,电位基 本上保持不变。 重现性 溶液的浓度和温度改变时,按Nernst 响应, 无滞后现象。 稳定性 测量中电位保持恒定、并具有长的使用寿命。 例: 甘汞电极(SCE),银-氯化银电极等。
O
O
O
O
O
二甲基-二苯并30-冠醚-10
四、气敏电极(sensor)
气敏电极端部装有透 气膜,气体可通过它进人管内。 管内插入pH玻璃复合电极,复 合电极是将外多比电极(Ag/ AgCI)绕在电极周围。管中充 有电解液,也称中介液。试样 中的气体通过透气膜进入中介 液,引起电解液中离子活度的 变化,这种变化由复合电极进 行检测。 如 CO2气敏电极,用 PH玻璃电极作为指示电极,中 介液为0.01mol/L的碳酸氢钠。 二氧化碳与水作用生成碳酸, 从而影响碳酸氢钠的电离平衡 来指示CO2 。
实验离子选择电极法测定水样中氟的含量

当内外参比电极电位及αF-(内)为常数时,上列电池电动势可简化为:
E
常数
2.303RT F
lg
F_
(外)
二、实验原理
由上式可知,被测溶液氟离子活度的对数值与电池电动势呈直线关系。 当溶液的离子强度不变时,则E与lgCF-呈线性关系。故为测定溶液中的 氟离子浓度,通常通过标准曲线测定未知的氟离子浓度。 另外,如果溶液中含有能与氟离子产生配位反应的阳离子如 Al 3+、Fe 3+ 等也会严重干扰测定,故需添加掩蔽剂来排除干扰。又如溶液的pH值过 高,则会增大前述的 OH- 离子的干扰;pH值过低又会由于HF和HF2-的形 成而降低氟离子的活度,适当的pH范围为5~6。 为满足上述要求,在制作标准曲线和测定未知试样时,溶液中都加入相 同量的总离子强度缓冲调节剂(TISAB),即由NaCl、HAc、NaAc、柠 檬酸钠组成的水溶液。这种处理方法可保证(1)使溶液的总离子强度几 乎不变,从而保持活度系数不变;(2)由于HAc-NaAc缓冲溶液能保持 合适的 pH 范围5~5.5,因此可避免 OH- 的干扰;(3)若试样中有干扰 离子Al 3+和Fe3+则柠檬酸根离子能与Al3+和Fe3+结合使氟游离成为离子形 态。
六、思考题
三、实验仪器与试剂
仪器
50mL烧杯,50mL容量瓶,5mL吸量管,10mL吸 量管,电磁搅拌器,氟离子选择电极,饱和甘汞电 极,酸度计
试剂
Creativity 分析纯NaF、NaCl、HAc、NaAc、柠檬酸钠
四、实验操作
3 2
1
•配制系列标准 氟溶液
电位分析及离子选择电极

12:41:57
电位分析的理论基础
理论基础:能斯特方程(电极电位与溶液中待测离子活
度间的定量关系)。
对于氧化还原体系:
Ox + ne- = Red
E
EO Ox/Red
RT nF
ln
aOx aRe d
对于金属电极(还原态为纯金属,活度定为1):
结构:右图 敏感膜:氟化镧单晶 掺有EuF2 的LaF3单晶切片; 内参比电极:Ag-AgCl电极(管内)。
内参比溶液:0.1mol/L的NaCl和0.001mol/L的NaF混合 溶液(F-用来控制膜内表面的电位,Cl-用以固定内参比电 极的电位)。
12:41:57
原理:
LaF3的晶格中有空穴,靠近空穴的 可移动离子可以移入至空穴而导电。对 于一定的晶体膜,空穴的大小、形状和 电荷分布,只能容纳一定的可移动离子, 而其它离子则不能进入。晶体膜就是这 样限制了除待测离子外其它离子的移入 而显示其选择性,故膜电极一般都具有 较高的离子选择性。
EHg 2Cl 2 / Hg
EAgCl/Ag
K
2.303RT F
lg
aH
E液接
E不对称
E电池
K
2.303RT F
pH试液
25 C : E电池 K 0.059pH试液
故原电池的电动势与溶液的pH之间呈线性关系,
其(响应)斜率为2.303RT/F,此值与温度有关,在
25 ℃ 时为0.059v。
12:41:57
E膜
K
2.303RT ni F
lg ai
ni
Ki, j (a j )nj
电位分析法

内、外参比电极的电位值固定,且内充溶液中离子的活度 也一定,则电池电动势为:
RT EK ln ai nF
离子选择性电极的类型和结构
1976年IUPAC基于膜的特征,推荐将其分为以下几类
离子选择性电极(又称膜电极)
注意:离子活度系数保持不变时,膜电位才与log ci
呈线性关系。
总离子强度调节缓冲溶液简称TISAB
TISAB的作用:
①保持较大且相对稳定的离子强度,使活度系数恒定; ②维持溶液在适宜的pH范围内,满足离子电极的要求; ③掩蔽干扰离子。 典型组成(测F-): 1mol/L的NaCl,使溶液保持较大稳定的离子强度; 0.25mol/LHAc和0.75mol/LNaAc, 使溶液pH在5左右; 0.001mol/L的柠檬酸钠, 掩蔽Fe3+、Al3+等干扰离子。
公式使用时注意:对阳
离子,△E不变;对阴离子,△E
前加负号或取△E的绝对值。
优点:
(1)无须绘制标准曲线
(仅需一种浓度标液) (2)无需配制或添加 TISAB (3)操作步骤简单、快 速
3、直读法--pH测定原理与方法 ⑴ 直读法:对于被测溶液中
的某种成分能够在仪器上直接读 出其浓度的方法称为直读法。如 在pH计或pNa计上就能测定pH值
影响电位测定准确性的因素
(1) 测量温度:影响主要表现在对电极的标准电极电位、 直线的斜率和离子活度的影响上。 仪器可对前两项进行校正,但多数仅校正斜率。 温度的波动可以使离子活度变化,在测量过程中应尽量 保持温度恒定。 (2) 线性范围和电位平衡时间:一般线性范围在10-1~10-6 mol / L;平衡时间越短越好。测量时可通过搅拌使待测离子 快速扩散到电极敏感膜,以缩短平衡时间。 测量不同浓度试液时,应由低到高测量。
2.离子选择性电极分类及原理解析

1.晶体膜电极(氟电极)
结构:右图
敏感膜:(氟化镧单晶)
掺有EuF2 的LaF3单晶切片;
内参比电极:Ag-AgCl电极(管 内 )。 内参比溶液:0.1mol/L的NaCl和0.1mol/L的NaF混合溶液(F-用 来控制膜内表面的电位,Cl-用以固定内参比电极的电位)。
原理:
LaF3的晶格中有空穴,在晶格上的F-可以移 入晶格邻近的空穴而导电。离子的大小、形状 和电荷决定其是否能够进入晶体膜内。
当氟电极插入到F-溶液中时,F-在晶体膜 表面进行交换。25℃时:
RT lna F =K - 0.059 lgaF- = K + 0.059 pF E膜 = K nF
具有较高的选择性,需要在pH5~6之间使 用。 pH高时,溶液中的OH-与氟化镧晶体膜中 的F-交换。 pH较低时,溶液中的F -生成HF。
lg ci E
E E
nF
lnai
2、标准加入法
设某一试液体积为V0,其待测离子的浓度为cx, 往试
液中准确加入一小体积Vs(大约为V0的1/100)的用待测
离子的纯物质配制的标准溶液, 浓度为Cs(约为Cx的100 倍)。由于V0>>Vs,可认为溶液体积基本不变。则: 浓度增量为:⊿c = Cs Vs / V0
2.303 RT E1 K lg( xi i c x ) nF
2.303 RT E2 K lg( x2 2 c x x2 2 c) nF
可以认为γ 2≈γ 1,χ 2≈χ 1。则:
2.303 RT c E E2 E1 lg(1 ) nF cx
2.303 RT 令:S ; nF c 则: E S lg(1 ) cx c x c(10 E / s 1) 1
电位分析法离子选择性电极的选择性

2. 标准加入法
标准曲线法要求标准溶液与待测溶液具有相近的离子强 度和组成,否则将会因活度系数变化而引起误差。而标准 加入法则在一定程度上减免这一误差的产生。
设:未知液中待测离子浓度为cx,溶液体积为V0,测得电动 势为E1,则
E1
K '
2.303RT nF
lg(x1 1cx )
x1为游离的离子的摩尔分数。
EM
K
2.303RT nF
lg[ ai
K i, j(a j )ni
nj ]
式中第二项对阳离子为正号;对阴离子为负号。
离子选择性系数Ki,j的物理意义:
1.它是在其他相同条件下,同时提供相同的电位时的欲测 离子活度ai与干扰离子活度aj的比值:
Ki, j ai (a j )ni n j
Ki,j愈小,说明j离子的干扰愈小,即此电极对欲测离子的 选择性愈好。 Ki,j愈小愈好。 2. Ki,j值并非一真实的常数,其值与i和j例子的活度和实 验条件等有关,所以不能直接利用Ki,j的文献值作为分析 测定时的干扰校正。但可作为判断离子选择性电极在已 知杂质存在下时的干扰程度的一个指标,对拟定有关分 析方法时起参考作用。
E
K
2.303RT F
lg
a F
对各种离子选择性电极:
E电极
K
RT nF
ln
a离子
1.标准曲线法
配制出与试样组成相似的标准 溶液来制作标准曲线。即将离子 选择性电极与参比电极插入一系 列活(浓)度已知的标准溶液并测 定相应的电动势
注意:离子活度系数保持不变时, 膜电位才与log ci呈线性关系。-------------恒定背景法
相对误差的计算:
根据Ki,j的定义,利用下式可以估量在测定中的误差:
电位分析及离子选择电极
如H+,Na+,K+,Li+,Ag+离子响应电极(p139)。其中H+离子响 应电极(即pH玻璃电极)被最早最广泛应用。下面以pH玻璃 电极为例,详细阐述玻璃电极的工作原理。
18:14:39
pH玻璃电极
H+响应的玻璃膜电极:内充0.1mol/LHCl 溶液,敏感膜厚度约为0.10mm。
玻璃膜内、外表面的性质基本相同,则k外=k内 , a’1 = a’2
E 18:14:39
膜
=
E外
-
E内
=
0.059
lg(
a1
/
a2)
玻璃电极电位
作为玻璃电极的整体,玻璃电极的电位应包括内参比电极 的电位,即
E玻 = E内参比 + E膜 于是 E玻 = E内参比 + 0.059v lg( a1 / a2)
敏化电极(sensitized electrodes) 气敏电极:如氨电极 酶电极:如尿素电极
18:14:39
1.非晶体膜电极(玻璃电极)
玻璃膜电极,它的核心部分是玻璃 膜,是在SiO2基质中加入Na2O和少量 CaO烧制而成,膜厚0.5mm,呈球泡型。 球泡内充注内参比溶液(含有与待测离 子相同的离子),再插入一根AgCl-Ag电 极作内参比电极。
18:14:39
18:14:39
18:14:39
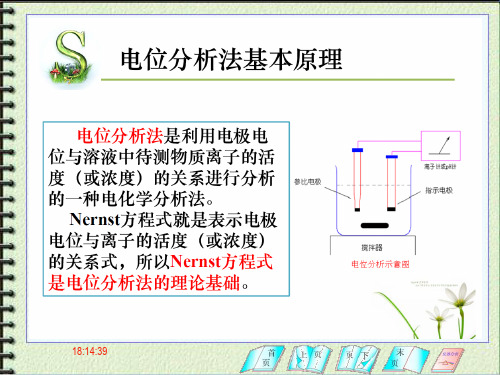
一、电位分析原理
principle of potentiometry analysis
电位分析是通过在零电流条件下测 定两电极间的电位差(电池电动势)所 进行的分析测定。
E 电池= E + - E 装置:参比电极、指示电极、电位
电位及离子选择性电极法

在于将膜电位引出。
ISE法的特点:
①选择性好,多数情况下共存离子的干扰小, 不需复杂处理待测液即可直接测定 ②灵敏度高。可达10-5- 10-8 mmol/L. ③实际测定的是溶液中离子活度,这是生物 学中一个重要的物理量。 ④溶血、脂血及黄疸不影响测定。 ⑤设备简单,分析速度快,易于自动化。 ⑥标本用量少而且应用广。
⑤NaN3可明显干扰Cl的测定。
电解质检测中各项的意义:
血清钾:3.5-5.5 mmol/L • 钾在参与蛋白质和糖的代谢,维持心肌和神经肌肉正常的应激性,维持酸碱
平衡等方面起重要作用。 降低: ①钾的摄入不足。 ②钾的过度丢失。如严重的呕吐、腹泻及胃肠引流、肾脏疾病(肾衰多尿期)等。 ③钾的细胞内转移。如家族性周期性四肢麻痹、肌无力症、给予大量葡萄糖等。 ④肾上腺皮质功能亢进。如醛固酮增多症。 ⑤碱中毒。 ⑥药物作用:a.长期使用大量肾上腺皮质激素,如可的松、地塞米松等;b.使用
降低 ①丢失过多。如严重呕吐和腹泻;大量使用利尿等 ②钠的摄入量不足。如饥饿、营养不良、低盐疗法等。 ③酸中毒 。
增高 ①肾上腺皮质功能亢进症。如柯兴综合征、原发性醛固酮增多症。 ②高渗性脱水症。 ③钠进量过多。如注射高渗盐水或进食过量钠盐,且伴有肾功能失常时。 ④潴钠性水肿。常见于心脏病、心力衰竭、肝硬化、肾病等。
和待测液(Es),根据以下公式计算:
Ex –Es = K 2.303RT
nF
lg a i
3. 标准加入法:适用于体系复杂,且与标准液浓度有较大
差异的待测液。先测定体积为Vx、浓度为Cx的待测液电动
势E,然后在此溶液中加入体积为Vs的标准液,测量电动势
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
potentiometry and conductometry
一、电位分析原理
principle of potentiometry analysis
第一节 电位分析原理与离子 选择性电极
principle of potentio-metry analysis and ion selective electrode
酶催化反应:
CO(NH2 )2 + H2O ──→ 2NH3 + CO2
葡萄糖氧化酶 尿酶
氨电极检测
葡萄糖 + O2 + H2O ────→ 葡萄糖酸 + H2 O2
氧电极检测
R-CHNH2 COO+O2 +H2 O ────→
氨基酸氧化酶
R-COCOO- +NH4+ +H2 O2
氨基酸通过以上反应后检测,或进一步氧化放出CO2 , 用气敏电极检测。
玻璃电极电位
作为玻璃电极的整体,玻璃电极的电位应包括内参比电极 的电位,即 于是 E玻
E玻 = E内参比 + E膜 = E内参比 + 0.059v lg( a1 / a2)
由于内参比溶液中的H+活度( α 2)是固定的,则:
E玻=K + 0.059vlg a1 =K-0.059vpH试液
上式表明:在25 ℃时,试液pH的每改变 1个单位,电位变化59mv,这是玻璃电极成 为氢离子指示电极的依据。
06:04:27
外参比电极
(-)Ag, AgCl | HCl | 玻璃膜 | 试液溶液 KCl(饱和) | Hg2Cl2(固), Hg(+)
E玻璃
电池电动势为:
E甘汞
E电池 E甘汞 E玻璃 E液接 E不对称 EHg2Cl 2 /Hg ( EAgCl/Ag E膜 ) E液接 E不对称 2.303RT EHg2Cl 2 /Hg EAgCl/Ag K lg aH E液接 E不对称 F 2.303RT E电池 K pH 试液 25 C : E电池 K 0.059pH 试液 F
++-
a1 、 a2 分别表示外部试液和电极内参比溶液的H+活度; a’1 、 a’2 分别表示玻璃膜外、内水合硅胶层表面的H+活 度 k外 、 k内 则是由玻璃膜外、内表面性质决定的常数。 玻璃膜内、外表面的性质基本相同,则k外=k内 , a’1 =
a’ 2
06:04:27
E膜 = E外 - E内 = 0.059 lg( a1 / a2)
principle of potentiometry analysis 电位分析是通过在零电流条件下测 定两电极间的电位差(电池电动势)所 进行的分析测定。 E 电池= E
+
-E
-
装置:参比电极、指示电极、电位
差计;
分为:直接电位法和电位滴定法 当测定时,参比电极的电极电位保持不变,电池电动势随 指示电极的电极电位而变,而指示电极(离子选择性电极) 的电极电位随溶液中待测离子活度而变。
1976年IUPAC基于膜的特征,推荐将其分为以下几类: 原电极(primary electrodes) 晶体膜电极(crystalline membrane electrodes) 均相膜电极:如氟电极、氯电极 非均相膜电极:如硫电极 非晶体膜电极(crystalline membrane electrodes) 刚性基质电极:如pH电极
原理:
LaF3的晶格中有空穴,靠近空穴的 可移动离子可以移入至空穴而导电。对 于一定的晶体膜,空穴的大小、形状和 电荷分布,只能容纳一定的可移动离子, 而其它离子则不能进入。晶体膜就是这 样限制了除待测离子外其它离子的移入 而显示其选择性,故膜电极一般都具有 较高的离子选择性。 当氟电极插入到 F- 溶液中时, F- 在 晶体膜表面进行交换。25℃时: E膜 = K - 0.059 lgaF- = K + 0.059 pF 氟电极的电位为 :EF-=E内参比+E膜= K - 0.059 lgaF06:04:27
水化硅胶层厚度:0.01~10 μm。在水化层,玻璃上的 H+与溶液中H+发生离子交换而产生相界电位:E内与E外。 H+水化层
06:04:27
H+
溶液
玻璃膜电位
E内 = k内 + 0.059v lg( a2 / a2’ )
E外 = k外 + 0.059v lg(a1 / a1’ )
-+
+-
玻璃电极放入待测溶液, 25℃平衡后: - + H+水化层 H+ 溶液 -+
气敏电极也被称为:探头、探测器、传感器。
06:04:27
气敏电极一览表
06:04:27
(2)酶电极
基于界面酶催化 化学反应的敏化电极; 酶特性:酶是具 有特殊生物活性的催 化剂,对反应的选择 性强,催化效率高, 可使反应在常温、常 压下进行; 可被现有离子选择性电极检测的常见的酶催化产物: CO2,NH3,NH4+,CN-,F-,S2-,I-,NO206:04:27
06:04:27
3.液膜电极(流动载体膜电极)
钙电极:内参比溶液为含 Ca2+ 水溶液。内外管之间装的是
0.1mol/L二癸基磷酸钙(液体离子交
换剂)的苯基磷酸二辛酯溶液。其极 易扩散进入微孔膜,但不溶于水,
故不能进入试液溶液。
衡。由于Ca 在水相(试液和内参比溶液)中的活度与有机相中的活度
0.059 v E膜 K -试液两相界面间传递钙离子,直至达到平 lg Ca 2( 25 C) 二癸基磷酸根可以在液膜 2 2+
(1)气敏电极 基于界面化学反应的敏化电极;
结构特点: 在原电极上覆盖一层 膜或物质,使得电极的选择性提高。 复合电极:指示电极与参比电极 组装在一起; 试样中待测组分气体扩散通过透气膜,进入离子选择电 极的敏感膜与透气膜之间的极薄液层内,使液层内离子选择 电极敏感的离子活度变化,则离子选择电极膜电位改变,故 电池电动势也发生变化。
SiO2基质中加入Na2O、Li2O和CaO烧 结而成的特殊玻璃膜。 水浸泡后,表面的 Na+ 与水中的
H+ 交换, 表面形成水合硅胶层 。 H+ + Na+Gl- Na+ +
溶液 玻璃膜 溶液
H+Gl玻璃膜
所以玻璃电极使用前,必须在水
溶液中浸泡。
06:04:27
玻璃膜电位的形成
玻璃电极使用前,在水溶液中浸泡后,生成三层结构 ,即中间的干玻璃层和两边的水化硅胶层:
故原电池的电动势与溶液的pH之间呈线性关系, 其(响应)斜率为2.303RT/F,此值与温度有关,在 25 ℃ 时为0.059v。
06:04:27
但由于K值无法测量,实际上,试样的pHx是同已知pHs的标 准缓冲溶液相比求得的。
两种溶液,pH已知的标准缓冲溶液 s和pH待测的试液x。测定各自的 电动势为:
氟电极的特性
因为没有其它离子进入晶格,具有较 高的选择性,干扰只是在晶体表面的化学 反应引起。 需要在pH5~7之间使用,pH高时,溶液中 的OH-与氟化镧晶体膜中的F-交换: LaF3+3OH-→La(OH)3+3FpH较低时,溶液中的F -生成HF或HF2 - 。
06:04:27
离子选择性电极的共性
06:04:27
玻璃电极的特性
(1) 不对称电位(25℃):
E膜 = E外 - E内 = 0.059 lg( a1 / a2)
如果: a1= a2 ,则理论上E膜=0,但实际上E膜≠0 产生的原因: 玻璃膜内、外表面含钠量、表面张力以及 机械 和化学损伤的细微差异所引起的。长时间浸泡(24hr) 恒定(1~30mV); (2) 酸差:测定溶液酸度太大(pH<1)时, 电位值偏离线性 关系,pH的测量值比实际高,产生误差; (3) 碱差(或钠差) : pH>10产生误差,主要是Na+参与相 界面上的交换所致,pH降低;
由此可见,测定了电极电位,就可确定离子的活度(或在 一定条件下确定其浓度),这就是电位分析法的理论依据。
06:04:27
二、离子选择性电极的种类、原理与结构
type , principle and structure of ion selective electrode 离子选择性电极(又称膜电极)。
2.303 RT ES K pH S F
' S
;
2.303 RT EX K pH X F
' X
若测定条件完全一致,则K’s = K’x , 两式相减得:
E X ES pH X pH S 2.303 RT / F
式中pHs已知,实验测出Es和Ex后,即可计算出试液的pHx 。所以 用电位法测定溶液pH时,先用标准缓冲溶液定位(校正),然后可直接 在pH计上读出试液的pH。使用时,尽量使温度保持恒定并选用与待测溶 液pH接近的标准缓冲溶液来校正。
用离子选择性电极测定有关离子时,一般都是基 于内部溶液与外部溶液之间产生的电位差,即所谓 的膜电位。 因此离子选择性电极法的定量依据是:
E膜电极
2.303RT 0.059v K lg K lg (25C ) nF n
式中,n为被测离子所带的电荷数; ±号取值:对阳离子取“+”号,而阴离子则取“-”号。
06:04:27
(3)组织电极
(tissue electrodes )
特性:以动植物组织为敏感膜;
优点:
a. 来源丰富,许多组织中含有大量的酶; b. 性质稳定,组织细胞中的酶处于天然状态,可发挥较 佳功效; c. 专属性强; d. 寿命较长; e. 制作简便、经济,生物组织具有一定的机械性能。 制作关键:生物组织膜的固定,通常采用的方法有物理 吸附、共价附着、交联、包埋等。
