离子反应离子方程式PPT课件
合集下载
11.10《离子反应》PPT课件

(4)发生氧化还原反应
离子方程式的书写:
⑴Cl2+ NaOH
⑵Fe+H2SO4
⑶ Na+H2O
⑷ MnO2+HCl
(5) H2SO4+Ba(OH)2
第二课时
注意事项:
1.固体间的反应一般不写离子反应方程式;
△
Ca(OH )2 2NH4Cl CaCl2 2NH3 2H2O
熟石灰 氯化铵
2.固体与浓硫酸反应,无离子方程式
(2) 生成挥发性的物质,如 H2、CO2、NH3、H2S、Cl2
2HCl Na2CO3 H2O CO2 2NaCl
2H CO32 H2O CO2
(3)生成难电离的物质,如 弱酸、弱碱、水。
HCl NaOH H2O NaCl
H OH H2O
(4)发生氧化还原反应
热水瓶使用一段时间后,瓶胆内壁会形成水垢(组成 为碳酸钙、氢氧化镁),水垢可用稀盐酸、醋酸来溶 解而除去。请写出其反应的离子方程式。
你的结论?
电解质溶液 (C、V相等)
盐酸
氨水 NaOH溶 醋酸溶液 液
电解质
通电后灯泡 亮度
HCl
亮
NH3•H2O NaOH CH3COOH
暗亮 暗
离子浓度大小 大
小
大
小
为什么相同浓度的溶液,其离子浓度不同呢?
电解质的电离程度不同
一、强电解质和弱电解质
1、强电解质:在水溶液里完全电离成离子的 电水 ④Cl2
⑤ Na2O固体
⑥ BaSO4固体
⑦ SO3
⑧石墨 ⑨熔融KNO3
属于电解质的是 ①⑤⑥⑨ , 属于非电解质的是 ②⑦ 。
能导电的有 ③⑧⑨
离子方程式的书写:
⑴Cl2+ NaOH
⑵Fe+H2SO4
⑶ Na+H2O
⑷ MnO2+HCl
(5) H2SO4+Ba(OH)2
第二课时
注意事项:
1.固体间的反应一般不写离子反应方程式;
△
Ca(OH )2 2NH4Cl CaCl2 2NH3 2H2O
熟石灰 氯化铵
2.固体与浓硫酸反应,无离子方程式
(2) 生成挥发性的物质,如 H2、CO2、NH3、H2S、Cl2
2HCl Na2CO3 H2O CO2 2NaCl
2H CO32 H2O CO2
(3)生成难电离的物质,如 弱酸、弱碱、水。
HCl NaOH H2O NaCl
H OH H2O
(4)发生氧化还原反应
热水瓶使用一段时间后,瓶胆内壁会形成水垢(组成 为碳酸钙、氢氧化镁),水垢可用稀盐酸、醋酸来溶 解而除去。请写出其反应的离子方程式。
你的结论?
电解质溶液 (C、V相等)
盐酸
氨水 NaOH溶 醋酸溶液 液
电解质
通电后灯泡 亮度
HCl
亮
NH3•H2O NaOH CH3COOH
暗亮 暗
离子浓度大小 大
小
大
小
为什么相同浓度的溶液,其离子浓度不同呢?
电解质的电离程度不同
一、强电解质和弱电解质
1、强电解质:在水溶液里完全电离成离子的 电水 ④Cl2
⑤ Na2O固体
⑥ BaSO4固体
⑦ SO3
⑧石墨 ⑨熔融KNO3
属于电解质的是 ①⑤⑥⑨ , 属于非电解质的是 ②⑦ 。
能导电的有 ③⑧⑨
化学1必修2.2《离子反应》教学+(1)-PPT课件

【讨论与思考】
物质溶解于水时产生自由移动的 离子过程可用什么方程式来表示?
2. 电离及电离方程式
填空: ⑴能发生电离的物质类别: ⑵电离的条件(与通电有无关系):
⑶电离的结果: ⑷电离的定义: ⑸电离的表示方法:
酸碱盐在水溶液中的电离
电离方程式
用分子式和离子符号表示电解质电离 的方程式叫做电离方程式
【注意事项】
……不用湿手板开关、换灯泡,插、拔插头 不站在潮湿的桌椅上接触火线……
——引自初三物理“用电安全”
酸碱盐在水溶液中的电离
化学问题:NaCl溶液导电性研究
1.水的导电性 2.NaCl晶体的导电性 3.NaCl溶液的导电性
纯水
NaCl晶体 不导电
溶解
?
NaCl溶液 导电
酸碱盐在水溶液中的电离
Cu2+ + 2OH- == Cu(OH)2↓
离子方程式
2.正确书写离子方程式的步骤
(1)写出化学方程式:
例:2AgNO3+CuCl2== 2AgCl↓+Cu(NO3)2 (2)把易溶于水、易电离(强酸\强碱\可
溶性盐)的物质拆写成离子形式。
难溶或难电离的物质以及气体等仍用化学 式表示。 2Ag++2NO3-+Cu2++2Cl- == 2AgCl↓+Cu2++2NO3-
2.向盛2 mL NaOH 溶液的试 管中滴加酚酞溶液,再慢慢 加入稀盐酸,直到无色
红色慢慢变浅,最后无色 H++OH- = H2O
3.向盛2 mL Na2CO3 溶液的 有无色无味气体产生
试管中加入2 mL 稀HCl
2H++CO32-=CO2↑+H2O
物质溶解于水时产生自由移动的 离子过程可用什么方程式来表示?
2. 电离及电离方程式
填空: ⑴能发生电离的物质类别: ⑵电离的条件(与通电有无关系):
⑶电离的结果: ⑷电离的定义: ⑸电离的表示方法:
酸碱盐在水溶液中的电离
电离方程式
用分子式和离子符号表示电解质电离 的方程式叫做电离方程式
【注意事项】
……不用湿手板开关、换灯泡,插、拔插头 不站在潮湿的桌椅上接触火线……
——引自初三物理“用电安全”
酸碱盐在水溶液中的电离
化学问题:NaCl溶液导电性研究
1.水的导电性 2.NaCl晶体的导电性 3.NaCl溶液的导电性
纯水
NaCl晶体 不导电
溶解
?
NaCl溶液 导电
酸碱盐在水溶液中的电离
Cu2+ + 2OH- == Cu(OH)2↓
离子方程式
2.正确书写离子方程式的步骤
(1)写出化学方程式:
例:2AgNO3+CuCl2== 2AgCl↓+Cu(NO3)2 (2)把易溶于水、易电离(强酸\强碱\可
溶性盐)的物质拆写成离子形式。
难溶或难电离的物质以及气体等仍用化学 式表示。 2Ag++2NO3-+Cu2++2Cl- == 2AgCl↓+Cu2++2NO3-
2.向盛2 mL NaOH 溶液的试 管中滴加酚酞溶液,再慢慢 加入稀盐酸,直到无色
红色慢慢变浅,最后无色 H++OH- = H2O
3.向盛2 mL Na2CO3 溶液的 有无色无味气体产生
试管中加入2 mL 稀HCl
2H++CO32-=CO2↑+H2O
离子反应ppt课件

教学目标
Overview of job performance
教学目标
1
本质与实质 发生条件
2
离子方程式
3
兴趣与素养
教学重难点
Work plan for next year
教学重难点
教学重点
离子反应的实质 探究离子反应发生的条件
教学难点
理解离子反应式的原理与实质
电解
离子
电离
质
反应
…
原理
…
教学过程
教材分析
Overview Of Annual Work
选自人教版高中化学 必修一第一章第二节
1
重要的化学用语
离子反应
2
基本概念 基础知识
3
贯穿始终 难点和重点
学情分析
Overview of job performance
已掌握:
学情分析
将学习:
电解质的概念 电离方程式书写
分析离子之间的反应, 引导学生形成科学的思 维方法。
Work plan for next year
引入Leabharlann 实验教学过程微观
分析
总结
板书
教学过程
引入
实验
微观
分析
总结
板书
菠菜豆腐汤到底能不能喝?
教学过程
引入
实验
微观
分析
总结
板书
硫酸钠分别与氯化钡、氯化钾反应 写出反应方程式
教学过程
引入
实验
微观
分析
总结
利用所学电解质与电离方程分析问题: “变与不变”
“不变”引出离子反应的实质:电解质在 水溶液中的反应,是离子之间的反应
高中化学4 离子反应 离子方程式的书写-课件 2021届高三高考化学一轮复习(共38张PPT)

难点突破
★电解质溶液的导电原理
3.同一温度下,强电解质溶液a、弱电解质溶液b、金属
导体c三者的导电能力相同,若升高温度后,它们的导
电能力强弱顺序是 ( A )
A.b>a>c
B.a=b=c
C.c>a>b
D.b>c>a
3.电离 电离方程式
(1)电离的定义和条件
定义
-
电解质在水溶液中或熔融状态下,离解成 自由移动的离子的过程
易错辨析
1.正误判断,正确的划“√”,错误的划“×” (1)金属能导电,所以金属是电解质( × ) (2)Cl2的水溶液能导电,所以Cl2是电解质( × ) (3)硫酸在水溶液中能完全电离,所以稀硫酸是强电解质
( ×) (4)SO2、NH3的水溶液能导电,所以SO2、NH3均是电解 质( × ) (5)BaSO4的水溶液的导电性很弱,故它是弱电解质( × ) (6)强电解质溶液导电性比弱电解质溶液导电性强( × ) (7)弱电解质溶液中存在多种共价化合物分子( √ ) (8)强电解质都是离子化合物 ( × )
NaHCO3=Na++HCO3-,HCO3- H++CO32-
④强酸的酸式盐如NaHSO4完全电离, 但在熔融状态和水溶液里的电离是不相同的。
熔融状态时:NaHSO4=Na++HSO4溶于水时:NaHSO4=Na++H++SO42-
⑤两性氢氧化物双向电离 H++AlO2-+H2O Al(OH)3 Al3++3OH-
随堂练习
完成下列反应的离子方程式: (1)醋酸与氨水混合 _C_H__3C__O_O__H_+__N__H_3_·_H_2_O__=_=_C_H__3C__O_O__-_+__N_H__+ 4_+__H_2_O__。 (2)向NaHSO3溶液中加入过量NaHSO4溶液 H__S_O__-3 _+__H_+_=_=_=__H_2_O_+__S_O__2_↑_____________________。 (3)氧化镁溶于稀硫酸 __M__g_O_+__2_H__+_=_=_=_H__2_O_+__M__g_2_+___________________。 (4)碳酸锌溶于稀硝酸中 _Z_n_C__O_3_+__2_H__+_=_=_=_Z__n_2+__+__H_2_O__+__C_O__2↑____________。 (5)石灰乳与Na2CO3溶液反应 _C__a_(O__H_)_2_+__C_O__23-_=_=_=__C_a_C_O__3_+__2_O_H__-_____________。
离子反应及离子方程式ppt课件

(2)NaOH、KOH、Ba(OH)2 NaOH == Na+ + OH-
HNO3 == H+ + NO3-
Ca(OH)2 == Ca2+ + 2OH-
H2SO4 == 2H+ + SO42-
Ba(OH)2 == Ba2+ + 2OH-
(3)Na2SO4、 Fe2(SO4)3、 NH4C1
Na2SO4 == 2Na+ + SO42- ▲酸:电离时生成的阳离子全部是H+的化合物 Fe2(SO4)3 == 2Fe3+ + 3SO42- ▲碱:电离时生成的阴离子全部是OH-的化合物
Na
Na
+
+
Na NO3-
+
HNO3 NaOH NaNO3
+ H+ NO3Na++ OH+ Na+ NO3-
+ H+ OH- H2O
H+
SO42-
H+
H+
SO42-
H+
O- OH-
Na
+ Na +
+
OH-
Na+
Na
+
Na
+
Na
+
Na
+
SO42-
H2SO4 NaOH Na2SO4
+ 2H+ SO42Na++ OH+ 2Na+ SO42-
NH4C1 == NH4+ + C1-
▲盐:电离时能生成金属离子和酸根阴离子的化合物。
包括铵根离子
1.下列电离方程式中,正确的是( )
D
高三一轮复习离子反应离子方程式ppt课件

为深入学习习近平新时代中国特色社 会主义 思想和 党的十 九大精 神,贯彻 全国教 育大会 精神,充 分发挥 中小学 图书室 育人功 能
第二章
第二讲 离子反应 离子方程式
(2)意义:离子方程式不仅可以表示某一个具体的化学反应, 还可以表示同一类型的离子反应,如氢氧化钠溶液和盐酸反 应、氢氧化钙溶液和硝酸反应的离子方程式,都可用 _____H_+_+__O__H_-_=_=_=_H__2O_来表示。
为深入学习习近平新时代中国特色社 会主义 思想和 党的十 九大精 神,贯彻 全国教 育大会 精神,充 分发挥 中小学 图书室 育人功 能
第二章
第二讲 离子反应 离子方程式
(4)Ba(OH)2 与 H2SO4 两稀溶液混合: _________________________________________________。 (5)Fe(OH)3 溶于 HI 溶液中: _________________________________________________。 (6)FeBr2 溶液中通入过量 Cl2: __________________________________________________。 (7)FeO 溶于稀 HNO3 中: __________________________________________________。
第二章
第二讲 离子反应 离子方程式
• 络合形反应:例如FeCl3溶液中加入
KSCN溶液显血红色
为深入学习习近平新时代中国特色社 会主义 思想和 党的十 九大精 神,贯彻 全国教 育大会 精神,充 分发挥 中小学 图书室 育人功 能
第二章
第二讲 离子反应 离子方程式
离子方程式 (1)书写步骤(以 CaCO3 与盐酸的反应为例):
人教版教材《离子反应》精品课件1

②NaAlO2 不足:AlO-2 +CO2+2H2O===Al(OH)3↓+HCO3-。
••••与量有关的离子方程式的书写••••
复分解反应——以少定多! ①连续型
(3)多元弱酸盐与强酸反应。如 Na2CO3 溶液与稀盐酸: 盐酸不足:CO23-+H+===HCO-3 ; 盐酸过量:CO23-+2H+===CO2↑+H2O。 (4)铝盐溶液与强碱溶液 铝盐过量:Al3++3OH-===Al(OH)3↓; 强碱过量:Al3++4OH-===AlO-2 +2H2O。
B.碳酸氢钠是烘制糕点所用发酵剂的主要成分之一
A. 1与6
B. 2与8
C. 9与11 D. 8与14
③该有机物分子中含有酯基,能够发生水解反应,含有羟基与其所连碳原子 邻位碳原子上有氢原子,能够发生酯化反应和消去反应,
原子守恒 也能够与钠反应放出氢气,故③正确;
C. 化合物X2Y、ZY、WY3 中化学键的类型相同
••••••••离子方程式•••••••••••
(2)意义:
离子方程式不仅可以表示某一个具体的化学反应,还可以表示同一类型的离 子反应,如氢氧化钠溶液和盐酸反应、氢氧化钙溶液和硝酸反应的离子方程 式,都可用H++OH-=== H2O来表示。
•••••离子方程式的书写••••••••
定物质 配氧还 等电荷 补齐水
“拆写”正误 客观事实 化钠和弱酸,HClO的酸性小于HF,溶液的pH:①>②,选项B错误;C、溶液的碱性越强消耗的盐酸越多,溶液中c(OH-):①>②,
故加入盐酸至中性所消耗盐酸体积:①>②,选项C错误;D、NaClO和NaF的物质的量相同,根据物料守恒可知n(HF)+n(F-)=n(
HClO)+n(ClO-),选项D正确。答案选D。
新教材高中化学精品课件 离子反应 离子方程式

× 1.CO2、NH3溶于水能导电,所以二者为电解质( ) 2.NaCl溶液在电流的作用下电离成钠离子和氯离子( × ) 3.强电解质都是离子化合物,弱电解质都为共价化合物( × ) √ 4.BaSO4的水溶液不易导电,但BaSO4是强电解质( ) 5.HClO是弱酸,但NaClO是强电解质( √ )
2.离子方程式 (1)离子方程式:用 实际参加反应的离子符号 来表示反应的式子。 (2)离子方程式的意义 离子方程式不仅可以表示 某一个具体的化学反应 ,还可以表示 同一类型的离子反应。 3.离子方程式中物质的“拆分” (1)一般规律 ①能拆分写成离子形式的物质是易溶的强电解质,包括 强酸 、 强碱 、大多数 可溶性盐 。 ②不能拆分的物质包括单质、氧化物、弱电解质、难溶电解质、气体。
(2)完成下列反应的离子方程式,注意微溶物质、NH+4 与碱反应的条件。
①澄清石灰水中加入稀盐酸 OH-+H+===H2O 。
②Na2SO4溶液与AgNO3溶液混合 SO42-+2Ag+===Ag2SO4↓ 。
③铵盐溶液与强碱溶液混合加热检测 NH+4 NH+4 +OH-==△===NH3↑+H2O 。
(4)已知PbSO4不溶于水,但可溶于醋酸铵溶液,反应方程式如下: PbSO4+2CH3COONH4===(CH3COO)2Pb+(NH4)2SO4 将硫化钠溶液与醋酸铅溶液混合,可生成沉淀,写出反应的离子方程式: _(C__H_3_C_O__O_)_2P__b_+__S_2-__=_=_=_P_b_S_↓__+__2_C_H__3_C_O_O__-_。
(3)CuSO4溶液与Ba(OH)2溶液混合 Cu2++SO24-+Ba2++2OH-===Cu(OH)2↓+BaSO4↓ 。
反思归纳
多重反应离子方程式书写时的注意点
第二节离子反应要的离子方程式的写法PPT课件
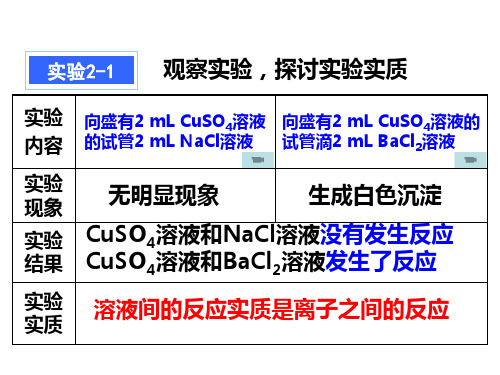
实验2-1 观察实验,探讨实验实质
实验 向盛有2 mL CuSO4溶液 向盛有2 mL CuSO4溶液的 内容 的试管2 mL NaCl溶液 试管滴2 mL BaCl2溶液
实验 现象
无明显现象
生成白色沉淀
实验 CuSO4溶液和NaCl溶液没有发生反应 结果 CuSO4溶液和BaCl2溶液发生了反应
实验 实质
随堂练习
1、写出下列化学方程式和离子方程式
①Na2CO3+HCl ②CuCl2+NaOH
①Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ CO32- + 2H+ = H2O + CO2↑
②CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl Cu2+ + 2OH- = Cu(OH)2↓
深入挖掘:课本34页9
二、离子反应及其发生的条件
1、离子反应的定义 2、离子方程式的书写步骤 3、离子反应发生的条件 4、离子反应的实质
1、课本P34页习题第9题(离子方程式 暂不写)
2、预习课本P31-P32离子方程式及其 书写
复习部分酸、碱、盐的溶解性表及常见的强弱电解质
① HCl + NaOH = NaCl +H2O ② CuCl2 + 2NaOH = Cu(OH)2↓+ 2NaC ③ CuSO4 + Fe = FeSO4 + Cu ④ 2HCl+ CaCO3 = CaCl2 + H2O + CO2↑
三.离子反应方程式表示的意义 细心探究:完成下列反应的离子方程式
溶液间的反应实质是离子之间的反应
实验 向盛有2 mL CuSO4溶液 向盛有2 mL CuSO4溶液的 内容 的试管2 mL NaCl溶液 试管滴2 mL BaCl2溶液
实验 现象
无明显现象
生成白色沉淀
实验 CuSO4溶液和NaCl溶液没有发生反应 结果 CuSO4溶液和BaCl2溶液发生了反应
实验 实质
随堂练习
1、写出下列化学方程式和离子方程式
①Na2CO3+HCl ②CuCl2+NaOH
①Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ CO32- + 2H+ = H2O + CO2↑
②CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl Cu2+ + 2OH- = Cu(OH)2↓
深入挖掘:课本34页9
二、离子反应及其发生的条件
1、离子反应的定义 2、离子方程式的书写步骤 3、离子反应发生的条件 4、离子反应的实质
1、课本P34页习题第9题(离子方程式 暂不写)
2、预习课本P31-P32离子方程式及其 书写
复习部分酸、碱、盐的溶解性表及常见的强弱电解质
① HCl + NaOH = NaCl +H2O ② CuCl2 + 2NaOH = Cu(OH)2↓+ 2NaC ③ CuSO4 + Fe = FeSO4 + Cu ④ 2HCl+ CaCO3 = CaCl2 + H2O + CO2↑
三.离子反应方程式表示的意义 细心探究:完成下列反应的离子方程式
溶液间的反应实质是离子之间的反应
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.(1)写出下列离子方程式对应的化学方程式。 ①Cu2++Fe===Fe2++Cu:________________________________________; ②H++OH-===H2O:____________________________________________; ③Fe3++3OH-===Fe(OH)3↓:____________________________________; ④Ca2++OH-+HCO- 3 ===CaCO3↓+H2O:__________________________ _______________________________________________________________。
______________________,并揭示了这类化学反应的本质。如HCl、 同H__N一_O_类3_、_型_H的_2_S离_O_子4_分反__别应__与__N_a_O_H_。、KOH溶液反应的实质是
H++OH-===H2O
• (3)离子方程式的书写步骤。 • 以CaCO3与盐酸的反应为例:
离子反应离子方程式PPT课件
离子反应离子方程式PPT课件
【答案】(1)(合理答案均可)①CuSO4+Fe===FeSO4+Cu ②HCl+NaOH===NaCl+H2O ③FeCl3+3NaOH===Fe(OH)3↓+3NaCl ④Ca(OH)2+NaHCO3(少量)===CaCO3↓+NaOH+H2O (2)①Al3++3NH3·H2O===Al(OH)3↓+3NH+ 4 ②MgO+2H+===H2O+Mg2+ ③OH-+H+===H2O ④HCO- 3 +CH3COOH===CH3COO-+H2O+CO2↑
离子反应离子方程式PPT课件
离子反应离子方程式PPT课件
• (4)向氨水中通入HCl直至过量( ) • (5)向NaOH溶液中通入少量Cl2( ) • (6)向饱和石灰水中不断通入CO2( ) • 【答案】(1)D (2)B (3)C (4)B (5)C (6)A
离子反应离子方程式PPT课件
离子反应离子方程式PPT课件
离子反应离子方程式PPT课件
离子反应离子方程式PPT课件
(2)完成下列反应的离子方程式。 ①AlCl3 溶液中加入过量氨水:_____________________________________; ②氧化镁溶于稀硫酸:____________________________________________; ③澄清石灰水中加入稀盐酸:______________________________________; ④小苏打溶液与乙酸溶液混合:____________________________________ _______________________________________________________________。
(3)离子反应的本质。
A~E 中,混合后溶液中 SO24-的物质的量减少的是____A____(填序号,下同);H +的物质的量减少的是_B__C_D__E____;因此离子反应的本质是溶液中某些离子的物质的 量的_减__少___。
• 2.离子方程式 • (1)离子方程式:用_实__际__参__加_反__应__的_离__子__符__号_____来表示反应的式子。 • (2)离子方程式的意义。 • 离子方程式不仅可以表示一定物质间的某个反应,而且还可以表示
• 【答案】(1)× (2)× (3)× (4)× (5)× (6)× (7)× (8)×
离子反应离子方程式PPT课件
离子反应离子方程式PPT课件
• 2.下列几种导电性变化图像,把符合要求的图像序号填在相应的题目 后面括号中。
• (1)向H2SO4溶液中加入等体积、等物质的量浓度的Ba(OH)2溶液( ) • (2)向H2S溶液中通入Cl2直至过量( ) • (3)向AgNO3溶液通入少量HCl( )
【答案】
CaCO3 + 2HCl===CaCl2 + H2O+CO2↑
CaCO3 + 2H + + 2Cl - ===Ca2++2Cl-+H2O+CO2↑
CaCO3 + 2H + ===Ca2 + + H2O+CO2↑ 质量 电荷
【思维深化】
• 1.判断正误(正确的画“√”,错误的画“×”)。 • (1)水溶液中的反应一定是离子反应( ) • (2)离子反应一定有离子参加( ) • (3)离子反应只表示一个具体反应( ) • (4)碳酸钠与盐酸和醋酸反应的离子方程式相同( ) • (C5u)↓将(Na投入) 到CuSO4溶液中的离子反应为2Na+Cu2+===2Na++
离子反应离子方程式PPT课件
(6)氢氧化铁溶于氢碘酸中的离子反应为 Fe(OH)3+3H+===Fe3++3H2O( ) (7)向小苏打溶液中加入过量的澄清石灰水的离子反应为 2HCO- 3 +Ca2++2OH- ===CaCO3↓+2H2O+CO23-( ) (8)Cl2 通入水中的离子反应为 Cl2+H2O===2H++Cl-+ClO-( )
第二章
化学物质及其变化
第二节 离子反应 离子方程式
考点2 离子反应 离子方程式
栏目导航
01
夯实考点
02
考点突破
03 真题体验·直击高考
ቤተ መጻሕፍቲ ባይዱ
04
配套训练
1
夯实考点
【知识梳理】
• 1.离子反应 • (1)概念:有离子参加或有离子生成的反应统称为离子反应。
(2)离子反应的条件。
在稀 H2SO4 中分别加入下列物质,有关反应的离子方程式如下: A.加入 BaCl2 溶液:Ba2++SO24-===BaSO4↓ B.加入 CH3COONa 溶液:CH3COO-+H+===CH3COOH C.加入 Na2CO3 溶液:CO23-+2H+===CO2↑+H2O D.加入 Zn 粒:Zn+2H+===H2↑+Zn2+ E.加入 NaOH 溶液:H++OH-===H2O 从 A~E 可知离子反应发生的条件:①生成_难__溶___的物质,②生成_难__电__离___的物 质,③生成_易__挥__发___的物质,④发生_氧__化__还__原_____反应。
______________________,并揭示了这类化学反应的本质。如HCl、 同H__N一_O_类3_、_型_H的_2_S离_O_子4_分反__别应__与__N_a_O_H_。、KOH溶液反应的实质是
H++OH-===H2O
• (3)离子方程式的书写步骤。 • 以CaCO3与盐酸的反应为例:
离子反应离子方程式PPT课件
离子反应离子方程式PPT课件
【答案】(1)(合理答案均可)①CuSO4+Fe===FeSO4+Cu ②HCl+NaOH===NaCl+H2O ③FeCl3+3NaOH===Fe(OH)3↓+3NaCl ④Ca(OH)2+NaHCO3(少量)===CaCO3↓+NaOH+H2O (2)①Al3++3NH3·H2O===Al(OH)3↓+3NH+ 4 ②MgO+2H+===H2O+Mg2+ ③OH-+H+===H2O ④HCO- 3 +CH3COOH===CH3COO-+H2O+CO2↑
离子反应离子方程式PPT课件
离子反应离子方程式PPT课件
• (4)向氨水中通入HCl直至过量( ) • (5)向NaOH溶液中通入少量Cl2( ) • (6)向饱和石灰水中不断通入CO2( ) • 【答案】(1)D (2)B (3)C (4)B (5)C (6)A
离子反应离子方程式PPT课件
离子反应离子方程式PPT课件
离子反应离子方程式PPT课件
离子反应离子方程式PPT课件
(2)完成下列反应的离子方程式。 ①AlCl3 溶液中加入过量氨水:_____________________________________; ②氧化镁溶于稀硫酸:____________________________________________; ③澄清石灰水中加入稀盐酸:______________________________________; ④小苏打溶液与乙酸溶液混合:____________________________________ _______________________________________________________________。
(3)离子反应的本质。
A~E 中,混合后溶液中 SO24-的物质的量减少的是____A____(填序号,下同);H +的物质的量减少的是_B__C_D__E____;因此离子反应的本质是溶液中某些离子的物质的 量的_减__少___。
• 2.离子方程式 • (1)离子方程式:用_实__际__参__加_反__应__的_离__子__符__号_____来表示反应的式子。 • (2)离子方程式的意义。 • 离子方程式不仅可以表示一定物质间的某个反应,而且还可以表示
• 【答案】(1)× (2)× (3)× (4)× (5)× (6)× (7)× (8)×
离子反应离子方程式PPT课件
离子反应离子方程式PPT课件
• 2.下列几种导电性变化图像,把符合要求的图像序号填在相应的题目 后面括号中。
• (1)向H2SO4溶液中加入等体积、等物质的量浓度的Ba(OH)2溶液( ) • (2)向H2S溶液中通入Cl2直至过量( ) • (3)向AgNO3溶液通入少量HCl( )
【答案】
CaCO3 + 2HCl===CaCl2 + H2O+CO2↑
CaCO3 + 2H + + 2Cl - ===Ca2++2Cl-+H2O+CO2↑
CaCO3 + 2H + ===Ca2 + + H2O+CO2↑ 质量 电荷
【思维深化】
• 1.判断正误(正确的画“√”,错误的画“×”)。 • (1)水溶液中的反应一定是离子反应( ) • (2)离子反应一定有离子参加( ) • (3)离子反应只表示一个具体反应( ) • (4)碳酸钠与盐酸和醋酸反应的离子方程式相同( ) • (C5u)↓将(Na投入) 到CuSO4溶液中的离子反应为2Na+Cu2+===2Na++
离子反应离子方程式PPT课件
(6)氢氧化铁溶于氢碘酸中的离子反应为 Fe(OH)3+3H+===Fe3++3H2O( ) (7)向小苏打溶液中加入过量的澄清石灰水的离子反应为 2HCO- 3 +Ca2++2OH- ===CaCO3↓+2H2O+CO23-( ) (8)Cl2 通入水中的离子反应为 Cl2+H2O===2H++Cl-+ClO-( )
第二章
化学物质及其变化
第二节 离子反应 离子方程式
考点2 离子反应 离子方程式
栏目导航
01
夯实考点
02
考点突破
03 真题体验·直击高考
ቤተ መጻሕፍቲ ባይዱ
04
配套训练
1
夯实考点
【知识梳理】
• 1.离子反应 • (1)概念:有离子参加或有离子生成的反应统称为离子反应。
(2)离子反应的条件。
在稀 H2SO4 中分别加入下列物质,有关反应的离子方程式如下: A.加入 BaCl2 溶液:Ba2++SO24-===BaSO4↓ B.加入 CH3COONa 溶液:CH3COO-+H+===CH3COOH C.加入 Na2CO3 溶液:CO23-+2H+===CO2↑+H2O D.加入 Zn 粒:Zn+2H+===H2↑+Zn2+ E.加入 NaOH 溶液:H++OH-===H2O 从 A~E 可知离子反应发生的条件:①生成_难__溶___的物质,②生成_难__电__离___的物 质,③生成_易__挥__发___的物质,④发生_氧__化__还__原_____反应。
