Tau蛋白与α-突触核蛋白在常见神经系统退行性疾病中的致病机制
α-突触核蛋白的生物学功能及其在帕金森病中的作用

α-突触核蛋白的生物学功能及其在帕金森病中的作用熊中奎;胡雅儿【摘要】@@ α-突触核蛋白(α-synuclein)是一种脑内含量丰富的神经蛋白,既参与正常突触功能的维持,又与各种神经退行性疾病有关.在帕金森病(Parkinson's disease,PD)患者脑内,α-突触核蛋白是多巴胺神经元中嗜伊红染色Lewy小体主要成分.α-突触核蛋白基因位于染色体4q213-q22,均由5个外显子构成.【期刊名称】《中国病理生理杂志》【年(卷),期】2010(026)009【总页数】4页(P1855-1858)【关键词】α-突触核蛋白;帕金森病【作者】熊中奎;胡雅儿【作者单位】绍兴文理学院医学院临床医学部,浙江,绍兴,223000;上海交通大学医学院细胞调控实验室,上海,200025;上海交通大学医学院细胞调控实验室,上海,200025【正文语种】中文【中图分类】R363α-突触核蛋白(α-synuclein)是一种脑内含量丰富的神经蛋白,既参与正常突触功能的维持,又与各种神经退行性疾病有关。
在帕金森病(Parkinson’s disease,PD)患者脑内,α-突触核蛋白是多巴胺神经元中嗜伊红染色Lewy小体主要成分。
α-突触核蛋白基因位于染色体4q21.3-q22,均由5个外显子构成。
α-突触核蛋白由140个氨基酸残基构成,分子量约19 kD。
根据估算,α-突触核蛋白占脑匀浆蛋白含量的1%,在端脑中含量丰富。
最初研究认为α-突触核蛋白与核膜之间存在关联性,而后来的研究发现它可通过经典分泌通路被分布于各种质膜上。
α-突触核蛋白分子在自然状态下呈伸展状,其保守的赖氨酸和谷氨酸残基与两性端部基团(headgroup)相互作用,而中性基团插入到酰基链区域,使之在质膜上呈疏松的卷曲α-螺旋结构,伸展并平行于质膜的曲面[1]。
1 生物学功能到目前为止,还没有全面地认识α-突触核蛋白的生物学功能,但是现有资料至少表明α-突触核蛋白具有以下几种功能:(1)调节突触的可塑性。
神经退行性疾病与蛋白质聚集现象相关

神经退行性疾病与蛋白质聚集现象相关近年来,神经退行性疾病成为了全球范围内的一个严重健康问题。
许多研究表明,神经退行性疾病如阿尔茨海默病(Alzheimer's disease)、帕金森病(Parkinson's disease)和亨廷顿舞蹈病(Huntington's disease)等,与异常的蛋白质聚集现象密切相关。
这一发现引发了对蛋白质聚集对神经退行性疾病发展的作用的深入研究。
蛋白质聚集是指在生物体内,蛋白质分子失去正常的构象,由于环境或基因突变的影响,发生异常聚集形成堆积物。
这些堆积物通常富含β-淀粉样结构,形成蛋白质聚集现象,进而干扰正常的细胞功能。
许多神经退行性疾病患者在病变组织中发现了这些异常的蛋白质聚集物。
对于不同的神经退行性疾病,异常聚集的蛋白质种类和位置有所不同,但它们共同诱导了细胞功能障碍和神经元死亡。
首先,让我们来看看阿尔茨海默病(Alzheimer's disease)和蛋白质聚集的关系。
在阿尔茨海默病患者的大脑中,β-淀粉样蛋白(β-amyloid)和Tau蛋白是最常见的异常聚集物。
β-淀粉样蛋白是由β-淀粉样前体蛋白(β-amyloid precursor protein)生成的,而Tau蛋白则是神经元支持骨架的关键成分。
β-淀粉样蛋白聚集形成的斑块被认为是阿尔茨海默病的主要病理特征,并且与神经元死亡和记忆损失紧密相关。
同时,Tau蛋白的异常磷酸化和聚集也被认为是神经退行性疾病发展的重要因素。
接下来,我们转向帕金森病(Parkinson's disease)。
在帕金森病患者的大脑中,主要异常聚集物为α-突触核蛋白(α-synuclein)形成的Lewy小体。
α-突触核蛋白是一种神经元膜蛋白,在正常情况下在突触前区域发挥调节突触可塑性和神经递质释放的作用。
然而,在帕金森病中,α-突触核蛋白异常聚集形成Lewy小体,引发了神经毒性和神经元丧失。
铜稳态与神经退行性疾病

铜稳态与神经退行性疾病【摘要】人体从食物中获取铜,主要从肠道吸收,经过肝脏由胆汁排出体外。
铜参与人体中多项生理活动,尤其在维持中枢神经系统的正常功能上,起到非常重要的作用。
铜的稳态与神经退行性疾病有较大的关系。
铜稳态异常会导致星形胶质细胞功能异常,引起淀粉样蛋白、α-突触核蛋白、tau蛋白增多,增加神经炎症,加重氧化应激等。
【关键词】铜稳态、神经退行性疾病、阿尔茨海默病、帕金森病。
[1]1、概述铜在人体内是一种重要的金属,是许多生理蛋白和酶活动的重要媒介,它们可以促进细胞功能和中枢神经系统的发育。
同时,在诸多生理过程中,它作为催化剂,参与氧化还原反应,如能量提供、铁的平衡等[1]。
铜摄入过多或过少都会引发疾病,尤其是神经退行性疾病,动态平衡的铜稳态对于疾病的发生发展都密切相关。
2、外周铜代谢人体中的铜主要通过日常饮食来获取。
大量铜存在于海鲜、巧克力、坚果、食用菌类、绿叶蔬菜、豆类及谷类食品中。
它在小肠的近端部分被吸收。
吸收后的铜,主要与氨基酸或有机酸的配体形式的存在。
食物进入肠道后,特异性铜转运蛋白1(copper transporter 1,CTR1)和非特异性二价金属转运体(palent metal transporter 1,DMT1)负责从摄取的饮食中吸收铜。
食物中的大部分铜以Cu2+的氧化形式存在,必须还原成Cu+才能被消化系统有效吸收。
铜从肠上皮细胞通过腺苷三磷酸酶7A(adenosine triphosphatase 7A,ATP7A)进入血液。
铜通过CTR1膜蛋白进入细胞。
在人类细胞内,Cu+被普遍存在的含半胱氨酸的三肽谷胱甘肽(glutathione,r-glutamyl cysteingl +glycine,GSH)螯合,并储存在金属硫蛋白(metallothionein,MT)中;它可以被铜伴侣运送到特定的目标。
铜转运金属伴侣可以在胞浆池中护送来自CTR1的Cu+,以促进其向特定靶区室的供应。
神经系统疾病的蛋白质异常研究

神经系统疾病的蛋白质异常研究蛋白质是构成生命体的重要分子之一,它们在维持正常生理功能中起着关键作用。
然而,神经系统疾病过程中蛋白质异常功能的发生和累积,已被广泛认为是引发和促进疾病发展的重要因素之一。
本文将探讨神经系统疾病中蛋白质异常的研究进展,并探讨相关的治疗策略。
一、神经系统疾病中的蛋白质异常现象1.1 神经退行性疾病中的蛋白质聚集神经退行性疾病,如阿尔茨海默氏病和帕金森病,以异常的蛋白质聚集为特征。
在阿尔茨海默氏病中,β-淀粉样蛋白和Tau蛋白的异常聚积导致神经元的损伤和认知功能的下降。
而在帕金森病中,α-突触核蛋白(α-synuclein)的异常聚集导致多巴胺神经元的功能障碍和运动障碍的发生。
1.2 蛋白质突变与神经系统疾病的关联一些神经系统疾病与特定蛋白质的突变相关。
例如,亨廷顿舞蹈症是由HTT基因突变引起的,该基因编码产生亨廷顿蛋白(Huntingtin protein)。
亨廷顿蛋白的突变导致异常的扩增,进而引发神经元的死亡和病理特征的出现。
二、蛋白质异常对神经系统疾病发展的影响2.1 炎症和氧化应激反应的增加神经系统疾病中的蛋白质异常常常引发炎症和氧化应激反应的增加。
炎症反应和氧化应激可以促进蛋白质异常的形成和进一步的神经损伤,形成恶性循环。
因此,抑制炎症和氧化应激反应可能成为治疗神经系统疾病的一种策略。
2.2 神经元细胞死亡和功能障碍蛋白质异常的积累可以引发神经元的细胞死亡和功能障碍。
例如,在帕金森病中,α-突触核蛋白的异常聚集导致多巴胺神经元的损伤和功能障碍,进而造成运动障碍的出现。
因此,研究神经元细胞的保护策略和促进功能恢复的方法具有重要意义。
三、神经系统疾病蛋白质异常的治疗策略3.1 蛋白质清除策略清除异常蛋白质对于治疗神经系统疾病具有重要意义。
一种策略是通过免疫疗法来清除异常蛋白质,例如使用单克隆抗体来特异性识别和清除异常蛋白质的聚集体。
此外,促进细胞内的蛋白质降解途径,如自噬和蛋白酶体途径,也可以帮助降低蛋白质异常的积累。
突触核蛋白稳态-概述说明以及解释

突触核蛋白稳态-概述说明以及解释1.引言1.1 概述概述:突触核蛋白是一类在突触前端特异表达的蛋白质,对突触的形成和功能起着重要作用。
突触核蛋白的稳态是维持正常突触功能的关键因素,它受到多种调控机制的影响。
在突触核蛋白稳态失衡的情况下,可能导致突触功能异常,甚至引发神经系统疾病。
因此,深入了解突触核蛋白的功能、调控机制和稳态具有重要的科学意义和临床应用前景。
本文将探讨突触核蛋白稳态的相关内容,旨在增进对神经系统功能调控的认识,并为相关疾病的治疗提供新的思路和方法。
1.2文章结构1.2 文章结构本文将首先介绍突触核蛋白的概念和作用,探讨其在神经元内的重要性。
接着将深入探讨突触核蛋白的调控机制,包括转录调控、翻译后修饰以及功能调控等方面。
最后,结合前人研究成果,分析突触核蛋白稳态的影响因素和研究进展,为读者提供全面的了解和认识。
1.3 目的部分的内容如下所示:本文旨在探讨突触核蛋白稳态的重要性及其调控机制。
通过系统性地分析突触核蛋白在突触功能中的作用和调控机制,我们可以更好地理解突触核蛋白在神经系统中的重要性,以及其对神经元功能和突触传递的影响。
同时,本文还将讨论突触核蛋白稳态的影响因素和研究进展,旨在为进一步探索突触核蛋白在神经系统中的作用提供参考和指导。
通过对突触核蛋白稳态的深入研究,可以为神经科学领域的疾病诊断和治疗提供重要的理论基础和临床应用前景。
2.正文2.1 突触核蛋白的功能和重要性突触核蛋白是一种重要的细胞蛋白质,主要存在于突触前端,扮演着促进突触传递和维持突触稳定的关键角色。
突触核蛋白通过与其他突触相关蛋白相互作用,调节突触的结构和功能,参与神经递质释放、突触可塑性和突触后内部信号转导等过程。
突触核蛋白的功能主要包括以下几个方面:1. 突触传递调节:突触核蛋白能够调节突触后细胞的去极化和膜电位改变,从而影响神经递质的释放和突触传递过程。
2. 突触可塑性:突触核蛋白参与了突触的可塑性调控,包括长时程增强(LTP)和长时程抑制(LTD)等重要的突触可塑性过程。
tau蛋白截短原理

tau蛋白截短原理
tau蛋白截短原理是一个复杂的生物学过程,涉及到多个因素和机制。
首先,我们要明白tau蛋白是一种在神经元中发现的蛋白质,它在维持细胞结构和功能中起着重要作用。
然而,当tau蛋白发生异常时,会导致神经元的损伤和神经退行性疾病的发生。
tau蛋白截短是一种不正常的生物学现象,其中tau蛋白被切割成更短的形式。
这一过程是由一种称为胱天蛋白酶的酶催化的。
当胱天蛋白酶的活性增强时,它会切割tau蛋白,使其变得更短。
这种截短会导致tau蛋白失去其正常功能,并可能导致神经元的损伤。
除了胱天蛋白酶的作用外,逆转录酶复合物也参与了tau蛋白截短的过程。
逆转录酶复合物是一种在细胞内循环的复合物,它负责拯救被分解的蛋白质并将其运送回细胞表面。
当逆转录酶复合物的活性降低时,tau蛋白在细胞内停留的时间更长,增加了被胱天蛋白酶切割的可能性。
这种“交通堵塞”状态会导致神经元的损伤和神经退行性疾病的发生。
为了更好地理解tau蛋白截短的原理,还需要进一步研究胱天蛋白酶、逆转录酶复合物和其他相关分子的作用机制。
这将有助于发现新的治疗方法,以减轻神经退行性疾病对人类健康的影响。
因此,tau蛋白截短原理是一个复杂的过程,涉及到多个分子和机制的相互作用。
为了更好地理解这一过程,需要进一步深入研究相关分子的作用机制,并寻找新的治疗方法来减轻神经退行性疾病对人类健康的影响。
阿尔兹海默症的病理生理机制研究进展

阿尔兹海默症的病理生理机制研究进展阿尔兹海默症(Alzheimer's Disease,AD)是一种神经退行性疾病,是老年痴呆的主要形式之一。
其病理生理机制的研究一直是科学界关注的焦点。
本文将对阿尔兹海默症的病理生理机制研究进展进行探讨。
一、β-淀粉样蛋白的积聚阿尔兹海默症的主要病理特征是脑内异常沉积的β-淀粉样蛋白(amyloid-β protein,Aβ)斑块。
这些斑块主要由β-淀粉样蛋白在大脑中形成的异常积聚而成。
Aβ是由β-淀粉样前体蛋白(amyloid precursor protein,APP)经过酶的切割而产生的。
目前,研究者普遍认为,Aβ的过度积聚是阿尔兹海默症发病的重要原因之一。
二、tau 蛋白的异常磷酸化除了Aβ的异常积聚外,tau 蛋白在阿尔兹海默症的发病中也起到了重要的作用。
tau 蛋白是一种微管相关蛋白,其主要功能是维持神经元细胞的稳定性。
然而,在阿尔兹海默症患者中,tau 蛋白发生异常的磷酸化,导致其失去正常的功能,形成了神经纤维缠结。
这种神经纤维缠结的形成会抑制神经元的正常通信,最终导致记忆和认知功能的受损。
三、炎症反应的参与炎症反应在阿尔兹海默症的发病过程中也起到了重要的角色。
许多研究表明,慢性神经炎症反应对于病理生理机制的改变和神经元损伤具有重要影响。
在阿尔兹海默症患者的大脑组织中,可观察到炎症反应标志物的异常表达,如促炎细胞因子和细胞粘附分子的异常上调。
这些炎症反应的变化进一步加剧了神经细胞的损伤和炎症反应的进程,形成了恶性循环。
四、氧化应激的作用氧化应激是指细胞内外环境中自由基产生和清除失衡而导致的一系列破坏性反应。
阿尔兹海默症患者的大脑组织中常常会存在高水平的氧化应激。
自由基的生成和释放会导致神经细胞的氧化损伤,同时影响细胞内钙离子的平衡,最终导致神经元的凋亡和炎症反应的进一步加剧。
总结:阿尔兹海默症的病理生理机制非常复杂,目前的研究主要集中在Aβ的异常积聚、tau 蛋白的异常磷酸化、炎症反应的参与以及氧化应激等方面。
细胞自噬在神经系统疾病中的作用及其调控机制

细胞自噬在神经系统疾病中的作用及其调控机制随着人口老龄化的加剧,神经系统疾病已经成为人们健康的重要威胁之一。
目前发现,自噬是细胞中一种代谢清除系统,能够通过降解细胞内异常蛋白质和细胞器组分来维持细胞的正常代谢水平。
然而,当自噬功能受损时,爆发神经系统疾病的风险就增加了。
本文主要从细胞自噬在神经系统疾病中的作用及其调控机制两方面来进行探讨。
细胞自噬在神经系统疾病中的作用细胞自噬对于神经系统的正常功能发挥了关键的作用。
特别是与神经性变性疾病相关的异常蛋白质的降解和细胞器组分的清除,这些都是自噬作用发挥的关键作用。
自噬可以降解α-突触核心蛋白和Tau蛋白,以避免它们在神经元中形成团块,从而防止了阿尔茨海默病的发生。
此外,自噬还能降解有毒的蛋白质,如Huntingtin和α-肌动蛋白,以避免发生 Huntington 病和肌萎缩侧索硬化症。
自噬不但能够清除细胞中的一些异常蛋白质,还能调节神经元中的代谢性过程,维持神经元正常的功能活动。
例如,自噬调节神经元内线粒体的代谢,降低内线粒体氧化应激对神经元的伤害,在神经元疾病的发生中发挥着重要的保护作用。
细胞自噬在神经系统疾病中的调控机制虽然自噬在神经系统疾病中发挥着重要的作用,但自噬的执行过程受到很多因素的调控。
研究发现,自噬信号途径和自噬基因的表达水平、ATG蛋白和调控ATG蛋白的后翻译修饰水平等因素都会影响细胞自噬的完成程度。
最近一项研究表明,在正常神经系统中,β-淀粉样蛋白可以通过激活自噬来促进神经元的健康状态,从而预防神经退化病的发生。
然而,当β-淀粉样蛋白水平升高时,自噬被抑制,导致神经细胞发生异常,形成蛋白质聚集体,并最终导致神经退化。
此外,自噬过程的生物学调节机制也非常重要。
如PI3K/AKT/mTOR 信号通路能够正调节自噬,而 p53 和 AMPK 信号通路却能够负调节自噬。
研究表明,正常大脑干神经细胞中,AMPK信号通路能够促进细胞自噬,从而保护神经细胞不受糖尿病的毒性影响。
5种脑脊液生物标志物在鉴别诊断痴呆和帕金森综合征患者中的准确性
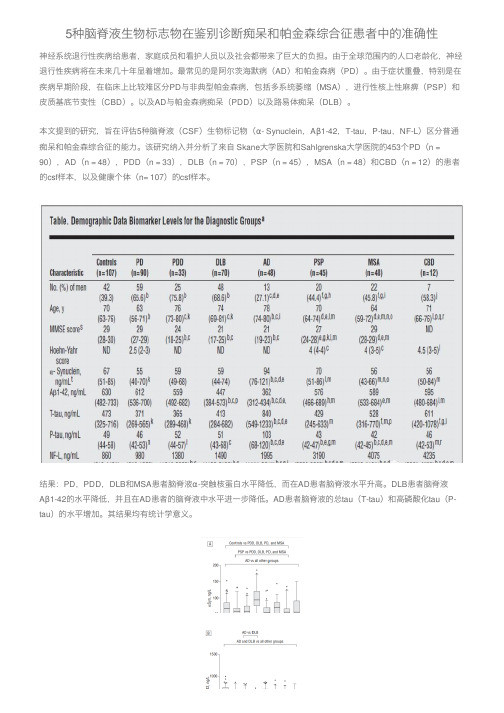
5种脑脊液⽣物标志物在鉴别诊断痴呆和帕⾦森综合征患者中的准确性神经系统退⾏性疾病给患者,家庭成员和看护⼈员以及社会都带来了巨⼤的负担。
由于全球范围内的⼈⼝⽼龄化,神经退⾏性疾病将在未来⼏⼗年显着增加。
最常见的是阿尔茨海默病(AD)和帕⾦森病(PD)。
由于症状重叠,特别是在疾病早期阶段,在临床上⽐较难区分PD与⾮典型帕⾦森病,包括多系统萎缩(MSA),进⾏性核上性⿇痹(PSP)和⽪质基底节变性(CBD)。
以及AD与帕⾦森病痴呆(PDD)以及路易体痴呆(DLB)。
本⽂提到的研究,旨在评估5种脑脊液(CSF)⽣物标记物(α- Synuclein,Aβ1-42,T-tau,P-tau,NF-L)区分普通痴呆和帕⾦森综合征的能⼒。
该研究纳⼊并分析了来⾃ Skane⼤学医院和Sahlgrenska⼤学医院的453个PD(n = 90),AD(n = 48),PDD(n = 33),DLB(n = 70),PSP(n = 45),MSA(n = 48)和CBD(n = 12)的患者的csf样本,以及健康个体(n= 107)的csf样本。
结果:PD,PDD,DLB和MSA患者脑脊液α-突触核蛋⽩⽔平降低,⽽在AD患者脑脊液⽔平升⾼。
DLB患者脑脊液Aβ1-42的⽔平降低,并且在AD患者的脑脊液中⽔平进⼀步降低。
AD患者脑脊液的总tau(T-tau)和⾼磷酸化tau(P-tau)的⽔平增加。
其结果均有统计学意义。
ROC曲线显⽰,这些⽣物标志物的联合使⽤可以将AD与DLB和PDD区分开,曲线下⾯积为0.90,α-突触核蛋⽩(α-Synuclein)和总tau(T-tau)对该模型贡献最⼤。
神经丝轻链蛋⽩(NF-L)的脑脊液⽔平在⾮典型帕⾦森病(即PSP,MSA和CBD)中显着增加,多变量回归分析显⽰单独的神经丝轻链(NF-L)的⽔平可区分PD与⾮典型帕⾦森病。
参考⽂献:Hall S, Öhrfelt A, Constantinescu R, et al . Accuracy of a Panel of 5 Cerebrospinal Fluid Biomarkers in the Differential Diagnosis of Patients With Dementia and/or Parkinsonian Disorders.Arch Neurol. 2012 Nov;69(11):1445-52.若家族中有2名以上痴呆患者,则他们可能罹患家族性阿尔茨海默病(FAD)。
阿尔茨海默病病理基础

阿尔茨海默病病理基础
阿尔茨海默病是一种常见的神经退行性疾病,其主要病理特征是大脑中神经细胞的死亡和突触的损失。
在阿尔茨海默病患者的大脑中,出现了两种异常蛋白质:β淀粉样蛋白和tau蛋白。
β淀粉样蛋白是由神经元中的APP(β淀粉样前体蛋白)切割而成的,而tau蛋白则是神经元细胞骨架的组成部分。
在阿尔茨海默病中,β淀粉样蛋白在大脑中沉积形成斑块,tau蛋白则聚集形成神经纤维缠结。
这些异常蛋白质的沉积和聚集导致神经元死亡和突触损失,最终导致大脑功能的丧失。
此外,阿尔茨海默病还伴随着神经炎症反应和氧化应激反应的增加。
神经炎症反应会引发免疫细胞的浸润和炎症介质的释放,进一步破坏神经元和突触。
氧化应激反应则会导致细胞内氧化损伤的增加,从而加速神经元的死亡。
虽然阿尔茨海默病的具体病因仍不清楚,但对其病理基础的研究有助于发展更有效的治疗策略和预防措施。
- 1 -。
tau蛋白在术后认知功能障碍中的作用及研究进展

tau蛋白在术后认知功能障碍中的作用及研究进展术后认知障碍是患者在全麻术后出现的一种神经系统并发症,表现为意识、认知、记忆等方面的功能障碍。
多种原因可以导致此病的发生,其发病机制尚不清楚,然而炎症因子导致的tau蛋白过度磷酸化对术后认知功能障碍的影响是目前的研究热点。
现将其研究进展作一综述。
标签:术后认知功能障碍tau蛋白磷酸化【文献标识码】B【文章编号】1004-4949(2014)11-0792-01术后认知功能障碍是指患者在接受全麻或者手术之后出现的以精神错乱、记忆力下降、注意力不集中等为主要临床症状的一种疾病,但其发病机制目前尚不明确。
近年来tau蛋白在术后认知功能障碍发生中的作用逐渐成为研究热点,本文就tau蛋白在术后认知功能障碍中的研究进展综述如下。
1术后认知功能障碍及其炎症机制研究近况术后认知功能障碍(POCD)是术前无精神异常的患者在术后早期出现的大脑功能活动紊乱并以认知功能减退为特征的脑功能失调,是手术后常见的并发症之一。
该病主要表现为意识、认知、记忆等方面的功能障碍。
多数患者的术后认知障碍是可逆的,也有少部分患者可长期存在或终生认知功能障碍[1]。
多种因素均可影响患者的术后认知功能障碍,如麻醉因素、手术因素、围手术期处理因素等。
近年来,炎症反应机制在术后认知功能障碍中的作用成为研究的热点。
手术、创伤、感染等各种因素均可造成中枢神经系统内的炎症细胞以及炎症因子增多。
炎症细胞包括胶质细胞以及外周炎症细胞。
星形胶质细胞在炎症反应中浓度过度升高,不但损伤神经组织,而且抑制突触再生[2],同时诱导炎症介质的产生,如IL-6 TNF-a等,导致急性炎症反应以及脑水肿,从而介导神经损伤和认知功能障碍。
另一方面,外周的淋巴细胞以及单核细胞会通过血脑屏障而募集到中枢神经系统,导致炎症、水肿以及脱髓鞘等病变,进一步影响认知功能。
术后感染、组织损伤、应激反应等均可使中枢神经系统内的炎症因子水平增高,其来源于中枢神经系统内胶质细胞和炎症细胞的释放以及外周炎症介质通过多种途径进入中枢神经系统。
tau蛋白磷酸化机制

tau蛋白磷酸化机制Tau蛋白是神经元突触中的重要基质蛋白,它在突触的稳定性、神经元信号传递和内部物质运输等方面扮演着重要角色。
然而,在阿尔茨海默病等神经退行性疾病中,Tau蛋白的异常聚集和磷酸化状态的改变会导致神经元损伤和神经系统衰退。
本文将就Tau蛋白的磷酸化机制进行详细的阐述。
一、Tau蛋白的结构与功能Tau蛋白是一种高度可磷酸化的蛋白质,其主要在神经元轴突的微管组装和稳定中发挥重要作用。
Tau蛋白主要存在于神经元胞体和轴突中,这种蛋白质通过微管系统的动态调节来维持神经元的形态和功能。
除此之外,Tau蛋白还参与了突触稳定性的维持和神经元内部物质运输的正常进行。
二、Tau蛋白的磷酸化过程Tau蛋白的功能和磷酸化状态息息相关,当Tau蛋白中的磷酸化水平发生改变时,其在轴突功能和细胞骨架结构等方面的维持都会产生重要的影响。
磷酸化是通过蛋白激酶来实现的,Tau蛋白主要被四种蛋白激酶磷酸化,分别为cyclin-dependent kinase 5 (CDK5)、Glycogen synthase kinase-3β (GSK-3β)、microtubule-affinityregulating kinase (MARK)和Ca2+/calmodulin-dependent protein kinase II (CaMKII)。
每种蛋白激酶在磷酸化Tau蛋白的过程中都有特定的作用。
CDK5主要将Tau蛋白的Ser235和Ser404位点磷酸化,这种磷酸化状态在阿尔茨海默病中会发生异常。
GSK-3β主要磷酸化Tau蛋白的Ser199和Ser396位点,这种磷酸化状态与Tau蛋白的聚集有着密切的关系。
MARK主要磷酸化Tau蛋白的Ser262、Ser293和Ser324位点,这种磷酸化状态与Tau蛋白在微管动态稳定性中的作用密切相关。
CaMK-II主要磷酸化Tau蛋白的Ser199位点,这种磷酸化状态在Tau蛋白的亲和力和空间构象的改变中有着重要作用。
内质网应激在神经退行性疾病中的作用

内质网应激在神经退行性疾病中的作用神经退行性疾病是指一类由神经元(神经细胞)的死亡或萎缩引起的不可逆性神经系统疾病,主要包括阿尔茨海默病、帕金森病、亨廷顿病、肌萎缩侧索硬化症等。
这些疾病通常发生在老年人身上,严重影响他们日常生活和生存质量,而且目前还没有有效的治疗方法。
因此,寻找治疗这些疾病的新靶点和方法是非常重要的。
近年来,越来越多的实验和研究表明,内质网应激可能是神经退行性疾病发生和发展的关键因素之一,因为内质网与机体内蛋白的合成、折叠和质量控制密切相关,并且维持细胞健康和稳态的平衡。
因此,本文将探讨内质网应激在神经退行性疾病中的作用和机制。
一、内质网应激的定义和机制内质网是细胞质中一个复杂的内膜系统,包括粗面内质网和平滑内质网两部分。
粗面内质网上有大量的核糖体粒子,可以合成和修饰蛋白质,而平滑内质网则主要参与细胞的代谢和信号传导。
内质网应激是指内质网内膜上的蛋白质在合成或折叠过程中出现异常,导致内质网信号传导通路的激活,进而引起一系列生物学响应。
内质网应激的主要机制包括:1. 非特异性拓扑损伤(non-specific topological insult):由于各种条件导致内质网膜质量异常或破裂,进而导致蛋白质聚集和积累;2. 蛋白质翻译和折叠异常(protein translation and folding abnormalities):由于合成速度过快或质量控制机制受到损伤,导致翻译或折叠异常,并产生毒性蛋白质;3. 信号传导途径的破坏(disruption of signaling pathways):由于各种途径受到损伤,内质网应激信号传导途径被激活。
二、2.1 内质网应激与阿尔茨海默病阿尔茨海默病是一种神经退行性疾病,它的主要病理特征是脑内β淀粉样蛋白斑和Tau蛋白沉积,导致大脑神经元死亡和功能障碍。
研究表明,内质网应激与阿尔茨海默病的关系非常密切。
首先,β淀粉样蛋白斑和Tau蛋白在合成和折叠过程中很可能引发内质网应激。
阿尔茨海默症的原理

阿尔茨海默症的原理阿尔茨海默症是一种慢性进行性的神经退行性疾病,主要影响老年人,是导致老年性痴呆的最常见原因。
阿尔茨海默症的病理特征包括大脑中的β-淀粉样蛋白斑块沉积、神经纤维缠结( 由异常磷酸化的tau蛋白形成)、神经元和突触的损失以及脑组织的萎缩。
关于阿尔茨海默症的发病机制,目前有多个假说:1.(淀粉样蛋白假说:这是最广为接受的理论之一。
它认为阿尔茨海默症的发生与大脑中β-淀粉样蛋白的异常聚集有关。
Aβ蛋白是从一种大分子前体蛋白经过切割产生的小肽段。
在AD患者的大脑中,Aβ蛋白错误折叠并形成不溶性的纤维,进而聚集成斑块,这些斑块被称为“老年斑”。
斑块的形成可能导致神经元功能障碍和细胞死亡。
2.(Tau蛋白假说:Tau蛋白通常与微管结合,帮助维持神经细胞内的结构和运输系统。
在AD中,Tau蛋白发生异常磷酸化,导致其从微管上脱离并形成不溶性的纤维缠结。
这些缠结破坏了细胞内部的运输系统,导致细胞功能紊乱和死亡。
3.(神经炎症假说:这个理论认为,阿尔茨海默症的发展与大脑中的慢性炎症反应有关。
免疫细胞 如小胶质细胞)在Aβ斑块周围激活,释放炎症介质,这可能加剧神经损伤。
4.(氧化应激假说:氧化应激是指细胞内自由基的产生与抗氧化防御系统之间的失衡。
在AD中,氧化应激可能导致脂质、蛋白质和DNA的损伤,从而促进细胞功能障碍和死亡。
5.(神经递质变化假说:AD患者的大脑中,某些神经递质(如乙酰胆碱)的水平显著下降。
这种变化与认知功能的丧失有关。
6.(遗传和环境因素:遗传因素,如APOEε4等基因变异,与AD 的风险增加有关。
此外,环境因素如生活方式、教育水平、心血管健康等也被认为可能影响AD的发展。
尽管上述假说提供了对AD发病机制的理解,但目前尚无单一理论能够完全解释AD的所有病理过程。
实际上,这些机制可能是相互关联和相互作用的,共同导致疾病的发展和进展。
因此,阿尔茨海默症的发病原理仍然是一个活跃的研究领域,科学家们正在不断探索新的治疗方法和干预措施。
蛋白质聚集体在神经系统疾病中的作用

蛋白质聚集体在神经系统疾病中的作用随着人类寿命的增长和生活方式的改变,神经系统疾病的发病率也在逐年上升。
这些疾病包括阿尔茨海默病、帕金森病、亨廷顿病等,它们在患者的日常生活中带来了巨大的负担和痛苦,也对社会、经济、医疗等方面带来了重大挑战。
近年来,人们开始重视蛋白质聚集体在神经系统疾病中的作用,这一领域的发展也为我们深入研究这些疾病的病理机制提供了新的方向。
蛋白质聚集体由多个蛋白质的异常聚集所组成,它们在神经系统疾病中的作用已经得到了广泛的研究。
蛋白质聚集在神经元中形成的堆积物被称为包涵体(inclusion body),它们可以影响细胞内各种生物学过程,并且在长时间内慢慢积蓄,最终导致细胞死亡和神经系统疾病的出现。
蛋白质聚集体在阿尔茨海默病中的作用阿尔茨海默病(Alzheimer's disease,AD)是一种常见的老年性神经系统退行性疾病,它的主要症状包括失忆、认知能力下降、行为异常等。
近年来,研究表明AD的主要发病机制与β淀粉样蛋白(β-amyloid,Aβ)蛋白质聚集体的形成有关。
在AD患者的脑组织中,Aβ聚集成大量不可溶性斑块,其主要成分为Aβ42,这种聚集体对神经元活性产生毒性影响,导致神经元退行性变和细胞死亡,从而影响大脑的功能。
蛋白质聚集体在帕金森病中的作用帕金森病(Parkinson's disease,PD)是一种常见的神经系统运动障碍性疾病,其主要症状是肌肉僵硬、震颤和行动迟缓等。
PD 患者的大脑中主要发生多巴胺神经元死亡,这些神经元损伤的形成与α-突触核蛋白(α-synuclein,α-syn)聚集体有关。
α-syn是一种普遍存在于神经系统中的蛋白质,其异常聚集和沉积是引起PD 的主要病理机制之一。
α-syn聚集体形成的中毒效应主要包括诱导神经元凋亡和细胞质基质的束缚,导致细胞膜破裂和细胞死亡。
蛋白质聚集体在亨廷顿病中的作用亨廷顿病(Huntington's disease,HD)是一种常见的遗传性神经系统疾病,其特征是中枢神经系统神经元的变性和凋亡,导致肌肉僵硬、智力下降等症状。
不同亚型的tau蛋白沉积部位

不同亚型的tau蛋白沉积部位Tau蛋白是一种在人脑中广泛存在的蛋白质,它在调控微管的稳定性和形态功能中发挥重要作用。
然而,当Tau蛋白发生异常聚集和沉积时,可能与神经退行性疾病如阿尔茨海默病和帕金森病等有关。
多种亚型的Tau蛋白沉积部位不同,以下是关于不同亚型的Tau蛋白沉积部位的介绍。
1.阿尔茨海默病(Abberant tau):阿尔茨海默病是一种神经退行性疾病,最为常见的临床病理特征就是Tau蛋白的异常沉积。
在阿尔茨海默病患者的大脑中,Tau蛋白发生了磷酸化异常,并形成了神经原纤维缠结和神经元线索。
这些沉积物主要位于大脑皮层和海马区等高级认知功能区域。
研究表明,这些沉积物的形成与神经元内部运输的紊乱有关。
2.皮肤神经纤维结构病(Frontotemporal lobar degeneration, FTD):皮肤神经纤维结构病是一类神经退行性疾病,其病理特征与Tau 蛋白的异常沉积有关。
在FTD患者的大脑中,Tau蛋白主要沉积于额叶和颞叶区域。
这些沉积物不同于阿尔茨海默病中的神经原纤维缠结,而是形成了一种新的病理学亚型,称为前额颞部神经纤维融合蛋白病(Frontotemporal lobar degeneration, FTLD)。
FTD的临床症状主要包括个性与行为改变、语言障碍和运动障碍等。
3.帕金森病(parkinsonian tauopathies):帕金森病是一种以肌肉抖动、肌力减退和运动障碍为主要症状的神经退行性疾病,其病理特征之一就是Tau蛋白的异常沉积。
在帕金森病患者的大脑中,Tau蛋白主要沉积于大脑腹侧纵隔核和中脑黑质等区域。
这些沉积物与帕金森病的运动障碍症状密切相关,可能干扰了神经传递的正常功能。
4. supranuclear palsy (PSP):PSP是一种进展性的神经退行性疾病,其主要临床特征是步态和眼球运动异常。
在PSP患者的大脑中,Tau蛋白主要在大脑皮质和脑干区域沉积,并形成圆球体和资质体等病理学特征。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
・ 综
述・
T a u 蛋 白与 一 突触核 蛋 白在 常见神经 系统退行性疾病 中的致病机 制
唐 智 伟 , 张淑 坤 , 吴世政
( 1 . 青海大学医学院, 青海 西宁 8 1 0 0 1 6 ; 2 . 青海省人 民医院神 经内科 , 青海 西宁 8 1 0 0 0 7 )
d y s un f c t i o n , a n d P D ma n i f e s t s ma i n l y mo t o r i mp a i m e r n t . Th e t wo d i s e a s e s a f f e c t a b o u t 5 0 mi l l i o n p e o p l e i n t h e wo r l d ,
关性 加 以 综 述 。
【 关键 词】 T a u 蛋 白; 一 突触核蛋 白; 阿尔茨海默症 ; 帕金 森病
【 中图分类号】 R 7 4 1
【 文献标识码】 A
【 文章编号】
Pa t h o g e n e s i s o f Ta u p r o t e i n a n d o L — s y n u c l e i n i n c o mm o n d e g e n e r a t i v e d i s e a s e s o f n e r v o u s s y s t e m. T A NG Zh i - w e i ,
Z H A N G S h u - k u n ,W U S h i - z h e n g . .Me d i c a l C o l l e g e o f Q i n g h a i U n i v e r s i t y ,X i n i n g 8 1 0 0 1 6 ,Q i n g h a i ,C H I N A ; 2 . D e p a r t m e n t fN o e u r o l o g y , Q i n g h a i P r o v i n c i a l P e o p l e H o s p i t a l , X i n i n g 8 1 0 0 0 7 , Q i n g h a i , C H I N A
【 A b s t r a c t 】A l o n g w i t h he t c o n t i n u o u s d e v e l o p m e n t o f s o c i a l e c o n o m y a n d t h e a g i n g o f p o p u l a t i o n s , h t e o n s e t o f
【 摘要 】 随着 经济 社会 的不 断发展 , 社会 老龄化 趋势 日益加 剧 , 与 年龄相 关 的神经 系统退行 性疾病 的发 病 也 随之增加 。而在这其 中, 阿尔茨海默症( AD ) 与帕金森病( P D ) 是最经 典的两种神经系统退行性疾病 , AD主要 表现
为进行 性 记忆 功能 减退 和认 知 功能 障碍 ; 而P D主要表 现为 运动 功能 障碍 , 这 两种 疾病 影 响着全世 界 范围 内约 5 0 0 0 万的人 口, 而这其 中大部分 病例 的分 布特点表现为散 发。研究表 明 A D及 P D发病分别 与 T a u 蛋 白及 一 突触 核 蛋 白的关 系密切 , 本 文就 T a u 蛋 白与O t 一 突触 核蛋 白在这两种神 经系统退行性疾病 中的发病机制及两种蛋 白的相
a g e — r e l a t e d n e u r o d e g e n e r a t i v e d i s e a s e s i s i n c r e a s i n g . Al z h e i me r ’ S d i s e a s e( AD ) a n d P a r k i n s o n ’ S d i s e a s e( P D) a r e a mo n g
t h e mo s t c l a s s i c n e u r o d e g e n e r a t i v e d i s e a s e s . AD i s ma i n l y c h a r a c t e r i z e d b y me mo r y f u n c t i o n i mp a i r me n t a n d c o g n i t i v e
Ha i n a n Me d J ,Fe b .2 0 1 7 .Vo 1 .2 8 ,No .3
海 南医学 2 0 1 7 年2 月第 2 8 卷第 3 期
d o i : 1 0 . 3 9 6 9 / j . i s s n . 1 0 0 3 — 6 3 5 0 . 2 0 1 7 . 0 ቤተ መጻሕፍቲ ባይዱ . 0 3 5
a n d t h e c a s e s a r e s p o r a d i c . S t u d i e s h a v e s h o wn ha t t t h e p a t h o g e n e s i s o f AD a n d P D i s c l o s e l y r e l te a d t o t a u p r o t e i n a n d
—
s y n u c l e i n . Th e r e v i e w s u mma r i z e s t h e p a t h o g e n e s i s o f t a u p r o t e i n a n d O / 一 s y n u c l e i n i n he t wo t d i s e a s e s a n d he t c o r r e l a —
