2015治疗用生物制品批准临床
国家药品监督管理局公告2018年第94号——关于临床试验用生物制品参照药品一次性进口有关事宜的公告

国家药品监督管理局公告2018年第94号——关于临床试验用生物制品参照药品一次性进口有关事宜的公
告
文章属性
•【制定机关】国家药品监督管理局
•【公布日期】2018.11.30
•【文号】国家药品监督管理局公告2018年第94号
•【施行日期】2018.11.30
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】药政管理
正文
国家药品监督管理局公告
2018年第94号
关于临床试验用生物制品参照药品一次性进口有关事宜的公
告
为落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号)的有关要求,支持和鼓励生物类似药的研发,更好地满足公众用药需求,现决定对符合以下条件、用于临床试验参照药的生物制品,可予以一次性进口。
现将有关事项公告如下:
一、可以申请一次性进口的生物制品范围包括:
(一)国内已经批准注册,但药品研发机构或者生产企业无法及时从国内市场获得的原研生物制品;
(二)国外已上市、国内尚未批准注册但已获批开展临床试验的原研生物制品。
二、国家药品监督管理局委托药品审评中心负责办理临床试验用生物制品参照药品一次性进口的受理、审查及审批。
三、本公告自发布之日起实施。
《关于研制过程中所需研究用对照药品一次性进口有关事宜的公告》(国家食品药品监督管理总局公告2016年第120号)、《生物类似药研发与评价技术指导原则(试行)》(国家食品药品监督管理总局通告2015年第7号)与本公告不一致的,以本公告为准。
特此公告。
国家药监局
2018年11月30日。
2015年6月CDE药品审评报告

2015 年6 月CDE 药品审评报告Insight - China Pharma Data2015 年7 月2015 年6 月CDE 药品审评报告——丁香园Insight 数据库6 月看点∙国内第一个 1.1 类 DPP-4 抑制剂申报上市∙ 3.1 类首家抢仿扎堆丙肝领域∙吉利德 Sofosbuvir / GS-5816 二联复方首次在中国申报∙海正、人福、扬子江等企业收获 1.1 类临床批件∙赛诺菲、辉瑞新型生物制品首次在中国申报_______________________________________________________________________________________根据丁香园Insight - China Pharma Data 数据库最新统计,2015 年6 月CDE 共承办新的药品注册申请有783 个(以受理号计,下同),与5 月份(797 个)几乎持平。
2015 年上半年已经走完,至此我们来回顾下2015 年上半年CDE 承办药品注册申请的数量情况:Insight 系列报告以下,分别来分析化药、中药、生物制品的申报受理及审评审批情况。
一、化药申报受理情况:6 月份CDE 共承办新的化药注册申请以受理号计684 个。
其中各个申请类型的具体数据如下所示:1. 新药(1)1.1 类新药国内第一个1.1类DPP-4抑制剂申报上市根据Insight 数据库统计,6 月份CDE 共承办化药1.1 类新药申请以受理号计有13 个,涉及6 个品种,其中,江苏恒瑞的磷酸瑞格列汀申请上市,其余为临床申请。
具体数据如下所示:SPH3127片是上海医药近五年来的第一个 1.1 类新药,并且属于重大专项审评品种。
目前该品种处于 IND 序列药学和药理毒理专业审评中,而排在 SPH3127 前后的非重大专项品种还处在排队审评中。
江苏恒瑞的瑞格列汀片剂于 2015 年 6 月初申报上市,这是国内企业研发的第一个处于上市申请阶段的DPP-4抑制剂,恒瑞继续当仁不让地领跑国内药品研发。
治疗用生物制品注册分类新旧对照

治疗用生物制品注册分类新旧对照2017年10月23日,CFDA发布《药品注册管理办法(修订稿)》,同时附件《生物制品注册分类和申报资料要求(试行)》将治疗用生物制品进行了重新分类,由原来的15类变为5类,分类也更加明确。
同时,创新药的定义由原来的“中国新”变为“全球新”。
1类:新型生物制品:指未在境内外上市的全新治疗用生物制品。
由已上市的治疗用生物制品成分组成的新复方制剂,在境内外已上市制品基础上,改变氨基酸序列、改变蛋白质高级结构和多聚体形态的,改变翻译后修饰,或者对产物进行化学修饰(包括PEG化偶联修饰等)的,应当按照注册分类1类申报。
基因治疗和细胞治疗的全新生物产品(如创新机制、新载体、新靶细胞等。
)须根据第1类的注册分类申报。
2类:改良型生物制品:指在境内外已上市制品基础上,对其制剂水平的结构(如影响释放和生物利用度的粒径及其分布、包合、聚合结晶等制剂技术产生的结构改变)剂型、处方工艺、给药途径等进行优化,对适应症进行增加、优化或者用药人群的增加(如增加儿童、老年人用药人群);或者首次采用DNA重组技术制备的制品(例如以重组技术替代合成技术、生物组织提取技术等)、与境内外已上市制品制备方法不同的制品(例如采用不同表达体系、宿主细胞等)。
在国内外已上市产品基础上改进的基因治疗和细胞治疗生物制品,按第二类注册分类申报。
除儿童用药外,改进后的新生物制品应具有明显的临床优势,或产品的安全性和质量控制有显著提高。
3类:境外上市、境内未上市的生物制品:若原研药/参照药仅在境外上市,申请人按生物类似药研发的生物制品可按此类别申报临床试验申请;不能按生物类似药技术要求进行研制申报的,申请人应根据制品情况按照注册分类1类或者2类申报临床试验申请。
原则上,注册分类3的生物制品应当在其原研药/参照药获得境内临床试验批准后方可开展临床试验。
完成临床试验后,根据当时情势按照适宜的注册分类提交上市申请。
4类:境内已上市的生物制品。
中国药典三部2015版凡例

中国药典三部2015版凡例《中国药典》三部2015版凡例总则⼀、《中华⼈民共和国药典》简称《中国药典》,依据《中华⼈民共和国药品管理法》组织制定和颁布实施。
《中国药典》⼀经颁布实施,其相关内容的上版标准或其原国家标准即同时停⽌使⽤。
《中国药典》由⼀部、⼆部、三部、四部及其增补本组成,药典⼀部收载药材和饮⽚、植物油脂和提取物、成⽅制剂和单味制剂等;药典⼆部收载化学药品、抗⽣素、⽣化药品、放射性药品等;药典三部收载⽣物制品;各部内容分别包括凡例、正⽂(各论)和通则。
本版药典新增第四部,集中收载药典通则和药⽤辅料,为便于药典使⽤,对部分正⽂(各论)品种常⽤的通则亦列于各部之后。
除特别注明版次外,《中国药典》均指现⾏版《中国药典》。
本部为《中国药典》三部。
⼆、国家⽣物制品标准由凡例、⽣物制品通则、总论与正⽂(各论)及其引⽤的检测⽅法通则(简称通则)共同构成。
本部药典收载的凡例、⽣物制品通则、总论、通则对未载⼊本版药典但经国务院药品监督管理部门颁布的其他⽣物制品国家标准具同等效⼒。
三、凡例是为正确使⽤《中国药典》进⾏质量检定的基本原则,是对《中国药典》正⽂(各论)、⽣物制品通则、总论、通则及与质量检定有关的共性问题的统⼀规定。
⽣物制品通则是对各论⽣产和质量管理规范的原则性要求。
总论是对某⼀类别⽣物制品⽣产及质量控制的通⽤性技术要求。
四、凡例、⽣物制品通则、总论和通则中采⽤“除另有规定外”这⼀⽤语,表⽰存在与凡例、⽣物制品通则、正⽂(总论) 或通则有关规定不⼀致的情况时,则在正⽂(各论)中另作规定,并按此规定执⾏。
五、正⽂(各论)所设各项规定是针对符合中国现⾏《药品⽣产质量管理规范》(Good manufacture Practices, GMP ) 的产品⽽⾔。
任何违反GMP或有未经批准添加物质所⽣产的药品,即使符合《中国药典》或按照《中国药典》没有检出其添加物质或相关杂质,亦不能认为其符合规定。
六、《中国药典》的英⽂名称为Pharmacopoeia of The People’s Republic of China;英⽂简称为Chinese Pharmacopoeia;英⽂缩写为Ch. P . 。
国家药品审评中心审评人员公示名单2015.04
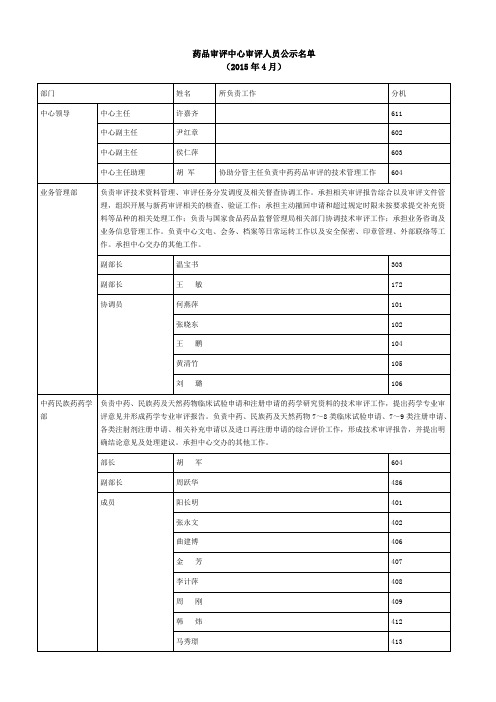
罗建辉、高恩明、白玉、项金忠
药理毒理学部
王庆利、韩玲、王海学、朱家谷、孙涛、胡晓敏、笪红远、朱飞鹏、宁可永、光红梅、黄芳华
中药民族药临床部
李攻戍、刘炳林、吕佳康、裴小静
化药临床一部
杨志敏、高晨燕、赵德恒、陈晓媛、杨焕、张杰
化药临床二部
王涛、杨进波、卓宏、赵明、王水强、左晓春、赵建中、谢松梅、钱思源、华尉利、鲁爽
副部长主持工作杨志敏304副部长579成员543王朝云547554化药临床二部负责神经系统药物循环系统药物肾脏泌尿系统药物生殖系统药物消化系统药物抗感染药物电解质酸碱平衡及营养药扩容药皮肤科及五官科药物器官移植外科和其他化学药物以及治疗和预防用生物制品临床试验申请包括国际多中心临床试验申请注册申请的临床研究资料的技术审评工作提出临床专业审评意见并形成临床专业审评报告
生物统计学部
黄钦
副部长
李攻戍
487
成员
薛斐然
418
周贝
419
裴小静
425
刘炳林
426
吕佳康
427
化药临床一部
负责精神障碍疾病药物、镇痛药及麻醉科药物、内分泌用药、抗风湿及免疫药物、呼吸系统及抗过敏药物、抗肿瘤药物、血液病药物、医学影像学等化学药物以及治疗和预防用生物制品临床试验申请(包括国际多中心临床试验申请)、注册申请的临床研究资料的技术审评工作,提出临床专业审评意见并形成临床专业审评报告。负责上述治疗领域化学药品1~4类及进口药注册申请、国际多中心临床试验申请、相关补充申请的评价工作,形成技术审评报告,并提出明确结论意见及处理建议。承担中心交办的其他工作。
副部长(主持工作)
杨建红
607
副部长
黄晓龙
《中国药典》2015年版目录(三部四部)

附件《中国药典》2015年版目录三部生物制品通则1生物制品生产检定用菌毒种管理规程2生物制品国家标准物质制备和标定规程3生物制品生产用原材料及辅料质量控制规程4生物制品分批规程5生物制品分装和冻干规程6生物制品包装规程7生物制品贮藏和运输规程8免疫血清生产用马匹检疫和免疫规程9血液制品生产用人血浆10生物制品生产检定用动物细胞基质制备及检定规程总论1人用疫苗总论2人用重组DNA蛋白制品总论3人用重组单克隆抗体制品总论4微生态活菌制品总论Ⅰ预防类1伤寒疫苗2伤寒甲型副伤寒联合疫苗3伤寒甲型乙型副伤寒联合疫苗4伤寒Vi多糖疫苗5重组B亚单位/菌体霍乱疫苗(肠溶胶囊)6A群脑膜炎球菌多糖疫苗7A群C群脑膜炎球菌多糖疫苗8A群C群脑膜炎球菌多糖结合疫苗9ACYW135群脑膜炎球菌多糖疫苗10b型流感嗜血杆菌结合疫苗11吸附白喉疫苗12吸附白喉疫苗(成人及青少年用)13吸附破伤风疫苗14吸附白喉破伤风联合疫苗15吸附白喉破伤风联合疫苗(成人及青少年用) 16吸附百日咳白喉联合疫苗17吸附百白破联合疫苗18吸附无细胞百白破联合疫苗19皮上划痕用鼠疫活疫苗20皮上划痕人用炭疽活疫苗21皮上划痕人用布氏菌活疫苗22皮内注射用卡介苗23钩端螺旋体疫苗24乙型脑炎减毒活疫苗25冻干乙型脑炎灭活疫苗(Vero细胞)26森林脑炎灭活疫苗27双价肾综合征出血热灭活疫苗(Vero细胞)28双价肾综合征出血热灭活疫苗(地鼠肾细胞)29双价肾综合征出血热灭活疫苗(沙鼠肾细胞)30冻干人用狂犬病疫苗(Vero细胞)31冻干甲型肝炎减毒活疫苗32甲型肝炎灭活疫苗(人二倍体细胞)33重组乙型肝炎疫苗(酿酒酵母)34重组乙型肝炎疫苗(CHO细胞)35重组乙型肝炎疫苗(汉逊酵母)36甲型乙型肝炎联合疫苗37麻疹减毒活疫苗38腮腺炎减毒活疫苗39风疹减毒活疫苗(人二倍体细胞)40水痘减毒活疫苗41麻疹腮腺炎联合减毒活疫苗42麻疹风疹联合减毒活疫苗43麻腮风联合减毒活疫苗44流感全病毒灭活疫苗45流感病毒裂解疫苗46口服脊髓灰质炎减毒活疫苗(猴肾细胞)47脊髓灰质炎减毒活疫苗糖丸(人二倍体细胞) 48脊髓灰质炎减毒活疫苗糖丸(猴肾细胞)Ⅱ治疗类1白喉抗毒素2冻干白喉抗毒素3破伤风抗毒素4冻干破伤风抗毒素5多价气性坏疽抗毒素6冻干多价气性坏疽抗毒素7肉毒抗毒素8冻干肉毒抗毒素9抗蝮蛇毒血清10冻干抗蝮蛇毒血清11抗五步蛇毒血清12冻干抗五步蛇毒血清13抗银环蛇毒血清14冻干抗银环蛇毒血清15抗眼镜蛇毒血清16冻干抗眼镜蛇毒血清17抗炭疽血清18抗狂犬病血清19人血白蛋白20冻干人血白蛋白21人免疫球蛋白22冻干人免疫球蛋白23乙型肝炎人免疫球蛋白24冻干乙型肝炎人免疫球蛋白25静注乙型肝炎人免疫球蛋白(pH4)26冻干静注乙型肝炎人免疫球蛋白(pH4)27狂犬病人免疫球蛋白28冻干狂犬病人免疫球蛋白29破伤风人免疫球蛋白30冻干破伤风人免疫球蛋白31静注人免疫球蛋白(pH4)32冻干静注人免疫球蛋白(pH4)33人凝血因子Ⅷ34人纤维蛋白原35人纤维蛋白粘合剂36人凝血酶原复合物37抗人T细胞猪免疫球蛋白38抗人T细胞兔免疫球蛋白39注射用重组人促红素(CHO细胞)40重组人促红素注射液(CHO细胞)41注射用重组人干扰素α1b42重组人干扰素α1b注射液43重组人干扰素α1b滴眼液44注射用重组人干扰素α2a45重组人干扰素α2a注射液46重组人干扰素α2a栓47注射用重组人干扰素α2a(酵母)48注射用重组人干扰素α2b49重组人干扰素α2b注射液50重组人干扰素α2b滴眼液51重组人干扰素α2b栓52重组人干扰素α2b乳膏53重组人干扰素α2b凝胶54注射用重组人干扰素α2b(酵母)55注射用重组人干扰素α2b(假单胞菌)56重组人干扰素α2b注射液(假单胞菌)57重组人干扰素α2b喷雾剂(假单胞菌)58重组人干扰素α2b软膏(假单胞菌)59注射用重组人干扰素γ60注射用重组人白介素-261重组人白介素-2注射液62注射用重组人白介素-2(Ⅰ)63注射用重组人白介素-1164注射用重组人白介素-11(酵母)65重组人粒细胞刺激因子注射液66注射用重组人粒细胞巨噬细胞刺激因子67重组牛碱性成纤维细胞生长因子外用溶液68外用重组牛碱性成纤维细胞生长因子69重组牛碱性成纤维细胞生长因子凝胶70重组牛碱性成纤维细胞生长因子滴眼液71外用重组人表皮生长因子72重组人表皮生长因子外用溶液(Ⅰ)73重组人表皮生长因子凝胶(酵母)74重组人表皮生长因子滴眼液(酵母)75注射用重组链激酶76尼妥珠单抗注射液77注射用鼠神经生长因子78注射用A型肉毒毒素Ⅲ体内诊断类1结核菌素纯蛋白衍生物2卡介菌纯蛋白衍生物3布氏菌纯蛋白衍生物4锡克试验毒素-3-Ⅳ体外诊断类1乙型肝炎病毒表面抗原诊断试剂盒(酶联免疫法)2丙型肝炎病毒抗体诊断试剂盒(酶联免疫法) 3人类免疫缺陷病毒抗体诊断试剂盒(酶联免疫法)4梅毒螺旋体抗体诊断试剂盒(酶联免疫法)5梅毒快速血浆反应素诊断试剂6梅毒甲苯胺红不加热血清试验诊断试剂7抗A抗B血型定型试剂(单克隆抗体)四部药用辅料1乙交酯丙交酯共聚物(5050)(供注射用) 2乙交酯丙交酯共聚物(7525)(供注射用) 3乙交酯丙交酯共聚物(8515)(供注射用) 4乙基纤维素5乙基纤维素水分散体6乙基纤维素水分散体(B型)7乙酸乙酯8乙醇9二丁基羟基甲苯10二甲基亚砜11二甲硅油12二氧化钛13二氧化硅14二氧化碳15十二烷基硫酸钠16十八醇17十六十八醇18十六醇19丁香茎叶油20丁香油21丁香酚22三乙醇胺23三油酸山梨坦(司盘85)24三硅酸镁25三氯叔丁醇26三氯蔗糖27大豆油28大豆油(供注射用)29大豆磷脂30大豆磷脂(供注射用)31小麦淀粉32山梨酸33山梨酸钾34山嵛酸甘油酯35门冬氨酸36门冬酰胺37马来酸38马铃薯淀粉39无水亚硫酸钠40无水枸橼酸41无水碳酸钠42无水磷酸氢二钠43无水磷酸氢钙44木薯淀粉45D-木糖46木糖醇47牛磺酸48月桂山梨坦(司盘20)49月桂氮酮50月桂酰聚氧乙烯(12)甘油酯51月桂酰聚氧乙烯(32)甘油酯52月桂酰聚氧乙烯(6)甘油酯53月桂酰聚氧乙烯(8)甘油酯54巴西棕榈蜡55玉米朊56玉米淀粉57正丁醇58甘油59甘油(供注射用)60甘油三乙酯61甘油磷酸钙62甘氨酸63可可脂64可压性蔗糖65可溶性淀粉66丙二醇67丙二醇(供注射用)68丙氨酸69丙烯酸乙酯-甲基丙烯酸甲酯共聚物水分散体70丙酸71石蜡72卡波姆73卡波姆共聚物74甲基纤维素75白凡士林76白陶土77白蜂蜡78亚硫酸氢钠79西黄蓍胶80色氨酸81冰醋酸82交联羧甲纤维素钠83交联聚维酮84羊毛脂85异丙醇86红氧化铁87纤维醋法酯88麦芽酚89麦芽糊精90麦芽糖91壳聚糖92低取代羟丙纤维素93谷氨酸钠94肠溶明胶空心胶囊95辛酸96辛酸钠97没食子酸98尿素99阿司帕坦100阿拉伯半乳聚糖101阿拉伯胶102纯化水103环甲基硅酮104环拉酸钠105苯扎氯铵106苯扎溴铵107苯甲酸钠108苯甲醇109DL-苹果酸110L-苹果酸111果胶112果糖113明胶空心胶囊114依地酸二钠115乳糖116单糖浆117油酰聚氧乙烯甘油酯118油酸乙酯119油酸山梨坦(司盘80)120油酸钠121油酸聚氧乙烯酯122泊洛沙姆188123泊洛沙姆407124组氨酸125枸橼酸126枸橼酸三乙酯127枸橼酸三正丁酯128枸橼酸钠129轻质氧化镁130轻质液状石蜡131氢化大豆油132氢化蓖麻油133氢氧化钠134氢氧化钾135胆固醇136亮氨酸137活性炭(供注射用)138浓氨溶液139盐酸140氧化钙141氧化锌142氧化镁143氨丁三醇144倍他环糊精145胶态二氧化硅146胶囊用明胶147粉状纤维素148烟酰胺149烟酸150DL-酒石酸151酒石酸钠152海藻酸5153海藻酸钠154海藻糖155预胶化羟丙基淀粉156预胶化淀粉157黄凡士林158黄原胶159黄氧化铁160硅化微晶纤维素161硅酸镁铝162甜菊素163脱氧胆酸钠164羟乙纤维素165羟丙甲纤维素166羟丙甲纤维素邻苯二甲酸酯167羟丙纤维素168羟丙基倍他环糊精169羟丙基淀粉空心胶囊170羟苯乙酯171羟苯丁酯172羟苯丙酯173羟苯丙酯钠174羟苯甲酯175羟苯甲酯钠176羟苯苄酯177混合脂肪酸甘油酯(硬脂) 178液状石蜡179淀粉水解寡糖180蛋黄卵磷脂181蛋黄卵磷脂(供注射用)182维生素E琥珀酸聚乙二醇酯183琥珀酸184琼脂185棕氧化铁186棕榈山梨坦(司盘40)187硬脂山梨坦(司盘60)188硬脂酸189硬脂酸钙190硬脂酸锌191硬脂酸聚烃氧(40)酯192硬脂酸镁193硝酸钾194硫酸195硫酸钙196硫酸铝197硫酸铵198硫酸羟喹啉199紫氧化铁200黑氧化铁201氯化钙202氯化钠(供注射用)203氯化钾204氯化镁205氯甲酚206稀盐酸207稀醋酸208稀磷酸209焦亚硫酸钠210焦糖211滑石粉212富马酸213酪氨酸214硼砂215硼酸216微晶纤维素217微晶蜡218腺嘌呤219羧甲纤维素钙220羧甲纤维素钠221羧甲淀粉钠222聚乙二醇1000223聚乙二醇1500224聚乙二醇300(供注射用) 225聚乙二醇400226聚乙二醇400(供注射用) 227聚乙二醇4000228聚乙二醇600229聚乙二醇6000230聚乙烯醇231聚山梨酯20232聚山梨酯40233聚山梨酯60234聚山梨酯80235聚山梨酯80(供注射用) 236聚丙烯酸树脂Ⅱ237聚丙烯酸树脂Ⅲ238聚丙烯酸树脂Ⅳ239聚甲丙烯酸铵酯Ⅰ240聚甲丙烯酸铵酯Ⅱ241聚氧乙烯242聚氧乙烯(35)蓖麻油243聚维酮K30244蔗糖245蔗糖八醋酸酯246蔗糖丸芯247蔗糖硬脂酸酯248碱石灰249碳酸丙烯酯250碳酸氢钠251碳酸氢钾252精制玉米油253精氨酸254橄榄油255醋酸256醋酸纤维素257醋酸钠258醋酸羟丙甲纤维素琥珀酸酯259糊精260缬氨酸261薄荷脑262磷酸263磷酸二氢钾264磷酸钙265磷酸氢二钠266磷酸氢二钾267磷酸氢二钾三水合物268磷酸氢二铵269磷酸淀粉钠270麝香草酚通则和指导原则序号编码目录10100制剂通则20101片剂30102注射剂40103胶囊剂50104颗粒剂60105眼用制剂70106鼻用制剂80107栓剂90108丸剂100109软膏剂乳膏剂110110糊剂120111吸入制剂130112喷雾剂140113气雾剂150114凝胶剂160115散剂170116糖浆剂180117搽剂190118涂剂200119涂膜剂210120酊剂220121贴剂230122贴膏剂240123口服溶液剂口服混悬剂口服乳剂250124植入剂260125膜剂270126耳用制剂280127洗剂290128冲洗剂300129灌肠剂310181合剂320182锭剂330183煎膏剂(膏滋)340184胶剂350185酒剂360186膏药370187露剂380188茶剂390189流浸膏剂与浸膏剂400200其他通则410211药材和饮片取样法420212药材和饮片检定通则430213炮制通则440251药用辅料450261制药用水460291国家药品标准物质通则470300480301一般鉴别试验490400光谱法500401紫外-可见分光光度法510402红外分光光度法7520405荧光分光光度法530406原子吸收分光光度法540407火焰光度法550411电感耦合等离子体原子发射光谱法560412电感耦合等离子体质谱法570421拉曼光谱法580431质谱法590441核磁共振波谱法600451X射线衍射法610500色谱法620501纸色谱法630502薄层色谱法640511柱色谱法650512高效液相色谱法660513离子色谱法670514分子排阻色谱法680521气相色谱法690531超临界流体色谱法700532临界点色谱法710541电泳法720542毛细管电泳法730600物理常数测定法740601相对密度测定法750611馏程测定法760612熔点测定法770613凝点测定法780621旋光度测定法790622折光率测定法800631pH值测定法810632渗透压摩尔浓度测定法820633黏度测定法830661热分析法840681制药用水电导率测定法850682制药用水中总有机碳测定法860700其他测定法870701电位滴定法与永停滴定法880702非水溶液滴定法890703氧瓶燃烧法900704氮测定法910711乙醇量测定法920712甲氧基、乙氧基与羟丙氧基测定法930713脂肪与脂肪油测定法940721维生素A测定法950722维生素D测定法960731蛋白质含量测定法970800限量检查法980801氯化物检查法990802硫酸盐检查法1000803硫化物检查法1010804硒检查法1020805氟检查法1030806氰化物检查法1040807铁盐检查法1050808铵盐检查法1060821重金属检查法1070822砷盐检查法1080831干燥失重测定法1090832水分测定法1100841炽灼残渣检查法1110842易炭化物检查法1120861残留溶剂测定法1130871甲醇量检查法1140872合成多肽中的醋酸测定法11508732-乙基己酸测定法1160900特性检查法1170901溶液颜色检查法1180902澄清度检查法1190903不溶性微粒检查法1200904可见异物检查法1210921崩解时限检查法1220922融变时限检查法1230923片剂脆碎度检查法1240931溶出度与释放度测定法1250941含量均匀度检查法1260942最低装量检查法1270951吸入制剂微细粒子空气动力学特性测定法1280952黏附力测定法1290981结晶性检查法1300982粒度和粒度分布测定法1310983锥入度测定法1321100生物检查法1331101无菌检查法1341105非无菌产品微生物限度检查:微生物计数法1351106非无菌产品微生物限度检查:控制菌检查法1361107非无菌药品微生物限度标准1371121抑菌效力检查法1381141异常毒性检查法1391142热原检查法1401143细菌内毒素检查法1411144升压物质检查法1421145降压物质检查法1431146组胺类物质检查法1441147过敏反应检查法1451148溶血与凝聚检查法1461200生物活性测定法1471201抗生素微生物检定法1481202青霉素酶及其活力测定法1491205升压素生物测定法1501206细胞色素C活力测定法1511207玻璃酸酶测定法1521208肝素生物测定法1531209绒促性素生物测定法1541210缩宫素生物测定法1551211胰岛素生物测定法1561212精蛋白锌胰岛素注射液延缓作用测定法1571213硫酸鱼精蛋白生物测定法1581214洋地黄生物测定法1591215葡萄糖酸锑钠毒力检查法1601216卵泡刺激素生物测定法1611217黄体生成素生物测定法1621218降钙素生物测定法1631219生长激素生物测定法1641401放射性药品检定法1651421灭菌法1661431生物检定统计法1672000中药其他方法1682001显微鉴别法1692101膨胀度测定法1702102膏药软化点测定法1712201浸出物测定法1722202鞣质含量测定法1732203桉油精含量测定法1742204挥发油测定法1752301杂质检查法1762302灰分测定法1772303酸败度测定法1782321铅、镉、砷、汞、铜测定法1792322汞和砷元素形态及其价态测定法1802331二氧化硫残留量测定法1812341农药残留量测定法1822351黄曲霉毒素测定法1832400注射剂有关物质检查法1843000生物制品相关检查方法1853100含量测定法1863101固体总量测定法1873102唾液酸测定法(间苯二酚显色法)1883103磷测定法1893104硫酸铵测定法1903105亚硫酸氢钠测定法1913106氢氧化铝(或磷酸铝)测定法1923107氯化钠测定法1933108枸橼酸离子测定法1943109钾离子测定法1953110钠离子测定法1963111辛酸钠测定法1973112乙酰色氨酸测定法1983113苯酚测定法1993114间甲酚测定法2003115硫柳汞测定法2013116对羟基苯甲酸甲酯、对羟基苯甲酸丙酯含量测定法2023117O-乙酰基测定法2033118己二酰肼含量测定法2043119高分子结合物含量测定法2053120人血液制品中糖及糖醇测定法2063121人血白蛋白多聚体测定法2073122人免疫球蛋白类制品IgG单体加二聚体测定法2083123人免疫球蛋白中甘氨酸含量测定法2093124重组人粒细胞刺激因子蛋白质含量测定法92103125组胺人免疫球蛋白中游离磷酸组胺测定法2113126IgG含量测定法2123127单抗分子大小变异体测定法(CE-SDS)2133200化学残留物测定法2143201乙醇残留量测定法2153202聚乙二醇残留量测定法2163203聚山梨酯80残留量测定法2173204戊二醛残留量测定法2183205磷酸三丁酯残留量测定法2193206碳二亚胺残留量测定法2203207游离甲醛测定法2213208人血白蛋白铝残留量测定法2223209羟胺残留量测定法2233300微生物检查法2243301支原体检查法2253302外源病毒因子检查法2263303鼠源性病毒检查法2273304SV40核酸序列检查法2283305猴体神经毒力试验2293306血液制品生产用人血浆病毒核酸检测技术要求2303400生物测定法2313401免疫印迹法2323402免疫斑点法2333403免疫双扩散法2343404免疫电泳法2353405肽图检查法2363406质粒丢失率检查法2373407外源性DNA残留量测定法2383408抗生素残留量检查法(培养法)2393409激肽释放酶原激活剂测定法2403410抗补体活性测定法2413411牛血清白蛋白残留量测定法2423412大肠杆菌菌体蛋白质残留量测定法2433413假单胞菌菌体蛋白质残留量测定法2443414酵母工程菌菌体蛋白质残留量测定法2453415类A血型物质测定法2463416鼠IgG残留量测定法2473417无细胞百日咳疫苗鉴别试验(酶联免疫法)2483418抗毒素、抗血清制品鉴别试验(酶联免疫法)2493419A群脑膜炎球菌多糖分子大小测定法2503420伤寒Vi多糖分子大小测定法2513421b型流感嗜血杆菌结合疫苗多糖含量测定法2523422人凝血酶活性检查法2533423活化的凝血因子活性检查法2543424肝素含量测定法2553425抗A、抗B血凝素测定法2563426人红细胞抗体测定法2573427人血小板抗体测定法2583500生物活性/效价测定法2593501重组乙型肝炎疫苗(酵母)体外相对效力检查法2603502甲型肝炎灭活疫苗体外相对效力检查法2613503人用狂犬病疫苗效价测定法2623504吸附破伤风疫苗效价测定法2633505吸附白喉疫苗效价测定法2643506类毒素絮状单位测定法2653507白喉抗毒素效价测定法2663508破伤风抗毒素效价测定法2673509气性坏疽抗毒素效价测定法2683510肉毒抗毒素效价测定法2693511抗蛇毒血清效价测定法2703512狂犬病免疫球蛋白效价测定法2713513人免疫球蛋白中白喉抗体效价测定法2723514人免疫球蛋白Fc段生物学活性测定法2733515抗人T细胞免疫球蛋白效价测定法(E 玫瑰花环形成抑制试验)2743516抗人T细胞免疫球蛋白效价测定法(淋巴细胞毒试验)2753517人凝血因子Ⅱ效价测定法2763518人凝血因子Ⅶ效价测定法2773519人凝血因子Ⅸ效价测定法2783520人凝血因子Ⅹ效价测定法2793521人凝血因子Ⅷ效价测定法2803522重组人促红素体内生物学活性测定法2813523干扰素生物学活性测定法2823524重组人白介素-2生物学活性测定法2833525重组人粒细胞刺激因子生物学活性测定法2843526重组人粒细胞巨噬细胞刺激因子生物学活性测定法2853527重组牛碱性成纤维细胞生长因子生物学活性测定法2863528重组人表皮生长因子生物学活性测定法2873529重组链激酶生物学活性测定法2883530鼠神经生长因子生物学活性测定法2893531尼妥珠单抗注射液生物学活性测定法2903532重组人白介素-11生物学活性测定法2913533注射用A型肉毒毒素成品效价测定法(平行线法)2923600特定生物原材料/动物2933601无特定病原体鸡胚质量检测要求2943602实验动物微生物学检测要求2953603实验动物寄生虫学检测要求2963604新生牛血清检测要求2973605细菌生化反应培养基29837002993701生物制品国家标准物质目录3008000试剂与标准物质3018001试药3028002试液3038003试纸3048004缓冲液3058005指示剂与指示液3068006滴定液3078061对照品对照药材对照提取物3088062对照品标准品3099000指导原则3109001原料药物与制剂稳定性试验指导原则3119011药物制剂人体生物利用度和生物等效性试验指导原则3129012生物样品定量分析方法验证指导原则3139013缓释、控释和迟释制剂指导原则3149014微粒制剂指导原则3159015药品晶型研究及晶型质量控制指导原则3169101药品质量标准分析方法验证指导原则3179102药品杂质分析指导原则3189103药物引湿性试验指导原则3199104近红外分光光度法指导原则3209105中药生物活性测定指导原则3219106基于基因芯片的药物评价技术与方法指导原则3229107中药材DNA条形码分子鉴定法指导原则3239201药品微生物检验替代方法验证指导原则3249202非无菌产品微生物限度检查指导原则3259203药品微生物实验室质量管理指导原则3269204微生物鉴定指导原则3279205药品洁净实验室微生物监测和控制指导原则3289206无菌检查用隔离系统验证指导原则3299301注射剂安全性检查法应用指导原则3309302中药有害残留物限量制定指导原则3319303色素测定法指导原则3329304中药中铝、铬、铁、钡元素测定指导原则3339305中药中真菌毒素测定指导原则3349501正电子类放射性药品质量控制指导原则3359502锝[99mTc]放射性药品质量控制指导原则3369601药用辅料功能性指标研究指导原则3379621药包材通用要求指导原则3389622药用玻璃材料和容器指导原则3399901国家药品标准物质制备指导原则11。
2015版《中国药典》四部介绍及其在中药分析鉴定中的应用

2015 年版《中国药典》四部介绍及其在中药分析鉴定中的应用李峰2015年版《中国药典》已于2015年6月5日由国家食品药品监督管理总局正式颁布。
2015年版《中国药典》最大的变动之一是将原药典各部附录整合,并与药用辅料标准单立成卷,首次作为《中国药典》第四部,解决了长期以来药典各部共性检测方法重复收录、彼此之间方法不协调、不统一、不规范,给药品检验实际操作带来不便的问题。
2015年版《中国药典》四部是保证《中国药典》执行的重要基础,是2015年版《中国药典》水平和特色的重要体现,也是系统阐述药品检测技术、传播药典知识的良好教科书,对于强化药品监管手段,保障药品质量不断提高,促进先进检测技术应用和行业健康必将发挥积极的作用。
一、2015年版《中国药典》四部介绍2015年版《中国药典》四部内容包括凡例、通则和药用辅料。
药典通则涵盖了通用性要求、检验方法、指导原则以及试剂和标准物质等药品标准的共性要求,是药典标准的基础,不但反映了我国药品质量控制整体状况和药品检验技术水平;同时也对规范药品研究、生产、检验、加强药品监管发挥重要作用。
现就2015年版《中国药典》四部整体情况简要介绍如下。
1.2015年版《中国药典》四部增修订整体情况2015年版《中国药典》四部收载通则总数317个,将药典一部、二部、三部制剂整合后共计38个,检测方法附录287个,其中新增通则28个 (检定方法通则27个、制剂通则1个),整合通则63个,修订通则 67 个;新增生物制品总论3个;指导原则共计30个,其中新增15个,修订10个。
辅料收载总数约270个品种,其中新增137 个,修订97个,不收载2个。
2.2015年版《中国药典》四部主要特点2.1 整体提升质控水平《中国药典》凡例、通则、总论是药典的重要组成部分,对药品标准的检测方法和限度进行总体规定,对药典以外的其他药品国家标准具同等效力。
通过对2010年版《中国药典》相关内容的全面增修订,全面完善了药典标准基本共性规定,从整体上提升对药品质量控制的要求,形成了以凡例为统领,通则为同类药品基本准则、各论作为基本要求的药典标准体例。
《临床试验期间生物制品药学研究和变更技术指导原则(征求意见稿)》起草和修订说明

一、起草目的为进一步深化药品审评审批制度改革,支持生物制品产业发展,规范临床试验期间生物制品药学研究和变更,根据《中华人民共和国药品管理法》、《中华人民共和国疫苗管理法》和《药品注册管理办法》相关规定及要求,按照国家药监局工作部署,药品审评中心起草本技术指导原则。
二、起草过程按照国家局工作部署,药品审评中心就临床试验期间生物制品药学研究和变更进行课题立项,成立指导原则起草小组。
经书面征求部分生物制品企业意见、就重大问题召开专家咨询会议征求专家意见、上网公开征求意见、召开专家定稿会,形成终稿。
三、起草思路本技术指导原则的起草,借鉴了国内及ICH等国外相关法规和指导原则,在遵循生物制品研发规律的基础上,针对生物制品临床期间药学变更的特点、类型和具体阶段,从技术角度阐述在中国境内已获得临床试验默示许可的生物制品在临床试验期间药学研究的思路、方法及阶段性要求,例举了影响安全性的重大药学变更。
本技术指导原则为便于申办者研究及上市申报,格式上将阶段性技术要求与生物制品CTD格式相衔接。
四、主要内容本技术指导原则分为七部分,包括前言、一般原则、药学研究阶段性要求、药学变更管理和影响安全性的重大变更示例、参考文献、名词解释、缩写词列表。
第一部分介绍了本指导原则制定背景、主要内容及适用范围等。
第二部分介绍了临床期间药学研究和变更研究的基本考量、药学变更风险评估和可比性研究以及沟通交流等内容。
第三部分详述了生物制品临床试验期间药学研究的阶段性要求,包括原液及制剂等。
第四部分对临床期间药学变更管理进行了概括,并例举了影响安全性的重大变更事项。
第五部分至第七部分分别介绍了本指导原则起草过程中主要的参考文献,以及指导原则中的名词解释、缩写词等。
五、需要说明的问题为更好地理解本指导原则内容,需说明以下问题:1、本指导原则根据《药品注册管理办法》规定要求制定,以国家颁布的相关法律法规及其他技术指导原则为基础。
本指导原则属于生物制品临床试验期间药学研究和变更的一般性要求,对具体研究事项直接引荐参考已发布相关指导原则。
生物制剂临床使用管理制度

生物制剂临床使用管理制度一、总则(一)为加强生物制品的管理,进一步规范该类药物的临床应用,保障医疗质量和医疗安全,根据《中华人民共和国传染病防治法》、《生物制品管理规定》、《中华人民共和国药典<临床用药须知>(2015)》的有关规定,结合我院实际情况,制定本管理制度。
(二)生物制品是药品的一大类别,系指以微生物、细胞、动物或人源组织和体液等为原料,应用现代生物技术或传统技术而制成的制品,用于多种人类疾病的预防、治疗和诊断。
人用生物制品包括:细菌类疫苗(含毒素类)、病毒类疫苗、抗毒素及免疫血清、血液制品、细胞因子、酶、体内及体外诊断制品,以及其他生物活性制剂,如毒素、抗原、变态反应原、单克隆抗体、抗原抗体复合物、免疫调节剂及微生态制剂。
血液制剂使用参照医院《血液制剂使用管理制度》执行。
二、生物制品采购与贮存管理(一)生物制品由药学部统一采购供应。
任何其他科室或部门不得从事生物制品的采购、调剂活动,不得在临床使用非药学部门采购供应的生物制品。
(二)生物制品贮存应有专门的设施,具体贮存方法应按照药品说明书的规定实施。
三、临床应用管理(一)生物制品临床应用应遵循相应的诊疗规范和指南,严格按照药品说明书规定使用。
(二)生物制品在使用前必须进行外观检查,对于安瓿有裂纹、标签不清、药液变色,有摇不散的异物、絮状物和经冻结者均不可用。
静脉用生物制品应根据药品说明书规定选择合适溶媒配制,不得与其他药物混合、配伍使用。
四、生物制品不良反应监测与报告(一)生物制剂在使用时可能发生各种反应,特别是各种血清、类毒素、疫苗等制剂。
一般反应有局部和全身反应;异常反应有晕厥、过敏性休克、变态反应、特异质反应等。
为预防严重异常反应的发生,临床使用生物制剂要注意详细询问病史,有过敏史的患者易发生过敏性休克。
注射动物血清制品前,应按照说明书要求进行过敏试验。
(二)加强生物制品不良反应监测,防范生物制品不良事件的发生。
医护人员应掌握生物制品的不良反应及相应的处置方法,保障患者用药安全。
中国健康人体对注射用rhPTH(1-84)试验耐受性和安全性监护

中国健康人体对注射用rhPTH(1-84)试验耐受性和安全性监护李忠芳; 刘亚妮; 吴健鸿; 曾繁典; 师少军【期刊名称】《《护理研究》》【年(卷),期】2019(033)018【总页数】5页(P3123-3127)【关键词】注射用重组人甲状旁腺素(1-84); 健康受试者; 耐受性; 安全性; 护理监护; 不良反应【作者】李忠芳; 刘亚妮; 吴健鸿; 曾繁典; 师少军【作者单位】430022 华中科技大学同济医学院附属协和医院; 430030 华中科技大学同济医学院临床药理研究所【正文语种】中文【中图分类】R471重组人甲状旁腺素(1-84)[recombinant human parathyroid hormone(1-84),rhPTH(1-84)]为女性绝经期后抗骨质疏松药,属《药品注册管理办法》治疗用生物制品1类。
rhPTH(1-84)与人体内源性甲状旁腺素氨基酸序列一致,通过基因重组技术制备,具有与内源性激素相同的受体亲和力和相同的生理作用。
rhPTH(1-84)通过刺激骨松质层和骨皮质层的新骨形成作用,改善骨小梁微结构,有效增加骨量、骨密度和骨强度,是目前唯一有效的骨同化效应药物[1-2]。
2015年1月,美国食品药品监督管理局(FDA)批准NPS公司开发的 rhPTH(1-84)(Natpara)上市,作为钙和维生素 D治疗的辅助治疗,临床用于控制甲状旁腺功能减退病人的低血钙症。
欧盟2017年5月批准该药以品牌名Natpara上市[3-4]。
国外多项长期临床观察研究提示,rhPTH(1-84)使用较为安全[5-6]。
但尚未见rhPTH(1-84)在中国人群的安全性研究报道。
本研究首次以中国健康受试者为研究对象,旨在监护评价中国健康人群单次和多次皮下注射rhPTH(1-84)的安全性和耐受性,为该药临床合理给药提供依据。
1 对象与方法1.1 受试者选择1.1.1 入选标准①健康志愿者;②年龄19~45岁,男女各半;③体质指数19~24 kg/m2;④全面健康体检合格,血常规、尿常规、血生化、心电图、胸部X线片检查无异常或异常但无临床意义;⑤自愿参加试验并签署知情同意书。
关于国家食品药品监督管理总局批准

股票简称:海正药业股票代码:600267 公告编号:临2017-06号债券简称:15海正01 债券代码:122427债券简称:16海正债债券代码:136275浙江海正药业股份有限公司关于甘精胰岛素、甘精胰岛素注射液及注射用结核病变态反应原RP22获得临床批件的公告近日,浙江海正药业股份有限公司(以下简称“公司”)收到国家食品药品监督管理总局(以下简称“国家食药监总局”)核准签发的甘精胰岛素、甘精胰岛素注射液及注射用结核病变态反应原RP22的药物临床试验批件。
现就相关情况公告如下:一、临床试验批件主要内容1、药品名称:甘精胰岛素批件号:2016L10796剂型:原料药规格:----申请事项:国产药品注册申请人:浙江海正药业股份有限公司受理号:CXSL1600005浙注册分类:治疗用生物制品15类审批结论:根据《中华人民共和国药品管理法》及有关规定,经审查,本品符合药品注册的有关要求,批准本品制剂进行临床试验。
2、药品名称:甘精胰岛素注射液批件号:2016L10793剂型:注射剂规格:3ml:300单位(笔芯)申请事项:国产药品注册申请人:浙江海正药业股份有限公司受理号:CXSL1600006浙注册分类:治疗用生物制品15类审批结论:根据《中华人民共和国药品管理法》及有关规定,经审查,本品符合药品注册的有关要求,批准本品进行临床试验。
3、药品名称:注射用结核病变态反应原RP22批件号:2016L10792剂型:注射剂规格:10μg申请事项:国产药品注册申请人:浙江海正药业股份有限公司受理号:CXSL1400078浙注册分类:治疗用生物制品4类审批结论:根据《中华人民共和国药品管理法》及有关规定,经审查,本品符合药品注册的有关要求,批准本品进行临床试验。
二、该药品研发及相关情况1、甘精胰岛素注射液(甘精胰岛素为其原料药)是一种长效胰岛素,用于需要胰岛素治疗的糖尿病患者,本品上市原研药“来得时®”(英文商品名:“Lantus®”)由赛诺菲安万特公司开发,2000年在美国上市,2004年进入中国市场,2015年的全球销售额达到63.9亿欧元。
Insight:2015年4月CDE药品审评报告

2015 年4 月CDE 药品审评报告Insight - China Pharma Data2015 年5 月2015 年4 月CDE 药品审评报告——丁香园Insight 数据库要点∙ 4 月份药品申报量创今年以来最高点∙正大天晴近4 年来首次申报化药1.1 类新药∙齐鲁制药抢仿迅速∙每周口服一次降糖药曲格列汀遭国内药企抢仿∙GSK 提交多替拉韦进口上市申请∙江苏恒瑞镇痛新药M6G 获批临床_____________________________________________________________________________________________根据丁香园Insight - China Pharma Data 数据库最新统计,2015 年4 月CDE 共承办新的药品注册申请以受理号计有846 个,与 3 月份(719 个)相比增幅约达18%。
其中增量主要集中在化药,这也是今年以来月受理量的最高点。
以下,分别来分析化药、中药、生物制品的申报受理及审评审批情况。
一、化药申报受理情况:4 月份CDE 共承办新的化药注册申请以受理号计728 个,涉及327 个品种。
其中各个申请类型的具体数据如下所示:Insight 系列报告1. 新药(1)1.1 类新药8 个化药1.1 类新药申报临床根据Insight 数据库统计,4 月份CDE 共承办化药1.1 类新药申请以受理号计有23 个,涉及8 个品种,且均为新药临床申请。
具体数据如下所示:正大天晴申报的TQ-B3234 具体适应症暂时不详。
这是正大天晴继2011 年申报舒布替尼之后,近4 年来申报的唯一一个化药1.1 类新药。
正大天晴是国内仿制药领域领先的医药企业,但其在创新药物研发领域仍有待加强,其目前还没有获批上市的 1.1 类新药。
丹诺医药申报的TNP-2092 为消化道感染用药。
除了TNP-2092 之外,其研发管道上还有尚未申报的具有不同灭菌机理的双靶标分子新药候选物TNP-2198 和TNP-2500。
2015出台的医疗器械政策汇总表

完整版:2015医疗器械政策汇总一、分类界定序号分类界定颁发机构日期1 食品药品监管总局办公厅关于乳腺摄影立体定位装置等153个产品分类界定的通知(食药监办械管〔2015〕49号)最新15个Ⅲ类医疗器械分类界定总局 3.31最新58个Ⅱ类医疗器械分类界定最新51个Ⅰ类医疗器械分类界定最新29个非医疗器械分类界定2 食品药品监管总局办公厅关于人工血管接环等172个产品分类界定的通知(食药监办械管〔2015〕69号))总局受理中心5.183 食品药品监管总局办公厅关于恒温核酸扩增检测仪等22个产品分类界定的通知(食药监办械管〔2015〕75号)总局受理中心6.114 食品药品监管总局办公厅关于多功能超声骨刀等127个产品分类界定的通知(食药监办械管〔2015〕104号)总局受理中心7.2二、政策法规序号法规名称颁发机构日期1 食品药品监管总局关于加强避孕套质量安全管理的通知(食药监械监〔2015〕30号)总局 3.232 食品药品监管总局办公厅关于印发体外诊断试剂质量评估和综合治理工作方案的通知(食药监办械监〔2015〕55号)总局 4.073 主动脉覆膜支架系统临床试验审评要点医疗器械技术审评中心4.234 全降解冠状动脉药物洗脱支架临床试验审评要点医疗器械技术审评中心4.235 国务院关于印发《中国制造2025》的通知(国发〔2015〕28号)国务院 5.86 国家发展改革委、财政部关于印发《药品、医疗器械产品注册收费标准管理办法》的通知(发改价格[2015]1006号)国家发展改革委5.127 食品药品监管总局关于印发境内第三类医疗器械注册质量管理体系核查工作程序(暂行)的通知(食药监械管〔2015〕63号)总局 6.088 食品药品监管总局关于对取消和下放行政审批事项加强事中事后监管的意见(食药监法〔2015〕65号)总局 6.99 《药品医疗器械飞行检查办法》(国家食品药品监督管理总局令第14号)总局 6.2910 《医疗器械分类规则》(国家食品药品监督管理总局令第15号)总局7.1411 食品药品监管总局办公厅关于经营免验配耳背式数字助听器有关问题的复函(食药监办械监函〔2015〕414号)总局7.1412 欧洲通过医疗器械和体外诊断器械新法规提案的普遍方法商务部7.213 食品药品监管总局关于进一步加强药品医疗器械保健食品广告审查监管工作的通知(食药监稽〔2015〕145号)总局7.3114 国家卫生计生委医政医管局关于印发《药物代谢酶和药物作用靶点基因检测技术指南(试行)》和《肿瘤个体化治疗检测技术指南(试行)》的通知国家卫生计生委7.3115 食品药品监管总局发布医疗器械软件注册技术审查指导原则总局8.716 食品药品监管总局关于印发医疗器械经营企业分类分级监督管理规定的通知(食药监械监〔2015〕158号)总局8.1717 食品药品监管总局关于印发医疗器械经营环节重点监管目录及现场检查重点内容的通知(食药监械监〔2015〕159号)总局8.1718 国务院关于改革药品医疗器械审评审批制度的意见(国发〔2015〕44号)国务院8.1819 食品药品监管总局介绍药品医疗器械审评审批制度改革情况中国政府8.1820 食品药品监管总局办公厅关于个体工商户从事医疗器械经营活动有关问题的复函(食药监办械监函〔2015〕533号)总局9.0221 食品药品监管总局办公厅关于启用医疗器械注册管理信息系统备案子系统的通知(食药监办械管函〔2015〕534号)总局9.0222 食品药品监管总局关于印发医疗器械生产质量管理规范现场检查指导原则等4个指导原则的通知(食药监械监〔2015〕218号)总局9.2523 食品药品监管总局印发《医疗器械生产质量管理规范现场检查指导原则》等4个现场检查指导原则总局10.124 食品药品监管总局等部门关于印发开展打击非法制售和使用注射用透明质酸钠行为专项行动工作方案的通知(食药监械监〔2015〕236号)总局10.1425 食品药品监管总局关于印发医疗器械经营质量管理规范现场检查指导原则的通知(食药监械监〔2015〕239号)总局10.1526 《医疗器械使用质量监督管理办法》(国家食品药品监督管理总局令第18号)总局10.2127 食品药品监管总局办公厅关于经营体外诊断试剂相关问题的复函(食药监办械监函〔2015〕646号)总局10.2228 食品药品监管总局发布医疗器械使用质量监督管理办法总局10.2329 医疗器械注册管理法规解读之四总局11.230 食品药品监管总局关于执行医疗器械和体外诊断试剂注册管理办法有关问题的通知(食药监械管〔2015〕247号)总局11.431 食品药品监管总局关于印发医疗器械检验机构资质认定条件的通知(食药监科〔2015〕249号)总局11.432 医疗器械注册管理法规解读之五总局11.1933 关于《医疗器械使用质量监督管理办法》的说明总局11.334 《医疗器械通用名称命名规则》(国家食品药品监督管理总局令第19号)总局12.21三、公告/通知/通告/通报序号公告、通知、通告、通报颁发机构日期1国家食品药品监督管理总局关于发布医疗器械生产企业供应商审核指南的通告(2015年第1号)总局 1.192关于调整行政许可事项申报资料接收方式的公告(第133号)总局受理中心 1.303关于采用签收方式接收申报资料的公告(第136号)总局受理中心 2.124关于医用电气设备受理有关问题的公告(第137号)总局受理中心 2.275关于国家食品药品监督管理总局食品安全监管三司、医疗器械注册管理司咨询安排的公告(第139号)总局受理中心 2.286关于调整行政受理、制证咨询服务电话接听安排的公告(第140号)总局受理中心 2.287国家食品药品监督管理总局关于批准发布YY 0572-2015《血液透析及相关治疗用水》等90项医疗器械行业标准的公告(2015年第8号)总局 3.028国家食品药品监督管理总局药物临床试验机构资格认定复核检查公告(第4号)总局 3.199关于调整注册申报资料接收方式的公告(第141号)总局受理中心 3.2010关于医疗器械(含体外诊断试剂)延续注册申报资料有关问题的公告(第144号)总局受理中心 3.3111关于医疗器械延续注册申请过渡期相关问题的公告(第143号)总局受理中心 3.3112关于印发《体外诊断试剂抽验工作方案》的通知(食药监械监便函〔2015〕37号)总局器械监管司4.813国家食品药品监督管理总局关于发布生物制品稳定性研究技术指导原则的通告(2015年第10号)总局 4.1514国家食品药品监督管理总局关于发布雌激素受体、孕激素受体抗体试剂及检测试剂盒技术审查指导原则的通告(2015年第11号)总局 4.1715国家食品药品监督管理总局关于注销医疗器械注册证书的公告(2015年第12号)总局 4.1716国家食品药品监督管理总局关于发布医疗器械临床评价技术指导原则的通告(2015年第14号)总局 5.1917第一批优秀国产医疗设备品目遴选顺利完成国家卫生计生委5.2118国家食品药品监督管理总局关于发布药品、医疗器械产品注册收费标准的公告(2015年第53号)总局 5.2719国家食品药品监督管理总局关于发布医疗器械产品出口销售证明管理规定的通告(2015年第18号)总局 6.0120国家食品药品监督管理总局关于发布《中华人民共和国药典》(2015年版)的公告(2015年第67号)总局 6.0521关于执行《国家食品药品监督管理总局关于发布医疗器械产品出口销售证明管理规定的通告》有关事宜的公告(第148号)总局受理中心 6.2422关于调整注册申报资料接收方式的公告(第150号)总局受理中心7.0123国家卫生计生委关于取消第三类医疗技术临床应用准入审批有关工作的通知国家卫生计生委7.224关于发布《前列腺特异性抗原检测前列腺癌临床应用》等4项推荐性卫生行业标准的通告国家卫生计生委7.225国家食品药品监督管理总局关于医疗器械临床试验备案有关事宜的公告(2015年第87号)总局7.0326国家食品药品监督管理总局关于发布医疗器械生产质量管理规范附录体外诊断试剂的公告(2015年第103号)总局7.127国家食品药品监督管理总局关于发布医疗器械生产质量管理规范附录无菌医疗器械的公告(2015年第101号)总局7.128国家食品药品监督管理总局关于发布医疗器械生产质量管理规范附录植入性医疗器械的公告(2015年第102号)总局7.129国家发展改革委关于实施增强制造业核心竞争力重大工程包的通知(发改产业[2015]1602号)国家发展改革委7.1330国家食品药品监督管理总局关于贯彻落实小微企业行政事业性收费优惠政策的通告(2015年第31号)总局7.1431国家食品药品监督管理总局关于发布乙型肝炎病毒基因分型检测试剂技术审查指导原则的通告(2015年第32号)总局7.1532国家食品药品监督管理总局关于发布影像型超声诊断设备新技术注册技术审查指导原则的通告(2015年第33号)总局7.1533关于办理受理和领取批件等行政许可事项的公告(第151号)总局受理中心7.1634食品药品监管总局办公厅关于印发2015年国家医疗器械抽验产品检验方案的通知(食药监办械监〔2015〕100号)总局7.1635国家医疗器械不良事件监测年度报告(2014年度)总局7.236第二批优秀国产医疗设备产品遴选工作启动国家卫生计生委7.23372014年度食品药品监管统计年报总局7.2438国家医疗器械质量公告(2015年第1期,总第6期)总局7.2439关于发布医疗器械软件注册技术审查指导原则的通告(2015年第50号)总局8.0540国家医疗器械质量公告(2015年第2期,总第7期)总局9.241食品药品监管总局办公厅关于启用医疗器械注册管理信息系统备案子系统的通知(食药监办械管函〔2015〕534号)总局9.242关于体外诊断试剂临床试验机构盖章有关事宜的公告(第154号)总局受理中心9.0943国家食品药品监督管理总局关于发布结核分枝杆菌复合群核酸检测试剂注册技术审查指导原则的通告(2015年第65号)总局9.2144关于对部分发补未回的申报资料进行退审的公告医疗器械技术审评中心9.2245国家食品药品监督管理总局关于境内医疗器械生产企业跨省新开办企业时办理产品注册及生产许可有关事宜的公告(2015年第203号)总局10.2146国家食品药品监督管理总局关于规范含银盐医疗器械注册管理有关事宜的公告(2015年第225号)总局11.947国家食品药品监督管理总局关于发布药物临床试验数据现场核查要点的公告(2015年第228号)总局11.148关于药品注册审评审批若干政策的公告(2015年第230号)总局11.1149医疗器械不良事件信息通报(2015年第1-3期)总局11.1250国家食品药品监督管理总局关于征求《关于解决药品注册申请积压实行优先审评审批的意见(征求意见稿)》意见的公告(2015年第227号)总局11.1351国家食品药品监督管理总局关于发布丙型肝炎病毒核糖核酸测定试剂等4个医疗器械技术审查指导原则的通告(2015年第93号)总局11.2652医疗器械不良事件监测的主要目的和意义总局11.2653国家食品药品监督管理总局关于发布医疗器械注册指定检验工作管理规定的通告(2015年第94号)总局11.2754国家食品药品监督管理总局首次组织开展对境外医疗器械生产企业生产现场检查总局12.255食品药品监管总局办公厅关于医疗器械检验机构资质认定条件有关事项的通知(食药监办科函〔2015〕775号)总局12.756广东省探索试行《第二类创新医疗器械特别审批程序》总局12.1157食品药品监管总局办公厅关于启用医疗器械注册管理信息系统受理和制证、技术审评、行政审批子系统的通知(食药监办械管函〔2015〕804号)总局12.1558国家食品药品监管总局出台食品药品领域主要信访事项法定办理途径及相关法律依据总局12.2159广东省率先实施医疗器械注册无纸化审评审批总局12.2260关于征求加强医疗器械监督抽验复检工作有关意见的函(食药监械监便函〔2015〕137号)总局12.2461国务院关于同意建立药品医疗器械审评审批制度改革部际联席会议制度的批复国务院12.2462国家食品药品监督管理总局发布2015年第3期国家医疗器械质量公告总局12.25四、征求意见序号征求意见颁发机构日期1关于征求医疗器械生产质量管理规范无菌医疗器械附录和植入性医疗器械附录意见的函(食药监械监便函〔2015〕6号)总局器械监管司 2.092关于征求《医疗器械生产质量管理规范体外诊断试剂附录》意见的函(食药监械监便函〔2015〕10号)总局器械监管司 2.163关于征求《出具医疗器械出口销售证明管理规定》意见的函(食药监械监便函〔2015〕14号)总局器械监管司 3.134关于征求医疗器械临床试验备案有关事宜意见的函(食药监械管便函〔2015〕25号)总局器械注册司 4.285关于《腹腔内置疝修补补片动物实验技术审评要点》第一次征求意见的通知医疗器械技术审评中心4.36关于对《动物源性医疗器械产品注册申报资料指导原则(修订版)》征求意见的通知医疗器械技术审评中心6.17关于《人红细胞反定型试剂技术审查指导原则》(征求意见稿)公开征求意见的通知医疗器械技术审评中心6.188关于征求《医疗器械经营企业分类分级监督管理规定(征求意见稿)》意见的函(食药监械监便函〔2015〕89号)总局器械监管司7.039国家食品药品监督管理总局关于公开征求《医疗器械命名规则(试行)》﹙征求意见稿﹚意见的通知总局7.110国家食品药品监督管理总局关于公开征求《医疗器械临床试验机构资质认定管理办法》﹙征求意见稿﹚意见的通知总局7.211关于征求《医疗器械生产质量管理规范现场检查指导原则》等四个指导原则意见的函(食药监械监便函〔2015〕98号)总局器械监管司7.2412关于《主动脉覆膜支架系统的临床试验指导原则》(修订稿)公开征求意见的通知医疗器械技术审评中心9.2213关于《α-氰基丙烯酸酯类医用粘合剂产品注册申报资料指导原则》(征求意见稿)征求意见的通知医疗器械技术审评中心9.2214关于征求相关医疗器械注册事项办理程序意见的函(食药监械管便函〔2015〕61号)总局器械注册司9.2815关于对《软性接触镜上市前临床试验指导原则》征求意见的通知医疗器械技术审评中心9.2816关于对《脊柱后路内固定系统产品注册技术审查指导原则》征求意见的通知医疗器械技术审评中心9.2817关于《影像型超声诊断设备(第三类)产品注册技术审查指导原则》(征求意见稿)征求意见的通知医疗器械技术审评中心9.318国家食品药品监督管理总局器械监管司公开征求《医疗器械工艺用水质量管理指南》意见总局器械监管司10.0919关于《粒子束治疗系统注册申报资料指导原则》&《一次性使用脑积水分流器注册技术审查指导原则》(征求意见稿)征求意见的通知医疗器械技术审评中心10.1920关于《植入式心脏起搏器注册申报资料指导原则(征求意见稿)》征求意见的通知医疗器械技术审评中心10.2621关于《医用X射线诊断设备(第三类)产品注册技术审查指导原则(征求意见稿)》&《离心式血液成分分离设备非临床注册技术审查指导原则(征求意见稿)》征求意见的通知征求意见的通知医疗器械技术审评中心10.2622关于《可吸收性外科缝线产品注册技术审查指导原则》(征求意见稿)征求意见的通知医疗器械技术审评中心10.2723关于《治疗呼吸机注册技术审查指导原则》征求意见的通知医疗器械技术审评中心11.224关于《脉搏血氧仪设备临床评价技术审查指导原则》征求意见的通知医疗器械技术审评中心11.325关于《高频手术设备注册技术审查指导原则》&《强脉冲光治疗仪产品注册技术审查指导原则》(征求意见稿)征求意见的通知医疗器械技术审评中心11.626关于《牙科基托聚合物材料注册技术审查指导原则》(征求意见稿)征求意见的通知医疗器械技术审评中心11.627关于对《无源植入类骨关节产品说明书编写指导原则》及《常见无源植入类骨关节产品说明书示例》征求意见的通知医疗器械技术审评中心11.1228食品药品监管总局办公厅国家卫生计生委办公厅关于公开征求医疗器械不良事件监测和再评价管理办法(征求意见稿)意见的函(食药监办械监函〔2015〕723号)医疗器械技术审评中心11.1229关于对《髋关节假体注册技术审查指导原则—临床试验部分》征求意见的通知医疗器械技术审评中心11.2430关于征求对《椎间融合器技术审查指导原则(征求意见稿)》意见的通知医疗器械技术审评中心11.2731关于征求对《免于进入临床试验的第二类医疗器械目录(第二批)(征求意见稿)和《免于进行临床试验的第三类医疗器械目录(第二批)(征求意见稿)意见的通知医疗器械技术审评中心12.1432关于征集“胎儿染色体非整倍体(T21、T18、T13)检测试剂盒(高通量测序法)”生产企业信息的通知医疗器械技术审评中心12.23来源:奥咨达整理。
《中国药典》2015年版通则

0100本制剂通则中原料药物系指用于制剂制备的活性物质,包括中药、化学药、生物制品原料药物。
中药原料药物系指 饮片、植物油脂、提取物、有效成分或有效部位》化学药原料药物系指化学合成、或来源于天然物质或采用生物技术获 得的有效成分(即原料药);生物制品原料药物系指生物制品原液或将生物制品原液干燥后制成的原粉。
本制剂通则中各剂型、亚剂型并不适用于所有原料药物,而应取决于原料药物特性、临床给药需求以及药品的安 全性、有效性和稳定性等。
本制剂通则适用于中药、化学药和治疗用生物制品(包 括血液制品、免疫血清、细胞因子、单克隆抗体、免疫调节 剂、微生态制剂等)。
预防类生物制品,应符合本版药典三部相应品种项下的有关要求。
除另有规定外,生物制品应于2〜8X:避光贮存和运输。
片剂系指原料药物或与适宜的辅料制成的圆形或异形的 片状固体制剂。
中药还有浸膏片、半浸膏片和全粉片等。
片剂以口服普通片为主,另有含片、舌下片、口腔貼 片、咀嚼片、分散片、可溶片、泡腾片、阴道片、阴道泡腾 片、缓释片、控释片、肠溶片与口崩片等。
含片系指含于口腔中缓慢溶化产生局部或全身作用的片剂。
含片中的原料药物一般是易溶性的,主要起局部消炎、杀菌、收敛、止痛或局部麻醉等作用。
舌下片系指置于舌下能迅速溶化,药物经舌下黏膜吸 收发挥全身作用的片剂。
舌下片中的原料药物应易于直接吸收,主要适用于急症 的治疗。
口腔貼片系指粘贴于口腔,经黏膜吸收后起局部或全身作用的片剂。
口腔貼片应进行溶出度或释放度(通则0931)检查。
咀嚼片系指于口腔中咀嚼后吞服的片剂。
咀嚼片一般应选择甘露醇、山梨醉、蔗糖等水溶性辅料作填充剂和黏合剂。
咀嚼片的硬度应适宜。
分散片系指在水中能迅速崩解并均勻分散的片剂。
分散片中的原料药物应是难溶性的。
分散片可加水分散 后口服,也可将分散片含于口中吮服或吞服。
分散片应进行溶出度(通则0931)和分散均匀性检查。
可溶片系指临用前能溶解于水的非包衣片或薄膜包衣片剂。
我院贝伐珠单抗生物类似药与原研药相关不良反应回顾性分析

我院贝伐珠单抗生物类似药与原研药相关不良反应回顾性分析Δ丁年羊1*,李莉2,方攀奇1,徐思露1,赵敏1,燕丹1 #(1.江苏省肿瘤医院/南京医科大学附属肿瘤医院/江苏省肿瘤防治研究所药学部,南京 210009;2.南京市食品药品监督检验院,南京 211198)中图分类号 R969.3文献标志码 A 文章编号 1001-0408(2024)04-0472-04DOI 10.6039/j.issn.1001-0408.2024.04.17摘要目的分析某院贝伐珠单抗生物类似药与原研药相关药物不良反应(ADR)的发生情况,为临床合理用药提供数据支持。
方法对江苏省肿瘤医院2022年1-12月上报的贝伐珠单抗生物类似药和原研药相关ADR报告进行回顾性分析。
结果我院使用贝伐珠单抗的患者共6818人次,上报ADR报告136份,贝伐珠单抗生物类似药的ADR发生率显著高于原研药(2.18% vs.0.71%,P=0.004)。
ADR报告中,治疗方案以贝伐珠单抗与其他肿瘤治疗药物的联合治疗方案为主(129人次);痊愈和好转的患者有118人次;一般ADR报告108份,严重ADR报告28份;ADR主要累及系统/器官以心血管系统为主,贝伐珠单抗生物类似药与原研药引起的高血压/血压升高、白细胞/血小板降低、腹泻和发热发生率比较,差异均无统计学意义。
结论贝伐珠单抗生物类似药的相关ADR发生率明显高于原研药,但ADR临床表现无明显差异,临床医生可以根据患者及其家属意愿选择使用。
关键词贝伐珠单抗;生物类似药;原研药;药物不良反应;合理使用Retrospective analysis of adverse drug reactions of bevacizumab biosimilar and original drug in our hospitalDING Nianyang1,LI Li2,FANG Panqi1,XU Silu1,ZHAO Min1,YAN Dan1(1. Dept. of Pharmacy,Jiangsu Cancer Hospital/The Affiliated Cancer Hospital of Nanjing Medical University/Jiangsu Institute of Cancer Research,Nanjing 210009, China;2. Nanjing Institute for Food and Drug Control, Nanjing 211198, China)ABSTRACT OBJECTIVE To analyze the occurrence of adverse drug reactions (ADR)between bevacizumab biosimilars and original drugs,and to provide data support for rational use of drugs in clinical.METHODS ADR reports of bevacizumab biosimilars and original drugs reported by Jiangsu Cancer Hospital from January to December 2022were retrospectively analyzed. RESULTS A total of 6818patients were treated with bevacizumab,and 136 ADR patients were reported. The incidence of ADR caused by bevacizumab biosimilars was higher than original drugs (2.18%vs. 0.71%,P=0.004). In ADR reports,the main treatment plan was bevacizumab combined with other tumor drugs (129patients);118patients were cured and improved;there were 108 general reports and 28 serious reports; the main system/organ involved in ADR was the cardiovascular system; there were no statistical significance in the incidence rates of hypertension/blood pressure increase,leukocyte/platelet decrease,diarrhea and fever caused by bevacizumab biosimilars and original drugs.CONCLUSIONS The incidence of ADR related to bevacizumab biosimilars is significantly higher than that of the original drugs,but there is no significant difference in the clinical manifestation of ADR. Clinicians can use bevacizumab biosimilars or original drugs based on the willingness of patients and their families. KEYWORDS bevacizumab; biosimilars; original drugs; adverse drug reactions; reasonable use贝伐珠单抗是由中国仓鼠卵巢细胞表达的特异性靶向游离血管内皮生长因子(vascular endothelial growth factor,VEGF)的重组人源化免疫球蛋白G1单克隆抗体,其能通过阻断游离VEGF与其受体结合,抑制肿瘤组织血管生成而发挥抗肿瘤作用。
玻璃体腔注射康柏西普治疗老年性黄斑病变的护理

玻璃体腔注射康柏西普治疗老年性黄斑病变的护理发表时间:2015-08-17T16:01:53.263Z 来源:《健康必读》2015年第6期供稿作者:韩坤萍[导读] 黄斑病变是一临床难治的顽固性眼病,它是一种能够导致中心视力丧失的疾病。
韩坤萍(云南省第一人民医院眼科云南昆明650032)【中图分类号】R473.77【文献标识码】B【文章编号】1672-3783(2015)06-0069-01【摘要】黄斑病变是一临床难治的顽固性眼病,它是一种能够导致中心视力丧失的疾病。
国家食品药品监督管理总局批准的康柏西普眼用注射液是治疗用生物制品Ⅰ类新药,系一种VEGF受体与人免疫球蛋白Fc段基因重组的融合蛋白,能通过结合血管内皮生长因子VEGF,竞争性抑制VEGF与受体结合并阻止VEGF家族受体的激活,从而抑制内皮细胞增殖和血管新生。
我科采用在玻璃体腔注射康柏西普联合激光治疗顽固性黄斑病变,效果满意,对其进行护理在患者的康复过程中是重要手段之一。
为探讨玻璃体腔注射康柏西普治疗老年性黄斑病变的相关护理方法,对我科43例黄斑病变的患者进行护理,为临床相关护理方法提供参考依据。
【关键词】玻璃体腔注射;康柏西普;老年性黄斑病变;护理老年性黄斑变性(senilemaculardegeneration)亦称年龄相关性黄斑变性(age-relatedmaculardegeneration)或衰老性黄斑变性(agingmaculardegeneration)。
它是一种能够导致中心视力丧失的疾病,当黄斑区视网膜后有异常的新生血管生长,即称之为黄斑变性。
这些新生血管十分脆弱,容易发生出血和液体渗漏,这些出血和液体渗漏会导致黄斑部水肿隆起,很快发生对黄斑的破坏,随着黄斑变性的发展,中心视力迅速丧失。
该病大多始发于50岁上下,年龄越大,患病率越高,发病与性别、种族无明显关系,双眼同时或先后受害,70岁以上的老年人中发病率可达15-33%,通常由糖尿病、视网膜静脉阻塞、葡萄膜炎、白内障人工晶体术后等原因引起,是一临床难治的顽固性眼病,治疗方法虽多,但往往效果欠佳[3]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中国人民解放军军事医学科学院放射与 辐射医学研究所
注射用重组新蛭素(酵母)
治疗用生物制品1
神州细胞工程有限公司
注射用重组人凝血因子VIII
治疗用生物制品10
神州细胞工程有限公司
注射用重组人凝血因子VIII
治疗用生物制品10
玉溪九洲生物技术有限责任公司
马抗狂犬病免疫球蛋白(F(ab’)2)
治疗用生物制品10
治疗用生物制品
Genzyme Europe B.V.
注射用阿糖苷酶α
治疗用生物制品
Novartis Pharma AG
RLX030
治疗用生物制品
艾尔建信息咨询(上海)有限公司 注射用A型肉毒毒素
治疗用生物制品
艾尔建信息咨询(上海)有限公司 注射用A型肉毒毒素
治疗用生物制品
安进生物技术咨询(上海)有限公司 AMG 145
企业名称
药品名称
注册分类
Bayer Pharma AG
血管内皮生长因子抑制剂
治疗用生物制品
Bayer Pharma AG
阿柏西普眼内注射溶液
治疗用生物制品
Bayer Pharma AG
阿柏西普眼内注射溶液
治疗用生物制品
Bayer Pharma AG
阿柏西普眼内注射溶液
治疗用生物制品
BristolMyers Squibb Company
重组人源化抗血管内皮生长因子(VEGF)单 克隆抗体注射液
治疗用生物制品1
泰州君实生物医药科技有限公司
重组人源化抗PD-1单克隆抗体注射液
治疗用生物制品1
无锡和邦生物科技有限公司
注射用促胰岛素分泌肽融合蛋白
治疗用生物制品1
烟台荣昌生物工程有限公司
注射用重组人源化抗HER2单抗-MMAE偶联剂 治疗用生物制品1
受理号
JXSL1300036 JXSL1400049 JXSL1400050 JXSL1400051 JXSL1300032 JXSL1300064 JXSL1300068 JXSL1300069 JXSL1400033 JXSL1300075 JXSL1300081 JXSL1200080 JXSL1200081 JXSL1400005 JXSL1400006 JXSL1200037 JXSL1300063 JXSL1300039 JXSL1300040 JXSL1300018 JXSL1300019
治疗用生物制品
赛诺菲(中国)投资有限公司
SAR236553注射液
治疗用生物制品
山西威奇达光明制药有限公司
重组人促红素注射液(CHO细胞)
治疗用生物制品
上海罗氏制药有限公司
注射用曲妥珠单抗
治疗用生物制品
深圳新鹏生物工程有限公司 石药集团百克(山东)生物制药有限公 司
注射用重组人肿瘤坏死因子相关凋亡诱导 配体 聚乙二醇化重组人粒细胞刺激因子注射液
Lebrikizumab注射液
治疗用生物制品
罗氏(中国)投资有限公司
帕妥珠单抗
治疗用生物制品
罗氏(中国)投资有限公司
Lebrikizumab注射液
治疗用生物制品
罗氏(中国)投资有限公司
Lebrikizumab注射液
治疗用生物制品
诺和诺德(中国)制药有限公司
德谷门冬双胰岛素注射液
治疗用生物制品
JXSL1300026 JXSL1300027 JXSL1300028 JXSL1300058 JXSL1300059 JXSL1300060 JXSL1300061 JXSL1400019 JXSL1400020 JXSL1400021 JXSL1400022 CYSB1400222 JYSB1500006 CXSB1400014 CYSB1400132 JXSL1300033 JXSL1100062
CXSL1300036 CXSL1300037 CXSL1300104 CXSL1300105 CXSL1200033 CXSL1200099 CXSL1300056 CXSL1300122 CXSL1400065 CXSL1400002 CXSL1400005
CXSL1300062
CXSL1100085 CXSL1400052 CXSL1400036
杭州泰格医药科技股份有限公司
奥克纤溶酶注射液
治疗用生物制品
江苏万邦生化医药股份有限公司
重组人胰岛素
治疗用生物制品
江苏先声药业有限公司
阿巴西普注射液
治疗用生物制品
罗氏(中国)投资有限公司
帕妥珠单抗注射液
治疗用生物制品
罗氏(中国)投资有限公司
Lebrikizumab注射液
治疗用生物制品
罗氏(中国)投资有限公司
治疗用生物制品 治疗用生物制品
武田药品(中国)有限公司
注射用维布妥昔单抗
治疗用生物制品
优诺康(北京)医药技术服务有限公司 皮肤点刺试剂盒
治疗用生物制品
石药集团中奇制药技术(石家庄)有限 公司
重组胰高血糖素样肽-1受体激动剂注射液
治疗用生物制品
北京美福源生物医药科技有限公司
注射用重组人血清白蛋白/干扰素α2b融合 蛋白
赛诺菲(中国)投资有限公司
SAR236553注射液
治疗用生物制品
赛诺菲(中国)投资有限公司
SAR236553注射液
治疗用生物制品
赛诺菲(中国)投资有限公司
SAR236553注射液
治疗用生物制品
赛诺菲(中国)投资有限公司
SAR236553注射液
治疗用生物制品
赛诺菲(中国)投资有限公司
SAR236553注射液
治疗用生物制品
东北制药集团沈阳第一制药有限公司 地衣芽孢杆菌活菌胶囊
治疗用生物制品
广州倍绣生物技术有限公司
猪源纤维蛋白粘合剂
治疗用生物制品
广州倍绣生物技术有限公司
猪源纤维蛋白粘合剂
治疗用生物制品
广州倍绣生物技术有限公司
猪源纤维蛋白粘合剂
治疗用生物制品
杭州泰格医药科技股份有限公司
注射用A型肉毒毒素
治疗用生物制品
治疗用生物制品
F.HoffmannLa Roche Ltd.
注射用Trastuzumab-MCC-DM1
治疗用生物制品
F.Hotuzumab-MCC-DM1
治疗用生物制品
F.HoffmannLa Roche Ltd.
注射用Trastuzumab-MCC-DM1
JXSL1100039
JXSL1100040
JXSL1300030 JXSL1300022 JXSL1300023 JXSL1300024 JXSL1300079 JXSL1300080
CXSB1400009
CXSB1400010
JXSL1400009 JXSL1400010 JXSL1400011 JXSL1400012 CBSR1200001 CYSB1400255 CYSB1400256 CYSB1400257 JXSL1300009 JXSL1300071 CXSB1300015 JXSL1300046 JXSL1300034 JXSL1300048 JXSL1300049 JXSL1300083 JXSL1400028 JXSL1400029 JXSL1300025
武汉中原瑞德生物制品有限责任公司 人凝血因子Ⅷ
诺和诺德(中国)制药有限公司
德谷门冬双胰岛素注射液
治疗用生物制品
诺和诺德(中国)制药有限公司
德谷胰岛素注射液
治疗用生物制品
诺和诺德(中国)制药有限公司
德谷胰岛素注射液
治疗用生物制品
赛诺菲(中国)投资有限公司
SAR236553注射液
治疗用生物制品
赛诺菲(中国)投资有限公司
SAR236553注射液
治疗用生物制品
精蛋白重组人胰岛素注射液(预混30/70) 治疗用生物制品15
河北大安制药有限公司
静注人免疫球蛋白(pH4)
治疗用生物制品15
江苏万邦生化医药股份有限公司
重组甘精胰岛素
治疗用生物制品15
江苏万邦生化医药股份有限公司
重组甘精胰岛素注射液
治疗用生物制品15
江西博雅生物制药股份有限公司
人凝血因子Ⅷ
治疗用生物制品15
Ixekizumab(LY2439821)注射剂
治疗用生物制品
F.HoffmannLa Roche Ltd
MPDL3280A 注射液
治疗用生物制品
F.HoffmannLa Roche Ltd
MPDL3280A 注射液
治疗用生物制品
F.HoffmannLa Roche Ltd.
注射用Trastuzumab-MCC-DM1
正大天晴药业集团股份有限公司
注射用重组人凝血因子Ⅷ
治疗用生物制品10
长春金赛药业有限责任公司
重组人生长激素注射液
治疗用生物制品13
广东双林生物制药有限公司
人凝血因子Ⅷ
治疗用生物制品15
合肥天麦生物科技发展有限公司
精蛋白重组人胰岛素注射液(预混50/50) 治疗用生物制品15
合肥天麦生物科技发展有限公司
通化东宝药业股份有限公司
门冬胰岛素30注射液
治疗用生物制品15
通化东宝药业股份有限公司
门冬胰岛素30注射液
治疗用生物制品15
武汉生物制品研究所有限责任公司 人凝血因子Ⅷ
治疗用生物制品15
CXSL1500022 CXSL1300017 CXSL1300033
CXSL1300077
CXSL1400042
治疗用生物制品
重组人血管内皮生长因子受体-抗体融合蛋 白注射液(静脉给药)
