安乃近检验记录
高效液相色谱法测定安乃近片中安乃近的含量

i w s 3 m.R sl : el err g f h rgn cdw s .3 0 540 ( = .9 ) teaeaercvr a n a 0a 2 eut T n a a eo C l oei ai a 0 0 96— .9 g r 0 9 99 , vr oeyrt sh i n o c h g e e
O
25 .
75 .
l 0
果其最大吸收波长分别为 2 5n 6 m和 2 5n 4 m。故选取 251 为检测波长。 6 1 " 1 1
《 中国药典》 中安乃近片含量测定只有碘量法 , 本
1 安 乃 近 .
文参考有关文献采用高效液相色谱法 , 两方法结果基
本一 致 。
图 1 对照品( A) 供试 品 ( 阴 性对照 ( H L 色谱 图 B) C) P C
收稿 日 :0 1 4 6 期 21- - 02
天津药学
Taj P amay 0 1 i i hr c 2 1 年 nn
第2 3卷第 5期
9
3 讨 论
3 1 溶液的选择 分别以甲醇 一 6 :4 ) 乙腈 一 . 水(0 0 、 水(O 0 ; 2 :8 ) 甲醇 一 .2m lL磷酸二氢钾溶液 ( 0 0 o / 用
D tr n t no hoo ei cda dp enf r ior igin isb L to eemiai f lr gncai n aci oi i Xa eqn j gpl yHP C me d o c l nn a l h
Xu h rn L f n S n Ya y n eS i g 。 i o Yu a g , u n a
回收率为 9 .2 ,S 93% R D为 07% ( = ) .2 n 6 。结论 : 该方法简便 、 准确 、 重复性好 , 适用于dJ 清降丸的质量控制 。 ,h
安乃近片成品检验记录

公司安乃近片成品检验记录第一页【依据】中华人民共和国药典(年版二部)【性状】本品为。
结论:【鉴别】取本品适量研细,以下方法试验⑴称取本品细粉g,加稀盐酸1ml溶解后,加次氯酸钠试液2滴,,加热煮沸后,。
(规定:先产生瞬即消失的蓝色,加热煮沸后变成黄色。
)结论:⑵称取本品g,加稀盐酸8ml溶解后,加热,。
(规定:加热即发生二氧化硫的臭气,然后发生甲醛的臭气。
)结论:【检查】室温:相对湿度:重量差异仪器:取本品20片,称定重量:20片+纸:-纸:平均片重:g ;差异限度:g×(±0.5%)=±g ;上限:g+g=g;下限:g -g=gg;g;g;g;g;g;g;g;g;g;g;g;g;g;g;g;g;g;g;g;(规定:每片重量与平均片重相比较,均不得超出重量差异限度;或超出重量差异限度的药片不多于2片,且均未超出限度1倍)结论:崩解时限:取本品6片,用BJ—1型片剂崩解测定仪,调节水温为37℃,依仪器操作法操作,。
(规定:不得过15分钟)结论:脆碎度:仪器:取本品片,用吹风机除去脱落的粉末,精密称定:样品+纸:—纸:样品净重:检验员:复核员:年月日安乃近片成品检验记录第二页将上述片子置脆碎仪转筒内,转动100次,取出,用吹风机除去脱落的粉末,精密 称定: 样品+纸:—纸:样品净重:减失重量:检视片子: 。
(规定:减失重量不得过1%;不得检出断裂、龟裂及粉碎的片) 结论:【含量测定】 仪器:取本品10片,精密称定重量:10片+纸:- 纸:平均片重: g/片 ⑴ ⑵-) -)分别加乙醇与0.01mol/L 盐酸溶液各10ml ,使安乃近溶解后,立即用碘滴定液 (0.1mol/L )滴定(控制滴定速度为每分种3~5ml ),至溶液所显得浅黄色(或带紫 色)在30秒钟内不褪。
每1ml 碘滴定液(0.1mol/L )相当于17.57mg 的 C 13H 16N 3NaO 4S ·H 2O 。
安乃近注射液半成品检验操作记录
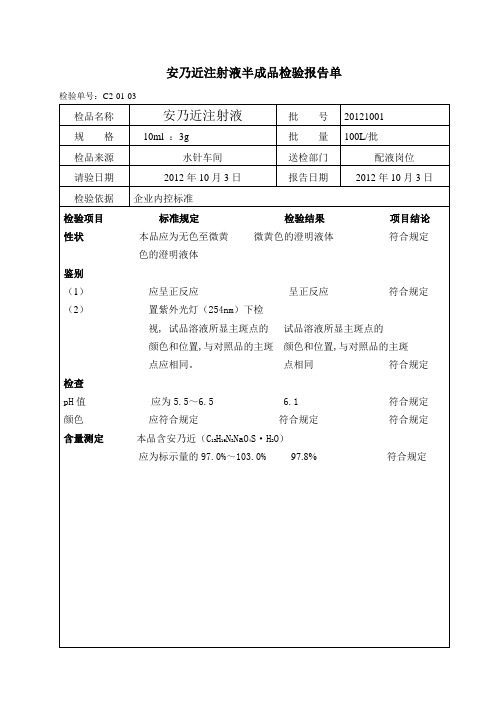
检验单号:C2-01-03
检品名称
安乃近注射液
批号
20121001
规格
10ml:3g
批量
100L/批
检品来源
水针车间
送检部门
配液岗位
请验日期
2012年10月3日
报告日期
2012年10月3日
检验依据
企业内控标准
检验项目标准规定检验结果项目结论
性状本品应为无色至微黄微黄色的澄明液体符合规定
检验单号:C2-01-03
检品名称
安乃近注射液
批号
20121003
规格
10ml:3g
批量
100L/批
检ห้องสมุดไป่ตู้来源
水针车间
送检部门
配液岗位
请验日期
2012年10月5日
报告日期
2012年10月5日
检验依据
企业内控标准
检验项目标准规定检验结果项目结论
性状本品应为无色至微黄微黄色的澄明液体符合规定
色的澄明液体
鉴别
应为标示量的97.0%~103.0%97.8%符合规定
结论
本品按企业内控标准检验,结果:符合规定。
质检负责人:复核人:检验员:
安乃近注射液半成品检验报告单
检验单号:C2-01-03
检品名称
安乃近注射液
批号
20121002
规格
10ml:3g
批量
100L/批
检品来源
水针车间
送检部门
配液岗位
请验日期
2012年10月4日
应为标示量的97.0%~103.0%98.4%符合规定
结论
本品按企业内控标准检验,结果:符合规定。
安乃近注射液的含量测定

维生素C 注射液的含量测定一、实验说明安乃近分子结构中含有+4价具有还原性的硫元素,可与I 2发生反应,根据所消耗I 2的量来测定本品的含量。
N N CH 3N CH 2SO 3NaCH 36H 5CH 3O+ 2H 2O+I 2N N CH 3N CH 2OH CH 36H 5CH 3O+ 2HI+NaHSO 4安乃近注射液中通常添加亚硫酸氢钠作为抗氧剂,亚硫酸氢钠与I 2也能发生氧化还原反应,如直接用碘液滴定,测定结果偏高,通常加入甲醛进行掩蔽。
通过本实验的训练,理解注射剂含量测定时干扰的存在和排除方法,掌握容量分析法测定注射剂的含量计算方法,巩固滴定操作技能。
二、仪器与试剂(一)仪器移液管(10mL ),棕色酸式滴定管(50 mL ),量筒(100 mL 、10 mL ),锥形瓶(250 mL )。
(二)试剂维生素C ,碘滴定液(0.05 mol ·L -1),稀醋酸,新沸过的冷水,淀粉指示液。
三、测定方法精密量取安乃近注射液适量(约相当于含安乃近3 g ),置100 mL 量瓶中,加乙醇80 mL ,再加水稀释至刻度,摇匀,立即精密量取10 mL ,加乙醇2 mL ,水6.5 mL 与甲醛溶液0.5 mL ,放置1 min ,加盐酸溶液(9→1 000)1.0 mL ,摇匀,用碘滴定液(0.05 mol ·L -1)滴定(控制滴定速度为3~5 mL ·min -1),至溶液所显的浅黄色在30 s 内不褪。
每1 mL 碘滴定液(0.05 mol ·L -1)相当于17.57 mg 的C 13H 16N 3NaO 4S ·H 2O 。
四、数据记录与报告。
HPLC法测定安乃近注射液有关物质

HPLC法测定安乃近注射液有关物质摘要:目的:研究如何在HPLC法下测定安乃近注射液有关物质的含量是否在安全范围之内。
方法:采用HPLC法下测定安乃近注射液中杂质峰面积情况,并将杂质峰面积与对照组溶液主峰面积进行对比,杂质峰面积占比即安乃近注射液有关物质的含量。
结果:色谱条件中检测波长、流速、柱温、进样量、色谱峰保留时间等参数分别为265nm、1.0mL/min、30℃、10μL、7.1min。
破坏性试验结果表明加热1h或者强光照射4h后,安乃近主要成分和有关物质的降解产物均能够有效分离,而且安乃近注射液与甲醇溶液的混合溶液样本是不稳定的。
试验结果表明安乃近注射液中有关物质含量最高的为6.9%,有关物质含量最低的为3.7%,平均有关物质含量为5.0%。
结论:HPLC法测定安乃近注射液有关物质具体操作比较简单,能够直接测定安乃近注射液杂质含量,该测定方法具备推广价值。
关键词:HPLC法;安乃近注射液;有关物质引言:安乃近注射液,适应症为用于高热时的解热,也可用于头痛、偏头痛、肌肉痛、关节痛和痛经等,该药物有可能引起严重的不良反应,很少在风湿性疾病中应用。
之所以安乃近注射液会导致患者出现贫血、皮肤过敏、局部红肿疼痛、过敏性休克、大汗淋漓至虚弱等不良反应,是因为安乃近注射液中含有一定杂质,这些杂质含量越高患者出现不良反应的几率就越高,因此检测安乃近注射液有关物质含量是必要的。
1仪器与试药本试验采用HPLC法测定安乃近注射液有关物质共使用液相色谱仪、色谱工作站、各个生产厂家的安乃近注射液样品、甲醇溶液、磷酸盐缓冲液(pH值为7)等仪器与试药。
其中液相色谱仪、色谱工作站都由赛默飞公司生产,甲醇溶液为HPLC法的色谱纯,磷酸盐缓冲液由磷酸二氢钠、三乙胺、氢氧化钠分析纯配制(取6.0g磷酸二氢钠加水溶解至1000mL,再加入1ml三乙胺即可得到磷酸盐缓冲液,最后采用氢氧化钠分析纯将磷酸盐缓冲液pH值调整至7)[1]。
安乃近原料检验操作规程

GMP管理文件一.目的:为规定安乃近的检查方法和操作要求,特制定此标准。
二.适用范围:适用于本公司安乃近的质量检测。
三.责任者:检验员四.正文:【检品名称】安乃近【引用标准】安乃近内控质量标准【使用仪器】干燥箱【操作内容】【性状】本品为白色(供注射用)或略带微黄色(供口服用)的结晶或晶性粉末;无臭,味微苦;水溶液放置后渐变黄色.本品在水中易溶,在乙醇中略溶,在乙醚中几乎不溶.【鉴别】(1)取本品约20mg,加稀盐酸1ml溶解后,加次氯酸试液2滴,产生瞬即消失的蓝色,加热煮沸后变成黄色.(2)取本品约0.2 mg,加稀盐酸8ml溶解后,加热即发生二氧化硫的臭气,然后生甲醛的臭气.(3)本品的红外光吸收图谱应与对照的图谱一致.(4)本品显钠盐的火焰反应。
【检查】酸度取本品0.50g,加水50ml溶解后,依法检查,PH值应为6.0~7.0.溶液的澄清度与颜色取本品2.5 g(供注射用)或1.0 g(供口服用),加水10ml使溶解,俟气泡消失后,立即检视,溶液应澄清无色;如显色,立即与同体积的对照液(取比色用重铬酸钾液 1.2ml、比色用硫酸铜液0.10ml与比色用氯化钴液0.10ml,加水至50ml,摇匀)比较,不得更深.甲醇溶液的澄清度取本品0.50 g,加甲醇10 ml,振摇使溶解,如显浑浊,立即与对照液{取标准硫酸钾溶液0.50 ml、1mol/l盐酸溶液1 ml与新制的氯化钡溶液(1→20)3 ml,加水至10 ml,摇匀,并放置10分钟}比较,不得更浓(供注射用)。
硫酸盐取本品0.20 g,依法检查,与标准硫酸钾溶液2.0 ml制成的对照液比较,不得更浓(0.1%).4-N-去甲基安乃近取本品0.50 g,置50ml量瓶中,加水溶解并稀释至刻度,摇匀,量取1.0ml,置25ml纳氏比色管中,加水至10ml,加盐酸溶液(1→2)5ml,置水浴加热5分钟,放冷,加水7ml,摇匀,加10%香草醛的乙醇溶液 2.0ml,加水至刻度,摇匀,与对照用安乃溶液 1.0 ml(含安乃近对照品10 mg )加4-N-去甲基安乃近溶液(每1 ml 含无水4-N-去甲基安乃对照品10ug)2.0 ml(供注射用)或7.0 ml(供口服用)用同一方法制成的对照液比较,不得更深{0.2%(供注射用)或0.7%(供口服用)}.干燥失重取本品,在105℃干燥至恒重,减失重量不得过5.5%.重金属取本品1.0 g,置石英坩埚或硬质玻璃蒸发皿中,加硫酸1 ml 使湿润,缓缓炽灼至硫酸蒸气除尽,放冷,加硝酸0.5 ml,继续炽灼至氧化氮蒸气除尽后,在500~600℃炽灼使完全灰化,放冷,加盐酸2 ml,置水浴上蒸干,加水15 ml使溶解,滴加氨试液至对酚酞指示液显中性,再加醋酸盐缓冲液(PH3.5)2 ml与水适量使成25 ml依法检查,含重金属不得过百万分之十(供注射用)或百万分之二十(供口服用).【含量测定】取本品约0.3 g,精密称定,加乙醇与0.01mol/l盐酸溶液各10 ml溶解后,立即用碘滴定液(0.05mol/l)滴定(控制滴定速度为每分钟3~5ml),至溶液所显的浅黄色在30秒钟同偿褪.每1ml碘滴定液(0.05 mol/l)相当于16.67mg的C13H16N3NaO4S。
安乃近片剂的制备实验报告(西南大学药学院)

安乃近片剂的制备与质量检查李昀松樊洁(西南大学药学院,重庆400715)摘要:目的研究安乃近片剂的制备工艺,并对制得的安乃近片剂进行质量检查。
方法以安乃近为主药,淀粉作为稀释剂,硬脂酸镁作为润滑剂, 10%的淀粉浆作为黏合剂,采用湿法制粒压片法制备安乃近片剂;然后对所制得的片剂进行外观、片重差异、硬度、脆碎度及崩解时限检查。
结果安乃近片剂的外观形状规则,表面光滑,硬度均一;片重差异检查时2片超出限度要求,脆碎度检查时减少质量为5.2%,6片安乃近片6min全部崩解。
结论安乃近片剂的外观、硬度、片重差异及崩解时限符合规定,脆碎度不符合规定。
关键字安乃近;片剂;湿法制粒压片法;质量检查Analgin tablet preparation and quality checkLI Yun Song ; FAN Jie(college of southwest university, chongqing 400715)【Abstract】objective:to study the preparation technology of analgin tablet, and of analgin tablet for quality check. Method :is given priority to with analgin, starch as diluent, magnesium stearate as lubricant, 10% of the starches as adhesive, USES the wet legal system grain of tableting prepared analgin tablet; Then the tablet was prepared by difference appearance, tablet weight, hardness, brittle broken degree and disintegration time limit of inspection. Results:the appearance of analgin tablet shape rules, smooth surface, uniform hardness; Check weight difference when 2 pills beyond limit, brittle broken degree of inspection quality to reduce 5.2%, 6 pieces of analgin tablet min all collapse. Conclusion:analgin tablet appearance, hardness, weight difference and disintegration time limit within the rules, brittle broken degree is not in conformity with the provisions.【keyword】analgin; Tablets; The wet legal system grain of tabletting method; Quality check片剂系指药物与适宜辅料混匀压制而成的圆片状或异形片状的固体制剂。
安乃近片检验方法确认方案

安乃近片检验方法确认文件编号:×××药厂安乃近片检验方法确认方案起草人_____________ 部门____________ 日期___________ 审核人_____________ 部门____________ 日期___________ 审核人_____________ 部门____________ 日期___________ 批准人_____________ 日期__________ _目录一、确认方案1.概述2.确认的原则和目的3.确认的项目和范围4.组织及职责4.1确认方案和报告的起草、审核、批准4.2确认方案的培训4.3组织实施过程中的变更和偏差4.4实施组织人员5.样品和标准品信息6.分析仪器7. 实施检验人员信息8. 确认方法8.1鉴别检验方法确认8.2有关物质检查确认8.3含量测定确认9.结论报告二、确认报告三、确认证书1、概述安乃近片收载于《中国药典》2010年版第一增补本,本公司生产的规格为0.5g/片,其检测主要内容为:【性状】本品为白色或几乎白色片【鉴别】(1)取本品的细粉适量(相当于安乃近20mg),加稀盐酸1ml溶解后,加次氯酸钠试液2滴,产生瞬即消失的蓝色,加热煮沸后变成黄色。
(2)取本品细粉适量约(相当于安乃近0.1g),置试管中,加水1.5ml和稀盐酸1.5ml 溶解后,试管口覆盖一张用碘酸钾0.1g溶于淀粉指示液10ml润湿的滤纸,缓缓加热滤纸变蓝色,取下滤纸继续加热,用玻璃棒蘸取1滴变色酸硫酸溶液(1→100),置试管口,10分钟内,玻璃棒上的试剂显蓝紫色。
【检查】(1)有关物质取本品细粉适量,精密称定,加甲醇溶解并稀释制成每1ml中含安乃近5mg的溶液作为供试品溶液(临用新制);另精密称取4-甲氨基安替比林对照品5mg,置100ml 量瓶中,精密加入供试品溶液1ml,加甲醇溶解并稀释至刻度,摇匀,作为对照溶液。
另取安乃近和4-N-去甲基安乃近对照品适量,加甲醇溶解并稀释成每1ml中各含25ug的混合溶液作为系统适用性试验溶液。
HPLC 法测定重感灵片中的安乃近的含量

2.7 精密度试验 取上述对照品溶液 1 份,连续进样 6 次,测定安乃近色谱峰积分面积,结果 RSD=0.2%(n=6)。
2.8 待测溶液稳定性试验 取上述同一样品溶液,分 别于 0、2、4、6、8 h 进样,测定安乃近色谱峰的积分 面积,结果在室温条件下样品中安乃近在 8 h 内稳定, RSD=0.5%。
2.1 检测波长的选择 取安乃近适量 ( 约 10 mg),精密 称定,置棕色量瓶中,用甲醇 - 水 (70: 30) 混合液配制, 用量为 0.1 mg/mL,摇匀,既得。扫描范围为 200~400 nm,最大吸收波长为 275 nm。参考国家食品药品监督管 理总局国家药品标准 (WS-10872(ZD-0872)-2002-2011Z) [2] 重感灵片质量标准测定安乃近的检测波长 275 nm,采用 275 nm 作为检测波长。
2.4 干扰试验 按处方量配制阴性样品,按供试品溶 液的制备方法配制供试品溶液和阴性样品溶液。精密量 取供试品溶液和阴性样品溶液各 10μL,按上述色谱条件 测定,并记录色谱图。结果阴性品的色谱图在安乃近峰 处无色谱峰。结果表明,其他药材和辅料对安乃近的含 量测定无干扰。
2.5 校正曲线与线性关系 精密称取安乃近标准品 0.017 82 g 置 100 mL 量瓶中,用甲醇 - 水 (70: 30) 的混合 溶液溶解并稀释至刻度,精密测定 1,2,5,7,10,12, 15,20μL 注入液相色谱仪。记录色谱图。以溶液浓度 (x) 为横坐标,峰面积 (y) 为纵坐标进行线性回归分析。回归 方程为 y-0.001 2x-0.008 6。结果表明,安乃近的线性范 围为 0.178 2~3.564 mg/mL,r=0.999 9。
高效液相色谱法测定安乃近注射液的含量

HP C L 法
药典 漳
定。 将测得结果 与 20 0 5年版《 中国 药 典 ( 部 )I 二 》 中方 法 的结 果 比
较 , 果 见 表 2 结 。
3 讨 论
醇溶解并稀 释至刻度 , 匀 , 摇 作为贮备液 , 精密 量取该贮备液 1 0 ., 20 30 4 0 50m , . ,. ,. , . L 分别置 1 0m 0 L量瓶 中 , 甲醇稀释至刻度 , 用 作为对照品溶液 。 密量取供试 品适量 ( 精 约相当于安乃 近 2 g , 5 )置 m 10m 0 L量瓶中 , 甲醇溶解并稀释至刻度 , 匀 , 用 摇 作为贮备液 , 精密
取 3 0mL 置 10mL量 瓶 中 , 甲 醇 稀 释 至 刻 度 , 匀 , 样 平 : . , 0 加 摇 每
测 定 2次 , 果 见 表 1 结 。
袁 1 安 乃近 加 样 回收 试 验 结 果 ( n=6 )
L C一1 A v 0 T p型高效液相 色谱 仪( 日本 岛津) 普利赛斯 电子 分 ; 析天平 。 安乃近对 照品 ( 号为 10 0 批 0 0 2—19 0 , 9 5 4 中国药品生物 制 品检定所 ) 安乃近注射 液( ; 规格为 2m 0 5g林州市 大众 药业 有 L: . , 限公司) 甲醇 ( ; 色谱 纯) 水( , 重蒸馏水 ) 。
/mV U/mV U/mV
样品含量 ( / L m )加入量( / L m )测得 量(g m )回收率( ). % )脚 ( I/ L L % j 『 (
l 0I O
1 O0i
1 00l
5l 0
0 ====== —一 = 0 5 l 0 £ /mi n 1 5
1 仪 器 与试 药
R-ZL-035-01安乃近注射液检验记录

R-ZL-035-01安乃近注射液检验记录1、性状本品为液体。
(标准:无色或微黄色的澄明液体)2.1取本品适量(约含安乃近20mg)ml,加稀盐酸1ml混匀后,加次氯酸钠试液2滴,产生瞬即消失的,冷却煮熟后变为。
(标准:蓝色;黄色)结论:2.2取本品适量(约含安乃近0.1g)ml,置试管中,加水1.5ml和稀盐酸1.5ml混匀后,试管口覆盖一张用碘酸钾0.1g溶于淀粉指示液10ml润湿的滤纸,缓缓加热滤纸变,取下滤纸继续加热,用玻璃棒蘸取1滴变色酸硫酸溶液(1→100),置试管口,10分钟内,玻璃棒上的试剂显。
(标准:蓝色;蓝紫色)结论:3、检查3.1颜色取本品,与黄色3号标准比色液(《中国药典》2021年版二部附录ⅸa)比较,。
(标准:严禁更深)结论:3.2ph值(照《中国药典》2021年版二部附录ⅵh)温度:仪器型号:取适量磷酸盐标准缓冲液(ph6.86)和四硼酸钠标准缓冲液(ph9.18)进行校正,校正后,取供试品溶液,测定。
(标准:5.0~7.0)检验结果:(1)(2)平均值:修成约值:结论:3.3装量差异取本品5支,开启时注意避免损失,将内容物分别用ml的干燥注射器及注射剂针头抽尽,然后注入用经标化的ml量具内,在室温下检视。
(标准:每支装量均不得少于其标示量)3.4可知异物检查(照《中国药典》2021年版二部第三章)yb-2型无瑕度检测仪(2000~3000lx)检测。
(标准:抽查20两支,均严禁验出可知异物,例如验出1两支,另挑20支同法检验,均严禁验出)3.5不溶性微粒检查(照《中国药典》2021年版二部,不溶性微粒:光阻法检测)(标准:每瓶供试品中含10µm以上的微粒不得过3000粒,含25µm以上的微粒不得过300粒。
)3.6无菌(照《中国药典》2021年版二部第三章)供试品制取:常规法供试品支,轻易过滤器。
检查法:薄膜过滤法,用三联全封闭薄膜过滤器直接过滤,分别将2份100ml硫乙醇酸盐流体培养基及1份100ml改良马丁培养基加入相应滤筒内,其中一筒硫乙醇酸盐流体培养基加入小于100cfu的金黄色葡萄球菌做阳性对照。
安乃近微生物限度检查方法的验证

安乃近片微生物限度检查方法验证报告1 目的确认安乃近片的抑菌活性及测定方法的可靠性。
2 内容细菌、霉菌及酵母菌数的测定和控制菌的检查。
3 方法按中国药典2010版微生物限度检查方法验证的要求进行方法验证。
4 菌种4.1 细菌、霉菌及酵母菌计数方法的验证所用菌种:大肠埃希菌〔CMCC(F)44 102〕(10-7)、金黄色葡萄球菌〔CMCC(B)26 003〕(10-6)、枯草芽孢杆菌〔CMCC(B)63 501〕(10-5)、白色念珠菌〔CMCC(F)98 001〕(10-5)、黑曲霉菌〔CMCC(F)98 003〕(10-4)。
4.2 控制菌检查方法的验证所用菌种:大肠埃希菌〔CMCC(F)44 102〕。
5 培养基、稀释剂营养肉汤培养基、改良马丁培养基、改良马丁琼脂斜面培养基、营养琼脂培养基、玫瑰红钠琼脂培养基、PH7.0无菌氯化钠-蛋白胨缓冲液、0.9%无菌氯化钠溶液、胆盐乳糖培养基、MUG培养基、乳糖胆盐发酵培养基。
6 方法验证6.1 验证要求细菌、霉菌及酵母菌数测定,至少进行3次独立的平行试验,每次平行试验回收率均应在70%以上:若试验组的菌回收率(试验组的平均菌落数-供试品对照组的平均菌落数的值占菌液组的平均菌落数的百分率)均不低于70%,照该供试液制备方法和计数法测定供试品的细菌、霉菌及酵母菌数。
控制菌检查方法的验证要求试验组检出试验菌—大肠埃希菌。
6.2 验证过程6.2.1 细菌、霉菌及酵母菌数测定方法的验证6.2.1.1 菌液制备a、取经30—35℃培养18—24小时的大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌、培养物1ml,分别加9ml无菌0.9%氯化钠溶液10倍稀释为10-7、10-6、10-5约50—100cfu /ml,做活菌计数备用。
b、取经23—28℃培养24—48小时的白色念珠菌液体培养物1ml加9ml无菌0.9%氯化钠溶液10倍稀释为10-5约50—100cfu/ml,做活菌计数备用。
实验五 安乃近片的含量测定档
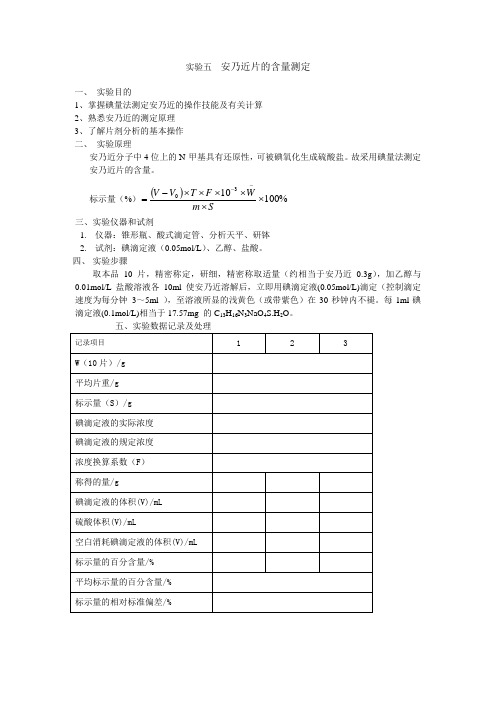
实验五安乃近片的含量测定
一、实验目的
1、掌握碘量法测定安乃近的操作技能及有关计算
2、熟悉安乃近的测定原理
3、了解片剂分析的基本操作
二、实验原理
安乃近分子中4位上的N-甲基具有还原性,可被碘氧化生成硫酸盐。
故采用碘量法测定安乃近片的含量。
标示量(%)
()
%
100
103
0⨯
⨯
⨯
⨯
⨯
⨯
-
=
-
-
S
m
W
F
T
V
V
三、实验仪器和试剂
1.仪器:锥形瓶、酸式滴定管、分析天平、研钵
2.试剂:碘滴定液(0.05mol/L)、乙醇、盐酸。
四、实验步骤
取本品10片,精密称定,研细,精密称取适量(约相当于安乃近0.3g),加乙醇与0.01mol/L 盐酸溶液各10ml使安乃近溶解后,立即用碘滴定液(0.05mol/L)滴定(控制滴定速度为每分钟3~5ml ),至溶液所显的浅黄色(或带紫色)在30秒钟内不褪。
每1ml碘滴定液(0.1mol/L)相当于17.57mg 的C13H16N3NaO4S.H2O。
五、实验数据记录及处理
六、注意事项
1. 碘具有挥发性,取后应立即盖好瓶塞。
2. 注意节约碘液,淌洗滴定管或未滴完的碘液应倒入回收瓶中。
七、思考题
1.为什么使用碘量瓶进行操作?
2.加入乙醇的作用是什么?
3.为何要控制滴定的速度?。
实验六 安乃近片的含量测定

实验六 安乃近片的含量测定一.实验目的1. 掌握碘量法测定安乃近片的操作技能及有关计算;2. 熟悉安乃近片的含量测定原理;3. 了解片剂分析的基本操作步骤。
二.实验原理本品分子中4位上的N-甲基具有还原性,可被碘氧化生成硫酸盐。
反应是如下: ++→++422NaHSO HI O HI故《中国药典》现行版采用碘量法测定安乃近片的含量。
三.实验药品及仪器实验药品:安乃近片1片,乙醇,盐酸溶液(0.1mol/L ),碘滴定液(0.1mol/L ) 实验仪器:酸碱滴定管四.实验内容及步骤1. 取本品1片,精密称定,研细,精密称取适量,加乙醇与0.1mol/L 盐酸溶液各10ml,使安乃近片溶解;2. 用碘滴定液(0.1mol/L )滴定(控制滴定的速度在每分钟3~5ml ),至溶液所显的浅黄色颜色(或带紫色)在30秒钟内不退色,即完成滴定。
五.操作注意事项1. 本品含安乃近(O H S NaO N H C 2431613⋅)应为标示量的95.0%~105.0%。
试验时间实验地点 实验人员 2011年4月17日基础有机化学实验室 唐鹰2. 2I 具有挥发性,去后应立即盖好瓶塞。
3. 注意节约碘液,淌洗滴定管或未滴定完的碘液倒入回收瓶中。
六.实验数据记录及含量计算将所得实验数据代入公式 标示量%%10010)(30⨯⨯⨯⨯⨯⨯-=--S m W F T V V 在实验中,得出以下数据: 空白试验组:0V =0.2ml ; 实验组:V=15.2ml 。
有实验一致的数据有:T=17.57mg ,F=1,W =0,3025g ,m=0.3025g ,S=0.25g 其中W =0,3025g 是由网上所得,为平均每片阿司匹林片的重量。
代入公式 =⨯⨯⨯⨯⨯⨯=%10025.03025.03025.010157.172.02.15%3-)—(含量105.4%实验结果讨论与分析:有计算所得的结果,实验所得阿司匹林含量稍稍大于标定量的105%,可能是由于滴定终点推迟多加了一点碘液所致,或者是由于是严重一些小失误所致。
高效液相色普法测定安乃近含量
·49 ·
高效液相色谱法测定安乃近片的含量
马继红
(安徽省安庆市第一制药厂 ,安庆 246002)
摘要 目的 建立高效液相色谱法测定安乃近的含量 。方法 采用 Accuil2C18色谱柱 ,甲醇∶水 (60∶40) 为流动相 ,231 nm 为检 测波长 ,室温下对安乃近片中安乃近进行含量测定 。结果 安乃近在 4104~4014 mg·L - 1范围内 ,峰面积与其浓度线性关系良 好 ( r = 01999 9) ;样品平均回收率为 99187 % ,精密度 RSD 为 1121 %。结论 该法简便 、快速 、专属性强 。 关键词 高效液相色谱法 ;安乃近
安乃近片《中国药典》2000 版二部收载 ,其含量测定用碘 量法 。最近我们发现有不法分子利用药典含量测定方法专属 性不强的特征 ,混掺其它成分 ,采用药典方法测定含量时 ,符 合规定 。针对此现象 ,我们设立了高效液相色谱法测定含量 。 1 仪器与试药
日本岛津 UV224012PC 紫外分光光度计 ; 美国光谱物理 公司 SP28810 高效液相色谱仪 ; SP2100 紫外检测器 ; SP24290 积分 仪 ; 色 谱 柱 : Accuil C18 10 μl 250 mm ×416 mm ; 上 海 FA1004 微量分析天平 。安乃近对照品 (中国药品生物制品检 定所 ,批号 000229504) 。样品为监督抽检 ;甲醇为色谱纯 。实 验条件 :柱温 :室温 ;检测器灵敏度 : 011 ;响应时间 : 110 ;检测 波长 : 231 nm ; 流 速 : 016 ml ·min - 1 ; A T : 32 CS : 0125 cm · min - 1 。 2 吸收波长的选择
安乃近检测与片剂胶囊剂的制备

含量测定
取本品约0.3g,精密称定,加乙醇与 0.01mol/L盐酸溶液各10ml溶解后,立即 用碘滴定液(0.05mol/L)(预估用量) 滴定(控制滴定速度为每分钟3~5ml), 至溶液所显示的浅黄色在30秒钟内不褪, 每1ml碘滴定液(0.05mol/L)相当于 16.67mg的C13H16N3NaO4S
安乃近胶囊的制备
取片剂中整粒后的颗粒作为胶囊的填充物 胶囊的填充 胶囊的包装
胶囊的填充
胶囊套盒机
胶囊的包装
胶囊铝塑包装机
注意事项
(1)滴定管活塞不能混用 (2)控制滴定速度,注意终点判定 (3)结果记录:现象,碘液用量,含量 计算 (4)准确快速进行实验:熟悉实验内容
安乃近片剂的制备
原料:安乃近原料药、淀粉、滑石粉、 硬脂酸镁 按照自己设计的处方进行
原辅料过45目筛
工艺流程
制软材 制粒
10%淀粉浆的制备
制粒
用摇摆式颗粒机制粒后干燥,60~70度6小时
摇摆式颗粒机
Байду номын сангаас粒
将干燥的颗粒分别过10目和80目的筛网, 去除成块和过细的颗粒,取用中间段颗 粒,加入硬脂酸镁或滑石粉,轻摇混合 均匀。
压片
用压片机压片
筛片
用筛片机筛 选合格的片 剂
质量评价
按药典要求评价 片重差异 硬度:硬度仪 脆碎度:脆碎度仪 崩解时限:六管崩解仪 含量测定
工业药剂学实验
固体制剂的制备与检测
何小燕 Email:hxy0262@
目录
第一次课:安乃近原料的鉴别和含 量测定+片剂软材的制备 第二次课:安乃近片剂和胶囊的制 备+安乃近片剂的质量检测和含量 测定
安乃近注射液(成品)检验操作规程

GMP管理文件
一、目的:为规定安乃近注射液生产过程中的质量控制和检验操
作要求,特制定此操作规程。
二、适用范围:适用于安乃近注射液成品的检验。
三、责任者:生产部经理、检验员、生产人员
四、正文:
质量标准:见安乃近注射液(成品)内控质量标准
操作内容:
【性状】本品为无色至微黄色的澄明液体.
【鉴别】(1)取本品适量,照安乃近项下的鉴别(1)项试验,显相同的反应.
(2)取本品适量,加乙醇制成每1ml中含1.5mg的溶液,作为供试品溶液;另取安乃近对照品,加乙醇制成每1ml中含1.5mg的溶液,作为对照品溶液.照薄层色谱法试验,吸取上述两种溶液各2ul,分别点于同一硅胶GE254薄层板上,以乙醇-苯(7.5:5)为展开剂,展开,晾干,置紫外光灯(254nm)下检视。
供试品溶液所显主斑点的颜色和位置应与对照品的主斑点相同。
【检查】PH值应为5.5~6.5.
颜色取本品,与黄色3号标准比色液比较,不得更深.
其他应符合注射剂项下有关的各项规定.
【含量测定】精密量取本品10ml,置100ml量瓶中,加乙醇80ml,再加水稀释至刻度,摇匀,立即精密量取10ml,加乙醇2ml、水6.5ml与甲醛溶液0.5ml,主置1分钟,加盐酸溶液(9→1000)1.0ml,摇匀,用碘滴定液(0.05mol/l)滴定(控制滴定速度为每分钟3~5ml),至溶液所显的淡黄色在30秒钟内不褪.每1ml碘滴定液(0.05 mol/l)相当于17.57mg的C13H16N3NaO4S·H2O。
hplc法测定安乃近注射液有关物质

207HPLC 法测定安乃近注射液有关物质刘晓丹 乌日罕 毕力格 阿迪亚 王惠英(内蒙古自治区兽药监察所,内蒙古呼和浩特 010000)摘 要:【目的】建立HPLC 法测定安乃近注射液有关物质。
【方法】采用Waters XBridge C18(4.6 mm×150 mm,5 μm)色谱柱,流动相为磷酸盐缓冲液(磷酸二氢钠6.0g,加水1000ml,加三乙胺1ml,加氢氧化钠溶液调pH 至7.0)-甲醇(75︰25),流速为1.0 ml/min,检测波长为254nm,进样量为10 μl,柱温为30 ℃。
【结果】4-甲氨基安替比林质量浓度在0.0004076~0.4075 mg/mL (Y=2.43e+007X-3.27e+003,R2=0.9999)与峰面积积分值呈良好的线性关系;精密度试验RSD 为1.0%(n=6);重复性试验RSD 为0(n=6);回收率试验RSD 为1.7%。
【结论】该法测定安乃近注射液有关物质简便、快捷,稳定性好,重复性高,可用于控制安乃近注射液有关物质的质量。
关键词:HPLC;安乃近注射液;4-甲氨基安替比林;有关物质安乃近注射液为解热镇痛类药,用于肌肉痛、关节痛、偏头痛、风湿症等。
安乃近注射液现收载在《中国兽药典》2015年版一部上,标准中未对有关物质进行控制检测。
安乃近性质不稳定,光、热、酸、碱均可使其分解,主要降解产物为4-甲氨基安替比林。
国内企业大多采用4-甲氨基安替比林与羟基次甲基磺酸钠缩合的方法生产安乃近,由于由多步化学反应过程组成,每一步几乎都有副反应发生,最终产品可能积累了多种化学杂质。
《中国兽药典》2015年版一部安乃近原料药和安乃近片有关物质采用反相高效液相色谱法,色谱柱为C18,以磷酸盐缓冲液(磷酸二氢钠 6.0g,加水1000ml,加三乙胺1ml,用氢氧化钠溶液调节pH 值至7.0)-甲醇(75:25)为流动相,检测波长254nm。
蔡涛等人采用反相高效液相色谱法,色谱柱为C18,以磷酸盐缓冲液(磷酸二氢钠6.0g,加水1000ml,加三乙胺1ml,用氢氧化钠溶液调节pH 值至7.0)-甲醇(74:26)为流动相,检测波长为246nm,检测安乃近注射液中有关物质。
安乃近的性质实验报告

一、实验目的1. 了解安乃近的物理性质。
2. 掌握安乃近的化学性质。
3. 熟悉安乃近的鉴别方法。
二、实验原理安乃近,化学名称为N-(2-羟基乙基)安替比林,是一种常用的解热镇痛药。
本实验通过对安乃近的物理性质和化学性质的观察,以及与其他药物的鉴别,以了解安乃近的性质。
三、实验材料1. 安乃近片剂2. 水浴锅3. 试管4. 烧杯5. 玻璃棒6. 滴管7. 酒精8. 稀盐酸9. 氢氧化钠溶液10. 碘液11. 硫酸铜溶液12. 氯化钡溶液13. 碘化钾溶液14. 氯化铁溶液四、实验步骤1. 物理性质观察(1)外观:观察安乃近片剂的颜色、形状、大小。
(2)溶解性:将安乃近片剂溶解于水中,观察其溶解情况。
(3)熔点:将安乃近片剂放入水浴锅中,加热至熔化,记录熔点。
2. 化学性质观察(1)与酸反应:取一小块安乃近片剂,加入稀盐酸,观察其反应情况。
(2)与碱反应:取一小块安乃近片剂,加入氢氧化钠溶液,观察其反应情况。
(3)与碘反应:取一小块安乃近片剂,加入碘液,观察其反应情况。
(4)与硫酸铜反应:取一小块安乃近片剂,加入硫酸铜溶液,观察其反应情况。
(5)与氯化钡反应:取一小块安乃近片剂,加入氯化钡溶液,观察其反应情况。
(6)与碘化钾反应:取一小块安乃近片剂,加入碘化钾溶液,观察其反应情况。
(7)与氯化铁反应:取一小块安乃近片剂,加入氯化铁溶液,观察其反应情况。
3. 鉴别方法(1)与对乙酰氨基酚鉴别:取一小块安乃近片剂,加入酒精,观察其溶解情况。
与对乙酰氨基酚片剂进行对比。
(2)与阿司匹林鉴别:取一小块安乃近片剂,加入酒精,观察其溶解情况。
与阿司匹林片剂进行对比。
五、实验结果与分析1. 物理性质观察结果(1)外观:安乃近片剂为白色片状,形状规则,大小均匀。
(2)溶解性:安乃近片剂在水中溶解较快,溶解后溶液呈无色。
(3)熔点:安乃近片剂的熔点为156℃。
2. 化学性质观察结果(1)与酸反应:安乃近片剂与稀盐酸反应,产生气泡。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
鉴
别
1取本品约20mg,加稀盐酸1ml溶解后,加次氯酸钠试液2滴,产生瞬即消失的臭气。
检验结果:
2取本品约0.2g,加稀盐酸8ml溶解后,加热即发生二氧化硫的臭气,然后发生甲醛的臭气。
检验结果:
3本品的红外光吸收图谱应与对照的图谱一致。
检验结果:
4本品显钠盐的火焰反应。
检验结果:
检查
1取本品0.50g,加水50ml溶解后,依法检查,PH值应为6.0~7.0。
样品编号
内 容
1
2
样 品 取 量 Vs(g)
消耗滴定液体积V(ml)
计算公式:
V×M×T
X = ×100%
Vs×0.1×(1-干燥失重含量)
M=滴定液的摩尔浓度(mol/L) T=0.01667g/ml
按干燥品计,样品的含量X(%)
含 量 平 均 值(%)
A-B
相对偏差×100%
A+B
标准规定:按干燥品计算,含C13H16N3NaO4S不得少于99.0%(供注射用)。
干燥失重
天平室温度 ℃ 湿度 %
干燥条件
取本品,在105℃干燥至恒重,减失重量不得过5.5%。
检 品 号
1
2
称量瓶重W0(g)
瓶+药重W1(g)
干燥后瓶+药重W2(g)
计算公式
W1- W2
干燥失重=×100%
W1- W0
干燥失重(%)
平均值(%)
标准规定
减失重量不得过5.5%
项目结论:
检验人: 复核人:
有限公司
原辅料检验记录附页
文件编号: 00 第 2 页 共 3 页
含量测定:安乃近室温 ℃ 湿度 %
滴定液名称:碘滴定液标示浓度0.05mol/L 实际浓度 mol/L
主要
分析
仪器
名 称
型 号
精 度
狭缝宽度
测定用波长
编 号
分 析 天 平
0.0001
_______
_______
样品制备:
取本品约0.3g,精密称定,加乙醇与0.01mol/L盐酸溶液各10ml溶解后,立即用碘滴定液(0.05mol/L)滴定,至溶液所显的浅黄色在30秒钟内不褪。
检验项目 标准规定 检验结果 项目结论
(1)性状 应为白色或略带微黄色
结晶或结晶性粉末规定
(2)鉴别 1应呈正反应规定
2应成正反应规定
3应符合规定规定
4 应符合规定规定
(3)检查:
1、有关物质 应符合规定规定
2、干燥失重 不得过0.5%规定
(4)含量测定:
按干燥品计,
不得少于99.0%。规定
检验结论: 本品按<<安乃近内控质量标准>>检验,结果
有限公司
原辅料检验记录首页
文件编号: 00第 1 页 共 3 页
原辅料名称
安乃近
检验单号
批 号
供货单位
供货数量
请验部门
原辅料库
取样数量
取 样 人
规 格
送检日期
年 月 日
报告日期
年 月 日
检验依据
《安乃近内控质量标准》
性
状
本品应为白色或略带微黄色的结晶或结晶性粉末;无臭,味微苦;水溶液放置后渐变为黄色。
项目结论:
检验结论:本品按《安乃近内控质量标准》检验,结果规定。
备注
复核人: 检验人:
有限公司
原辅料检验记录报告单
文件编号: 00 第 3 页 共 3 页
原辅料名称
安乃近
检验单号
批 号
供货单位
供货数量
请验单位
原辅料库
取样数量取 Biblioteka 人规 格送检日期
年 月 日
报告日期
年 月 日
检验依据
<<安乃近内控质量标准>>
规定。
备注:
负责人: 复核人: 检验人:
检验结果:
2 取本品2.5g(供注射用),加水10ml使溶解,俟气泡消失,立即检视,应澄清无色;如显色应与同体积的对照溶液比较,不得更深。 检验结果:
3 取本品0.50g,加甲醇10ml,震摇使溶解,如显浑浊,立即与对照溶液比较,不得更浓(供注射用) 检验结果:
4 取本品0.20g,依法检查,与标准硫酸钠溶液2.0ml制成的对照液比较,不得更浓(0.1%) 检验结果:
