酸性强弱
常见酸的酸性强弱排序

常见酸的酸性强弱排序
强酸:
HClO4(高氯酸)>HI(碘化氢)>HBr(氢溴酸)>HCl(盐酸)>HNO3(硝酸)>H2SeO4(硒酸)>H2SO4(硫酸)>HClO39(氯酸)>中强酸:
H2C2O4(草酸)>H2SO3(亚硫酸)>H3PO4(磷酸或正磷酸)>CH3COCOOH (丙酮酸)>HNO2(亚硝酸)>HF(氢氟酸)>HCOOH>(甲酸)>弱酸:
C3H6O3(乳酸)>C6H5COOH( 苯甲酸)>CH2=CH-COOH( 丙烯酸)>CH3COOH(乙酸)>C2H5COOH(丙酸)>C17H33COOH(油酸)>C17H35COOH(硬脂酸)>H2CO3(碳酸)>H2S(硫化氢,水溶液氢硫酸)>HClO(次氯酸)>H3BO3(硼酸)>H2SiO3(硅酸)>C6H5OH (苯酚)
酸性常用该酸的标准溶液(I=0,温度25摄氏度,1标压,C=1.0 mol/L)的PKa表示,即酸度常数。
在弱酸中,应依照酸的解离常数来判断。
(数值越小酸性越强)
HIO3 0.31 H2S2O3 0.6 H4P2O7 0.7 H2CrO4 0.74 HSCN 0.9 H3PO2 1.23 H3PO3 1.43 H2SO3 1.91 HClO2 1.95 H3PO4 2.18 H3AsO4 2.21 HNO2 3.15 HF 3.17 HCNO 3.48 H2CO3 6.35 H2S 7.02 HClO 7.53 HBrO 8.63 HCN 9.21 H3BO3 9.24 H3AsO3 9.29。
20种弱酸酸性强弱顺序口诀

20种弱酸酸性强弱顺序口诀
来讲讲酸弱酸强的顺序,你要把它清楚搞懂,一定能帮你考物理
课考试分数拿高分。
碳酸氢铵、甲硫酸、氢硫酸、氢硝酸、丙酸弱,硫酸、磷酸、盐酸、氨强氧化物、硫酸氢钠都稍强;丁硫酸、乙醇酸、草酸、乙硫酸、异丁酸稍弱,丙硫酸、氯酸、柠檬酸、磷酸氢三钠强一点;最后是乙酸、醋酸、氢氟酸、硝酸及硫酸铁,酸的弱强没有悬念!
不论是室内有有关酸的化学实验,还是室外课堂中研究相关物质
的化学反应,都有可能要用到酸弱酸强的排序规律。
因此,为了更好
地完成这些化学实验或者科学研究,我们有必要对来讲讲酸弱酸强的
顺序作出认识。
首先,我们需要把酸的弱强排序比清楚,碳酸氢铵、甲硫酸、氢
硫酸、氢硝酸、丙酸弱,硫酸、磷酸、盐酸、氨强氧化物、硫酸氢钠
都稍强;丁硫酸、乙醇酸、草酸、乙硫酸、异丁酸稍弱,丙硫酸、氯酸、柠檬酸、磷酸氢三钠强一点;最后是乙酸、醋酸、氢氟酸、硝酸
及硫酸铁,我们必须把它记在心中,不要搞混顺序。
其次,针对酸的弱强排序,我们在实验中,可以利用酸的弱强排序,来比较研究不同强度的酸的反应效率。
用相同浓度的酸,对比研
究弱酸和强酸对材料的影响,可以得出比较准确的实验结果。
最后,我们也可以利用熔点的变化来验证酸的弱强排序,将某一
酸的溶解度分别加入到具备相同浓度的强酸和弱酸中,比较两种混合
物的温度变化,进而比较出具备不同强度的酸。
总之,来讲讲酸弱酸强的顺序,对于我们掌握物理实验,尤其是
实验中涉及到有关酸的化学反应,都是十分必要的。
只要把它记住,
能够让我们完成有关实验和研究工作。
常见酸的酸性强弱的比较

常见酸的酸性强弱的比较文档编制序号:[KK8UY-LL9IO69-TTO6M3-MTOL89-FTT688]常见酸的酸性强弱的比较含氧酸的酸性强弱的判据:①不同元素的最高价含氧酸,成酸元素的非金属性越强,则酸性越强。
如非金属性Cl>S>P>C>Si 则酸性:HClO 4>H 2SO 4>H 3PO 4>H 2CO 3>H 2SiO 3②同种元素的不同价态含氧酸,元素的化合价越高,酸性越强。
如酸性HClO 4>HClO 3>HClO 2>HClO ,H 2SO 4>H 2SO 3,HNO 3>HNO 2,H 3PO 4>H 3PO 3>H 3PO 2 无氧酸(气态氢化物的水溶液)酸性强弱的判据:①同一主族元素,核电荷数越多,原子半径越大,氢化物酸性越强,如酸性:HI>HBr>HCl>HF(弱酸)②非同一主族元素的无氧酸酸性,需靠记忆。
如酸性:HCl>HF>H 2S 由反应方向判据:酸A+盐B→盐A’+酸B’ 则酸性 A>B’如:CO 2+2H 2O+NaBO 2=H 3BO 3+NaHCO 3,H 3BO 3+Na 2CO 3=NaBO 2+NaHCO 3+H 2O , 则酸性:H 2CO 3>H 3BO 3>HCO 3- 由R-O-H 模型来判据:R 元素的价态越来越高,半径越小,则R-OH 的酸性越强,R 元素的价态越低,半径越大,则R-O-H 的碱性越强,如第三周期元素的最高价氧化物对应水化物:NaOH 、Mg(OH)2、Al(OH)3、H 2SiO 3、H 3PO4、H 2SO 4、HClO 4。
自左至右,碱性减弱,酸性增强。
由电子效应来比较:羧酸酸性强弱跟烃基和羧基的相互影响有一定的关系,这种相互影响常用诱导效应来加以解释。
且有Cl 3CCOOH>CHCl 2COOH>CH 2ClCOOH>CH 3COOH碱的碱性强弱的比较总原则:根据碱的电离常数的大小:碱的电离常数越大,该碱的碱性越强。
常见酸的酸性强弱的比较

常见酸的酸性强弱的比较首先要看你是哪种酸碱理论如果是电离理论..则Ka越大;越易电离;酸性越强..如果是质子理论..则越容易给出质子;酸性越强含氧酸的酸性强弱的判据:在有氧酸根中;主元素的非金属性越强;与氧的结合能力就越强;于是与氢之间的键的键能就越小;氢就越容易游离出来..①不同元素的最高价含氧酸;成酸元素的非金属性越强;则酸性越强..如非金属性Cl>S>P>C>Si则酸性:HClO4>H2SO4>H3PO4>H2CO3>H2SiO3②同种元素的不同价态含氧酸;元素的化合价越高;酸性越强..有些高价酸在通常情况下氧化性强于酸性;就是说通常这些酸都显氧化性而不显酸性;比如高锰酸和高氯酸..在书写方程式的时候要注意不要忽略了酸的强氧化性..酸性HClO4>HClO3>HClO2>HClO氧化性HClO>HClO2>HClO3>HClO4H2SO4>H2SO3;HNO3>HNO2;H3PO4>H3PO3>H3PO2无氧酸气态氢化物的水溶液酸性强弱的判据:对于无氧酸来说;在元素周期表中;卤素的无氧酸是同周期中最强的;例如HCl>H2S..在氢硫酸溶液里;硫化氢分子内存在着氢键;这个氢键使硫化氢的结构更加稳定;所以氢在水中更加不容易电离出来;所以硫化氢的酸性弱于盐酸的酸性..①同一主族元素;核电荷数越多;原子半径越大;氢化物酸性越强..如酸性:HI>HBr>HCl>HF弱酸②非同一主族元素的无氧酸酸性;需靠记忆..如酸性:HCl>HF>H2S由反应方向判据:酸A+盐B→盐A’+酸B’则酸性A>B’如:CO2+2H2O+NaBO2=H3BO3+NaHCO3;H3BO3+Na2CO3=NaBO2+NaHCO3+H2O;则酸性:H2CO3>H3BO3>HCO3-由R-O-H模型来判据:R元素的价态越来越高;半径越小;则R-OH的酸性越强;R元素的价态越低;半径越大;则R-O-H的碱性越强;如第三周期元素的最高价氧化物对应水化物:NaOH、MgOH2、AlOH3、H2SiO3、H3PO4、H2SO4、HClO4..自左至右;碱性减弱;酸性增强..由电子效应来比较:羧酸酸性强弱跟烃基和羧基的相互影响有一定的关系;这种相互影响常用诱导效应诱导效应是指在有机分子中引入一原子或基团后;使分子中成键电子云密度分布发生变化;从而使化学键发生极化的现象;称为诱导效应..来加以解释..且有Cl3CCOOH>CHCl2COOH>CH2ClCOOH>CH3COOH有机酸的酸性:一般来说;分子量越大的酸酸性越弱..因为在有机酸中;酸显酸性是因为有羧基的存在..如果酸的原子量很大;与羧几相连的碳与羧基中的氧的碳氧键就越弱;相应的氧氢键就越强;所以氢就越不容易游离出来..HClO4高氯酸>HI氢碘酸>HBr氢溴酸>HCl盐酸>H2SO4硫酸>HNO3硝酸>HClO3氯酸以上为强酸>H2C2O4草酸>H2SO3亚硫酸>H3PO4磷酸>CH3COCOOH丙酮酸>HNO2亚硝酸>HF氢氟酸>HCOOH甲酸以上为中强酸>C3H6O3乳酸>C6H5COOH苯甲酸>CH2=CH-COOH丙烯酸>CH3COOH醋酸>C2H5COOH丙酸>C17H33COOH油酸>C17H35COOH硬脂酸>H2O·CO2即H2CO3碳酸>H2S氢硫酸>HClO次氯酸>H3BO3硼酸>H2SiO3偏硅酸>C6H5OH苯酚酸性常用该酸的标准溶液I=0;温度25摄氏度;1标压;C=1.0mol/L的PKa表示;即酸度常数..在弱酸中;应依照酸的解离常数来判断..数值越小酸性越强HIO3碘酸0.31H2S2O3硫代硫酸0.6H4P2O7焦磷酸0.7H2CrO4铬酸0.74HSCN硫氰酸0.9H3PO2次磷酸1.23H3PO3亚磷酸1.43H2SO3亚硫酸1.91HClO2亚氯酸1.95 H3PO4磷酸2.18H3AsO4砷酸2.21HNO2亚硝酸3.15HF氢氟酸3.15HCNO异氰酸3.48H2CO3碳酸3.60H2S氢硫酸7.02HClO次氯酸7.53HBrO次溴酸8.63HCN氢氰酸9.21H3BO3硼酸9.24H3AsO3亚砷酸9.29H2SiO3偏硅酸9.77HIO次碘酸10.64H2O2过氧化氢11.65HAlO2偏铝酸12.2碱的碱性强弱的比较总原则:根据碱的电离常数的大小:碱的电离常数越大;该碱的碱性越强..推论:金属阳离子的水解常数越大;由该金属原子在该价态组成的氢氧化物的碱性越弱..1、金属元素的电负性越小;该金属的最高价氧化物对应的水化物即氢氧化物的碱性越强..A一般金属活动性越大即金属活动性顺序表中排位越靠前;该金属的最高价氧化物对应的水化物即氢氧化物的碱性越强..B元素周期表中;同周期的金属{主族}元素随着原子序数的递增;该金属的最高价氧化物对应的水化物即氢氧化物的碱性越弱;同周期的金属{副族}元素随着原子序数的递增;该金属的最高价氧化物对应的水化物即氢氧化物的碱性越弱;同周期的金属主族与副族元素之间不能应用此规律..C元素周期表中;同族的金属{主族}元素随着原子序数的递增;该金属的最高价氧化物对应的水化物即氢氧化物的碱性越强;一般同族的金属{副族}元素随着原子序数的递增;该金属的最高价氧化物对应的水化物即氢氧化物的碱性越弱..2、同种金属元素不同价态的氧化物对应的水化物即氢氧化物的碱性的判断方法可根据盐类水解的规律:盐中有弱酸或碱根就水解;越弱越水解;水解产物越稳定;判断而得:同种金属元素低价态的氧化物对应的水化物即氢氧化物的碱性比其高价态的氧化物对应的水化物即氢氧化物的碱性..其实氧化物对应水化物的酸碱性可用离子键理论解释R离子和氢离子中;谁对氧离子的吸引力若;就在谁处电离;在A处电离;该氢氧化物显碱性;在B处电离;该氢氧化物显酸性..随着同主族的R的原子序数的增大;R的半径也递增;对氧离子的引力自然减弱;越显碱性如:碱性:LiOH<NaOH<KOH<RbOH<CsOH;同样;随着同周期的R的原子序数的增大;R的半径减小;对氧离子的引力增强;越显酸性如:碱性:NaOH>MgOH2>AlOH3碱可以分为可溶性和不可溶性;常见的可溶的强碱有常见的不可溶的弱碱有括号里写上颜色。
常见酸的酸性强弱的比较

常见酸的酸性强弱的比较含氧酸的酸性强弱的判据:①不同元素的最高价含氧酸,成酸元素的非金属性越强,则酸性越强。
如非金属性Cl>S>P>C>Si则酸性:HClO4>H2SO4>H3PO4>H2CO3>H2SiO3②同种元素的不同价态含氧酸,元素的化合价越高,酸性越强。
如酸性HClO4>HClO3>HClO2>HClO,H2SO4>H2SO3,HNO3>HNO2,H3PO4>H3PO3>H3PO2无氧酸(气态氢化物的水溶液)酸性强弱的判据:①同一主族元素,核电荷数越多,原子半径越大,氢化物酸性越强,如酸性:HI>HBr>HCl>HF(弱酸)②非同一主族元素的无氧酸酸性,需靠记忆。
如酸性:HCl>HF>H2S由反应方向判据:酸A+盐B→盐A’+酸B’则酸性A>B’如:CO2+2H2O+NaBO2=H3BO3+NaHCO3,H3BO3+Na2CO3=NaBO2+NaHCO3+H2O,则酸性:H2CO3>H3BO3>HCO3-由R-O-H模型来判据:R元素的价态越来越高,半径越小,则R-OH的酸性越强,R元素的价态越低,半径越大,则R-O-H的碱性越强,如第三周期元素的最高价氧化物对应水化物:NaOH、Mg(OH)2、Al(OH)3、H2SiO3、H3PO4、H2SO4、HClO4。
自左至右,碱性减弱,酸性增强。
由电子效应来比较:羧酸酸性强弱跟烃基和羧基的相互影响有一定的关系,这种相互影响常用诱导效应来加以解释。
且有Cl3CCOOH>CHCl2COOH>CH2ClCOOH>CH3COOH碱的碱性强弱的比较总原则:根据碱的电离常数的大小:碱的电离常数越大,该碱的碱性越强。
推论:金属阳离子的水解常数越大,由该金属原子在该价态组成的氢氧化物的碱性越弱。
1、金属元素的电负性越小,该金属的最高价氧化物对应的水化物(即氢氧化物)的碱性越强。
强酸、弱酸常见的七种判断方法
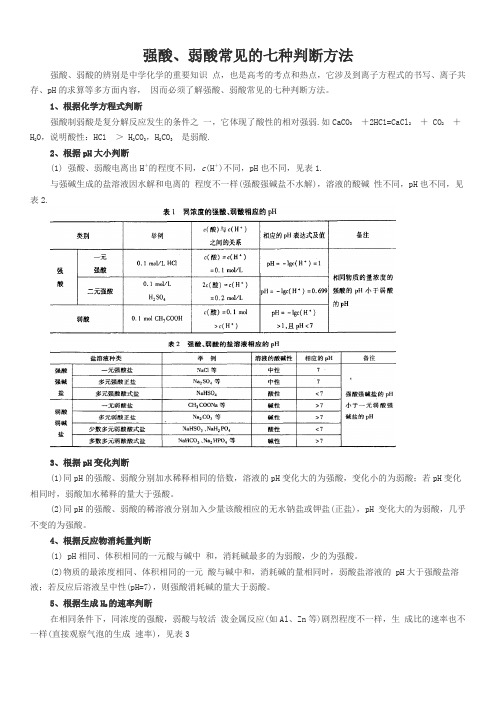
强酸、弱酸常见的七种判断方法强酸、弱酸的辨别是中学化学的重要知识点,也是高考的考点和热点,它涉及到离子方程式的书写、离子共存、pH的求算等多方面内容,因而必须了解强酸、弱酸常见的七种判断方法。
1、根据化学方程式判断强酸制弱酸是复分解反应发生的条件之一,它体现了酸性的相对强弱.如CaCO3+2HC l=CaCl2+ CO2+H2O,说明酸性:HC l> H2CO3,H2CO3是弱酸.2、根据pH大小判断(1) 强酸、弱酸电离出H+的程度不同,c(H+)不同,pH也不同,见表1.与强碱生成的盐溶液因水解和电离的程度不一样(强酸强碱盐不水解),溶液的酸碱性不同,pH也不同,见表2.3、根据pH变化判断(1)同pH的强酸、弱酸分别加水稀释相同的倍数,溶液的pH变化大的为强酸,变化小的为弱酸;若pH变化相同时,弱酸加水稀释的量大于强酸。
(2)同pH的强酸、弱酸的稀溶液分别加入少量该酸相应的无水钠盐或钾盐(正盐),pH 变化大的为弱酸,几乎不变的为强酸。
4、根据反应物消耗量判断(1) pH相同、体积相同的一元酸与碱中和,消耗碱最多的为弱酸,少的为强酸。
(2)物质的最浓度相同、体积相同的一元酸与碱中和,消耗碱的量相同时,弱酸盐溶液的 pH大于强酸盐溶液;若反应后溶液呈中性(pH=7),则强酸消耗碱的量大于弱酸。
5、根据生成H2的速率判断在相同条件下,同浓度的强酸,弱酸与较活泼金属反应(如Al、Zn等)剧烈程度不一样,生成比的速率也不一样(直接观察气泡的生成速率),见表36、根据导电性强弱判断同温度、同物质的量浓度强酸、弱酸溶液,电离出自由移动离子浓度不同(强酸是完全电离,弱酸是部分电离),溶液的导电性也不同,强酸溶液的导电性强于弱酸溶液(可以用电流计测出)。
7、根据中和热大小判断相同条件下,绝大多数弱酸电离时需要吸收大量的热量,因此与强碱中和释放出的热量 (又称中和热)小于强酸(可以用量热计测出)_ 如1 L0. 1 mol/L HC l与CH3COOH稀溶液与同浓度的NaOH溶液中和,测得HC l的中和热所放出的热量为57. 3 KJ/mol,CH3COOH的中和热所放出的热量为56.0 KJ/mol。
常见酸酸性强弱比较

常有酸的酸性强弱的比较含氧酸的酸性强弱的判据:①不一样元素的最高价含氧酸,成酸元素的非金属性越强,则酸性越强。
如非金属性Cl>S>P>C>Si则酸性:HClO4>H2SO4>H3PO4>H2CO3>H2SiO3②同种元素的不一样价态含氧酸,元素的化合价越高,酸性越强。
如酸性HClO4>HClO3>HClO2>HClO,H2SO4>H2SO3,HNO3>HNO2,H3PO4>H3PO3>H3PO2无氧酸(气态氢化物的水溶液)酸性强弱的判据:①同一主族元素,核电荷数越多,原子半径越大,氢化物酸性越强,如酸性:HI>HBr>HCl>HF(弱酸)②非同一主族元素的无氧酸酸性,需靠记忆。
如酸性:HCl>HF>H2S由反响方向判据:酸A+盐B→盐A’+酸B’则酸性A>B’如:CO2+2HO+NaBO2=H3BO3+NaHCO3,H3BO3+Na2CO3=NaBO2+NaHCO3+H2O,则酸性:H2CO3>H3BO3>HCO3-由R-O-H模型来判据:R元素的价态愈来愈高,半径越小,则R-OH的酸性越强,R元素的价态越低,半径越大,则R-O-H的碱性越强,如第三周期元素的最高价氧化物对应水化物:NaOH、Mg(OH)2、Al(OH)3、H2SiO3、H3PO4、H2SO4、HClO4。
自左至右,碱性减弱,酸性加强。
由电子效应来比较:羧酸酸性强弱跟烃基和羧基的互相影响有必定的关系,这类互相影响常用引诱效应来加以解说。
且有Cl3CCOOH>CH2C lOOH>CH2ClCOOH>CH3COOH碱的碱性强弱的比较总原则:依据碱的电离常数的大小:碱的电离常数越大,该碱的碱性越强。
推论:金属阳离子的水解常数越大,由该金属原子在该价态构成的氢氧化物的碱性越弱。
1、金属元素的电负性越小,该金属的最高价氧化物对应的水化物(即氢氧化物)的碱性越强。
高中化学酸性强弱顺序

高中化学酸性强弱顺序酸性强弱顺序是高中化学中重要的基础知识之一,它对于理解酸碱反应、物质性质等问题具有重要意义。
在化学反应中,了解各种酸的强弱顺序可以帮助我们更好地预测反应结果,合理应用化学知识。
一、强酸和弱酸的区分在化学中,酸的强度取决于其在水溶液中的电离程度。
强酸是指在水中完全电离的酸,其水溶液中存在大量的H+离子;而弱酸是指在水中只部分电离的酸,其水溶液中H+离子的浓度较低。
通常,我们可以通过实验测定酸溶液的电导率、酸解离度等来判断其强弱程度。
二、酸性强弱顺序的排列1. 强酸:盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)等。
这些酸在水中完全离解,产生大量氢离子,具有强酸的性质,通常呈强酸性。
2. 弱酸:乙酸(CH3COOH)、碳酸(H2CO3)等。
这些酸在水中只能部分离解,生成的氢离子浓度较低,呈弱酸性。
3. 有机酸:柠檬酸、草酸等。
有机酸是一类含有羧基的有机化合物,其酸性较弱,常常用作食品添加剂和药物原料。
4. 稀硫酸:稀硫酸(H2SO4)比浓硫酸(H2SO4)弱。
在浓硫酸的酸性中,硫酸根离子的作用大于氢离子,使其呈现较弱的酸性。
5. 有机酸盐:乙酸盐、柠檬酸盐等。
部分有机酸的盐也具有一定的酸性,但通常比相应的无机酸弱。
三、酸性强弱顺序的应用1. 化学反应:在化学反应中,酸的强弱决定了其参与反应的活性和方向性。
强酸通常具有更强的腐蚀性和反应性,可以与碱、碱式氧化物等产生中和反应,生成盐和水;弱酸在一些反应中需要加热或者加入催化剂才能发生反应。
2. 工业应用:在工业生产中,我们需要根据酸性强弱顺序选择适当的酸来完成特定反应。
比如,硫酸多用于金属电镀、清洗等工艺中,而乙酸常用于食品添加剂、溶剂等领域。
3. 环境保护:了解酸性强弱顺序也有助于我们对环境污染的认识和治理。
一些强酸的排放会对大气、水体造成污染,影响生态平衡和人类健康。
总的来说,酸性强弱顺序是高中化学中的基础知识,我们应该通过实验、探究等方式深入理解,为今后的学习和工作打下坚实基础。
常见酸的酸性强弱的比较

常见酸的酸性强弱的比较TYYGROUP system office room 【TYYUA16H-TYY-TYYYUA8Q8-常见酸的酸性强弱的比较首先要看你是哪种酸碱理论如果是电离理论。
则Ka越大,越易电离,酸性越强。
如果是质子理论。
则越容易给出质子,酸性越强含氧酸的酸性强弱的判据:在有氧酸根中,主元素的非金属性越强,与氧的结合能力就越强,于是与氢之间的键的键能就越小,氢就越容易游离出来。
①不同元素的最高价含氧酸,成酸元素的非金属性越强,则酸性越强。
如非金属性Cl>S>P>C>Si则酸性:HClO4>H2SO4>H3PO4>H2CO3>H2SiO3②同种元素的不同价态含氧酸,元素的化合价越高,酸性越强。
有些高价酸在通常情况下氧化性强于酸性,就是说通常这些酸都显氧化性而不显酸性,比如高锰酸和高氯酸。
在书写方程式的时候要注意不要忽略了酸的强氧化性。
酸性HClO4>HClO3>HClO2>HClO(氧化性HClO>HClO2>HClO3>HClO4)H2SO4>H2SO3,HNO3>HNO2,H3PO4>H3PO3>H3PO2无氧酸(气态氢化物的水溶液)酸性强弱的判据:对于无氧酸来说,在元素周期表中,卤素的无氧酸是同周期中最强的,例如HCl > H2S。
在氢硫酸溶液里,硫化氢分子内存在着氢键,这个氢键使硫化氢的结构更加稳定,所以氢在水中更加不容易电离出来,所以硫化氢的酸性弱于盐酸的酸性。
①同一主族元素,核电荷数越多,原子半径越大,氢化物酸性越强。
如酸性:HI>HBr>HCl>HF(弱酸)②非同一主族元素的无氧酸酸性,需靠记忆。
如酸性:HCl>HF>H2S由反应方向判据:酸A+盐B→盐A’+酸B’则酸性 A>B’如:CO2+2H2O+NaBO2=H3BO3+NaHCO3,H3BO3+Na2CO3=NaBO2+NaHCO3+H2O,则酸性:H2CO3>H3BO3>HCO3-由R-O-H模型来判据:R元素的价态越来越高,半径越小,则R-OH的酸性越强,R元素的价态越低,半径越大,则R-O-H的碱性越强,如第三周期元素的最高价氧化物对应水化物:NaOH、Mg(OH)2、Al(OH)3、H2SiO3、H3PO4、H2SO4、HClO4。
如何判断酸性强弱

强酸弱酸怎么判断
可以从PH、氢离子浓度、复分解反应等判断强酸弱酸。
1、区别强酸弱酸的方法,看氢离子浓度。
强酸在水溶液中会完全电离,这是区别于中强酸和弱酸的最大不同。
2、利用复分解反应的原理只能用强酸制弱酸而不能用弱酸制强酸,即反应物中的酸酸性强于生,成物中酸的酸性(复分解反应中)。
利用元素周期表的规律,非金属性越强的元素,对应的最高价含氧酸酸性越强,F没有对应的含氧酸,最强的酸是高氯酸(HC104) 。
3、相同PH的强酸与弱酸的区别: PH值指的是已经电离出来的氢离子浓度强酸是完全电离,弱酸是部分电离,所以相同体积同PH值时弱酸的物质的量浓度要远大于强酸(同元酸比较),和碱反应弱酸里的氢离子浓度减小,所以平衡朝着氢离子增大的方向移动。
常见强酸:高氯酸、硫酸、硝酸、盐酸;中强酸:磷酸;弱酸:亚硫酸、碳酸等。
酸性强弱

酸性强弱HClO4(高氯酸)>HI(氢碘酸)>HBr(氢溴酸)>HCl(盐酸)>H2SO4(硫酸)>HNO3(硝酸)>HClO3(氯酸)(以上为强酸)>H2C2O4(草酸)>H2SO3(亚硫酸)>H3PO4(磷酸)>CH3COCOOH(丙酮酸)>HNO2(亚硝酸)>HF(氢氟酸)>HCOOH(甲酸)>(以上为中强酸)C3H6O3(乳酸)>C6H5COOH(苯甲酸)>CH2=CH-COOH(丙烯酸)>CH3COOH(醋酸)>C2H5COOH(丙酸)>C17H33COOH(油酸)>C17H35COOH(硬脂酸)>H2O·CO2(即H2CO3)(碳酸)>H2S(氢硫酸)>HClO(次氯酸)>H3BO3(硼酸)>H2SiO3(偏硅酸)>C6H5OH(苯酚)高氯氢碘氢溴氢氯酸,硫酸硝酸绿酸酸;草酸亚硫磷丙烯,亚硝氢氟甲中酸;乳酸苯甲丙烯酸,乙(醋)酸丙酸油硬脂,碳酸氢硫次氯酸,硼酸偏硅苯酚弱。
酸性常用该酸的标准溶液(I=0,温度25摄氏度,1标压,C=1.0 mol/L)的PKa表示,即酸度常数。
在弱酸中,应依照酸的解离常数来判断。
(数值越小酸性越强)HIO3(碘酸)0.31 H2S2O3(硫代硫酸)0.6 H4P2O7 (焦磷酸)0.7 H2CrO4(铬酸)0.74 HSCN (硫氰酸)0.9H3PO2(次磷酸)1.23 H3PO3(亚磷酸)1.43 H2SO3(亚硫酸)1.91 HClO2(亚氯酸)1.95H3PO4(磷酸)2.18 H3AsO4(砷酸)2.21 HNO2(亚硝酸)3.15 HF(氢氟酸)3.15 HCNO(异氰酸)3.48H2CO3(碳酸)3.60 H2S(氢硫酸)7.02 HClO(次氯酸)7.53 HBrO (次溴酸)8.63HCN (氢氰酸)9.21 H3BO3(硼酸)9.24 H3AsO3(亚砷酸)9.29 H2SiO3(偏硅酸)9.77HIO (次碘酸)10.64 HAlO2(偏铝酸)12.2碱的排序为:CsOH > R b OH > KOH > NaOH > Ba(OH)2 > LiOH > Sr(OH)2 > Ca(OH)2 (以上均为强碱)> Mg(OH)2> AgOH(相当于Ag2O的悬浊液) (以上为中强碱)> NH3.H2O (NH4OH)> Fe(OH)2> Cu(OH)2> Fe(OH)3> Al(OH)3(明显的两性,碱性很弱了)。
酸性强弱

强酸:H2SO4,HCl,HBr,HI,HNO3,HClO4。
中强酸:HNO2,H3PO4。
也有时会把HNO2归为弱酸。
弱酸:HClO,H2S,H2CO3,CH3COOH,H2SiO3,H4SiO4。
酸性强酸>中强酸>弱酸强酸中:高氯酸HClO4是无机酸中最强的酸。
但在浓溶液中,HClO4以分子形式存在(这点类似于浓硫酸)。
酸性HCl<HBr<HI,HF还更小,是弱酸。
这是因为从F到I,卤原子半径逐渐增大,对氢原子的吸引力逐渐减小,因而更容易失去氢原子,酸性就更强了。
一般不会拿H2SO4,HNO3来比酸性,因为有浓稀之别,还会自身氧化还原什么的,太复杂了。
只要知道它们都是强酸就好。
中强酸中:中学阶段要求掌握的中强酸只有两个:亚硫酸H2SO3和磷酸H3PO4。
HNO2不要求掌握。
有时归为中强酸有时归为弱酸。
很不稳定,逐渐分解为NO和HNO3。
弱酸中:你举的这些弱酸,CH3COOH是最强的,H2CO3是第二强的了。
(汗..天天说某某酸是“比碳酸还弱的酸”,其实碳酸在弱酸中还是蛮强的嘛)H2SiO3,H4SiO4可以说是同一种物质了。
前者加上水就是后者。
而且往往H4SiO4不稳定,极易分解为H2SiO3和水。
酸性大小比较:CH3COOH>H2CO3>H2S>H2SiO3,CH3COOH>H2CO3>H2S>HClO。
H2SiO3与HClO的酸性不好比较了,也没有什么意义。
反正都很弱。
值得注意的是,“酸性”一定是指溶液而言。
比如H2S气体、冰醋酸(CH3COOH晶体)、硅酸胶体等等,就无“酸性”可言。
HCl<HBr<HI这个关系也必须在溶液中才有意义。
82回答者:重铸轩。
酸的强度排序

常见酸的酸性强弱排序强酸:HClO4(高氯酸)>HI(碘化氢)>HBr(氢溴酸)>HCl(盐酸)>HNO3(硝酸)>H2SeO4(硒酸)>H2SO4(硫酸)>HClO39(氯酸)> 中强酸:H2C2O4(草酸)>H2SO3(亚硫酸)>H3PO4(磷酸或正磷酸)>CH3COCOOH (丙酮酸)>HNO2(亚硝酸)>HF(氢氟酸)>HCOOH>(甲酸)> 弱酸:C3H6O3(乳酸)>C6H5COOH( 苯甲酸)>CH2=CH-COOH( 丙烯酸)>CH3COOH(乙酸)>C2H5COOH(丙酸)>C17H33COOH(油酸)>C17H35COOH(硬脂酸)>H2CO3(碳酸)>H2S(硫化氢,水溶液氢硫酸)>HClO(次氯酸)>H3BO3(硼酸)>H2SiO3(硅酸)>C6H5OH (苯酚)酸性常用该酸的标准溶液(I=0,温度25摄氏度,1标压,C=1.0 mol/L)的PKa表示,即酸度常数。
在弱酸中,应依照酸的解离常数来判断。
(数值越小酸性越强)HIO3 0.31 H2S2O3 0.6 H4P2O7 0.7 H2CrO4 0.74 HSCN 0.9 H3PO2 1.23 H3PO3 1.43 H2SO3 1.91 HClO2 1.95 H3PO4 2.18 H3AsO4 2.21 HNO2 3.15 HF 3.17 HCNO 3.48 H2CO3 6.35 H2S 7.02 HClO 7.53 HBrO 8.63 HCN 9.21 H3BO3 9.24 H3AsO3 9.29 H2SiO3 9.77 HIO 10.64 H2O2 11.65 HAlO2 12.2。
常见酸的酸性强弱的比较

常见酸的酸性强弱的比较首先要看你是哪种酸碱理论如果是电离理论。
则Ka越大,越易电离,酸性越强。
如果是质子理论。
则越容易给出质子,酸性越强含氧酸的酸性强弱的判据:在有氧酸根中,主元素的非金属性越强,与氧的结合能力就越强,于是与氢之间的键的键能就越小,氢就越容易游离出来。
①不同元素的最高价含氧酸,成酸元素的非金属性越强,则酸性越强。
如非金属性Cl>S>P>C>Si则酸性:HClO4>H2SO4>H3PO4>H2CO3>H2SiO3②同种元素的不同价态含氧酸,元素的化合价越高,酸性越强。
有些高价酸在通常情况下氧化性强于酸性,就是说通常这些酸都显氧化性而不显酸性,比如高锰酸和高氯酸。
在书写方程式的时候要注意不要忽略了酸的强氧化性。
酸性HClO4>HClO3>HClO2>HClO(氧化性HClO>HClO2>HClO3>HClO4)H2SO4>H2SO3,HNO3>HNO2,H3PO4>H3PO3>H3PO2无氧酸(气态氢化物的水溶液)酸性强弱的判据:对于无氧酸来说,在元素周期表中,卤素的无氧酸是同周期中最强的,例如HCl>H2S。
在氢硫酸溶液里,硫化氢分子内存在着氢键,这个氢键使硫化氢的结构更加稳定,所以氢在水中更加不容易电离出来,所以硫化氢的酸性弱于盐酸的酸性。
①同一主族元素,核电荷数越多,原子半径越大,氢化物酸性越强。
如酸性:HI>HBr>HCl>HF(弱酸)②非同一主族元素的无氧酸酸性,需靠记忆。
如酸性:HCl>HF>H2S由反应方向判据:酸A+盐B→盐A’+酸B’则酸性A>B’如:CO2+2H2O+NaBO2=H3BO3+NaHCO3,H3BO3+Na2CO3=NaBO2+NaHCO3+H2O,则酸性:H2CO3>H3BO3>HCO3-由R-O-H模型来判据:R元素的价态越来越高,半径越小,则R-OH的酸性越强,R元素的价态越低,半径越大,则R-O-H的碱性越强,如第三周期元素的最高价氧化物对应水化物:NaOH、Mg(OH)2、Al(OH)3、H2SiO3、H3PO4、H2SO4、HClO4。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
For personal use only in study and research; not for commercial use
酸性强弱
HClO4(高氯酸)>HI(氢碘酸)>HBr(氢溴酸)>HCl(盐酸)>H2SO4(硫酸)>HNO3(硝酸)>HClO3(氯酸)(以上为强酸)
>H2C2O4(草酸)>H2SO3(亚硫酸)>H3PO4(磷酸)>CH3COCOOH(丙酮酸)>HNO2(亚硝酸)>HF(氢氟酸)>HCOOH(甲酸)>(以上为中强酸)
C3H6O3(乳酸)>C6H5COOH(苯甲酸)>CH2=CH-COOH(丙烯酸)>CH3COOH(醋酸)>C2H5COOH(丙酸)>C17H33COOH(油酸)>C17H35COOH(硬脂酸)>H2O·CO2(即H2CO3)(碳酸)>H2S(氢硫酸)>HClO(次氯酸)>H3BO3(硼酸)>H2SiO3(偏硅酸)>C6H5OH(苯酚)
高氯氢碘氢溴氢氯酸,硫酸硝酸绿酸酸;草酸亚硫磷丙烯,亚硝氢氟甲中酸;
乳酸苯甲丙烯酸,乙(醋)酸丙酸油硬脂,碳酸氢硫次氯酸,硼酸偏硅苯酚弱。
酸性常用该酸的标准溶液(I=0,温度25摄氏度,1标压,C=1.0 mol/L)的PKa表示,即酸度常数。
在弱酸中,应依照酸的解离常数来判断。
(数值越小酸性越强)
HIO3(碘酸)0.31 H2S2O3(硫代硫酸)0.6 H4P2O7 (焦磷酸)0.7 H2CrO4(铬酸)0.74 HSCN (硫氰酸)0.9
H3PO2(次磷酸)1.23 H3PO3(亚磷酸)1.43 H2SO3(亚硫酸)1.91 HClO2(亚氯酸)1.95
H3PO4(磷酸)2.18 H3AsO4(砷酸)2.21 HNO2(亚硝酸)3.15 HF(氢氟酸)3.15 HCNO(异氰酸)3.48
H2CO3(碳酸)3.60 H2S(氢硫酸)7.02 HClO(次氯酸)7.53 HBrO (次溴酸)8.63
HCN (氢氰酸)9.21 H3BO3(硼酸)9.24 H3AsO3(亚砷酸)9.29 H2SiO3(偏硅酸)9.77
HIO (次碘酸)10.64 HAlO2(偏铝酸)12.2
碱的排序为:CsOH > R b OH > KOH > NaOH > Ba(OH)2 > LiOH > Sr(OH)2 > Ca(OH)2 (以上均为强碱)> Mg(OH)2> AgOH(相当于Ag2O的悬浊液) (以上为中强碱)
> NH3.H2O (NH4OH)> Fe(OH)2> Cu(OH)2> Fe(OH)3> Al(OH)3(明显的两性,碱性很弱了)
仅供个人用于学习、研究;不得用于商业用途。
For personal use only in study and research; not for commercial use.
Nur für den persönlichen für Studien, Forschung, zu kommerziellen Zwecken verwendet werden.
Pour l 'étude et la recherche uniquement à des fins personnelles; pas à des fins commerciales.
толькодля людей, которые используются для обучения, исследований и не должны использоваться в коммерческих целях.
以下无正文
仅供个人用于学习、研究;不得用于商业用途。
For personal use only in study and research; not for commercial use.
Nur für den persönlichen für Studien, Forschung, zu kommerziellen Zwecken verwendet werden.
Pour l 'étude et la recherche uniquement à des fins personnelles; pas à des fins commerciales.
толькодля людей, которые используются для обучения, исследований и не должны использоваться в коммерческих целях.
以下无正文。
