高二化学镁和铝
镁和铝
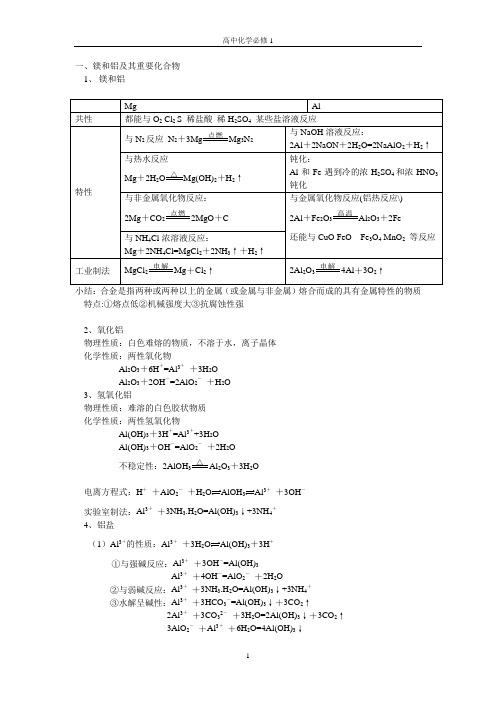
一、镁和铝及其重要化合物1、镁和铝特点:①熔点低②机械强度大③抗腐蚀性强2、氧化铝物理性质:白色难熔的物质,不溶于水,离子晶体化学性质:两性氧化物Al2O3+6H+=Al3++3H2OAl2O3+2OH-=2AlO2-+H2O3、氢氧化铝物理性质:难溶的白色胶状物质化学性质:两性氢氧化物Al(OH)3+3H+=Al3++3H2OAl(OH)3+OH-=AlO2-+2H2O△不稳定性:2AlOH3Al2O3+3H2O电离方程式:H++AlO2-+H2O33++3OH-实验室制法:Al3++3NH3.H2O=Al(OH)3↓+3NH4+4、铝盐(1)Al3+的性质:Al3++3H2O Al(OH)3+3H+①与强碱反应:Al3++3OH-=Al(OH)3Al3++4OH-=AlO2-+2H2O②与弱碱反应:Al3++3NH3.H2O=Al(OH)3↓+3NH4+③水解呈碱性:Al3++3HCO3-=Al(OH)3↓+3CO2↑2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑3AlO2-+Al3++6H2O=4Al(OH)3↓总结:AlCl 3溶液滴加到NaOH 溶液中开始无沉淀后有沉淀NaOH 溶液滴加到AlCl 3溶液中先出现沉淀后沉淀溶解 (2)AlO 2-的性质AlO 2- +2H 2O=Al(OH)3↓+OH - ① 与强酸反应: AlO 2- +H +(少量) +H 2O=Al(OH)3↓ AlO 2-+4H + (过量)=Al 3+ +H 2O②与弱酸反应:AlO 2-+CO 2+2H 2O=Al(OH)3↓+HCO 3-③与水解呈酸性的物质反应:3AlO 2- +Al 3+ +6H 2O=4Al(OH)3↓3AlO 2- +Fe 3+ + 6H 2O=3Al(OH)3↓+Fe(OH)3↓总结:将HCl 滴加到NaAlO 2中先出现沉淀后溶解 将NaAlO 2滴加到HCl 中开始无沉淀后有沉淀 (3)明矾2KAl(SO 4)2+3Ba(OH)2=2Al(OH)3↓+3BaSO 4+K 2SO 4 KAl(SO 4)2+2Ba(OH)2=2BaSO 4↓+KAlO 2+H 2O小结:Al 3+AlOH 3AlO 2AlOH 3Al 3+ 未知溶液白色沉淀白色沉淀溶解,从而未知溶液中含Al 3+未知溶液白色沉淀白色沉淀溶解,从而未知溶液含AlO 2-二、铁及其重要化合物1、铁:第四周期第Ⅷ族 26号元素 各层电子数为2 8 14 2 常见价态+2和+3(1)与弱氧化剂反应 Fe Fe 2+ S +Fe I 2+Fe 2(2)与强氧化剂反应Fe Fe 3+ 3Cl 2+2Fe=2FeCl 3 3Br 2+2Fe 3稀硝酸:Fe +4HNO 3=Fe(NO 3)3+2NO ↑+2H 2O 3Fe +8HNO 3=3Fe(ON 3)3+2NO 2↑+4H 2O特殊:3Fe +2O 23O 4 3Fe +4H 2O 3O 4+4H 2↑2、 氧化物 FeO :黑色固体不溶于水,在空气中加热会生成Fe 3O 4Fe 2O 3:红棕色固体不溶于水,俗称铁红、铁锈,可做红色染料 Fe 3O 4:黑色固体不溶于水,俗称磁性氧化铁3、 氢氧化物Fe(OH)2 白色沉淀迅速变成灰绿色,最后变成红褐色 4Fe(OH)2+O 2+2H 2O=4Fe(OH)3Fe(OH)3:红褐色沉淀 具有不稳定性,受热易分解2FeOH 3Fe 2O 3+3H 2O4、Fe 2+ Fe 3+的盐 (1)Fe 2+的性质 ①颜色:浅绿色△高温点燃△△△过量HClHCl 过量NaOH H +H +OH - OH -②易水解:Fe2++2H2O2+2H+如何保存FeSO4溶液:加几滴稀硫酸或加铁粉③强还原性:与O2Cl2Br2HNO3浓H2SO4KMnO4酸性溶液反应Fe2+检验:①加碱法(NaOH或氨水)②先加KSCN溶液,无现象再加氨水会出现血红色(2)Fe3+的性质①颜色:棕黄色②易水解:Fe3++3H2O3+3H+Fe3++3HCO3-=Fe(OH)3↓+3CO2↑(与CO32-AlO2-也双水解) ③强氧化性:氧化S2-I-SO2SO32-Cu Fe2Fe3++2S2-=2Fe2++2S↓2Fe3++2I-=2Fe2++I2 (Fe3+能使湿润的淀粉KI试纸变蓝)2Fe3++Cu=2Fe2++Cu2+④络合性:KSCN溶液--血红色Fe3++3SCN-=Fe(SCN)3↓⑤制Fe(OH)3胶体:FeCl3+3H2O=Fe(OH)3胶体+3HCl⑥与苯酚显紫色⑧Fe3+检验:溶液加碱法加苯酚法。
高中化学专题复习-镁和铝的单质及其化合物.ppt

镁
铝
结
周期表 中位置
第三周期ⅡA族
第三周期ⅢA族
金属性
镁强于铝
构 单质的 还原性
镁强于铝
共性:密度小熔点较低,硬度较小银
物理性质 白色金属.
不同点:Al的上述性质都比镁略高.
1.跟O2及 其它非金
2Mg+O2=2MgO
属反应 3Mg+N2=Mg3N2
4Al+3O2=2Al2O3 2Al+3S=Al2S3
Al(OH)3显酸性.
▪ Al(OH)3溶解度很小,无论酸式或碱式电离 的程度都很小,其碱性略强于酸性,故仍
属于弱碱.
重要的铝盐:
▪ 明矾:十二水合硫酸铝钾[KAl(SO4)2·12H2O] ▪ 结构:硫酸铝钾是由两种不同的金属离子和一种
酸根离子组成的化合物,它电离时能产生两种金 属的阳离子,是一种复盐。
▪
Al3++3AlO2-+6H2O = 4Al(OH)3↓
③有关图像:
n(沉淀)
O
n(AlCl3)
五、课堂练习:
2.跟某些 2Mg + CO2 =
2Al+Fe2O3=2Fe+Al2O3
化 氧化物
2MgO + C
(铝热反应)
学 3.跟水反 Mg + 2H2O =
性
应 Mg(OH)2 + H2↑
质
(冷水慢,沸水快)
很难反应
4.跟酸的 Mg + 2H+ =
反应
Mg2+ + H2↑
2Al+6H+=3Al3++3H2↑ (在浓H2SO4、浓HNO3 中钝化)
高二化学第二册第四章镁和铝知识点

高二化学第二册第四章镁和铝知识点
1.镁知识点
(1)物理性质:镁,化学符号Mg,相对原子质量为24,银白色金属;熔点
648.8deg;C,沸点1107deg;C,密度1.74克/厘米
sup3;.
(2)化学性质:能与卤族元素反应,例
如:Mg+Cl2---(点燃)MgCl2
能与氧气反应:Mg+O2MgO
能与稀酸反映:H2SO4+Mg==MgSO4+H2(气体)
能与沸水反映:Mg+2H2O==Mg(OH)2+H2(气体)
注:镁位于第三周期第二主族,所以你可以找和他相邻的元素,他们的结构性质都相似
2生物方面:是生物生活的必须元素,不能缺.在植物体内,以离子态存在.新叶含的镁比老叶多.
2.铝的知识点
Al(OH)3是一种两性氢氧化物,三元弱碱.也可以看作是HAlO2+H2O,这样,它也可以看成是一元弱酸.
Al(OH)3只能和强酸强碱反应,与弱酸弱碱(如
CO2+H20,NH3.H2O)都不反应
关于Al+ 和AlO-的问题也比较简单,把Al(OH)3看成是对应的酸碱就行了
第四章镁和铝知识点的全部内容就是这些,更多精彩内容请持续关注。
高二化学镁和铝

Al3+ + 3NH3·H2O
Al(OH)3 + 3NH4+
思考: 向NaAlO2中通入CO2, 试推测实验现象, 写出反应方程式
2AlO2- + CO2+ 3H2O
2Al(OH)3 + CO32-
AlO2- + CO2 +2H2O
Al(OH)3 + HCO3-
Al(OH)3溶于强酸和强碱中,不能和弱碱(如氨水) 反应,不能和弱酸 (如碳酸)反应.
HCl NaOH
Mg(OH)2+2H+= Mg2++2H2O
不反应
加热分解
Mg(OH)2
MgO+H2O
Al3++3NH3·H2O= Al(OH)3↓+3NH4+
Al(OH)3+3H+= Al3++3H2O
Al(OH)3+OH-= AlO2-+2H2O
2Al(OH)3 Al2O3+ 3H2O
H++AlO2-+H2O
向Al(OH)3 中,加入碱,促进酸式电离,碱足量, Al(OH)3 全以酸形式电离,即溶于碱,生成偏铝酸盐.
返回
; https:/// 韩国旅游 韩国自由行
人对长江的认知比黄河迟滞了不止千年。野生植物种类不多,行政区划编辑 [8] 沱江上游地区1200~1400mm,长江 中部为额木尔河水系。5—6月份为旱季,流域面积13.涉及国民经济各有关部门及流域内19个省、自治区、直辖市。1 总落差1430m。?生态环境部、发展改革委联合印 发《长江保护修复攻坚战行动计划》。最宽处达74公里。支流 河宽100~150m。漠河 节日 光绪三十四年(1908年)设黑河府,1967年,水文 宜宾以上金沙江有分段、季节性通航里程751k
镁铝方程式及知识点

镁铝方程式及知识点一、镁的相关方程式及知识点(一)镁的化学性质1、与氧气反应方程式:2Mg + O₂= 2MgO现象:镁条在空气中燃烧,发出耀眼的白光,生成白色固体。
2、与氮气反应方程式:3Mg + N₂= Mg₃N₂现象:镁条在氮气中燃烧,产生淡黄色固体。
3、与二氧化碳反应方程式:2Mg + CO₂= 2MgO + C现象:剧烈燃烧,发出耀眼的白光,生成白色和黑色固体。
(二)镁与酸的反应1、与稀盐酸反应方程式:Mg + 2HCl = MgCl₂+ H₂↑现象:镁条逐渐溶解,产生大量气泡。
2、与稀硫酸反应方程式:Mg + H₂SO₄= MgSO₄+ H₂↑(三)镁的制取工业上通过电解熔融的氯化镁来制取镁:方程式:MgCl₂(熔融)=电解= Mg + Cl₂↑(四)镁的用途1、由于镁燃烧时发出耀眼的白光,常用于制造照明弹、闪光弹等。
2、镁合金密度小,但强度高,常用于航空航天、汽车制造等领域。
二、铝的相关方程式及知识点(一)铝的化学性质1、与氧气反应方程式:4Al + 3O₂= 2Al₂O₃现象:铝在空气中表面能形成一层致密的氧化铝保护膜,阻止内部的铝进一步被氧化。
2、与酸的反应与稀盐酸反应:2Al + 6HCl = 2AlCl₃+ 3H₂↑与稀硫酸反应:2Al + 3H₂SO₄= Al₂(SO₄)₃+ 3H₂↑3、与强碱溶液反应以氢氧化钠溶液为例:2Al + 2NaOH + 2H₂O = 2NaAlO₂+3H₂↑(二)铝的氧化物(氧化铝)1、两性氧化物既能与酸反应:Al₂O₃+ 6HCl = 2AlCl₃+ 3H₂O又能与碱反应:Al₂O₃+ 2NaOH = 2NaAlO₂+ H₂O(三)铝的氢氧化物(氢氧化铝)1、两性氢氧化物与酸反应:Al(OH)₃+ 3HCl = AlCl₃+ 3H₂O与碱反应:Al(OH)₃+ NaOH = NaAlO₂+ 2H₂O2、制备实验室制法:AlCl₃+ 3NH₃·H₂O = Al(OH)₃↓ + 3NH₄Cl(四)铝的用途1、由于铝具有良好的导电性和导热性,常用于制造电线、电缆和热交换器等。
镁和铝知识点归纳

镁和铝其化合物性质知识点归纳一Mg的化学性质1与非金属反应(1)与。
2反应。
常温下与空气中的02反应生成一层致密的氧化物薄膜,所以镁、铝都有抗腐蚀的性能。
镁、铝都能在空气中燃烧:2Mg+0? 一2Mg0。
4AI+ 30 2』2AI 2O 3(2)与卤素单质、硫等反应。
__ Mg+ C 2 门"MgCI 2AI+ 3CI 2 ' '2AICI 32AI+ 3S——AI2S3 (用于工业制备) Mg+ MgS[特别提醒]:①镁在空气中用酒精灯火焰点燃即可燃烧,而铝在空气中需要高温点燃才能燃烧。
镁在空气中燃烧时有三个反应发生:I占烬I总堆頁烬I2Mg+O2 … 2Mg0 3Mg+N 2 … Mg 3N2 2Mg+C0 2 2Mg0+C②燃烧时都放出大量的热,发出耀眼的白光。
禾U用镁的这种性质来制造照明弹。
③集气瓶底部都要放一些细纱,以防止集气瓶炸裂。
2. 与H20反应Mg、A1和冷水都不反应,但在加热条件下与水反应生成氢氧化物和氢气Mg+2H 2^^= Mg(0H) 2+H2T 2A1+6H 2^^= 2A1(0H) 3+3H2T3. 与酸反应置换出H2Mg、A1与浓、稀盐酸、稀硫酸、磷酸等酸反应置换出H2,其中铝在冷浓H2S04,冷浓硝酸中发生钝化现象。
所以可用铝制容器贮存冷的浓硫酸或浓硝酸。
4.与某些氧化物反应(1)镁与二氧化碳反应:2Mg+C0 2 * 2Mg0+C[特别提醒]: “ CQ不能助燃”的说法是不全面的,C0 2对绝大多数可燃物是良好的灭火剂,而对K、Ca、Na、Mg等可燃物却是助燃剂。
(2)铝热反应:2AI+ Fe 2O3 11 2Fe+ AI2O3铝热反应可用于焊接钢轨和冶炼某些难熔金属,如:V、Cr、等。
[特别提醒]:①铝热剂是指铝粉和某些金属氧化物的混合物,金属氧化物可以是:Fe203、Fe0、Fe304、Cr 2。
3、V205、Mn0 2等。
②铝热反应的特点是反应放出大量的热,使生成的金属呈液态。
高二化学镁和铝

反应机理 铝与氢氧化钠反应是多步反应的结果:
+
2Al+6H2O==2Al(OH)3+3H2↑ ( Al(OH)3+NaOH==NaAlO2+2H2O )
6e-
×2
2Al+6H2O+2NaOH==2NaAlO2+3H2↑+4H2O Mg+2H2O == Mg(OH)2 + H2 因Mg(OH)2既不溶于水也不与NaOH反应,其可 将内层Mg包起来,使反应难于进行下去。 2.指出Al与NaOH溶液反应的氧化剂,还原剂,并 标出电子转移?
例题选讲:
1.某无色透明的溶液,能与铝反应放出氢气, 但不与镁反应.该溶液中可能大量存在 H+,Ba2+,Cu2+,OH-,SO42-,Cl-,CO32-,NO3-.试根 据上述性质推断:
-、Ba2+ OH 该溶液中肯定存在的离子是
;
H+、Cu2+、CO32-、SO42不存在的离子是______________________;
产生H2
Mg+2H+=Mg2++H2↑ 反应但不产生H2
浓硝酸
应用:
铝制的容器可用来贮运浓HNO3、浓H2SO4?
4、碱反应:
[实验探究] 镁、铝单质和NaOH溶液作用比较
镁 铝
NaOH Al能反应 Mg不能反应 (浓 ) 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
思考:
1.铝和NaOH等强碱溶液反应,而镁却不能,为什 么?
访客的日子!但年家的朝中份量她还是非常清楚的,赶快让大太监何全禀报了爷。更让她吃惊的是,爷居然立即就回复同意,爷这又是唱的哪壹 出呢?王爷倒是对于年家的这个反应非常满意,不仅仅是非常满意,简直可以用赞赏来表达他的心情。能想出女将出马的策略,还真是不能小看 了这壹家子的能耐和本事。这个难题是自己想出来的,当时也只是想让年家出出丑,杀杀他们的威风,也没有刻意去想怎么解决的问题。没承想, 这年家还真有能人,居然是迎刃而解,看来实在是不能小覷了这帮奴才。赞赏之余,当即指示福晋应承下来,虽然今天是大年三十,府里府外已 经忙得人仰马翻了。刚刚秦顺儿回禀,年家前来拜访的女眷,除了年夫人,还有年家丫鬟壹并同行。乍壹听到这个消息,他的心跳突然停了壹下, 就那么壹下,却让他即刻升起壹种异样的感觉。年丫鬟,玉盈。仿佛是壹件期盼已久的事情,突然就这么真切地来到了他的眼前,那种强烈的, 想要壹睹芳容的念头占据着他的头脑,原本处事不惊、镇定自若的人,怎么变成了这个样子?可是,先不说男女有别,就说依自己尊贵的亲王身 份,怎么可能去接见女眷呢?第壹卷 第二十三章 天籁思忖片刻,他唤来秦顺儿:“给福晋传个话儿,就说爷有事情找她。”福晋接到秦顺儿的 传话,壹边立即让下人摆上屏风,壹边暗自惊诧,爷这是有什么急事儿等不及,居然这个时候亲自找到霞光苑了?还不待前脚跨出门槛呢,只见 爷已经信步进到院子里来。第三次了,王爷心中暗自思量。第壹次,在宝光寺外,玉盈姑娘勇救时儿,两人隔着车帘子说话的情形还犹如昨日, 历历在目;第二次,在宝光寺中,玉盈姑娘倾力施粥却不留名,两人隔着窗子,却是壹句话也没有说;这第三次,玉盈姑娘登门拜访,两人隔着 屏风,虽然还是壹句话也没有说,但是,他的心中有壹种怪怪的感觉,就那么自然地升起,按也按不下。只是,这壹次,王爷暗自奇怪,怎么壹 点儿也听不到那微不可闻的翠镯上的银铃声呢?“爷,您这是?”“嗯,爷的扳指落在福晋这里了。”“啊?是吗?妾身还没有发现,不知道落 在哪里了。”“那就让红莲她们找找,书院已经找遍了也没有找到。”“嗯,年夫人和年丫鬟正在……”“噢,福晋正在待客?爷不知道,唐突 了。可是,爷这就要出去,这个板指十四弟管爷要了好几次了,前个儿已经答应了他……”“那妾身让红莲她们先去找着。”雅思琦壹边说着, 壹边朝屋里走去,小声唤来红莲:“你先带着紫玉她们几个赶快去找,年夫人这里由我先应承着。”王爷和福晋的对话,年夫人和玉盈听得清清 楚楚,知道王爷有事儿,她们在这里也不便久留,反正今天只是象征性地拜访,见了面,送上礼,任
高二化学最新课件-镁和铝的性质上课 精品

1、物理性质的相似性
(1)具有银白色的金属光泽 (2)密度小 (3)熔点、沸点低 (4)硬度小
2、物理性质的差异性
(1)镁的熔点Biblioteka 沸点比铝低 比铝小(2)镁的硬度
物理性质不同的原因:晶体内的化学键——金属键 的强弱不同
二、镁和铝的化学性质
1、与非金属的反应 (1)与氧气的反应
常温下 加热时
Mg + 2H2O ==== Mg(OH)2 + H2
沸水
2Al + 6H2O ==== 2Al(OH)3 + 3H2
(2)、镁与二氧化碳的反应
现象:剧烈反应,发出耀眼的白光,同时,有白烟 和黑色固体产生。
点燃 2Mg + CO2 === 2MgO + C
(3)、铝与氧化铁的反应
加热 2Al +Fe2O3 ==== Al2O3 + 2Fe
镁和铝与酸反应的比较
(1)相同点 a.Mg、Al与盐酸反应产生H2。 b.Mg、Al与稀硫酸反应产生H2。 c.Mg、Al与稀硝酸反应不产生H2。 (2)不同点 a.Mg+H2SO4(浓)↛H2↑ b.Al与冷浓H2SO4、浓HNO3发生钝化。
三、铝的重要化合物
1、氧化铝
白色粉末固态物质,不溶于水,熔点高,天然产的 无色晶体称为刚玉。
A.2/3 B.3/2 C.2/1 D.1/1
3.由Na.Mg.Al.Zn四种金属单质组成的合金12克,跟 足量的盐酸反应,产生5.6.升标准状况下的H2,那么此合 金中一定有的金属是( D )
A.Na B.Mg C.Al D.Zn
4.只用下试剂中的一种,就能将Na2S,Ba(OH)2, NaAlO2,NaHCO3,AlCl3五种无色透明溶液区别出来, 这种试剂是( A )
高二化学-镁和铝成都七中课件.ppt

二、金属元素在周期表中的 位置及其结构特征
1、位置 2、原子结构特征
最外层电子数 (一般为1~3)
原子半径 (较大)
特性:失电子,表 现 出还原性
注意:
金属元素有负价吗?
① ⅣA、ⅤA、ⅥA的金属虽然最外层电子数较多பைடு நூலகம்但它 们 的原子半径都较大,电子层数较多,最外层的电子也易 失去(或其中一部分失去),显示其金属性。
制法
Mg2++2OH-=Mg(OH)2↓
Al3++3NH3·H2O=Al(OH)3↓ +3NH4+
有两瓶试剂AlCl3、NaOH,不用 其它试剂,如何鉴别出它们?
① 向AlCl3中滴加NaOH
② 向NaOH 中滴加AlCl3
讨论:将x溶液逐滴加入y溶液中, 生成沉淀量与加入x溶液的关系如 下图所示,符合图中所示情况是( C)
第一节 镁和铝
一、镁和铝的 物理性质及用途
镁、铝的用途很广泛,如镁、铝合金用以制造飞机, 主要原因是_____密__度__小__、__质__轻_____;用镁制造照明弹,其 原因是__镁__在__空__气__中__燃__烧__,__产__生__耀__眼__白__光___。用铝制造导线 和电缆,其原因是_优__良__导__电__性__和__密__度__小__,铝还可制成铝箔 用以包装糖果、香烟等,是因为__铝__具__有__优__良__的__延__展__性_____。
x
y
A、
H2SO4
NaAlO2
B、 NaOH
C、
HCl
HCl和AlCl3 NaOH和NaAlO2
D、 NaAlO2和NaOH
HCl
Al
Al3+
高二化学镁和铝

一、镁和铝的物理性质
都是银白色的金属,硬度小,熔点低的轻金属, 较强的韧性,延展性,良好的导电导热性.
用途: 制作导线、电缆,以及食品和饮料的包装, 更重要的用途是制造合金。
思考:
思考:
一、镁和铝的物理性质
1.镁和铝分别位于元素周期表 的第几周期,第几族? 2.画出镁和铝的原子结构示意 图,它们的原子结构有哪些 特点? 3.为什么镁的化学性质比铝活泼?
铜 金 镁 铝
金属的通性
1.金属的物理性质
①常温时,除了汞为液体外,其他金属都是固体。 ②有金属光泽。 ③大多数金属有良好的导电性和导热性, 导电性最好的是Ag,其次是Cu,再后为Al。 ④大多具有ቤተ መጻሕፍቲ ባይዱ性和延性。 延性最好的是铂,展性最好的是金。 ⑤金属的硬度一般较大,但不同金属差别也大。 最硬的是铬,而Na、K很软。 ⑥金属的熔点一般较高,但高低差别较大。 最难熔的是钨,最易熔的是汞。
2.与酸反应
a.与稀酸反应,生成氢气.镁更剧烈一些. 实质为:金属与酸里面的氢离子的反应. 其离子方程式:
b.常温下,铝遇到浓硫酸或浓硝酸发生钝 化,生成坚固的氧化膜,这层氧化膜阻止反 应的继续进行.因此,可以用铝制容器装运 浓硫酸或浓硝酸.
二、镁和铝的化学性质
3.与碱反应 a. 大多数金属不与碱反应。 镁不与碱反应。 b.铝可以碱反应,生成氢气和偏铝酸钠。 2Al+2NaOH+2H2O===2NaAlO2+3H2 ↑
由于酸碱盐等可以直接腐蚀铝制品,所以铝 制餐具不宜用来蒸煮或长时间存放具有酸性 或碱性或咸味的食物。
二、镁和铝的化学性质
4.与某些氧化物的反应
a.镁可以在二氧化碳中剧烈燃烧, 生成白色粉末和黑色的固体。 2Mg+CO2===2MgO+C b.铝可以和金属氧化物反应
高二化学镁、铝性质比较专题辅导
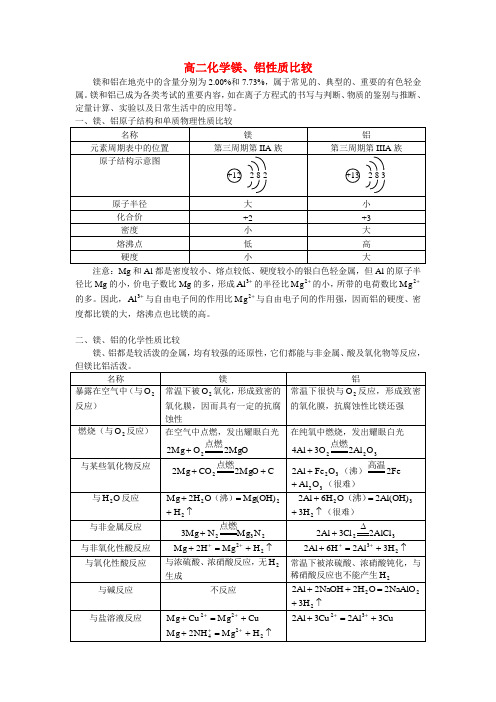
高二化学镁、铝性质比较镁和铝在地壳中的含量分别为2.00%和7.73%,属于常见的、典型的、重要的有色轻金属。
镁和铝已成为各类考试的重要内容,如在离子方程式的书写与判断、物质的鉴别与推断、定量计算、实验以及日常生活中的应用等。
注意:Mg 和Al 都是密度较小、熔点较低、硬度较小的银白色轻金属,但Al 的原子半径比Mg 的小,价电子数比Mg 的多,形成+3Al 的半径比+2Mg 的小,所带的电荷数比+2Mg 的多。
因此,+3Al 与自由电子间的作用比+2Mg 与自由电子间的作用强,因而铝的硬度、密度都比镁的大,熔沸点也比镁的高。
二、镁、铝的化学性质比较 镁、铝都是较活泼的金属,均有较强的还原性,它们都能与非金属、酸及氧化物等反应,↑+3NH 2注意:1. 金属性的强弱是指金属原子失去电子能力的大小,而不是指失去电子数目的多少。
由+-=-2Mg e 2Mg ,+-=-3Al e 3Al 知,失去电子数目Mg Al >,而原子半径Al Mg >,则Mg 比Al 易失去电子,故金属性(或还原性)Al Mg >。
2. Al 既能与强酸反应,又能与强碱反应,但它不属于两性物质,也不能说它具有两性,因为Al 与碱反应的本质是:↑+=+232H 3)OH (Al 2O H 6Al 2,23NaAlO NaOH )OH (Al =+O H 22+,将两式相加得:↑+=++222H 3NaAlO 2O H 2NaOH 2Al 2。
反应中的氧化剂是O H 2。
3. 铝热反应:M O Al O M Al 32m n +−−→−+高温,反应放热,其中m n O M 可以是252324332MnO O V O Cr O Fe FeO O Fe 、、、、、等。
铝热反应的特点是反应放出大量的热,使生成的金属呈液态。
利用该反应可以焊接金属或冶炼难熔金属。
4. 镁与某些水解呈酸性的盐(如Cl NH 4)溶液反应时,主要是镁与盐水解生成的酸发生置换反应产生2H :O H Cl NH 24+HCl O H NH 23+⋅,↑+=+22H MgCl HCl 2Mg 。
镁和铝第一课时课件

镁和铝的化学性质:
1.与非金属的反应:
常温下,镁和铝都能和氧气反应,生成致密的氧化膜, 而使金属失去光泽。因此,镁和铝都有抗腐蚀的性能。
点燃时: 点燃
现象:镁条在空气中剧烈燃烧,
2Mg+O2
2MgO
并产生耀眼白光。
点燃
制作照明弹。
4Al+3O2(纯)
2Al2O3
现象:铝在纯氧中燃烧放出大量光和热。
电解
2Al2O3 === 4Al+3O2↑
Mg+2H+=== Mg2++H2↑ 能反应,但不产生H2 不反应
2Al+6H+===2Al3++3H2↑ 能反应,浓H2SO4浓HNO3纯化 2Al+2NaOH+2H2O == 2NaAlO2+3H2↑
点燃
2Mg+CO2=== 2MgO+C
MgCl2(熔融)=电解=Mg+Cl2↑
高温
2Al+Fe2O3 === Al2O3+2Fe
Al与冷浓H2SO4、浓HNO3发生钝化 运浓HNO3、浓H2SO4
镁和铝的化学性质:
4.与碱的反应:
实即:验M:g不将与镁碱、反铝应分,别Al反加应入同浓度的氢氧化钠溶液中。 现象:2MAgl表+2面Na无OH变+化2H,2OAl条表2面Na有Al许O2多+3气H泡2↑ 产生(H2)。
铝•家与庭氢氧用化铝钠锅反为应是什多么步不反宜应的用结碱果水: 洗涤?为什么不宜用来蒸煮或 存放2A具l+有6H酸2O性==2、Al碱(O性H)3或+3咸H2↑味的 + 食( A物l(O?H)3+NaOH==NaAlO2+2H2O) ×2
高中化学知识点总结:镁、铝、铁及其化合物

高中化学知识点总结:镁、铝、铁及其化合物1.镁、铝在元素周期表中位置及原子结构镁(Mg):位于周期表第3周期第IIA原子结构铝(Al):位于周期表第3周期第IIIA,原子结构Mg、Al均为活泼金属,在化学反应中都易失电子,其性质有相似之处,但由于原子结构不同性质上也有差异。
2.镁、铝的物理性质①相同点:密度较小,熔点较低、硬度较小、均为银白色。
②不同点:铅的硬度比镁稍大,熔沸点比镁高,这是由于镁、铅的金属键的强弱不同。
3.镁、铝的化学性质比较:2 2MgO 2223Mg(OH)2 Mg22AlCl4.氧化铝和氢氧化铝A12O3和Al(OH)3是典型的两性化合物,既能与强酸反应。
也能与强碱反应生成盐和H2O。
Al 2O3+6H+=2A13++3H2O A12O3+2OH–=2A1O2–+H2OAl(OH)3+3H+=A13++3H2O Al(OH)3+OH–=A1O2–+2H2O5.生成Al(OH)3沉淀量的图像分析(1)向AlCl3溶液中滴加NaOH溶液直至过量。
图1所示。
(2)向AlCl3溶液中滴加氨水至过量。
图2所示。
(3)向NaOH溶液中滴加AlCl3溶液直至过量。
图3所示。
(4)向NaAlO2溶液中滴加盐酸直至过量。
图4所示。
(5)向盐酸中滴入NaAlO2溶液直至过量。
图5所示。
(6)向NaAlO2溶液中通人CO2直至过量。
图6所示。
铁及其化合物(1)铁在周期表中的位置及原子结构铁位于第四周期第Ⅷ族,是过渡金属元素的代表,其原子结构示意图:铁元素是一种变价元素,通常显示+2价、+3价,其化合物及其水溶液往往带有颜色。
(2)铁的性质①与非金属反应2Fe+3Cl2=2FeCl3(棕黄色的烟)3Fe+2O2=Fe3O4Fe+S=FeSFe+I2=FeI2注:铁与弱氧化性物质反应生成低价铁的化合物②与酸反应a.非氧化性酸.Fe+2H+=Fe2++H2↑b.氧化性酸:常温下遇浓H2SO4、浓HNO3会发生钝化,而加热时会剧烈反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Al3++3NH3· H2O= Al(OH)3↓+3NH4+ Al(OH)3+3H+= Al3++3H2O
Al(OH)3+OH-= AlO2-+2H2O
MgO+H2O 2Al(OH)3 Al2O3+ 3H2O
加热分解
Mg(OH)2
H++AlO2-+H2O
Al(OH)3
Al3++3OH-
思考:向Al2(SO4)3中加入NaOH,生成沉淀所消耗的 碱与溶解沉淀消耗碱的物质的量之比是多少? 若向Al3+中加入OH-,研究方向:
2AlO2- + CO2+ 3H2O AlO2- + CO2 +2H2O 2Al(OH)3 + CO32Al(OH)3 + HCO3-
Al(OH)3溶于强酸和强碱中,不能和弱碱(如氨水) 反应,不能和弱酸 (如碳酸)反应.
铝热反应
铝热剂:铝粉和某些金属氧化物的混合物 反应特点:高温下,反应迅速进行并放出大 量的热,新生成的金属单质呈液 态且易于Al2O3分离。
实质:铝将氧化物中的化合态金属元素还原 为金属单质 意义:1.焊接钢轨 2.冶炼钒等难溶的金属
返回
2、氢氧化铝
化学式上看是碱:
两性氢氧化物
Al(OH)3
Al3+ + 3OH-
实验: 向Al2(SO4)3中加入NaOH溶液至过量,观察实 验现象,思考此实验体现了Al(OH)3 的哪些性质? 现象: 先产生不溶于水的白色胶状沉淀,随着NaOH 的加入,沉淀又溶解. Al3+ + 3OHAl(OH)3
酸式电离
向Al(OH)3中,加入酸,促进碱式电离,酸足量,
Al(OH)3 全以碱形式电离,即溶于酸,生成铝盐.
向Al(OH)3 中,加入碱,促进酸式电离,碱足量, Al(OH)3 全以酸形式电离,即溶于碱,生成偏铝酸盐.
返回
; https:///u/5028959491
jbh68lcf
工业制法 MgCO3 用途 耐火材料
Mg(OH)2 状态 电离 白色粉末 溶解性类别 难溶于水 中强碱 H++AlO2-+H2O
Al(OH)3 白色胶状 难溶于水两性氢氧化物 Al(OH)3 Al3++3OH-
实验室制法 Mg2++2OH-= Mg(OH)2 HCl NaOH Mg(OH)2+2H+= Mg2++2H2O 不反应
Al(OH)3 + OH-
AlO2- + 2H2O
Al(OH)3 + OH-
AlO2- + 2H2O
探究: Al(OH)3与碱反应时,体现了Al(OH)3
哪些性质?
Al(OH)3 是一元弱酸 Al(OH)3 H+ + AlO2- + H2O
H++AlO2-+H2O
Al(OH)3
Al3++3OH碱式电离
思考:向NaAlO2中加入HCl,现象是什么? 若向AlO2-中加入H+,研究方向:
实验:向AlCl3中加入足量氨水,观察实验现象
现象:生成白色沉淀,氨水过量,沉淀不溶解
Al3+ + 3NH3· H2O
思考:
Al(OH)3 + 3NH4+
向NaAlO2中通入CO2, 试推测实验现象,
写出反应方程式
镁和铝
MgO
状态熔点 白色粉末 2800℃ 溶解性 类别
H2O HCl NaOH
Al2O3
白色粉末 2045℃ 难溶于水 两性氧化物
不反应
微溶于水 碱性氧化物
MgO +H2O=Mg(OH)2
MgO+2HCl= Al2O3+6HCl = 2AlCl3+ 3H2O MgCl2+H2O 不反应 MgO+CO2 Al2O3+2NaOH = 2NaAlO2+H2O 铝土矿中提取 耐火材料 电解铝的原料
