工科综合化学6章
工科化学与实验(金继红)第5章-习题及思考题答案

思考题1.氧化还原反应的特征是什么?什么是氧化剂和还原剂?什么是氧化反应和还原反应?氧化还原反应的特征是有电子的转移或偏移。
在氧化还原的过程中,得电子的物质为氧化剂,失电子的物质为还原剂。
氧化数升高的过程称为氧化,氧化数降低的过程称为还原。
2.如何用离子-电子法配平氧化还原方程式?配平原则:(1)反应过程中氧化剂所夺得的电子数必须等于还原剂失去的电子数。
(2)反应前后各元素的原子总数相等。
配平步骤:将反应式改写成两个半反应式,先将两个半反应式配平,然后将这些反应加合起来,消去电子而完成。
3.什么是氧化还原电对?同一元素原子的氧化型物质及对应的还原型物质称为氧化还原电对。
氧化还原电对通常写成: 氧化型/还原型(Ox/Red),如: Cu2+/Cu;Zn2+/Zn4.如何用图式表示原电池?为简单起见,通常用符号表示原电池。
图式中“∣”表示相界面;“‖”表示盐桥;(—)和(+)分别表示原电池的负极和正极。
一般进行氧化反应的负极写在左边,进行还原反应的正极写在右边。
要注明电池反应的温度和压力,如不写明,一般是指在298.15K和标准压力下。
对气体要注明压力,对溶液要注明浓度,当溶液浓度为1mol/L时可以不写。
当电极无金属导体时,需要增加只起导电作用而不参加反应的惰性电极Pt 或C;若参加电极反应的物质中有纯气体,液体或固体时,则应写在惰性导体的一边。
5. 原电池的两个电极符号是如何规定的?如何计算电池的电动势?(—)和(+)分别表示原电池的负极和正极。
电池电动势 E = E + - E -E +和 E - 分别代表正,负极的电极电势。
6. 电对的电极电势值是否与电极反应式的写法有关?电对的电极电势值是强度性质,与电极反应式的写法无关。
7. 原电池的电动势与离子浓度的关系是什么?从能斯特方程中可反映出影响电极电势的因素有哪些?原电池的电动势与正极和负极的电极电势有关,等于两者之差。
而电极电势与离子浓度之间的关系,可由能斯特方程表达。
工科背景下化工过程分析与合成课程教学改革--评《化学过程工艺学》(第2版)

书评㊃广告工科背景下化工过程分析与合成课程教学改革 评‘化学过程工艺学“(第2版)高晓新(常州大学石油化工学院,江苏常州213164)化工过程分析与合成课程是一门结合化学工艺与化学工程理论的综合性课程,对于提高当代大学生有效组织化工过程工艺流程的能力㊁实现我国化工专业人才的创新发展具有重要指导价值㊂在工科背景下加强对该课程的教学改革研究,能够切实增强专业学科的教学质量,为新时期祖国发展提供重要的专业优秀人才㊂由刘代俊㊁蒋文伟和张昭编著,化学工业出版社出版的‘化学过程工艺学“(第2版)一书,对化学加工过程中的共性特点进行了整合分类,并在综合考虑工艺核心反应过程中相间的变化特点和相应的分离过程的基础上,以典型的工业实例为现实案例,对固㊁液㊁气相间物质的转化过程和工业处理手段进行了分析和阐述,从专业角度为读者提供了更广阔的化工视野,可作为高等院校化工及相关专业本科生的教材,也可为相关化工专业研究人员提供理论参考㊂该书共分为九章㊂第一章详细介绍了化学工业在世界经济发展中的重要性㊁发展特点㊁发展动力,并进一步指出化学过程工艺学的高校教学任务㊂第二章从化学矿㊁煤㊁石油三个方面对化学工业资源进行了全面论述㊂第三章介绍了固体化学矿的初加工及液固相间的化学工程㊂第四章介绍了液相中的化工处理过程㊂第五章与第六章分别介绍了气-固相体系的物相转化与化学加工以及气液相系统中的物质转化与化学加工方法㊂第七章对气-液-固三相中进行的化工过程进行了全面论述㊂第八章进一步阐述了固相过程与高温合成原理㊂第九章则论述了循环经济与生态工业园区的集成㊂化学工业作为国民经济的基础型产业之一,是创新工业革命的有力助手㊂在新的经济发展阶段,加强工科背景下化工过程分析与合成课程教学改革研究,有助于促进我国工程教育的改革,进一步提高我国工程教育的质量,为推动我国化工教育的国际化发展步伐提供重要支撑㊂首先,加强课程内容的选择完善,重构化工过程分析与合成课程体系建设㊂新世纪以来,高校扩招使得我国培养的工科类专业毕业生数量逐年递增,中国高等教育向着现代化方向改革发展的同时,我国的工科毕业生却存在与社会发展需求严重脱节的现象㊂工科背景下,化工过程分析与合成专业课程的教学思想和教学手段相对落后,学生很难得到有效培养和训练,实践和创新能力明显不足㊂因此,为推动我国化工专业教育改革发展,建设更为科学合理的化工专业教育体系㊁为国家发展建设培养综合素质全面发展的化工专业人才成为迫切之需㊂化工过程分析与合成课程涉及的专业基础知识繁冗复杂,这与教学课时的时限性之间构成了较为明显的矛盾㊂因此,以‘化学过程工艺学“(第2版)为该课程参考教材,结合化工过程分析与合成等相关课程,对课程教学内容进行选择完善,有利于优化专业课程教学体系㊁提高教学质量,从而实现化工专业课程的综合发展㊂其次,改善课堂教学形式,增强互动式教学课堂占比㊂一方面,学校要转变传统的教学观念,将 以教师为中心 的课堂教学转变为 教师引导,学生自主性探索 的互动式教学模式㊂传统 满堂灌 式的教学方式打磨了学生学习的积极性和主动性,不利于学生终身学习能力㊁社会适应能力和创新能力的培养,而新的教学课程改革强调学生在课堂教学过程中的重要性,教师可通过问题启发式㊁小组讨论式等多元化的互动式教学模式,激发学生的课堂学习积极性,在互动交流中实现对新知识的内化吸收,从而有效增强学生对于专业化工问题的分析能力和解决能力㊂另一方面,学校应加强实践教学比重,提高学生的化工实践能力,把以讲解教材㊁传授知识为主的封闭式教学转变为增长经验㊁创造创新的开放式教学㊂这就要求教师在课程教学过程中多带领学生进行实验教学,帮助学生加深对书本中化工理论知识的理解,同时积极组织学生参加全国大学生化工设计竞赛,在提高课堂教学质量的同时提高学生的实践应用能力㊂‘化学过程工艺学“(第2版)一书坚持理论与实际相结合的原则,作者在总结多年教学经验的基础上,采用了大量反映化工实际过程的多媒体材料,进一步增加书中形象思维的分量,对于提高学生对化工现场的认识能力和创新思维具有较好的效果,值得阅读学习㊂[作者简介:高晓新(1979 ),男,副教授,主要研究方向为化工过程模拟优化及化工分离]。
教学大纲-四川大学化学学院

教学大纲一、课程基本信息课程名称:物理化学(Physical Chemistry)课程号(代码):20307130,20307030,20306930,20306830,20315930,20320840,30829720,30829840 课程类别:类级平台课(必修)学时学分:理科类:102学时,6学分,工科类:72学时,4学分;医药类:药学68学时,4学分;医检、卫检:51学时,3学分。
前修课程:无机化学、分析化学、有机化学、大学物理、大学数学等开课时间:大学二、三年级课程教材:理科:《物理化学》(上、下册),袁永明,何玉萼,薛英,胡常伟编,四川大学出版社,1998年工科:《物理化学教程》,周鲁主编,科学出版社, 2002年医药类:《物理化学》(第5版),侯新朴,詹先成等编,人民卫生出版社,2003年开课单位:四川大学物理化学教研室任课教师:周鲁(教授)、薛英(教授)、卫永祉(教授)、何玉萼(教授)、李象远(教授)、龚茂初(教授)、高翔(副教授)、杨华清(副教授)、翟淑华(讲师)、谈宁馨(讲师)、童冬梅(讲师)、林涛(讲师)、唐星烁(讲师)、胡安明(讲师)、张文华(讲师)、周歌(讲师)。
适用专业:四川大学化学学院、生命学院、化学工程学院、高分子材料与工程学院、材料科学与工程学院、轻纺与食品学院、建筑与环境学院、制造科学与工程学院、药学院、临床医学院、公共卫生学院等11个学院化学、应用化学、材料化学、生命科学、生物技术、化学工程、化学工艺、化学冶金、生物化工、药学、医检、卫检、安全工程、皮革、食品、纺织、塑料、铸造、无机材料、高分子材料、金属材料、环境科学、环境工程、给排水工程、生物医学工程、制药工程等27个专业本科生。
二、课程的内容和任务物理化学是化学科学的一个重要分支学科。
它借助于数学、物理学等基础科学的理论及实验方法,从物质的物理现象和化学现象的联系入手 , 研究化学反应的平衡规律和速率规律,以及这些规律在科研、生产、生活实践中的应用。
天津理工大学2024年硕士研究生招生考试复试大纲 材料:《材料综合》复试大纲

材料综合复试大纲(复试分为三部分内容,考生可以选择其中任一部分作答。
)第一部分无机化学参考书目:《无机化学》,大连理工大学无机化学教研室编,高等教育出版社。
第三章化学动力学基础掌握活化分子和活化能的概念,并能用其说明浓度、温度、催化剂对化学反应速率的影响;掌握化学反应速率、反应速率方程、反应级数等概念;熟悉Arrhenius 方程。
第五章酸碱平衡掌握酸碱质子理论基本要点;掌握同离子效应和缓冲溶液的概念、一元强弱酸、Lewis酸碱的相关内容;掌握配位化合物的基本概念。
第六章沉淀溶解平衡掌握相关理论并解释沉淀析出的实验现象。
第七章氧化还原反应电化学基础掌握电极电势的基本概念及应用;熟悉氧化还原反应的基本概念。
第八章原子结构掌握核外电子排布的基本原理;掌握周期表中元素的分区、结构特征;熟悉原子半径、电离能、电子亲和能和电负性的变化规律。
第十章固体结构熟悉晶体的类型、特征和组成晶体的微粒间的作用力;能用相关知识点解释结构对物性的影响。
元素部分(s、p、d区元素),掌握性质递变规律。
第二部分物理学参考书目:《物理学》上、下册,东南大学等七所工科院校编,马文尉改编,高等教育出版社。
第五章静电场理解电场强度,掌握场强叠加原理,了解电荷连续分布的带电体的场强,理解电场线、电通量,掌握高斯定理,理解环路定理,了解电势,电势差及电势叠加原理。
第六章静电场中的导体与电介质了解静电场中加入导体和电解质后电场发生的变化,了解电容器的概念。
第七章恒定磁场理解磁感应强度,掌握毕奥-萨伐尔定律,理解磁感线、磁通量,掌握磁场中的高斯定理和安培环路定理;理解洛沦兹力,了解霍尔效应。
第八章电磁感应电磁场理解电动势的概念,掌握法拉第电磁感应定律,理解动生电动势、感生电动势的本质。
第十一章光学理解光的相干条件及获得相干光的基本原理和一般方法;了解光程概念以及光程差与相位差的关系,了解反射时产生半波损失的条件;了解杨氏双缝干涉的基本装置和实验规律;了解干涉条纹的分布特点及其应用;了解薄膜干涉原理在实际中的应用。
大学工科化学物理化学教案

一、教学目标1. 理解物理化学的基本概念、基本原理和基本方法。
2. 掌握热力学、动力学、电化学、胶体化学等基本知识。
3. 能够运用物理化学的基本原理解决实际问题。
二、教学内容1. 热力学基础- 状态函数和过程函数- 热力学第一定律- 热力学第二定律- 熵和自由能- 吉布斯自由能和化学平衡2. 动力学基础- 反应速率和反应机理- 链式反应和自由基反应- 速率方程和反应级数- 酶催化反应3. 电化学基础- 电荷守恒和欧姆定律- 电化学电池和电解- 电解质溶液和离子平衡- 电化学腐蚀和电化学保护4. 胶体化学基础- 胶体溶液和胶体性质- 胶体稳定性和胶体聚沉- 胶体分散系和胶体分离- 胶体在工业和生物中的应用三、教学方法1. 讲授法:系统讲解物理化学的基本概念、基本原理和基本方法。
2. 讨论法:引导学生分析实际问题,运用物理化学的基本原理进行解决。
3. 案例分析法:通过实际案例,让学生掌握物理化学的应用。
4. 实验教学法:通过实验操作,让学生加深对物理化学知识的理解。
四、教学进度安排1. 第1-2周:热力学基础2. 第3-4周:动力学基础3. 第5-6周:电化学基础4. 第7-8周:胶体化学基础5. 第9-10周:综合练习与复习五、教学手段1. 教材:全国普通高等院校工科化学规划精品教材《物理化学》2. 课件:制作与教学内容相关的PPT3. 网络资源:利用网络资源,如学术论文、教学视频等,丰富教学内容六、教学评价1. 课堂表现:关注学生在课堂上的积极参与和思考。
2. 作业与练习:检查学生对基本概念、基本原理和基本方法的掌握程度。
3. 实验报告:评估学生在实验操作和数据分析方面的能力。
4. 综合测试:对整个学期的学习情况进行综合评价。
通过本课程的学习,学生应能够掌握物理化学的基本知识,具备运用物理化学原理解决实际问题的能力。
有机化学第七版答案陆涛

有机化学第七版答案陆涛【篇一:有机化学大纲】xt> 适合专业:药物制剂总学时数:72 学分:4一、课程教学目的与任务通过基础有机化学的学习,使学生掌握各类有机化合物的基本性质、制备方法及分析鉴定的手段,为解决各类有机化学问题打下基础。
培养理工科逻辑严谨的思维习惯和科学严谨的实验习惯,有机物种类繁多,本课程的主要任务是通过逻辑性思维和严谨实验作风的培养,使学生能够对新型有机物触类旁通,举一反三。
二、理论教学的基本要求了解各类有机化合物的波谱特征,初步学会解析图谱。
了解分析分子结构和性能的关系、官能团对分子物理性质和化学性质的影响、官能团之间的相互影响;理解分离提纯有机混合物的一般方法以及常见有机物及官能团的定性鉴定和某些定量测定的方法。
理解nmr 、ir、uv 、ms 的基础知识。
理解主要有机反应如取代、加成、消除、氧化还原、重排、缩合、协同反应等的反应机理并能在解释实际问题时加以应用,能用化学动力学和化学热力学概念来解释某些实验现象;掌握母体烃类化合物、各类官能团化合物、一般杂环化合物和简单高分子化合物的命名、结构特征、物理性质,它们的主要反应性能和应用,它们的实验室制备方法和工业制备方法及这两类方法的异同点,学会用逆合成原理进行简单的合成设计。
掌握静态立体化学的各种基本概念和基础知识,初步具有构型和构象分析的能力,掌握动态立体化学的基本概念和在反应中的应用。
三、实践教学的基本要求(无)五、推荐使用教材及主要教学参考书推荐使用教材:陆涛,胡春,项光亚,有机化学(第七版),北京:人民卫生出版社,2012 主要参考书:[1] 洪筱坤, 有机化学,北京:中国中医药出版社,2005[2] 邢其毅,徐瑞秋,周政, 基础有机化学,北京:高等教育出版社,1993 [3] 胡宏纹,有机化学,北京:高等教育出版社,1990 [4] 尚振海, 有机反应中的电子效应,北京:高等教育出版社,1992【篇二:华中科技大学755 药学综合】/p> 一、考试性质药学综合是报考我校药学专业硕士研究生的一门综合基础课程,由有机化学、分析化学和药理学三门课程组成。
工程化学课程教学大纲

工程化学课程教学大纲英文名称:Engineering Chemistry 课程编码:10110010学时:32/6 学分:2课程性质:公共必修课课程类别:理论课先修课程:开课学期:第一学期适用专业:机械工程学院、电气工程学院、信息工程学院、理学院、建工学院等一、课程的性质与任务工程化学是机械学院、电气学院、信息学院、理学院、车辆学院、建工学院等学院学生必修基础课程,工程化学从物质的化学组成、化学结构和化学反应出发,密切联系现代工程技术中遇到的如材料的选择和寿命、环境的污染与保护、能源的开发与利用、信息传递、生命科学发展等有关化学问题,深入浅出地介绍有现实应用价值和有潜在应用价值的基础理论和基本知识,使学生在今后的实际工作中能有意识地运用化学观点去思考、认识和解决问题。
二、教学目标与要求工程化学课程内容共分六章,第一章物质的聚集状态;第二章化学反应原理;第三章水溶液中的离子平衡;第四章电化学基础;第五章物质结构基础;第六章化学与人类的进步。
通过本课程的学习,使机械学院、电气学院、信息学院、理学院、车辆学院、建工学院等学院学生掌握化学基础知识,为进一步提高专业素质训练奠定基础。
三、课程的基本内容与教学要求第一章物质的聚集状态[教学目的与要求]:理解系统、环境概念;掌握“物质的量”的符号、单位及有关计算;理解反应进度的概念,掌握化学计量数正、负值的确定。
理解各类晶体名称、晶格结点上粒子及其作用力、熔点、硬度、延展性、导电性,掌握溶液的蒸汽压下降、凝固点下降、沸点上升和产生渗透压的原因;了解等离子态的形成和组成,了解大气湿度概念和相对湿度的计算,掌握酸雨的pH值范围,理解温室气体和温室效应,理解臭氧层出现空洞原因、危害和预防措施。
[本章主要内容]:1.1化学基本概念1.2气体、等离子体1.3液体和水污染1.4固体、固体废弃物污染及治理[本章重点]:1.分子、原子、元素、系统、环境、相、气体、等离子体等基本概念2.稀溶液的通性3. 晶体类型[本章难点]:1.稀溶液的通性2.过渡型晶体第二章化学反应原理[教学目的与要求]:明确焓变和内能的变化是不同过程中系统变化时总能量的改变,理解Qp,Qv,ΔrH,Δf H m(H2O),ΔrHθm等各符号的名称、意义,了解ΔG在化学反应中的意义,理解其作为反应自发性判据,理解ΔrHθm(T)≈ΔrHθm(298.15),ΔrSθm(T)≈ΔrSθm(298.15),掌握ΔrGθm(T), ΔrG(298.15), ΔrGm的计算方法。
任务驱动教学法在工科化学教学中的应用

任务驱动教学法在工科化学教学中的应用[摘要]任务驱动教学法是建构主义学习理论指导下的一种教学模式,它以学生为学习主体,倡导学生自主学习,以具体的任务为学习动力或动机,激发学生的学习兴趣,提高学生的思维能力和应用能力。
本文举例分析了任务驱动教学法在工科化学课教学过程的具体实践,并对任务驱动教学法教学存在的优缺点进行了探讨。
[关键词]任务设计工科化学任务驱动教学法[中图分类号]g424.1 [文献标识码]a随着化学学科研究范围的迅速扩展,当今诸多关键学科领域如基因、环境、信息、机械、新材料和新能源等的发展和创新,都越来越离不开化学知识的应用。
作为化学和这些学科的桥梁,面向非化工专业开设的工科化学课,在学生今后的专业学习和实际工作中具有非常重要的作用。
但有资料显示[1],44%的学生表示对学习“工科化学”目的性不明确,认为只是为了拿“学分”;对传统的“以教师为中心”、“满堂灌”的教学模式有57%的学生不满意。
针对这种现象,笔者在工科化学教学实践中,尝试应用任务驱动法教学,既激发了学生的学习兴趣,又让学生感受到了工科化学的真实用途,收到了良好的教学效果。
一、任务驱动教学法的探究任务驱动教学法[2]是指以具体的任务为学习动力或动机、以完成任务的过程为学习的过程、以展示任务成果的方式来体现教学成就的教学活动。
任务驱动教学法自20世纪80年代兴起以来,一直受到国内外许多学者和教师的关注,早期多用于语言教学,是一种实践性很强的、强调以学生为中心的、重视过程与互动的教学模式。
近几年来,众多学者和教师尝试在非语言教学领域使用任务教学法,并取得了较好的效果。
任务驱动法教学是一种基于建构主义理论的教学模式,它强调“在做中学”的理念。
它将所要学习的新知识隐含在一个或几个任务之中,学生在教师的帮助指导下,对老师提出的任务进行分析、讨论;通过感知、体验、实践等方式进行自主探究,从而找出解决问题的方法;通过相互协作完成一系列的任务,并通过任务的完成来实现对所学知识的意义建构。
2020年大学化学教案3篇

大学化学教案 3 篇1.蛋白质的三级结构概念:整条肽链中全部氨基酸残基的相对空间位置。
即肽链中所有原子在三维空间的排布位置。
主要次级键——疏水作用、离子键(盐键)、氢键、范德华力等。
结构域(domain):大分子蛋白质的三级结构常可分割成一个或数个球状或纤维状的区域,折迭得较为紧密,各行其功能,称为结构域。
分子伴侣:通过提供一个保护环境从而加速蛋白质折迭成天然构象或形成四级结构的一类蛋白质。
2.蛋白质的四级结构每条具有完整三级结构的多肽链,称为亚基(subunit)。
蛋白质分子中各亚基的空间排布及亚基接触部位的布局和相互作用,称为蛋白质的四级结构。
各亚基之间的结合力——疏水作用、氢键、离子键。
3.蛋白质的分类:根据组成分为单纯蛋白质和结合蛋白质,根据形状分为球状蛋白质和纤维状蛋白质。
4. 蛋白质组学基本概念:一种细胞或一种生物所表达的全部蛋白质,即“一种基因组所表达的全套蛋白质”。
1. 蛋白质一级结构与功能的关系一级结构是高级结构和功能的基础;一级结构相似其高级结构与功能也相似;氨基酸序列提供重要的生物进化信息;氨基酸序列改变可能引起疾病。
2. 蛋白质空间结构与功能的关系蛋白质的功能依赖特定空间结构;肌红蛋白的结构与功能。
血红蛋白结构、运输02功能,氧饱和曲线。
蛋白质构象改变可引起疾病如疯牛病等。
1.两性解离等电点:当蛋白质溶液处于某一pH时,蛋白质解离成正、负离子的趋势相等,即成为兼性离子,净电荷为零,此时溶液的pH 称为蛋白质的等电点。
2.胶体性质3.变性、复性、沉淀及凝固蛋白质的变性(denaturation) :在某些物理和化学因素作用下,蛋白质分子的特定空间构象被破坏,从而导致其理化性质改变和生物活性的丧失。
变性的本质:破坏非共价键和二硫键,不改变蛋白质的一级结构。
造成变性的因素:如加热、乙醇等有机溶剂、强酸、强碱、重金属离子及生物碱试剂等。
蛋白质变性后的性质改变:溶解度降低、粘度增加、结晶能力消失、生物活性丧失及易受蛋白酶水解。
工科化学与实验(金继红)第4章-习题及思考题答案

第四章溶液中的离子平衡
思考题:
1.酸碱质子理论的基本要点是什么
2.
答:1)酸给出质子后变成碱,碱接受质子后变成酸,酸是质子的给予体,碱是质子的接受体;2)酸=碱+质子,此式中右边的碱是左边的酸的共轭酸,左边的酸是右边的碱的共轭酸;3.)既能给出质子又能接受之子的物质是两性物质;4)酸碱中和的实质是质子的传递反应.
已知
(1)1.0×10−2mol Ba(NO)3和2.0×10−2mol NaF溶于1 dm3水中;
(2)0.50 dm3的1.4×10−2mol·dm−3CaCl2溶液与0.25 dm3的0.25 mol·dm−3Na2SO4溶液相混合。
解:(1)
有BaF2沉淀生成。
(2)
有CaSO4沉淀生成。
15.计算在0.020 mol·dm−3AlCl3溶液中AgCl的溶解度。
(7)外轨型配位化合物;
当配位原子的电负性较大,如卤素、氧等,它们不易给出孤对电子,对中心离子影响较小,使中心离子原有的电子层构型不变,仅用外层空轨道ns、np、nd杂化,生成数目相同、能量相等的杂化轨道与配体结合。这类配合物称外轨型配合物。如[Ag(NH3)2]+
(8)单齿配体与多齿配体
单齿配体:一个配体中只有一个配位原子;多齿配体:一个配体中有两个或两个以上的配位原子。
(4)配位体;
配体就是形成配位键时,提供电子对的一方。如[Co(NH3)6]SO4中的NH3
(5)配位数;
中心离子(原子)可以பைடு நூலகம்配位体形成配位键的数目称为配位数。如[Co(NH3)6]SO4配位数为6
(6)内轨型配位化合物;
当配位原子的电负性较小,如碳、氮等,较易给出孤对电子,对中心离子的影响较大,使其价电子层结构发生变化,(n-1)d轨道上的成单电子被强行配对,空出内层能量较低的(n-1)d轨道与n层的s、p轨道杂化,形成数目相同,能量相等的杂化轨道与配体结合。这类配合物称内轨型配合物。如[Fe(CN)6]4-
大学化学教材

大学化学教材1、大学化学/普通高等教育“十一五”国家级规划教材2、大学化学教程——高等学校教材3、新大学化学(第二版)4、大学化学——面向21世纪课程教材5、化学功能材料概论——高等学校教材6、新编普通化学/21世纪高等院校教材7、大学基础化学/高等学校教材8、大学化学9、大学化学10、大学普通化学(第六版)11、大学化学教程——21世纪高等院校教材12、大学化学13、化学实验教程——高等学校教材14、大学化学(高等学校教学用书)15、大学化学原理及应用(上下)/高等学校教材16、大学化学教程/高等学校教材17、大学基础化学/新世纪高职高专教材18、新大学化学19、大学化学原理及应用·上下册20、普通化学(英文版)21、近代高分子科学22、绿色化学与环境23、普通化学简明教程24、大学化学(第二版)——高等学校教材1、大学化学/普通高等教育“十一五”国家级规划教材•作者:金继红主编•丛书名:•出版社:化学工业出版社•ISBN:9787502597221•出版时间:2007-1-1•版次:1•印次:1•页数:403•字数:679000•纸张:胶版纸•包装:平装•开本:16开•定价:39 元当当价:30.6 元折扣:78折节省:8.40元钻石vip价:30.60 元••共有顾客评论0条内容提要本书为普通高等教育“十一五”国家级规划教材。
本书在编写过程中注意与中学化学的衔接,力求理论联系实际,概念阐述准确,深入浅出,循序渐进,便于教师教学和学生自学。
本书包括物质的聚集状态、热力学第一定律、热力学第二定律、相平衡、化学平衡、水溶液中的离子平衡(含酸碱滴定、重量分析)、氧化还原和电化学基础(含氧化—还原滴定)、原子结构、分子结构、晶体结构、配位化合物(含配位滴定)、单质和无机化合物、表面与胶体、环境化学及材料化学等内容。
本书可供高等学校非化学化工类专业对化学要求较多的材料、地质、能源、环境、冶金、海洋等专业的基础化学教学使用。
工科大学化学教学大纲

工科大学化学教学大纲课程名称:工科大学化学学分:13;总学时:216;实验学时:0先修课程要求:中学化学适应专业:化学教改班、冶金工程、环境工程使用教材:一课程的性质及任务化学学科的“四大化学”(无机化学、有机化学、分析化学、物理化学)原来独立设课,一些教学内容重复,课程之间衔接不够。
随着科学技术的迅速发展,新的化学知识内容不断增加,使得冶金、材料类专业对化学系列课程的要求越来越高。
在厚基础、宽口径的人才培养要求下,四门化学课程的总教学时数要压缩。
这些都迫使四门化学系列课程必须进行改革。
“工科大学化学”是化学系列课程经过重大改革后形成的“四大化学”融合的理论教学新课程,是冶金、材料、环境等专业工科人才培养重要的基础课程。
“工科大学化学”的教学目标,是培养学生具有初步的化学科学思维方法,进而具有获取和综合运用化学知识的能力,并为最终实现化学的“精神”——创新未来打下基础。
二课程的知识结构及教学内容三、课程的教学方法自工科大学化学成功申报为国家精品课程以来,课程组多次研究召开教学研讨会,并对教学内容进行了优化与更新,并主编了新的工科大学化学教材。
在此基础上,根据课程特点和教学重点、难点和教学体系的发展,改进教学方法,并根据教学内容的调整对教材的重点、难点及解决办法都有一点程度的改进和创新。
四.课程教学重点与难点(1)“理论化学”版块教学重点:1)掌握结构化学基础理论(含原子、分子、晶体和配合物的结构理论),能使用结构理论解释物质的基本性质。
2)掌握化学热力学基本概念,学会判断化学反应的方向和限度问题。
3)掌握化学动力学基本概念,学会分析化学反应的速率问题,并初步了解化学反应的机理。
4)应用化学热力学和化学动力学的理论,理解电解质溶液、可逆电池、表面与胶体化学的基本规律。
5)掌握并运用有机波谱基础知识。
教学难点:1)热力学基本概念抽象,函数计算推导复杂,应用条件的微小差别就有不同的计算公式,因此,公式繁多,易混淆,从而导致对化学热力学的理解难、计算难、应用难。
华南理工大学考试教材

华工和物化专业课共分为两批,分别是工科物化二和理科物化一,工科物化二最近已经不要求统计热力学内容参考书工科类(非化学类专业)教材:1. 葛华才,袁高清,彭程编. 立体化《物理化学》. 高等教育出版社,2008年下半年将由出版。
配套光盘内容含:教材题解,复习题要,2000-2008年历年研究生题解及本科生典型题解,模拟练习题等。
2. 天津大学物理化学教研室编,王正列,周亚平修订。
物理化学(上下册):第四版。
北京:高等教育出版社。
2001年。
主要教材。
理科类(化学专业)教材:1.南京大学化学化工学院傅献彩等编,物理化学:第五版(上,下册). 北京:高等教育出版社,2005,2006。
主教材实验教材1.华南理工大学物理化学教研室编。
物理化学实验。
广州:华南理工大学出版社,2003年。
主教材2. 复旦大学等编.《物理化学实验》。
北京:高等教育出版社,1993年下载地址:华南理工物化真题PDF及DOC下载好的话,请回个贴,呵呵~~~~/d/e68c5bc59ec0c0bc8ca006154b2bc2fdfac48a1deecb3600华南理工大学物化学习专貼(也有部分化原资料)前言:华工的化工专业这两年很火,难度高于大工,也不低于天大,所以报考时要小心,我认为华东理工的性价比很好,入学难度比较小。
所以我认为如果你想上华工,而且能拿到全免加补助最好奔向最少350分,甚至不少于380分的目标去,低于340分的有可能只是陪太子读书的角色,所以这个分数段的考生复试一定要付出更多努力。
个人意见:清华>中科院(大物所,上有机所)>浙大>天大>华工>大工>华理>北化和中石油>南工正题:华工和物化专业课共分为两批,分别是工科物化二和理科物化一,工科物化二最近已经不要求统计热力学内容。
在2005年以前个人认为无论是工科还是理科物化出题难度较小,而且风格不变,不适合考研这种选拔性的考试,但2006年以后,个人就无法把握规律了。
太原理工大学工科教学大纲_谢鲜梅_物理化学

《物理化学》课程教学大纲Physical Chemistry课程编号: 600155 学分数:6适用专业:化工工艺、制药工程、生物工程、材料化学总学时数:96 学时(理论课72 学时)执笔者:杨冬花编写日期:2008年2月一、课程的性质和目的物理化学是高等工业学校化学工程与工艺、制药工程、生物工程、材料化学专业的必修基础课。
本课程较为系统地讨论有关化学和与化学变化相关连的物理变化的各种基本原理和共同规律,使学生掌握物理化学的基本计算方法和基本实验能力,并为他们学习专业课程打下基础。
二、课程教学内容1.理论教学(72学时)第一章绪论和气体(4学时)了解物理化学的主要内容,特点及学习方法。
掌握物理量的标准化表示和运算。
理解学习物理化学的意义。
了解理想气体与实际气体的偏差,理解对应状态原理,并掌握压缩因子图的应用。
重点掌握:用解析法和图解法求各种气体的状态参数。
第二章热力学第一定律(8学时)理解系统、环境、状态、平衡态、状态函数、强度性质、广度性质、可逆过程等基本概念。
掌握功、热、热力学能、焓等的定义和相互关系,熟练应用热力学第一定律进行相关计算。
掌握单纯状态变化过程,相变化过程和化学变化过程状态函数和过程函数的计算。
掌握标准摩尔定容热容、标准摩尔定压热容、标准摩尔相变焓、标准摩尔生成焓、标准摩尔燃烧焓、基尔霍夫定律的定义和应用,重点掌握:热力学第一定律,焓、相变焓,热力学第一定律对理想气体的应用,反应焓,生成焓,燃烧焓,基尔霍夫定律。
第三章热力学第二定律(8学时)理解热力学第二、三定律经典表述的实质以及不同表述之间的关系,掌握通过计算内能、焓、熵、亥姆霍茨函数和吉布斯函数,判断各种过程变化方向和限度的方法,了解演绎法在化学热力学中的作用,并掌握有关热力学证明的方法。
重点掌握:热学力第二、三定律及熵判据,各类过程熵差的计算,亥姆霍兹自由能和吉布斯自由能,热力学基本方程及麦克斯韦关系式。
第四章溶液及相平衡(16学时)掌握理想稀溶液的两个经验定律以及稀溶液依数性的应用。
工科物理化学中思维导图应用的探索

工科物理化学中思维导图应用的探索摘要物理化学是化学最重要的基础学科之一,但学习效果不太理想。
思维导图的引入为物理化学的学习注入了新鲜活力。
首先从教师和学生两个层面分析了思维导图引入的必要性,接着在预习、学习过程中、课后复习和单元总结四个环节用具体的实例介绍了思维导图在工科物理化学中的应用。
以期在培养学生的学习兴趣、逻辑思维能力等方向取得一定的效果,培养适应时代发展的应用型人才。
关键词思维导图工科物理化学系统化物理化学是化学的最重要的基础学科之一,是化学、化工、材料、生化、制药、食品和环境等诸多专业学生必修的重要基础课,也是介于基础课与专业课之间承上启下的课程,在四大化学中,学生普遍反映该门课程是最难学的一门学科[1]。
由于学生的逻辑思维能力和知识水平存在一定的差异性,物理化学学习的效果不太理想,学生的学习成绩呈现两极分化的现象。
传统的教学手段已经不能满足现阶段的教学,改革势在必行。
近年来思维导图在大学课程中得到了广泛的关注,该方法在物理化学的学习中的应用也值得探究。
本文讨论将思维导图引入到工科物理化学的学习中,达到提高教学效果的目的。
在此抛砖引玉,以期共同推进物理化学教学的改革,同时降低物理化学学习的难度。
1思维导图的特点及其在物理化学学习中的重要性1.1 思维导图的特点思维导图,英文是The Mind Map,又叫心智导图,是20世纪60年代英国教育学家托尼﹒布赞首创的一种新型的思维模式[2]。
思维导图从一个主要概念开始,随着思维的不断深入,逐步建立一个有序、发散的图形。
目前,思维导图主要有圆圈图、气泡图、双重气泡图、树状图、括号图、桥状图、流程图、多重流程图这八种形式,可以根据相关知识来进行选择流程图的样式[3]。
同时运用思维导图可以将新知识的关键概念与头脑中已有的知识联系起来,让孤立的知识储存变成有系统的知识构建[4]。
思维导图的特点归纳如下:(1)重点突出。
将思维导图应用在物理化学中,往往把最重要的内容列在中央的位置,以此为中心点不断向两边或四个方向发散,形成完整的知识体系,重点内容也一目了然。
《分析化学实验》(一)课程实验教学大纲(工科).
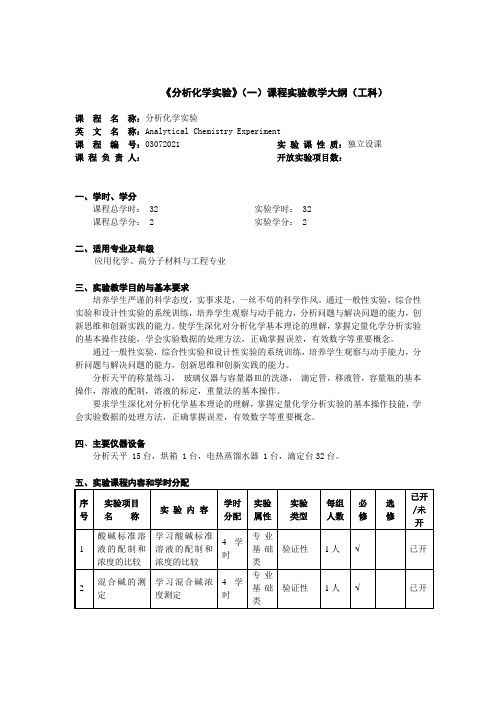
《分析化学实验》(一)课程实验教学大纲(工科)课程名称:分析化学实验英文名称:Analytical Chemistry Experiment课程编号:03072021实验课性质:独立设课课程负责人:开放实验项目数:一、学时、学分课程总学时: 32 实验学时: 32 课程总学分: 2 实验学分: 2二、适用专业及年级应用化学、高分子材料与工程专业三、实验教学目的与基本要求培养学生严谨的科学态度,实事求是,一丝不苟的科学作风。
通过一般性实验,综合性实验和设计性实验的系统训练,培养学生观察与动手能力,分析问题与解决问题的能力,创新思维和创新实践的能力。
使学生深化对分析化学基本理论的理解,掌握定量化学分析实验的基本操作技能,学会实验数据的处理方法,正确掌握误差,有效数字等重要概念。
通过一般性实验,综合性实验和设计性实验的系统训练,培养学生观察与动手能力,分析问题与解决问题的能力,创新思维和创新实践的能力。
分析天平的称量练习,玻璃仪器与容量器皿的洗涤,滴定管,移液管,容量瓶的基本操作,溶液的配制,溶液的标定,重量法的基本操作。
要求学生深化对分析化学基本理论的理解,掌握定量化学分析实验的基本操作技能,学会实验数据的处理方法,正确掌握误差,有效数字等重要概念。
四、主要仪器设备分析天平 15台,烘箱 1台,电热蒸馏水器 1台,滴定台32台。
五、实验课程内容和学时分配六、考核方式实验操作考核七、实验教材(讲义、指导书)、参考书(一)实验教材《分析化学实验》(第三版),四川大学化工学院浙江大学化学系编,北京:高等教育出版社、2003年(二)参考书1.同上2.同上修(制)订人:石慕尔审核人:陈慧娟 2006年 07 月(备注:表中选择“必修”、“选修”栏请用“√”表示)。
大学基础化学课件工科06化学热力学基础

fH m / kJ mol
1
H2O (l) -285.8
NaOH (s) -425.6
O2 (g) 0
-510.9
[ 4 (NaOH ,s ) 0 ( O ,g )] rH m fH m fH m 2 [ 2 (Na O ,s ) 2 ( H O ,l)] fH m 2 2 fH m 2 [ 4 ( 425 . 6 ) 0 ] [ 2 ( 510 .9 ) 2 ( 285 .8 )]
24
QV与Qp的关系
• 对于无气体参加的化学反应 W = – p外 V 0 QV = Qp
• 有气体参加的化学反应 QV = Qp – p外 V = Qp - n(g) RT Qp
25
2. 焓 (H) 和焓变 (H)
封闭系统的等压过程:
U = Qp – p 外 V
U2 – U1 = Qp – p外 (V2 – V1) U2 – U1 = Qp – (p2V2 – p1V1) Qp = (U2 + p2V2) – (U1 + p1V1)
1 H 1530 kJ mol r m
(90kJ· mol-1)
34
5. 热化学方程式
表示化学反应及其反应热关系的化学方程式
2H (g) O (g) 2H O(l) 2 2 2
1
Δ H (298.15K) 571.66 kJ mo r m
热化学方程式的书写:
广度性质:与物质的量有关,具有加和性
如:V、n、U、H、S、G 等 强度性质:与物质的量无关,不具有加和性 如:T、p、c、Vm、E等
强度=广度/广度
20
“新工科”背景下“工程化学”教学内容改革探索

“新工科”背景下“工程化学”教学内容改革探索随着时代的进步和科技的发展,工科教育也需要与时俱进。
在“新工科”背景下,工程化学教学内容的改革变得尤为重要。
本文将探索“新工科”背景下工程化学教学内容的改革。
注重实践教学。
工程化学是一门实践性很强的学科,学生需要通过实际操作来巩固和应用所学知识。
在教学中应该增加实践环节,如实验、项目实践等。
通过实践,学生可以了解和掌握化学原理、工程设计和操作等方面的知识和技能,提高他们解决实际工程问题的能力。
关注案例教学。
工程化学是一个非常实际的学科,与许多实际工程问题息息相关。
在教学中可以引入一些真实的工程案例,让学生通过分析和解决实际问题来学习化学知识。
通过案例教学,学生可以更好地理解理论知识的应用,培养他们的实际工程能力。
融入跨学科的教学内容。
在“新工科”背景下,“跨学科”成为了工科教育的一个重要特点。
工程化学作为交叉学科,应该与其他学科进行融合,培养学生的综合能力。
可以将工程化学与材料学、能源学等学科进行有机结合,探讨新材料的开发和能源的利用等问题。
通过跨学科的教学,学生可以更好地应对复杂的工程问题,有助于他们的综合应用能力的发展。
注重创新思维培养。
在“新工科”背景下,创新能力成为了工程人才的一项重要素质。
在工程化学教学中应该注重培养学生的创新思维。
可以引入一些开放性问题,鼓励学生进行探索与实践。
通过这种方式,可以培养学生的创新思维和解决问题的能力,为他们的未来工作做好准备。
“新工科”背景下的工程化学教学内容改革应该注重实践教学、案例教学、跨学科教学和创新思维培养。
通过这些改革,可以提高学生的实际工程能力和综合应用能力,培养更适应时代发展需求的工程人才。
工科必学知识点总结

工科必学知识点总结工科是一门综合性学科,涵盖了从数学、物理、化学到材料、机械、电子等多个领域的知识。
工科的学习需要掌握大量的基础知识和专业知识,下面将对工科必学的知识点进行总结。
数学是工科最基础的学科之一,掌握好数学知识是工科学习的基石。
数学中的微积分、线性代数、概率统计等知识点在工科中都有广泛的应用。
先来说说微积分,微积分是分析函数的变化规律的数学工具,包括导数、积分、微分方程等内容。
在工科中,微积分主要用来描述物理变化规律、工程问题的求解等。
线性代数是研究向量空间和线性变换的数学分支,它在工科中主要用来解决多元方程组、矩阵计算、特征值问题等。
概率统计是研究随机事件发生规律的数学分支,它在工科中主要应用于风险评估、质量控制、可靠性分析等方面。
物理学是工科的另一个基础学科,它是研究自然界中物质和能量相互转换的规律。
物理中的力学、电磁学、热学等内容在工科中有广泛的应用。
力学是研究物体运动和相互作用的学科,它包括静力学、动力学、静电学等内容,在工科中主要应用于工程力学、材料力学、流体力学等方面。
电磁学是研究电荷和电磁场相互作用的学科,它包括静电学、静磁学、电流电磁场等内容,在工科中主要应用于电路、电机、电力系统等方面。
热学是研究热量和温度变化规律的学科,它包括热力学、热传导、热辐射等内容,在工科中主要应用于热工流程、能源转换、制冷技术等方面。
工科的专业知识点涉及到材料、机械、电子等多个领域。
材料科学是研究材料性能和组织结构的学科,它在工科中主要涉及金属材料、非金属材料、复合材料等。
金属材料一般是指金属元素或金属合金,它们具有良好的导电、导热、强度等性能,在工科中广泛应用于结构件、电器元件等方面。
非金属材料包括陶瓷材料、聚合物材料、复合材料等,它们具有轻质、耐磨、耐腐蚀等特点,在工科中主要应用于航空航天、汽车工业、建筑材料等方面。
机械学是研究机械运动和力的学科,在工科中主要涉及静力学、动力学、振动学、机械设计等内容。
新工科背景下应用化学综合实验课程思政育人实践

新工科背景下应用化学综合实验课程思政育人实践
胡思江;王红强;彭继明;郑锋华;潘齐常;刘葵;李庆余
【期刊名称】《大学化学》
【年(卷),期】2024(39)2
【摘要】针对新工科理念和课程思政的要求,避免专业教育和思政教育“两张皮”的问题,从教材、课程教学和平台建设等方面介绍了新工科理念和课程思政在应用化学综合实验中的有机融合实践。
在前期课程教学基础和初步实践基础上,提出了建设配套教材、发挥线上线下教学、搭建校内科研与工程实践平台、拓展校外实践基地等具体的改革路径,将课程思政全方位融入教学活动中,构建了应用化学综合实验课程思政育人新体系,助力新工科背景下新兴应用型人才培养。
该实践可为其他实验课程开展新工科背景下课程思政改革提供参考。
【总页数】7页(P214-220)
【作者】胡思江;王红强;彭继明;郑锋华;潘齐常;刘葵;李庆余
【作者单位】广西师范大学化学与药学学院;桂林师范高等专科学校化学与药学系【正文语种】中文
【中图分类】G64;O6
【相关文献】
1.课程思政视阈下三全育人研究与实践
——以贺州学院应用化学专业为例2.新工科背景下给排水科学与工程专业课程思政育人模式实践3.“新工科”背景下大学物理实验教学中课程思政的探索与实践
4.“三全育人”背景下高校课程思政与思政课程协同育人路径研究
5.新农科背景下的《兽医公共卫生学》课程思政育人能力与实践
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1
T2V4
1
T1V1
1
二式相除
V3 / V4 V2 / V1
V2 V4 W Q1 Q2 nRT1 ln nRT2 ln V1 V3
W Q Q1 Q2 nRT1 ln
V2 V nRT2 ln 2 V1 V1
可逆的卡诺热机效率(Carnot efficiency):
W Q1 Q2 nR(T1 T2 ) ln( V2 / V1 ) Q1 Q1 nRT1 ln( V2 / V1 )
W Q1 Q2 T1 T2 Q1 Q1 T1
1+Q2/Q1=1-T2/T1
Q1/T1+Q2/T2=0
2014-8-10 8
Q1 Q2 0 T1 T2
2014-8-10
15
思考题
系统由相同的始态出发,分别经绝热可逆和绝热不可逆两条途 径,能否到达相同的终态?为什么?
思考题
1-3,4(1-3)
习题
1
2014-8-10
16
——隔离系统:与环境无任何能量的交换: S(隔)0 (过程能自发进行>0,可逆过程或平衡状态=0) 或 dS(隔)0 (过程能自发进行>0,可逆过程或平衡状态=0) 意义:在隔离系统中发生的不可逆过程一定是自发过程,它
2014-8-10
p1V1 p 2V2 T1 T2
此式有误
V2 p nCV ,m ln 2 V1 p1
23
T2 p nR ln 1 T1 p2
S nC p ,m ln
对于凝聚态(液态、固态)物质,当压力变化不太大时,有:
S
2
nCV ,m dT T
1
2
nC p ,m dT T
2014-8-10 1
3 .掌握亥姆霍兹函数和吉布斯函数的定义,了解 A 、 G 的物理意义,明确应用S、A、G作为过程方向和限度判据的 适用条件。
4.掌握单纯的p-V-T变化、相变化和化学变化过程中 S和 G的计算方法;明确fGm、fGm以及Sm、rSm的意义及其应 用。 5.掌握热力学基本方程、吉布斯——赫姆霍兹方程及其应
Cu
h2 T2 T=T2-T1 0
推动力 限度
h= h2- h1 0
待找
h= h2- h1 =0
复原方法
Wsurr
T=T2-T1 =0
Wsurr WsurrQ
p=p2-p1 =0
Wsurr WsurrQ
待找
Wsurr WsurrQ 3
后果
2014-8-10
WsurrQ
结论:
T2 ln T1
T2 S nCV ,m ln T1
式中T1为始态温度,T2为终态温度。
2014-8-10
22
3. p、V、T都改变的过程
将 Q dU W 代入 r S S 2 S1
S
2 1 2 dU 2 W dU Wr r 1 T 1 T T
(1) 在 T1 和 T2 两热源间工作的所有可逆热机效率必相等 , 与所用工 作物无关;
(2) 在 T1 和 T2 两热源间工作的所有热机中,可逆热机的效率最大。
推论:
在相同温度两热源间工作的所有可逆热机,其效率必相等;而在 相同温度两热源间工作的不可逆热机,其效率一定小于可逆热 机效率。即 Q1 Q2 T1 T2 r Q1 T1
求系统的熵变。假定过程是:(1)可逆膨胀;(2)自由膨胀。 解:(1)
V2 S nR ln 1mol 8.314 J K 1 mol 1 ln 10 19.14 J K 1 V1
(2)因始末态同(1),S是状态函数,故S=19.14JK-1
2014-8-10 20
S dS Qr / T
1 1 2 2
2014-8-10
12
说明 ——熵S的物理意义:系统混乱程度的度量
玻尔兹曼公式: S=kln k=R/L——玻尔兹曼常数 ——热力学几率(微观状态数) 故一般,S(固)<S(液) < S(气) ——熵是系统的容量性质;单位:J· K-1; 2002年11月25日(41-42)
用。 6.掌握偏摩尔量和化学势的物理意义,明确化学势的各种 表达式,了解逸度、活度及标准态的概念,明确化学势在处理 平衡问题和研究多组分系统性质中的作用。 7.了解稀溶液的依数性。
2014-8-10
2
自发过程(无它物影响而可自动发生的过程)的共同特征:
A、水的流动 h1 B、热的传导 T1 C、气体膨胀 p1 p2 p=p2-p1 0 D、化学反应 2H2+O2=2H2O
ΔS为正值,并不意味着过程不可逆,因它不是孤立系统。考虑环境 熵变: 对(1) Qr V2 S 环 nRT ln nR ln 10 19.14 J K 1 T V1 (ΔS)孤=(ΔS)系+(ΔS)环=19.14J· K-1-19.14J· K-1=0 该过程是可逆过程。 (2)在自由膨胀中,系统与环境没有热交换,Q=0,所以环境的 熵变等于零,孤立系统的总熵变: (ΔS)孤=19.14 J· K-1 >0 自发(不可逆)过程。
2014-8-10
5
6.1.1 热机效率(efficiency of the heat engine) 定义:
W Q1 Q2 Q1 Q1
Q1——系统从高温热源吸热 (Q1>0); W——系统对环境做功 (W<0); Q2——系统向低温热源放热 (Q2<0); 一个循环后,ΔU=Q1+Q2+W=0
2014-8-10
14
S= S 2 S1 Q / T 12
dS
Q
T
2 1
(不可逆过程>,可逆过程=)
S
Q (不可逆过程>,可逆过程=) T
讨论 ——绝热过程,
S0(不可逆过程>0,可逆过程=0) ——意义:在可逆绝热过程中,系统的熵不变;在不可逆绝热 过程中,系统的熵增加,绝热系统不可能发生ΔS<0的变化。
使系统熵值增大;隔离系统中的可逆过程意即系统达到了平衡状态; 在隔离系统中不可能发生熵值减小的过程。——熵增原理
(principle of entropy increasing)。可用隔离系统的熵变的符号作为过 程方向与限度的判据——熵判据。 S(隔)=0过程达平衡 S2 S3
S(隔)>0过程自发
2
Qr
T
1
如果系统是理想气体且不做非体积功,则不论什么过程,均有:
S
2
nCV ,m dT T
1
V2
V1
如果CV,m不随温度而改变,则有
T2 V2 S nCV ,m ln nR ln T1 V1
nRdV V
代 CV ,m R C p ,m 入上式,且
则有
S nC p ,m ln
Q
2014-8-10
r
/T 0
Q
r
/T 0
11
Q
熵变S的定义
一函数的全微分。就是说,ห้องสมุดไป่ตู้Qr
def
r
/T 0
按积分定理,若沿封闭曲线的环积分为零,被积分的变量应为某
/T
为某一函数的全微分,用S表
示这一函数,可以定义为S的全微分,即
dS Qr / T
第六章 热力学第二定律
本章要求
本章以过程的方向和限度为主线,讨论热力学第二定律的基 本内容。通过本章的学习,对热力学的方法及其特点应有一个较 为全面的了解,为解决各类平衡问题奠定理论基础。 本章学习的主要要求为: 1.了解自发过程的共同特征,热力学第二、第三定律的文字 表述。 2.掌握熵函数的概念:熵的引入、定义和熵增原理的本质, 能熟练地应用克劳修斯不等式。
S1
2014-8-10 17
使用熵判据适用的条件:隔离系统。
对非隔离系统:将系统与环境合并为一个大的隔离系统,
分别求出原系统和原环境的熵变,其和即为该大的隔离系统的 熵变:
S 隔 S 系 S 环 0
(自发过程>0,平衡状态=0)
dS 隔 dS 系 dS 环 0 (自发过程>0,平衡状态=0) Q dS 环 或 S=Q/T(环) T环
S
2
Qr
T
1
Qr T
2014-8-10
19
若系统是理想气体,则因等温过程U=0,故:
Qr Wr pdV nRT ln
V1 V2
V2 V1
V2 p1 S nR ln nR ln V1 p2
W
此式有误
例6.1 1 mol理想气体在298 .15K时等温膨胀,体积增大至 10倍,
习题 2,4,52002年11月29日(43-44)
2014-8-10
18
§6.4 熵变的计算
基本公式:
S S 2 S1
2
Qr
T
1
不论过程是否可逆,都必须通过可逆过程的热温商来计算熵变。 如果过程不可逆,应设计一个与不可逆过程始态、终态相同的可逆 过程来计算,因为熵是状态函数,其变化只由始态、终态决定,与 途径无关。
6.4.1 简单状态变化 1. 等温过程:
2014-8-10
13
6.3.2 克劳修斯不等式与熵增原理 克劳修斯不等式
由卡诺定理证明此卡诺不可逆循环的热温商之和小于零。即
Q 0 T 不可逆
Q1
T1
Q2
T2
0
1 Q Q 2 r 0 T 12 T
