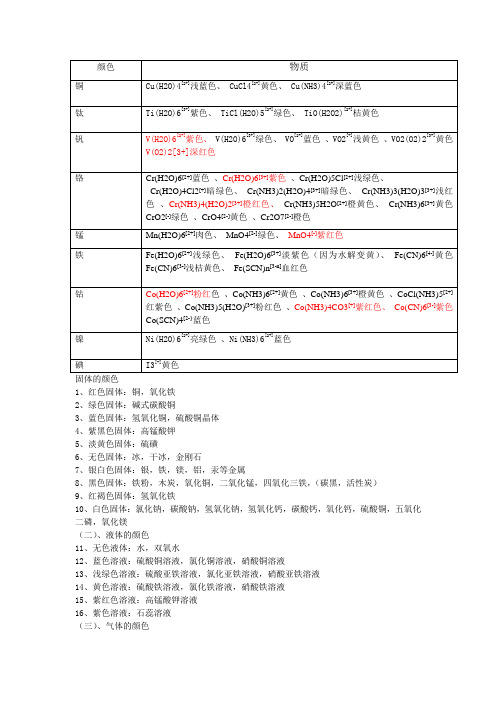
几种有颜色的离子
各种离子的颜色

固体的颜色
1、红色固体:铜,氧化铁
2、绿色固体:碱式碳酸铜
3、蓝色固体:氢氧化铜,硫酸铜晶体
4、紫黑色固体:高锰酸钾
5、淡黄色固体:硫磺
6、无色固体:冰,干冰,金刚石
7、银白色固体:银,铁,镁,铝,汞等金属
8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)
9、红褐色固体:氢氧化铁
10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁(二)、液体的颜色
11、无色液体:水,双氧水
12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液
13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液
14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液
15、紫红色溶液:高锰酸钾溶液
16、紫色溶液:石蕊溶液
(三)、气体的颜色
17、红棕色气体:二氧化氮
18、黄绿色气体:氯气
19、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体。
各种离子的颜色
1、红色固体:铜,氧化铁
2、绿色固体:碱式碳酸铜
3、蓝色固体:氢氧化铜,硫酸铜晶体
4、紫黑色固体:高锰酸钾
5、淡黄色固体:硫磺
6、无色固体:冰,干冰,金刚石
7、银白色固体:银,铁,镁,铝,汞等金属
8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)
9、红褐色固体:氢氧化铁
10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁
(二)、液体的颜色
11、无色液体:水,双氧水
12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液
13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液
14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液
15、紫红色溶液:高锰酸钾溶液
16、紫色溶液:石蕊溶液
(三)、气体的颜色
17、红棕色气体:二氧化氮
18、黄绿色气体:氯气
19、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体。
二、初中化学溶液的酸碱性
1、显酸性的溶液:酸溶液和某些盐溶液(硫酸氢钠、硫酸氢钾等)
2、显碱性的溶液:碱溶液和某些盐溶液(碳酸钠、碳酸氢钠等)
3、显中性的溶液:水和大多数的盐溶液
常见离子的颜色

常见离子的颜色
铜离子Cu2+:蓝色
亚铁离子Fe2+:浅绿色
铁离子Fe3+:黄色
高锰酸根离子MnO4-:深紫色
锰离子Mn2+:淡粉色
常见物质的颜色
多数气体为无色,多数固体化合物为白色,多数溶液为无色。
一些特殊物质的颜色:
黑色:MnO2、CuO、FeO、Fe3O4、C、FeS(硫化亚铁)
蓝色:CuSO4•5H2O、Cu(OH)2、CuCO3、含Cu2+ 溶液、
液态固态O2(淡蓝色)
红色:Cu(亮红色)、Fe2O3(红棕色)、红磷(暗红色)、Fe2O3(棕红色)、
Fe(OH)3 (红褐色)、[Fe(SCN)]2+(血红)、Br2水(红棕)、NO2(红棕)黄色: S(淡黄)、Agl(黄色)、、Na2O2(淡黄色)、AgBr(浅黄)、FeCl3(棕黄)、 I2水(棕黄色)、Cl2(黄绿色)含Fe3+ 的溶液(棕黄色)
绿色:FeSO4•7H2O、碱式碳酸铜[Cu2(OH)2CO3] 、含Fe2+ 的溶液(浅绿色)
紫色:KMnO4溶液(MnO4-紫色)、I2(紫黑色)
无色气体:N2、CO2、CO、O2、H2、CH4
有色气体:Cl2(黄绿色)、NO2(红棕色)有刺激性气味的气体:NH3(此气体可使湿润pH试纸变蓝色)、SO2
有臭鸡蛋气味:H2S
常见一些变化的判断:
①白色沉淀且不溶于稀硝酸或酸的物质有:BaSO4、AgCl(就这两种物质)
②蓝色沉淀:Cu(OH)2、CuCO3
③红褐色沉淀:Fe(OH)3 Fe(OH)2为白色絮状沉淀,但在空气中很快变成灰绿色沉
淀,再变成Fe(OH)3红褐色沉淀
④沉淀能溶于酸并且有气体(CO2)放出的:不溶的碳酸盐
常见离子和化合物的颜色

常见离子和化合物的颜色
一、常见离子的颜色
【无色阳离子】
Ag+,K+,Ca2+,Pb2+,Zn2+,Na+,NH4+,Ba2+,Hg2+,Mg2+,Al3+,Sn2+,Sn4+。
【有色阳离子】
Mn2+浅玫瑰色,稀溶液无色;[Fe(H2O)6]3+淡紫色,常见含Fe3+溶液为黄色;Fe2+浅绿色,稀溶液无色;Cr3+绿色或紫色;Co2+玫瑰色或粉红色;Ni2+绿色;Cu2+(实际上是[Cu(H2O)4]2+)蓝色;[Cu(NH3)4]2+深蓝色。
【无色阴离子】
SO42–,PO43–,F–,SCN–,C2O42–,SO32–,Cl–,NO3–,S2–,Br–,NO2–,ClO3–,CO32–,SiO32–,I–,CH3COO–,BrO3–。
【有色阴离子】
Cr2O72–橙色;CrO42–黄色;MnO4–紫色;MnO42–墨绿色;[Fe(CN)6]4–黄绿色;[Fe(CN)6]3–黄棕色;[CuCl4]2–黄色。
二、有特征颜色的常见化合物
【红色】
甲基橙在pH ≤ 3. 1的环境中,石蕊在pH ≤ 5. 0的环境中,酚酞在pH ≤ 10. 0的环境中,NO2(红棕),Br2(g)(红棕),Br2(l)(深红棕),Fe2O3(红棕),Cu2O(砖红),HgO,Pb3O4,硫氰合铁配合物系列,Fe(OH)3(红褐),Cu(紫红),品红,红磷(暗红),MnSO4 · 7H2O等锰盐(粉红),苯酚在空气中的氧化产物(粉红)。
【橙色】
溴水,重铬酸盐,甲基橙在3. 1 < pH < 4. 4的环境中,氯金酸。
高中化学涉及到的一些离子的颜色

高中化学涉及到的一些离子的颜色
带颜色的离子:
高锰酸根:紫色
锰酸根:墨绿色
重铬酸根:橙红色
铬酸根:柠檬黄色
Cu2+:蓝色/绿色
Fe3+:黄褐色
Fe2+:淡绿色
Ni2+:绿色
Cr3+:绿色/蓝色
Mn2+:淡粉色
Co2+:粉红色
[Fe(SCN)6]3-:血红色
苯酚合铁络离子:紫堇色
以下是一些物质的颜色:
黄色:
AgI、Ag3PO4、P4(黄磷)、溴水(黄--橙)、FeS2、Al2S3、甲基橙在弱酸性、中性或碱性环境中、某些蛋白质加硝酸。
淡黄色:
S、Na2O2、T N T、PCl5、AgBr、浓HNO3(混有NO2)、浓HCl(混有Fe3+)、硝基苯(溶有NO2)。
灰黄色:Mg3N2
棕黄色:
FeCL3溶液、碘水(深黄--褐)
黑色:
CuS、Ag2S、Cu2S、PbS、HgS(黑色或红色)、FeS、FeO、Fe3O4、MnO2、CuO、Ag2O、I2(紫黑)、Si(灰黑)、C、Ag、KMnO4(紫黑)、石油
绿色:
CuCl2溶液、Cu2(OH)2CO3、FeSO4/7H2O(浅绿)、F2(浅黄绿)、Cl2(黄绿)、氯水(浅黄绿)
红色:
CuO、Cu、Fe(SCN)2+、甲基橙在酸性环境中、紫色石蕊试液在酸性环境中、酚酞在碱性环境中、品红试液、红磷(暗红)、Br2(深红棕)、Br2在CCl4溶液中(紫红)、苯酚被空气氧化(粉红)
棕色:
固体FeCl3、固体CuCl2、NO2(红棕)、Fe2O3(红棕)
紫色:
KMnO4溶液、I2在CCl4溶液中
灰色:
As、Sn、Fe3C
褐色:
碘酒、2Fe2O3/3H2O、Fe(OH)3(红褐)
常见离子及沉淀的颜色

常见离子及沉淀的颜色
作者:一介书生来源:站长原创发布日期:2009-9-14 点击次数: 1539
1、水溶液中常见离子的颜色
①无色阳离子:
H+、Ag+、K+、Na+、NH4+、Cu+、Mg2+、Sr2+、Ba2+、Zn2+、Cd2+、
Hg+、Hg2+、Sn2+、Sn4+、Al3+
②无色阴离子:
SO3 2-、SO42-、S2O32-、CO32-、SiO32-、S2-、Cl-、F-、Br-、I-、NO3-、
PO43-、HPO42-、ClO-、SCN-、CN-、OH-、CH3COO-、C2O42-
③有颜色的阳离子:
Mn2+浅玫瑰色
Co2+粉红色
Fe2+ 浅绿色
Ni2+亮绿色
Fe3+黄色或棕色(水合离子)
Cu2+ 蓝色(稀)绿色(浓)
[Cu(NH)] 2+深蓝色
④有颜色的阴离子:
MnO4-紫色,紫红色
MnO42-绿色
[Fe(CN)6]4-黄色
[Fe(CN)6]3-红色
2、几种常见沉淀的颜色
①白色沉淀:
AgCl 、 PbCl2、Ag2SO4、CaSO4、BaSO4、BaSO3、 CaCO3、CaSO3、Mg(OH)2
ZnCO3、MgCO3、Zn(OH)2、Al(OH)3、ZnS、Fe(OH)2
②黑色沉淀:
Ag2S 、FeS 、Fe2S3、PbS 、CuS 、Hg2S
③黄色沉淀:
AgBr(浅黄色)、AgI 、Ag3PO4、CdS 、Ag2CO3(浅黄色)
④其它颜色沉淀:
MnS 肉红色
Cu(OH)2蓝色Fe(OH)3红褐色HgS 红色FeS2黄色
金属离子颜色

金属离子颜色
答:金属离子颜色有铜离子(蓝色)、亚铁离子(浅绿色)、锰离子(浅粉色)、高锰酸根离子(紫红色)、镉离子(蓝绿色)。
1、铜离子
通常显蓝色,铜离子Cu2+在水溶液中实际上是以水合离子的形式存在的,水合铜离子呈蓝色,所以我们常见的铜盐溶液大多呈蓝色。
2、亚铁离子
亚铁离子浅绿色,金属阳离子,离子符号Fe2+。一般呈浅绿色,有较强的还原性。
3、锰离子
锰离子浅粉色,是细胞中许多酶的活化剂,缺绿会在嫩叶中或老叶中出现,依植物种类和生长速率决定。
4、镉离子
镉离子蓝绿色,它是一种吸收中子的优良金属,制成棒条可在核反应堆内减缓链式裂变反应速率,而且在锌-镉电池中颇为有用。
5、高锰酸根离子
MnO4是锰酸根或高锰酸根,颜色为高锰酸根紫红色,化合价为高锰酸根化合价-1,锰酸根-2。
各种离子的颜色

所有金属离子都有的。下面的供你参考:
.红色Fe(SCN)]2+(血红色);Cu2O(砖红色);Fe2O3(红棕色);红磷(红棕色);液溴(深红棕色);Fe(OH)3(红褐色);I2的CCl4溶液(紫红色);MnO4-(紫红色);Cu(紫红色);在空气中久置的苯酚(粉红色).
2.橙色:溴水;K2Cr2O7溶液.
3.黄色:AgI(黄色);AgBr(浅黄色);K2CrO4(黄色);Na2O2(淡黄色);S(黄色);FeS2(黄色);久置浓HNO3(溶有NO2);工业浓盐酸(含Fe3+);Fe3+水溶液(黄色);久置的KI溶液(被氧化成I2)
4.绿色:Cu2(OH)CO3;Fe2+的水溶液;FeSO4.7H2O;Cl2(黄绿色);F2(淡黄绿色);Cr2O3
5.蓝色:Cu(OH)2;CuSO4.5H2O;Cu2+的水溶液;I2与淀粉的混合物.
6.紫色:KMnO4(紫黑色);I2(紫黑色);石蕊(pH=8--10);Fe3+与苯酚的混合物.
7.黑色:FeO,Fe3O4,FeS,CuS,Cu2S,Ag2S,PbS,CuO,MnO2,C粉.
8.白色:Fe(OH)2,AgOH,无水
CuSO4,Na2O,Na2CO3,NaHCO3,AgCl,BaSO4,CaCO3,CaSO3,Mg(OH)2,
Al(OH)3,三溴苯酚,MgO,MgCO3,绝大部分金属等.
一、单质绝大多数单质:银白色。
Cu 紫红O2 无Au 黄S 黄B 黄或黑F2 淡黄绿C(石墨黑Cl2 黄绿C(金刚石)无Br2 红棕Si 灰黑I2 紫黑H2 无稀有气体无P 白、黄、红棕。
常见离子的颜色

常见离子的颜色
铜离子Cu2+:蓝色
亚铁离子Fe2+:浅绿色
铁离子Fe3+:黄色
高锰酸根离子MnO4-:深紫色
锰离子Mn2+:淡粉色
常见物质的颜色
多数气体为无色,多数固体化合物为白色,多数溶液为无色。
一些特殊物质的颜色:
黑色:MnO2、CuO、FeO、Fe3O4、C、FeS(硫化亚铁)
蓝色:CuSO4?5H2O、Cu(OH)2、CuCO3、含Cu2+溶液、
液态固态O2(淡蓝色)
红色:Cu(亮红色)、Fe2O3(红棕色)、红磷(暗红色)、Fe2O3(棕红色)、
Fe(OH)3(红褐色)、[Fe(SCN)]2+(血红)、Br2水(红棕)、NO2(红棕)
黄色:S(淡黄)、Agl(黄色)、、Na2O2(淡黄色)、AgBr(浅黄)、FeCl3(棕黄)、I2水(棕黄色)、Cl2(黄绿色)含Fe3+的溶液(棕黄色)
绿色:FeSO4?7H2O、碱式碳酸铜[Cu2(OH)2CO3]、含Fe2+的溶液(浅绿色)
紫色:KMnO4溶液(MnO4-紫色)、I2(紫黑色)
无色气体:N2、CO2、CO、O2、H2、CH4
有色气体:Cl2(黄绿色)、NO2(红棕色)
有刺激性气味的气体:NH3(此气体可使湿润pH试纸变蓝色)、SO2有臭鸡蛋气味:H2S
常见一些变化的判断:
①白色沉淀且不溶于稀硝酸或酸的物质有:BaSO4、AgCl(就这两种物质)
②蓝色沉淀:Cu(OH)2、CuCO3
③红褐色沉淀:Fe(OH)3Fe(OH)2为白色絮状沉淀,但在空气中很快变成灰绿色沉淀,
再变成Fe(OH)3红褐色沉淀
④沉淀能溶于酸并且有气体(CO2)放出的:不溶的碳酸盐
常见离子的颜色

常见离子的颜色常见离子及颜色如下:
1、高锰酸根离子MnO₄⁻:紫色
2、锰酸根离子MnO₄²⁻:绿色
3、铬酸根离子CrO₄²⁻:黄色
4、重铬酸根离子Cr₂ O₇²⁻:橙色
5、铜离子Cu ²⁺:蓝色
6、亚铜离子Cu⁺:红色
7、铁离子Fe ³⁺:褐色
8、亚铁离子Fe²⁺:淡绿色
9、亚钴离子Co ²⁺:粉红色
10、锰离子Mn ²⁺:淡粉红色
11、溴离子Br⁻:淡黄色
各种离子在溶液中的颜色

各种离子在溶液中的颜色
1.铁离子:Fe2+在水溶液中呈现绿色或蓝绿色,而Fe3+则呈现黄色或橙色。
2. 铜离子:Cu2+在水溶液中呈现蓝色。
3. 锰离子:Mn2+在水溶液中呈现粉红色。
4. 镉离子:Cd2+在水溶液中呈现无色。
5. 银离子:Ag+在水溶液中呈现白色。
6. 铅离子:Pb2+在水溶液中呈现白色。
7. 铬离子:Cr3+在水溶液中呈现绿色。
以上是一些常见离子在水溶液中的颜色。这些颜色可以用于化学实验和分析中,例如确定未知物质中是否含有某种离子。
- 1 -
常见离子的颜色

常见离子的颜色
铜离子Cu2+:蓝色
亚铁离子Fe2+:浅绿色
铁离子Fe3+:黄色
高锰酸根离子MnO4-:深紫色
锰离子Mn2+:淡粉色
常见物质的颜色
多数气体为无色,多数固体化合物为白色,多数溶液为无色。
一些特殊物质的颜色:
黑色:MnO2、CuO、FeO、Fe3O4、C、FeS(硫化亚铁)
蓝色:CuSO4•5H2O、Cu(OH)2、CuCO3、含Cu2+ 溶液、
液态固态O2(淡蓝色)
红色:Cu(亮红色)、Fe2O3(红棕色)、红磷(暗红色)、Fe2O3(棕红色)、
Fe(OH)3 (红褐色)、[Fe(SCN)]2+(血红)、Br2水(红棕)、NO2(红棕)黄色: S(淡黄)、Agl(黄色)、、Na2O2(淡黄色)、AgBr(浅黄)、FeCl3(棕黄)、 I2水(棕黄色)、Cl2(黄绿色)含Fe3+ 的溶液(棕黄色)
绿色:FeSO4•7H2O、碱式碳酸铜[Cu2(OH)2CO3] 、含Fe2+ 的溶液(浅绿色)
紫色:KMnO4溶液(MnO4-紫色)、I2(紫黑色)
无色气体:N2、CO2、CO、O2、H2、CH4
有色气体:Cl2(黄绿色)、NO2(红棕色)
有刺激性气味的气体:NH3(此气体可使湿润pH试纸变蓝色)、SO2
有臭鸡蛋气味:H2S
常见一些变化的判断:
①白色沉淀且不溶于稀硝酸或酸的物质有:BaSO4、AgCl(就这两种物质)
②蓝色沉淀:Cu(OH)2、CuCO3
③红褐色沉淀:Fe(OH)3 Fe(OH)2为白色絮状沉淀,但在空气中很快变成灰绿色沉
淀,再变成Fe(OH)3红褐色沉淀
④沉淀能溶于酸并且有气体(CO2)放出的:不溶的碳酸盐
各种离子的颜色

.红色Fe(SCN)]2+(血红色);Cu2O(砖红色);Fe2O3(红棕色);红磷(红棕色);液溴(深红棕色);Fe(OH)3(红褐色);I2的CCl4溶液(紫红色);MnO4-(紫红色);Cu(紫红色);在空气中久置的苯酚(粉红色).
2.橙色:溴水;K2Cr2O7溶液.
3.黄色:AgI(黄色);AgBr(浅黄色);K2CrO4(黄色);Na2O2(淡黄色);S(黄色);FeS2(黄色);久置浓HNO3(溶有NO2);工业浓盐酸(含Fe3+);Fe3+水溶液(黄色);久置的KI溶液(被氧化成I2)
4.绿色:Cu2(OH)CO3;Fe2+的水溶液;FeSO4.7H2O;Cl2(黄绿色);F2(淡黄绿色);Cr2O3
5.蓝色:Cu(OH)2;CuSO4.5H2O;Cu2+的水溶液;I2与淀粉的混合物.
6.紫色:KMnO4(紫黑色);I2(紫黑色);石蕊(pH=8--10);Fe3+与苯酚的混合物.
7.黑色:FeO,Fe3O4,FeS,CuS,Cu2S,Ag2S,PbS,CuO,MnO2,C粉.
8.白色:Fe(OH)2,AgOH,无水CuSO4,Na2O,Na2CO3,NaHCO3,AgCl,BaSO4,CaCO3,CaSO3,Mg(OH)2,
Al(OH)3,三溴苯酚,MgO,MgCO3,绝大部分金属等.
一、单质绝大多数单质:银白色。
Cu 紫红O2 无Au 黄S 黄B 黄或黑F2 淡黄绿C(石墨黑Cl2 黄绿C(金刚石)无Br2 红棕Si 灰黑I2 紫黑H2 无稀有气体无P 白、黄、红棕。
各种离子在溶液中的颜色

各种离子在溶液中的颜色
离子在溶液中的颜色是由其分子结构和化学性质决定的,不同的离子具有不同的颜色。本文将介绍一些常见离子在溶液中的颜色。
1. Fe3+离子:在溶液中呈现深红色。
3. Ag+离子:在溶液中呈现白色,但浓度较高时也能呈现淡黄色。
综上所述,不同离子在溶液中呈现的颜色是因其自身特性及其与水分子间的相互作用
发生的,我们可以通过这些颜色来判断化学反应中离子的状态及变化。
常见离子的颜色

绿色:FeSO4?7H2O、碱式碳酸铜[Cu2(OH)2CO3] 、含Fe2+ 的溶液(浅绿色)
紫色:KMnO4溶液(MnO4-紫色)、I2(紫黑色)
无色气体:N2、CO2、CO、O2、H2、CH4
有色气体:Cl2(黄绿色)、NO2(红棕色)
金属离子的颜色

金属离子的颜色。
答案:1、铜离子,蓝色,含有铜离子的溶液呈现蓝色;
2、亚铁离子,浅绿色,在溶液中,加入NaOH溶液,产生白色胶状沉淀,迅速变成绿色;
3、铁离子,黄色,在溶液中呈现黄色;
4、钠离子,呈现黄色,焰色反应,火焰颜色呈黄色;
5、钾离子,呈现紫色,焰色反应,火焰透过蓝色钴玻璃颜色呈紫色。
