注射用利福霉素钠工艺规程
注射剂的制备工艺流程备课讲稿

注射剂的制备工艺流程1.配制配液应在洁净区内进行。
配液方法通常有稀配法和浓配法两种,根据产品的不同要求,将原料加入溶剂中一次配成注射剂所规定的浓度,或将全部原料加入部分溶剂中,配成浓溶液,加热滤过后再加溶剂至全量。
提高注射剂的澄明度和稳定性的措施:(1)热处理冷藏,即将配制的注射液加热至950℃以上30分钟后冷藏,使杂质呈胶体分散状态的沉淀而除去。
(2)活性炭处理使用0.1%~1.0%的经150℃干燥活化3~4h的针用活性炭与药液同煮至沸,稍冷后过滤;使用时应注意活性炭对有效成分的影响。
加入附加剂,如抗氧剂、止痛剂和pH调节剂等。
2.滤过(1)初滤常用的滤材有滤纸、绸布、纸浆、滤板等。
常用的滤器有布氏漏斗、砂滤棒、板框压滤机等。
(2)精滤常用滤器有垂熔玻璃滤器(球、棒)、微孔滤膜滤器及超滤器等。
其中,G3、G4垂熔玻璃滤器一般用于加压或减压过滤,G6垂熔玻璃滤器可用于滤过除菌;0.22μm以下的微孔滤膜可用于无菌过滤。
(3)常用的滤过方式有减压过滤及加压滤过。
3.灌封灌封包括药液灌注和安瓿熔封,这两步应在同一室中进行。
灌封有手工和机械两种灌封操作,大生产常用自动安瓿灌封机。
(1)灌注①应做到剂量准确。
②灌装药液尽量不要使灌注针头与安瓿颈内壁碰撞,以免爆裂或产生焦头。
③接触空气易变质的药物,在灌装过程中,应排除容器内空气,可填充二氧化碳或氮等气体,并立即用适宜的方法熔封或严封。
(2)熔封安瓿的熔封应严密,无缝隙,不漏气,颈端应圆整光滑,无尖头及小泡。
4.灭菌和检漏(1)灭菌注射剂熔封或严封后,一般应根据药物性质选用适宜的方法和条件及时灭菌,以保证制成品无菌。
中药注射剂多采用流通蒸汽或煮沸灭菌(100℃,30~45分钟),容量较大的可酌情延长灭菌时间。
(2)检漏注射剂在灭菌时或灭菌后,应采用减压法或其他适宜的方法进行容器检漏。
目的是将熔封不严的注射剂剔除。
5.印字与包装注射剂经质量检查各项目合格后方可印字、包装。
一种利福霉素钠的生产工艺-概述说明以及解释

一种利福霉素钠的生产工艺-概述说明以及解释1.引言1.1 概述概述利福霉素钠是一种重要的抗生素药物,广泛应用于临床治疗中。
本文旨在介绍利福霉素钠的生产工艺,详细探讨关键工艺要点,以期为相关领域的研究和生产提供参考。
利福霉素钠是一种通过发酵生产的药物,其生产工艺涉及多个关键步骤和环节。
本文将从以下几个方面进行分析和介绍:原料的选择与处理、发酵过程的控制、药物的提取与纯化、最终的制剂制备等。
首先,在原料的选择与处理方面,生产过程中所使用的原料需要经过严格的筛选和处理。
其中,发酵菌株的选择至关重要,只有选用了优良菌株,才能确保产生高效的利福霉素钠。
此外,发酵培养基的组成和配比也需要精细调控,以提供菌株生长所需的养分和环境。
其次,发酵过程的控制是生产工艺中的关键步骤之一。
通过恰当地控制发酵温度、pH值、氧气供应以及搅拌速度等参数,可以有效提高利福霉素钠的产量和质量。
此外,对于发酵过程中的副产物或杂质的控制也需要进行相应的研究和优化。
再次,在药物的提取与纯化方面,常用的方法包括溶剂萃取、离子交换、凝胶过滤等。
这些方法需要综合考虑药物产率、纯度以及反应过程的可操作性等因素,在实践中进行合理选择。
最后,经过前期的工艺研究和实验验证,利福霉素钠的制剂制备阶段是将药物转化为可供临床使用的最终制品。
这其中,药物的配方设计、制剂工艺的优化以及生产工艺的规模化等都是需要充分考虑的。
综上所述,本文将对利福霉素钠的生产工艺进行详细阐述,重点介绍各个环节的关键要点与技术措施。
通过对这些关键问题的深入研究,有望进一步优化利福霉素钠的生产工艺,提高药物产量和质量,为临床治疗提供更好的药物资源。
文章结构部分的内容可以写成以下的形式:1.2 文章结构本文共分为引言、正文和结论三个部分。
每个部分的内容安排如下:引言部分包括概述、文章结构和目的。
在概述中,将对利福霉素钠的生产工艺进行简要介绍,提出该工艺的研究意义和应用前景。
文章结构部分即本节,将详细说明本文的组织结构和各个部分的内容安排。
冻干工艺DOC
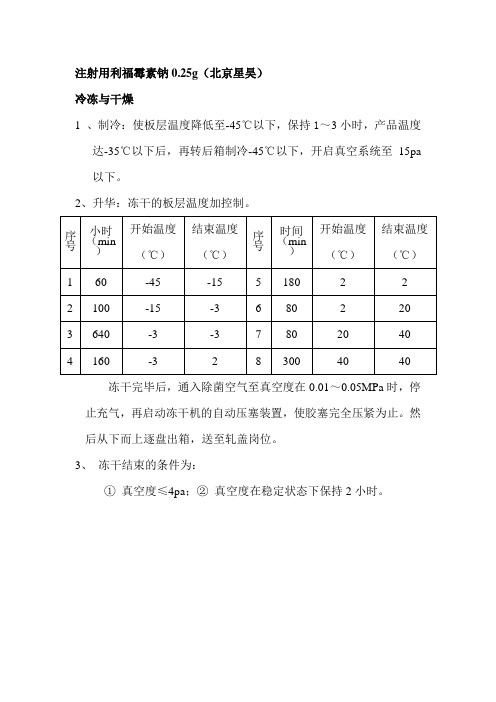
序
号
时间
(h)
开始温度(℃)
结束温度(℃)
序
号
时间
(h)
开始温度(℃)
结束温度(℃)
1
0.5
-34
3
4
0.5
12
37
2
4
3
3
5
7
37
37
3
16
3
12
合计
28
3、冻干完毕后,全真空压塞。然后从下而上逐盘出箱,送至轧盖岗位。
注射用克林霉素磷酸酯0.3g(浙江佐力)
45
4
35
45
合计
24.5小时
27小时
冻干完毕后,通入除菌空气至真空度在0.01~0.05MPa时,停止充气,再启动冻干机的自动压塞装置,使胶塞完全压紧为止。然后从下而上逐盘出箱,送至轧盖岗位。
5、冻干结束的条件为:
①真空度≤4pa;②真空度在稳定状态下保持2小时。
注射用棓丙酯(60mg)(北京四环制药)
90
10
37
90
10
37
90
10
37
60
10
40
6
420
37
37
420
37
37
420
37
37
420
40
40
合计
27小时
33小时
33小时
34小时
其中第4段为缓慢均匀升温。
冻干完毕后,通入除菌空气至真空度在0.01~0.05MPa时,停止充气,再启动冻干机的自动压塞装置,使胶塞完全压紧为止。然后从下而上逐盘出箱,送至轧盖岗位。
利福霉素发酵生产工艺1

发酵工艺
4、二级种子罐的培养条件: 培养温度30℃,罐压0.05Mpa,接种量10%,全程开搅拌,搅拌转速 220r/min,培养时间24小时左右。
5、60m3发酵罐培养条件: 培养温度27℃,罐压0.05Mpa,接种量10%,全程开搅拌,搅拌转速 130r/min,培养至38h补加0.5%的前体,流加补料,培养时间9天。
培养条件
1、斜面培养条件: 培养温度30℃,湿度30-60%,培养时间7d。 2、母瓶培养条件: 培养温度30℃,装量120/750ml,摇床转速220r/min,培养时间2d。 3、子瓶培养条件: 培养温度30℃,装量120/750ml,摇床转速220r/min,接种量5%,培养时间1d。 4、发酵瓶培养条件: 培养温度30℃,装量25/250ml,摇床转速220r/min,接种量5%,培养时间7-8d. 5、15L自动发酵罐培养条件: 通气1:1(vvm)搅拌,转速500r/min,接种量10%,培养温度0~30℃,分批补 料,发酵周期8天。
仪器设备
pH计 分光光度计 旋转摇瓶机 离心机 光学显微镜 自动发酵罐 pH电极 溶氧电极
ቤተ መጻሕፍቲ ባይዱ
谢谢观赏
WPS Office
Make Presentation much more fun
@WPS官方微博 @kingsoftwps
利福霉素发酵工艺流程 种子培养发酵培养 补料控制
利福霉素
英文名称:rifamycin 分子式:C37H47NO12 分子结构式:
利福霉素类药物
从地中海链霉菌产生的、结构域功能相近的一组抗生素,它具有广谱抗菌作 用,对结核杆菌、麻风杆菌、链球菌、肺炎球菌等革兰氏阳性细菌,特别是耐 药性金黄色葡萄球菌的作用都很强。对某些革兰氏阴性菌也有效。 ,其作用机制是通过与依赖DNA的RNA聚合酶结合而抑制原核生物的转录起 始。 利福霉素类药物有:利福霉素B二乙酰胺、利福平等。目前在临床应用的有利 福平、利福喷汀及利福布汀。 利福平是其中药效最好、目前应用最多的一种,不仅抗菌谱广,能用于多种细 菌感染性疾病,而且与其他药物之间无交叉抗药性,对结核病的疗效尤为突出, 是治疗结核病的第一线药物
利富霉素钠的生产工艺流程

利富霉素钠的生产工艺流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!利富霉素钠是一种广谱抗生素,其生产工艺流程主要包括以下几个步骤:1. 培养菌种:首先需要选择一种适合生产利富霉素的菌种,如链霉菌。
注射用利福霉素钠的处方优化及稳定性考察

注射用利福霉素钠的处方优化及稳定性考察
薛梅妍;王东凯;纪标;宋涛;刘威;赵鹏;贾军
【期刊名称】《中国新药杂志》
【年(卷),期】2006(15)4
【摘要】目的:优化注射用利福霉素钠的处方并考察其稳定性.方法:针对影响制剂成型性和稳定性的因素,分别对支持剂和抗氧剂进行考察,并进行处方优化.采用加速试验考察稳定性.结果:最佳处方为:取利福霉素钠25 g,甘露醇3 g,焦亚硫酸钠1 g,注射用水加至500 mL.结论:焦亚硫酸钠的抗氧化作用是影响注射用利福霉素钠长期稳定的主要因素.
【总页数】4页(P284-287)
【作者】薛梅妍;王东凯;纪标;宋涛;刘威;赵鹏;贾军
【作者单位】沈阳药科大学药剂系,沈阳,110016;沈阳药科大学药剂系,沈
阳,110016;沈阳药科大学药剂系,沈阳,110016;沈阳药科大学药剂系,沈阳,110016;沈阳药科大学药剂系,沈阳,110016;沈阳药科大学药剂系,沈阳,110016;沈阳沃森药物研究所,沈阳,110016
【正文语种】中文
【中图分类】R944.11;R978.3
【相关文献】
1.注射用磷霉素钠应用注射用局部覆聚四氟乙烯膜卤化丁基像胶塞(氯化)稳定性考察研究 [J], 陶慧颖;王滨涛
2.注射用泮托拉唑钠与注射用头孢唑肟钠配伍稳定性考察 [J], 朱雪松;钟基大;王启斌;郑芳
3.注射用头孢替唑钠与注射用卡络磺钠配伍稳定性考察 [J], 郑芳;李鹏;朱雪松;钟基大
4.注射用加替沙星与注射用头孢地嗪钠配伍稳定性考察 [J], 杨继章;刘瑞琴;张辰辰
5.HPLC法测定利福霉素钠及注射用利福霉素钠有关物质 [J], 刘杨;姚兰;李冰;张亚杰
因版权原因,仅展示原文概要,查看原文内容请购买。
注射用利福霉素钠含量测定及配伍稳定性若干指标考察

.
1 ×1 n , 0 9 99 ) T e v rg c vr a 1 0 ( =7 R= . 9 0 . h eaer o e w s a e y 1 0 4 % . o c s n T i me o c ua . n iv .n l be R f cnsdu r ne t nc nb o p t l w t 5 g — 0 . 6 C n l i hs t di a c rt s s i a dr i l. i myi o im f jc o a ecm a be i % l u o h s e e te ea a oi i i h u
meh n 1 c tnt l一0 0 5 mo ta o eo ii a r e . 7 l・L‘ p tsim iy rgn p op aeslt n 10 mo 。 oa s u dh d oe h s h t oui 一 , l・L ct t ouin 3 3 3 4) T ef w o i aeslt ( 0:0:6: . h o r o l
安 徽 医 药
A h i dcl n h r aet a Junl 2 1 e ; (2 nu Mei dP am cui l o ra aa c 00D c含 量 测 定 及 配伍 稳 定 性 若 干 指 标 考 察
rt w s1 0 m ・ n ,n e c o a e n t t 2 n A c rig t pec bn n r a o , f y i o i r net n w s a a . l mi ~ a d d t t nw v l gh a 2 7 m. c odn rsr igif t n r a c sdu f j i a e ei e o i o m i im n m o i co
利福霉素钠注射液质量标准提高工作探讨

案 l的要求 , , ’ 辽宁省食 品药 品检 验所接受此项 工作 , 该品种在
国家 局 网 站 上共 查 到 1 批 准 文 号 , 者所 在 检 验 所 收 到 三 个 8个 笔
此项 为修订项 目。根据此次标 准提高工作及 中国药典 20 05
年版的要求 , 笔者 对本 品的无 菌检查 方法 进行 了验 证并修 订。 明确了取样量 、 冲洗液及 冲洗量和 阳性对照菌。
R sac n R fmyi o im net n a o tQu ly Sa d r eg t / i K N in C E u eerho i a c S du Ijc o b u a t tn ad H ihe 3 Bn , A G Qag , H N G o— g n i i n g , F i 1i nn rv c lntu oda dD u ot lS ey n 10 3 C i Seyn st efF o n rgC nr e .La i Poi i stto o n rgC nr ,hna g102 ,hn 2 hnagI tu oda dD u ot l o g n a I i e fF o a nito o
adhi t ulySadr. n e he Q a t tnad g n i
【 e od】 Rf y n oi @co ; S na e h n R s nil K yw rs imc d m I tn t dr Hi t ; e os it a iS u r i a d ge p bi y
利福霉素钠 注射 液为利福 霉素钠 加适量维 生素 c、 焦亚硫
酸 钠 、 二 醇 、 氧化 钠 的灭 菌 水 溶 液 , 执 行 标 准 为 国 家 药 品 丙 氢 现 标 准 J 。根 据 国家 药 典 会 “ 射 剂 质 量 标 准 提 高 第 三 次 工 作 会 注 议 纪 要 _ 及 “ 学 药 品 第 二 批 注 射 剂 质 量 标 准 提 高 工 作 方 I ’ 化
利福霉素钠注射液及其制备方法[发明专利]
![利福霉素钠注射液及其制备方法[发明专利]](https://img.taocdn.com/s3/m/799f298e25c52cc58ad6becf.png)
专利名称:利福霉素钠注射液及其制备方法专利类型:发明专利
发明人:白宗锋,武东亮,张新鲜
申请号:CN200910172753.X
申请日:20091127
公开号:CN101708155A
公开日:
20100519
专利内容由知识产权出版社提供
摘要:本发明公开了一种利福霉素钠注射液的制备方法,在1000ml的注射液中,含有以下各成分:以CHNO计的62.5g的利福霉素钠,7.5g的维生素C,4g焦亚硫酸钠,170ml丙二醇,1g的药用活性炭,余量为注射用水,其具体制备方法如下:①在注射用水中加入丙二醇,搅拌均匀,充氮,搅拌加入维生素C至溶解完全,调pH值至6.2~6.4;②加入焦亚硫酸钠,溶解完全后,加入利福霉素钠原料搅拌至完全溶解,调pH值至7.2~7.3,补加注射用水至全量;③加入活性炭,50℃温度条件下充氮搅拌10分钟,静置、脱炭过滤,调pH值为7.2~7.3,先后通过0.45μm、0.22μm滤芯过滤;④半成品检验合格后,经0.22μm滤芯过滤,充氮保护;⑤贮存液经0.22μm滤膜过滤,充氮灌
封,100℃流通蒸气灭菌30分钟,检漏、灯检、晾干、印字、包装,即得到利福霉素钠注射液。
申请人:河南辅仁怀庆堂制药有限公司
地址:454950 河南省焦作市武陟县沁河路中段路北河南辅仁怀庆堂制药有限公司
国籍:CN
代理机构:郑州科维专利代理有限公司
更多信息请下载全文后查看。
一种稳定的利福霉素钠注射液和利福霉素钠氯化钠(葡萄糖)注射液的

专利名称:一种稳定的利福霉素钠注射液和利福霉素钠氯化钠(葡萄糖)注射液的制备方法
专利类型:发明专利
发明人:郭瑞,孟祥军,齐杰,赵玉才
申请号:CN200810140950.9
申请日:20080806
公开号:CN101642429A
公开日:
20100210
专利内容由知识产权出版社提供
摘要:一种稳定的利福霉素钠注射液和利福霉素钠氯化钠(葡萄糖)注射液的制备方法。
其特征在于:其原料的重量组成为:利福霉素钠100~1000mg,维生素C15~850mg,焦亚硫酸钠15~350mg,丙二醇1~10000ml;其它等适量;制成利福霉素钠注射液,规格为2ml;5ml;10ml和利福霉素钠氯化钠(葡萄糖)注射液,规格为100ml;250ml;500ml。
本发明的特征在于通过溶液pH 值的控制,使本品在加热高压下灭菌达到国家对注射剂无菌保证水平的要求(F≥8)时,其有关物质检查项符合国家药品标准的要求。
申请人:郭瑞
地址:450004 河南省郑州市管城区城东路106号院2号楼11号
国籍:CN
更多信息请下载全文后查看。
包合的利福霉素钠粉针剂及其制备方法[发明专利]
![包合的利福霉素钠粉针剂及其制备方法[发明专利]](https://img.taocdn.com/s3/m/633da39131b765ce04081411.png)
专利名称:包合的利福霉素钠粉针剂及其制备方法专利类型:发明专利
发明人:宁宗超,张蓓
申请号:CN200410021543.8
申请日:20040723
公开号:CN1723891A
公开日:
20060125
专利内容由知识产权出版社提供
摘要:本发明提供了一种包合的利福霉素钠粉针剂及其制备方法。
它是由治疗有效量的利福霉素钠,以及羟丙基-β-环糊精、甘露醇和注射用水经制备而成。
各组份按重量比为利福霉素钠1份,羟丙基-β-环糊精1~50份,甘露醇0~10份,注射用水10~100份。
本发明的制备方法是,将羟丙基-β-环糊精用注射用水溶解后,加入利福霉素钠,搅拌、研磨或超声,得利福霉素钠包合物溶液,加入甘露醇,经过滤除菌后进行无菌分装和冷冻干燥制成无菌粉针,或利福霉素钠包合物溶液,通过冷冻干燥或喷雾干燥得到无菌粉末,进行无菌分装制成无菌粉针。
本发明所提供的包合的利福霉素钠粉针有利于储存运输,使用更加安全可靠。
申请人:王玫
地址:110016 辽宁省沈阳市沈河区文化路103号沈阳药科大学55号信箱
国籍:CN
更多信息请下载全文后查看。
HPLC法测定利福霉素钠及注射用利福霉素钠有关物质

HPLC法测定利福霉素钠及注射用利福霉素钠有关物质刘杨;姚兰;李冰;张亚杰【摘要】目的建立HPLC梯度洗脱法测定利福霉素钠及注射用利福霉素钠的有关物质.方法选用Waters C18色谱柱,以0.18%磷酸二氢钠溶液(用8.5%的氢氧化钠溶液调解pH值至7.5)-乙腈(90:10)为流动相A;0.18%磷酸二氢钠溶液(用8.5%的氢氧化钠溶液调解pH值至7.5)-乙腈(50:50)为流动相B;梯度洗脱[0min(70%A)→35min(15%A) →37min(70%A) →47min(70%A)];流速为1 mL/min,检测波长为254nm.结果经过方法学验证试验,认定方法可行.结论本方法灵敏、准确,专属性强.【期刊名称】《中国抗生素杂志》【年(卷),期】2014(039)007【总页数】4页(P520-523)【关键词】高效液相色谱法;利福霉素钠;注射用利福霉素钠;有关物质【作者】刘杨;姚兰;李冰;张亚杰【作者单位】辽宁省药品检验检测院,沈阳110023;辽宁省药品检验检测院,沈阳110023;辽宁省药品检验检测院,沈阳110023;辽宁省药品检验检测院,沈阳110023【正文语种】中文【中图分类】R978.1利福霉素钠属安莎类抗生素,是半合成的利福霉素中的广谱抗生素,对金黄色葡萄球菌、结核分枝杆菌有较强的杀菌作用,用于结核杆菌感染疾病的治疗。
但是,利福霉素钠结构复杂、不稳定、容易产生降解杂质。
对于利福霉素钠,现行标准[1]采用HPLC梯度洗脱法进行有关物质检查。
但是,流动相中较高的盐浓度与乙腈混合时,极易析出结晶,需控制室内温度20℃以上,给检验带来不便。
现根据分离情况调节磷酸二氢钠溶液浓度,将原标准中流动相B 中乙腈的比例降低,改善了流动相B混合后易析出结晶的问题,并对梯度洗脱表进行了修订,分离效果好,柱效高。
经方法学验证研究,认定方法可行。
该方法亦可用于注射用利福霉素钠的有关物质测定。
2023年关于“利福霉素”解析

药物相互作用
如与其他药物同时使用可能会发生药物相互作用,详情请咨询医师或药师。
药理作用
抗生素类药。本品为半合成利福霉素类中的广谱抗菌药。对金黄色葡萄球菌(包括耐青霉素和耐新 霉素株),结核杄菌有较强的抗菌作用。对常见革兰阴性菌作用弱。其作用机制是抑制体内核糖核 酸聚合酶的活性,从而影响核糖核酸的合成和蛋白质代谢导致细菌生长繁殖停止而达到杀菌作用。 与其他类抗生素或抗结核药尚未发现交叉耐药。
2023年关于“利福霉素”解析
定义
利福霉素,常用利福霉素钠,西药名。 常用剂型有注射剂等。 为抗感染药。 用于结核杆菌感染的疾病和重症耐甲氧西林金葡菌、表葡菌以及难治性军团菌感染的联合治疗。。
适应症
本品用于结核杆菌感染的疾病和重症耐甲氧西林金葡菌、表葡菌以及难治性军团菌感染的联合治疗。
用法用量
不良反应
1、滴注过快可出现暂时性巩膜或皮肤黄染;肌肉注射可引起局部疼痛,有时出现硬皮、肿块。
2、少数病人可出现一过性肝脏损害、黄疸及肾损害。
3、其他不良反应有恶心、食欲不振及眩晕,偶见耳鸣及听力下降、过敏性皮炎等。
注意事项
1 、 长 期 应 用 本 品 , 可 见 A LT 轻 度 增 高 , 停 药 后 一 般 可 自 行 恢 复 。 2、本品不宜与其他药物混合使用,以免药物析出。 3、用药后病人尿液呈红色,属于正常现象。 4、与异烟肼合用,对结核菌有协同抗菌作用,但对肝毒性亦增加。 5、用药期间应监测肝功能。 6、孕妇及哺乳期妇女用药:孕妇及哺乳期妇女慎用。 7、儿童用药:详见用法用量。 8、老年用药:肝功能不全、胆道梗阻、慢性酒精中毒者应用本品应适当减量。 9、药物过量:利福霉素使用过量后不能经血液透析或腹腔透析清除。
本品不同剂型、不同规格的用法用量可能存在差异,请阅读具体药物说明书使用,或遵医嘱。
利福霉素钠静脉注射致高热2例

利福霉素钠静脉注射致高热2例发表时间:2012-11-19T10:30:23.450Z 来源:《中外健康文摘》2012年第28期供稿作者:李再春[导读] 静点时应有人陪护,以免发生意外。
静点后适当休息。
本两例患者都是青年人,在临床上应引起高度重视。
李再春 (吉林省长春市双阳区结核病防治所吉林长春 130600)【中图分类号】R969【文献标识码】A【文章编号】1672-5085(2012)28-0276-011、临床资料患者:2例均为男性,分别为18、19周岁,汉族。
依次为高二、高三学生。
前者在2011年10月份患病,后者是在2012年2月份患病。
均不同程度表现为右侧胸部不适、平卧时呼吸不畅,伴有刺激性咳漱、无痰,发热,无明显乏力、盗汗等。
遂去当地区医院就诊,胸部X线平片:均示右侧胸腔呈外高内低水样密度影。
胸腔B超报告:右侧胸腔积液。
两例患者均行胸穿手术置管并做胸水化验确诊为结核性渗出性胸膜炎。
在治疗前常规检查血、尿、肝功,均无异常,痰抗酸杆菌涂片检查阴性,体温分别为36.8℃、37.1℃,体质量无异常。
均给予初治抗结核治疗方案规律治疗,疗程一年。
征得患者同意,在治疗第一周给予利福霉素钠注射液0.5g加5%葡萄糖250毫升缓慢静点,一日2次。
静点期间停服复合利福平胶囊制剂。
当日静点约1h后,均出现高热寒战,浑身酸软无力,经家属、同学送至医院治疗,给予抗过敏、退热、平衡补液盐等治疗后缓解。
第2日给予糖盐水加能量合剂补充体液等治疗后康复出院。
期间并未出现任何不良反应。
两例患者既往无其他病史及家族史、药物过敏史等,静点前均未感冒、无高热、浑身不适等,入院后体温分别为39.8℃、40.1℃。
检查:心率、呼吸加快,血压正常。
神志清楚,精神萎靡,神经反射存在、病理反射未引出,血常规无异常。
出院后,两例患者再次静点该药,其表现及程度同前基本一致,治疗用药同前。
遂嘱其停止静点,改用复合利福平胶囊制剂口服治疗,第2日虽体温稍高但未出现高热等副反应,之后体温正常。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
低硼硅玻璃管制注射剂瓶(10ml,无色)
BZ-002
STP-QS3-0001
YBB00302002
注射用卤化丁基胶塞(三叉20-D3,免洗)
BZ-005
STP-QS3-0002
YBB00052005
抗生素瓶用铝塑组合盖(20-7.1)
BZ-008
STP-QS3-0003
YBB00372003
1500.0g
4500.0g
9.00kg
乙醇(95%)
3210g
9630g
19.26kg
氢氧化钠溶液(1mol/L)
适量
适量
适量
维生素C钠
75.0g
225.0g
450.0g
焦亚硫酸钠
37.5g
112.5g
225.0g
注射用水
加至60kg
加至180kg
加至360kg
药用炭
30.0g
90.0g
180.0g
8.1.7.11岗位操作人员将胶塞清洗机状态标识更换为“清洁待用”,各辅助操作间状态标识更换为“已清洁”,各功能操作间状态标识更换为“清场合格证”(副本)。
8.1.7.12将内包材等废弃物由物料缓冲室传出洁净区,按“SOP-SH3-0001”即《注射剂车间生产废弃物处理标准操作程序》及时清理废弃物。
文件名称:注射用利福霉素钠生产工艺规程
编码:STP-MF1-0003
颁发部门:质量管理部
版次:第02版
页次:共35页第1页
起草人:
审核人:
QA审核:
起草日期:年月日
审核日期:年月日
审核日期:年月日
批准人:
批准日期:年月日
实施日期:年月日
分发部门:质量管理部、生产技术部、注射剂车间以及存档。
1目的
制订注射用利福霉素钠生产工艺规程,规范生产过程,保证产品质量。
8.1.6.13操作人员关闭水、电、气阀门,按“SOP-SH3-1015”即《生产区人员进入注射剂车间D级洁净区更衣标准操作程序》的相反顺序退出洁净区。
8.1.7胶塞清洗灭菌
8.1.7.1于生产前一天,操作人员按“SOP-SH3-1015”即《生产区人员进入D区更衣标准操作程序》进入内包材洗涤灭菌室,执行”SOP-PR2-0003”即《注射剂车间内包材清洗灭菌岗位标准操作程序》,按“SMP-PR1-0028”即《生产前检查标准管理程序》和“SMP-PR1-0006”即《车间温湿度、压差标准管理程序》检查生产环境的温湿度及压差和胶塞清洗机,均应正常;若不正常,及时上报于生产管理负责人处理。
注射用利福霉素钠说明书
BZ-018
STP-QS3-0004
STP-QS3-0011
—
注射用利福霉素钠标签
BZ--0011
—
注射用利福霉素钠纸盒
BZ-020
STP-QS3-0006
STP-QS3-0011
—
注射用利福霉素钠瓦楞纸箱
BZ-021
STP-QS3-0007
8.1.2.2于生产前,各岗位操作人员检查各工序相关设备及管道的清洁、消毒、灭菌有效期,若超过有效期,应按各工序相关设备及管道的清洁、消毒、灭菌的标准操作程序执行。
8.1.2.3准备完毕,各岗位操作人员进行自检,合格后申请QA检查,合格后签发清场合格证。
8.1.2.4岗位操作人员将设备状态标识更换为“清洁待用”,各辅助操作间状态标识更换为“已清洁”,各功能操作间状态标识更换为“清场合格证”(副本)。
8.1.6.5将核对无误的铝塑组合盖转移至内包材洗涤灭菌室,将铝塑组合盖手动
投料于铝盖清洗机。
8.1.6.6执行“SOP-EQ4-0017”即《ACA450-10-SS全自动铝盖清洗机标准操作程
序》,设置灭菌温度为121℃,灭菌时间30分钟;在灭菌过程中保证灭菌温度在
121℃以上。
8.1.6.7清洗、灭菌、干燥、降温结束后,关闭铝盖清洗机电源,并通知制水、动力岗位关闭纯蒸汽;并填写设备使用记录。
8操作过程
8.1生产前准备
8.1.1记录准备
8.1.1.1于生产前一天,生产技术部根据批生产指令按“SMP-PR1-0019”即《批生产记录标准管理程序》发放批生产记录于各个生产工序。
8.1.1.2D级洁净区人员通过物料缓冲室,将批生产记录和其他各项相关记录传递至D级洁净区。
8.1.1.3冻干工序人员将批生产记录和其他各项相关记录直接领至冻干控制室,根据批生产指令规定的产品批号准确放至对应冻干机号的电脑控制工作台上。
2范围
本规程适用于注射用利福霉素钠(0.25g)生产工艺的控制。
3职责
注射剂车间、生产技术部负责执行本程序,质量管理部监督执行。
4产品概述:
通用名称:注射用利福霉素钠
商品名称:星索宁
批准文号:国药准字H20041633
产品规格:以利福霉素(C37H47NO12)计:0.25g(25万利福霉素单位)。
8.1.6铝塑组合盖清洗灭菌
8.1.6.1于轧盖前,操作人员按“SOP-SH3-1015”即《生产区人员进入D区更衣标准操作程序》进入内包材洗涤灭菌室,执行”SOP-PR2-0012”即《注射剂车间内包材清洗灭菌岗位标准操作程序》,按“SMP-PR1-0028”即《生产前检查标准管理程序》和“SMP-PR1-0006”即《车间温湿度、压差标准管理程序》检查生产环境的温湿度及压差和铝盖清洗机,均应正常;若不正常,及时上报于生产管理负责人处理。
8.1.7.13操作人员关闭水、电、气阀门,按“SOP-SH3-1015”即《生产区人员进入D区更衣标准操作程序》的相反顺序退出洁净区。
8.1.7.14胶塞灭菌次数不超过两次。
8.1.8器具、洁净服的清洗、灭菌
8.1.8.1于生产前一天,操作人员按“SOP-SH3-1014”即《生产区人员进入C区更衣标准操作程序》进入C级洁净区,执行”SOP-PR2-0016”即《注射剂车间灭菌岗位标准操作程序》,按“SMP-PR1-0028”即《生产前检查标准管理程序》和“SMP-PR1-0006”即《车间温湿度、压差标准管理程序》检查生产环境的温湿度及压差和灭菌柜,均应正常;若不正常,及时上报于生产管理负责人处理。
8.1.5.2执行“SOP-PR2-0011”即《内包材拆包标准操作程序》,开始脱内包材的外包装。
8.1.5.3脱去外包装后,用75﹪乙醇润湿的洁净抹布擦拭内包材的内包装表面,将清洁后的玻璃瓶、胶塞、铝塑组合盖整齐码放在缓冲室或内包材暂存室的地托上,挂好物料标识卡,按“SOP-SH3-0001”即《注射剂车间生产废弃物处理标准操作程序》及时清理废弃物。
8.1.7.5将核对无误的胶塞转移至内包材洗涤灭菌室,将胶塞手动投料于胶塞清
洗机。
8.1.7.6执行“SOP-EQ4-0013”即《RSA380-10-SS全自动胶塞清洗机标准操作程
序》,设置灭菌温度为121℃,灭菌时间30分钟;在灭菌过程中保证灭菌温度在
121℃以上。
8.1.7.7清洗、灭菌、干燥、降温结束后,关闭胶塞清洗机电源,并通知制水、动力岗位关闭纯蒸汽、压缩空气;并填写设备使用记录。
8.1.7.2岗位操作人员确认各项无误后,方可将胶塞清洗机状态标识更换为“运行中”,各辅助操作间状态标识更换为“使用中”,功能操作间状态标识更换为“生产中”。
8.1.7.3操作人员通知制水、动力岗位提供纯化水、注射用水、纯蒸汽、压缩空气。
8.1.7.4根据批生产指令,在缓冲室或内包材暂存室核对胶塞规格、数量。
8.1.2生产环境准备
8.1.2.1于生产前一天,各岗位操作人员检查操作间“清场合格证”(副本)的清洁有效期,若超过有效期,按“SOP-SH3-1002”即《注射剂车间洁净区卫生清洁消毒标准操作程序》、“SOP-SH3-1012”即《注射剂车间清场标准操作程序》,以及根据生产安排按“SOP-SH3-1017”即《B级区甲醛熏蒸标准操作程序》适时地对生产环境进行清洁、消毒。
8.1.6.2岗位操作人员确认各项无误后,方可将铝盖清洗机状态标识更换为“运行中”,各辅助操作间状态标识更换为“使用中”,功能操作间状态标识更换为“生产中”。
8.1.6.3操作人员通知制水、动力岗位提供纯化水、注射用水、纯蒸汽、压缩空气。
8.1.6.4根据批生产指令,在缓冲室或内包材暂存室核对铝塑组合盖规格、数量。
8.1.6.8按“SOP-SH5-1021”即《ACA450-10-SS全自动铝盖清洗机清洁标准操作规程》清洁设备。
8.1.6.9按“SOP-SH3-1012”即《注射剂车间清场标准操作程序》清场,并完成批生产记录。
8.1.6.10清场完毕,自检,合格后申请QA检查,合格后签发清场合格证,正本附入本批批生产记录。副本挂于房间生产状态标识牌上。
8.1.3领料
8.1.3.1于生产前一天或当天,领料员凭批生产指令和领料单到仓库领取原料、辅料及内包装材料。
8.1.3.2领料时,库管员、领料员双人复核领取的物料名称、规格、数量、批号、检验报告单应与批生产指令一致,并检查物料外包装的完好情况,确认各项无误后,双方在领料单上签字,领料员将物料运至车间物料入口。
8.1.6.11岗位操作人员将铝盖清洗机状态标识更换为“清洁待用”,各辅助操作间状态标识更换为“已清洁”,各功能操作间状态标识更换为“清场合格证”(副本)。
8.1.6.12将内包材等废弃物由物料缓冲室传出洁净区,按“SOP-SH3-0001”即《注射剂车间生产废弃物处理标准操作程序》及时清理废弃物。
6生产工艺流程及环境区域划分(见附页)
7质量标准
品名
物料编号
内控质量标准编号
法定标准
利福霉素钠
YL-002
STP-QS1-0002
YBH14812004
维生素C钠
FL-012
STP-QS2-0009
