ISO14971-2019医疗器械风险评估记录报告
ISO14971-2019医疗器械风险管理控制程序

ISO14971-2019医疗器械风险管理控制程序1.0目的为了确保产品安全性,依据标准 ISO14971:2019《医疗器械—风险管理对医疗器械的应用》,对产品风险控制,使产品风险可控,根据《管理手册》要求,制定本控制程序。
2.0适用范围本程序适用于公司二、三类医疗器械产品,仅限于与人体健康、环境或财产的侵害相关的风险,不涉及对动物侵害的相关的风险,也不涉及商业、技术、项目等方面的风险管理活动。
3.0职责3.1总经理3.1.1提供适当的资源和人员;3.1.2批准风险管理计划与安全风险分析报告;3.1.3按照计划的间隔组织评审风险管理过程的适宜性,以保证风险管理过程的持续有效性。
3.2研发部门3.2.1按照计划组织、领导和协调风险管理活动;3.2.2制定风险管理计划并组织评审;3.2.3组织建立风险管理小组并明确小组成员的职责分配;3.2.4通过安全风险分析报告记录风险管理活动的过程与结果,组织安全风险分析报告的评审;3.2.5需要时更新安全风险分析报告;3.2.6通知相关人员关于安全风险分析报告的更新。
3.3相关部门参与分险管理活动。
4.0工作程序4.1风险管理涉及医疗器械整个寿命周期,从产品策划开始,到有效期结束,包括设计开发和生产后阶段的风险管理。
4.2风险管理应当符合ISO14971:2019标准的要求,且符合适用的法律法规、规范性文件的要求。
4.3研发部门对本部门研发的产品制定风险管理计划并对设计和开发阶段进行风险管理,质量管理部按风险管理计划对生产和生产后阶段进行风险管理。
4.4风险管理计划4.4.1对于新产品的设计和开发,应在立项时制定风险管理计划。
风险管理计划应制定风险管理的工作路线,描述风险管理的目标、过程和方法。
计划应覆盖产品有效期。
4.4.2指定的风险管理负责人负责完成风险管理计划并组织评审,由相关责任人审核后批准实施。
风险管理负责人负责对风险管理计划进行维护,在适用时进行更新。
医疗器械ISO14971风险管理报告(精品范本)

医疗器械ISO14971 风险管理报告[范本]产品名称:产品编号:风险管理计划编制人:编制日期:1、范围:产品描述:本风险管理计划主要是对产品在其整个生命周期内(包括设计开发、产品实现、最终停用和处置阶段)进行风险管理活动的策划。
2、职责与权限的分配2.1总经理为风险管理提供适当的资源,对风险管理工作负领导责任。
保证给风险管理、实施和评定工作分配的人员是经过培训合格的,保证风险管理工作执行者具有相适应的知识和经验。
2.2技术部负责产品设计和开发过程中的风险管理活动,形成风险分析、风险评价、风险控制、综合剩余风险分析评价的有关记录,并编制风险管理报告。
2.3质量部、、销售部、生产部等相关部门负责从产品实现的角度分析所有已知的和可预见的危害以及生产和生产后信息的收集并及时反馈给技术部进行风险评价,必要时进行新一轮风险管理活动。
2.4技术部和评审组成员定期对风险管理活动的结果进行评审,并对其正确性和有效性负责。
2.5办公室负责对所有风险管理文档的整理工作。
3、风险分析3.1参加风险分析的部门包括生产部、质量部、技术部、、销售部等,技术部主要分析设计开发阶段已知和可预见的危害事件序列,生产部主要分析产品生产阶段的已知和可预见的危害事件序列,和销售部主要分析产品生产后已知和可预见的危害事件序列,技术部负责收集各部门分析的结果并按照16号令的要求和YY/T0316:2008附录E.1的资料对所有已知和可预见的危害事件序列进行分类,组织各部门进行风险评价和风险控制措施的分析与实施并编制成相应的表格。
3.2风险分析内容包括:1)可能的危害及危害事件序列2)危害发生及其引起损害的概率3)损害的严重度3.3在产品设计开发初始阶段由于对产品设计细节了解较少,采用PHA(初步危害分析)技术对产品进行危害、危害处境及可能导致的损害进行分析。
3.4在设计开发成熟阶段采用失效模式和效应分析(FMEA)及失效模式、效应和危害分析(FMECA)对产品进行危害、危害处境及可能导致的损害进行分析。
ISO14971-2019医疗设备—风险管理在医疗设备中的应用标准培训教材

中的应用标准培训教材
allen
目录
前言 1 范围 2 规范性引用文件 3 术语和定义 4 风险管理体系的一般要求 5 风险分析 6 风险评估
目录
7 风险控制 8 总体残留风险评估 9 风险管理审查 10 生产和后期制作活动 附件A(资料性)要求的理由 附件B(资料性)医疗器械风险管理流程 附件C(资料性)基本风险概念
3 术语和定义
3.8生命周期
从最初的构思到最终的报废和处置,整个医疗器械 生命周期的所有阶段
3 术语和定义
3.9制造商
负责设计和/或制造医疗设备(3.10)的自然人或法人,目的 是使该医疗设备(3.10)以其名义可使用,无论该医疗设备 (3.10)是否为由该 人本人或由他人代为设计和/或制造
注释 1:自然人或法人有最终法律责任,以确保遵守拟提供 或出售的医疗设备所在国家或地区对医疗设备的所有适用法 规要求,除非该责任特 别由另一人承担该辖区内监管机构 (RA)的人员。
3 术语和定义
3.9制造商 进入注释 6:仅将自己的地址和联系方式添加到医疗设备或 包装上,而不覆盖或更改现有标签的授权代表,分销商或进 口商,不被视为制造商。 进入注释 7:在某种程度上,配件应符合医疗设备的法规要 求,负责该配件的设计和/或制造的人员应被视为制造商。
3 术语和定义
3.10医疗装置 制造商(3.9)拟单独或组合用于人类的仪器,仪器,工具, 机器,器具,植入物,体外使用的试剂,软件,材料或其他 类似或相关物品或以上的特定医疗目的 —疾病的诊断,预防,监测,治疗或缓解, —诊断,监控,治疗,减轻或补偿伤害, —对解剖结构或生理过程的调查,替换,修改或支持,
3 术语和定义
ISO14971医疗器械风险管理报告

ISO14971医疗器械风险管理报告ISO14971医疗器械风险管理报告目录1.概述2.风险管理人员及其职责分工3.风险的可接受性准则4.预期用途和与安全性有关的特征的判定5.危害、可预见的事件序列和危害处境6.风险评价、风险控制和风险控制措施验证7.综合剩余风险的可接受性评价8.生产和生产后信息9.风险管理评审结论1.概述目的和适用范围本文是对xxx进行风险管理的报告,报告中对xxx在上市后风险管理情况进行总体评价,所有的可能危害以及每一个危害产生的原因进行了判定,对于每种危害可能产生损害的严重度和危害的发生概率进行了估计,在某一风险水平不可接受时,采取了降低风险的控制措施,同时,对采取风险措施后的剩余风险进行了可接受性评价,证实对产品的风险已进行了管理,并且控制在可接受范围内。
1.2 引用相关标准及产品有关资料1)YY0316-2008医疗器械——风险管理对医疗器械的应用2)注册产品标准3)质量手册4)使用说明书5)xx使用情况、维修记录、顾客投诉、意外事故记录等6)专业文献中的文章和其他信息1.3.产品描述1.3.1. 概况所属安全类别为xx类;所属防护类型为xx型;电源种类为市电网供电,供电电源电压为xxV,频率为50Hz±1Hz;输入功率为xxVA;具有应用部分:xx;属于xxx安装设备;具有信号输入部分;运行方式:连续运行。
1.3.2. 预期用途xxx是对xx进行xxx的一种设备。
1.3.3. 预期目的xx是xx,以此达到xx的目的。
1.3.4. 适用环境温度:xx0C ~ +xx0C;相对湿度:xx% ~ xx%;大气压力:xxkPa ~ xxkPa;额定电压:xxV、频率50HZ±1HZ1.3.5. 设备组成xx由xxx组成。
1.3.6. 适应症xxx1.3.7. 禁忌症xxx。
1.4.风险管理计划简述xxx开始策划立项时,我们就针对该产品进行了风险管理活动的策划,指定了风险管理计划, 该风险管理计划确定了风险管理参加人员及职责的分配、基于制造商决定可接受风险方针的风险可接受性准则,包括在损害发生概率不能估计时的可接受风险的准则等内容。
iso-14971风险管理报告模板

iso-14971风险管理报告模板风险管理报告产品名称:产品型号:编制:时间:审核:时间:批准:时间:目录第一章综述 (4)1........................................................ 产品简介 42........................................ 产品预期使用寿命 43................................ 风险管理实施情况简述 44................................................ 参考标准列表 55............................ 风险管理职责和权限分配 56............................ 风险管理评审人员和职责 67................................................ 风险管理计划 6第二章风险分析 (8)1............................................ 风险可接受准则 82........................................ 安全性特征分析表 10第三章风险评估和控制 (45)第四章剩余风险评价 (48)第五章风险/收益分析 (49)第六章评估由风险控制措施产生的风险-次生风险- 50 - 第七章关于生产和生产后的信息.................... - 51 -第八章风险管理评审........................................ - 52 -1........................................ 风险管理评审输入 - 52 -2................................ 风险管理计划完成情况 - 52 -3............................ 综合剩余风险可接受评审 - 52 -4............................ 评审通过的风险管理文档 - 53 - 第九章风险管理评审结论................................ - 54 -第一章综述1. 产品简介产品名称. 预期用途. 原理. 主要功能. 技术参数. 使用环境等请对产品基本性能定义(基本性能指产品必须有的性能,若该性能不满足要求,将导致不可接受的风险。
ISO14971-2019医疗器械风险管理控制程序

ISO14971-2019医疗器械风险管理控制程序1.0目的为了确保产品安全性,依据标准 ISO14971:2019《医疗器械—风险管理对医疗器械的应用》,对产品风险控制,使产品风险可控,根据《管理手册》要求,制定本控制程序。
2.0适用范围本程序适用于公司二、三类医疗器械产品,仅限于与人体健康、环境或财产的侵害相关的风险,不涉及对动物侵害的相关的风险,也不涉及商业、技术、项目等方面的风险管理活动。
3.0职责3.1总经理3.1.1提供适当的资源和人员;3.1.2批准风险管理计划与安全风险分析报告;3.1.3按照计划的间隔组织评审风险管理过程的适宜性,以保证风险管理过程的持续有效性。
3.2研发部门3.2.1按照计划组织、领导和协调风险管理活动;3.2.2制定风险管理计划并组织评审;3.2.3组织建立风险管理小组并明确小组成员的职责分配;3.2.4通过安全风险分析报告记录风险管理活动的过程与结果,组织安全风险分析报告的评审;3.2.5需要时更新安全风险分析报告;3.2.6通知相关人员关于安全风险分析报告的更新。
3.3相关部门参与分险管理活动。
4.0工作程序4.1风险管理涉及医疗器械整个寿命周期,从产品策划开始,到有效期结束,包括设计开发和生产后阶段的风险管理。
4.2风险管理应当符合ISO14971:2019标准的要求,且符合适用的法律法规、规范性文件的要求。
4.3研发部门对本部门研发的产品制定风险管理计划并对设计和开发阶段进行风险管理,质量管理部按风险管理计划对生产和生产后阶段进行风险管理。
4.4风险管理计划4.4.1对于新产品的设计和开发,应在立项时制定风险管理计划。
风险管理计划应制定风险管理的工作路线,描述风险管理的目标、过程和方法。
计划应覆盖产品有效期。
4.4.2指定的风险管理负责人负责完成风险管理计划并组织评审,由相关责任人审核后批准实施。
风险管理负责人负责对风险管理计划进行维护,在适用时进行更新。
ISO14971医疗器械风险管理报告(标准模版+参考模板)
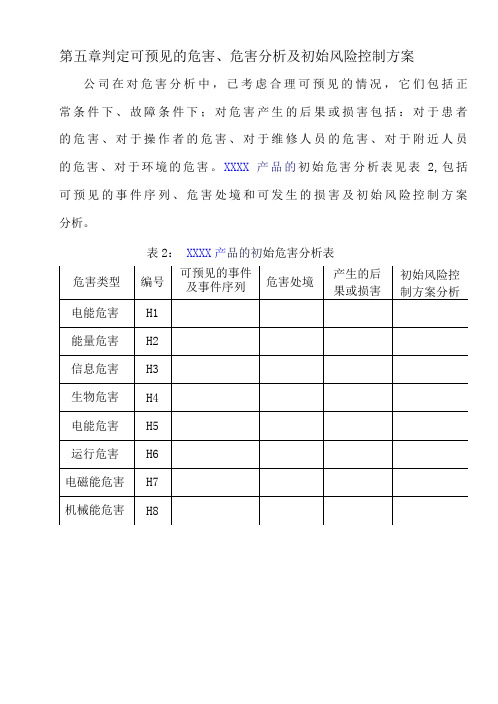
第五章判定可预见的危害、危害分析及初始风险控制方案公司在对危害分析中,已考虑合理可预见的情况,它们包括正常条件下、故障条件下;对危害产生的后果或损害包括:对于患者的危害、对于操作者的危害、对于维修人员的危害、对于附近人员的危害、对于环境的危害。
XXXX产品的初始危害分析表见表2,包括可预见的事件序列、危害处境和可发生的损害及初始风险控制方案分析。
表2:XXXX产品的初始危害分析表第六章风险评价、风险控制和风险控制措施验证公司对已知危害进行风险评价,按照风险可接受准则判断每个危害的风险是否达到可接受水平,对合理可行降低的风险、不经过风险/收益分析既判定为不可接受的风险采取控制措施,并对具体措施进行实施验证,同时重新对采取措施后的风险进行估计,确认其风险水平是否可接受。
XXXX产品风险评价、风险控制措施记录表见表3。
⅛3≡⅛w>i R≡ι≡a≡施骷际:m Word w≡≡fiTO≡B*≡≡财船,≡≡第七章综合剩余风险评价公司在采取降低风险的措施后,……等危害的风险已降到广泛可接受的程度,……等危害的风险也降到了合理可行降低的程度。
(还要说明采取降低风险的措施后,有没有引入新的风险,若有,则须进行再次评价和控制),经评防盗版提示:原文档为Word可编辑版本文本框下载后可很方便删除本文档排版精美如不符合,均为盗版6)专家结论结论:风险管理评审小组在分析了以上方面,并临床应用专家进行了充分的沟通后,一致评价,本产品的综合剩余风险可接受。
第八章生产和生产后信息医疗器械XXXX产品已正式投入生产并上市,公司已对生产和生产后信息收集和评审,并填写了XXXX产品生产和生产后信息收集表(表4),以决定是否需要改进产品(尤其安全性)和服务该项目风险管理负责人对得到的生产和生产后信息进行管理,必要时,风险管理小组开展活动实施动态风险管理。
表4:XXXX产品生产和生产后信息收集表第九章风险管理评审结论风险管理评审小组经过对XXXX产品评审,认为:-风险管理计划已被适当地实施;-综合剩余风险是可接受的;-已有适当方法获得相关生产和生产后信息,并在适当时启动动态风险管理程序。
ISO14971-2019医疗器械风险控制措施

环境 加快,或
温度、 者 受 潮
温度计
仓 储
湿度 不符
引起短 路,使用
S3
重 要
或湿度 计失灵
P4
无
合要 者 接 触
求等 到 非 安
全产品
严格按照 工艺流程 和产品标 S2 P1 H9 准进行生 产,加强成 品检验
加强印刷 供应商管 理,加强对 包装箱标 S3 P1 H7 识清晰度、 耐磨性的
评审
定时校准 温度计和 湿度计,做 好温度湿 S3 P2 H5 度监控记
能预期使用(正常状态) H9
和相应的检验规程和工艺流
2、某些部件缩水程度不同、组装不到位或者漏检 程,对生产设备进行严格的
安装、运行和性能验证
第5页共8页
3.3.设计开发过程中,运用FMEA、FMECA,对于与产品安全性相
关的失效模式,按风险管理流程,进行风险分析、风险评价和风险控
制, 以下是FMEA、FMECA技术用与产品制造过程的记录:
第4页共8页
序》《库房管理规程》《成 品检验规程》
H6 产品上标识不明确
严格按照相关规程操作保证 标识质量
H7 包装上防护措施标识不明确不清晰
严格执行《疗器械说明书、 标签和包装标识管理规定》
说明书上注意事项、操作步骤描述繁琐或不清晰易 H8
懂或信息不全
严格执行《医疗器械说明书、
1、没有注意说明书上注意事项及图示而使产品不 标签和包装标识管理规定》
第2页共8页
1、产品描述
超声影像分析仪适用于超声诊断治疗中辅助诊断。 超声影像分析仪在超声检查中通过刷卡自动录入病人信息,可同 步采集超声图像和视频,并具备录音功能。可将采集的图像、视频、 音频资料保存在以病人姓名和超声号命名的同一个文件夹内。超声影 像分析仪能快速对图像进行定量分析以辅助医师做出超声影像学诊 断,其可分析的功能包括:肿瘤纵横比、不规则度的自动计算、超声 多普勒信号的提取与定量、超声回声信号的提取与定量、超声造影时 间-强度曲线的绘制与分析等;图像处理功能:对图像和视频进行 ROI 分析、统计,具备将图像转化为视频、图像格式转化、图像调节、数 据输出。同时还可对超声图像进行纹理分析,可反应组织或肿瘤内部 回声的均匀度、不均匀度、峰值、混乱度。
ISO14971-2019医疗设备—风险管理在医疗设备中的应用

国际标准ISO 标准14971第三版2019-12 ISO14971-2019医疗设备—风险管理在医疗设备中的应用©ISO 2019•前言 (iv)•介绍 (vi)• 1 范围 (1)• 2 规范性引用文件 (1)• 3 术语和定义 (1)• 4 风险管理体系的一般要求 (7)• 4.1 风险管理流程 (7)• 4.2 管理职责 (8)• 4.3 人员能力 (9)• 4.4 风险管理计划 (9)• 4.5 风险管理文件 (10)• 5 风险分析 (10)• 5.1 风险分析过程 (10)• 5.2 预期用途和合理可预见的滥用 (10)• 5.3 识别与安全有关的特性 (11)• 5.4 识别危害和危险情况 (11)• 5.5 风险估算 (11)• 6 风险评估 (12)•7 风险控制 (12)•7.1 风险控制方案分析 (13)•7.2 实施风险控制措施 (13)•7.3 残留风险评估 (13)•7.4 利益风险分析 (14)•7.5 风险控制措施带来的风险 (14)•7.6 风险控制的完整性 (14)•8 总体残留风险评估 (14)•9 风险管理审查 (15)•10 生产和后期制作活动 (15)•10.1 一般 (15)•10.2 信息收集 (15)•10.3 信息审查 (16)•10.4 动作 (16)•附件A(资料性)要求的理由 (17)•附件B(资料性)医疗器械风险管理流程 (26)•附件C(资料性)基本风险概念 (30)•参考书目 (36)前言ISO(国际标准化组织)是国家标准机构(ISO 成员机构)的全球联合会。
制定国际标准的工作通常是通过 ISO 技术委员会来进行的。
对建立了技术委员会的主题感兴趣的每个成员机构均有权代表该委员会。
与ISO 联络的政府和非政府国际组织也参加了这项工作。
在电子技术标准化的所有问题上,ISO 与国际电子技术委员会(IEC)紧密合作。
ISO / IEC 指令第 1 部分中描述了用于开发本文档的过程以及打算进一步维护的过程。
医疗器械定期风险评价报告

医疗器械定期风险评价报告1000字医疗器械定期风险评价报告一、前言本报告为医疗器械的定期风险评价报告,主要对医疗器械的安全性进行评估,并提出相应的改进意见和建议。
此评价主要基于医疗器械使用情况及实际应用中的医疗安全问题,旨在为医疗机构提供有关医疗器械安全的评估参考。
二、评估对象本次风险评价的对象为:心电图机、麻醉机、输液泵等常见的临床医疗器械。
三、评估方法1. 风险分析通过分析使用过程中的异常情况、不良事件及近期的安全警示,对器械在实际使用中所存在的风险进行评估。
2. 风险编号按照ISO14971标准进行风险等级划分,并对每一项风险进行编号。
3. 风险辨识确定风险源、事故机制、可能受伤害部位及受伤害的严重程度等,辨识可能的风险。
4. 风险评估针对各项风险进行概率和影响的评估,确定风险等级。
5. 风险管理在确定器械的风险等级后,采取相应的控制措施对风险进行有效的管理和控制。
四、结果分析1. 心电图机风险编号:ECG-01风险描述:电极接触不良,影响测量准确度风险等级:中等改进措施:增加提醒功能,提醒用户检查电极连接是否正常。
风险编号:ECG-02风险描述:使用过程中电极过热,烧伤患者风险等级:严重改进措施:加强电极散热设计,降低电极温度。
2. 麻醉机风险编号:ANES-01风险描述:氧气浓度超标或不足,导致氧气中毒或低氧血症风险等级:高风险改进措施:加强气路质量监控,增加气路故障报警功能。
风险编号:ANES-02风险描述:麻醉剂过量或过敏,导致意外死亡或严重后果风险等级:严重改进措施:严格地医嘱管理,确保用药合理、安全。
3. 输液泵风险编号:INF-01风险描述:输液泵设置错误,导致输液速度过快或过慢风险等级:中等改进措施:加强人员培训,提高用户操作技能。
风险编号:INF-02风险描述:输液管路堵塞,导致输液停止或过量风险等级:中等改进措施:注意管路的清洁,加强对管路的监控和维护。
五、结论和建议通过风险评估,发现医疗器械在实际使用过程中存在的风险问题,建议采取相应措施进行风险管理。
【医疗器械风险分析报告】医疗器械ISO14971风险管理报告范本

【医疗器械风险分析报告】医疗器械ISO14971风险管理报告范本医疗器械iSo14971风险管理报告范本风险产品名称:产品编号:管理文档风险管理计划编制人:编制日期:1、范围:产品描述:本风险管理计划主要是对产品在其整个生命周期内(包括设计开发、产品实现、最终停用和处置阶段)进行风险管理活动的策划。
2、职责与权限的分配2.1总经理为风险管理提供适当的资源,对风险管理工作负领导责任。
保证给风险管理、实施和评定工作分配的人员是经过培训合格的,保证风险管理工作执行者具有相适应的知识和经验。
2.2技术部负责产品设计和开发过程中的风险管理活动,形成风险分析、风险评价、风险控制、综合剩余风险分析评价的有关记录,并编制风险管理报告。
2.3质量部、、销售部、生产部等相关部门负责从产品实现的角度分析所有已知的和可预见的危害以及生产和生产后信息的收集并及时反馈给技术部进行风险评价,必要时进行新一轮风险管理活动。
2.4技术部和评审组成员定期对风险管理活动的结果进行评审,并对其正确性和有效性负责。
2.5办公室负责对所有风险管理文档的整理工作。
3、风险分析3.1参加风险分析的部门包括生产部、质量部、技术部、、销售部等,技术部主要分析设计开发阶段已知和可预见的危害事件序列,生产部主要分析产品生产阶段的已知和可预见的危害事件序列,和销售部主要分析产品生产后已知和可预见的危害事件序列,技术部负责收集各部门分析的结果并按照16号令的要求和YY/T0316:20XX附录E.1的资料对所有已知和可预见的危害事件序列进行分类,组织各部门进行风险评价和风险控制措施的分析与实施并编制成相应的表格。
3.2风险分析内容包括:1)可能的危害及危害事件序列2)危害发生及其引起损害的概率3)损害的严重度3.3在产品设计开发初始阶段由于对产品设计细节了解较少,采用PHa(初步危害分析)技术对产品进行危害、危害处境及可能导致的损害进行分析。
3.4在设计开发成熟阶段采用失效模式和效应分析(FmEa)及失效模式、效应和危害分析(FmEca)对产品进行危害、危害处境及可能导致的损害进行分析。
14971 风险分析报告范本

Risk Management风险管理公司名称: Company Name: 公司地址: Company Address: 产 品:Product: 型 Model: 附 件: 号:Accessories: 标 准: ISO 14971:2000+A1:2003Standard: 结 论: 所有可识别的风险都已经被评估。
在采取适当的措施以降低这些风 险之后,关于产品预期的应用和用途上,各种等级的风险是可以接 受的。
All risks associated with the identified hazards have been evaluated. After appropriate measures to reduce these risks have been taken, the overall level of risk of the product is acceptable with regard to the intended application and use of the application.Result:编写 Compiled by:(Name/Title/Dept.)日期 Date: 日期 Date:评审 Reviewed by(Name/Title/Dept.)批准 Approved by:(Name/Title/Dept.)日期 Date:page 1 of 16Risk Analysis公司名称 Company: 产品名称 Product:特征的定性定量分析: (acc. to ISO 14971:2000+A1:2003, cl. 4.2)Identification of qualitative and quantitative characteristics (acc. to ISO 14971:2000, cl. 4.2)1预期用途和怎样使用: Intended use and how to use 是否接触病人或其他人: Intended to contact patient or other person 所用的元件/材料: Materials/components used 能量给予/源于病人: Energy to/from patient 物质给予/源于病人: Substances to /from patient 被加工的生物材料: Biological materials processed 灭菌/用户灭菌或其它微 生物控制: Sterile/Intended to be sterilized 用户是否需日常清洁或消 毒: routinely cleaned and disinfected by the user 改变病人环境:Modify patient environment 测量功能: Measurements 器械输出的数据解释: Interpretative 是否与其它药物或医疗技 术联用:use in conjunction with medicines or other medical technologies 不需要的能量或物质输 出:Unwanted outputs of energy or substances 受环境影响:(操作、运 输的存储的环境,包括溢 出,电能和冷却提供) Susceptible to234 56789 10 11 121314page 2 of 16Risk Analysis公司名称 Company: 产品名称 Product:environmental influences 器械是否影响环境 influence the environment 基本消耗品/附件 Consumables/accessorie s associated 是否需要维护或校正 Routine maintenance/calibration 是否包括软件 Software 是否有严格的寿命周期 Restricted “shelf-life”: 延长/长期使用的影响 Delayed and/or longterm use effect 使用者或病人对器械机械 力控制 Mechanical forces 决定器械的寿命(包括老 化)Lifetime of the device determined 一次性/重复使用 Single use/re-use 是否需安全退出运行或处 置 safe decommissioning or disposal 安装和使用是否需特殊培 训 Special training required to install or use 新生产过程是否需建立或 引入 new manufacturing processes need to be established or introduced 是否器械的成功使用,决 定性的取决于人为因素, 如用户接口 successful application of the medical device critically dependent on human factors, such as user interface 医疗器械是否有连接部分15161718 19 20212223 2425262727.1page 3 of 16Risk Analysis公司名称 Company: 产品名称 Product:或附件 connecting parts or accessories 27.2 是否有控制接口 control interface 27.3 器械是否显示信息 display information 27.4 器械是否由莱单控制 controlled by a menu 28 器械是否可移动或可携带 式 To be mobile or portable Letters in the first column refer to ISO 14971:2000, cl. 4.2. 其它重要的特征page 4 of 16Risk Analysis公司 Company:No.产品 Products : 风险评估Risk Evaluation危害 Hard 总论 General详细说明可能的危害 Identify hazards减低风险措施Risk Reduction Measure证明 EvidenceNHALORSODRLD2. Energy Hazards 能量危害1 2 3 4 5 6 电能 Electricity 热 Heat 机械力 Mechanical force 离子辐射 Ionizing radiation 非离子辐射 Nonionizing radiation 电磁场 Electromagnetic fields 可移动部件 Moving parts 悬浮物 Suspended masses 支持病人器械失败 Patient support device failure 压力(管壁破裂) Pressure(vessel rupture) 声压 Acoustic pressure 振动 Vibration 磁场 Magnetic fields(e.g. MRI)7 8 91011 12 13D3. Biological hazards 生物危害1 微生物污染 Biocontaminationpage 5 of 16Risk Analysis公司 Company:No.产品 Products : 风险评估Risk Evaluation危害 Hard 总论 General详细说明可能的危害 Identify hazards减低风险措施Risk Reduction Measure证明 EvidenceNHALORSODRL2 34 5 6 7 8 9 1011 1213生物不相容 Bioincompatibility 不正确的成份(化学 组成) Incorrect formulation(chemic al composition) 毒性 Toxicity 变态反应性 allergenicity 诱变性 mutagenicity 致瘤性 oncogenicity 致畸性 teratogenicity 致癌性 Carcinogenicity 再感染,交叉感染 Re-and/or crossinfection 致热性 pyrogenicity 不能保持卫生安全 Inability to maintain hygienic safety 降解 DegradationD4. Environmental hazards and contributory factors 环境危害及其形成因素1 电磁场 electromagnetic fields 不充足的能量或冷 却提供 Inadequate supply of power or coolantpage 6 of 162Risk Analysis公司 Company:No.产品 Products : 风险评估Risk Evaluation危害 Hard 总论 General详细说明可能的危害 Identify hazards减低风险措施Risk Reduction Measure证明 EvidenceNHALORSODRL345678910对电磁干扰的敏感 性 Susceptibility to electromagnetic interference 电磁干扰的发射 Emissions of electromagnetic interference 不充足的能量提供 Inadequate supply of power 不充足的冷却提供 inadequate supply of coolant 储存或操作偏离规 定的外部环境条件 Storage or operation outside prescribed environmental conditions 与其它器械不相容 Incompatibility with other devices 意外的机械危害 Accidental mechanical damage 废弃物和/或器械处 置的污染 Contamination due to waste products and /or device disposalpage 7 of 16Risk Analysis公司 Company:No.产品 Products : 风险评估Risk Evaluation危害 Hard 总论 General详细说明可能的危害 Identify hazards减低风险措施Risk Reduction Measure证明 EvidenceNHALORSODRLD5. Hazards resulting from incorrect output of energy and substances 不正确的能量和物质输出产生的危害1 2 3 4 5 电能 electricity 辐射 radiation 音量 volume 压力 pressure 医疗气体的供应 supply of medical gases 麻醉剂的供应 supply of anaesthetic agents6D6. Hazards related to the use of the device and contributory factors 使用器械危害及其形成因素1 2 不适当的标签 Inadequate labeling 不适当的使用手册 Inadequate operating instructions 如: 附件技术规范不适 当 inadequate specification of accessories 预使用检查规范不 适当 inadequate specification of pre-use checks 操作说明书过于复 杂 overcomplicated operatingpage 8 of 16Risk Analysis公司 Company:No.产品 Products : 风险评估Risk Evaluation危害 Hard 总论 Generalinstructions 服务和维修规范不 适当 inadequate specification of service and maintenance 由无经验或未经培 训的人使用 Use by unskilled/untrained personnel 合理的可预见的错 误使用 Reasonably foreseeable misuse 不充分的副作用警 告 Insufficient warning of side effects 不充分的一次性使 用器械重复使用后 的可能危害 Inadequate warning of hazards likely with re-use of single use devices 不正确的测量和其 它方面计量 Incorrect measurement and other metrological aspects 与消耗品/附件/其它 器械不相容 Incompatibility with 详细说明可能的危害 Identify hazards减低风险措施Risk Reduction Measure证明 EvidenceNHALORSODRL345678page 9 of 16Risk Analysis公司 Company:No.产品 Products : 风险评估Risk Evaluation危害 Hard 总论 General详细说明可能的危害 Identify hazards减低风险措施Risk Reduction Measure证明 EvidenceNHALORSODRL9consumables/acces sories/other devices 锐边、锐角 sharp edges or pointsC7. Inappropriate, inadequate or over-complicated user interface (man/machine communication) 不正确、不充分或过于复杂的用户介 不正确、 机交流) 面 (人/机交流) 机交流1 错误或判断错误 Mistakes and judgement errors 重叠和认知检索错 误 Lapses and cognitive recall errors 滑移和疏忽(精神 或实际的)Slips and blunders (mental or physical) 违反或偏离说明 书、程序等 Violation or abbreviation of instructions, procedures, etc., 复杂或混淆的控制 系统 Complex or confusing control system 含糊的或不清晰的 医疗器械状态 Ambiguous or unclear device state 设置、测量或其它page 10 of 16234567Risk Analysis公司 Company:No.产品 Products : 风险评估Risk Evaluation危害 Hard 总论 General信息的含糊或不清 晰的显示 Ambiguous or unclear presentation of settings, measurements or other information 结果的错误呈显示 Mispresentation of results 视觉、听觉或触觉 的不充分 Insufficient visibility, audibility or tactility 动作控制或实际状 态信息显示的图象 不清 Poor mapping of controls to action, or of displayed information to actual state 与现存设备相比, 模式或图象成问题 Controversial modes or mappings as compared to existing equipment 详细说明可能的危害 Identify hazards减低风险措施Risk Reduction Measure证明 EvidenceNHALORSODRL891011D8. Hazards arising from functional failure, maintenance and ageing 功能性失效,维护、老化的危害和形成因素 功能性失效,维护、1 错误的数据转换 Erroneous data transferpage 11 of 16Risk Analysis公司 Company:No.产品 Products : 风险评估Risk Evaluation危害 Hard 总论 General详细说明可能的危害 Identify hazards减低风险措施Risk Reduction Measure证明 EvidenceNHALORSODRL234567维护(包括维修后功 能检查技术参数不 足)的技术参数不足 或缺乏 Lack of , or inadequate specification for maintenance including inadequate specification of post maintenance functional checks 不适当的维护 Inadequate maintenance 缺乏决定器械寿命 的因素决定 Lack of adequate determination of end of device life 缺少电气/机械完整 性 Loss of electrical / mechanical integrity 不适当的包装(污染 和/或器械损坏) Inadequate packaging(contamin ation and /or deterioration of the device ) 重复使用或不正确 的重复使用 re-use and / or Improperpage 12 of 16Risk Analysis公司 Company:No.产品 Products : 风险评估Risk Evaluation危害 Hard 总论 General详细说明可能的危害 Identify hazards减低风险措施Risk Reduction Measure证明 EvidenceNHALORSODRL8re-use 由于重复使用使用 造成的功能恶化 (如液/气路的逐渐 闭塞、流阻、电导 率的变化) Deterioration in function (e.g. gradual occlusion of fluid/gas path, or change in resistance to flow, electrical conductivity) as a result of repeated use.B2. Additional hazards to in vitro diagnostic medical devices 体外诊断医疗器械的额外危害1 批次的不均匀性、 批次和批次的不一 致性 Batch inhomogeneity, batch-to-batch inconsistency 共同的干扰因素 Common interfering factors 延期效应 Carry-over effects 样本标示错误 Specimen identification errors 稳定性问题(在储page 13 of 1623 45Risk Analysis公司 Company:No.产品 Products : 风险评估Risk Evaluation危害 Hard 总论 General存中、运输中、使 用中、容器第一次 打开后)Stability problems (in storage, in shipping, in use, after first opening of the container) 与样本的抽取、准 备及稳定性问题 Problems related to taking, preparation and stability of speciments 先决条件的不适当 技术规范 Inadequate specification of prerequisites 不适当的试验特 性)Inadequate test characteristics 详细说明可能的危害 Identify hazards减低风险措施Risk Reduction Measure证明 EvidenceNHALORSODRL678生产后信息 Post-production information生产后经验 Post-production experience:page 14 of 16Risk Analysis公司 Company:No.产品 Products : 风险评估Risk Evaluation危害 Hard 总论 General详细说明可能的危害 Identify hazards 风险管理经验的评审 Review of risk management experience:减低风险措施Risk Reduction Measure证明 EvidenceNHALORSODRLpage 15 of 16Risk Analysis公司 Company: 产品 Product:缩略词:Abbreviations used RE S O D 风险评估 Risk Evaluation 严重程度 Severity (9 – 非常严重 very severe, 0 –不严重 not severe) 发生频率 Occurrence (9 – 经常 often, 0 – 不发生 never) 可发现 Detection (9 – 当风险发生时不可能发现 impossible to detect before risk occurs, 0 – 当风险发生时一定可发现 will be certainly detected before risk occurs) 风险等级 Risk Level = 严重性 Severity × 发生频率 Occurrence × 可发现 Detection 1-9: 可忽略的风险,不需进一步行动 neglectable risk, no further actions; 9-24: 中等风险,建议预防措 施 moderate: minimal risk, preventive action recommended; 2548: 中等风险,要求预防措施 moderate risk, preventive action required; >48: 风险通常一般不可接受 risk is usually not acceptable 风险减少措施 Risk Reduction Measure 新危害发生 New hazard generated (no/ yes - if yes, 如不可接受, 写出危害号码 then number of new hazard indicated) 风险是否可接受 Acceptable Level of Risk (no/ yes)RLRRM NH ALORpage 16 of 16。
ISO14971医疗器械风险评价程序

医疗器械风险评价程序1目的建立和保持一个系统,以记录本公司的产品有关的危害、估计和评价相关的风险、控制这些风险并监视上述控制的有效性。
2范围适用于本公司生产的所有产品。
3职责3.1 法规部负责执行风险分析,风险评价和风险控制,并形成《风险分析报告》。
3.2 法规部负责收集和评审在生产后的阶段中得到的产品或类似产品的信息,并对信息中可能与安全性有关的问题进行评价。
4工作程序4.1 风险分析4.1.1 描述产品的预期用途、预期目的以及合理可预见的误用;将所有可能影响产品安全性的定性定量特征列出清单;上述记录都应保持在风险管理文档中。
4.1.2 编写在正常和故障两种状态下与产品有关的可知的或可预见的危害清单。
清单应至少包括以下内容并在风险管理中予以记录和保持:1) 能量危害和形成因素压力2) 生物学危害及其形成因素生物污染不正确的配方毒性变态反应性降解3) 环境危害及其形成因素储存或运行偏离预定的环境条件,和其它预期使用的医疗器械不相容意外的机械破坏处置废物产生的污染4) 与产品使用有关的危害和形成因素不适当的标记不适当的操作说明不适当的先决条件技术说明由不熟练/非专业人员使用合理可预见的误用与其它医疗器械的不相容性5) 功能性失效引起的危害和形成因素不适当的包装,引起产品的污染和变质稳定性问题(在储存中、运输中、使用中、容器第一次打开后)批次的不均匀性,批次与批次之间的不一致过期效应4.1.3 对于每一个判定的危害,都应利用可获得的资料或数据估计在正常和故障两种条件下的一个或多个风险。
对于其损害发生概率不能加以估计的危害,应列出一个危害可能产生的后果的清单,并在风险管理文档中加以记录和保持。
在对每一种危害的风险进行评估时,应考虑以下方面:1) 分析结果的可信度;2) 似是而非的检查;3) 对照的可用性;4) 适用于医疗实验室的质量保证措施/方法;5) 缺陷/错误的可检测性;6) 专业人员/非专业人员的使用;7) 信息提供的方法。
ISO14971-2019医疗器械总体残留风险评估记录

文件编号:Q2-8.0-01 ISO14971-2019医疗器械总体残留风险评估记录编制风险评估小组审核批准生效日期2020-04-10XXX医疗科技有限公司目录1、风险管理计划完成情况2、总体残留风险可接受评审3、关于生产和生产后信息4、评审通过的风险管理文档4.1安全特征问题清单及可能的危害4.2初始危害判定和初始风险控制措施4.3风险评估、风险控制措施及残留风险评估记录表1、风险管理计划完成情况评审小组对风险管理计划的完成情况逐一进行了检查,通过对相关风险管理文档的检查,认为风险管理计划已基本实施。
见《风险管理文档》。
2、综合剩余风险可接受评审评审小组对所有剩余风险进行了综合分析,考虑所有单个剩余风险共同影响下的作用,评审结果认为:产品综合剩余风险可接受,以下为具体评价方面:1)单个风险的风险控制是否有相互矛盾的要求?结论:尚未发现现有风险控制有相互矛盾的情况。
2)警告的评审(包括警告是否过多?)结论:警告的提示清晰,符合规范。
3)说明书的评审(包括是否有矛盾的地方,是否难以遵守)结论:产品说明书符合10 号令及产品专用安全标准要求,相关产品安全方面的描述清晰易懂,易于使用者阅读。
4)和类似产品进行比较结论:较类似产品超声图像定量分析诊断仪风险可控性更易接受。
5)评审小组结论结论:风险管理评审小组在分析了以上方面后,一致评价,本产品的综合剩余风险可接受。
3、关于生产和生产后信息生产和生产后信息获取方法参见《质量信息反馈控制程序》(文件编号:版本号:B),评审组对《质量信息反馈控制程序》中的生产和生产后信息获取方式的适宜性和有效性进行了评价,认为:该方法是适宜和有效的,一生产和生产后信息的获取可按照《质量信息反馈控制程序》的要求获得,该项目风险管理负责人对得到的生产和生产后信息进行管理,必要时,风险管理小组开展活动实施动态风险管理。
由于本产品尚未正式生产,一旦正式生产,将对生产中的各类风险情况进行收集,并再次进行分析、评价、控制,更新风险管理报告内容。
ISO14971-2019中文版

• 7.4 利益风险分析…..........…..……............…...…..................……...…·······14 • 7.5 风险控制措施带来的风险……………………………………………………··14 • 7.6 风险控制的完整性......…………..........…..……...….......………·…·········14 • 8 总体残留风险评估............…....................…..….....…...……........…······14 • 9 风险管理审查……...............…...............…..……...….......…·……·············15 • 10 生产和后期制作活动·…..……·….......…..……..….......…·………···········15 • 10.1 -舟�································································································15 • 10.2信息收集·······················································································15
国际标准
ISO 标准 14971
第三版
医疗设备—风险管理在医疗设备中的应用
曰四小
版权保护的文件
©ISO 2019
版权所有。 除非另有说明, 或者在实施时需要,否则,未经事先书面许 可,不得以任何形式或手段,通过电子或机械手段(包括影印或在互联 网或内部网上发布)以任何形式复制或使用本出版物的任何部分。 书面 许可。 可以从以下地址的ISO或请求者所在国家的ISO成员体内请求 许可。 ISO版权局 CP 401•章de Blandonnet 8 CH-1214 Vernier, 日内瓦 电话: +41 22 749 01 11 传真: +41 22 749 09 47 电子邮件: copyright@ 网站: 在瑞士出版
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H8
P2
信息不全
1、 没有注意说明书上注意事项及图示而使产品不能预 期
使用(正常状态)
H9
P2
2、 某些部件缩水程度不同、组装不到位或者漏检
2.损害发生严重度的分析
收集类似产品有关的临床资料和最新不良时间报告等信息,按照 ISO 14971-2019标准和风险管理计划中规定的损害严重度准则对每一 项 危害处境可能引起的损害严重度进行等级划分,具体记录如下表:
编号:XXX
ISO14971-2019医疗器械风险评估记录报告
编制
审核
批准 生效日
期
风险评估小组
年月 日
XXXX医疗有限公司
目录
一、产品描述 二、概述 三、风险评估流程 1.损害发生概率的分析 2.损害发生严重度的分析 3.风险可接受性判断
一、产品描述
超声影像分析仪适用于超声诊断治疗中辅助诊断。 超声影像分析仪在超声检查中通过刷卡自动录入病人信息,可同 步采集 超声图像和视频,并具备录音功能。可将釆集的图像、视频、 音频资料 保存在以病人姓名和超声号命名的同一个文件夹内。超声影 像分析仪能 快速对图像进行定量分析以辅助医师做出超声影像学诊 断,其可分析的 功能包括:肿瘤纵横比、不规则度的自动计算、超声 多普勒信号的提取 与定量、超声回声信号的提取与定量、超声造影时 间-强度曲线的绘制与 分析等;图像处理功能:对图像和视频进行ROI 分析、统计,具备将图像 转化为视频、图像格式转化、图像调节、数 据输出。同时还可对超声图 像进行纹理分析,可反应组织或肿瘤内部 回声的均匀度、不均匀度、峰 值、混乱度。
118
S2
懂或信息不全
1、 没有注意说明书上注意事项及图示而使产品不能
预期使用(正常状态)
H9 2、 某些部件缩水程度不同、组装不到位或者漏检
S2
3.风险可接受性判断
按照风险管理计划确定的风险可接受性准则,对估计的每一个风 险进 行可接受性判断,记录如下: 风险评价记录表
概率
经常
P6
有时
P5
偶然
P4
编
可能引起损害发生的严
可预见的事件及事件序列
号
重度等级
保护接地阻抗、连续漏电流、耐压强度不符合标准 要
H1
S4
求
H2 产品非预期运动
S2
113 元件老化
S3
H4 计算机电磁辐射过高
S2
115 仓库环境温度、湿度不符合要求等
S3
116 产品上标识不明确
S2
H7 包装上防护措施标识不明确不清晰
S3
说明书上注意事项、操作步骤描述繁琐或不清晰易
编号
可预见的事件及事件序列
可能引起损害发生 的概率等级
H1 保护接地阻抗、连续漏电流、耐压强度不符合标准要求
P3
H2 产品非预期运动
P4
H3 元件老化
P2
H4 计算机电磁辐射过高
P2
H5 仓库环境温度、湿度不符合要求等
P4
H6 产品上标识不明确
P3
H7 包装上防护措施标识不明确不清晰
P2
说明书上注意事项、操作步骤描述繁琐或不清晰易懂或
很少
P3
非常少
P2
极少
P1
S4 灾难性
U U U R(H1) R A
严重程度
S3 致命
S2 中度
U
u
U
R
R(H5)H7)
A(H4) (H9)
A
A
SI 轻度
R R R A A A
说明:A:可接受的风险; R:合理可行降低(ALARP)的风险;
U:不经过风险/收益分析即判定为不可接受的风险。
二、概述
按照风险管理过程,对经风险分析确定的危害和危害处境发生的 概率及 其所引起的损害概率与损害的严重程度进行分析并赋值,此过 程称为风 险估计。风险评价过程就是对经估计的风险与风险管理计划 中给定的风 险可接受准则进行比较,以决定该风险的可接受性。
三、风险评估流程
1.损害发生概率的分析
按照ISO 14971-2019标准对上一步分析得到的每一项危害处境 引起的损害 发生概率进行估计,然后依据风险管理计划第4条4.2.2 的损害发生概率等级 的准则,对估计的每一项损害概率划分等级,具 体记录如下表:
