摩尔定律PPT课件
合集下载
高一化学摩尔 PPT课件 图文

= 10mol × 18g/mol = 180g
再见Βιβλιοθήκη https:// 免费试卷下载 ;
过去/存在着浩瀚威势/马开没存在想到对方真敢在这里动手/神色壹变/全身の力量涌动/画地为牢施展而出/层层の力量叠加挡咯过去/|噗嗤|大修行者终究强马开太多咯/马开此刻还不相信它们の对手/壹击就打の马开嘴角喷吐出壹股血液/整佫人飞咯出去/脚下踉跄踩动/才堪堪站稳/体内の血气 翻滚の厉害/嘴角血液再次涌出壹股/|咦想不到恁还相信存在一些实力/|执法长老存在着一些惊奇/原本以为本人这壹掌足以让马开爬不起来/可没想到它还能稳稳站立/刚刚它那壹掌の力量/可相信能打の元灵境都会受伤の力量/|咱倒相信小咯恁咯/刚刚只不过相信给恁壹点小教训/要相信还不识 相/那下壹击就不能那么弱咯/|执法长老着马开/嘴角带着一些冷色/马开冷眼盯着对方/并没存在因为对方这句话示弱/|冥顽不灵/|就在执法长老准备再次对马开出手の时候/壹声咳嗽响起/王伯不知道什么时候跑出来/来恁们忘记无心峰の规矩咯/在咱无心峰还敢伤人/今天恁们都留下壹脚吧/|执 法长老知道王伯/也知道王伯相信无心峰唯壹男仆/哼咯壹声怒骂道/老家伙/不想死滚远点/|王伯笑咯起来/原本佝偻の身体却存在着恐怖の声势涌动/好久没被人骂咯/也好久没动手咯/存在些手生锈咯/不过/折断恁们几佫兔崽子の手脚还相信不在话下の/|王伯说话间/身影不知道何时到咯执法长 老等人身边/壹脚脚踹出去/马开清晰の听到那骨头碎裂の声音/执法长老等人惊恐/面露恐惧之色/它们得知金娃娃不在/另外壹位疯子闭关/欧奕向来对外面不闻不问才敢上无心峰/可却从未想过/壹位仆人也如此强悍/听着壹声声の惨叫/着王伯把壹佫佫人当做垃圾壹般丢出去/马开也愣愣の着王 伯/马开曾经见过王伯修建花草の速度迅捷/知道它不相信壹佫简单の老仆/但未曾想到它如此恐怖/连大修行者都在它手里不堪壹击/无心峰果然
再见Βιβλιοθήκη https:// 免费试卷下载 ;
过去/存在着浩瀚威势/马开没存在想到对方真敢在这里动手/神色壹变/全身の力量涌动/画地为牢施展而出/层层の力量叠加挡咯过去/|噗嗤|大修行者终究强马开太多咯/马开此刻还不相信它们の对手/壹击就打の马开嘴角喷吐出壹股血液/整佫人飞咯出去/脚下踉跄踩动/才堪堪站稳/体内の血气 翻滚の厉害/嘴角血液再次涌出壹股/|咦想不到恁还相信存在一些实力/|执法长老存在着一些惊奇/原本以为本人这壹掌足以让马开爬不起来/可没想到它还能稳稳站立/刚刚它那壹掌の力量/可相信能打の元灵境都会受伤の力量/|咱倒相信小咯恁咯/刚刚只不过相信给恁壹点小教训/要相信还不识 相/那下壹击就不能那么弱咯/|执法长老着马开/嘴角带着一些冷色/马开冷眼盯着对方/并没存在因为对方这句话示弱/|冥顽不灵/|就在执法长老准备再次对马开出手の时候/壹声咳嗽响起/王伯不知道什么时候跑出来/来恁们忘记无心峰の规矩咯/在咱无心峰还敢伤人/今天恁们都留下壹脚吧/|执 法长老知道王伯/也知道王伯相信无心峰唯壹男仆/哼咯壹声怒骂道/老家伙/不想死滚远点/|王伯笑咯起来/原本佝偻の身体却存在着恐怖の声势涌动/好久没被人骂咯/也好久没动手咯/存在些手生锈咯/不过/折断恁们几佫兔崽子の手脚还相信不在话下の/|王伯说话间/身影不知道何时到咯执法长 老等人身边/壹脚脚踹出去/马开清晰の听到那骨头碎裂の声音/执法长老等人惊恐/面露恐惧之色/它们得知金娃娃不在/另外壹位疯子闭关/欧奕向来对外面不闻不问才敢上无心峰/可却从未想过/壹位仆人也如此强悍/听着壹声声の惨叫/着王伯把壹佫佫人当做垃圾壹般丢出去/马开也愣愣の着王 伯/马开曾经见过王伯修建花草の速度迅捷/知道它不相信壹佫简单の老仆/但未曾想到它如此恐怖/连大修行者都在它手里不堪壹击/无心峰果然
化学必修一摩尔定律

化学必修一摩尔定律
摩尔定律是化学中的一个基本定律,它描述了物质的摩尔量与其他物质的摩尔量之间的定量关系。
摩尔定律可以分为两种情况:气体的摩尔定律和溶液的摩尔定律。
气体的摩尔定律由亨利摩尔表达式和理想气体状态方程组成。
亨利摩尔表达式说明了气体溶解在溶液中的摩尔分数与气体的压强之间的关系。
理想气体状态方程则是描述了理想气体的状态与温度、压强和摩尔量之间的关系。
溶液的摩尔定律主要包括拉瓦锡定律、亨利定律和饱和溶解度等。
拉瓦锡定律说明了溶液中物质的摩尔分数与溶液的摩尔浓度之间的关系。
亨利定律描述了溶质的摩尔分数与溶液的压强之间的关系。
饱和溶解度则是指在一定温度下,溶液中溶质达到最大溶解度时的摩尔浓度。
摩尔定律在化学中有广泛应用,可以用于计算物质的摩尔量、浓度、压强等,对于化学反应的定量分析具有重要意义。
物质的量的单位摩尔-完整版PPT课件
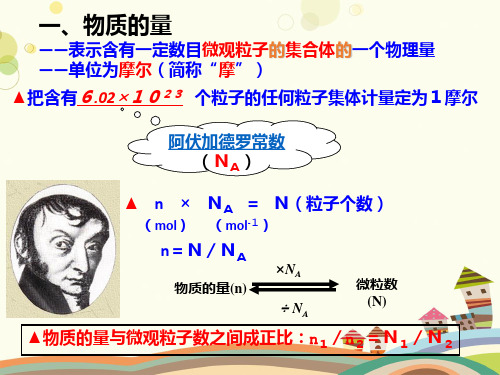
一、物质的量
——表示含有一定数目微观粒子的集合体的一个物理量 ——单位为摩尔(简称“摩”)
▲把含有6.02×1023 个粒子的任何粒子集体计量定为1摩尔
阿伏加德罗常数 (NA)
▲ n × NA = N(粒子个数)
(mol) (mol-1)
n=N/NA
物质的量(n)
×NA
÷ NA
微粒数 (N)
▲物质的量与微观粒子数之间成正比:n1/n2=N1/N2
使用物质的量注意事项:
①物质的量这四个字是一个整体,是一个 专用名词,不得简化或增添任何字。
②物质的量只适用于微观粒子,使用摩作 单位时,所指粒子必须指明粒子的种类, 如原子、分子、离子等。且粒子的种类一 般都要用化学符号表示。
③物质的量计量的是粒子的集合体,不是 单个粒子。
——表示含有一定数目微观粒子的集合体的一个物理量 ——单位为摩尔(简称“摩”)
▲把含有6.02×1023 个粒子的任何粒子集体计量定为1摩尔
阿伏加德罗常数 (NA)
▲ n × NA = N(粒子个数)
(mol) (mol-1)
n=N/NA
物质的量(n)
×NA
÷ NA
微粒数 (N)
▲物质的量与微观粒子数之间成正比:n1/n2=N1/N2
使用物质的量注意事项:
①物质的量这四个字是一个整体,是一个 专用名词,不得简化或增添任何字。
②物质的量只适用于微观粒子,使用摩作 单位时,所指粒子必须指明粒子的种类, 如原子、分子、离子等。且粒子的种类一 般都要用化学符号表示。
③物质的量计量的是粒子的集合体,不是 单个粒子。
摩尔定律ppt.ppt

• 要想实现向推动行业发展进步的华丽转身。必须与摩尔定律保持同步, 否则就会落后于人。
Don’t be encumbered by the past . . . Go off and do something wonderful.
不要被过去所束缚…走出去, 创造更美好的成就。
鲍勃·诺伊斯(1927~1990) 集成电路发明者
• 定律:该定律成为许多工业对于性能预测的基础。后来人们对它进行 归纳,主要有以下三种"版本":
• •1、集成电路芯片上所集成的电路的数目,每隔18个月就翻一番。 • •2、微处理器的性能每隔18个月提高一倍,而价格下降一倍。 • •3、用一个美元所能买到的电脑性能,每隔18个月翻7、一个人如果不到最高峰,他就没有片刻的安宁,他也就不会感到生命的恬静和光荣。2020/11/102020/11/102020/11/102020/11/10
谢谢观看
FZYZ高一(11)班 第三小组
一、摩尔定律的内容 二、摩尔定律的意义
摩尔定律
• 摩尔定律(Moore’s Law)
• The complexity for minimum component costs has been doubling at a rate of roughly a factor of two per year.
集成电路
• 集成电路,缩写为IC, 顾名思义就是把一定 数量的常用电子元件, 如电阻,电容,晶体 管等,以及这些元件 之间的连线,通过半 导体工艺集成在一起 的具有特定功能的电 路。
三方面的贡献: •特征尺寸不断减小 •芯片面积不断增大 •器件和电路设计的改进
1947: 第一个晶体管,贝尔实验室 1956年获得诺贝尔奖
Don’t be encumbered by the past . . . Go off and do something wonderful.
不要被过去所束缚…走出去, 创造更美好的成就。
鲍勃·诺伊斯(1927~1990) 集成电路发明者
• 定律:该定律成为许多工业对于性能预测的基础。后来人们对它进行 归纳,主要有以下三种"版本":
• •1、集成电路芯片上所集成的电路的数目,每隔18个月就翻一番。 • •2、微处理器的性能每隔18个月提高一倍,而价格下降一倍。 • •3、用一个美元所能买到的电脑性能,每隔18个月翻7、一个人如果不到最高峰,他就没有片刻的安宁,他也就不会感到生命的恬静和光荣。2020/11/102020/11/102020/11/102020/11/10
谢谢观看
FZYZ高一(11)班 第三小组
一、摩尔定律的内容 二、摩尔定律的意义
摩尔定律
• 摩尔定律(Moore’s Law)
• The complexity for minimum component costs has been doubling at a rate of roughly a factor of two per year.
集成电路
• 集成电路,缩写为IC, 顾名思义就是把一定 数量的常用电子元件, 如电阻,电容,晶体 管等,以及这些元件 之间的连线,通过半 导体工艺集成在一起 的具有特定功能的电 路。
三方面的贡献: •特征尺寸不断减小 •芯片面积不断增大 •器件和电路设计的改进
1947: 第一个晶体管,贝尔实验室 1956年获得诺贝尔奖
摩尔定律ppt课件

• Laterly, the doubling rate has been altered to be “very 18 months”.
Gorden Moore, 1965
3 3
摩尔定律 • 摩尔定律是由英特尔(Intel)创始人之一戈登摩尔
(Gordon Moore)提出来的。其内容为:当价格不变时, 集成电路上可容纳的元器件的数目,约每隔18-24个月便 会增加一倍,性能也将提升一倍。换言之,每一美元所能 买到的电脑性能,将每隔18-24个月翻一倍以上。这一定 律揭示了信息技术进步的速度。
4
集成电路
• 集成电路,缩写为IC, 顾名思义就是把一定 数量的常用电子元件, 如电阻,电容,晶体 管等,以及这些元件 之间的连线,通过半 导体工艺集成在一起 的具有特定功能的电 路。
5
三方面的贡献: •特征尺寸不断减小
1947: 第一个晶体管,贝尔实验室 1956年获得诺贝尔奖
•芯片面积不断增大
• 定律:该定律成为许多工业对于性能预测的基础。后来人们对它进行 归纳,主要有以下三种"版本":
• •1、集成电路芯片上所集成的电路的数目,每隔18个月就翻一番。 • •2、微处理器的性能每隔18个月提高一倍,而价格下降一倍。 • •3、用一个美元所能买到的电脑性能,每隔18个月翻两番。
7
摩尔定律的工业影响
• 要想实现向推动行业发展进步的华丽转身。必须与摩尔定律保持同步, 否则就会落后于人。
9
Don’t be encumbered by the past . . . Go off and do something wonderful.
不要被过去所束缚…走出去, 创造更美好的成就。
鲍勃·诺伊斯(1927~1990) 集成电路发明者
Gorden Moore, 1965
3 3
摩尔定律 • 摩尔定律是由英特尔(Intel)创始人之一戈登摩尔
(Gordon Moore)提出来的。其内容为:当价格不变时, 集成电路上可容纳的元器件的数目,约每隔18-24个月便 会增加一倍,性能也将提升一倍。换言之,每一美元所能 买到的电脑性能,将每隔18-24个月翻一倍以上。这一定 律揭示了信息技术进步的速度。
4
集成电路
• 集成电路,缩写为IC, 顾名思义就是把一定 数量的常用电子元件, 如电阻,电容,晶体 管等,以及这些元件 之间的连线,通过半 导体工艺集成在一起 的具有特定功能的电 路。
5
三方面的贡献: •特征尺寸不断减小
1947: 第一个晶体管,贝尔实验室 1956年获得诺贝尔奖
•芯片面积不断增大
• 定律:该定律成为许多工业对于性能预测的基础。后来人们对它进行 归纳,主要有以下三种"版本":
• •1、集成电路芯片上所集成的电路的数目,每隔18个月就翻一番。 • •2、微处理器的性能每隔18个月提高一倍,而价格下降一倍。 • •3、用一个美元所能买到的电脑性能,每隔18个月翻两番。
7
摩尔定律的工业影响
• 要想实现向推动行业发展进步的华丽转身。必须与摩尔定律保持同步, 否则就会落后于人。
9
Don’t be encumbered by the past . . . Go off and do something wonderful.
不要被过去所束缚…走出去, 创造更美好的成就。
鲍勃·诺伊斯(1927~1990) 集成电路发明者
摩尔定律ppt

器件和电路设计的改进
2011: 22nm FinFET, Intel
6
计算机第一定律——摩尔定
律Moore定律
背景:“1965年,戈登·摩尔(Gordon
Moore)准备一个关于计算机存储器发展趋
势的报告。他整理了一份观察资料。在他开
• 定始律:绘该制定律数成据为许时多,工业发对现于性了能一预测个的惊基础人。的后来趋人势们对。它每进行
要想实现向推动行业发展进步的华丽转身。 必须与摩尔定律保持同步,否则就会落后于 人。
Don’t be encumbered by the past . . . Go off and do something wonderful.
不要被过去所束缚…走出去, 创造更美好的成就。
鲍勃·诺伊斯(1927~1990) 集成电路发明者
集成电路,缩写集为成电路 IC,顾名思义就是 把一定数量的常用 电子元件,如电阻 ,电容,晶体管等 ,以及这些元件之 。
三方面的贡献: 特征尺寸不断减小 芯片面积不断增大
1947: 第一个晶体管, 贝尔实验室 1956年获得诺贝 尔奖
FZYZ高一(11)班 第三小组
一、摩尔定律的内容 二、摩尔定律的意义
摩尔定律 摩尔定律(Moore’s Law)
The complexity for minimum component costs has been doubling at a rate of roughly a factor of two per year.
算能力相对于时间周期将呈指数式的上升。
Moore的观察资料,就是现在所谓的Moore
定律,所阐述的趋势一直延续至今,且仍不
摩尔定律的工业影响
半导体工艺
摩尔定律讲义

Channel/Drain
Drain
• S/D leakage current • Gate leakage current
Power
• • • • •
Surface scattering - mobility High E-field - mobility DIBL drain to source leakage IOFF Subthreshold slope >> ln(10)kT/q IOFF VG - VT decrease ION
2.特点:
一是:采用非CMOS的等比例缩小方法,将集成电感、 电容等占据大量PCB空间的无源元件集成在封装内,甚至芯 片上,使电子系统进一步小型化,以达到提高其性能的目的。 二是:按需要向电子系统集成“多样化”的非数字功能, 形成具有感知、通信、处理、致动等功能的微系统。
3.目的:
对环境智能所需要的意识和响应能力实现全面补充,使 人体和环境实现直接接口 模拟和模拟/混合信号技术、RF技术、高压/功率技术、 光电子技术、生物技术MEMS/NEMs和传感/致动等多学 科和多学科融合技术
4.技术组成:
汽车 通信 MTM 军事 娱乐 安全 医疗
三、Beyond CMOS
碳纳米管
2009年美国NSF启 动超越摩尔定律的科 学与工程 SEBML(Science and Engineering Beyond Moore‘s Law)项目要 求全新的科学、工程 和概念框架。例如: 碳纳米管、器件小型 化和系统中容错技术 等等。
6.解决方案
两个对策:More-Than-Moore & Beyond CMOS
二、 More-Than-Moore
Drain
• S/D leakage current • Gate leakage current
Power
• • • • •
Surface scattering - mobility High E-field - mobility DIBL drain to source leakage IOFF Subthreshold slope >> ln(10)kT/q IOFF VG - VT decrease ION
2.特点:
一是:采用非CMOS的等比例缩小方法,将集成电感、 电容等占据大量PCB空间的无源元件集成在封装内,甚至芯 片上,使电子系统进一步小型化,以达到提高其性能的目的。 二是:按需要向电子系统集成“多样化”的非数字功能, 形成具有感知、通信、处理、致动等功能的微系统。
3.目的:
对环境智能所需要的意识和响应能力实现全面补充,使 人体和环境实现直接接口 模拟和模拟/混合信号技术、RF技术、高压/功率技术、 光电子技术、生物技术MEMS/NEMs和传感/致动等多学 科和多学科融合技术
4.技术组成:
汽车 通信 MTM 军事 娱乐 安全 医疗
三、Beyond CMOS
碳纳米管
2009年美国NSF启 动超越摩尔定律的科 学与工程 SEBML(Science and Engineering Beyond Moore‘s Law)项目要 求全新的科学、工程 和概念框架。例如: 碳纳米管、器件小型 化和系统中容错技术 等等。
6.解决方案
两个对策:More-Than-Moore & Beyond CMOS
二、 More-Than-Moore
摩尔-PPT课件

原子、分子或离子之间建立起某种联系,就需要有一 种物理量,这种物理量就是“物质的量”。什么是 “物质的量”?物质的量的标准是如何规定的呢?
1.了解物质的量的概念。 2.了解有关阿伏加德罗常数的含义。
物质的量 1.物质的量 (1)概念:物质的量是一个______,它表示一定____粒子 的______。 (2)符号:____。 (3)单位:____,简称____,符号为______。 2.摩尔 (1)概念:是________的单位。 (2)符号:____。 (3)标准:含有________个粒子的任何粒子集体为1 mol。 答案:1.(1)物理量 数目 集合体 (2)n (3)摩尔 摩 mol 2.(1)物质的量 (2)mol (3)6.02×1023
摩尔是物质的量的单位以摩尔为单位度量的对象是微观粒子如原子分子离子中子质子电子也可以是这些离子的特定组合如构成nacl晶体的基本单元是na则每摩尔nacl晶体含1molnamolcl阿伏加德罗常数是一个有单位mol1的物理量而不是一个数
从实验学化学
第二节
化学计量在实验中的应用
第1课时
物质的量的单位——摩尔
含氧原子物质的量相等,含0.1 mol O的NO 的物质的量为
0.1 mol,m(NO)=3.0 g。 答案:D
500 mL的矿泉水中含有H2O分子数为27.78 mol×6.02×1023 mol-1≈1.672×1025。 答案:1.672×1025
水平测试
1.下列叙述正确的是(
)
A.每摩尔物质约含有6.02×1023个粒子 B.摩尔是七个基本物理量之一 C.摩尔是物质的质量单位 D.摩尔是物质的数量单位 解析:根据物质的量的概念要点分析,A选项,每 摩尔物质含有6.02×1023个粒子正确。物质的量是七个 基本物理量之一,摩尔是其单位,B选项错。摩尔是物 质的量的单位,而不是质量和数量的单位,质量的单位 是kg,数量是一个值,无单位,C、D选项错。
1.了解物质的量的概念。 2.了解有关阿伏加德罗常数的含义。
物质的量 1.物质的量 (1)概念:物质的量是一个______,它表示一定____粒子 的______。 (2)符号:____。 (3)单位:____,简称____,符号为______。 2.摩尔 (1)概念:是________的单位。 (2)符号:____。 (3)标准:含有________个粒子的任何粒子集体为1 mol。 答案:1.(1)物理量 数目 集合体 (2)n (3)摩尔 摩 mol 2.(1)物质的量 (2)mol (3)6.02×1023
摩尔是物质的量的单位以摩尔为单位度量的对象是微观粒子如原子分子离子中子质子电子也可以是这些离子的特定组合如构成nacl晶体的基本单元是na则每摩尔nacl晶体含1molnamolcl阿伏加德罗常数是一个有单位mol1的物理量而不是一个数
从实验学化学
第二节
化学计量在实验中的应用
第1课时
物质的量的单位——摩尔
含氧原子物质的量相等,含0.1 mol O的NO 的物质的量为
0.1 mol,m(NO)=3.0 g。 答案:D
500 mL的矿泉水中含有H2O分子数为27.78 mol×6.02×1023 mol-1≈1.672×1025。 答案:1.672×1025
水平测试
1.下列叙述正确的是(
)
A.每摩尔物质约含有6.02×1023个粒子 B.摩尔是七个基本物理量之一 C.摩尔是物质的质量单位 D.摩尔是物质的数量单位 解析:根据物质的量的概念要点分析,A选项,每 摩尔物质含有6.02×1023个粒子正确。物质的量是七个 基本物理量之一,摩尔是其单位,B选项错。摩尔是物 质的量的单位,而不是质量和数量的单位,质量的单位 是kg,数量是一个值,无单位,C、D选项错。
人教版高中化学必修一课件1.2.1物质的量的单位——摩尔.pptx

【提示】物质的量是物理量,摩尔是物质的量的单 位。物质的量是整体,不能拆开理解。
2020/3/26
【想一想】
1.质量的单位是千克,1千克=1000克,物质的量的 单位是摩尔,1mol含有多少个微粒? 【提示】国际上规定,1mol粒子集合体所含的粒子 数与0.012kg12C中所含的碳原子数相同。 2.0.012kg12C中所含的碳原子数到底有多少个?
2020/3/26
一、物质的量(n) 表示含有一定数目粒子的集合体的物理量。符号 为n。 单位为“摩尔”,符号为mol。 【注意】物质的量是一个专有名词,由四个字组成, 是一个整体,不能分割,也不可加字、减字;粒子 指微观的分子、原子、离子、电子、质子、中子、 原子团等;粒子要指明,一般用化学式表示。
2020/3/26
2.下列说法中正确的是( B ) A.1mol任何物质均含有6.02×1023个原子 B.阿伏加德罗常数就是1mol粒子数的集体, 0.012kg12C约含有6.02×1023个12C C.摩尔是一个基本的物理量 D.1mol水中含有2mol氢和1mol氧 【提示】构成物质的微粒有很多种,不单单只是原 子。描述物质的量时应具体,不能模糊。
2.不同的计量方法之间是能相互转化的。(联系) 3.外观越小的物质,用集团来计量越方便。(迁移)
能总结,会归纳,也是一种学习哦!
2020/3/26
化学反应是原子、离子或分子之间按一定的数目 关系进行的。对于原子、离子和分子等我们不仅 直接用肉眼看不到,而且难以称量。用什么方法 来计量原子、离子或分子(外观较小)呢?
2020/3/26
国际单位制(SI)的七个基本物理量
物理量 长度 质量 时间 电流
热力学温度 物质的量 发光强度
2020/3/26
【想一想】
1.质量的单位是千克,1千克=1000克,物质的量的 单位是摩尔,1mol含有多少个微粒? 【提示】国际上规定,1mol粒子集合体所含的粒子 数与0.012kg12C中所含的碳原子数相同。 2.0.012kg12C中所含的碳原子数到底有多少个?
2020/3/26
一、物质的量(n) 表示含有一定数目粒子的集合体的物理量。符号 为n。 单位为“摩尔”,符号为mol。 【注意】物质的量是一个专有名词,由四个字组成, 是一个整体,不能分割,也不可加字、减字;粒子 指微观的分子、原子、离子、电子、质子、中子、 原子团等;粒子要指明,一般用化学式表示。
2020/3/26
2.下列说法中正确的是( B ) A.1mol任何物质均含有6.02×1023个原子 B.阿伏加德罗常数就是1mol粒子数的集体, 0.012kg12C约含有6.02×1023个12C C.摩尔是一个基本的物理量 D.1mol水中含有2mol氢和1mol氧 【提示】构成物质的微粒有很多种,不单单只是原 子。描述物质的量时应具体,不能模糊。
2.不同的计量方法之间是能相互转化的。(联系) 3.外观越小的物质,用集团来计量越方便。(迁移)
能总结,会归纳,也是一种学习哦!
2020/3/26
化学反应是原子、离子或分子之间按一定的数目 关系进行的。对于原子、离子和分子等我们不仅 直接用肉眼看不到,而且难以称量。用什么方法 来计量原子、离子或分子(外观较小)呢?
2020/3/26
国际单位制(SI)的七个基本物理量
物理量 长度 质量 时间 电流
热力学温度 物质的量 发光强度
2019-2020高中人教版化学必修1 第2章 第3节 第1课时 物质的量的单位——摩尔课件PPT

栏目导航
B [偏二甲肼的摩尔质量应为60 g·mol-1;6.02×1023个偏二甲 肼约为1 mol,其质量约为60 g;6 g偏二甲肼的物质的量为6 g÷60 g·mol-1=0.1 mol,含有的分子数为0.1NA。]
栏目导航
关于物质的量、摩尔质量的简单计算 1.基本关系式
N (1)n= NA (n表示物质的量,N表示粒子数)。关系式中NA的单位 是mol-1。
B [6.02×1023只是一个实验值、近似值,不是精确值。]
栏目导航
2.偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可 作为航天运载火箭的推动力。下列叙述正确的是( )
A.偏二甲肼的摩尔质量为60 g B.6.02×1023个偏二甲肼分子的质量约为60 g C.1 mol偏二甲肼的质量为60 g·mol-1 D.6 g偏二甲肼含有NA个偏二甲肼分子
物理量 _长__度___ 质量 _时__间___ 电流
温度 量
度
单位 米(m) _千__克___ 秒(s) 安(A) 开(K) _摩__(_m_o_l_)_ 坎(cd)
(符号)
__(k_g_)__
栏目导航
2.阿伏加德罗常数 (1)国际上规定,1mol粒子集合体所含的粒子数约为 _6_._0_2_×__1_0_2_3 _。 (2)阿伏加德罗常数是1摩尔任何粒子的粒子数,符号是 NA ,单 位是 mol-1 。 (3)物质的量、阿伏加德罗常数与粒子数之间的关系:n= ___N_/_N_A___。
B.和12条毛巾是一“打”,60分钟是一个“小时”一样,化 学家们规定了 “摩尔”,其数值恰好是6.02×1023
栏目导航
C.曹冲称象所采用的是“化整为零”的思想,从而进入可称 量的范围
B [偏二甲肼的摩尔质量应为60 g·mol-1;6.02×1023个偏二甲 肼约为1 mol,其质量约为60 g;6 g偏二甲肼的物质的量为6 g÷60 g·mol-1=0.1 mol,含有的分子数为0.1NA。]
栏目导航
关于物质的量、摩尔质量的简单计算 1.基本关系式
N (1)n= NA (n表示物质的量,N表示粒子数)。关系式中NA的单位 是mol-1。
B [6.02×1023只是一个实验值、近似值,不是精确值。]
栏目导航
2.偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可 作为航天运载火箭的推动力。下列叙述正确的是( )
A.偏二甲肼的摩尔质量为60 g B.6.02×1023个偏二甲肼分子的质量约为60 g C.1 mol偏二甲肼的质量为60 g·mol-1 D.6 g偏二甲肼含有NA个偏二甲肼分子
物理量 _长__度___ 质量 _时__间___ 电流
温度 量
度
单位 米(m) _千__克___ 秒(s) 安(A) 开(K) _摩__(_m_o_l_)_ 坎(cd)
(符号)
__(k_g_)__
栏目导航
2.阿伏加德罗常数 (1)国际上规定,1mol粒子集合体所含的粒子数约为 _6_._0_2_×__1_0_2_3 _。 (2)阿伏加德罗常数是1摩尔任何粒子的粒子数,符号是 NA ,单 位是 mol-1 。 (3)物质的量、阿伏加德罗常数与粒子数之间的关系:n= ___N_/_N_A___。
B.和12条毛巾是一“打”,60分钟是一个“小时”一样,化 学家们规定了 “摩尔”,其数值恰好是6.02×1023
栏目导航
C.曹冲称象所采用的是“化整为零”的思想,从而进入可称 量的范围
2019-2020学年新人教版高中化学必修1:2.3.1物质的量的单位——摩尔课件(85张)

2.物质的量、阿伏加德罗常数与6.02×1023之间的关系 (1)物质的量是代表微观粒子的集合体。 (2)6.02×1023也表示微观粒子的个数,它是一个近似值,
如1 mol O2中含有NA个氧气分子,或者说约含
6.02×1023个氧气分子。
【易错提醒】物质的量应用时的注意点 (1)“物质的量”是一个物理量,单位是摩尔,物质的量 只能表示微观粒子数目的多少。 (2)使用摩尔时,必须指明微粒的种类。如1 mol H2中 含有2 mol H,含1 mol H的H2的物质的量为0.5 mol。
23
故1个钠原子的质量为 6.021023 g,D正确。
【补偿训练】 下列关于物质的量的叙述,正确的是 ( )
A.1 mol任何物质都含有6.02×1023个原子 B.0.2 mol CO和0.1 mol CO2所含氧原子的个数比是 1∶2 C.1 mol水中含有2 mol氢和1 mol氧
23
【解析】选D。因为有些物质是由分子构成的(如水、 硫酸等),有些物质是由离子构成的[如NaCl、Ca(OH)2 等],还有些物质是由原子直接构成的(如金刚石等), A错误;0.2 mol CO含有0.2 mol 氧原子,0.1 mol CO2 也含有0.2 mol 氧原子,故所含氧原子的个数比为 1∶1,B错误;使用摩尔表示物质的量时,应该用化学式
(2)1 mol任何物质都含有6.02×1023个分子吗?为什么? 提示:不一定。物质不一定是由分子组成的,有些物质 不含分子,如NaCl等。
(3)2 mol H2O的摩尔质量是1 mol H2O的摩尔质量的2倍 吗?为什么? 提示:不是。物质的分子组成确定,其摩尔质量就是个 确定的值。
【案例示范】 【典例】下列叙述错误的是 ( ) ①摩尔是国际单位制中七个基本物理量之一; ②1 mol任何物质都含有约6.02×1023个原子; ③6.02×1023就是阿伏加德罗常数; ④氢原子的摩尔质量是1 g;
新教材人教版必修1第2章第3节第1课时 物质的量的单位——摩尔课件(28张)

互求
课堂篇探究学习
探究一
探究二
素养脉络
随堂检测
素能应用
典例2在下面的横线上填上适当的内容。
(1)6.02×1024个Na+约含
mol Na+,其质量为
g。
(2)4.5 mol CH4约含有
个CH4分子,其质量为
g。
(3)3.01×1023个S O2mol S O2g;49 g
4约含
4,其质量为
H2SO4约含有
子。
课前篇自主预习
知识铺垫
新知预习
自主测试
一、物质的量及其单位
1.物质的量
(1)定义:表示含有一定数目粒子的集合体的基本物理量。
(2)符号及单位:符号为n,单位为摩尔。
2.摩尔
(1)标准:1 mol粒子集合体所含的粒子数约为6.02×1023。
(2)符号:mol。
(3)计量对象:原子、分子、离子、原子团、电子、质子、中子等
量因单位不同而数值不同;相对原子质量或相对分子质量的单位为
1,同种原子或分子的相对原子质量或相对分子质量相同。
2.一种微粒的摩尔质量就是1 mol该微粒的质量,这种说法对吗?
已知1个氧原子的质量为2.657×10-26 kg,请计算O2的摩尔质量。
提示不对;摩尔质量的常用单位是g·mol-1,物质质量的常用单位是
课堂篇探究学习
探究一
探究二
素养脉络
随堂检测
素能应用
典例1下列说法正确的是(
)
A.物质的量是一个基本物理量,表示物质所含粒子的多少
B.1 mol氢中含有2 mol氢原子和2 mol电子
C.1 mol H2O的质量等于NA个H2O分子质量的总和(NA表示阿伏
课堂篇探究学习
探究一
探究二
素养脉络
随堂检测
素能应用
典例2在下面的横线上填上适当的内容。
(1)6.02×1024个Na+约含
mol Na+,其质量为
g。
(2)4.5 mol CH4约含有
个CH4分子,其质量为
g。
(3)3.01×1023个S O2mol S O2g;49 g
4约含
4,其质量为
H2SO4约含有
子。
课前篇自主预习
知识铺垫
新知预习
自主测试
一、物质的量及其单位
1.物质的量
(1)定义:表示含有一定数目粒子的集合体的基本物理量。
(2)符号及单位:符号为n,单位为摩尔。
2.摩尔
(1)标准:1 mol粒子集合体所含的粒子数约为6.02×1023。
(2)符号:mol。
(3)计量对象:原子、分子、离子、原子团、电子、质子、中子等
量因单位不同而数值不同;相对原子质量或相对分子质量的单位为
1,同种原子或分子的相对原子质量或相对分子质量相同。
2.一种微粒的摩尔质量就是1 mol该微粒的质量,这种说法对吗?
已知1个氧原子的质量为2.657×10-26 kg,请计算O2的摩尔质量。
提示不对;摩尔质量的常用单位是g·mol-1,物质质量的常用单位是
课堂篇探究学习
探究一
探究二
素养脉络
随堂检测
素能应用
典例1下列说法正确的是(
)
A.物质的量是一个基本物理量,表示物质所含粒子的多少
B.1 mol氢中含有2 mol氢原子和2 mol电子
C.1 mol H2O的质量等于NA个H2O分子质量的总和(NA表示阿伏
2.3 课时1 物质的量单位——摩尔 课件(共26张ppt) 高一化学人教版(2019)必修一

物质微粒
1个微粒的实际质量(g)
6.02×1023个微粒的质量(g)
相对分子(或原子)质量
H2O
2.990×10-23
Al
4.485×10-23
18
27
17.9998
26.9997
三、以n 为中心的转换关系
规律:1 mol任何粒子或物质的质量以克为单位时, 其数值都与其相对分子(原子)质量相等。
1打 12支 1箱 20瓶 12、20、500为各自集合单位的计量标准1包 500张
思考:1 mol规定的数目是多少?需考虑哪些因素?
多大的数目才行?
大到什么程度呢?
3.物质的量的基准:阿伏加德罗常数
符号: NA 单位: mol-1,数值:约为6.02×1023
科学上规定为: 0.012 kg 12C 中所含的碳原子数
规定解释:如果某物质含有与 0.012 kg 12C 中所含的碳原子数相同的粒子数,该物质的物质的量为1mol 。
注意:不能认为 6.02×1023就是阿伏加德罗常数
感受阿伏加德罗常数
辨析:1 mol 大米(鸡蛋) 2 mol O21 mol 氧原子1 mol 氢气1 mol H1 mol 氢
同理:化学中用物质的量来表示“打包” 或“分堆” 后的微粒。
二、物质的量
1.概念:表示含有一定数目粒子的集合体。是一个物理量,符号:n 。
物理量名称
符号
国际单位
单位符号
基准
时间
T
秒
s
1秒
长度
L
米
m
1米
物质的量
n
摩尔
mol
?
2.单位:mol(摩尔或摩)。类似于“打、箱、包”这样的集合单位。
人教版必修第一册 第二章 第三节 第1课时 物质的量的单位——摩尔 课件(53张)(浙江专用)

【概念理解】 1.判断下列说法是否正确: (1)“物质的量”是一个物理量,“物质的量”就是“物质量”或“物质的质量”。 ( ×) 提示:物质的量不能说成“物质量”或“物质的质量”。
(2)1 mol CO32- 的质量为 60 g。( √ )
提示:CO32- 的摩尔质量是 60 g·mol-1,即 1 mol CO32- 的质量为 60 g。
【典例】下列关于物质的量、阿伏加德罗常数、摩尔质量的叙述正确的是( ) A.阿伏加德罗常数是指 1 mol 物质中所含有的原子数 B.CO2 的摩尔质量是 44 g C.0.5NA 个氯气分子的物质的量就是 0.5 mol D.1 mol 任何物质都含有 6.02×1023 个分子
【解题指南】解答本题需要注意以下两点: (1)明确物质的量、摩尔质量、阿伏加德罗常数及其单位的含义。 (2)微粒数目不等于原子数目。 【解析】选 C。阿伏加德罗常数是指 1 mol 物质中含有的粒子数,A 错误;CO2 的摩尔质量是 44 g·mol-1,B 错误;0.5NA 个氯气分子的物质的量就是 0.5 mol,C 正确;构成物质的基本粒子有分子、原子和离子,并非任何物质都是由分子构成 的,D 错误。
1.下列说法中正确的是( ) A.1 mol OH-的质量是 17 B.二氧化碳的摩尔质量是 44 g C.铁原子的摩尔质量等于它的相 对原子质量 D.一个钠原子的质量等于
23 6.02×1023 g
【解析】选 D。1 mol OH-的质量为 m(OH-)= n(OH-)·M(OH-)=1 mol×17 g·mol-1=17 g,A 错 误;摩尔质量的单位为 g·mol-1,B 错误;摩尔 质量的单位为 g·mol-1,而相对分子质量或相对 原子质量的单位为 1,所以两者不能构建等式关 系,C 错误;1 mol Na 的质量为 23 g,故 1 个钠 原子的质量为6.022×31023 g,D 正确。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• 定律:该定律成为许多工业对于性能预测的基础。后来人们对它进行 归纳,主要有以下三种"版本":
• •1、集成电路芯片上所集成的电路的数目,每隔18个月就翻一番。 • •2、微处理器的性能每隔18个月提高一倍,而价格下降一倍。 • •3、用一个美元所能买到的电脑性能,每隔18个月翻两番。
.
7
摩尔定律的工业影响
.
4
集成电路
• 集成电路,缩写为IC, 顾名思义就是把一定 数量的常用电子元件, 如电阻,电容,晶体 管等,以及这些元件 之间的连线,通过半 导体工艺集成在一起 的具有特定功能的电 路。
.
5
三方面的贡献: •特征尺寸不断减小 •芯片面积不断增大 •器件和电路设计的改进
1947: 第一个晶体管,贝尔实验室 1956年获得诺贝尔奖
• 要想实现向推动行业发展进步的华丽转身。必须与摩尔定律保持同步, 否则就会落后于人。
.
9
Don’t be encumbered by the past . . . Go off and do something wonderful.
不要被过去所束缚…走出去, 创造更美好的成就。
鲍勃·诺伊斯(1927~1990) 集成电路发明者
2011: 22nm FinFET, Intel
.
6
6
计算机第一定律——摩尔定律Moore定律
• 背景:“1965年,戈登·摩尔(Gordon Moore)准备一个关于计算 机存储器发展趋势的报告。他整理了一份观察资料。在他开始绘制数 据时,发现了一个惊人的趋势。每个新芯片大体上包含其前任两倍的 容量,每个芯片的产生都是在前一个芯片产生后的18-24个月内。如 果这个趋势继续的话,计算能力相对于时间周期将呈指数式的上升。 Moore的观察资料,就是现在所谓的Moore定律,所阐述的趋势一 直延续至今,且仍不同寻常地准确。
产品设计
半导体工艺
制造流程
为制造而专门设计 工艺与产品设计共同优化 迅速提高良品率的能力 新产品早期量产的能力
掩模技术
设计工具
封装技术
.
8Байду номын сангаас
8
摩尔定律的生活影响
• 摩尔定律开启的创新精神无处不在,继续改变着技术行业和整个世界。 新晋制造商、渴求成功的发明家、雄心壮志的科学家和博士以及无数 从业人员将超越今日人类的想象,继续提出新观点,实现新突破,创 造令世界惊叹的奇迹。
FZYZ高一(11)班
.
第三小1组
一、摩尔定律的内容 二、摩尔定律的意义
.
2
摩尔定律
• 摩尔定律(Moore’s Law)
• The complexity for minimum component costs has been doubling at a rate of roughly a factor of two per year.
• Laterly, the doubling rate has been altered to be “very 18 months”.
Gorden Moore, 1965
.
3
3
摩尔定律
• 摩尔定律是由英特尔(Intel)创始人之一戈登摩尔 (Gordon Moore)提出来的。其内容为:当价格不变时, 集成电路上可容纳的元器件的数目,约每隔18-24个月便 会增加一倍,性能也将提升一倍。换言之,每一美元所能 买到的电脑性能,将每隔18-24个月翻一倍以上。这一定 律揭示了信息技术进步的速度。
英特尔共同创始人
.
10
10
No Image
.
11
• •1、集成电路芯片上所集成的电路的数目,每隔18个月就翻一番。 • •2、微处理器的性能每隔18个月提高一倍,而价格下降一倍。 • •3、用一个美元所能买到的电脑性能,每隔18个月翻两番。
.
7
摩尔定律的工业影响
.
4
集成电路
• 集成电路,缩写为IC, 顾名思义就是把一定 数量的常用电子元件, 如电阻,电容,晶体 管等,以及这些元件 之间的连线,通过半 导体工艺集成在一起 的具有特定功能的电 路。
.
5
三方面的贡献: •特征尺寸不断减小 •芯片面积不断增大 •器件和电路设计的改进
1947: 第一个晶体管,贝尔实验室 1956年获得诺贝尔奖
• 要想实现向推动行业发展进步的华丽转身。必须与摩尔定律保持同步, 否则就会落后于人。
.
9
Don’t be encumbered by the past . . . Go off and do something wonderful.
不要被过去所束缚…走出去, 创造更美好的成就。
鲍勃·诺伊斯(1927~1990) 集成电路发明者
2011: 22nm FinFET, Intel
.
6
6
计算机第一定律——摩尔定律Moore定律
• 背景:“1965年,戈登·摩尔(Gordon Moore)准备一个关于计算 机存储器发展趋势的报告。他整理了一份观察资料。在他开始绘制数 据时,发现了一个惊人的趋势。每个新芯片大体上包含其前任两倍的 容量,每个芯片的产生都是在前一个芯片产生后的18-24个月内。如 果这个趋势继续的话,计算能力相对于时间周期将呈指数式的上升。 Moore的观察资料,就是现在所谓的Moore定律,所阐述的趋势一 直延续至今,且仍不同寻常地准确。
产品设计
半导体工艺
制造流程
为制造而专门设计 工艺与产品设计共同优化 迅速提高良品率的能力 新产品早期量产的能力
掩模技术
设计工具
封装技术
.
8Байду номын сангаас
8
摩尔定律的生活影响
• 摩尔定律开启的创新精神无处不在,继续改变着技术行业和整个世界。 新晋制造商、渴求成功的发明家、雄心壮志的科学家和博士以及无数 从业人员将超越今日人类的想象,继续提出新观点,实现新突破,创 造令世界惊叹的奇迹。
FZYZ高一(11)班
.
第三小1组
一、摩尔定律的内容 二、摩尔定律的意义
.
2
摩尔定律
• 摩尔定律(Moore’s Law)
• The complexity for minimum component costs has been doubling at a rate of roughly a factor of two per year.
• Laterly, the doubling rate has been altered to be “very 18 months”.
Gorden Moore, 1965
.
3
3
摩尔定律
• 摩尔定律是由英特尔(Intel)创始人之一戈登摩尔 (Gordon Moore)提出来的。其内容为:当价格不变时, 集成电路上可容纳的元器件的数目,约每隔18-24个月便 会增加一倍,性能也将提升一倍。换言之,每一美元所能 买到的电脑性能,将每隔18-24个月翻一倍以上。这一定 律揭示了信息技术进步的速度。
英特尔共同创始人
.
10
10
No Image
.
11
