滴定分析计算
滴定分析的计算

0.5000×V+0.09760×4800 = 0.1000 ×(4800+V)
V=28.80mL
2. 标定溶液浓度的有关计算
基本公式:
mA a cBVB MA b
例1: 称取邻苯二甲酸氢钾(KHP)基准物质0.4925
克,标定NaOH溶液,终点时用去NaOH溶液 23.50mL,求NaOH溶液的浓度。MKHP=204.2 解: NaOH + KHP = NaKP + H2O
已知:M(KHP)=204.22 g.mol-1,
M(H2C2O4.2H2O)=126.07 g.mol-1
解:以邻苯二甲酸氢钾(KHP)为基准物质, 其滴定反应为: KHP + NaOH = KNaP + H2O 即 nKHP nNaOH
mKHP (cV )NaOH M KHP
V=20 mKHP=0.10 g.mol-1 2010-3L204.22 g.mol-1=0.40g V=25 mKHP=0.10 g.mol-1 2510-3L204.22 g.mol-1=0.50g
3.被测物质的质量和质量分数的计算
基本公式:
a m A cBVB M A b m A a cBVB M A wA mS b mS
例1: 测定工业纯碱Na2CO3的含量,称取
0.2560g试样,用0.2000mol.L-1 HCl标液滴
定,若终点时消耗HCl标液22.93mL,计 算试样中Na2CO3的百分含量。
解: Ca2+ + C2O42- = CaC2O4
CaC2O4 + H2SO4 = CaSO4 + H2C2O4 = 10CO2 +2MnSO4+K2SO4 + 8H2O
分析化学第三章滴定分析

• C(1/6K2Cr2O7)=? C(K2Cr2O7) • v(1/6K2Cr2O7)=? V(K2Cr2O7) • m(1/6K2Cr2O7)=? m(K2Cr2O7)
配制C(1/6K2Cr2O7)=0.05000mol/L重铬酸钾 标准溶液1L,应称取纯K2Cr2O7多少克?
解:滴定反应2HClNa2CO32NaClCO2 H2O
n
Na2CO3
1 2
nHCl
1 2
cHClVHCl
wNa2CO3
mNa2CO3 m样
100%
1 2
cHClVHCl
M
m样
Na2CO3
100%
0.50.207121.45103106.0100% 95.82%
根据滴定度的概念可得 T=C(KMnO4)×1mL×10-3×5×M(Fe) =0.02718×0.001×5×55.845=0.007590g/mL
2019/7/23
第五节 滴定分析结果的计算
1. 方法一、 根据被测物的物质的量nA与滴定剂的物 质的量nB 的关系
aA+bB = cC+dD 当达到化学计量点时amolA恰好与bmolB作用完全
2019/7/23
二 滴定操作方式
1.直接滴定 标准溶液直接滴定被测物质。最基本的一种滴定方式 。能够应用于直接滴定的化学反应,必须符合:
(1)反应定量; (2)反应必须完全,通常达到99.9%以上; (3)反应必须迅速; (4)有确定滴定终点的简便方法。
2019/7/23
2.返滴定
反应虽可进行完全,但速度慢。 先准确加入过量的一种标准溶液,充分反应后用 另一种标准溶液滴定过量的第一种标液。 根据两标液的物质的量和计量关系式推算出被测 组分的含量。 例如,HCl滴CaCO3
第三节 滴定分析的计算

n
A
t
n
T
例如:已知基准物质的质量mT,求被滴定溶液的浓 度CA ,则用:nA = CA VA nT = mT/MT
即:
am CV t M
A A
T
T
本节小结
1、滴定液配制的计算 配置前物质的状态是固体: CTVT = mT/MT 配置前物质的状态是液体: C1V1 = C2V2 2、滴定分析的计算 反应式:aA + tT cC + dD A为待测物质,T为滴定液 基本计算公式:aA = a/t ·nT ①若待测物A为液体,滴定剂B为液体,即液-液反应,则:
C1V1=C2V2
一、滴定液配制的计算 (二)应用实例 例1 准确称取基准K2Cr2O7 5.001g,溶解后稀释至1000ml 的容量瓶中,则配成的K2Cr2O7浓度是多大? C(K2Cr2O7) = m/MV = 0.01670 mol/L 例2 欲配制浓度为0.1mol/L盐酸溶液1000ml,应取浓度为 12mol/L的浓盐酸的体积为多少毫升? VHCI = C2V2/C1 = 8.3(ml) 例3 市售浓盐酸密度为1.19g/ml,质量分数为0.37,求浓 盐酸物质的量浓度。 1000ρω
V(NaOH) = 23.80(ml) 2、滴定液的标定 (1)用基准物质标定滴定液 例2 为标定HCI溶液,去硼砂(Na2B4O7· 10H2O) 0.4709g,用HCI滴定至化学计量点,消耗HCI25.20ml,求 HCI溶液的物质的量浓度。 C(HCI)=0.09803(mol/L)
例1
(二)应用实例 2、滴定液的标定 (2)用另一已知准确浓度的滴定液标定 例3 20.00ml未知浓度的NaOH溶液,用0.09984mol/L的 HCI滴定液滴定,达到计量点时用去22.40ml HCI溶液,计 算此NaOH溶液的物质的量浓度。 3、含量计算 C(NaOH)= 0.1118(mol/L)
第4章2滴定分析计算

2、分析氢氧化钠的纯度时,如果欲使 0.1500mol/LHCl标准溶液的体积(以ml为单位)乘 以2等于试样中NaOH的百分含量,问分析时应称取 试样的质量为多少克?
S=(0.1500×4.00g)/2
=0.3000g 答: 应称取试样的质量为0.3000g
约为37%。计算(1)每升浓盐酸中所含HCl的物质
的量浓度;(2)欲配制浓度为0.10mol/L的稀盐酸
500ml,需量取上述浓盐酸多少毫升?
解:(1) nHCll=(m/M)HCl=1.19×1000×0.37/36.46 =12 mol
cHCl=nHCl/VHCl=(m/M)HCl/ VHCl =(1.19×1000×0.37/36.46)/1.0=12 mol/L
=0.6740 g
第十四讲
第四章 滴定分析法概论
14-5
(二) 标定溶液浓度的有关计算
基本公式 mA / M A (a / b)cBVB
例3 用Na2B4O7·10H2O标定HCl溶液的 浓度,称取0.4806g硼砂,滴定至终点时消耗 HCl溶液25.20ml,计算HCl溶液的浓度。
解:Na2B4O7+2HCl +5H2O = 4H3BO3 +2NaCl n(Na2B4O7)=(1/2)n(HCl)
=0.006702 g/ml
同理可得:
c(K2Cr2O7)/1000=(1/3)T K2Cr2O7/Fe2O3/MFe2O3 T K2Cr2O7/Fe2O3= c(K2Cr2O7)×MFe2O3×3/1000
=0.009581 g/ml
分析化学第三章第三节滴定分析中的计算

VT TT / B B% 100% ms
14
3. 待测物质质量和质量分数的计算
设试样的质量为ms,则待测组分B在试样中的质量分数wB 为:
mB b cTVT M B wB ms t ms 若用百分数表示质量分数, 则将质量分数乘以100即可。
15
6、计算实例
例1 配0.01000mol/L K2Cr2O7标准溶液250.0mL,求m?
TT / B
mB VT cT cT 1000 mB TT / B M B VT M B
nT cT VT t 又 nB b mB M B TT / B cT M B b 1000 t
!
(3.9)
注:TT/B单位为[g/mL]
13
(3)被测物质百分含量的计算
当滴定剂的浓度用滴定度TT/B表示时,则被测组分B的 百分含量可由下式求得:
22
例:称取铁矿样 0.5000g ,溶解还原成 Fe 2 + 后,用 T(K2Cr2O7/Fe)=0.005022g· mL-1的重铬酸钾标准溶
液滴定,消耗25.10mL,求T(K2Cr2O7/Fe3O4) 和试
样中以Fe、Fe3O4表示时的质量分数。
解Cr2O72-+6Fe2++14H+→2Cr3++6Fe3++7H2O
0.0002 Er 0.08% 0.1% 0.25
为使称量误差在±0.1%以内,可以称取10 倍量的K2Cr2O7 (即0.25g左右)
溶解并定容在250ml 容量瓶中,然后用移液管移取25.00ml 三份进行标
定。这种方法俗称 “称大样”,可以减小称量误差。 如果基准物质的摩尔质量较大,或被标定溶液的浓度较大,其称样质量
-的基本单元:
4.6 滴定分析的计算

3.求待测组分 的质量分数及质量浓度 求待测组分A的质量分数及质量浓度 求待测组分
设测定时称取试样的质量为ms (g) 设测定时称取试样的质量为 则待测组分的质量分数为
mA wA = ms
c BV B M A wA = ms
量取试液的体积为Vs (L) 量取试液的体积为 待测组分的质量浓度为
mA cBVB M A ρA= = Vs Vs
基本单元的确定
2HCl + Na2CO3 2NaCl + H2O + CO2↑
反应中盐酸给出一个质子,碳酸钠接受2 反应中盐酸给出一个质子,碳酸钠接受2个 1 质子,因此分别选取 选取HCl和 Na2CO3 作为 质子,因此分别选取 和 2 基本单元。 基本单元。由于反应中盐酸给出的质子数必 定等于碳酸钠接受的质子数, 定等于碳酸钠接受的质子数,因此根据质子 转移数选取基本单元后, 转移数选取基本单元后,反应到达化学计量 点时: 点时: 1 n(HCl) = n( Na2CO3)
解: 反应过程如下
2Fe2++MnO2(s)+4H+ 2Fe3++Mn2++2H2O Cr2O72-+6Fe2++14H+ 2Cr3++6Fe3++7H2O
由反应式可知
1 2+)-n( 1 K Cr O ) n( MnO2)=n(Fe - 2 6 2 2 7 1 c( 6 K2Cr2O7) =6c(K2Cr2O7)
例1:
溶液500.00mL,需用 2C2O4 · 2H2O 需用Na 溶液 需用 多少克? 多少克 已知Na 解: 已知 2C2O4 · 2H2O的Mr=170.0 则 的
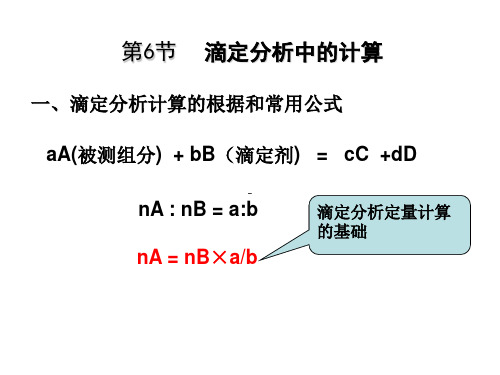
第六节 滴定分析中的计算
HCl 和NaOH溶液的浓度分别为 1.000 mol / L 和 1.200 mol / L
23.已知1.00mL某HCl标准溶液中含氯化氢0.004374g/mL,试计算: (1) 该HCl溶液对NaOH的滴定度THCL/NaOH; (2) 该HC1溶液对CaO的滴定度THCl/CaO。
解:(1)
THCl
NaOH
cHCl M NaOH 1000
1 0.004374 40.00 36.461000 1000
=0.004794g· -1 mL (2)
THCl CaO
cHCl M CaO 1000
1 0.004374 56.08 1 36.461000 1 2 1000 2
=0.003361g· -1 mL
25. 在1.000gCaCO3试样中加入0.5100 mol· -1HC1溶液50.00 ml, L 待完全反应后再用0.4900mol· -1NaOH 标准溶液返滴定过量的HC1溶液, L 用去了NaOH溶液25.00 mL。求CaCO3的纯度。
解:5C2O42- + 2MnO4- +16H+ = 10CO2 +2Mn2+ +8H2O
因此 n(Na2C2O4)=(5/2)n(KMnO4) (cV)(Na2C2O4)=(5/2)(cV)(KMnO4) 根据题意,有VNa2C2O4=VKMnO4,则 cNa2C2O4=(5/2)cKMnO4=2.5×0.02012mol.L-1 =0.05030 mol.L-1 mNa2C2O4=(cVM)Na2C2O4 =0.05030mol.L-1×100.0×10-3L×134.00g.mol-1 =0.6740 g
第六节 滴定分析中的计算

(三)物质的量浓度与滴定度间的换算
滴定度是指每毫升标准溶液所含溶质的质量,即:
TB / A mA / VB
B为标准溶液的化学式 mA:g VB:mL A为被测物质的化学式
cB 1.00103 nB b TB / A / M A nA a
10 TB / A b cB MA a
滴定分析定量计算 的基础
设体积为VA的被滴定物质的溶液其浓度为cA, 在化学计量点时用去浓度为cB 的滴定剂体积为VB 。 则:
cA×VA = cB×VB×a/b 或 mA/MA =(a/b) cB×VB V:L m:g M:g.mol-1
c:mol.L-1
通常在滴定时,体积以mL为单位来计量,运算时 要化为L,即 mA/ MA= (cB×VB/1000)×a/b
(二) 标定溶液浓度的有关计算
基本公式
mA / M A (a / b)cBVB
例3 用Na2B4O7· 2O标定HCl溶液的浓度,称取 10H 0.4806g硼砂,滴定至终点时消耗HCl溶液25.20mL, 计算HCl溶液的浓度。 解:Na2B4O7+2HCl +5H2O = 4H3BO3 +2NaCl nNa2B4O7=(1/2)nHCl (m/M)Na2B4O7=(1/2)(cV)HCl cHCl=0.1000 mol.L-1
CaC2O4 + H2SO4
CaSO4 + H2C2O4
10CO2 +2MnSO4+K2SO4 + 8H2O
5H2C2O4+2KMnO4+3H2SO4
2KMnO4
5H2C2O4
5CaC2O4
5Ca2+
滴定分析中的计算

滴定分析中的计算
3. 估计消耗标准溶液的体 【例积3-7】
称取0.3000 g草酸(H2C2O4·2H2O)溶于适量水后,用KOH溶液 (0.2 mol·L-1)滴定至终点,问大约消耗此溶液多少毫升?
解:该滴定反应为 有关各物质之间的量的关系为 所以
即大约消耗KOH溶液24 mL。
滴定分析中的计算
解:该滴定反应式为 有关各物质之间的量的关系为
即试样中Na2CO3的百分含量为94.47%。
滴定分析中的计算
【例3-10】
称取CaCO3试样0.2501 g,用0.2602 mol·L-1的盐酸标准溶液 25.00 mL溶液,回滴过量的酸用去0.2450 mol·L-1的NaOH标准溶液 6.50 mL,求试样中CaCO3的百分含量。
解:已知cK2Cr2O7=0.02 mol·L-1,VK2Cr2O7=500.00 mL,则
滴定分析中的计算
【例3-6】
标定0.10 mol·L-1的NaOH溶液时,希望滴定时用去NaOH滴定液 20~25 mL,应称取邻苯二甲酸氢钾基准物质多少克?
解:该标定反应式为
有关各物质之间的量的关系为
即应称取邻苯二甲酸氢钾基准物质0.41~0.51 g。
滴定分析中的计算
二、 滴定分析计算示例 1. 计算被测溶液浓度 【例3-3】
用0.1043 mol·L-1的H2SO4标准溶液滴定25.00 mL NaOH溶液时, 用去硫酸溶液 24.21 mL,计算该NaOH溶液的浓度。
解: 该滴定反应式为
有关各物质之间的量的关系为
所以
滴定分析中的计算
【例3-4】
4. 物质的量浓度和滴定度的相互换算
滴定度是每毫升标准溶液相当于待测物质的质量。标准溶液 与被测物质反应为
滴定分析概述-滴定分析的计算-例题-计算过程步骤

二、滴定分析的计算
1 用液体或固体配制一定浓度的溶液
例1 已知浓H2SO4的相对密度为1.84g/mL,其中H2SO4 的含量为98%,欲配制0.2mol/L H2SO4标准溶液500mL, 应取浓H2SO4多少毫升( MH2SO4 98.08g/mol )?
解:
500
nH2SO4
C ·V 稀H2SO4 稀H2SO4
滴定分析法概论
裴晓丽
第三节 滴定分析的计算
一、滴定分析的计算基础
1 滴定剂物质的之量间n的T与关待系测式物物质的量nA
tT + aA
滴定剂 待测物
bB + cC
t nT = a nA
(4-2)
24MnO-4 + 5C2O42- + 16H+
2Mn2+ + 10CO2 + 8H2O
2
n = 5 n MnO-4
解:2HCl + Na2CO3 = 2NaCl + CO2 + H2O
CHCl ·VHCl
2 ·mNa2CO3 1 MNa2CO3
1000
0.2 20105.99
m Na2CO3
2 1000
0.21g
0.2 30105.99
m Na2CO3
2 1000
0.32g
5 估计消耗标准溶液的体积
COOH + NaOH
OCOCH3
COONa
+
OCOCH3
H2 O
据
A% TT/A ·VT 100%
S
19.0818.02 0.1050
阿斯匹林%
0.1000 100% 99.56%
滴定分析计算

cBVB = cAVA
(2-3)
若被测物质为固体物质, 到
达化学计量点时, 由式(2-1)和式
(2-3) 可得到:
cBVB
mA MA
mA cBVBM A
(2-4)
滴定分析在实际操作时, 体积 常以毫升为计量单位, 若将体积 化为以升为单位, 则上式可改为:
mA
cB
VB 1000
M A或mA
cBVBM A
C
1000
mBA
MA
mA
cBVB M A 1000
若试样质量为ms, 则被测组分的质量
分数为
wA
cBVB M A 1000 ms
例6:
欲测定大理石中CaCO3含量, 称取大理石试样0.1557g, 溶解后 向试液中加入过量的(NH4)2C2O4, 使Ca2+成CaC2O4沉淀析出, 过滤、 洗涤, 将沉淀溶于稀H2SO4, 此溶 液中的C2O42-需用15.00mL 0.04000mol/L KMnO4标准溶液 滴定, 求大理石中CaCO3的含量。
解: 反应式为
H2C2O4 + 2 NaOH Na2C2O4 + 2H2O
根据等物质的量反应规则
n(NaOH) = n(
1 2
H2C2O4)
因1
Mr 126.08
M ( 2 H2C2O4 ·2H2O ) 2 2 63.04
故 w(H2C2O4
·2H2O)
c(NaOH) V
(NaOH) M (1 2
n(
1 2
I
2
)
n(S2O32-
)
n(
1 6
K
2Cr2O7
)
又知:
滴定分析的计算讲解

例2 为了标定Na2S2O3溶液,精密称取K2Cr2O7
2.4530g,溶解后配成500mL溶液,量取此K2Cr2O7溶
液25.00mL,加H2SO4及过量KI, 再用Na2S2O3待标液
滴定析出的I2, 用去26.12mL, 求Na2S2O3的浓度。
解:反应过程如下: Cr2O72- + 6I- + 14H+ → 2Cr3+ + 3I2 + 7H2O I2 + 2S2O32→ 2I- + S4O626S2O32-
滴定分析法的计算
一、滴定分析计算的依据 对于任一滴定反应 tT +aA → P T为滴定剂,A为待测物质,P为生成物。 1.方法一:按反应的计量关系
t a t n 或 T nT nA a nA
C A VA a CT VT t
对固体物质
mA
a CTVT M A t
例1 测定工业纯碱Na2CO3的含量,称取0.2560克试样,
1Cr2O72- 3I2
C Na2 S2O3VNa2 S2O3 6CK 2Cr2O7 VK 2Cr2O7 6C K 2Cr2O7 VK 2Cr2O7 VNa2 S2O3 2.4530 6 294.19 25 0.5 0.0958 m ol/ L 26.12
C Na2 S2O3
称取0.1500gNa2C2O4基准物,溶解后在强酸性溶液中
用KMnO4溶液滴定,用去20.00mL,计算
C(1/5KMnO4)及高锰酸钾对铁的滴定度。
n(1/2Na2C2O4)=n(1/5KMnO4)
2MnO 5C2O 16H 2Mn 10CO2 8H 2O
4
第3章滴定分析概论2 分析计算及质子平衡式

(m / M ) K2Cr2O7
6 0.4903 0.2500 cNa2S2O3 294.18 24.95103 0.1002mol / L
已知在酸性溶液中,KMnO4与Fe2+反应时, 1.00ml KMnO4溶液相当于0.1117g Fe,而 10.00ml KHC2O4∙H2C2O4溶液在酸性介质中 恰好和2.00ml上述KMnO4溶液完全反应, 问需要多少毫升0.2000mol/L NaOH溶液才
[Na+] = [Cl又称作 标签浓度;
平衡浓度指溶液中实际存在的微观浓 度。
分析浓度等于各型体平衡浓度之和。
• 溶液中某型体的平衡浓度在溶质总浓
度中所占的分数。
i [i]/ c
注:分布分数是宏观可以测定的量(分 析浓度)和微观真实的量(平衡浓度) 之间的桥梁,类似于物质的量的概念。
• 某型体的分布系数决定于酸碱或者配 合物的性质、溶液的酸度或游离配体 的浓度,与总浓度无关。
i [i]/ c
能定量说明溶液中各型体的分布情况 由分布系数可求得溶液中各种型体的
平衡浓度 计算滴定分析中的副反应系数 考察滴定反应的完全程度 预计分步滴定的可能性
质量平衡(Mass balance) 电核平衡 质子平衡
一、滴定分析计算的依据 二、滴定分析法的有关计算
计算的依据为“等物质的量规则”。 该规则的内容为:当标准溶液与被测
物质刚好反应完全时,参与反应的被 测物质与标准溶液的基本单元的物质 的量相等。
数学表达式为:
tT bB cC dD
nT : nB = t : b
nT
V = 500.0ml
wB
滴定分析法

滴定分析法一、溶液浓度的表示方法1、物质的量浓度指在单位体积的溶液中所含溶质的物质的量,以符号c表示。
其公式为:B为溶质的化学式;V为B溶液的体积——L;n B为溶质B的物质的量——mol;c B为B物质的物质的量浓度——mol/L;n B物质的物质的量——mol;m B为B物质的质量——g;M B为B物质的摩尔质量——g/mol;所以,C B又可这样求得2、质量分数B的质量分数=B的质量/混合物的质量质量分数表示:mg/g、μg/g、ng/g。
3、质量浓度B的质量浓度=B的质量/混合物的体积单位为g/L或mg/L、μg/L、ng/L。
4、体积分数B的体积分数=混合前B的体积/混合物的体积5、滴定度每mL标准溶液A相当于被测物质B的克数(TA/B,g或 mg)例如:THCl/NaOH = 0.004000 g/mL1mL HCl恰能与0.004000 g NaOH完全作用如果在滴定中消耗该K2Cr2O7标准溶液19.43mL,则被滴定溶液中铁的质量为多少克?解:m Fe=0.005000×19.43=0.009715g二、滴定分析基础1.基本概念:滴定剂(标准溶液):已知准确浓度的试剂溶液。
滴定:将滴定剂通过滴定管逐滴加入被测溶液中进行测定的过程。
化学计量点(sp):滴定剂与被测物按化学反应的计量关系正好完全反应的一点。
指示剂:通过颜色的改变来指示化学计量点到达的试剂。
一般有两种不同颜色的存在型体。
滴定终点(ep):指示剂改变颜色(滴定停止)的一点。
滴定误差(TE):滴定终点与化学计量点不完全一致造成的误差。
2.滴定分析法分类·酸碱滴定法·配位滴定法·氧化-还原滴定法·沉淀滴定法·非水滴定法3.滴定曲线和滴定突跃滴定曲线(titration curve):以作图的方式描述滴定过程中组分浓度的变化。
横坐标—加入滴定剂的体积(或滴定百分数)纵坐标—溶液组分浓度或浓度相关的某种参数滴定曲线的特点:1.曲线的起点决定于被滴定物质的性质和浓度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1. 滴定分析计算的依据 滴定分析计算的依据是“等物 质的量反应规则”。即:在滴 定 反应中, 标准溶液(B)和被测物 质(A)反应完全时, 消耗的两物 质的量相等。
nB = nA
(2-2)
若被测物质溶液的体积为VA, 浓度为cA, 到达化学计量点时, 用 去浓度为cB的滴定液的体积为VB, 由式(2-1)和式(2-2)可得到:
例8:
物质的量浓度c(K2Cr2O7)=0.01940mol/L 换算成TK2Cr2O7 及以TK2Cr2O7/FeO表示滴 定度。 c(K Cr O )M (K Cr O ) 0.01940 294 .19 解 (1)T 1000 1000
2 2 7 2 2 7 K 2 Cr2 O 7
解
反应式为
Ca 2 C2O2 4 CaC2O4 CaC2O4 2H H2C2O4 Ca 2 2 5H2C2O4 2MnO4 6H 10CO2 2Mn 8H2O
由反应式可知
5 5 2 5 n(MnO ) n( H 2 C 2 O 4 ) n( Ca ) n( CaCO 3 ) 2 2 2
例3:
为了标定Na2S2O3溶液, 精密称取 工作标准试剂K2Cr2O7 2.4530g, 溶 解后配成500mL溶液, 然后量取 K2Cr2O7溶液25.00mL, 加H2SO4 及过量KI, 再用Na2S2O3待标液 滴定析出的I2, 用去26.12mL, 求 c(Na2S2O3)。
解: 反应过程如下;
w (cB(1)VB(1) cB( 2)VB( 2) ) M A 1000 ms
例5:
用过量FeSO4还原MnO2试样,剩 余的亚铁可以用K2Cr2O7溶液返滴 定。假定二氧化锰试样为0.2000g, 加入c(Fe2+)=0.1000mol/L的溶液 50.00mL, 剩余的亚铁需用16.07mL 浓度为0.02300mol/LK2Cr2O7溶液 返滴定, 求试样中MnO2的含量。
例9: 已知盐酸对碳酸钙的滴定度
THCl/CaCO3=0.05004g/mL, 求以 c(HCl)表示的浓度。
2HCl CaCO3 CaCl2 CO2 H2O
HCl 1 1 1 1 CaCO 3 CaCl 2 CO 2 H 2 O 2 2 2 2
26I- Cr2O7 14H 3I2 2Cr3 7H2O
22I2 2S2O3 2I- S4O6
从反应式可知: 又知:
1 1 2n( I 2 ) n(S 2 O3 ) n( K 2 Cr2 O 7 ) 2 6
2.4530 1 c( K 2Cr2O7 ) 294.19 / 6 1000 0.10006mol /L 6 500
设测定时称取试样的质量为 ms, 则待测组分占试样的质 量分数为 m c V M w m 因为 m 1000
A s
B B A A
所以
w
cBVB M A 1000 ms
例4:
称取不纯的草酸试样0.1500g, 溶于适量水后, 用c(NaOH)为 0.09000mol/L的标准溶液滴定, 共用去 25.00mL, 求试样中 H2C2O4 ·2H2O的含量。
解: 选取NaOH和 H2SO4为基本 单元, 反应到达化学计量点时, 则
1 1 c(NaOH) V (NaOH) c( H 2SO 4 )V ( H 2SO 4 ) 2 2
1 2
1 0.1000 20.00 c( H 2SO 4 ) 19.95 2 1 c( H 2SO 4 ) 0.1002mol/ L 2 c(H2SO 4 ) 0.05010mol /L
0.005707 (g/mL)
22 n ( Cr O ) n ( 6 Fe ) n(6FeO) 2 7 根据反应式可得:
2 (2)Cr2O7 6Fe2 14H 2Cr 3 6Fe3 7H2O
TK 2Cr2O7 /FeO
c(K 2Cr2 O 7 ) M (6FeO ) 0.1940 71.85 6 1000 1000 0.008363 (g/mL)
(2) TB/A与cB间的换算
滴定度TB/A是指每毫升滴定液 相当于被测物质的克数, 根据式 mA=T B/A· VB 当 VB=1mL时, T B/A = mA V M 得 那么由式(2-5) m c 1000
B A B A
TB/A
TB/A 1000 MA cB 或cB 1000 MA
即: 或
cBVB cAVA 1000
mA cBVB M A 1000
nA = n C = nB
mA MA
若试样质量为ms, 则被测组分的质量 分数为 w c V M
B B A A
1000 ms
例6:
欲测定大理石中CaCO3含量, 称取大理石试样0.1557g, 溶解后 向试液中加入过量的(NH4)2C2O4, 使Ca2+成CaC2O4沉淀析出, 过滤、 洗涤, 将沉淀溶于稀H2SO4, 此溶 液中的C2O42-需用15.00mL 0.04000mol/L KMnO4标准溶液 滴定, 求大理石中CaCO3的含量。
0.1001 25 .00 26 .12
0.09581 mol/L
(2) 直接滴定法结果的计算
计算的依据是: 标准物质的量等于待测组分 的物质的量, 即 nB = nA mA c V c V 1000 或 B B A A MA 式中, mA — 待测组分占试样的 质量, 单位为g。
4. 物质的量浓度与滴定度的换算
(1) TB与cB间的换算 滴定度TB是指1mL标准溶液所 含溶质的克数, TB×1000为1L标准 溶液中所含溶质的克数, 再除以溶 质的摩尔质量MB, 即为物质的量 浓度cB。
TB 1000 cB M B cB 或TB MB 1000
例7:
试换算成 浓度。
(以上公式中V的单位是毫升)
例1:
欲配制c( Na2C2O4)为0.1000mol/L 溶液500.00mL,需用Na2C2O4 ·2H2O 多少克?
1 2
解: 已知Na2C2O4 ·2H2O的Mr=170.0 则
M( 1 170.0 Na 2 C 2 O 4 · 2H2 O) 2 2 85.00(g/mo l)
2
例如:
在酸性溶液中, 用KMnO4标 准溶液滴定Na2C2O4的反应为:
2MnO-4 5C2O-4 16H 2Mn2 10CO2 8H2O
将反应式各系数乘以1/2,则得
5 2 MnO C 2 O 2 8H Mn 5CO 2 4H 2 O 4 2
cBVB = cAVA
(2-3)
若被测物质为固体物质, 到 达化学计量点时, 由式(2-1)和式 (2-3) 可得到: mA cBVB mA cBVB M A MA (2-4)
滴定分析在实际操作时, 体积 常以毫升为计量单位, 若将体积 化为以升为单位, 则上式可改为:
VB 3 mA cB M A或mA cBVB M A 10 1000
根据等物质量反应规则
1 1 c( K 2 Cr2 O 7 ) V ( K 2Cr2 O 7 ) c(Na 2S2 O3 ) · V (Na 2S2 O3 ) 6 6
c(Na2S2 O 3 ) c( 1 1 K 2 Cr2 O 7 ) V ( K 2 Cr2 O 7 ) 6 6 V ( Na 2S2 O 3 )
解: 反应过程如下
由反应式可知
则 w(MnO ) [c(6Fe
2 2
2Fe2++MnO2(s)+4H+ 2Fe3++Mn2++2H2O Cr2O72-+6Fe2++14H+ 2Cr3++6Fe3++7H2O
) V (6Fe2 ) c(K 2Cr2O7 ) V (K 2Cr2O7 )] M (3MnO2 ) 1000 mS
(1) 写出有关的化学反应方程式, 并将其配平。 (2) 找出被测物质与标准溶液的 化学计量数。 (3) 确定标准溶液的基本单元, 就本 质而言, 确定标准溶液的基本单 元是任意的, 但为了计算简便, 通 常以标准溶液的分子系数为1(碘 1 量法中碘液以 2 I 为基本单元) (4) 确定被测组分的基本单元, 使之 符合等物质的量规则。
Na2CO3溶液的TNa2CO3=0.001060g/mL,
1 c( Na 2 CO 3 ), c( Na 2 CO 3 ) 2
表示的
0.001060 1000 c( Na 2 CO 3 ) 0.1000mol/L 106.0 1 0.001060 1000 c( Na 2 CO 3 ) 0.2000mol/L 2 106.0/2
(2-5) 式(2-4)和式(2-5)是滴定分析计算 的最基本公式。
2. 滴定分析中确定被测组分基本 单元的原则和步骤
应用等物质的量反应规则进行滴 定分析计算, 关键在于选择基本单元。 滴定分析中, 被测组分与标准溶液之 间是严格按照化学计量关系进行反 应的, 如果标准溶液的基本单元确定 了, 那么, 被测组分的基本单元就不 再是任意的, 它由标准溶液的基本单 元来确定, 其原则和步骤如下:
0.09000 25.00 63.04 0.9682 1000 0.1500
(3) 返滴定法结果的计算
计算的依据是: 待测组分的物质 的量等于第一种标准溶液物质的量 与第二种标准溶液物质的量之差。 即: nA = nB(1) - n B(2) 或: 1000nA = cB(1)VB(1) - cB(2)VB(2) 设试样的质量为ms , 则待测组分占 试样的质量分数为:
