酸碱盐的通性
酸碱盐怎么区分有哪些通性

酸碱盐怎么区分有哪些通性碱盐区分方法:1、看电离:电离时生成的阳离子全部是氢离子的就是酸,电离时生成的阴离子全部是氢氧根离子的就是碱,由金属离子或铵根离子与酸根离子形成的就是盐。
2、看化学式:一般酸的左边都只有一个元素H,右边是一个非金属原子或者一个原子团,如HCl,其左边是H,右边是非金属原子Cl,又如H2SO4、HNO3、H3PO4等。
酸碱盐怎么区分碱盐区分方法:1、看电离电离时生成的阳离子全部是氢离子的就是酸,电离时生成的阴离子全部是氢氧根离子的就是碱,由金属离子或铵根离子与酸根离子形成的就是盐。
2、看化学式一般酸的左边都只有一个元素H,右边是一个非金属原子或者一个原子团,如HCl,其左边是H,右边是非金属原子Cl,又如H2SO4、HNO3、H3PO4等。
碱左边是一个金属原子,右边是原子团OH,比如NaOH、Mg(OH)2、Fe(OH)3等。
盐左边是一个金属原子,右边是一个非金属原子或者一个原子团,其实可以看为酸的右边和碱的左边所组成,比如NaCl、Na2SO4、Na3PO4等。
酸碱盐的通性酸的通性:酸+酸碱指示剂酸+金属——盐+氢气酸+金属氧化物——盐+水酸+碱——盐+水酸+盐——新酸+新盐碱的通性:碱+酸碱指示剂碱+非金属氧化物碱+酸——盐+水碱+盐——新碱+新盐盐没有通性。
酸碱盐溶解性口诀酸类多数都易溶,硅酸微溶是独种。
碱类钾钠钡铵溶,钙是微溶余不溶。
硫酸铅钡沉水中,微溶钙银与亚汞。
盐类溶有钾钠铵,外加易溶硝酸盐。
碳酸能溶钾钠铵,其余俱沉水中间。
盐酸沉淀银亚汞,还有微溶氯化铅。
(最新)初中化学酸碱盐的通性详细总结

(最新)初中化学酸碱盐的通性详细总结一、酸的五大通性:1、酸溶液与酸碱指示剂的反应常见的酸有:HCl、HNO3、H2SO4、H2CO3 等(1)紫色石蕊试液或蓝色石蕊试纸遇到酸溶液变红色;(2)无色酚酞试剂遇到酸溶液不变色。
(化学反应实质是指示剂变色,注意说法:是紫色石蕊试液变成了红色,如果说紫色石蕊试液使酸溶液变成红色就是错误的。
)2、酸溶液与某些金属单质反应(置换反应)酸溶液 + (氢前)金属→盐溶液 + 氢气注意反应发生条件:在金属活动性顺序表中,排在氢前面的金属能置换出酸中的氢,排在氢后面的金属则不能(也就是不能发生反应);钾钙钠镁铝锌铁锡铅(氢)铜汞银铂金K Ca Na Mg Al Zn Fe Sn Pb Cu Hg Ag Pt Au如:Zn + 2HCl == ZnCl2 + H2↑;可以反应Cu + 2HCl == CuCl2 + H2↑;不能反应K Ca Na 比较特殊,和水也会发生剧烈反应,反应复杂,初中不考虑。
(1)排在金属活动性顺序表越前面的金属,反应现象越剧烈,速度越快,如Mg反应有明显放热现象;(2)强氧化性酸与金属反应后,不能生成氢气。
如浓硫酸、硝酸等强氧化性酸;3、酸溶液与某些金属氧化物反应(金属氧化物又称碱性氧化物)酸溶液 + 金属氧化物→盐溶液 + 水如:MgO + 2HCl == MgCl2 + H2O; ZnO + 2HNO3 == Zn(NO3)2+H2O AI2O3 + 3H2SO4 == AI2(SO4)3 + 3H2O反应时没有化合价的变化,互相交换成分,是复分解反应,可以认为酸溶液都能和碱性氧化物反应。
4、酸溶液与碱的反应(中和反应)酸 + 碱→盐 + 水HCI + NaOH ==NaCI +H2O酸和碱都能发生中和反应,也是复分解反应5、酸溶液与某些盐反应(反应条件:有沉淀或气体或者水,至少产生一种,反应就能进行)酸溶液 + 盐→新酸 + 新盐(1)通常遇到的盐是碳酸盐,有水 + 二氧化碳生成:酸 + 碳酸盐→新盐 + 水 + 二氧化碳如:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑;K2CO3 + 2HNO3 == 2KNO3 + H2O + CO2↑;(2).记住两种盐能与酸反应,生成特殊的沉淀;如:HCl + AgNO3 == AgCl↓+ HNO3;BaCl2 + H2SO4 == BaSO4↓+ 2HCl也是分别检验 Cl-及SO42-的化学方程式二、碱的四大通性常见的有NaOH Ca(OH)2 NH3•H2O 【KOH、Ba(OH)2 】1、与酸碱指示剂反应(1)碱溶液使紫色石蕊试剂或红色石蕊试纸变蓝;(2)会使无色酚酞溶液变红。
酸碱盐的通性

酸碱盐的通性
酸的通性:酸溶液能与酸碱指示剂反应、酸+碱性氧化物=盐+水等。
碱的通性:碱溶液能跟酸碱指示剂起反应,紫色石蕊试液遇碱变蓝,无色酚酞试液遇碱变红。
不溶性碱,如不能使酸碱指示剂变色等。
盐的通性:有些盐有微弱的腐蚀性,溶液的酸碱度根据盐的性质判定,能与某些酸,碱,盐反应,还能和其他某些化合物反应。
酸有腐蚀性,溶液呈酸性,能与活泼金属发生反应,碱,某些盐和金属氧化物反应与排在氢之前的活泼金属反应生成盐和氢气,与指示剂反应,pH显酸性的溶液不一定是酸,但是酸一定是酸性溶液(即显酸性)。
碱有腐蚀性。
溶液呈碱性,能与酸,某些盐,非金属氧化物反应,某些碱能与某些金属氧化物反应,与指示剂反应碱性溶液不一定是碱,但是碱一定是碱性溶液。
(显碱性的溶液不一定都是碱溶液,即所谓的碱;但碱,一定显碱性,即pH值大于7。
)
酸指电离时产生的阳离子全部都是氢离子的化合物;碱指电离时产生的阴离子全部都是氢氧根离子的化合物;盐指电离时生成金属阳离子(或铵根离子)和酸根离子的化合物。
可以简记为:氢头酸、氢氧根结尾碱、金属开头酸根结尾的是盐。
仅由氢离子和酸根离子、非金属单质结合生成的化合物为酸。
由金属离子和氢氧根离子结合生成的化合物为碱。
由金属离子和酸根离子结合生成的化合物为盐,不一定都是如此。
例子如CU2(OH)2CO3碱式碳酸铜,有氢氧根。
酸碱盐类化合物一定含有非金属元素。
酸碱盐de 通性以化学反应为例

第一章酸碱盐一、性质概括酸的通性(具有通性的原因:酸离解时所生成的阳离子全部是H+)(1)与酸碱指示剂的反应:使紫色石蕊试液变红色,不能使无色酚酞试液变色(2)活泼金属 + 酸→盐 + 氢气(3)碱性氧化物 + 酸→盐 + 水(4)碱 + 酸→盐 + 水(5)盐 + 酸→另一种盐 + 另一种酸(产物符合复分解条件)碱的通性(具有通性的原因:离解时所生成的阴离子全部是OH-)(1)碱溶液与酸碱指示剂的反应:使紫色石蕊试液变蓝色,使无色酚酞试液变红色(2)酸性氧化物+碱→盐+水(3)酸+碱→盐+水(4)盐+碱→另一种盐+另一种碱(反应物均可溶,产物符合复分解条件)二、酸碱通性具体涉及的化学方程式1、活泼金属 + 酸→盐 + 氢气注:a、活泼金属指在《金属活动顺序表》中的位置排在氢前面,且除去钾钙钠之外的金属,会考到的具体有、、、。
Zn+H2SO4==ZnSO4+H2↑Mg+H2SO4==MgSO4+H2↑Fe+H2SO4 ==FeSO4+H2↑2Al+3H2SO4 ==Al2(SO4)3+3H2↑Zn+2HCl==ZnCl2+H2↑Mg+2HCl==MgCl2+H2↑Fe+2HCl==FeCl2+H2↑2Al+6HCl==2AlCl3+3H2↑2、碱性氧化物 + 酸→盐 + 水Fe2O3+6HCl==2FeCl3+3H2O现象:红色固体逐渐溶解,形成黄色的溶液CuO+2HCl==CuCl2+H2O现象:黑色固体溶解,生成蓝色的溶液Fe2O3+3H2SO4==Fe2(SO4)3+3H2O 现象:红色固体溶解,生成黄色溶液CuO+H2SO4==CuSO4+H2O现象:黑色固体溶解,生成蓝色溶液3、酸性氧化物+碱→盐+水(该类反应不是复分解)Ca(OH)2+CO2===CaCO3↓+H2O 现象:生成白色的沉淀,用于检验CO2少量吸收2NaOH+CO2==Na2CO3+H2O 现象:无明显现象可吸收量多的CO22NaOH+SO2==Na2SO3+H2O Ca(OH)2+SiO2===CaSiO3+H2O 4、盐 + 酸→另一种盐 + 另一种酸AgNO3+HCl==AgCl↓+HNO3现象:有白色沉淀生成,用于检验氯离子CaCO3+2HCl==CaCl2+H2O+CO2↑现象:白色固体溶解,生成能使纯净石灰水变浑浊的气体Na2CO3+2HCl==2NaCl+H2O+CO2↑现象:生成能使纯净石灰水变浑浊的气体NaHCO3+HCl==NaCl+H2O+CO2↑现象:生成能使纯净石灰水变浑浊的气体BaCl2+H2SO4==BaSO4↓+2HCl 现象:生成不溶于强酸的白色沉淀,用于检验硫酸根离子CaCO3+H2SO4==CaSO4+H2O+CO2↑Na2CO3+H2SO4==Na2SO4+H2O+CO2↑2NaHCO3+H2SO4==Na2SO4+2H2O+2C O2↑现象:这三个反应现象同与盐酸反应现5、盐+碱→另一种盐+另一种碱(两者都可溶)2NaOH+FeCl2==Fe(OH)2↓+2NaCl 现象:生成白色絮状沉淀,2NaOH+CuSO4==Cu(OH)2↓+2NaSO4现象:生成蓝色絮状沉淀NH4Cl+NaOH==NH3↑+H2O+NaCl 现象:有可以使石蕊试纸变蓝的气体生成MgCl2+Ca(OH)2==Mg(OH)2↓+CaCl2现象:生成白色沉淀6、碱 + 酸→盐 + 水Fe(OH)3+3HCl==FeCl3+3H2O现象:红棕色絮状沉淀溶解,形成了黄色的溶液Cu(OH)2+2HCl==CuCl2+2H2O现象:蓝色沉淀溶解,形成黄绿色的溶液2NaOH+H2SO4==Na2SO4+2H2O现象:不明显Cu(OH)2+H2SO4==CuSO4+2H2O 现象:蓝色沉淀溶解,生成蓝色溶液三、盐的通性1、盐 + 酸→另一种盐 + 另一种酸a、酸与可溶性盐反应,生成物中有沉淀,促使复分解反应趋于完成。
酸碱盐氧化物定义及通性

酸碱盐氧化物的定义及通性一、酸1、酸的定义:化学上是指在溶液中电离时产生的阳离子完全是氢离子的化合物。
2、酸的通性:⑴、使酸碱指示剂变色(非氧化性酸):酸可以使紫色石蕊试液或蓝色石蕊试纸变为红色;无色酚酞试液遇酸不变色。
⑵、酸呈现酸性(pH值小于7)⑶、酸可以和处于金属活动性顺序表(H)前面的活泼金属的单质发生置换反应(氧化性酸除外)反应方程式为:酸+金属→盐+氢气(2HCl+Fe==FeCl2+H2↑、H2SO4+Fe==FeSO4+H2↑)⑷、酸可以跟碱性氧化物或某些金属氧化物反应反应方程式:酸+碱性(金属)氧化物-→盐+水(3H2SO4+Fe2O3==Fe2(SO4)3+3H2O)⑸、酸可以与碱发生酸碱中和反应反应方程式:酸+碱==盐+水(HCl+NaOH==NaCl+H2O)⑹、酸可以与某些盐反应生成酸和另一种新盐反应方程式:盐+酸==新盐+新酸(要按照复分解反应的条件来判断是否发生反应)例如:BaCl2+H2SO4==BaSO4↓+2HCl二、碱1、碱的定义:化学上指在溶液中解离时产生的阴离子全部都是氢氧根离子的化合物,叫碱2、碱的通性:非可溶性碱能与酸发生反应,例如:Cu(OH)2+2HCl==CuCl2+2H2O可溶性碱的通性:⑴、碱呈现碱性(pH值大于7):碱能使紫色石蕊试液变蓝,碱能使无色的酚酞试剂变红;⑵、碱可以与酸性氧化物发生反应反应方程式:碱+酸性氧化物==盐+水例如:Ca(OH)2+CO2==CaCO3↓+H2O 2NaOH+CO2==Na2CO3+H2O(注意:酸性氧化物不等于非金属氧化物)⑶、碱可以与酸发生中和反应(基本上都是放热反应)(见酸的通性的(5))⑷、碱可以与某些盐反应,生成新盐和新碱反应方程式:碱+盐==新盐+新碱例如:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH 反应条件:①满足复分解反应发生条件(生成物中有沉淀、气体或水)②反应物必须溶于水,例如下面的反应:CaCO3+Ba(OH)2==BaCO3+Ca(OH)2此反应虽然满足复分解反应的条件,却不是属于碱与盐的反应,因为CaCO3不溶于水三、盐1、盐的定义:盐是指一类金属离子或铵根离子(NH4+)与酸根离子或非金属离子结合形成的化合物2、盐的通性:⑴、某些盐溶液可以与金属反应反应方程式:盐溶液+金属==新的金属+新盐例如:Fe+CuSO4==FeSO4+Cu(注意:反应条件:①只有排在金属活动性顺序表前面的金属才能把排在后面的金属置换出来;②与金属发生反应是在盐溶液中,而不是与盐晶体反应;③其中所指的金属不包括钾钙钠)⑵、某些盐可以与酸发生反应反应方程式:盐+酸==新盐+新酸(复分解反应)例如:BaCl2+H2SO4==BaSO4↓+2HCl AgNO3+HCl==AgCl↓+HNO3⑶、某些可溶性盐可以与可溶性碱发生反应反应方程式:盐(可溶)+碱(可溶)==新盐+新碱(复分解反应)例如:Na2CO3+Ca(OH)2==CaCO3↓+2NaOH FeCl3+3NaOH==3NaCl+Fe(OH)3↓⑷、盐(可溶)+盐(可溶)==新盐+新盐(复分解反应)例如:NaCl+AgNO3==AgCl↓+NaNO3 Na2SO4+BaCl2==BaSO4↓+2NaCl四、氧化物1、氧化物的定义:氧化物通常是指其构成只含有两种元素,其中一种一定为氧元素,另一种若为金属元素,则为金属氧化物;若为非金属,则为非金属氧化物2、氧化物的通性:⑴、非金属氧化物(CO、NO除外):①跟水反应,生成相应的酸:例如 CO2+H2O==H2CO3 SO2+H2O==H2SO3②跟碱反应,生成盐和水例如 CO2+Ca(OH)2==CaCO3↓+H2O⑵、金属氧化物:①跟水反应,生成相应的碱(反应条件:对应的碱可溶于水的金属氧化物才能跟水反应)例如 K2O+H2O==2KOH CaO+H2O==Ca(OH)2②跟酸反应,生成相应的盐和水(反应条件:金属氧化物无论是否溶于水均可溶于酸中)例如Na2O+HCl==NaCl+H2O CuO+H2SO4==CuSO4+H2O。
酸碱盐的通性

酸、碱、盐的通性一、酸的化学性质1.酸与指示剂作用:2.酸 + 金属 -------- 盐 + 氢气(1)镁与盐酸、稀硫酸反应(2)锌与盐酸、稀硫酸反应(3)铁与盐酸、稀硫酸反应现象:(4)铝与盐酸、稀硫酸反应3.酸 + 金属氧化物-------- 盐 + 水(1)氧化铁与盐酸、稀硫酸反应(2)氧化铜与盐酸、稀硫酸反应4.酸 + 碱 -------- 盐 + 水(中和反应)(1)盐酸和烧碱溶液起反应:(2)用熟石灰中和酸性土壤(硫酸):(3)氢氧化镁治疗胃酸过多:氢氧化铝治疗胃酸过多:5.酸 + 盐 -------- 新酸 + 新盐(1)实验室制CO:2(2)碳酸钠与稀盐酸反应:(3)碳酸氢钠与稀盐酸反应:(4)硫酸和氯化钡溶液反应:二、碱的化学性质1.碱与指示剂作用:2.碱 + 非金属氧化物 -------- 盐 + 水(1)苛性钠暴露在空气中变质:(2)苛性钠吸收二氧化硫气体:(3)苛性钠吸收三氧化硫气体:(4)实验室检验CO2(石灰浆刷墙后墙壁变硬):3.碱 + 酸-------- 盐 + 水(中和反应,方程式见上)4.碱 + 盐 -------- 新碱 + 新盐(盐和碱都必须可溶)(1)氢氧化钙与碳酸钠溶液:(2)硫酸铜与烧碱溶液:(3)氯化铁溶液和氢氧化钠溶液:(4)氯化铵和氢氧化钙溶液:三、盐的化学性质1.盐(溶液)+金属------- 新盐+新金属(1)铁和硫酸铜溶液反应:(2)铜和硝酸银溶液反应:2.盐 + 酸-------- 新盐+ 新酸(见酸和盐反应,方程式见上)3.盐 + 碱 -------- 新盐 + 新碱(见碱和盐反应,方程式见上)4.盐 + 盐 ----- 两种新盐(两种盐都必须可溶)(1)氯化钠溶液和硝酸银溶液:(2)硫酸钠和氯化钡溶液:(3)氯化钡和碳酸钠溶液:补充:几种常见离子的检验1.Cl-离子的检验:取少量样品于试管中,滴加AgNO3溶液和稀HNO3,有白色沉淀生成,则样品含有Cl-。
酸碱盐通性总结

酸碱盐通性总结一、酸碱盐概念酸= + ;碱= + ;盐= + 。
二、知识储备:1.酸根离子:氯离子;硝酸根离子,硫酸根离子,碳酸根离子。
2.金属离子:(+1)钾离子,钠离子,银离子,铵根离子,(+2)钙离子,钡离子,镁离子,锌离子,亚铁离子,铜离子,(+3)铝离子,铁离子。
三、指示剂作用1.酸性溶液中含有大量离子,使石蕊溶液变,酚酞溶液;2.碱性溶液中含有大量离子,使石蕊溶液变,酚酞溶液。
四、复分解反应条件:(反应特点:离子交换,化合价不变)(1)沉淀:Ag++Cl-=AgCl↓ Ba2++SO42--==BaSO4↓ Ba2++CO32--==BaCO3↓Ca2++CO32--==CaCO3↓ Cu2++2OH--==Cu(OH)2↓ Fe3++3OH--==Fe(OH)3↓ Mg2++2OH—=Mg(OH)2↓(2)气体:2H++CO32--==CO2↑+H2O NH4++OH--==NH3↑+H2O(3)水:H++OH--==H2O(中和反应)五、八个反应公式:(一)、金属+酸= (置换反应)(氢前金属,铁为+2)1. 镁和硫酸:;2. 镁和盐酸:;3.铁和盐酸:。
4. 铁和硫酸:;5. 实验室制取氢气:;. ;(二)、金属+盐= (置换反应)(强换弱,铁为+2)1. 铁和硫酸铜溶液:,2. 铜和硝酸银溶液:,3. 铝和硫酸铜溶液:。
4. 锌和硫酸铜溶液:。
(三)碱+非金属氧化物= (盐比氧化物多一个“O”原子,元素化合价不变)1. 氢氧化钠在露置在空气中变质的原因:;2. 氢氧化钠和二氧化硫:;3. 二氧化碳的检验(用石灰浆刷墙,墙变硬的原因):;4. 用石灰水吸收硫酸厂排放的二氧化硫:;(四)、酸+金属氧化物= (复分解反应)(用于金属除锈)1. 氧化铜和硫酸:,2. 氧化铜和盐酸:;3. 硫酸除铁锈:,4. 盐酸除铁锈:;(五)、酸+碱= (中和反应-复分解反应)1. 氢氧化钠溶液中逐滴滴加盐酸:;2. 氢氧化铜和硫酸:,3. 用氢氧化镁治疗胃酸过多:;4. 用氢氧化铝治疗胃酸过多:;5. 氢氧化钠处理硫酸厂废水:,6. 用熟石灰改良含硫酸的土壤:;7. 氢氧化钡和硫酸:,(六)、酸+盐= (复分解反应)1. 碳酸钠和硫酸:;2. 纯碱和盐酸反应:;3. 盐酸和硝酸银:;4. 用小苏打治疗胃酸过多:;5.二氧化碳的实验室制法:。
酸碱盐金属金属氧化物非金属氧化物的通性
Fe+CuSO=
性盐反
出来面的金属
生成新盐和新
应
金属
金属化学性质的通性:
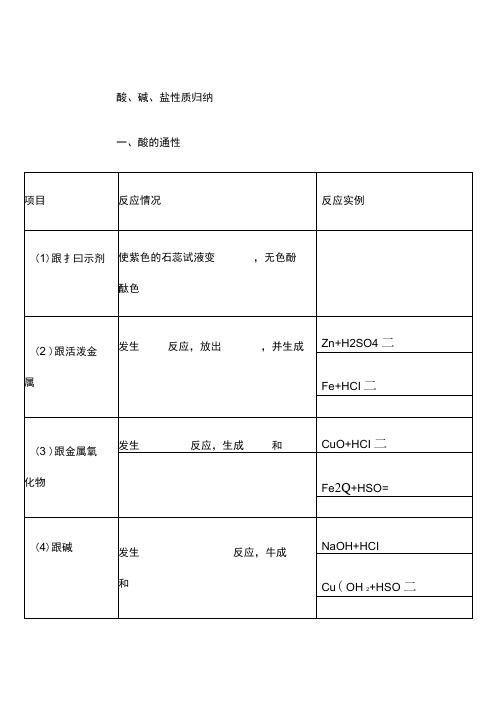
酸、碱、盐性质归纳
一、酸的通性
项目
反应情况
反应实例
(1)跟扌曰示剂
使紫色的石蕊试液变,无色酚
酞色
(2)跟活泼金
属
发生反应,放出,并生成
Zn+H2SO4二
Fe+HCI二
(3)跟金属氧
化物
发生反应,生成和
CuO+HCI二
Fe2Q+HSO=
(4)跟碱
发生反应,牛成
和
NaOH+HCI
Cu(OH2+HSO二
(5)跟某些盐
CuSO+NaOH二
碱反应
应和成
溶于水生成物要有沉淀
NHCI+Ca(OH2=
和
或气体或水
4、盐与
发生复分解反
反应物中的盐和盐要可
NaCI+AgNO
盐反应应和成和一溶于水生成物要有沉淀CuSOBaCb二
或气体或水
非金属氧化物通性(除NO CO外
SO+2NaOH二
金属氧化物的通性
项目
反应
情况
反应条件
反应实例
和新
Ca(OH2+FeCb二
盐的通性
项目
反应情况
反应条件
反应实例
1、盐与
发生置换反应
金属单质在金属活动顺
CuSO+Fe二
金属反
生成和
序中排在盐中金属
AgNO+Cu二
应
的,盐要可溶
2、盐与
发生复分解反
酸碱盐的通性

酸碱盐的通性
酸碱盐是我们生活中非常普遍的化学物质,常见的有盐酸、硫酸、磷酸、硝酸等,它们都是平时必不可少的化学物质。
从性质上看,酸碱盐都有一定的溶解性,能够溶解在水中,而且它们溶解反应
的速度也不一样。
其中,强酸例如盐酸,能够完全溶解在水中,而弱酸则只能部分溶解。
此外,酸碱盐也具有一定的热变性,有的可以带来不同的有趣变化,有的还可以用来实现发光反应。
从化学反应上看,酸碱盐有很多用途。
它们可以用作洗涤剂及溶剂,用来大规
模加工食物以及制造一些重要的有机分子,例如生物酶,从而使日常生活变得得心应手;酸碱盐也可以用来分离元素,以除去有害的杂质及有机物质或者控制反应条件,促进化学反应进行。
总而言之,酸碱盐是日常生活中非常重要的物质,它们不仅具有良好的溶解性
和热变性,还可以在化学反应中发挥重要作用,为日常生活节省了很多时间和精力。
酸碱盐金属金属氧化物非金属氧化物的通性

生成氧化物或过氧化物
Al+O2==
Cu+O2==
与ቤተ መጻሕፍቲ ባይዱ酸反应
排在前金属
发生置换反应生成盐和放出氢气
Fe+H2SO4=
与可溶性盐反应
排在前面金属从可溶性盐中置换出来面的金属
发生置换反应生成新盐和新金属
Fe+CuSO4=
金属化学性质的通性:
非金属氧化物通性(除NO、CO)外
项目
反应情况
反应实例
跟水反应
生成相应的
CO2+H2O=
SO2+H2O=
SO3+H2O=
跟碱反应
生成和
CO2+Ca(OH)2=
CO2+2NaOH=
SO3+2NaOH=
金属氧化物的通性
项目
反应情况
反应条件
反应实例
跟水反应
生成相应的
对应的碱可溶于水(KOH、NaOH、Ba(OH)2、Ca(OH)2的金属氧化物才能跟水反应
酸碱盐金属金属氧化物非金属氧化物的通性
酸、碱、盐性质归纳
一、酸的通性
项目
反应情况
反应实例
(1)跟指示剂
使紫色的石蕊试液变,无色酚酞色
(2)跟活泼金属
发生反应,放出,并生成
Zn+H2SO4=
Fe+HCl=
(3)跟金属氧化物
发生反应,生成和
CuO+HCl=
Fe2O3+H2SO4=
(4)跟碱
发生反应,生成和
Ca(OH)2+CO2=
(4)跟某些盐
高中化学酸碱盐通性总结

高中化学酸碱盐通性总结第一篇:高中化学酸碱盐通性总结酸(1)跟指示剂反应紫色石蕊试液遇酸变红色无色酚酞试液遇酸不变色(2)跟活泼金属起置换反应酸 + 金属==盐 + 氢气2HCl+Fe=FeCl2+H2↑(3)跟碱性氧化物反应酸 + 性氧化物—→盐+水3H2SO4+Fe2O3=Fe2(SO4)3+3H2O(4)跟某些盐反应酸+盐—→新酸+新盐H2SO4+BaCl2=2HCl+BaSO4↓(5)跟碱起中和反应酸+碱—→盐+水2HCl+Cu(OH)2=CuCl2+2H2O 碱(1)跟指示剂反应紫色石蕊试液遇碱变蓝色无色酚酞试液遇碱变红色(2)跟酸性氧化物反应碱+酸性氧化物—→盐+水2NaOH+CO2 = Na2CO3+H2O(3)跟酸反应碱+酸—→盐+水Ba(OH)2+2HCl=BaCl2+2H2O(4)跟某些盐反应碱+盐—→新碱+新盐Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 盐(1)跟某些金属的反应盐+金属—→新盐+新金属CuSO4+Fe=FeSO4+Cu(2)跟酸的反应盐+酸—→新盐+新酸BaCl2+H2SO4 = BaSO4↓+2HCl(3)跟某些碱的反应盐+碱—→新盐+新碱CuSO4+2KOH=K2SO4+Cu(OH)2(4)跟某些盐的反应盐+盐—→两种新盐NaCl+AgNO3=AgCl↓+NaNO3酸性氧化物:和碱反应只生成盐和水的氧化物1和碱反应生成盐(和水)2和碱性氧化物反应生成盐(和水)(SiO2,N2O5,也是酸性氧化物,但二氧化硅不溶于水,不能与水直接化合生成硅酸判定酸性氧化物最重要依据是化学反应前后各元素化合价保持不变)碱性氧化物:和酸反应只生成盐和水的氧化物1和酸反应生成盐(和水)2和酸性氧化物反应生成盐(和水)(碱金属和钙、锶、钡的氧化物能跟水反应,生成相应的氢氧化物。
其他碱性氧化物不能跟水反应。
)注(1)酸性氧化物不都是非金属氧化物,非金属氧化物也不都是酸性氧化物如Mn2O7、是酸性氧化物,却是金属氧化物;CO、NO2、NO 等都是非金属氧化物,但不是酸性氧化物(2)碱性氧化物都是金属氧化物,但金属氧化物不一定碱性氧化物。
酸碱盐金属金属氧化物非金属氧化物的通性

生成氧化物或过氧化物
Al+O2==
Cu+O2==
与稀酸反应
排在前金属
发生置换反应生成盐和放出氢气
Fe+H2SO4=
与可溶性盐反应
排在前面金属从可溶性盐中置换出来面的金属
发生置换反应生成新盐和新金属
Fe+CuSO4=
金属化学性质的通性:
发生反应,生成新和新
NaOH+CuSO4=
Ca(OH)2+FeCl3=
盐的通性
项目
反应情况
反应条件
反应实例
1、盐与金属反应
发生置换反应生成和
金属单质在金属活动顺序中排在盐中金属的,盐要可溶
CuSO4+Fe=
AgNO3+Cu=
2、盐与酸反应
发生复分解反应生成和
生成物中要有沉淀或气体或水
AgNO3+HCl=
(5)跟某些盐
发生反应,生成和
BaCl2+H2SO4=
CaCO3+2HCl=
碱的通性
项目
反应情况
反应实例
(1)跟指示剂
使紫色的石蕊试液变色,无色酚酞变色
(2)跟酸
发生反应,生成和
NaOH+HCl=
Cu(OH)2+H2SO4
(3)跟非金属氧化物
反应生成和
NaOH+SO2=
Ca(OH)2+CO2=
(4)跟某些盐
项目
反应情况
反应实例
跟水反应
ห้องสมุดไป่ตู้生成相应的
CO2+H2O=
SO2+H2O=
酸碱盐知识点归纳

酸碱盐知识点归纳一、酸酸是在水溶液中电离出的阳离子全部是氢离子(H⁺)的化合物。
1、常见的酸(1)盐酸(HCl):具有挥发性,浓盐酸在空气中会形成白雾。
(2)硫酸(H₂SO₄):具有吸水性,可用作干燥剂。
浓硫酸具有强腐蚀性,稀释浓硫酸时一定要将浓硫酸沿器壁慢慢注入水中,并不断搅拌。
(3)硝酸(HNO₃):具有强氧化性和腐蚀性。
2、酸的通性(1)使紫色石蕊试液变红,不能使无色酚酞试液变色。
(2)与活泼金属反应生成盐和氢气。
例如:Fe + 2HCl = FeCl₂+ H₂↑(3)与金属氧化物反应生成盐和水。
例如:Fe₂O₃+ 6HCl =2FeCl₃+ 3H₂O(4)与碱发生中和反应生成盐和水。
例如:HCl + NaOH = NaCl + H₂O(5)与某些盐反应生成新酸和新盐。
例如:HCl + AgNO₃=AgCl↓ + HNO₃3、酸的特性(1)浓盐酸的挥发性:打开浓盐酸的瓶盖,会看到瓶口有白雾产生,这是因为挥发出的氯化氢气体与空气中的水蒸气结合形成盐酸小液滴。
(2)浓硫酸的吸水性:浓硫酸可以吸收空气中的水分,因此可以用作干燥剂,但不能干燥氨气等碱性气体。
(3)浓硫酸的腐蚀性:浓硫酸具有很强的腐蚀性,能使木材、纸张等碳化变黑。
二、碱碱是在水溶液中电离出的阴离子全部是氢氧根离子(OH⁻)的化合物。
1、常见的碱(1)氢氧化钠(NaOH):俗称烧碱、火碱、苛性钠,具有强烈的腐蚀性,易潮解,可作干燥剂。
(2)氢氧化钙Ca(OH)₂:俗称熟石灰、消石灰,其水溶液俗称石灰水。
2、碱的通性(1)使紫色石蕊试液变蓝,使无色酚酞试液变红。
(2)与非金属氧化物反应生成盐和水。
例如:2NaOH + CO₂=Na₂CO₃+ H₂O(3)与酸发生中和反应生成盐和水。
例如:NaOH + HCl = NaCl + H₂O(4)与某些盐反应生成新碱和新盐。
例如:2NaOH + CuSO₄=Cu(OH)₂↓ + Na₂SO₄3、碱的特性(1)氢氧化钠易潮解,且在空气中容易吸收二氧化碳而变质。
酸碱盐的通性

酸碱盐的通性酸的通性:有腐蚀性,溶液呈酸性,能与活泼金属,碱,某些盐和金属氧化物反应与排在氢之前的活泼金属反应生成盐和氢气,与指示剂反应碱的通性:有腐蚀性,溶液呈碱性,能与某些金属,酸,某些盐和非金属氧化物反应,与指示剂反应盐的通性:有些盐有微弱的腐蚀性,溶液的酸碱度根据盐的性质判定,能与某些酸,碱,盐反应还能和其他某些化合物反应酸碱盐溶解性口诀酸+碱=盐+水即:中和反应。
反应条件:无反应类型:中和反应例:H2SO4(酸)+Mg(OH)2(碱)= MgSO4(盐)+ 2H2O(水)酸+盐=新酸+新盐反应条件:有气体或者水或者沉淀生成才能反应反应类型复分解例:2HCL(酸)+Na2CO3(盐)= H2CO3(新酸)+ 2NaCl(新盐)但是碳酸不稳定:H2CO3=H2O+CO2↑这样就有气体和水生成了酸+活泼金属=盐+氢气反应条件:金属是活泼金属反应类型:置换例:2HCl(盐酸)+Fe(活泼金属)= FeCl2(盐)+H2↑(氢气)酸+金属氧化物=盐+水反应条件:无反应类型:复分解例:H2SO4(酸)+CuO(金属氧化物)= CuSO4(盐)+H2O(水)酸碱盐的常见反应方程式(1)金属单质+ 酸-------- 盐+ 氢气(置换反应)26. 锌和稀硫酸Zn + H2SO4==== ZnSO4 + H2↑27. 铁和稀硫酸Fe + H2SO4 ====FeSO4 + H2↑28. 镁和稀硫酸Mg + H2SO4 ==== MgSO4 + H2↑29. 铝和稀硫酸2Al +3H2SO4 ==== Al2(SO4)3 +3H2↑30. 锌和稀盐酸Zn + 2HCl ====ZnCl2 + H2↑31. 铁和稀盐酸Fe + 2HCl ====FeCl2 + H2↑32. 镁和稀盐酸Mg+ 2HCl ==== MgCl2 + H2↑33. 铝和稀盐酸2Al + 6HCl ====2AlCl 3+ 3H2↑(2)金属单质+ 盐(溶液)------- 另一种金属+ 另一种盐34. 铁和硫酸铜溶液反应:Fe + CuSO4 ==== FeSO4 + Cu35. 锌和硫酸铜溶液反应:Zn + CuSO4 ==== ZnSO4 + Cu36. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2==== Cu(NO3)2 + Hg(3)碱性氧化物+酸-------- 盐+ 水37. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl==== 2FeCl3 + 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4==== Fe2(SO4)3 + 3H2O39. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O40. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4+ H2O41. 氧化镁和稀硫酸反应:MgO + H2SO4==== MgSO4 + H2O42. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O(4)酸性氧化物+碱-------- 盐+ 水43.苛性钠暴露在空气中变质:2NaOH + CO2 ====Na2CO3 + H2O 44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O 45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ====Na2SO4 + H2O 46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O 47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3 ↓+ H2O (5)酸+ 碱-------- 盐+ 水48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2==== CuCl2 + 2H2O51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ====FeCl3 + 3H2O53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O54.硫酸和烧碱反应:H2SO4 + 2NaOH==== Na2SO4 + 2H2O55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ====K2SO4 + 2H2O56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ====CuSO4 + 2H2O57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸+ 盐-------- 另一种酸+ 另一种盐59.大理石与稀盐酸反应:CaCO3 + 2HC l ==== CaCl2 + H2O + CO2↑ 60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑ 61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑ 62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO363.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4 ↓+ 2HCl(7)碱+ 盐-------- 另一种碱+ 另一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO4 66.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl 67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓ + 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH。
酸碱盐金属金属氧化物非金属氧化物的通性
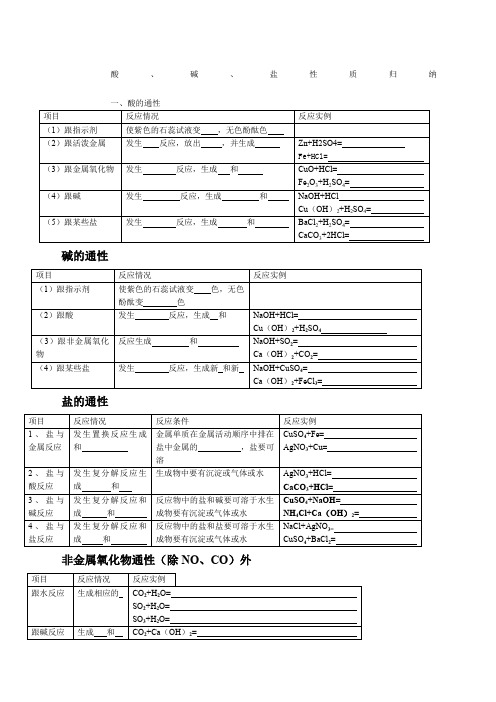
3、盐与碱反应
发生复分解反应和成和
反应物中的盐和碱要可溶于水生成物要有沉淀或气体或水
CuSO4+NaOH=
NH4Cl+Ca(OH)2=
4、盐与盐反应
发生复分解反应和成和
反应物中的盐和盐要可溶于水生成物要有沉淀或气体或水
NaCl+AgNO3=
CuSO4+BaCl2=
非金属氧化物通性(除NO、CO)外
项目
反应情况
反应实例
跟水反应
生成相应的
CO2+H2O=
SO2+H2O=
SO3+H2O=
跟碱反应
生成和
CO2+Ca(OH)2=
CO2+2NaOH=
SO3+2NaOH=
金属ቤተ መጻሕፍቲ ባይዱ化物的通性
项目
反应情况
反应条件
反应实例
跟水反应
生成相应的
对应的碱可溶于水(KOH、NaOH、Ba(OH)2、Ca(OH)2的金属氧化物才能跟水反应
(5)跟某些盐
发生反应,生成和
BaCl2+H2SO4=
CaCO3+2HCl=
碱的通性
项目
反应情况
反应实例
(1)跟指示剂
使紫色的石蕊试液变色,无色酚酞变色
(2)跟酸
发生反应,生成和
NaOH+HCl=
Cu(OH)2+H2SO4
(3)跟非金属氧化物
反应生成和
NaOH+SO2=
Ca(OH)2+CO2=
(4)跟某些盐
少量金属即使高温时也不反应如真金不变火炼说明金在高温时也不跟氧气反应。
高中化学酸碱盐通性总结

(1)跟指示剂反应紫色石蕊试液遇酸变红色无色酚酞试液遇酸不变色(2)跟活泼金属起置换反应酸+ 金属==盐+ 氢气2HCl+Fe=FeCl2+H2↑(3)跟碱性氧化物反应酸+ 性氧化物—→盐+水3H2SO4+Fe2O3=Fe2(SO4)3+3H2O(4)跟某些盐反应酸+盐—→新酸+新盐H2SO4+BaCl2=2HCl+BaSO4↓(5)跟碱起中和反应酸+碱—→盐+水2HCl+Cu(OH)2=CuCl2+2H2O碱(1)跟指示剂反应紫色石蕊试液遇碱变蓝色无色酚酞试液遇碱变红色(2)跟酸性氧化物反应碱+酸性氧化物—→盐+水2NaOH+CO2 = Na2CO3+H2O(3)跟酸反应碱+酸—→盐+水Ba(OH)2+2HCl=BaCl2+2H2O(4)跟某些盐反应碱+盐—→新碱+新盐Ca(OH)2+Na2CO3=CaCO3↓+2NaOH盐(1)跟某些金属的反应盐+金属—→新盐+新金属CuSO4+Fe=FeSO4+Cu(2)跟酸的反应盐+酸—→新盐+新酸BaCl2+H2SO4 = BaSO4↓+2HCl(3)跟某些碱的反应盐+碱—→新盐+新碱CuSO4+2KOH=K2SO4+Cu(OH)2(4)跟某些盐的反应盐+盐—→两种新盐NaCl+AgNO3=AgCl↓+NaNO3酸性氧化物:和碱反应只生成盐和水的氧化物1和碱反应生成盐(和水)2和碱性氧化物反应生成盐(和水)(SiO2,N2O5,也是酸性氧化物,但二氧化硅不溶于水,不能与水直接化合生成硅酸判定酸性氧化物最重要依据是化学反应前后各元素化合价保持不变)碱性氧化物:和酸反应只生成盐和水的氧化物1和酸反应生成盐(和水)2和酸性氧化物反应生成盐(和水)(碱金属和钙、锶、钡的氧化物能跟水反应,生成相应的氢氧化物。
其他碱性氧化物不能跟水反应。
)注(1)酸性氧化物不都是非金属氧化物,非金属氧化物也不都是酸性氧化物如Mn2O7、是酸性氧化物,却是金属氧化物;CO、NO2、NO等都是非金属氧化物,但不是酸性氧化物(2)碱性氧化物都是金属氧化物,但金属氧化物不一定碱性氧化物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
酸碱盐的通性
酸:物质在溶于水时,电离出的阳离子全部是氢离子的化合物称为酸。
酸的通性
(1) 酸溶液能与酸碱指示剂反应
1. 无色酚酞不变色
2.紫色石蕊变红色
(2) 酸+活泼金属=盐+氢气(酸通常指的是稀硫酸和稀盐酸,不能是浓硫酸或硝酸。
)
例:Zn+H2SO4==ZnSO4+H2↑
(3) 酸+碱性氧化物=盐+水
例:ZnO+H2SO4==ZnSO4+H2O
(4) 酸+碱=盐+水
例:2NaOH+H2SO4==Na2SO4+2H2O
(5) 酸+盐=新盐+新酸
要依照复分解的条件来判断是否会发生反应,常见的有强酸制弱酸、高沸点(不挥发性)酸制低沸点(挥发性)酸、以及某些沉淀不溶于酸等
例:H2SO4+BaCl2==BaSO4↓+2HCl
碱是电离时产生的阴离子全部都是氢氧根离子的化合物。
碱分为可溶性碱和不可溶性碱两种。
不可溶性碱,能与酸反应
例如:
(1) Cu(OH)2+2HCI=CuCl2+2H2O
(2) Mg(OH)2+2HCI=MgCI2+2H2O
可溶性碱通性
1.碱能使紫色石蕊试液变蓝
碱能使无色的酚酞试剂变红。
碱与酸碱指示剂的反应属于化学反应。
2.碱 +酸性氧化物==盐 + 水
举例:
②Ca(OH)2+CO2=CaCO3↓+H2O
②2NaOH+CO2=Na2CO3+H2O
3.碱+酸==盐+水(中和反应)
(一般来说,中和反应都是放热反应且中和反应是复分解反应)
举例:
①2NaOH+H2SO4=Na2SO4+2H2O
②Ca(OH)2+2HNO3=Ca(NO3)2+2H2O
4.碱 +盐==新盐 + 新碱
举例:
①Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
②Ba(OH)2+Na2CO3=BaCO3↓+2NaOH
条件:
①反应物必须可溶于水
②生成物至少有一种是沉淀
5.不溶性碱=加热=金属氧化物+水
举例:
Cu(OH)2≜CuO+H2O
盐指一类金属离子或铵根离子(NH4+)与酸根离子或非金属离子结合的化合物。
分为单盐和合盐,单盐分为正盐、酸式盐、碱式盐,合盐分为复盐和络盐。
其中酸式盐除含有金属离子与酸根离子外还含有氢离子,碱式盐除含有金属离子与酸根离子外还含有氢氧根离子,复盐溶于水时,可生成与原盐相同离子的合盐;络盐溶于水时,可生成与原盐不相同的复杂离子的合盐。
盐酸既是盐化工的重要产品,又是生产硅材料的重要原料。
盐的通性
a、盐溶液+金属→盐ˊ+金属ˊ置换反应Fe+CuSO4=FeSO4+Cu (可溶性盐,反应的金属活
泼性比生成的金属要强)
b、盐+酸→盐ˊ+酸ˊBaCl2+H2SO4=2HCl+BaSO4↓
c、盐溶液+碱溶液→盐ˊ+碱ˊNa2CO3+Ca(OH)2=2NaOH+CaCO3↓
d、盐溶液+盐溶液→盐ˊ+盐ˊ2AgNO3+BaCl2=Ba(NO3)2+2AgCl↓(反应物都可溶,生成物
至少有一种是沉淀)
e、。
