大肠菌群平板计数法原始记录
大肠菌群平板计数法实验报告

大肠菌群平板计数法实验报告
一、实验目的
本实验旨在通过大肠菌群平板计数法,检测两种不同类型的样品,分
别研究其大肠菌群的数量。
二、实验原理
大肠菌群平板计数法是一种测定复合微生物群落中不同细菌种群数量
的方法,通过在培养基上培养细菌分离特定细菌和其他微生物,然后在培
养基表面形成菌落,把形成的菌落数目统计出来就可以测定某一种细菌的
数量。
三、实验材料
1.无菌培养环:用于现场取样,主要成分是聚丙烯,尺寸为20
cm×40 cm;
2.筛选液:用于本实验的筛选液是根据微生物学原理,采用等量的乳
酸盐,氯化钠和磷酸盐等有机物质制备而成的液体,用于筛选出大肠菌群;
3.抗生素优势培养基:用于本实验,培养基由甘露醇、尿素、抗生素
等制备而成,用于培养出大肠菌群;
4.保存液:用于本实验的液体是根据微生物学原理,采用等量的乳酸盐、氯化钠和磷酸盐等有机物质制备而成,用于保存细菌;
5.透明细菌示踪液:用于本实验,示踪液由甘露醇、尿素、抗生素等
有机物质制备而成,用于追踪细菌的繁殖情况。
四、实验步骤
1.采样:用无菌环把样品和筛选液放在瓶中,搅拌均匀,然后加入适量。
大肠菌群测定原始记录

要求:初发酵试验:36℃±1℃;24h±2h或48h±2h。复发酵试验:36℃±1℃;48h±2h。
初发酵:_月_日_时至_月_日_时;复发酵:_月_日_时至_月_日_时。
稀释度
管号
接种量
(ml)
初次发酵
导管有
无气泡
阴
阳
性
复发酵
导管有
无气泡
阴
阳
性
大肠菌群最有可能数(MPN/100g)
LST肉汤
BGLB肉汤
大肠菌群测定原始记录
编号:
样品名称
规格型号
生产批次
抽样数量
检验标准
GB4789.3-2010
生产日期
检验日期
样品
处理
无菌操作取检样25g,加225ml无菌生理盐水,均质处理得1:10稀释液,再用灭菌生理盐水按梯度稀释,得1:100、1:1000稀释液,选择三个连续的适宜稀释度接种发酵管,双料发酵管接种稀释液10ml,单料发酵管接种稀释液1ml。
备注:
检验员:年月日校核员:年月日
1:10
1
24h( ) 48h( )
2
1
24h( ) 48h( )
3
1
24h( ) 48h( )
1:100
1
1
24h( ) 48h( )
2
1
24h( ) 48h( )
3
1
24h( ) 48h( )
1:1000
1
1
24h( ) 48h( )
2
1
24h( ) 48h( )
3
1
24h( ) 48h( )
大肠菌群的测定实验报告

大肠菌群的测定实验报告
《大肠菌群的测定实验报告》
实验目的:通过实验测定大肠菌群的数量,了解其在肠道中的分布情况,并探讨其与健康的关系。
实验方法:我们采集了一组健康人群的粪便样本,并使用培养基和平板计数法对大肠菌群进行测定。
首先,我们将粪便样本均匀涂抹在培养基上,然后将培养皿放入恒温箱中进行培养。
培养后,我们对培养皿上的菌落进行计数,并根据计数结果得出大肠菌群的数量。
实验结果:经过实验测定,我们发现健康人群的大肠菌群数量在正常范围内,平均值约为10^8 CFU/g。
同时,我们还发现不同个体之间的大肠菌群数量存在一定的差异,但总体上呈现出稳定的分布情况。
实验分析:大肠菌群在肠道中起着重要的作用,它能够帮助人体消化食物、产生维生素等。
同时,大肠菌群的数量与肠道健康密切相关,过多或过少都可能导致肠道问题。
因此,通过测定大肠菌群的数量,可以帮助我们了解肠道健康状况,及时采取相应的调节措施。
结论:通过本次实验测定,我们得出了健康人群大肠菌群数量的正常范围,并认识到了大肠菌群在肠道健康中的重要作用。
希望通过这一实验结果,能够为人们提供更多关于肠道健康的参考信息,促进人们更加关注和重视肠道健康。
微生物检测原始记录

菌落总数与大肠菌群检验原始记录样品名称仪器设备名称检验依据一、菌落总数cfu/ml(g)培养温度:培养时间:空白∕稀释稀释倍数原液液对照平板 1平板 2平均值检测结果:二、大肠菌群MPN/100ml ( g)培养基名称:培养温度:培养时间:共页第页样品编号仪器设备编号检验环境温度:湿度:培养基名称:年月日时 ---年月日时10-110-210-310-4年月日时---年月日时LST 发酵1ml × 30.1ml × 30.0 1ml × 3初发酵结果复发酵试验检测结果主检:年月日校核:年月日菌落总数和大肠菌群检测原始记录共页第页样品名称样品编号仪器设备名称仪器设备编号检验环境温度:湿度:检验依据GB4789.2-2010 GB4789.3-2010一、菌落总数 cfu/ml(g)培养基名称:培养温度: 36±1℃培养时间:年月日时---年月日时样品数样 1样 2样 3样 4样 5稀释倍数平板 1平板 2平板 1平板 2平板 1平板 2平板 1平板 2平板 1平板 2原液10-110-210-310-4空白对照检验结果二、大肠菌群 cfu/ml(g)培养基名称:培养温度: 36±1℃培养时间:年月日时---年月日时样品数样 1样 2样 3样 4样 5稀释倍数平板 1平板 2平板 1平板 2平板 1平板 2平板 1平板 2平板 1平板 2原液10-110-210-310-4空白对照验证试验检验结果主检:年月日校核:年月日XXXX检测有限公司水质微生物检验原始记录共页第页样品名称样品编号设备名称检验环境温度:湿度:检验依据一、菌落总数 cfu/ml(g)培养温度: 36± 1℃稀释倍数原液10-110-210-310-410-5平板 1平板 2平均值检测结果:二、总大肠菌群MPN/100ml (g)培养温度: 36± 1℃培养时间:LST 培养基10ml ×1ml ×0.1ml ×0.01ml ×发酵结果验伊红美蓝琼脂平板证革兰氏染色试验乳糖复发酵检测结果三、大肠埃希氏菌MPN/100ml ( g)验自总大肠菌群乳糖发酵试样中的阳性管中取一滴转接伊红美蓝琼脂平板证种与 EC 培养基中置44.5℃培养 24 小时观察试验四、耐热大肠菌群MPN/100ml ( g)验将总大肠菌群多管发酵法初发酵或产气的管中培养后的 EC-MUG 管在暗处用EC-MUG 管中波长 366nm 功率为 6W 的紫外光证用无菌金属接种环将试液接种到试置 44.5℃培养 24 小时观察灯照射验主检:年月日校核:年月日XXXX检测有限公司乳酸菌与大肠菌群检测记录共页第页样品名称样品编号仪器设备名称检验环境温度:湿度:检验依据一、乳酸菌 cfu/ml(g)培养温度: 36± 1℃培养时间:稀释倍数原液10-310-410-510-610-7平板 1平板 2平均值检测结果:二、大肠菌群MPN/100ml ( g)培养温度:培养时间:年月日时 ---年月日时LST 发酵1ml × 30.1ml × 30.0 1ml × 3发酵结果伊红美蓝琼脂平板验证试验革兰氏染色乳糖复发酵检测结果主检:年月日校核:年月日XXXX检测有限公司致病菌检验原始记录共页第页样品名称样品编号仪器设备名称仪器设备编号检验环境温度:湿度:致病菌培养温度:培养时间:年月日时 ---年月日时金黄色葡萄球菌25g 样品 +225ml7.5%(定性检验)氯化钠肉汤,均质检验依据:将上述培养物,分别观察溶血血浆凝固酶试验划线接种到涂片染色Baird-Parker 和血平板实验现象检测结果前增菌增菌分离沙门氏菌将上述培养物,25g样再次将上述培养生化试验品检验依据:+225mlBPW ,分别取 1ml 转接种于 10mlTTB 物,分别划线接种均质与于 BS 琼脂平板10mlSC 内,进行XLD 琼脂平板前增菌实验现象检测结果志贺氏菌25g 样品 +225ml检验依据:GN 增菌液实验现象检测结果25g 样品 +225ml 生理溶血性链球菌盐水,吸取5ml 接种于 50ml 葡萄糖肉汤曾检验依据:菌,划线接种于血平板实验现象检测结果主检:年月将上述培养物分别划线接种于划线接种 TSI,生化试验HE 平板和 EMB 平板葡萄糖半固体涂片染色观察溶血血浆凝固酶试验日校核:年月日霉菌和酵母菌检验原始记录共页第页样品名称样品编号仪器设备名称仪器设备编号检验依据检验环境温度:湿度:培养基名称培养温度: 28±1℃培养时间:年月日时---年月日时:观察培养培养温度观察时间观察结果第 1 天第 2 天第 3 天第 4 天第 5 天观察结论:菌落计数:培养温度: 28±1℃培养时间:年月日时---年月日时稀释倍数空白∕稀释液对照原液10-110-2-3-41010平板 1平板 2平均值检测结果主检:年月日校核:年月日商业无菌检验原始记录共页第页样品名称样品编号仪器名称检验环境温度:湿度:仪器编号检验依据1、保温试验:将完整试样一份置于36± 1℃培养箱保温十天,每天观察胖听、泄漏现象。
大肠菌群平板计数法原始记录
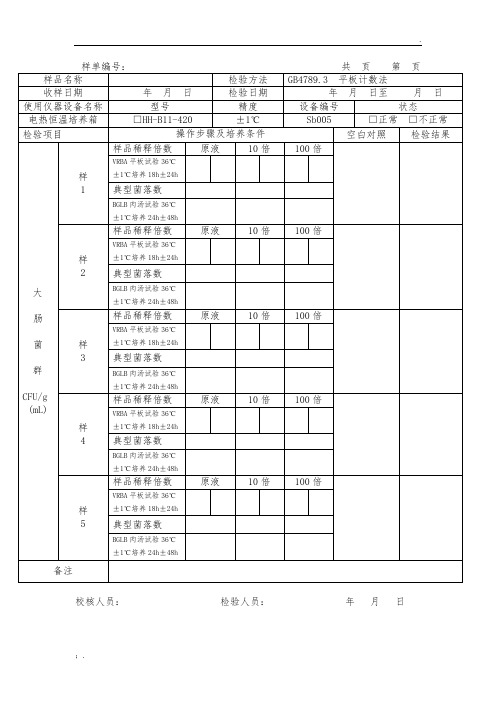
校核人员: 检验人员: 年 月 日
样品名称检验方法gb47893平板计数法收样日期使用仪器设备名称型号精度设备编号状态电热恒温培养箱hhb11420sb005正常不正常检验项目操作步骤及培养条件空白对照检验结果cfugml样品稀释倍数原液10vrba平板试验361培养18h24h典型菌落数bglb肉汤试验361培养24h48h样品稀释倍数原液10vrba平板试验361培养18h24h典型菌落数bglb肉汤试验361培养24h48h样品稀释倍数原液10vrba平板试验361培养18h24h典型菌落数bglb肉汤试验361培养24h48h样品稀释倍数原液10vrba平板试验361培养18h24h典型菌落数bglb肉汤试验361培养24h48h样品稀释倍数原液10vrba平板试验361培养18h24h典型菌落数bglb肉汤试验361培养24h48h备注校核人员
原液
10倍
100倍
VRBA平板试验36℃±1℃培养18h±24h
典型菌落数
BGLB肉汤试验36℃±1℃培养24h±48h
样
2
样品稀释倍数
原液
10倍
100倍
VRBA平板试验36℃±1℃培养18h±24h
典型菌落数
BGLB肉汤试验36℃±1℃培养24h±48h
样
3
样品稀释倍数
原液
10倍
100倍
VRBA平板试验36℃±1℃培养18h±24h
典型菌落数
BGLB肉汤试验36℃±1℃培养24h±48h
样
4
样品稀释倍数
原液
10倍
100倍
VRBA平板试验36℃±1℃培养18h±24h
典型菌落数
BGLB肉汤试验36℃±1℃培养24h±48h
微生物检验原始记录(大肠菌群)

微生物检验原始记录(大肠菌群)检验原始记录编号:报告类别:微生物共页项目:大肠菌群coliforms 检验地点:样品名称:样品编号:样品状态:符合检验要求;其他境条件:实验依据及步骤GB4789.3-2016样品稀释固体和半固体样品:称取25g样品置盛有225ml生理盐水或磷酸盐缓冲液的无菌均质容器内均质,或放入盛有225ml稀释液的无菌均质袋中拍击式均质器拍打,制成为1:10样品匀液。
依次进行10倍递增稀释。
液体样品:以无菌吸管吸取25ml样品置盛有225ml磷酸盐缓冲液或生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中混匀,为1:10样品匀液。
样品匀液的ph应在6.5-7.5之间,必要时分别用1mol/lNaOH或1mol/lHcL调节。
取1mL1∶10稀释匀液沿管壁缓缓注入9ml磷酸盐缓冲液或生理盐水的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用一支无菌吸管反复吹打,使其混合均匀,制成1:100样品匀液。
按上述操作顺序做10倍递增稀释液,每稀释一次,换用一支1mL灭菌吸量管。
从样品匀液制备到样品接种完毕,全过程不得超过15min。
初发酵试验(9管法)每个样品,选择3个适宜的连续稀释度的样品匀液(液体样品可以选择原液),每个稀释度接种3管月桂基硫酸盐胰蛋白胨(LST)肉汤(大肠菌群测定:如果超过1ml,则用双料LST肉汤)36℃±1℃培养24h±2h,观察倒管内是否有气泡产生。
产气者进行复发酵试验,未产气则继续培养至48±2h,产期进行复发酵试验。
未产气者为大肠菌群阴性。
复发酵试验(证实试验)用接种环从产气的LST肉汤管中分别取培养物1环,移种于煌绿糖胆盐肉汤(BGLB)管中,36℃±1℃培养48h±2h,,观察产气情况。
数据分析与结果一、菌落计数根据证实为大肠菌群的阳性管数,查MPN检索表,报告大肠菌群的最可能数。
大肠菌群检验原始记录表

从VRBA平板上挑取10个不同类型的典型和可疑菌落,分别移种于BGLB肉汤管内,36℃±1℃培养24-48h,观察产气情况
。凡是BGLB肉汤管产气,即可报告为大肠菌群阳性。
操作依据
GB4789.3-2010
稀释倍数
a-10倍
b-100倍
c灭菌生理盐水对照
/6.1
VRBA平板
操作依据 GB4789.3-2010
检验日期:
2016 年 月 日
采样依据 GB4789.12010/4.1、 4.2.1二级 采样方案 (n、c、m值 5、0、0)
10的均匀稀释液,编号a 灭菌生理盐水,编号c做
、b2、c1。向上述5个平 ,依次置于36℃±1℃培
养24-48h,观察产气情况
操作依据 B4789.3-2010
/6.1 操作依据 B4789.3-2010
/8.2 操作依据 B4789.3-2010
/8.3
实试验及观察结果 依据
B4789.3-2010 /8.4
肠菌群数的计算 据GB4789.3-2010
/8.5 数据修约依据 789.来自-2010/7.2报告依据 B4789.3-2010
/8.5
培养基)
年月日
。用灭菌吸管取1mla,加入9ml灭菌生理盐水中,混合均匀做成1:100的均匀稀释液,编号b。取1ml灭菌生理盐水,编号c做
为空白对照。
从a、b、c液中,分别前后2次,各吸取1ml移液到2个灭菌平皿中,平皿编号分别为a1、a2、b1、b2、c1。向上述5个平
皿中分别注入凉至46℃的VRBA15ml,混匀待VRBA凝固后,再加3mlVRBA覆盖平板表层,翻转平板后,依次置于36℃±1℃培 养箱中,培养20h。
食品中大肠菌群MPN计数检验原始记录表

5
未产气者继续培养24h,若产气则复发酵,反之为阴性;
初发酵
6
初发酵产气者接种BGLB肉汤36±1℃,48±2h复发酵;
复发酵
7
若复发酵继续产气则阳性;
查MPN表
结果
8
查MPN表,记录结果,报告
温度(℃)
相对湿度(%RH)
报告
检验员: 审核员:
食品中大肠菌群MPN计数检验原始记录表(2016)
样品名称
样品编号
检验项目
大肠菌群MPN计数(2016)
检验日期
检验地点
□BSL-2实验室
□洁净实验室
检验依据
判定依仪
□生物安全柜□超净台□电子天平
□恒温振荡器□冰箱□冰 箱
检验试剂
LST肉汤、BGLB肉汤、磷酸盐缓冲液或无菌生理盐水等。
样品制备
□固体和半固体样品:无菌称取25g,置于盛有225mL磷酸盐缓冲液或无菌生理盐水的无菌灭菌袋内,进行均质处理。
□液体样品:吸取25mL于样品于225mL磷酸盐缓冲液或无菌生理盐水中,混匀。
□液体样品:直接吸原液检验。 □液体样品:直接吸原液10mL检验。
检验程序
大肠菌群计数[ MPN/g (mL ) ]
1
25g(mL)样品+225mL稀释液均质(或原液直接检验;
初发酵温度
℃,时间h
2
10倍系列稀释,选3个适宜稀释度样品匀液;
复发酵温度
℃,时间h
3
每个梯度接种3管LST肉汤(如接种量超过1mL则用双料LST肉汤),每管接种进行初发酵;
接种量
mL (g) ×管数
4
培养36±1℃,24±2h,观察倒管是否有气泡产生;
大肠菌群平板计数法原始记录

报告日期: 规格型号 样品数量
2
3
4
5
结晶紫中性红胆盐琼脂(VRBA),36℃±1℃培养18h-24h,单位CFU/g 煌绿乳糖胆盐肉汤(BGLB),36℃±1℃培养18h-24h(产气
10-1
10-2
10-3 空白 计算公式 计算结果
大肠菌群数=阳性试管比例*平板菌落数*稀释倍数
检验员:
复核:
(+:表示产气;-:表示不产气)
报告日期: 规格型号 样品数量
10
-1
10
-2
10-3 空白 计算公式 计算结果
大肠菌群数=阳性试管比例*平板菌落数*稀释倍数
检验员:
复核:
****食品有限公司
大肠菌群平板计数法检验原始记录
编号: 检验日期: 产品名称 抽样日期 批次编号 抽样人 检测方法:GB4789.3平板计数法 稀释度 1 2 3 4 5 1
****食品有限公司
大肠菌群平板计数法检验原始记录
编号: 检验日期: 产品名称 抽样日期 批次编号 抽样人 检测方法:GB4789.3平板计数法 稀释度 1 2来自3 4 5 1 2 3 4 5
结晶紫中性红胆盐琼脂(VRBA),36℃±1℃培养18h-24h,单位CFU/g 煌绿乳糖胆盐肉汤(BGLB),36℃±1℃培养18h-24h,
微生物检验原始记录(大肠菌群)

编号:
报告类别:
微生物
共页
项目:
大肠菌群coliforms
检验地点:
样品名称:
样品编号:
样品状态:
符合检验要求; 其他
环境条件:
实验依据及步骤
GB4789.3-2016
样品稀释
固体和半固体样品:称取25g样品置盛有225ml生理盐水或磷酸盐缓冲液的无菌均质容器内均质,或放入盛有225ml稀释液的无菌均质袋中拍击式均质器拍打,制成为1:10样品匀液。依次进行10倍递增稀释。
M:微生物指标的最高安全限量值
2.例:n=5,c=2,m=1cfu/g,M=10cfu/g,即从一批产品中采集5个样品,
若5个样品的检测结果均小于或等于m值(≤1cfu/g),则这种情况是允许的;
若≤2个样品的结果(X)位于m值和M值之间(1cfu/g≤X≤10cfu/g),则这种情况也是允许的;
若有3个及以上样品的检验结果位于m和M之间,则这种情况是不允许的;
MPN检索表
(CFU/ml)
n=5 c=2 m=1
1
2
3
4
5
1
2
3
4
5
1
2
3
4
5
1
2
3
4
5
1
2
3
4
5
数据分析与结果
一、菌落计数
根据证实为大肠菌群的阳性管数,查MPN检索表,报告大肠菌群的最可能数。
二、缓冲液
1.磷酸盐缓冲液
磷酸二氢钾 34.0g 蒸馏水500ml (稀释液需要1000ml)
贮存液:将34.0g磷酸二氢钾溶于500ml蒸馏水中,用大约175ml的1mol/l氢氧化钠溶液调节ph至7.2,用蒸馏水稀释至1000ml后贮存冰箱。
大肠菌群平板计数法原始记录
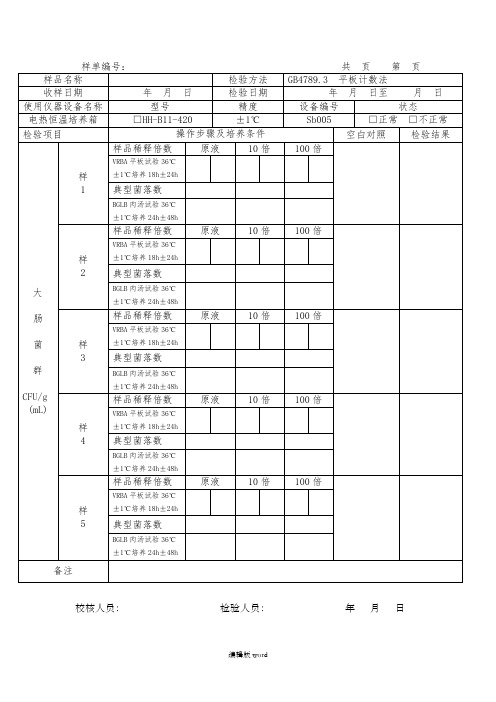
BGLB肉汤试验36℃±1℃培养24h±48h
样
2
样品稀释倍数
原液
10倍
100倍
VRBA平板试验36℃±1℃培养18h±24h
典型菌落数
BGLB肉汤试验36℃±1℃培养24h±48h
样
3
样品稀释倍数
原液
10倍
100倍
VRBA平板试验36℃±1℃培养18h±24h
典型菌落数
BGLB肉汤试验36℃±1℃培养24h±48h
样
4
样品稀释倍数
原液
10倍
100倍
VRBA平板试验36℃±1℃培养18h±24h
典型菌落数
BGLB肉汤试验36℃±1℃培养24h±48h
样
5
样品稀释倍数
原液
10倍
100倍
VRBA平板试验36℃±1℃培养18h±24h
典型菌落数
BGLB肉汤试验36℃±1℃培养24h±48h
备注
校核人员:检验人员:年月日
(此文档部分内容来源于网络,如有侵权请告知删除,文档可自行编辑修改内容,供参考,感谢您的配合和支持)
样单编号:共页第页
样品名称
检验方法
GB4789.3平板计数法
收样日期
年月日
检验日期
年月日至月日
使用仪器设备名称
型号
精度
设备编号
状态
电热恒温培养箱
□HH-B11-420
±1℃
Sb005
□正常□不正常
检验项目
操作步骤及培养条件
空白对照
检验结果
大
肠பைடு நூலகம்
菌
群
CFU/g
(mL)
食品大肠菌群的测定(平板计数法)(精)

任务五 典型和可疑菌落计数
• 选择菌落数在15~150之间的平板,分别计 数平板上出现的典型和可疑大肠菌群菌落。
• 典型菌落为紫红色,菌落周围有胆盐与酸形 成的沉淀环,菌落直径为0.5mm或更大。
• 任务六 证实试验
• 从VRBA平板上挑取10个不同类型的典型和 可疑菌落,分别移种于BGLB肉汤管内,进 行证实试验。
任务四 平板制备
选择适宜的稀释样液 根据对标本情况的估计,选择 3 个适宜稀释度,吸取该稀释度1mL稀释液于灭菌平皿内。
待培养基冷却至46℃左右,以无菌操作侵入无菌培 养皿中。每个平皿倒入约15-20mL培养基,利用培养基冲 散菌液,混匀。冷却凝固后,再在表面加3-4mL培养基。
从样品稀释到平板 涂布要求在15min 内 完成。
大肠菌群计数
1ml
1ml
1ml
生理 盐水
1:10
25g或
ml样品
1:100 1ml
1:1000 1ml
1:10000
1ml
1ml
VRBA的主要成分 乳糖、胆盐、结晶紫、 中性红及细菌生长所 必需的营养成分如:蛋 白胨、酵母膏等。 结晶紫和中性红为VRBA 的指示剂系统,在酸性条 件下为紫红色。
大肠菌群分解乳糖所 产生的酸与胆盐结合, 可形成沉淀。
加入46℃结晶紫中性红胆盐琼脂(VRBA)培养基 12~15ml待琼脂凝固后,再加3-4mL培养基覆盖。
挑选菌落接种BGLB
典型菌落为紫红色 , 菌 落周围有红色的胆盐沉 淀环。菌落直径为 0.5mm 或更大。
实践操作
任务一 仪器试剂准备
任务二 仪器试剂灭菌
任务三 样品稀释制备
全过程遵循无菌操作程序,考虑如何满足要求?
水质细总大肠菌群原始记录

水质细总大肠菌群原始记录1. 目的为确定本公司水质中菌落总数、大肠菌群测定使用方法,明确菌落总数、大肠菌群检测相关细则,指导人员正确作业,确保检测工作正常开展,根据《生活饮用水标准检验方法》GB5750.12-2006制订本方法作业指导书。
2. 适用范围适用于水质中菌落总数、大肠菌群的测定。
3. 职责检测人员严格按照本指导书要求开展检测工作。
4. 检测依据标准及检测方法《生活饮用水卫生标准》GB 5749-2006《生活饮用水标准检验方法》GB5750.12-20065. 标准值表1 二次供水菌落总数、大肠菌群6. 检验仪器及设备高压蒸汽灭菌器、恒温培养箱、冰箱、显微镜、PH试纸。
7. 试剂和材料营养琼脂培养基,三倍浓缩乳糖蛋白胨培养液,伊红美兰琼脂,革兰氏染色液。
8. 检测程序8.1 菌落总数:取采集的样品1mL于灭菌平皿内,倾入已融化冷却至45℃的营养琼脂15mL,同时做一个平行样和一个空白对照平皿,并立即摇匀。
冷却后,翻转平板,置于35℃~37℃恒温箱中,培养48h。
计数每个平板上的菌落数。
8.2 大肠菌群:在5支装有10mL双料乳糖蛋白胨培养液的试管各加水样10mL;在5支装有10mL单料乳糖蛋白胨的试管各加水样1mL,在5支装有10mL单料乳糖蛋白胨的试管各加稀释后的水样(1:10)1mL。
轻摇试管,是液体充分混匀,置35℃~37℃培养箱中24h。
观察是否产酸产气,若有,需进一步做证实试验。
8.3 取一环阳性管中的溶液接种到伊红美兰琼脂平板上,置35℃~37℃培养箱中18h~24h,观察菌落形态,典型的大肠菌群菌落为黑紫色或红紫色,具有金属光泽。
8.4 挑取可疑大肠菌群菌落1或2个进行革兰氏染色,同时接种乳糖发酵管,于36℃±1℃培养箱中,培养24h。
8.5 凡乳糖发酵管最终产酸、产气,革兰氏染色为阴性的无芽孢杆菌,为大肠菌群阳性。
记下证实试验的阳性管数,查总大肠菌群(MPN)检索表得出100mL水样中总大肠菌群的MPN值。
大肠菌群快速检测
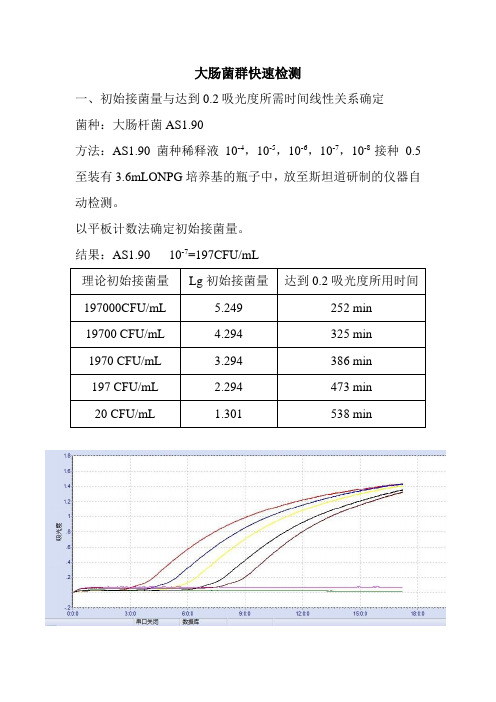
大肠菌群快速检测一、初始接菌量与达到0.2吸光度所需时间线性关系确定菌种:大肠杆菌AS1.90方法:AS1.90菌种稀释液10-4,10-5,10-6,10-7,10-8接种0.5至装有3.6mLONPG培养基的瓶子中,放至斯坦道研制的仪器自动检测。
以平板计数法确定初始接菌量。
结果:AS1.90 10-7=197CFU/mL以10为底初始接菌量的对数值为横坐标,达到0.2吸光度所用时间为纵坐标,得到初始接菌量与达到0.2吸光度线性关系,如下图示。
在高浓度初始接菌量下,初始接菌量与达到0.2吸光度所需时间呈现良好线性关系。
二、同一理论接菌量下不同反应瓶的时间比较菌种:大肠杆菌AS1.90方法:大肠杆菌AS1.90菌种稀释液10-6接种0.5至装有3.6mLONPG培养基的瓶子中,同样的接菌量做四管,放至斯坦道研制的仪器自动检测。
大肠杆菌AS1.90菌种稀释液10-9接种0.5至装有3.6mLONPG培养基的瓶子中,同样的接菌量做四管,放至斯坦道研制的仪器自动检测。
以平板计数法确定初始接菌量。
结果:10-8=108CFU/mL在高浓度初始接菌量(理论浓度10800CFU/mL)下,四个平行样达到0.2吸光度所用的时间基本一致,在6.5小时左右。
在低初始接菌量(理论浓度11CFU/mL)下, 四个平行样达到0.2吸光度所用的时间差别较大,有两管为535min,一管为570min,另一管为701min。
三、小结Ⅰ、在高浓度初始接菌量(102CFU/mL以上)时,初始接菌量与达到0.2吸光度所需时间呈现良好线性关系。
平行样达到0.2吸光度所用的时间基本一致。
Ⅱ、在低浓度初始接菌量(10CFU/mL以下)时,同样初始接菌量与达到0.2吸光度所需时间差别较大。
Ⅲ、实验中还发现,反应的容器对反应时间影响很大。
如在15*150mm试管反应的时间比在瓶子中反应时间多了4小时以上。
故统一容器的大小、形状和材料才能确定初始接菌量与达到一定吸光度所需时间线性关系。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
样单编号:共页第页样品名称检验方法GB4789.3 平板计数法
收样日期年月日检验日期年月日至月日使用仪器设备名称型号精度设备编号状态
电热恒温培养箱□HH-B11-420 ±1℃Sb005 □正常□不正常检验项目操作步骤及培养条件空白对照检验结果
大
肠
菌群
CFU/g (mL)
样
1
样品稀释倍数原液10倍100倍
VRBA平板试验36℃
±1℃培养18h±24h
典型菌落数
BGLB肉汤试验36℃
±1℃培养24h±48h
样
2
样品稀释倍数原液10倍100倍
VRBA平板试验36℃
±1℃培养18h±24h
典型菌落数
BGLB肉汤试验36℃
±1℃培养24h±48h
样
3
样品稀释倍数原液10倍100倍
VRBA平板试验36℃
±1℃培养18h±24h
典型菌落数
BGLB肉汤试验36℃
±1℃培养24h±48h
样
4
样品稀释倍数原液10倍100倍
VRBA平板试验36℃
±1℃培养18h±24h
典型菌落数
BGLB肉汤试验36℃
±1℃培养24h±48h
样
5
样品稀释倍数原液10倍100倍
VRBA平板试验36℃
±1℃培养18h±24h
典型菌落数
BGLB肉汤试验36℃
±1℃培养24h±48h
备注
校核人员:检验人员:年月日。
