第九章 醇和酚
有机化学9---醇和酚

9.1 醇和酚的分类、构造异构和命名 9.2 醇和酚的结构 9.3 醇和酚的制法 9.4 醇和酚的物理性质 9.5 醇和酚的波谱性质 9.6 醇和酚的化学性质
9.1 醇和酚的分类、构造和命名
H O
水
H
R-O-H
醇
Ar-O-H
酚
醇、酚和醚都可以看作水分子中的氢原子被烃基或芳 基取代的化合物。 将硫原子代替氧原子,即得对应的硫醇、硫酚。
CH3CH2CH2CH2OH
75% H2SO4 140 ℃
CH3CH=CHCH3
Al2O3 350-400 ℃
CH3CH2CH=CH2
◇ 醇进行分子内脱水的难易与醇的构造有关, 有顺序:叔醇 > 仲醇 >> 伯醇
9.6 醇和酚的化学性质
◇ 脱水产物符合Saytzeff规则, 主要生成双键上取代基多的烯烃.
(CH3)2CHONa CH2Cl CH2—O—CH(CH3)2
• 如用仲醇、叔醇进行反应时,以分子内脱水生成烯, 尤其是叔醇。
9.6 醇和酚的化学性质
(B)分子内脱水生成烯烃
CH2 H CH2 OH
浓 H2SO4 (98%) 170℃ 或 Al2O3 360 ℃
CH2=CH2
+
H2O
◇ 脱水剂:硫酸(易重排); 氧化铝(温度高,重复使用,较少重排) 如:
Al
CH3-C-O H 3
Al
+
1
1 2
H
2
反应活性:甲醇 > 伯醇 > 仲醇 > 叔醇
9.6 醇和酚的化学性质
(2)酸、碱性
◇ 醇与NaOH反应:
C2H5OH
+
有机化学

有机化学 第九章 醇、酚、醚
我们知道,仲醇与HBr反应是SN1机理:
有机化学
第九章 醇、酚、醚
CH3 C OH CH3
HCl
?
当羟基所在的碳原子上连有环烷基时,重排生成扩环产物。例如:
有机化学
第九章 醇、酚、醚
有机化学
第九章 醇、酚、醚
有机化学
第九章 醇、酚、醚
(二)弱碱性
氧盐
有机化学
第九章 醇、酚、醚
二、羟基的取代反应(C-O键断裂)
醇可以与多种卤化试剂作用,羟基被卤原子取代而中成卤 代烃。 (一)与氢卤酸的反应
R— OH + H— X
(1)反应机理
RX +
H2O
醇与氢卤酸反应涉及C—O键断裂。卤素(X–)取代羟基 ((OH),属于亲核取代(SN),不结构的醇采取不同的机理 (SN1或SN2)。
有机化学
第九章 醇、酚、醚
(三)频哪醇的脱水及频哪醇重排
通常将两个羟基都连在叔碳原子的歧α-二醇称频哪醇(pinaco1)。 在A12O3作用下频哪醇发生分子内脱除两分子水的反应生成共轭二 烯烃:
第三节
醇的化学性质
羟基是醇的官能团,醇的化学性质主要由羟基决 定,大部分反应都涉及O—H键断裂或C—O键断裂。
R CH2 — O — H
在化学习醇的化学性质时,要注意断键的部位,这 对了解它们的反应机理、活性及有关规律是很重要的。
有机化学
第九章 醇、酚、醚
一、酸性和碱性
(一)弱酸性 (羟基中氢的反应,O—H键断裂)
有机化学
第九章醇和酚
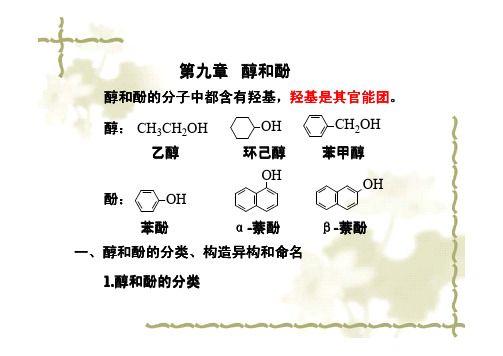
醇和酚的分子中都含有羟基,羟基是其官能团。
醇:酚:CH3CH2OH OH CH2OH 乙醇环己醇苯甲醇OHOHOH 苯酚α-萘酚β-萘酚一、醇和酚的分类、构造异构和命名1.醇和酚的分类第九章醇和酚按羟基数目不同可分为一元、二元及三元醇和酚等。
二元及二元以上的醇和酚统称多元醇和酚。
如:CH3OH CH2CH2OHOH CH2CH CH2OH OH OH甲醇(一元醇)乙二醇(二元醇)丙三醇(三元醇)OHCH3OHHOOH HO OH对甲基苯酚(一元酚)对苯二酚(二元酚)间苯三酚(三元酚)另外,醇还可按烃基的类型不同或按羟基所连碳原子的类型不同分类。
饱和醇不饱和醇脂环醇芳香醇伯醇(一级醇)仲醇(二级醇)叔醇(三级醇)2.醇和酚的构造异构(略)3.醇和酚的命名有些醇和酚存在于自然界,由于存在和来源不同,有些醇和酚有俗名。
如:CH3OH 木精C CH HCH3CH2CH2CH2OH 叶醇(可配制香精)CH CHCH2OH 肉桂醇(可配制香精)OHOCH3愈创木酚OH CH(CH3)2 CH3香芹酚OCH3OHCH2CH CH2丁香酚(可配制香精)一些简单的醇可用普通命名法命名,其原则是在“醇”字前面加上烃基的名称。
例:CH 3OH CH 3CH 2OH (CH 3)3COH 甲醇乙醇叔丁醇对于比较复杂的醇则需用系统命名法,选择含有羟基所连碳在内的最长碳链为主链,主链碳原子从离羟基较近的一端开始编号,根据主链碳原子数称为某醇。
例:CH 3CH 2CH 2CH 2OH 1-丁醇(正丁醇)2-丁醇(仲丁醇)CH 3CH 2CHCH 3OH5-甲基-3-己醇CH 3CHCH 2CHCH 2CH 3CH 3OH2-甲基-2-丙醇(叔丁醇)顺-2-乙基-3-戊烯-1-醇CH3C OHCH3CH3HO CH3 4-甲基环己醇CH2OHC CCH3CHCH2CH3H HCH2OH环己甲醇芳醇的命名,是以芳环为取代基来命名。
有机化学_高鸿宾_第四版_第9章_醇和酚
14
CH3
② 间接水合
CH3 CH3 C CH2 98%H2SO4 CH3 CH3 C CH3 OSO3H H2O CH3 CH3 C OH CH3
• 有重排产物
CH3 CH3 C CH3 H+ CH3 CH3 C CH3 CH
ONa H+ OH
SO3Na + NaOH
同上
ONa H+
OH
21
9.3.3 卤代烃或重氮盐的水解 • 相应的卤烃易得到时用此法
CH2 H2O CH2 CHCH2Cl NaOH
Na2CO3 H2O N2+ Br
NaNO2
CHCH2OH
CH2OH
CH2Cl
NH2 dil H2SO4
OH Br
H ,H2O
24
=>
(2) 二级醇的合成 • 羰基化合物是醛和甲酸酯
CH3 H3C C CH2 H H C H MgBr H3C C O H CH3 CH3 CH CH2 CH2 CH3 C O H MgBr
CH3 CH3 CH CH2 CH2
CH3 C O H H
HOH
CH3 CH2 4 CH2MgBr + CH3CH 纯醚 O
Cl2/H2O 70-80 。 C CH2 CH2
副产物多,环境污染重 Ca(OH)2 —HCl O2 Ag C 250-280。 CH2 O CH2 H2O CH2 OH 常用 CH2 OH
16
② 制丙三醇(甘油)
CH2=CHCH3 Cl2 。 500 C CH2=CHCH2Cl
CH2 Cl CH OH CH2 Cl CH2 OH CH Cl CH2 Cl
基础有机化学-第九章 醇和酚
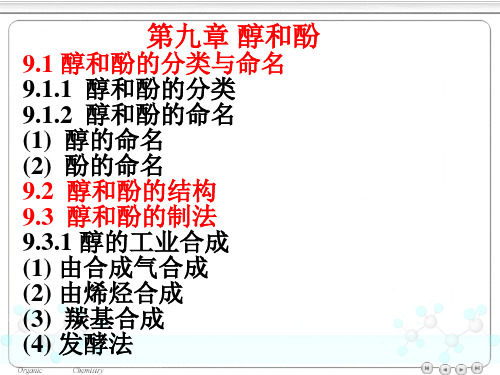
OH CH3
CHCH3
4–甲基–1–环己醇
OH 1 (4′ 甲苯基)
1 乙醇
多元醇的命名: ——写出多个羟基所在位置。
HOCH2CHCH3 OH
1,2-丙二醇
HOCH2CH2CH2OH
1,3-丙二醇
(2) 酚的命名 酚的俗名:
OH
HO
OH
COOH
OH 邻苯二酚 (儿茶酚)
OH
3,4,5-三羟基苯甲酸 (没食子酸)
9.3.1 醇的工业合成 (深红色列出的方法必须掌握)
(1) 由合成气(CO + H2 )合成
CO
+ 2 H2
CuO-ZnO-Cr2O3 2100~400 ℃
CH3OH
5~10 MPa
(2) 由烯烃合成
CH3CH
CH2
+
H2O
H3PO4 300℃,~7MPa
CH3CHCH3
OH
(3) 羰基合成
CH3CH
甲醇的结构:
0.143 nm
H
H
CO H 108.5°H
SP3
H
CC
O
HH
H
苯酚的结构:
碳原子 sp2杂化 存在p,π–共轭
0.142 nm
SP2 O 109° H
图 9.1 甲醇和苯酚的结构示意图
酚羟基氧上的孤电子与苯环存在P-π共 轭,酚羟基上的氢易离解,所以酚的酸性比醇 强。
9.3 醇和酚的制法
CH3(CH2)3CHCH3
OH
(9) 醛、酮、羧酸和羧酸衍生物的还原制备
(十一、十二、十三章里介绍)
CH3O
CHO
H2, Pt CH3OH
《醇和酚》醇酚的结构与活性关系

《醇和酚》醇酚的结构与活性关系在有机化学的世界里,醇和酚是两类非常重要的有机化合物。
它们在结构上有着相似之处,但也存在明显的差异,而这些结构上的特点直接影响着它们的化学活性。
醇,简单来说,是烃分子中饱和碳原子上的氢原子被羟基(OH)取代后的产物。
根据羟基所连接的碳原子的类型,醇可以分为伯醇、仲醇和叔醇。
伯醇中羟基连接在一级碳原子上,仲醇中羟基连接在二级碳原子上,叔醇中羟基连接在三级碳原子上。
酚则是羟基直接连接在芳香环上的化合物。
常见的酚有苯酚等。
醇和酚的结构差异首先体现在羟基所连接的基团上。
醇中的羟基连接在脂肪链上,而酚中的羟基直接与芳香环相连。
这一差异导致了它们在化学活性上的诸多不同。
从反应活性来看,酚中的羟基由于受到芳香环的影响,其酸性要比醇中的羟基强得多。
这是因为芳香环能够通过共轭效应分散氧原子上的负电荷,使得酚羟基更容易解离出氢离子。
例如,苯酚能与氢氧化钠溶液反应生成苯酚钠和水,而醇通常不能与氢氧化钠发生类似的反应。
在亲核取代反应中,醇的反应活性相对较低。
这是因为醇羟基中的氧原子上的孤对电子与碳氧键存在pπ 共轭,使得碳氧键具有一定的双键性质,键能增大,不易断裂。
相比之下,酚羟基由于与芳香环形成更大的共轭体系,其亲核取代反应活性也不高,但在某些特定条件下,如强亲核试剂存在时,仍能发生反应。
在氧化反应方面,醇的化学活性较为复杂。
伯醇可以被氧化为醛,进一步氧化还能得到羧酸;仲醇氧化后得到酮;而叔醇由于没有α氢原子,一般不易被氧化。
酚则比较容易被氧化,例如苯酚在空气中就能被氧化为粉红色的物质。
醇和酚在酯化反应中的表现也有所不同。
醇与羧酸反应可以生成酯,反应通常需要在酸催化下进行。
而酚与羧酸直接反应生成酯相对较困难,常常需要使用更强的反应条件。
在与金属钠的反应中,醇和酚都能放出氢气,这表明它们的羟基都具有一定的活性。
但由于酚的酸性较强,相同条件下,酚与金属钠反应的速率可能会比醇更快。
此外,醇和酚在与卤化氢的反应中也有差异。
有机化学上第九章 醇和酚

OH OH OCH3 邻甲氧基苯酚 o-甲氧基苯酚
OH COOH 邻羟基苯甲酸
萘酚 萘酚
OH 对羟基苯甲醛
(二) 醇和酚的结构
醇分子中氧原子采取不等性sp3杂化,具有四面体结构:
2 O£2s 2p £ 4
Ó Ô º s p sp3
H
O R
由于氧的电负性大于碳,醇分子中的C-O键是极性 键,ROH是极性分子。
H2O/H+
OH R'-C R R" ££ OH R'-CH-R R-CH2-OH
££
´ £££££££ ´ £££££££
R-CH2-CH2-OH
例:
O CH3(CH2)3MgCl + CH3-C-CH3
(1) 干醚 (2) H2O/H+
OH CH3CH2CH2CH2-C-CH3 CH3
(4) 醛、酮、羧酸和羧酸酯的还 原
£ °££
NaBH4/H+
CH3CH£CHCH2OH £
£ °££
¥ Ý ³º õ È Ò ± Na+C2H5OHº Ô £ µ ® Ò ´ º » Ç £ ¸ « ª © º ³ß Ó â ¹ O Na+C2H5OH R£C£OR' £ £ R£CH2OH + R'OH £ £ ¨1 ££ £ O H2£Ni R£C£OR' £ £ R£CH2OH + R'OH £ ££ £ ¨1 ££ £
HO OH HO OH HO OH
苯酚(一元酚)
对苯二酚(二元酚) 均苯三酚(三元酚)
②醇还可按与-OH相连的碳原子的类型分:伯、仲、叔醇
CH3CH2CH2CH2OH ¬ » ® ´ OH CH3CH2CHCH3 Ù » Ö ´ CH3 CH3£C£OH £ CH3 å » Ê ´
《醇和酚》醇的取代反应

《醇和酚》醇的取代反应《醇和酚——醇的取代反应》在有机化学的广袤世界里,醇是一类极其重要的化合物。
而醇的取代反应,更是其化学性质中的关键一环。
要理解醇的取代反应,首先得清楚什么是醇。
醇,简单来说,就是分子中含有羟基(OH)且羟基与饱和碳原子相连的有机化合物。
常见的醇有乙醇(酒精)、甲醇等。
醇的取代反应多种多样,其中比较常见的有与氢卤酸的反应、与羧酸的酯化反应以及分子间脱水反应等。
先来说说醇与氢卤酸的反应。
当醇与氢卤酸(如氢氯酸、氢溴酸等)混合时,在一定条件下,羟基会被卤原子取代,生成卤代烃和水。
这个反应的机理有点复杂,但可以简单理解为羟基中的氧原子先与氢卤酸中的氢离子结合,形成不稳定的中间体,然后卤离子进攻碳原子,取代羟基,最终形成卤代烃。
比如乙醇与氢溴酸反应,就能生成溴乙烷和水。
再讲讲醇与羧酸的酯化反应。
羧酸大家应该不陌生,像乙酸(醋酸)就是常见的羧酸。
当醇与羧酸相遇时,在催化剂和加热的条件下,醇中的羟基和羧酸中的羧基会发生反应,脱去一分子水,形成酯。
这是一个很重要的反应,在食品工业、香料制造等领域都有广泛的应用。
比如乙醇和乙酸反应,可以生成乙酸乙酯,这种酯具有特殊的果香气味,常用于调制香精和溶剂。
还有醇的分子间脱水反应。
当两个醇分子在一定条件下相遇时,一个醇分子的羟基和另一个醇分子的氢原子结合脱去一分子水,形成醚。
这个反应在有机合成中也有一定的用处。
醇的取代反应在实际应用中具有重要意义。
比如在药物合成中,通过控制醇的取代反应,可以得到具有特定药效的化合物。
在材料科学领域,利用醇的取代反应可以制备各种功能性的高分子材料。
为了让醇的取代反应更有效地进行,反应条件的控制至关重要。
温度、催化剂的选择、反应物的浓度等因素都会对反应的速率和产物的产率产生影响。
温度的高低会影响反应的速率和选择性。
一般来说,温度升高,反应速率会加快,但有时也可能导致副反应的增加。
催化剂的选择也很关键,不同的催化剂可能会引导反应朝着不同的方向进行,从而得到不同的产物。
有机化学-醇和酚
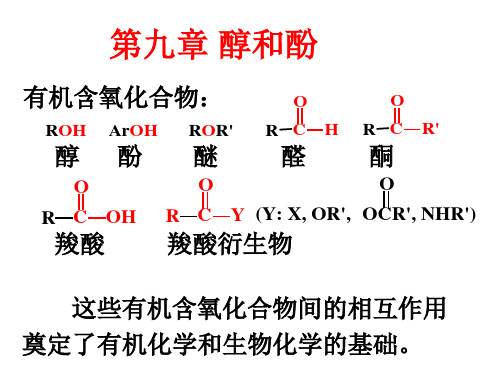
RCl + POCl3 + HCl
ROH + SOCl2
RCl + SO2 + HCl
9.6.3 与无机酸的反应
• 与硫酸、硝酸、磷酸等也可反应,生成无机酸酯:
CH3OH + H2SO4
O CH3OSOH CH3OH
O
硫酸氢甲酯
(酸性酯)
O
CH3OSOCH3 O
硫酸二甲酯
(中性酯)
• 硫酸与乙醇作用:硫酸氢乙酯和硫酸二乙酯。 (烷基化剂:硫酸二甲(乙)酯,有剧毒)
CH3 H
HCl
CH3
CH3-C— C-CH3
CH3-C-CH2-CH3
H
OH
Cl
重排反应历程:
Why?
CH3 CH3C-CHCH3 HCl
H OH
CH3
CH3
CH3C-CHCH3 -H2O CH3C-C+HCH3 重排
H +OH2
H Cl-
CH3
CH3C-CHCH3
H Cl
CH3 CH3C-CH2CH3
CH3 CH3 CHCH2OH
甲醇(木精)
烯丙醇
异丁醇
(Methyl alcohol) (Allyl alcohol) (Isopropyl alcohol)
CH2OH
Байду номын сангаас
OH
苯甲醇(苄醇)
(Benzyl alcohol)
环己醇
(b) 系统命名法 • 选择含有羟基的最长碳链作为主链 •从靠近羟基的一端编号
醇钠
RCH2ONa + 1/2H2
(CH3)3COK + 1/2H2
有机化学第9章醇-酚-醚

C H 3 C H 2 C H 2 C H 2 O HC u - C r O 2 C H 3 C H 2 C H 2 C H O + H 2 O 3 5 0 ℃
OH
R'
❖ 羟基连在同一碳原子上的化合物
RCH2C O R'
OH H
H
R C O -H2O R C O
醛
H
OH H R C O -H2O
R'
RC O 酮 R'
OH H R C O -H2O
OH
R C O 羧酸 OH
9.1.2 醇的结构
醇的氧原子为sp3杂化。其中两个sp3杂化轨道分别含有一个电子,与碳 原子的sp3杂化轨道和氢原子的1s轨道重叠。另外二个sp3杂化轨道分别 含有一对未共用电子对,交叉构象为优势构象。
CH3CH2CH2OH 丙醇
(CH3)2CHOH 异丙醇
(CH3)3COH 叔丁醇
OH
OH
C
环已醇
三苯甲醇
系统命名法
即选择含有羟基的最长碳链作为主链,把支链看作取代基,从离 羟基最近的一端开始编号,按照主链所含的碳原子数目称为“某 醇”,羟基在1位的醇,可省去羟基的位次。
例如:
2-丁烯醇(巴豆醇) 3-苯基-2-丙烯醇(肉桂醇) 3 ,4-二甲基-2-戊醇
R O H + S O C l 2 R C l + S O 2 + H C l
反应实际上是先形成氯代亚硫酸酯,再与Cl-进行亲核取 代反应
RCH2OH+SOCl2 -HCl
O CH2O S Cl
《有机化学》第九章醇、酚、醚的结构与性质

第九章醇、酚、醚的结构与性质前言(1) 醇的结构与性质醇分子可以看成是水分子中氢原子被烃基取代的产物或烃分子中氢原子被羟基(﹣OH)取代的产物。
和水分子一样,醇分子中氧原子也是sp3杂化的,sp3杂化的氧原子分别与烃基和氢形成2个σ键,还有两对孤电子对,在两个sp3杂化轨道上,因此醇分子不是直线型,而是角型的,所以醇分子是极性分子。
由于醇中含有羟基,分子间可以形成氢键,因此低级醇的熔点和沸点比分子量相近的碳氢化合物的熔点和沸点高得多。
随着分子量的增加,羟基在醇分子中比例减小,羟基对醇的影响减小,从而使高级醇的物理性质与烷烃近似。
低分子量的醇可以与水形成氢键而互溶。
羟基是醇的官能团,醇的化学性质也是由羟基引起的,主要是羟基的活性;羟基被取代的反应;羟基的氧化反应以及β﹣H的活性等。
(2) 酚的结构与性质酚羟基与芳羟基直接相连,羟基氧原子是sp2杂化的,还有一对孤电子在未杂化的p轨道上,p电子云正好能与苯环的大π键电子云发生侧面重叠,形成p-π共轭效应,其结果p电子云向苯环转移,而羟基氧氢之间的电子云向氧原子转移,使氢容易以离子形式离去,具有部分双键的性质,难以被取代,当氧原子电子云向苯环转移,使苯环电子云密度升高,因此苯环上发生亲电取代反应速度加快。
(3) 醚的结构与性质醚可以看作是水的两个氢原子被烃基取代所得的化合物。
氧原子也是 sp 3 杂化的,因此醚不是直线型结构,而是角形结构,醚是极性分子。
与醇相比,醚分子间不能形成氢键,沸点比同组分醇的沸点低得多,如乙醚沸点是34.6℃ ,而丁醇的沸点为117.8℃ 。
但是醚比分子量相近的烷烃分子的沸点高。
醚分子中的氧可与水形成氢键,所以醚在水中有一定溶解度,乙醚在水中溶解度为 8g/100ml ,对于环状醚,由于成环缘故,氧原子外突,形成氢键的能力较强,因此四氢呋喃, 1,4 ﹣二氧六环与水能混溶。
醚是一类相当不活泼的化合物(环醚除外),醚链对于碱,氧化物,还原剂都是十分稳定。
第9章 醇、酚、醚及消除反应

没有重排产物生成
3. 脱水反应
分子内脱水生成烯烃,β-氢的醇分子间脱水生成醚
17
低温脱水生成醚,高温脱水生成烯 醇结构对脱水有明显影响,三种类型的醇发生消除反应 的活性顺序为: 叔醇>仲醇>伯醇。 脱水产物符合查依采夫规则.
CH3 H3C C C CH3 (ii)
OH CH3
OH CH3 (iii)
(III)的稳定性比(I)大
22
9.2 消除反应的机理
B
C X H C
双分子消除反应(E2) 单分子消除反应(E1)
9.2.1 双分子消除反应(E2)
(1)碱进攻β-氢
(2)逐渐与之结合,碳氢键逐渐 断裂;与此同时,卤素X带着一 对电子逐渐离开中心碳原子。电 子云也重新分配,经过一个过渡 态
OH R C H
叔醇的C—O伸缩振动在1200~1150 cm-1
R
OH R C R R
8
O-H
2-戊醇的红外光谱图
R-OH CH3-CH2-CH2-CH-CH3
OH
核磁共振谱 H
R
羟基所连碳 上的氢的化学 位移出现在较 低场,δ=3.4~ 4.0ppm。
C H
O
H
1~5.5ppm范围内。 有时也可能隐藏在其它 质子吸收峰内,加入重水后 羟基质子可被重氢交换掉, 吸收峰消失。
按SN1机理进行反应时,有碳正离子中间 体生成,有时可能发生重排反应
C
CH3 CH3 CH3 C H Cl CH3 CH3
+
C
H
C
CH3 CH3 CH CH CH3 OH2 重排 CH3 CH3 C 3。 C Cl CH3 CH2 CH3
大学有机化学重点知识总结第九章 醇和酚1

2. 不同有机物酸性强弱
化合物 pKa
HC CH (CH3)3COH CH3CH2OH HOH CH3OH CF3CH2OH
RONa + H2O
酸 性 增 强
25 19 16 15.74 15.54 12.43
ROH + NaOH
3. 可用于销毁残余的金属钠
Na与醇的反应比与水的反应缓慢的多,反应 所生成的热量不足以使氢气自燃。
CH3
H OH2、 与卤化磷的反应
1. 醇与PX3、PX5 反应生成 RX:
PCl3 :反应比较复杂; PCl5 : 产率低
可用I2+P代替PI3 2. 反应特点: • 用于伯醇、仲醇 • 无重排产物
七、 与亚硫酰氯的反应
O ROH + Cl-S-Cl 二氯亚砜 b.p. 780C RCl + SO2 + HCl
95℃
CH2OH (74%)
OH Na2CO3 H 2O
Br + NBS 引发剂 CCl4
四、 由 Grignard 试剂制备
1. 格氏试剂与环氧乙烷作用
CH3
-
MgBr + CH2
+
CH3 CH2
① 纯醚 ② H3O
+
CH2CH2OH
O
-
环氧乙烷
邻甲基苯乙醇(66%)
制备增加2个碳的伯醇的好方法
(丙三醇)
2. 酚:分子中所含羟基的数目
OH OH HO OH OH OH
一元酚 苯酚
二元酚 对苯二酚
三元酚 间苯三酚
二、醇和酚的构造异构
1.醇:碳架异构和羟基位次异构
C4H9OH
CH3CH2CH2CH2OH CH3CHCH2OH CH3
Chapter 09 醇和酚

C H3 C H3 C C H3 OH
+
ClCH3 CH3C-CH2CH3 Cl
『思考题』 当HBr水溶液和3-丁烯-2-醇反应时,不仅生成3-溴-1-丁烯, 还生成1-溴-2-丁烯,试解释之。
OH HBr Br + Br
2)与 PX3 、SOCl2 反应
3 (CH3)2CHCH2OH RCH2OH + Br Br- + RCH2 PBr3 PBr2 SN2 3(CH3)2CHCH2Br + H3PO3 RCH2OPBr2 + HBr RCH2Br + -OPBr2
ROH + HCl RCl + H2O
3o 醇 、烯丙醇、苄醇 室温下反应液立即混浊、分层; 2o醇 1o醇 2 ~ 5 min. 反应液混浊、分层; 加热,反应液混浊、分层;
反应按SN1历程,有碳正离子重排。
CH3 CH3C-CHCH3 HCl H OH CH3 + CH3C-CHCH3 -H 2O CH3C-CHCH3 重排 H +OH2 H ClCH3 CH3C-CHCH3 H Cl CH3 CH3 CH3C-CH2CH3
【练习】
ClH2C H H CH2CHCH3 OH HO CH3 H H3C C CH2 OHOH
(E)-6-氯-4-己烯-2-醇
3-甲基-2-环戊烯-1-醇
1,2-丙二醇
酚的命名首要的是根据“优先次序”确定主官能团,只 有在芳环上羟基是最优先官能团的前提下才能命名为“酚” 。
《醇和酚》酚的醚化反应

《醇和酚》酚的醚化反应在有机化学的广阔领域中,酚的醚化反应是一个重要且有趣的研究方向。
这一反应不仅在理论研究中具有重要意义,也在实际的工业生产和实验室合成中有着广泛的应用。
首先,我们来了解一下什么是酚。
酚是一类含有羟基(OH)直接连接在芳香环上的有机化合物。
常见的酚有苯酚、甲酚等。
酚具有一定的酸性,其酸性比醇要强,但比羧酸弱。
那么,什么是醚化反应呢?简单来说,醚化反应就是将醇或酚中的羟基通过化学反应转化为醚键(O)的过程。
对于酚来说,醚化反应可以通过多种方法实现。
一种常见的酚醚化方法是使用卤代烃作为醚化试剂。
在适当的条件下,酚与卤代烃在碱性环境中发生反应。
例如,苯酚与溴乙烷在氢氧化钠存在的条件下,可以生成苯乙醚。
在这个反应中,氢氧化钠起到了吸收反应生成的卤化氢的作用,促进反应向生成醚的方向进行。
另一种常用的方法是使用硫酸二甲酯或硫酸二乙酯等作为醚化试剂。
这些试剂具有较强的甲基化或乙基化能力。
以硫酸二甲酯为例,它可以与酚在碱性条件下反应生成相应的甲基醚。
酚的醚化反应在工业生产中有着重要的应用。
例如,在香料和药物的合成中,通过醚化反应可以对酚进行修饰,改变其物理化学性质,从而获得具有特定香气或药效的化合物。
在实验室合成中,酚的醚化反应也是构建复杂有机分子的重要手段之一。
通过选择合适的醚化试剂和反应条件,可以精确地控制反应的进程和产物的结构。
然而,酚的醚化反应并非一帆风顺,也存在着一些挑战和需要注意的问题。
反应条件的控制至关重要。
例如,反应温度、反应时间、试剂的用量以及反应体系的酸碱度等因素都会对反应的结果产生影响。
如果条件控制不当,可能会导致副反应的发生,降低反应的产率和选择性。
此外,酚的醚化反应的选择性也是一个需要关注的问题。
在一些情况下,可能会同时发生多个反应位点的醚化,导致产物的复杂性增加。
为了提高选择性,常常需要使用特殊的催化剂或者对反应底物进行预处理。
在实际操作中,还需要考虑试剂的毒性和安全性。
第9章 醇、酚、醚

[总结 有机物的系统命名法的总原则 总结] 有机物的系统命名法的总原则: 总结
1.按官能团的优先次序排列, 选择最优先的官能团作为母 体官能团, 其它的官能团则作为取代基. 2.选择含有母体官能团的最长碳链作为主链, 主链的编号 首先应使母体官能团的编号最小, 其次是使取代基的编 号之和最小(即最低系列原则). [附] 常见官能团的优先次序: –COOH、–SO3H > –COOR、–CONH2 > –CHO、–CO– > –OH、–SH > –NH2 > C≡C、C=C > –Ph > –R > –OR、–X、–NO2 (见 刘庄编《普通有机化学》P167)
(HO)3P=O : 甘油三硝酸酯 (硝酸甘油)
O RO–P–OR + 3H2O OR
(RO)3P=O
有机酸酯: (见 P256) ROH + R′ COOH
R′ OH + H–X
• 反应活性(了解): HI > HBr > HCl •
H+ OH–
R–X + H2O
2. 醇的分类
• 根据羟基所连接的饱和碳原子的类型, 可分为 伯醇(1°)、 • •
仲醇(2°) 和 叔醇(3°). 根据所含羟基的数目, 可分为 一元醇 和 多元醇. 根据羟基所连的烃基结构, 可分为 饱和醇、不饱和醇 和 芳香醇.
3. 醇的命名法
① 普通命名法: 根据羟基所连的烃基 命名为 某(基)醇. 只适用于碳数不多、结构简单的醇. (例子见书) ② 系统命名法: 命名原则(见书): 选主链、主链的编号 例: CH3CHCH2CHCH3 CH3 OH 4–甲基–2–戊醇 • 不饱和醇的命名: 根据其不饱和键称为 某烯醇或某炔醇. 例: CH3CH=CHCH2OH 2–丁烯醇 (羟基位置为1时可省略) • 多元醇的命名: CH3CHCH2CHCH3 OH OH 2,4–戊二醇 • 脂环醇的命名: 根据脂环烃基 命名为 环某醇. 如 环己醇 • 芳香醇的命名: 把苯环看作取代基. 如 2–苯基乙醇 • 常见俗名: 酒精(乙醇)、甘油(丙三醇)、肌醇(环己六醇)
第九章 醇 酚 醚

第九章醇酚醚醇,酚,醚都是烃的含氧衍生物。
醇和酚是烃的羟基衍生物,而醚通常是有醇或酚制得的。
酚与醇在结构上的区别就在于它所含的羟基直接与芳环相联。
醇分子间能形成氢键,醇也能跟水形成氢键。
醇通常以下法制备:1.烯烃加水。
2.烯烃经羟汞化—脱汞反应。
3.烯烃经硼氢化—氧化反应。
4.Grignard反应。
一级醇:二级醇:三级醇:5.羰基化合物的还原。
6.卤代烷的水解。
醚可以通过一级卤代烷跟醇钠或酚钠的反应来制备(Williamson合成法)。
醇跟氢卤酸发生取代反应(1°ROH,S N2; 2°ROH和3°ROH,S N1)。
在硫酸或其他强酸存在下,醇能发生消除反应,这时醇的反应活性顺序是3°>2° >1°。
当醚跟HBr 或HI 共热时可发生取代反应。
醇可以跟有机酸或无机酸反应生成酯。
一级醇可以被氧化成羧酸(或醛),而二级醇被氧化成酮,三级醇在碱性条件下是抗氧化的。
环氧化物比其他醚更活泼,在酸性和碱性溶液中可以跟亲核试剂发生开环反应。
醇的酸性比水还弱,与醇显著不同,酚是具有相当酸性的化合物,它可以溶于氢氧化钠水溶液而变成它的盐。
酚的最突出的化学性质是它的环对亲电取代反应有极高的反应活性:1.卤代。
白色,可用于酚的鉴别2.硝化。
3.磺化。
4.酰基化反应,Fries重排:5.跟甲醛反应。
习题一、按系统命名法命名下列化合物:5. 醇、酚、醚(1) (2)3-乙基-2-甲氧基己烷 5-甲基-4-己烯-3-醇(3)(4)3-甲基-2-环己烯-1-醇 2-甲基-4-甲氧基苯酚(5) (6)4-烯丙基-2-甲氧基苯酚 6-甲基-3-乙基-5-溴-1-庚醇1. 2.3. 4.5. 6. 1、3-E-3-甲基-3-戊烯-2-醇; 2、R-3-甲基-2-丁醇; 3、(2S ,3S )-3-甲氧基-2-戊醇; 4、2-异丙氧基丁烷; 5、4-甲氧基苯酚; 6、5-溴-1-苯酚OH C CH 3HO 3)2OCH 3CH 3HO H H C 2H 5OOH OCH 3OH Br CH(CH CHCH-OCHCH CH CH 322233)CH CH CH 3233C=CHCHCH OH CH 3OHCH 33OHOCH 223OH OCH CH=CH CH CH CH CH 322233OHCHCHCH CHCH 2CH二、完成下列反应,写出反应的主要产物:1.2.3. 4.5. 6.7. 8.9.10.11.12.13. 14.1、CH 2CH 2CH CH 3=;2、CH 3CHCH 3=C ()2;3、CH 3CH 2CH 3O C ()3; 4、OCH 3CH 2CH 2CH 2OH + NaBr H 2SO 4(CH 3)3CCH 2OH CH 3CH 2Br + NaOC(CH 3)3OH +K 2CrO 7dil.H 2SO 4CH 3CH 2CH 2MgBr +CH 2-CH 2OEt 2OH 2O 3)2OH H 2SO 4CH 2CH 2OHOH SOCl 2[ ]CH 2CH 3O + HI CH=CHCHCH 3OH + CH 3CCH 3OAl[OCH(CH 3)2]3CH 3CH=CHCH 2OH +HBr OH +CH 3COCH 3H 2SO 4CH 3CH=CHCH 2OH + CrO 3(C 5H 5N)2.CH 2Cl 2CH 3( )CH 2Cl ( )( )CH 2CH=CH 2( )2CH5、CH 2CH 2CH 2OH CH 3; 633; 7CH 2CH 2CH 3OHNH 3;82CH 2Cl9、CH2CH 3I ; 10CH 3=OC =CH 、CH 3CH 3OH;11、CH 3Br CH 2CH =CH ; 12、313、CH 3CH =CH CHO ;14、Cl 2CCH、Lindlar 、、H 3+O 2CH 2CH 3OH三、选择正确答案,并说明理由:1. 具有下列结构的醇类化合物,可以稳定存在的是( )。
有机化学第9章 醇、酚和醚

OCH3 + H2 O
硫酸和乙醇作用,也可以得到硫酸氢乙酯和硫酸二乙酯。硫酸二 甲酯和硫酸二乙酯是烷基化试剂,可以用在有机物分子中导入甲基和乙 基的试剂,但是它们的蒸气有剧毒,使用时要特别注意。
( 2) 多元醇与一元酸的反应
CH2OH CHOH + 3 HONO2 ( HNO3 ) CH OH
2
CH2ONO2 CHONO2 CH2ONO2
H H H
烃基的供电子作用使氧 氢键极性下降。 氢原子既不供电子,也不吸电 子,氧氢键极性不变。 孤对电子占据的 P 轨道与苯环间存 在 P-π共轭体系,氧上电子云向苯 环转移,使氧氢键极性增强。
取代酚的酸性:(pKa值)
OH OH OH
吸电子基 酸性增加 斥电子基 酸性下降
OH
OH
OC H 3
C H3
分子间脱水 (伯醇 亲核取代 SN2机理):
总结:醇的分子内脱水和分子间脱水是两种互相竞争的反应。 高温有利于发生分子内脱水生成烯烃,较低温度则有利于分子间脱 水生成醚。 伯醇能进行分子内脱水和分子间脱水;仲醇和叔醇在酸催化作 用下主要是进行分子内脱水,产物是烯烃 。
5) 多元醇的特性 (1) 与氢氧化铜的反应(邻二醇结构)
(CH3)2CHCH2CH2OH + HONO
(CH3)2CHCH2CH2ONO + H2O 亚硝酸异戊酯
亚硝酸异戊酯用作血管舒张药,可缓解心绞痛,但副作用大。
O CH3OH + HOSO3H ( H2SO4 )
O CH3OH + CH3O S O OH CH3O
CH3O
S O
OH
O S O
+ H2 O
OH
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
问题1:醇与水,哪个酸性较强?
醇钠遇水即水解: RO-Na+ + HOH
较强碱 (1) R斥电子 (2) 酸性:HOH>ROH 较强酸
Na+OH- + ROH
较弱碱 较弱酸
可见,水的酸 性大于醇!
工业上生产醇钠,不使用昂贵的金属钠,而是利用上述平 衡反应:
Na+OH- + ROH
较弱碱 较弱酸
例1:
n-C 8H17OH
PCC CH2Cl2
n-C 7H15CHO
例2:
CH2OH
MnO 2 CH 2Cl 2
CHO
脱氢
RCH2OH OH R-CH-R'
Cu or Cu2O 325 C££
£
RCHO + H2 O R-C-R'+ H2
(2) 邻二醇的氧化
(A) 高碘酸氧化
高碘酸可将邻二醇氧化为醛或酮:
Fries重排:
酚酯在三氯化铝或二氯化锌等Lewis酸存在下,生成邻或对羟基
苯乙酮
OH
CH 3COCl or (CH 3CO) 2O
O-COCH 3
AlCl 3
OH + COCH 3
OH COCH 3
(低温为主) (高温为主)
Fries重排可用来制备酚酮。
P339 习题9.15-9.17
9.6.4 氧化反应
Á Ó Ý ² Á Ó 1Ý ²
Ý ² Á Ó 2Ý ² Á Ó
OH
OH
OH Cl
OH
OH COOH
NH2 对氨基苯酚
CH3 CHO 邻羟基苯甲酸 4-甲基-2-氯苯酚 水杨酸 对硝基苯酚 对羟基苯甲醛 NO2
9.2 醇和酚的结构
醇的结构图
结构的相似性 C、O为sp3杂化 O的电负性比C大
分馏去水,55% 氧原子上电子云密度降低!
难!
O
10%NaOH
酚酯一般采用酰氯或酸酐与酚或酚钠作用制备 :
O OH + Cl C
< 45 C,1h,85%
。
O C
+ HCl
COOH OH + (CH3CO)2O
浓2SO4 60 C,98%
COOH O O C CH3 + CH3COOH
反应顺利!
。
邻乙酰氧基苯甲酸 乙酰水杨酸 阿斯匹林
愉快气味;C12以上的醇为无色无味的蜡状固体。 大多数酚为无色固体。但受空气氧化成有色杂质,所以,商品
苯酚常带有颜色。
② 沸点: 与相对分子质量相近的其他有机物相比,醇和酚的沸点较高。
CH3OH (M=32) CH3CH3 (M=30)
C6H5OH (M=94) C6H5CH3 (M=92)
£ b.p 65 C £ b.p -88.6 C
≈10
15.7
≈16~18
问题3:为什么酚的酸性大于醇?
酚解离生成的芳氧基负离子,负电荷分散程度大,真实结构稳定:
OH OOO
-
O
-
O + H+
结构相似,能量低, 对真实结构贡献最大
负电荷分散到苯环上, 使真实结构更稳定
OH
O- + H+
离域,稳定性好! 有利于平衡向右移动!
而醇解离生成为烷氧基负离子,负电荷是定域的,不能很好地分散:
③ 按分子中醇羟基的个数:一元醇、二元醇、多元醇… …
CH2OH CH3OH 甲醇(一元醇) HOCH2CH2OH 乙二醇(二元醇) CHOH CH2OH 丙三醇(三元醇) HOCH2 CH2OH C CH2OH CH2OH 季戊四醇(四元醇)
(2) 酚的分类
根据分子中酚羟基的多少,分为一元酚、二元酚、多元酚等。
第九章
醇和酚
醇和酚的分子中都含有羟基。
醇羟基连在饱和碳上: CH3CH2OH 乙醇 酚羟基连在芳环上: OH 苯酚 萘酚 萘酚 OH 环己醇 OH OH CH2OH 苯甲醇(苄醇)
9.1 醇和酚的分类、同分异构和命名 9.1.1 醇和酚的分类 (1) 醇的分类
① 按与-OH相连的碳原子的类型分:伯、仲、叔醇。
酚的结构
由于羟基连在不同杂化态的碳原子上,醇和酚的极性不同, 理化性质不同!
整个分子的偶极矩 只有-I H H H
-I <<+C
=5.7 x 10-30C m O
=5.34 x 10-30C m O
C
H 酸性小于水
H 酸性大于水
9.4
醇和酚的物理性质
① 物态:
C4以下的醇为有酒味的流动性液体,C5~C11为油状液体,有不
b. 随C数↑,R在ROH中比例↑,而R一般是疏水的。
P330 习题9.5-9.7
9.5 醇和酚的波谱性质
(1) 醇和酚的IR谱图特征:
95 90 85 80 75 70 65 60
O
H
%T
55 50 45 40 35 30 25 20 15 10 4000 3000 2000 W a v en um b ers (c m -1) 1000
PCC
通用 伯醇氧化为醛 烯丙醇氧化成醛
2©醇氧化得酮:
OH R£CH£R' £ £
£ 2 ROH
[O]
O R-C-R'
3©醇不易氧化:
R' R-C-OH R"
£ 3 ROH
[O]
£ª£££££££££ £ ò ö é
[O] = KMnO4£K2Cr2O7+H2SO4£CrO3+HOAc
为使伯醇和仲醇氧化成羰基化合物,可采用一些弱的氧化 剂或特殊的氧化剂。
(1) 一元醇的氧化与脱氢
1©醇氧化得醛或酸:
££ b.p 78.5 C
£
[O]
££ b.p 21 C
£
[O]
££ b.p 118 C á
£
RCH2OH
£ 1 ROH
RCHO
RCOOH
á ££«££ £
£££££ « ©ª ££££
RCHO
[O] = KMnO4、K2Cr2O7+H2SO4、CrO3+C5H5N/HCl、新生MnO2
系统命名法:以醇为母体。选择含有-OH的最长碳链为 主 链,从靠近-OH的一端开始编号,把支链看成取代基。 例:
1 2 3 4 5 6
CH3CH-CH-CH2CH2CH3 OH CH CH CH
2 2 3
4 3
2
1
CH3CH2CH2CHCH2CH2CH2OH CH=CH2
5 6
3-丙基-2-己醇
4-丙-5-己烯-1-醇
OH OH R-CH-CH 2
O
HIO 4
R-C-H CH 2O + HIO 3 + H 2O
醛 AgNO 3
AgIO 3
白
OH OH R-CH-C-R" R'
O
HIO 4 醛
O
3
R-C-H + R'-C-R" + HIO
酚有芳环上的位置异构和侧链上的碳架异构
OH CH3 CH3 间甲苯酚 邻甲苯酚 CH3 对甲苯酚 CH2CH2CH3 4-丙基苯酚 CH(CH3)2 4-异丙基苯酚 OH OH OH OH OH CH3 CH2CH3 2-甲基-4-乙基苯酚
9.1.3 醇和酚的命名
(1) 醇的命名
有习惯命名法、衍生物命名法、系统命名法。
(CH3)2SO4
¨ö ££££££ CH3
NaOH
CH3
C12H25OH + H2SO4
£££
C12H25OSO2OH
ò á ££££££ á ò á £££££££
C12H25OSO3-Na+
£££££££ é õ ò á ¨ £££££££££ é
(3) 磷酸酯的生成
吡啶
3CH 3CH2CH2CH2OH + POCl3
P331图9-2,9-4
(2) 醇和酚的NMR谱
P331图9-3,9-5
δROH≈3.0-6.0, δArOH=4~9 醇羟基和酚羟基质子的吸收峰移动范围都较大,且影响 因素多,特征性差。
对乙基苯酚的核磁共振谱图
P332习题9-8,9-9
9.6 醇和酚的化学性质—醇和酚的共性
9.6.1 弱酸性
硝化甘油 民用炸药 心血管扩张药 、
CH2OH HOCH2-C- CH2OH + 4HONO2 CH2OH
££££ ë
CH2ONO2 O2NOCH2-C- CH2ONO2 + 4H2O CH2ONO2
£££££££££££££ á ë
(2) 硫酸酯的生成
CH3O H + HO SO2OH
CH3OSO2OH + H2O
ห้องสมุดไป่ตู้(选择含-OH和双键的长碳链为主链)
(2) 酚的命名
按照官能团优先次序规则,选择母体。
££«£ £ OH OH OH OH OH OH OCH3 Ú ³õ ù ¼ Ó Á » Ñ º ±² o-» Ñ º ±² ³õ ù ¼ Ó
¼ Ó ±²
CH3 NO2 ä ³±Ó ¶ õ ù ¼ Ó » » ¼ ² Ô Ï º ±² m-» ±² p-Ï º ±² ³¼ Ó õ ù ¼ Ó
离越不利;
② R体积越大,越不利于RO-的溶剂化,不利于RO—H的解离。
P335 习题9.10-9.14
9.6.2 醚的生成
醇和酚形成金属盐后,与卤代烃、硫酸二甲酯作用,生成相应的醚。
