人教版高中化学选修五 3.1.1乙醇的性质 (共19张PPT)
合集下载
人教版高中化学选修五课件乙醇

为何使液体温度迅速升到 170℃,不能过高或高低?
温度计的 位置? 有何杂质气体?如 何除去?
放入几片碎瓷 片作用是什么?
用排水集 气法收集
混合液颜色如何 变化?为什么?
1、放入几片碎瓷片作用是什么? 防止暴沸 2、浓硫酸的作用是什么? 催化剂和脱水剂
3、酒精与浓硫酸体积比为何要为1∶3?
因为浓硫酸是催化剂和脱水剂,为了保证有足够 的脱水性,硫酸要用98%的浓硫酸,酒精要用无水 酒精,酒精与浓硫酸体积比以1∶3为宜。 4、温度计的位置? 反应液的液面下
△ C2H5OH+HBrC2H5Br+H2O
(3)醇分子间脱水
CH3CH2OH+HOCH2CH3
浓H2SO4
140℃
CH3CH2OCH2CH3+H2O
焊接银器、铜器时,表 面会生成发黑的氧化膜, 银匠说,可以先把铜、 银在火上烧热,马上蘸 一下酒精,铜银会光亮 如初!这是何原理?
12
二、氧化反应
乙醇 K2Cr2O7 (橙红色)
驾 驶 员 正 在 接 受 酒 精 检 Cr2(SO4)3 查
(绿色)
三、消去反应
HH HCCHCH2=CH浓21+H7H020SC2OO4
H OH 羟基和氢脱去结合成水
思考: 什么样的醇能发生消去反应?
制乙烯实验装置
酒精与浓硫酸混 合液如何配置
浓硫酸的作 用是什么?
种无机物和有机物
SuzWheoiusHhiagnhaSncHhoigohlWSacnhgoxoial oli
三、乙醇的化学性质
HH
-C原子
-C原子
H C—C—O—H
④ H③H ② ①
1.取代反应(乙醇和钠的反应)
(新编)高中化学人教版选修5课件3.1.1醇

典例透析
IANLITOUXI
答案:C
点拨只有—OH在链的末端即含有—CH2OH时,才能被氧化成醛。 解答本题时可先将分子式改写成R—CH2OH的形式,R—有几种结 构,则氧化成的醛就有几种。
-22-
第1课时 醇
目标导航
Z Z D 知识梳理 HISHISHULI
重难聚焦
HONGNANJUJIAO
典例透析
+2H2O。
4.与氢溴酸反应
乙醇与浓氢溴酸混合加热发生取代反应时,断裂c键。化学方程
式为C2H5—OH+HBr
C2H5—Br+H2O。
特别提醒应用醇与金属钠的置换反应,可以测定醇分子中所含活
泼氢(或羟基)的数目,羟基数目与生成H2的对应关系是—
OH~
1 2
H2。
-18-
第1课时 醇
目标导航
Z Z D 知识梳理 HISHISHULI
-7-
第1课时 醇
目标导航
Z Z D 知识梳理 HISHISHULI
重难聚焦
HONGNANJUJIAO
典例透析
IANLITOUXI
一二
2.化学性质 醇的化学性质主要由羟基决定,氧原子吸引电子能力强于碳原子 和氢原子,所以碳氧键和氢氧键易断裂。以乙醇为例,可发生如下 反应:
-8-
第1课时 醇 一二
-13-
第1课时 醇 一二三
目标导航
Z Z D 知识梳理 HISHISHULI
重难聚焦
HONGNANJUJIAO
典例透析
IANLITOUXI
2.醇的催化氧化规律 醇分子中,—OH上的氢原子和与羟基相连的碳原子上的氢原子
结合外来的氧原子生成水,而醇本身形成了
人教版高中化学选修五课件3.1.1乙醇的组成、结构和性质(共74张PPT).pptx

答案 一、—OH C2H6O CH3—CH2—OH 二、1.无 特殊香味 液 小 酒精 任意比例 2.(1)2CH3CH2ONa+H2↑ C2H5Br+H2O CH3CH2—O—CH2CH3+H2O (2)2CO2+3H2O 2CH3CHO+2H2O (3)CH2===CH2↑+H2O 3.75% 4. 96% 99.5% 新制生石灰 蒸馏
(1)产生上述问题的主要原因是____________________ ______________________________。
(2)乙醇和浓硫酸在不同体积比的情况下乙烯产量的探 究:
由此可知,在相同实验条件下___________________ _______________________________。
2.了解逆合成分析法,通过简单化合物的逆合成分 析,巩固烃、卤代烃、烃的含氧衍生物的性质和转化关 系,并认识到有机合成在人类生活和社会进步中的重大意 义。
3.能结合生产、生活实际了解烃的含氧衍生物对环 境和健康可能产生的影响,讨论烃的含氧衍生物的安全使 用,关注烃的含氧衍生物对环境和健康的影响。
4.进一步学习科学探究的基本方法,初步学会运用 观察、实验、查阅资料等多种手段获取信息及加工信息的 能力。
1.乙醇的性质由乙醇的结构决定,从中理解事物 的因果关系。 情感、态度与价 2.通过乙醇在不同条件下脱水方式的差异性学 值观 习,加深外界条件对化学反应的影响的认识,培 养具体问题具体分析的思想观念。
自主学习
一、乙醇的组成和结构 乙醇是极性分子,官能团是________,分子式为 ________,结构简式__________________,分子中含有2 种类型的氢原子。
二、乙醇的性质和用途 1.物理性质 乙醇是________色、有________的________体,密度 比水________,俗称________,易挥发,能够溶解多种无 机物和有机物,能跟水以________互溶。
人教版高中化学选修5课件:3.1.1 醇PPT

乙醇
乙醛
乙酸
醇
反应
断键位置
与金属反应
①
催化氧化
①③
消去反应
②④
分子间脱水 与HX反应
①② ②
本课小第结15 页
⑤
H H② ①
H—C—C—O—H ③
④H H
醇
当堂巩第固16 页
1、乙醇分子中各种化学键如图所示,关于乙醇在各种反应中断裂键 的说法不正确的是( C )
A.和金属钠反应时键①断裂 B.和浓H2SO4共热到170 ℃时键②和⑤断裂 C.和浓H2SO4共热到140 ℃时仅有键②断裂 D.在Ag催化下与O2反应时键①和③断裂
浓硫酸
化学方程式为____C_H_3_C_H__2_C_H_2_O__H__1_7_0℃___C__H_3_C_H__=_C_H__2↑_+__H__2O_________。
A在铜作催化剂时,与氧气共热可以生成C,该氧化反应的化学方程式
Cu
为____2_C__H_3_C_H__2C__H_2_O__H_+__O_2___△_____2_C_H__3C__H_2_C_H__O_+__2_H__2O______________。
吸 湿 性 , 护 肤
醇
科学史第话6 页
醇的命名 (1)选主链 选最长碳链,且含-OH (2)编号 从离-OH最近的一端起编
(3)写名称 取代基位置— 取代基名称 — 羟基位置— 母体名称(羟基位 置用阿拉伯数字表示;羟基个数用“二”、“三”等表示)
CH2OH CH2OH
乙二醇
CH2OH 苯甲醇
CH2OH
化学 ·选修5《有机化学基础》
醇、酚
醇
教学目第标2 页
❖掌握乙醇的结构和性质 ❖了解醇类的官能团、结构特点、一般通性和几种
高级中学高中化学选修五人教版课件:3.1 乙醇

对酒 当歌,人生几何? 何以解忧? 唯有 杜康 。(曹操)
身边的“酒”
95% 75%
含酒精:38% - 65% 含酒精:8% - 15% 含酒精:6% - 20% 含酒精:3% - 5%
一、乙醇的物理性质
❖颜 色:无色透明
❖气 味:特殊香味 ❖状 态:液体 ❖密 度:比水小
200C时的密度是0.7893g/cm3 ❖挥发性:沸点78℃,易挥发 ❖溶解性:和水可以以任意比互溶
必修2 第三章第三节
乙醇
明月几时有, 把酒 问青天。(苏轼)
借问中国酒家的何酒处文有流化,牧长博童!大遥精指杏深花,村源(远杜牧)
葡萄美酒夜光杯,欲饮琵琶马上催。(王翰 )
• 关于酒的诗词名句有很多, 花间一同壶学酒们知,独道酌哪无些相?亲说。说(李看白。)
白日放歌需 纵酒 ,青春作伴好还乡。(杜甫)
钠与乙醇 先沉在液体下部
响声很小 有 缓慢 否
【对比思考】
乙醇
水
结构式
?
H―O―H
分析:水与钠反应生成H2,说明水中_O__―__H_键容易断裂。
而乙醇也能与钠反应产生H2,说明乙醇中存在_O_―__H__键_ 。
•1、所有高尚教育的课程表里都不能没有各种形式的跳舞:用脚跳舞,用思想跳舞,用言语跳舞,不用说,还需用笔跳舞。 •2、一切真理要由学生自己获得,或由他们重新发现,至少由他们重建。 •3、教育始于母亲膝下,孩童耳听一言一语,均影响其性格的形成。 •4、好的教师是让学生发现真理,而不只是传授知识。 •5、数学教学要“淡化形式,注重实质.
4.等物质的量的下列醇与足量的金属钠
反应,产生气体最多的是(
)
A.CH3OH
B. C2H5OH
身边的“酒”
95% 75%
含酒精:38% - 65% 含酒精:8% - 15% 含酒精:6% - 20% 含酒精:3% - 5%
一、乙醇的物理性质
❖颜 色:无色透明
❖气 味:特殊香味 ❖状 态:液体 ❖密 度:比水小
200C时的密度是0.7893g/cm3 ❖挥发性:沸点78℃,易挥发 ❖溶解性:和水可以以任意比互溶
必修2 第三章第三节
乙醇
明月几时有, 把酒 问青天。(苏轼)
借问中国酒家的何酒处文有流化,牧长博童!大遥精指杏深花,村源(远杜牧)
葡萄美酒夜光杯,欲饮琵琶马上催。(王翰 )
• 关于酒的诗词名句有很多, 花间一同壶学酒们知,独道酌哪无些相?亲说。说(李看白。)
白日放歌需 纵酒 ,青春作伴好还乡。(杜甫)
钠与乙醇 先沉在液体下部
响声很小 有 缓慢 否
【对比思考】
乙醇
水
结构式
?
H―O―H
分析:水与钠反应生成H2,说明水中_O__―__H_键容易断裂。
而乙醇也能与钠反应产生H2,说明乙醇中存在_O_―__H__键_ 。
•1、所有高尚教育的课程表里都不能没有各种形式的跳舞:用脚跳舞,用思想跳舞,用言语跳舞,不用说,还需用笔跳舞。 •2、一切真理要由学生自己获得,或由他们重新发现,至少由他们重建。 •3、教育始于母亲膝下,孩童耳听一言一语,均影响其性格的形成。 •4、好的教师是让学生发现真理,而不只是传授知识。 •5、数学教学要“淡化形式,注重实质.
4.等物质的量的下列醇与足量的金属钠
反应,产生气体最多的是(
)
A.CH3OH
B. C2H5OH
乙醇的性质复习ppt课件

浓硫酸与酒精体 积比?
为何使液体温度迅 速升到170℃?
浓硫酸的作 用是什么?
碎瓷片作用是 什么?
温度计的 位置?
用什么方法 收集乙烯?
装置的组装 顺序?
装置气密性 检验 ?
有何杂质气体? 如何除去?
为了规范事业单位聘用关系,建立和 完善适 应社会 主义市 场经济 体制的 事业单 位工作 人员聘 用制度 ,保障 用人单 位和职 工的合 法权益
乙醇可以看成是乙烷分子里的氢原子被羟基取代后 的产物.烃的衍生物:如卤代烃,溴苯,硝基苯,乙醇等.
②官能团:决定有机化合物的化学特性的原子或原子团
பைடு நூலகம்
常见的官能团有:卤素原子(—X)、羟基(—OH)、 醛基(—CHO)、 羧基(—COOH)、 硝基(—NO2)、 磺酸基(—SO3H)、氨基(—NH2)等( C=C )和 (-C≡C- )也分别是烯烃和炔烃的官能团
为了规范事业单位聘用关系,建立和 完善适 应社会 主义市 场经济 体制的 事业单 位工作 人员聘 用制度 ,保障 用人单 位和职 工的合 法权益
人教版《化学》必修二
4.乙醇的脱水反应 :
(1)分子间脱水——取代反应(①③号键断裂)
C2H5-OH
+
H-O-C2H5
浓H2SO4 1400C
C2H5-O-C2H5 乙醚
乙醇
乙醛
乙酸
(4)醇与羧酸的酯化反应
O
O
浓H2SO4
CH3—C—OH+H—O—C2H5
CH3—C—O—C2H5 + H2O
为了规范事业单位聘用关系,建立和 完善适 应社会 主义市 场经济 体制的 事业单 位工作 人员聘 用制度 ,保障 用人单 位和职 工的合 法权益
人教版高中化学选修五3.1 醇酚 (共28张PPT)教育课件

8
乙醇的化学性质
醇的化学性质主要由羟基所决定,乙醇中的C-O键和O-
H键有较强的极性,在反应中都有断裂的可能。
HH
(1)跟金属反应 (如K、Na、Ca、Mg、Al):
|| H—C—C —O—H
||
HH
2Na+2CH3CH2OH→2CH3CH2ONa+H2↑。
该反应中乙醇分子断裂了O—H键。
4/1/2021 9:32 PM
CH3CH2OCH2CH3+H2O 2CH3CH2OH+O2―催―△化→剂 2CH3CHO+2H2O
CH3CH2—OH+H—X――△→CH3CH2X+H2O
燃烧反应
4/1/2021 9:32 PM
CH3CH2OH+3O2―点―燃→2CO2↑+3H2O
反应 断裂的
类型
价键
取代 反应
①
消去 反应
②⑤
取代 反应
HH
全部断键
4/1/2021 9:32 PM
②催化氧化
a.用小试管取2mL无水乙醇 b.加热一端绕成螺旋状的铜丝至红热 c.将铜丝趁热插到盛有乙醇的试管底部 d.反复操作几次,观察铜丝颜色和液体
气味的变化 [实验现象]
a.铜丝红色→黑色→红色反复变化 b.在试管口可以闻到刺激性气味
2021/4/1
C—O、C—H C=C
CH2=CH2、H2O
[结论]醇发生消去反应的分子结构条件:与C-OH相邻的碳原 子上有氢原子.外部条件:浓硫酸、加热到170℃
4/1/2021 9:32 PM
练习:1、下列醇在浓硫酸作催化剂的条件下能发生消去反
应的有_B__D__E_F____
A.甲醇 B.2-甲基-2-丙醇 C.苯甲醇 D.2-甲基-3-戊醇
高中化学乙醇课件

拿轻放,避免撞击和摩擦。
废弃乙醇的处理方法
回收再利用
废弃的乙醇可以通过蒸馏等方法进行回收再利用,减少资 源浪费。
生物降解
乙醇可以被微生物降解,因此可以采用生物处理的方法进 行处理。例如,将废弃乙醇加入活性污泥中,通过微生物 的代谢作用将其降解为无害物质。
燃烧处理
在符合环保要求的前提下,废弃乙醇也可以采用燃烧的方 法进行处理。燃烧产生的热量可以用于发电或供暖等用途 。
储存安全
乙醇应储存在阴凉、通风、干燥 的地方,远离火源和热源。储存 容器应密封良好,防止挥发和泄
漏。
使用安全
在使用乙醇时,应佩戴防护眼镜 、手套等个人防护用品,避免皮 肤接触和吸入其蒸气。操作应在 通风良好的地方进行,避免产生
静电火花。
防火防爆
乙醇易燃易爆,应远离火源和静 电。在搬运和使用过程中,应轻
乙醇的分子结构与化学键
分子结构
乙醇分子由2个碳原子、6个氢原子和1个氧原子组成,呈线 性结构。
化学键
乙醇分子中存在共价键,包括碳-碳键、碳-氢键、碳-氧键和
04
外观与气味
乙醇为无色透明液体,具有特 殊香味。
熔点与沸点
乙醇的熔点为-114.1℃,沸点 为78.3℃。
2. 控制反应温度在约130°C,并加压以 促进反应进行。
步骤
1. 将乙烯通入含有催化剂(如磷酸或硫 酸)的水溶液中。
实验注意事项与操作技巧
注意事项 乙烯气体易燃易爆,操作时应远离火源并注意安全。
催化剂对皮肤有刺激性,需佩戴实验服和护目镜等防护用品。
实验注意事项与操作技巧
• 反应过程中会产生高温和高压,需使用专业设备并严格遵 守操作规程。
05 乙醇对环境的影响及安全 措施
废弃乙醇的处理方法
回收再利用
废弃的乙醇可以通过蒸馏等方法进行回收再利用,减少资 源浪费。
生物降解
乙醇可以被微生物降解,因此可以采用生物处理的方法进 行处理。例如,将废弃乙醇加入活性污泥中,通过微生物 的代谢作用将其降解为无害物质。
燃烧处理
在符合环保要求的前提下,废弃乙醇也可以采用燃烧的方 法进行处理。燃烧产生的热量可以用于发电或供暖等用途 。
储存安全
乙醇应储存在阴凉、通风、干燥 的地方,远离火源和热源。储存 容器应密封良好,防止挥发和泄
漏。
使用安全
在使用乙醇时,应佩戴防护眼镜 、手套等个人防护用品,避免皮 肤接触和吸入其蒸气。操作应在 通风良好的地方进行,避免产生
静电火花。
防火防爆
乙醇易燃易爆,应远离火源和静 电。在搬运和使用过程中,应轻
乙醇的分子结构与化学键
分子结构
乙醇分子由2个碳原子、6个氢原子和1个氧原子组成,呈线 性结构。
化学键
乙醇分子中存在共价键,包括碳-碳键、碳-氢键、碳-氧键和
04
外观与气味
乙醇为无色透明液体,具有特 殊香味。
熔点与沸点
乙醇的熔点为-114.1℃,沸点 为78.3℃。
2. 控制反应温度在约130°C,并加压以 促进反应进行。
步骤
1. 将乙烯通入含有催化剂(如磷酸或硫 酸)的水溶液中。
实验注意事项与操作技巧
注意事项 乙烯气体易燃易爆,操作时应远离火源并注意安全。
催化剂对皮肤有刺激性,需佩戴实验服和护目镜等防护用品。
实验注意事项与操作技巧
• 反应过程中会产生高温和高压,需使用专业设备并严格遵 守操作规程。
05 乙醇对环境的影响及安全 措施
人教版选修5 3.1 .1醇(共53张PPT)
人 教 版 选 修 5 3.1 .1醇(共 53张PPT)
人 教 版 选 修 5 3.1 .1醇(共 53张PPT)
(2)同一个碳原子上不能连接两个以上的 羟基。
否则:发生分子内自动脱水,生成醛基。
如:二氯甲烷在氢氧化钠水溶液中发生反
应:
注意:
卤代烃
和醇在
同分异
构体上
的区别。
人 教 版 选 修 5 3.1 .1醇(共 53张PPT)
方法:取一定质量的乙醇与足量的金属钠 反应,测量生成的气体的体积。 方程式:
2CH3CH2OH+2Na 2CH3CH2ONa+H2↑ 断键位置和接键形势 乙醇中羟基(—OH)中O—H键断裂,生 成乙醇钠和氢气。
反应类型 置换反应 还原反应 有时也说成取代反应
比较钠与水的反应:
分析乙醇与水分别与金属钠反应现象不 同的原因:
人 教 版 选 修 5 3.1 .1醇(共 53张PPT)
醇(第三课时) 一、化学性质 1、羟基部分 (一)、与钠的反应, 通式:2R—OH+2Na 2R—ONa+H2↑ 写出乙二醇和甘油分别与足量金属钠反应 的化学方程式:
人 教 版 选 修 5 3.1 .1醇(共 53张PPT)
人 教 版 选 修 5 3.1 .1醇(共 53张PPT)
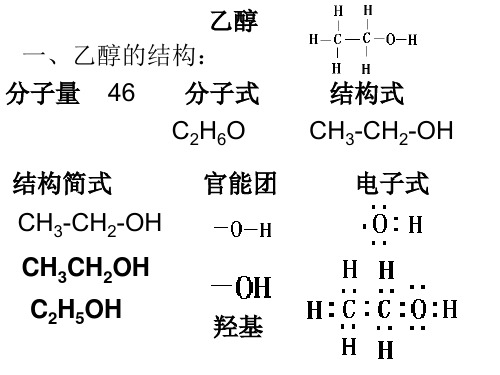
乙醇 一、乙醇的结构: 分子量 46 分子式
C2H6O
结构简式
官能团
CH3-CH2-OH
CH3CH2OH C2H5OH
羟基
结构式 CH3-CH2-OH
电子式
二、物理性质:
不用于鉴别
俗名 酒精 无色透明的液体,有特殊的香味,
比水轻,与水互溶, 沸点780C,易挥发。 乙醇在加热条件下发生反应常冷凝回流。
人 教 版 选 修 5 3.1 .1醇(共 53张PPT)
(2)同一个碳原子上不能连接两个以上的 羟基。
否则:发生分子内自动脱水,生成醛基。
如:二氯甲烷在氢氧化钠水溶液中发生反
应:
注意:
卤代烃
和醇在
同分异
构体上
的区别。
人 教 版 选 修 5 3.1 .1醇(共 53张PPT)
方法:取一定质量的乙醇与足量的金属钠 反应,测量生成的气体的体积。 方程式:
2CH3CH2OH+2Na 2CH3CH2ONa+H2↑ 断键位置和接键形势 乙醇中羟基(—OH)中O—H键断裂,生 成乙醇钠和氢气。
反应类型 置换反应 还原反应 有时也说成取代反应
比较钠与水的反应:
分析乙醇与水分别与金属钠反应现象不 同的原因:
人 教 版 选 修 5 3.1 .1醇(共 53张PPT)
醇(第三课时) 一、化学性质 1、羟基部分 (一)、与钠的反应, 通式:2R—OH+2Na 2R—ONa+H2↑ 写出乙二醇和甘油分别与足量金属钠反应 的化学方程式:
人 教 版 选 修 5 3.1 .1醇(共 53张PPT)
人 教 版 选 修 5 3.1 .1醇(共 53张PPT)
乙醇 一、乙醇的结构: 分子量 46 分子式
C2H6O
结构简式
官能团
CH3-CH2-OH
CH3CH2OH C2H5OH
羟基
结构式 CH3-CH2-OH
电子式
二、物理性质:
不用于鉴别
俗名 酒精 无色透明的液体,有特殊的香味,
比水轻,与水互溶, 沸点780C,易挥发。 乙醇在加热条件下发生反应常冷凝回流。
课件人教选修乙醇ppt完美PPT全文课件

饱和碳酸钠溶液的作用
物质
沸点(oC) 密度(g/mL) 水溶性
乙酸
117.9
1.05
易溶
乙醇
78.5
0.7893
易溶
乙酸乙酯
77
0.90
微溶
1、乙酸乙酯在无机盐(饱和碳酸钠溶液)的
溶解度减小,易于分层析出
2、中和挥发出来的乙酸,生成醋酸钠 (便于闻乙酸乙酯的气味)
3、溶解挥发出来的乙醇
长导管的位置与作用?
又由
又变成
,反复多次,可闻到
气味,
3、溶解挥发出来的乙醇
交警判断驾驶员是否酒后驾车的方法
铜丝由
变成
。
C:稀硫酸与氧化铜和金属铜都会反应,
乙醇燃烧时火焰的颜色?
该反应是可逆反应,加浓硫酸可加快反应速率并使反应向生成乙酸乙酯的反应方向进行。
4、酯化反应的反应机理(如何脱去水)?
能发生消去反应的醇的分子结构特点是什么?是不是所有的醇都能发生消去反应?
喝酒脸红的原因
酒精(既乙醇)吸收后,绝大部分在肝脏被氧
化分解。在醇脱氢酶的作用下氧化成乙醛,又在 醛脱氢酶的作用下氧化成乙酸,乙酸进入血液, 在代谢过程中,最后生成CO2和H2O排出体外。
乙醛能使脸部毛细血管扩张而变红,所以喝酒
脸红的人意味着他们有高效的醇脱氢酶,但是缺 乏醛脱氢酶,所以体内迅速积聚大量乙醛而迟迟 不能代谢,出现中毒现象,比如会面红耳赤、头 疼、心率加快、严重可导致死亡。
在试管I中依次加入2 mL蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和3 g 溴化钠粉末,在试管II中注入蒸馏水,烧杯中注入自来水。
2Cu+O +2CH CH OH+2CuO → 而使固体溶解,质量减轻。
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
比一比
反应
与金属反应 催化氧化 分子内脱水 酯化反应 与浓HBr反应
⑤
H H H H
② ① ③
H—C—C—O—H
④
断键位
置
① ①③ ②④ ① ②
反应类
型 置换
氧化
消去 取代 取代
2018/1/16
巴西利用甘蔗乙醇生产塑料
植物
糖类
发 酵 生物技术
乙醇
消去提纯
乙烯
加聚
聚乙烯
2018/1/16
乙醇的性质
3、氧化反应 4、取代反应
一、物理性质
二、化学性质
1、置换反应
2、酯化反应
①燃烧
②催化氧化
5、脱水反应
①分子内 ②分子间
2018/1/16
③强氧化剂氧化
二、化学性质
消去反应 ——实验室制乙烯
H
H
H—C—C—H H
OH
消去? 浓H2SO4
170℃
CH2=CH2 ↑+ H2O
消去反应醇的结构特点:邻碳上有氢
2018/1/16
二、化学性质
消去反应 ——实验室制乙烯
H
H
浓H2SO4 170℃
H—C—C—H H
OH
CH2=CH2 ↑+ H2O
消去反应醇的结构特点:邻碳上有氢
抟扶摇而徐徐释放气泡,与水大相径庭也。”
乙醇也,乙酸也,脱水以制乙酸乙酯也。
2018/1/16
重拾旧知
1、燃烧:CH3CH2OH + 3O2
点燃
CO2+H2O
Cu或Ag
2、催化氧化:2CH3CH2OH + 2O2 3、置换:2CH3CH2OH + 2Na
△
2CH3CHO + 2H2O
2CH3CH2ONa + H2↑
浓H2SO4
△
2、酯化:CH2CH3CH2OH + CH3COOH CH3COOCH2CH3 + H2O
H H H—C—C—O—H H H
Cu或Ag
3、催化氧化:2CH3CH2OH + 2O2 4、2018/1/16 取代反应:CH3CH2OH + HBr
△
△
2CH3CHO + 2H2O
CH3CH2Br + 2H2O
烃的含氧衍生物
第一节 醇 酚 第1课时 乙醇的化学性质
2018/1/16
2018/1/16
乙醇版《逍遥游》
北冥有醇,俗称酒精。用之广,不知其几百种也。
与水互溶,散发酒香,味之至,不知其几千里也。
点而燃,火焰若淡蓝之光。
是醇也,氧化则将生成醛.
有机者,志怪者也。
有机言曰:“醇之与钠反应也,钠沉乙醇底,
170
140 78
资料2:乙醚化学性质稳定。
资料3:乙醇的沸点约为78°C。
【交流探索】 1、可能产生哪些气体? 2、哪些气体对检验乙烯有影响? 3、又应如何检验乙烯?
2018/1/16
【寻求真相】
温度 /°C
可能产生哪些气体?
CO2、SO2 乙烯
170
140 78
乙醚 少量乙醇蒸汽 资料1:浓硫酸与无水乙醇共热温度过高, 就会产生炭粒,称为碳化现象。 资料2:乙醚化学性质稳定。
浓H2SO4
4、酯化:CH2CH3CH2OH + CH3COOH
2018/1/16
CH3COOCH2CH3 + H2O
△
2018/1/16
被其他氧化剂氧化
K2Cr2O7 酸性溶液
C2H5OH
Cr3+
橙色
KMnO4 酸性溶液
绿色
C2H5OH
2018/1/16
温顾知新
1、置换:2CH3CH2OH + 2Na 2CH3CH2ONa + H2↑
5、反应温度迅速升高至170°C
2018/1/16
6、实验结束后,先撤导管,再撤酒精灯
实际实验现象
烧瓶内
预期实验现象 实际实验现象
试管内
无明显现象 溶液变黑
酸性高锰 酸钾褪色 酸性高锰 酸钾褪色
2018/1/16
【探索酸性高锰酸钾的褪色的真相】
温度 /°C
资料1:浓硫酸与无水乙醇共热温度过高, 就会产生炭粒,称为碳化现象。
C2H5—O—H +HO—C2H5
2018/1/16
浓硫酸 140°C
C2H5—O—C2H5 + H2O
预测实验现象
烧瓶内
试管内
预期实验现 象
2018/1/16
无明显现象
酸性高锰 酸钾褪色
实验操作的注意事项
1、检查装置气密性 2、加入沸石,防暴沸
3、先加入乙醇,再加入浓硫酸 (浓硫酸的作用:脱水剂、催化剂) 4、温度计水银球在液面以下
2018/1/16
【寻求真相】 哪些气体对检验乙烯有影响?
乙醇蒸汽
乙醚
乙烯
SO2
CO2
【还原真相】 又应如何检验乙烯?
2018/1/16
品红
高锰酸钾 酸性溶液
【寻求真相】 哪些乙醚
乙烯
SO2
CO2
【还原真相】 又应如何检验乙烯?
2018/1/16
品红
高锰酸钾 酸性溶液
