2玻璃的粘度
什么是玻璃黏度的计算公式

什么是玻璃黏度的计算公式玻璃黏度的计算公式。
玻璃黏度是指玻璃在一定温度下的流动性能,是玻璃材料的重要物理性质之一。
在工业生产和科研领域中,对玻璃黏度的准确计算和控制具有重要意义。
本文将介绍玻璃黏度的计算公式及其相关知识。
玻璃黏度的计算公式可以通过斯托克斯-爱因斯坦公式来进行计算。
斯托克斯-爱因斯坦公式是描述玻璃黏度与温度之间关系的经验公式,其表达式为:η = A exp(B/T)。
其中,η表示玻璃的黏度,A和B为常数,T为温度(单位为K)。
A和B是与玻璃化学成分和结构有关的常数,它们可以通过实验测定得到。
公式中的指数函数exp表示自然对数的底e的幂函数。
在这个公式中,温度T是玻璃黏度的一个重要影响因素。
随着温度的升高,玻璃的黏度会逐渐减小。
这是因为温度升高会增加玻璃分子的热运动能量,使得分子之间的相互作用减弱,从而降低了玻璃的黏度。
因此,通过斯托克斯-爱因斯坦公式可以很好地描述玻璃黏度随温度变化的规律。
除了斯托克斯-爱因斯坦公式,还有其他一些描述玻璃黏度的计算公式,如沃格尔-弗洛伊德公式、阿伦尼乌斯公式等。
这些公式在不同的条件下有着不同的适用范围,可以根据实际情况选择合适的公式进行计算。
在实际应用中,玻璃黏度的计算不仅仅依靠公式,还需要考虑玻璃的化学成分、结构特征、加工工艺等因素。
一般来说,通过实验测定得到的黏度数据更为准确可靠。
实验测定可以通过旋转粘度计、旋转圆盘粘度计、振荡粘度计等仪器来进行。
通过实验测定得到的数据可以用来验证计算公式的准确性,并为工程设计和生产操作提供参考依据。
在工业生产中,控制玻璃黏度是非常重要的。
玻璃黏度的大小直接影响了玻璃的流动性能、成型工艺和产品质量。
因此,通过准确计算和控制玻璃黏度,可以提高玻璃制品的生产效率和质量稳定性。
总之,玻璃黏度的计算公式是描述玻璃黏度与温度之间关系的重要工具。
斯托克斯-爱因斯坦公式是其中一种常用的计算公式,通过该公式可以很好地描述玻璃黏度随温度变化的规律。
武汉理工材料科学基础第三章部分习题

瓷釉结构中各离子所处的位置。 5、 在硅酸盐玻璃和硼酸盐玻璃中,随着R2O的引入(<25mol%), 玻璃熔体的粘度怎样变化?试用聚合物理论解释。 6、 解释B2O3含量10mol%,SiO2含量90mol%的熔体,在冷却过 程中各自形成两个互不相容的分层玻璃,而加入适量Na2O后, 能得到均匀的玻璃。 7、 论证形成玻璃必须具有混合键。 8、 说明为什么镁橄榄石熔体不易形成玻璃而长石熔体易形成玻 璃?
分析:要应用关系式,必须换算成mol%。
解:玻璃组成
Na2O
CaO
SiO2
wt%
mol mol%
13
0.21 12.6
13
0.23 13.8
74
1.23 73.6
O 12.6 13.8 73.6 2 R = = = 2.36 Si 73.6
Z=4
X=2R-Z=2×2.36-4=0.72 Y=Z-X=4-0.72=3.28
3-7 (b) 上述数据是在恒压下取得,在恒容下,预计活化能 会有所不同。因为恒容时熔体所受压力应增加,这将使其粘
度增大,从而改变了活化能值。
3-9 在SiO2中应加入多少Na2O,使玻璃的O/Si=2.5,此时析晶能力是增强还是 削弱?
解;假定引入的Na2O的mol含量为 x , 则SiO2的mol含量为 1-x
网络状,且聚合程度高,故可形成玻璃。但当O/Si=3时, 由于碱金属氧化物明显增加,使熔体中分子较小的低聚合 物增加,熔体粘度变小,故可易结晶而不易形成玻璃。
3、 在硅酸盐熔体析晶的成核速率、生长速率随T变化的关系图 中,标出哪一条曲线代表成核速率,哪一条曲线代表生长速率? 为什么?
速 率
u IV
第三章 熔体和玻璃体
第4章玻璃的粘度及表面性质

第4章 玻璃的粘度及表面性质玻璃的粘度在重力、机械力和热应力等的作用下,玻璃液(或玻璃熔体)中的结构组元(离子或离子组团)彼其间发生流动。
若是这种流动是通过结构组元依次占据结构空位的方式来进行,那么称为粘滞流动。
看成使劲超过“内摩擦”阻力时,就能够发生粘滞流动。
粘滞流动用粘度衡量。
粘度是指面积为S 的两平行液面,以必然的速度梯度dxdV移动时需克服的内摩擦阻力f 。
dxdVSf η= (4-1) 式中: η—粘度或粘滞系数S —两平行液面间的接触面积dx dV /—沿垂直于液流方向液层间速度梯度粘度是玻璃的一个重要物理性质,它贯穿于玻璃生产的全进程。
在熔制进程中,石英颗粒的溶解、气泡的排除和各组分的扩散都与粘度有关。
在工业上,有时应用少量助熔剂降低熔融玻璃的粘度,以达到澄清和均化的目的。
在成形进程中,不同的成形方式与成形速度要求不同的粘度和料性。
在退火进程中,玻璃的粘度和料性对制品内应力的排除速度都有重要作用。
高粘度的玻璃具有较高的退火温度,料性短的玻璃退火温度范围一样较窄。
阻碍玻璃粘度的要紧因素是化学组成和温度,在转变区范围内,还与时刻有关。
不同的玻璃对应于某必然粘度值的温度不同。
例如粘度为1012s Pa •时,钠钙硅玻璃的相应温度为560℃左右,钾铅硅玻璃为430℃左右,而钙铝硅玻璃为720℃左右。
在玻璃生产中,许多工序(和性能)都能够用粘度作为操纵和衡量的标志(见表4-1)。
利用粘度来描述玻璃生产全进程较温度更确切与周密,但由于温度测定简便、直观,而粘度和组成关系的复杂性及适应性,因此适应上用温度来描述和规定玻璃生产工艺进程的工艺制度。
4.1.1粘度与温度关系由于结构特性的不同,因此玻璃熔体与晶体的粘度随温度的转变有显著的不同。
晶体在高于熔点时,粘度转变很小,当抵达凝固点时,由于熔融态转变成晶态的缘故,粘度呈直线上升。
玻璃的粘度那么随温度下降而增大。
从玻璃液到固态玻璃的转变,粘度是持续转变的,其间没有数值上的突变。
粘度

粘度在玻璃生产中的重要意义
粘度是玻璃的一个重要物理性质, 它贯穿于玻璃生产的全过程。 在工业上,有时应用少量助熔剂 降低熔融玻璃的粘度,以达到澄 清和均化的目的。
粘度在玻璃生产中的重要意义
在熔制过程中,石英颗粒的溶解、气 泡的排除和各组分的扩散都与粘度有 关。 在成形过程中,不同的成形方法与成 形速度要求不同的粘度和料性。 在退火过程中,玻璃的粘度和料性对 制品内应力的消除速度都有重要作用。
在玻璃生产中,许多工序(和性能) 都可以用粘度作为控制和衡量的标志。 使用粘度来描述玻璃生产全过程较温度 更确切与严密,但由于温度测定简便、 直观,而粘度和组成关系的复杂性及习 惯性,因此习惯上用温度来描述和规定 玻璃生产工艺过程的工艺制度。
粘度与温度的关系
由于结构特性的不同,因而玻璃熔 体与晶体的粘度随温度的变化有显著的 差别。时,由于熔融态转变 成晶态的缘故,粘度呈直线上升。玻璃 的粘度则随温度下降而增大。从玻璃液 到固态玻璃的转变,粘度是连续变化的, 其间没有数值上的突变。
粘度与温度的关系
所有实用硅酸盐玻璃,其粘度随 温度的变化规律都属于同一类型, 只是粘度随温度的变化速率以及对 应于某给定粘度的温度有所不同。
粘度与温度的关系
这两种玻璃随 着温度变化其粘度 变化速率不同,称 为具有不同的料性。 曲线斜率大的 玻璃 B 属于“短性” 玻璃;曲线斜率小 的玻璃A属于“长 性”玻璃。
粘度
成员:熊常久 黄菲 李军 温力伦 苏文强 嵇建鹏 高贺 史迎杰
主要解决以下两个问题:
粘度在玻璃生产中的重要意义? 粘度与温度的关系?
什么是粘度?
粘度是指面积为 S 的两平行液 面,以一定的速度梯度 dV/dx 移 动时 需克服的内摩擦阻力f。
第2章玻璃的粘度及表面性质

第2章玻璃的黏度及表面性质2.1玻璃的黏度生产上常把玻璃的粘度随温度变化的快慢称为玻璃的料性。
粘度随温度变化快的玻璃称为短性玻璃,反之称为长性玻璃。
图中分三个温度区:A区:温度较高,表现为典型的黏性液体,其弹性性质近于消失。
黏度决定于玻璃的组成和温度B区:(转变区)黏度、弹性模量随温度的↓而↑↑。
黏度与组成、温度和时间有关。
C区:温度↓而弹性模量↑,黏滞流动变得非常小。
黏度决定于组成和温度,与时间无关黏度与玻璃组成的关系(1)氧硅比氧硅比大(如熔体中碱含量增大,游离氧增多),非桥氧多,网络结构不牢固,熔体黏度减小;反之增大。
(表4-3 )(2)键强:在其它条件相同的前提下,粘度随阳离子与氧的键强增大而增大。
黏度按Li2O-Na2O-K2O依次递减(3)离子极化:离子极化力大的阳离子对桥氧的极化力强,使得Si-O键作用减弱,网络结构易于调整与移动,使η↓。
(4)结构对称性:网络基本结构单元的结构不对称,可能在结构中存在缺陷或弱点,使结构不稳定,粘度下降。
(5)配位数:4配位形成四面体进入网络结构,使结构紧密,粘度增大。
其它配位时就从网络中分离出来,使黏度降低。
如B2O3和A2O3硼反常现象:由硼离子配位数变化引起性能曲线上出现转折的现象,称为“硼反常现象”。
总结氧化物组成对玻璃粘度作用可归纳如下SiO2Al2O3 ZrO提高粘度。
K2O Na2O 降低粘度,Li2O高温时降低粘度,低温时增加粘度。
RO降低高温粘度,增加低温粘度。
PbO CdO Bi2O3 SnO等降低粘度。
2.2玻璃的表面张力熔融玻璃表面层的质点受到内部质点的作用而趋向于熔体的内部,使表面有收缩的趋势,因此玻璃液表面分子间存在着作用力,即表面张力。
总结:依组成对表面张力的不同作用,将组成氧化物分为Ⅰ类:非表面活性组份:一般是增加玻璃表面张力,符合加合性法则Ⅱ类:中间活性组份:加入量大时,可降低表面张力,不符合加合性法则Ⅲ类:难熔表面活性强的组份:有强的降低表面张力的能力,不符合加合性法则表面张力与温度、气氛和湿度的关系1、σ与T的关系温度升高,质点热运动能增大,体积膨胀。
i,ii,iii型玻璃分类

i,ii,iii型玻璃分类
摘要:
i,ii,iii 型玻璃分类
1.玻璃的分类概述
2.i 型玻璃的特点和应用
3.ii 型玻璃的特点和应用
4.iii 型玻璃的特点和应用
正文:
玻璃是一种常见的无机非晶固体材料,广泛应用于建筑、家居、医疗、电子等领域。
根据其性能和用途的不同,玻璃可以分为很多种类,其中最常见的分类方法是按照膨胀系数分为i, ii, iii 型玻璃。
i 型玻璃,也被称为硼硅玻璃,其膨胀系数在3.3×10^-6/℃,具有良好的耐热性能和化学稳定性。
因此,i 型玻璃广泛应用于实验室器皿、医药包装、光学仪器等领域。
ii 型玻璃,也被称为碱土硅玻璃,其膨胀系数在6.5×10^-6/℃,比i 型玻璃稍低,但在光学性能和机械强度方面表现更优。
因此,ii 型玻璃常用于生产平板玻璃、光学玻璃、器皿等。
iii 型玻璃,也被称为铅硅玻璃,其膨胀系数在10×10^-6/℃,是三种玻璃中膨胀系数最大的,具有良好的保温性能。
因此,iii 型玻璃主要用于生产保温瓶、热水杯等保温容器。
总的来说,i, ii, iii 型玻璃因其不同的膨胀系数和性能特点,在各自的领域
发挥着重要的作用。
玻璃的粘度,表面性质,力学和热学性质

C 玻璃的硬度主要取决于化学组成和结构,还与温度和 D 热处理历史有关。对玻璃冷加工影响非常大。 S
抗冲击强度
测量方法:落球法,压痕破坏法
5.1.4
玻璃的密度
密度主要取决于构成玻璃原子的质量, 也与原子的堆积紧密程度及配位数有关。
网络形成体
体积: [BO4]<[SiO4]<[AlO4]
影响热导率因素:
玻璃内部的导热包括:热传导,热辐射
低温时,热传导占主要地位,其大小主要取决 于玻璃的化学组成:键强越大,热传导性能越 好
高温时,热辐射占主要地位,温度越高,传导 性能越高。玻璃的颜色越深,导热性越差。
5.2.4
玻璃的热稳定性
玻璃经受剧烈的温度变化而不破坏的性能。
P K E cd
第4章
玻璃的粘度和表面性质
4.1
玻璃的粘度
定义 粘度是指面积为S的两平行液面,以一定的速 度梯度dV/dx移动时所需克服的内摩擦阻力f。 f=ηS dV
dx
粘度在玻璃生产过程中的作用
在熔制过程中,原料的溶解、气泡的排除、各组分的扩散均化
影响粘度的因素:化学组成、温度、热处理时间 在成形过程中,不同的成型方法与成形速度要求不同的粘度和料性
4.1.3
粘度与组成的关系
有利于形成大阴离子基团的组成使粘度增大(SiO2、 Al2O3、ZrO2等)
提供游离氧,破坏网络结构的,则使粘度减小;场 氧硅比较大,意味着大型的[SO4] 强较大的可能产生复杂的作用:高温降粘,低温增 群分解为小型[SO4]群,粘滞活化能降 粘 氧硅比 键强、离子的极化(R2O-SiO2) 结构的对称性(B2O3、P2O5、SiO2) 配位数(B2O3、Al2O3) 总体来说,键强大,则粘度大
玻璃常用的几种温度对应的粘度

房 地 产 行 业 在 一 定 程 度 上 受 挫 , 并 影 响 到 与 其 相 关 的 上 下 游 行 业 , 平 板 玻 璃 产 业 首 当 其 冲 。 平 板 玻璃在 20 0 9年 被 国 务 院 列 为 六 大 产 能 过 剩 行 业 ,
构 。 另 外 , 由 于 有 机 粘 合 剂 是 以 单 分 子 层 的 状 态 在
原 料 粒 子 表 面 接 合 的 , 因此 就 能 防 止 原 料 粒 子 与 有
机 粘合 剂 的相 互分 离。
( 自亚 太 卫 浴 网) 摘
性 ; 其 次 , 缺 乏 对 上 游 市 场 的 敏 感 性 , 在 房 地 产
气 泡 的 玻 璃 有 多 种 办 法 可 以 处 理 , 比 如 夹 铁 夹 子
回 釜 , 注 射 二 丁 脂 等 , 气 泡 产 生 在 内 部 或 者 气 泡
十 分 严 重 的 夹 层 玻 璃 甚 至 可 以 解 板 重 新 夹 入 胶 片
国 家 采 取 一 系 列 措 施 加 以调 控 。 然 而 2年 间这 一 行 业 重 复 建 设 并 没 有 得 到 遏 制 , 反 而 有 愈 演 愈 烈 的 迹 象 。 最 新 数 据 显 示 ,2 1 0 1年 全 年 国 内 平 板 玻 璃 产 量 7 8 万 重 箱 , 比 2 1 37 9 0 0年 增 长 1 . 5 8个 百 分 点 。 而 产 能 过 剩 直 接 导 致 价 格 下 滑 , 以 福 建 省 为 例 ,2 1 0 1年 1 9 月 , 平 板 玻 璃 出 口量 为 2 18 ~ 2 . 万 m 比 2 1 年 同 期 增 加 9 8 ; 总 价 值 11 8 , 00 .% 1
材料科学基础 熔体和玻璃体作业讲解

3-5 玻璃的组成是 玻璃的组成是13wt%Na2O 、13wt%CaO、74wt%SiO2,计算非桥氧分数。 计算非桥氧分数。 、
分析:要应用关系式,必须换算成 分析:要应用关系式,必须换算成mol%。 。
解:玻璃组成 Na2O wt% mol mol% 13 0.21 12.6 CaO 13 0.23 13.8 SiO2 74 1.23 73.6
3-9 在SiO2中应加入多少 2O,使玻璃的 中应加入多少Na 使玻璃的 使玻璃的O/Si=2.5,此时析晶能力 = , 是增强还是削弱? 是增强还是削弱?
解;假定引入的Na2O的mol含量为 x , 假定引入的 的 含量为 则SiO2的mol含量为 1-x 含量为 -
O x + 2(1 − x ) ∴R = = = 2.5 Si 1− x 1 解得 x = 3
O 12.6+13.8+ 73.6× 2 =2.36 R= = Si 73.6
Z=4 = X=2R-Z=2×2.36-4=0.72 = - = × - =
Y=Z-X=4-0.72=3.28 = - = - = 非桥氧分数%= 非桥氧分数%= X = 0.72 = % 18 X+Y 0.72 + 3.28
3-6 有两种不同配比的玻璃其组成如下: 有两种不同配比的玻璃其组成如下: 序 号 1 2 Na2O (wt%) 8 12 Al2O3(wt%) 12 8 SiO2(wt%) 80 80
试用玻璃结构参数说明两种玻璃高温下粘度的大小? 试用玻璃结构参数说明两种玻璃高温下粘度的大小? 玻璃组成: 解:玻璃组成: 序 号 Na2O wt% 1 2 8 12 mol% 8.18 12.1 Al2O3 wt% 12 8 mol% 7.48 4.87 SiO2 wt% 80 80 mol% 84.3 83.03
玻璃的粘度和温度关系

玻璃的粘度和温度关系玻璃的粘度和温度关系玻璃是一种非晶态材料,与晶体金属和晶体陶瓷不同,其结构不规则,没有重复周期性,具有高度的无序性。
因此,玻璃的性质很大程度上受到制备工艺、组成成分和从高温到常温的冷却速率的影响。
玻璃的粘度是指在一定温度下,玻璃流动所需要的力量。
粘度越大,玻璃越不易变形。
根据阿伦尼斯方程,玻璃的粘度与温度呈指数关系。
简单来说,玻璃越冷,它的粘度就越高;当温度升高时,玻璃的粘度就会下降,直到达到某个温度时,玻璃会变软并开始流动,这个温度被称为玻璃转变温度。
玻璃的粘度和温度关系可以用以下公式表示:η=Ae^(B/T),其中η表示玻璃粘度,A和B是常数,T表示温度。
可以看出,温度越高,分子热运动越剧烈,分子间距越大,粘度越低;温度越低,分子间距越小,粘度越高。
因此,玻璃的粘度温度关系可以看作是玻璃状态和成分的综合反映。
玻璃的粘度和温度关系在工程上具有广泛应用。
例如,在制造玻璃成型件时,需要将玻璃加热到准确的温度,使其流动,然后冷却成固体。
如果温度过低,玻璃会粘在模具上,无法成型;如果温度过高,玻璃会变稀,模型失真。
因此,了解玻璃的粘度温度关系对于玻璃成型工程的成功至关重要。
另外,玻璃的粘度温度关系对于玻璃的残余应力产生也有重要影响。
残余应力是指在加工过程中,由于它的形状、温度等因素的变化而引起的一种固有应力,这种应力存在于玻璃材料中。
在高温下制造,容易在玻璃中形成残余应力,产生裂纹和其他不可逆的缺陷。
了解玻璃的粘度温度关系,可以将制备过程控制在安全范围内。
总之,玻璃的粘度和温度关系是确定其物理和机械性质的重要指标。
在工业生产和研究中,了解这一关系是非常必要的。
未来,人们将通过进一步研究和理解,应用这一知识推动玻璃制造技术的发展,为人们提供更好的产品。
玻璃工艺学复习练习题

玻璃工艺学复习练习题玻璃工艺学复习练习题一、解释以下概念1.临界冷却温度:能生成玻璃的最小冷却速度。
2.不混溶区:玻璃发生分相的组成-温度范围。
3.晶核:具有一定大小能够稳定生长的结晶区域称为晶核。
4.粘度温度系数:玻璃的粘度温度系数= 粘度变化/温度变化=Δη/ΔT5.色散:折射率随入射光波长的不同而不同的现象称为色散。
6.转变温度:粘度为1012.4帕秒的温度7.软化温度:粘度为106.5-107.2帕秒的温度范围。
8.正常色散:折射率随波长减小而增大,色散随随波长减小而加剧的现象称为正常色散。
9.反常色散:光波波长接近玻璃的吸收带时,玻璃的折射率发生急剧变化,吸收带长波侧的折射率高于短波侧的折射率。
这种现象称为反常色散。
10.结石:玻璃中的结晶质夹杂物称为玻璃结石11.条纹:条纹呈线条状或纤维状,形状和粗细都不规则,与它周围的玻璃有时没有明显的界限,故亦称之为玻璃态夹杂物。
12.疖瘤:疖瘤大多是在高温时形成的液态球滴或球团。
由于这部分玻璃的粘度、表面张力比基体玻璃大,因而易收缩呈圆形或椭圆形。
疖瘤也可看成是条纹的前身,由于扩散不充分而造成。
二. 简答题1.在Na2O-SiO2玻璃中加入二价金属氧化物,玻璃的化学稳定性将怎样变化?既有断网作用,也有积聚作用。
在二元(RO-SiO2)玻璃中,主要起断网作用,使性能劣化。
对碱性氧化物有压制作用。
在碱硅玻璃中加入二价金属氧化物能使性能改善。
玻璃的密度、折射率等性质随二价金属离子半径大小而变化。
2.在Na2O-SiO2玻璃中加入B2O3,玻璃的结构将如何变化?在钠硅玻璃中加入B2O3,玻璃的结构随B2O3增加而逐渐加强,玻璃的性质得到改善。
但B2O3的含量超过某数值时,将出现逆转:随着B2O3的增加,玻璃结构逐渐弱化,玻璃的性质逐渐劣化,在玻璃的性质变化曲线上出现极值。
3.判断玻璃生成能力的三个动力学指标是什么?1.在熔点Tm附近熔体的粘度大小,粘度大,容易生成玻璃2. Tg/Tm比值的大小; Tg/Tm比值大,容易生成玻璃3. 临界冷却速度; 临界冷却速度越小,越容易生成玻璃4.分相结构对玻璃的性质有何影响?对第一类性质的影响:由离子的迁移特性决定的性质,如电阻率、化学稳定性等对玻璃的分相结构十分敏感。
玻璃的粘度及表面性质

氧硅比大(如熔体中碱含量增大,游离氧增 多),非桥氧多,网络结构不牢固,熔体黏度减 小;反之增大。
(2)键强:在其它条件相同的前提下,粘度随阳离 子与氧的键强增大而增大。
R2O-SiO2玻璃 黏度按Li2O-Na2O-K2O依次递减 (3)离子极化:离子极化力大的阳离子对桥氧的极化
(1) 应变点:η=1013.6,即应力在几小时内消 除的温度。 (2) 转变点(Tg): η=1012.4 Pa·S的温度。
(3) 退火点: η=1012 Pa·S的温度,应力在几 分钟内消除。
(4) 变形点: η=1010~1011Pa·S的温度范围。
(5) 软化温度(Tf): η=3×106~1.5×107 Pa·S的温度范围,相当于操作温度的下限
(6) 操作范围:相当于成形时玻璃液表面的温度范 围。T上限~T下限, T上限指准备成形操作的温度 ; T下限指成形时能保持制品形状的温度;η= 103~106.6Pa·S
(7) 熔化温度:η=10Pa·S
(8) 自动机供料的黏度:102~103Pa·S
3.1.6 黏度对生产的应用
1、在熔制阶段:其对应粘度为100.7-10 Pa·S
2、成型阶段:成形开始的黏度随制品的种类而异 ,一般在101.6~103 Pa·S,终了黏度 为101.6~103 Pa·S
3、玻璃退火:对应粘度为1011-1014 Pa·S,典型的钠 钙硅玻璃对应的温度为583℃~539℃ ,即退火温度范围
3.2 玻璃的表面张力
3.2.1 表面张力的物理意义
熔融玻璃表面层的质点受到内部质点的作用 而趋向于熔体的内部,使表面有收缩的趋势,即 玻璃液表面分子间存在着作用力,即
浮法玻璃的粘度与温度的相对应值

浮法玻璃的粘度与温度的相对应值
1、应变点:大致相当于粘度为1013.6泊的温度,即应力能在几小时内消除的温度,也称退火下限的温度,相对于的温度539℃-523℃(内部质点应力松弛停止的温度)。
2、转变点:相当于粘度为10∧12.6泊的温度,高于此点玻璃进入粘滞状态,开始出现塑性变形,力学性能开始迅速变化,相当于温度559-539℃(玻璃的许多物理性能如热容、密度、热膨胀系数、电导率在该粘度范围发生急剧变化。
这是玻璃结构发生了变化的缘故)。
3、退火点:大致相当于粘度10∧12泊的温度即应力能在几分钟消除的温度,也称为退货上限温度,相对于温度559℃.
4、变形点:相当于粘度10∧10-10∧11泊的温度范围,相对应温度609-583℃(对应于热膨胀曲线上的最高点的温度)。
5、软化温度:它与玻璃的密度和表面张力有关,相当于粘度2*10∧6—1.5*10∧7泊之间的温度。
密度约2.5g/cm3的玻璃相当于粘度为10∧6.6泊的温度软化温度大致相应于操作温度的下限,相对于温度764-716℃。
6、操作温度:相当于成型时玻璃的表面温度范围。
准备成型操作的温度,相当于粘度为3*10∧2—10∧3泊的温度,相对于温度1118----1013℃。
7、熔化温度:相当于粘度为10泊的温度,在此温度下能以一般要求的速度熔化。
玻璃粘度

退火点:玻璃在成型过程中,由于经受了剧烈的温度变化,使内外层产生温度梯度,并且由于制品的形状、厚度、受冷却程度等的不同,引起制品中产生不规则的热应力。
这种热应力能降低制品的机械强度和热稳定性,也影响玻璃的光学均一性,若应力超过制品的极限强度,便会自行破裂。
所以玻璃制品中存在不均匀的热应力是一个严重的缺陷。
退火是一种热处理过程,可使玻璃中存在的热应力尽可能消除或减小至允许值。
除玻璃纤维和薄壁小型空心制品外,几乎所有玻璃制品都需要进行退火。
玻璃制品中的热应力,按其存在的特点,分为暂时应力和永久应力两种。
软化点:在ASTM C-338(ASTM系美国材料与试验协会的英文缩写)中这样规定:长度为235mm、直径为0.65mm的玻璃纤维,上半部分100mm在炉子中以5±1℃的升温速率升温,当玻璃纤维的伸长速度达到1mm/min时温度即为Littleton(利特尔顿)玻璃软化点。
按照ASTM C-338方法测定玻璃软化点,具有速度快、操作简单、数据重复性好等优点,数据的精度在1℃以内。
特别注意:玻璃软化点是一个温度点,不是粘度点,玻璃软化点实际上不是粘度为107.6泊(4×107泊)时的温度;测定玻璃软化点,ASTM规定的方法只有玻璃纤维伸长方法,因为该方法的测试速度非常快,一个样品的测试一般只需5~10分钟,一个操作人员在8小时的工作时间内可以测试50个玻璃纤维样品,因此是被广泛使用的控制参数物质有晶体和非晶体之分。
只有晶体才有熔点,而非晶体有软化点。
软化点指非晶体达到一定温度时,不断加热,不断熔化。
熔点指物质达到一定温度时,一段时间内保持熔点温度不变,直至该晶体完全熔化再继续升温。
玻璃只有软化点,因为玻璃是一种非晶体。
玻璃粘度glass viscosity玻璃粘度glass viseosity玻璃熔体粘性的量度。
用刀表示,单位为帕·秒(Pa·s)。
玻璃粘度与玻璃的熔制、澄清、均化、成型、热处理、加工等过程有密切的关系。
玻璃的几种温度对应的粘度

玻璃的几种温度对应的粘度
1.应变温度
相当于粘度η=1012.5Pa·s的温度,即玻璃应力能在几小时内消除的温度。
2..转变温度
相当于η=1011.4Pa·s的温度,即玻璃在这一温度时的折射率、比热容、热膨胀系数等部分物理性质都会发生突变的温度。
3.退火温度
相当于粘度η=1011.0Pa·s的温度,即玻璃应力能在几分钟内消除的温度。
4.变形温度
相当于粘度η=109—10Pa·s的温度。
5.软化温度
相当于粘度η=3×106—1.5×107Pa·s时的温度。
一般将106.6Pa·s粘度的温度定义为软化温度,实际测定时的软化温度是指在每分钟5℃的升温速率下,试样由于自重而发生形变,使伸长速度达到每分钟1mm时的温度,用Tf表示,相当于成型温度下限的粘度。
6.成型范围
相当于成型时玻璃液表面的温度范围,其上限10—102Pa·s(或102—103Pa·s)的温度,是成型操作的上限温度。
一般操作范围的粘度在102—105.5Pa·s间
7.熔化温度
相当于粘度η=1Pa·s的温度,在此温度下玻璃能以一般要求的速度熔化。
玻璃常用的几种温度对应的粘度

玻璃常用的几种温度对应的粘度
1. 应变温度
相当于粘度η=1012.5Pa·s的温度,即玻璃应力能在几小时内消除的温度。
2..转变温度
相当于η=1011.4Pa·s的温度,即玻璃在这一温度时的折射率、比热容、热膨胀系数等部分物理性质都会发生突变的温度。
3. 退火温度
相当于粘度η=1011.0Pa·s的温度,即玻璃应力能在几分钟内消除的温度。
4. 变形温度
相当于粘度η=109—10Pa·s的温度。
5.软化温度
相当于粘度η=3×106—1.5×107Pa·s时的温度。
一般将106.6Pa·s 粘度的温度定义为软化温度,实际测定时的软化温度是指在每分钟5℃的升温速率下,试样由于自重而发生形变,使伸长速度达到每分钟
1mm时的温度,用Tf表示,相当于成型温度下限的粘度。
6.成型范围
相当于成型时玻璃液表面的温度范围,其上限10—102Pa·s(或102—103Pa·s)的温度,是成型操作的上限温度。
一般操作范围的粘度在102—105.5Pa·s间
7 .熔化温度
相当于粘度η=1Pa·s的温度,在此温度下玻璃能以一般要求的速度熔化。
玻璃工艺学2粘度与表面张力讲解

2.化学键的强度 其他条件相同时化学键越强粘度越大。 R2O-SiO 2中R+使粘度降低 (1)O/Si 高时 负离子团呈孤岛状,网络需 R-O 连接,
键强大? ? 大。 ? Li > ? Na > ? K
(2)O/Si 低时 网络较完整, R+主要起断网作用, 3.阳离子极化力 Li + 对 Ob的极化作用强, ? Li < ? Na < ? K 阳离子极化力大,减弱硅氧键的作用强,使 ? 降低。 非惰性气体型阳离子极化力 > 惰性气体型 如Pb2+、Cd 2+、Sn2+、Bi3+、Zn 2+、Co 2+等均可降低粘度。
4.热加工 烧口 火抛光
八、玻璃的润湿能力和润湿角 ? lg
三力平衡时
? sg= ? lgcos? + ? sl
?
? 为润湿角
? =0完全浸润
? sg
? sl
? 小利于封接
规律:?固体表面氧化程度低 ? 润湿好
?T?? 润湿性好
?同价离子r 小? 润湿性好 K<Na<Li
?气体介质 氧气、空气中好( ?小)
进一步吸附水
Si-O-H
O
H H
Si-O-R+H 2O? SiOH+ROH
若ROH 被冲去,则表面比内部缺少 R+
HH OO
Si Si
3.表面性质
?强度 表面微裂纹使强度 ? 。H+取代R+使表面产生 张应力,常会产生微裂纹。
?表面析晶能力强 4.玻璃的表面反应
(1)水化反应 硅羟团的生成及其对水的进一步吸附。 (2)与各种试剂反应
玻璃导热系数计算表
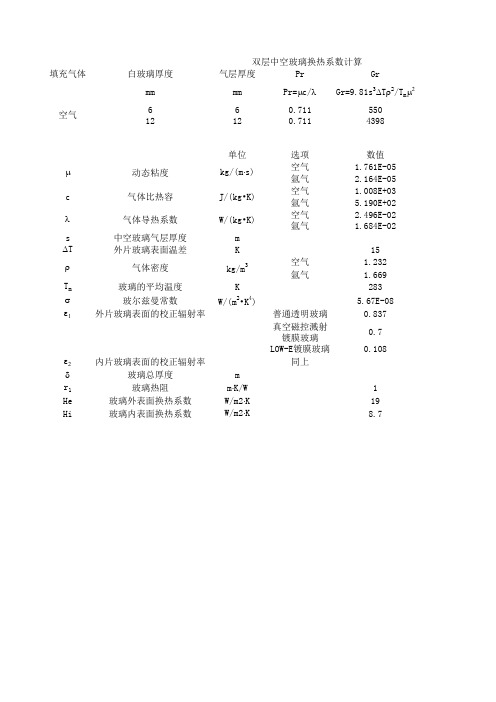
填充气体白玻璃厚度
气层厚度Pr Gr
mm
mm Pr=m c/l Gr=9.81s 3
D T r 2
/T m m
2
66
0.71155012
12
0.711
4398
单位
选项数值空气 1.761E-05氩气 2.164E-05空气 1.008E+03氩气 5.190E+02空气 2.496E-02氩气 1.684E-02s 中空玻璃气层厚度m D T 外片玻璃表面温差
K 15空气 1.232氩气
1.669T m 玻璃的平均温度K 283s 玻尔兹曼常数
W/(m 2•K 4)
5.67E-08e 1
外片玻璃表面的校正辐射率
普通透明玻璃0.837真空磁控溅射镀膜玻璃0.7LOW-E镀膜玻璃
0.108
e 2内片玻璃表面的校正辐射率
同上
d 玻璃总厚度m r 1玻璃热阻
m ⋅K/W 1He 玻璃外表面换热系数W/m2⋅K 19Hi
玻璃内表面换热系数
W/m2⋅K
8.7
r 气体密度
kg/m 3
kg/(m ⋅s)动态粘度m 双层中空玻璃换热系数计算
c 气体比热容J/(kg•K)气体导热系数W/(kg•K)
l 空气
Nu Hg HT Hs1/Ht
Nu= 0.035(GrPr)0.38如计算结果Nu<1,取Nu=1Hg=Nu l/s HT=4s(1/e
1
+1/e2-1)-1T m3Hs=Hg+HT1/Ht=1/Hs+d/r1
0.338 4.16 3.707.860.139 0.745 2.08 3.70 5.780.197
U
U=1/(1/He+1/Hi+1/Ht)
3.259
2.743。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
lg = +
T
2.1 玻璃的黏度 2.1.3 黏度与熔体结构的关系(掌握)
对硅酸盐熔体 ☺ 存在着大小不同的硅氧四面体群或络合阴离 子,它们在玻璃中存在着不同的结构,该结构与 温度有很大的关系。 ☺ 熔体中的硅氧四面体群有较大的空隙,可容纳 小型的硅氧四面体群穿插活动。高温时空隙较多、 大,有利用小型的穿插活动。则η↓。 ☺ 碱金属和碱土金属以离子状态存在,高温 时,它们较自由移动并且有减弱硅氧键的作用, 则η↓。当温度↓时,上述作用↓并且使硅氧四 面体由小变大,则η↑。
B 2O 3
2.1 玻璃的黏度
总结 氧化物组成对玻璃粘度作用可归纳如下 ☺ SiO2 Al2O3 ZrO提高粘度。 ☺ K2O Na2O 降低粘度,Li2O高温时降低 粘度,低温时增加粘度。
☺ RO降低高温粘度,增加低温粘度。 碱土金属离子对黏度增大的顺序为:
2
Mg
☺
Caቤተ መጻሕፍቲ ባይዱ
2
Sr
2
Ba
2.1 玻璃的黏度
图中分三个温度区
A区:温度较高,表现为典型 的黏性液体,其弹性性 质近于消失。黏度决定 于玻璃的组成和温度。 B区:(转变区)黏度、弹性模量随温度的↓而↑↑。 黏度与组成、温度和时间有关。 C区:温度↓而弹性模量↑,黏滞流动变得非常小。 黏度决定于组成和温度,与时间无关。 表4-1
第2章 玻璃的黏度及表面性质
2.1 玻璃的黏度 2.2 玻璃的表面张力 2.3 玻璃的表面性质
2.1 玻璃的黏度
2.1.1 概念(熟悉) 2.1.2 黏度与温度的关系(掌握) 2.1.3 黏度与熔体结构的关系(掌握) 2.1.4 黏度与玻璃组成的关系(掌握) 2.1.5 黏度参考点(熟悉)
2.1 玻璃的黏度 2.1.1 概念(熟悉)
PbO CdO Bi2O3 SnO等降低粘度。
2.1 玻璃的黏度 2.1.5 黏度参考点(熟悉)
粘度参考点:在玻璃温度-粘度曲线上,存在着 一些有代表性的点。 (1) 应变点:η=1013.6,即应力在几小时内消除 的温度。 (2) 转变点(Tg): η=1012.4Pa·S的温度。 (3) 退火点: η=1012Pa·S的温度,应力在几分 钟内消除。 (4) 变形点: η=1010~1011Pa·S的温度范围。 (5) 软化温度(Tf): η=3×106~1.5×107 Pa·S的温度范围,相当于操作温度的下限
黏滞流动:在外力作用下,玻璃液中的结构组 份(离子或离子基团)发生流动,如 该流动以占据结构空位的方式来进 行的,称~ 发生黏滞流动的条件:外力>内磨擦阻力 黏度又称黏滞系数,是流体抵抗流动的量度。
式中:η为黏度,单位为Pa·s
dV f S dx
2.1 玻璃的黏度 2.1.2 黏度与温度的关系(掌握)
• 所有实用硅酸盐玻璃,其黏度随温度的变化规 律属于同一类型。
• 在η =10-1011Pa·S范围内,粘度由温度及化学 组成所决定; • 在η =1011-1014Pa·S范围内,粘度与时间有关。 注:生产上常把玻璃的粘度随温度变化的快慢 称为玻璃的料性。粘度随温度变化快的玻 璃称为短性玻璃,反之称为长性玻璃。
2.1 玻璃的黏度
(6) 操作范围:相当于成形时玻璃液表面的温 度范围。T上限~T下限, T上限指准备成形操 作的温度; T下限指成形时能保持制品形状 的温度;η=103~106.6Pa·S (7) 熔化温度:η=10Pa·S (8) 自动机供料的黏度:102~103Pa·S 表4-4
黏度按Li2O-Na2O-K2O依次递减 (3)离子极化:离子极化力大的阳离子对桥氧的极化 力强,使得Si-O键作用减弱,网络 结构易于调整与移动,使η↓。
说明
非惰性气体型(外层电子数不充满) 阳离子的极化比惰性气体型的大。
2.1 玻璃的黏度
(4)结构对称性:网络基本结构单元的结构不对称, 可能在结构中存在缺陷或弱点, 使结构不稳定,粘度下降。 (5)配位数:4配位形成四面体进入网络结构,使结 构紧密,粘度增大。其它配位时就从网 络中分离出来,使黏度降低。如B2O3 和A2O3 当B3+是4配位时形成[BO4]时,黏度增大,而当6配 位形成八面体或3配位形成三角体时,黏度降低。 硼反常现象:由硼离子配位数变化引起性能曲线上出 现转折的现象,称为“硼反常现象”。
2.1 玻璃的黏度 2.1.4 黏度与玻璃组成的关系(掌握)
氧硅比 键强 离子极化 结构对称性 配位数 (1)氧硅比 氧硅比大(如熔体中碱含量增大,游离氧增 多),非桥氧多,网络结构不牢固,熔体黏 度减小;反之增大。(表4-3 )
2.1 玻璃的黏度
(2)键强:在其它条件相同的前提下,粘度随阳离 子与氧的键强增大而增大。 R2O-SiO2玻璃
