蒸 馏
蒸馏

D. 真空装置 真空装置:
根据实验要求,即根据所分离的液体的沸点, 根据实验要求,即根据所分离的液体的沸点,选择不同 真空度大小的真空泵。真空度越高,操作越烦琐, 真空度大小的真空泵。真空度越高,操作越烦琐,能用水泵 不用油泵。 不用油泵。 水泵:一般不需要附加干燥装置,只需安全瓶即可。 水泵:一般不需要附加干燥装置,只需安全瓶即可。 油泵:一般要加一个干燥塔装置,如固体氢氧化钠, 油泵:一般要加一个干燥塔装置,如固体氢氧化钠,固 体氯化钙等,同时需要连一个冷阱。 体氯化钙等,同时需要连一个冷阱。 高真空泵:连安全瓶、 装置(三个干燥塔); 高真空泵:连安全瓶、冷阱和保护 装置(三个干燥塔); 泵油常更换(至少1次 月 泵油常更换(至少 次/月)。 麦氏表(转动式) 麦氏表(转动式)
还是液体,只要在 l00℃左右具有一定的蒸气压,即有一定的 还是液体, ℃左右具有一定的蒸气压, 挥发性时,若与水在一起加热就能与水同时蒸馏出来, 挥发性时,若与水在一起加热就能与水同时蒸馏出来,这就 称为水蒸气蒸馏。 称为水蒸气蒸馏。
要求: 被分离物质不溶或微溶于水--先决条件。 --先决条件 要求 1. 被分离物质不溶或微溶于水--先决条件。
P总= P水+ Ps
水蒸气蒸馏冷凝液中,两种物质的相对质量( 水蒸气蒸馏冷凝液中,两种物质的相对质量(也是蒸 气中相对质量)与他们的蒸气压和相对分子量成正比。 气中相对质量)与他们的蒸气压和相对分子量成正比。
nA pA = nB pB
(二)简单蒸馏装置及操作
1. 蒸馏装置
A
普 通 蒸 馏 装 置
B. 空气冷凝蒸馏装置
B
C. 简单蒸馏装置 C
2. 蒸馏操作
(1)温度计测量度要高于沸点 -20℃,不宜高出太多。范围 )温度计测量度要高于沸点10- ℃ 不宜高出太多。 越大,精度越差。温度计位置* 越大,精度越差。温度计位置 (2)蒸馏瓶:液体在蒸馏瓶中的量不应超过其体积 ,使沸腾 )蒸馏瓶:液体在蒸馏瓶中的量不应超过其体积2/3, 的面积足够大。若超出, 的面积足够大。若超出,沸腾液体雾滴易被蒸汽带到接收 系统,沸腾强烈时,液体可冲出。蒸馏之前加沸石防暴沸。 系统,沸腾强烈时,液体可冲出。蒸馏之前加沸石防暴沸。 (3)冷凝管:直形冷凝管与空气冷凝管最为普遍。 )冷凝管:直形冷凝管与空气冷凝管最为普遍。 bp.<150℃蒸馏时,选用直形冷凝管。直形冷凝管长短 ℃蒸馏时,选用直形冷凝管。 决定于蒸馏液体的沸点: 越低 蒸汽不易冷凝, 越低, 决定于蒸馏液体的沸点:bp越低,蒸汽不易冷凝,故需长 冷凝管。 越高,蒸汽易冷凝,需短冷凝管; 冷凝管。bp. 越高,蒸汽易冷凝,需短冷凝管; bp.>150℃考虑用空气冷凝管,因为蒸汽温度较高,遇 ℃考虑用空气冷凝管,因为蒸汽温度较高, 冷循环水往往发生炸裂。 冷循环水往往发生炸裂。
化工原理09--蒸馏

层 塔 板上 上层 升塔 蒸板 汽下 的降 组液 成体 间的 的组 关成 系和 下
操 作 线 方 程 的 物 理 意 义 :
提馏段操作线方程
31
一精馏塔用于分离乙苯-苯乙烯混合物,进料量 3100kg/h,其中乙苯的质量分率为0.6,塔顶、底 产品中乙苯的质量分率分别要求为0.95、0.25。 求塔顶、底产品的质量流量、摩尔流量。
1、保持回馏比恒定 根据精馏段的操作线 方程,其斜率不变。
斜率 =R/R+1
xwe
xw1
xde
xd1
2、保持馏出液组成恒定
因回流比不断增大, 精馏段操作线的截 距不断减小。
63
xwe xw1
xd
第六节
特殊精馏
一、水蒸气蒸馏:
用于易分解而与水又 不互溶,或要求分离 压力不易达到的体系。 d 在分离的气相: P=pA+pw f
47
48
3、逐板计算法求理论塔板数:
平衡关系: y=x/(1+( -1)x),x=y/(y+ (1-y))
精馏段操作线方程: y=Rx/(R+1)+xD/(R+1)
提馏段操作线方程: y=L’x/(L’-W)+L’xW/(L’-W)
反复使用平衡关系和操作线关系即可求得理论塔板数
y1=xD 平衡关系 精馏段操作线方程 y’1 提馏段操作线方程 y2 x1 x2
组成量的关系满足 杠杆定律。
17
简单蒸馏的计算: 蒸馏釜的生产能力,根据热负荷 和传热能力 计算。 馏出液、残液的浓度与馏出量(或残留量) 之间的关系。
物料衡算 相平衡关系
18
三、简单蒸馏的计算: 在釜内某一瞬时,液体量为W,经微分时间dt 后,残液量为(W-dW),液相组成由x降为 (x-dx),气相组成为y。 对dt时间作易挥发组分的物料衡算: Wx=(W-dW)(x-dx)+ydW dW = dx W y-x 积分限为W=W1,x=x1;W=W2,x=x2, 1、溶液为理想溶液,得: lnW1/W2 =[1/(-1)] ln[x1(1-x2)/x2(1-x1)]+ln[1-x2/1-x1] 由:x1=A1/W1, x2=A2/W2 得:A1/A2=(B1/B2) W1=A1+B1,W2=A2+B2
蒸馏定义及特点(精)

2、按操作压力分为加压、常压和真空蒸馏
常压下为气态(如空气、石油气)或常压下泡点为室温 的混合物,常采用加压蒸馏;常压下,泡点为室温至 150℃左右的混合液,一般采用常压蒸馏;对于常压下泡 点较高(一般高于150℃)或热敏性混合物(高温下易发生分 解,聚合等变质现象),宜采用真空蒸馏,以降低操作温 度。
精馏是利用混合液中各组分间挥发度 的差异以实现高纯度分离的一种操作。平 衡蒸馏仅通过一次部分汽化和冷凝,只能 部分地分离混合液中的组分,若进行多次 的部分汽化和部分冷凝,便可使混合液中 各组分几乎完全分离。
一、精馏原理
工业上是将上图的每个分离器做成一块;或在一个圆形的塔内 装有一定高度的填料。板上液层或填料表面是汽液两相进行传热和 传质的场所。
所谓泡点是指液体在恒定的外压下,加热至开始出 现第一个气泡时的温度。露点是指气体冷却时,开始凝 聚出第一个液滴时的温度
3、按被分离混合物中组分的数目可分为两组分 精馏和多组分精馏
工业生产中,绝大多数为多组分精馏,但两 组分精馏的原理及计算原则同样适用于多组分精 馏,只是在处理多组分精馏过程时更为复杂些, 因此常以两组分精馏为基础。
4.按操作流程分为间歇蒸馏和连续蒸馏 间歇蒸馏主要应用于小规模、多品种或某些
有特殊要求的场合,工业中以连续蒸馏为主。间 歇蒸馏为非稳态操作,连续蒸馏一般为稳态操作。
三、精馏操作流程
精馏分离过程可连续操作,也可间歇操作。 精馏装置系统一般都应由精馏塔、塔顶冷凝器、 塔底再沸器等相关设备组成,有时还要配原料预 热器、产品冷却器、回流泵等辅助设备。
2.2 简单蒸馏和平衡蒸馏
对于组分挥发度相差较大、分离要求 不高的场合(如原料液的组分或多组分的初 步分离),可采用简单蒸馏和平衡蒸馏。
蒸馏

当αAB =1时, yA = xA , 组分A在气液相中的浓度相等,混合液就不能用普通 蒸馏的方法加以分离。
(4) 用相对挥发度表示气液平衡关系:
α=
yA / (1 – yA )
将此式加以变形,则可写为:
xA / (1 – xA )
yA = αxA 1+(α–1) xA
-------用α表示的理想溶液的平衡气液关系
D
DxD FxF
100%
塔底难挥发组分回收率:
W
W (1 xW ) 100% F (1 xF )
书120页例题
三、操作线方程:
1、精馏段操作线方程
选精馏段n+1层以上为衡算范围: 对所有的物料:
V LD
对易挥发组分:
Vyn1 Lxn DxD
即:
yn1
L V
xn
把拉乌尔定律应用在双组分理想溶液中,设双组分理想溶液由A、B两种 组分组成,则 PA= PA* xA ;PB= PB*xB ,对双组分溶液 xB =1 - xA , 设溶液
上方蒸汽的总压为P,A、B组分的蒸汽分压为PA、 PB,则
P = PA+PB = PA* xA + PB*xB , P = (PA* - PB* ) xA + PB* ,
2. y-x相图:
y-x相图表示在一定压力下,液相组成x和与x 相平衡的气相组成y的关系 。
x-y 图可通过 t-x-y 图作出 ,图中对角线 (y=x) 为 一参考线。 大多数溶液,两相平衡时
,y 总是大于 x,平衡线
位于对角线上方。 平衡线偏离对角线越远, 该溶液越易分离。 恒沸点时,x-y 线与对角 线相交,该点处汽液相组 成相等。
蒸馏

FiF V ' I Li VI L'i
F V 'L V L'
加料板(2)
L'L I iF
F I i
若定义:
q
L'L F
1koml原料变成饱和蒸汽 原料的摩尔汽化潜热
可得:L‘=L+qF V=V’+(1-q)F
q线方程
在进料板上,同时满足精馏段和提馏段的物料衡算, 故两操作线的交点落在进料板上。当q为定值,改变塔操 作的回流比时,两操作线交点轨迹即q线。联立两操作线 方程式的进料线方程。
第五章
蒸馏
第一节 概 述
一、蒸馏操作在化工生产中的应用 用于均相液 体混合物的分离,以达到提纯或回收某组分的目 的。 二、蒸馏分离的依据 蒸馏过程是利用流体混合 物中各组分挥发能力的差异,则将混合物进行分 离的单元操作。 三、蒸馏的分类
1、按操作方式:间歇蒸馏和连续蒸馏。 2、按蒸馏方法:简单蒸馏、平衡蒸馏(闪蒸) 精馏、特殊精馏。
F,iF,xF
ym,I,V
加料板(1)
xn-1,i,L
ห้องสมุดไป่ตู้
1.加料的热状态:五种
第 2.理论板加料
m 料衡算式:
块 板
FxF V ' ym1 Lx m1 Vym L' xm
ym+1,I,V' xm,i,L'
单板物料与热量衡算
相平衡方程: ym f (xm ) 3.精馏段与提馏段的两 相物流关系
恒摩尔流假定成立的条件 (1)各组分的摩尔气化潜热相等。 (2)气液接触时因温度不同而交换的显热可以 忽略。 (3)塔设备保温良好,热损失可以忽略不计。
三种蒸馏法详解

三种蒸馏法详解蒸馏可以分为3种蒸馏,⽔中蒸馏、⽔上蒸馏和⽔蒸⽓蒸馏当然论坛⾥各位友友们发的⾃制纯露帖⼦⼤多数都是使⽤的⽔中蒸馏这个三种蒸馏各有各的特点:㈠.⽔中蒸馏:(这个类似于煮粥,就是把需要蒸馏的植物,放在⽔中蒸馏)优点:①提取速度较快②对于芳⾹物质不容易蒸馏出来的植物,可以加快蒸馏速度缺点:①芳⾹物质会有浪费(因为植物在⽔中浸泡着,所以芳⾹物质会有⼀部分留在⽔中,不能被提取出来)②对提取出的芳⼼物质的品种损耗⼤(因为植物长时间在100度的⽔中浸泡着,有损芳⾹物质)适⽤于提取细胞壁较厚的植物原料或者价钱廉价的,如松针等㈡.⽔上蒸馏:(这个类似于蒸馒头,就是把需要蒸馏的植物,放在⽔上⽅蒸馏)优点:①提取出的芳⼼物质品质好②对于芳⾹物质较易蒸馏出来的植物,可以加快蒸馏速度缺点:①芳⾹物质会有少量浪费(因为植物在⽔上⽅,会有部分芳⾹物质随⽔滴滴回⽔中,所以有少量芳⾹物质留在⽔中,不能被提取出来)②对提取出的芳⼼物质的品种损耗较⼩植物(因为植物没有在100度的⽔中浸泡着,所以对芳⾹物质损耗较⼩)适⽤于提取细胞壁较薄的植物原料,如花瓣较厚的花等㈡.⽔蒸⽓蒸馏:“这个没想到怎么打⽐⽅”,就是把需要蒸馏的植物,和⽔分开在两个容器中,直接是⽔产⽣⽔蒸⽓然后⽔蒸⽓进⼊到装有需要蒸馏的植物的容器中蒸馏)优点:①提取出的芳⼼物质品质属于蒸馏法中最好的②蒸馏速度快③对于芳⾹物质较易蒸馏出来的植物,蒸馏速度更快④国际上蒸馏植物提取精油主流的蒸馏⽅式⑤芳⾹物质浪费量极少(因为植物与⽔分开的原因)⑥对提取出的芳⼼物质的品种损耗最⼩(因为植物与⽔分开原因)缺点:①略微有点⿇烦(因为多了个装花草的容器)②对于芳⾹物质不容易蒸馏出来的植物需要萃取的时间较长适⽤于提取玫瑰花薄荷叶等绝⼤部分常⽤来提取精油和纯露的植物当然友友们常⽤来做纯露的都是⼀些花瓣之类的了对于花、叶等的蒸馏,就推荐⼤家⽤⽔上蒸馏法吧,⽐⽔蒸⽓蒸馏差点,但是会⽐⼤家常⽤的⽔中蒸馏法好很多哦⽽且也不⿇烦,只是需要把花草放在⽔上⽅,提取出的芳⾹物质的品质和量就会有⼤幅的提升,那我们可是没理由不使⽤哦希望⼤家会⽀持。
蒸馏

蒸 馏蒸馏操作是分离液体混合物或液态气体混合物的常用单元操作。
它是以液体混合中各组分在相同操作条件下沸点(挥发度)的不同为依据,通过加入热量或取出热量的方法,使混合物形成气、液两相系统,气、液两相在相互接触中进行热量、质量传递,使易挥发组分在气相中增浓,难挥发组分在液相中增浓,从而实现互溶液体混合物分离的方法称为蒸馏。
蒸馏操作的依据:液体混合物中各组分沸点(挥发度)的差异;分离的条件:必须造成气、液两相系统。
轻组分(易挥发组分):液体混合物中沸点较低的组分容易汽化,称为轻组分。
重组分(难挥发组分):沸点较高的组分不易汽化,称为重组分。
馏出液:蒸馏所得到的蒸气冷凝后生成的液体称为馏出液。
馏出液中,轻组分的浓度较高。
残液(釜液):残留的液体称为残液。
残液中,重组分的浓度较高。
例如:在常压下,苯的沸点是80.1℃,甲苯的沸点是106℃,将苯和甲苯的混合液进行蒸馏时,苯是易挥发组分或轻组分,甲苯是难挥发组分或重组分,馏出液中:含高浓度的苯;残液中:含高浓度甲苯使苯和甲苯的混合液得以分离。
根据蒸馏操作的不同特点,蒸馏可以有不同的分类方法。
① 按蒸馏操作方式分类:可分为简单蒸馏、精馏和特殊精馏。
简单蒸馏适用于易分离物系或对分离要求不高的场合;精馏适用于难分离物系或对分离要求较高的场合;特殊蒸馏包括水蒸气蒸馏,恒沸蒸馏,萃取蒸馏,特殊精馏适用于普通精馏难以分离或无法分离的物系。
工业生产中以精馏的应用最为广泛。
② 按操作流程分类:可分为间歇蒸馏和连续蒸馏。
间歇蒸馏多应用于小规模生产或某些有特殊要求的场合。
工业生产中多处理大批量物料,通常采用连续蒸馏。
③ 按物系中组分的数目分类:可分为双组分蒸馏和多组分蒸馏。
工业生产以多组分蒸馏最为常见。
④ 按操作压强分类:可分为常压蒸馏、减压蒸馏和加压蒸馏。
工业生产中一般多采用常压蒸馏。
对在常压下物系沸点较高或在高温下易发生分解、聚合等 易变质的物系,常采用减压蒸馏。
对常压下物系的沸点在室温以下的混合物或气态混合物,则采用加压蒸馏。
什么是蒸馏

什么是蒸馏蒸馏作为化学实验中不可缺少的技术手段,令许多实验室对他都不陌生。
在生活中,它被用来获取蒸馏水,去除水中杂质,化解混合液,而在实验室中,则往往用来小颗粒物的分离和水合物的纯化。
面对蒸馏这项技术,你了解多少呢?下面就列出3-5项,为大家讲解蒸馏的基本内涵和相关实验中的应用技巧。
1. 什么是蒸馏?蒸馏是一种在化学实验中常用的技术手段,旨在通过把混合物经过加热分解,获得不饱和溶液或饱和溶液;通过改变溶剂蒸发沸点来实现混合液中分子的分离,最终获得混合物中两个或多个组分的精确分离。
2. 蒸馏的工作原理蒸馏是一种气液不断相互交替的过程,主要由加热、蒸发和冷却三个过程组成,反复运作以达到分离物质的目的,即:当溶剂被加热到它的沸点时,其中的部分溶质会被蒸发;再把其中的蒸汽通过管子,被冷却到凝华状态,使其分离出最终的混合液,从而实现了物质的分离。
3. 蒸馏的主要应用蒸馏在化学实验中有广泛的应用,其中包括:* 蒸发分离:在有机合成实验中,常用它来去除溶剂中的混杂物,以提高合成物的纯度;* 精馏分离:该过程能有效的提高混合物中化合物的纯度,常用其分离耦合反应产物中的一组杂质。
* 提取方法:也称温和搅拌法,将混合液的一组物质溶于某些溶剂中分离出来;* 溶剂汽提法:也称气溶胶萃取,主要应用于汽柱中沉淀物的抽查或物质的分离净化;* 减压蒸馏:可以利用减压蒸馏实现低沸点、极性、易老化物质的分离;* 改性蒸馏:又称蒸熏蒸馏,主要应用于膦酸盐类和硫酸盐类的分离,也可以用于生物化学中蛋白质的分离等。
4. 传统蒸馏与蓝牙蒸馏的不同传统蒸馏和蓝牙蒸馏都是为获得精确的物质分离和纯化而实施的技术,但两种方法分别具有不同的特点:* 传统蒸馏:传统蒸馏使用笨重的设备,受工作环境的影响较大,容易受室温变化的影响,影响精确度;* 蓝牙蒸馏:蓝牙蒸馏采用蓝牙智能技术,不受外界因素影响,即使遇到室温变化,也能保持蒸馏过程的稳定性,具有很高的精确度。
第二节蒸馏方式

3)加料板(原料液进入的那层塔板)把精馏塔 分为两段:
① 精馏段:加料板以上的塔,即塔上半部完成了
上升蒸汽的精制,即除去其中的难挥发组分,因
而称为精馏段。 ② 提馏段:加料板以下(包括加料板)的塔的下半部 完成了下降液体中难挥发组分的提浓,即除去了易挥 发组分,因而称为提馏段。 一个完整的精馏塔应包括精馏段和提馏段。
L xW
y D (1 V / F ) x W x F
令液相分率为q=L/F;则汽相分率为V/F=1-q,代入上式:
yD q q 1 xW xF q 1
V yD
1)总物料衡算:
yD q q 1 xW xF q 1
P F xF 高温 高压 t
2)相平衡关系:
xW
1 ( 1 ) x W
液体在填料表面展为液膜,流下时又汇成液滴, 当流到另一填料时,又重展成新的液膜。当气 相从塔底进入时,在填料孔隙内沿塔高上升, 与展在填料上的液膜连续接触,进行传质,使 气、液两相发生连续的变化,故称填料塔为微
分接触设备。
4、精馏条件
1) 设备条件:理论塔板(平衡级),多层塔板提供 汽液多次接触传质场所。 2) 回流条件:塔顶设置冷凝器提供液相回流, 塔底设置再沸器提供汽相回流。
饱和液相
x0 t0 L
y V t
y y0
B T0 t t0 x t-x
t-y
分离场所
B A
x x0
A y0 x0 y
y0 T0 V x L t 要求T0 >t0
2.精馏原理及流程
高纯度A 液相 汽相
冷凝器
精馏是利用 回流手段、经 过多次平衡级, 使物系实现高 纯度分离的操 作。
平衡级
化工原理-蒸馏

0
x或y
量 浓度差
L2
A 即:液相量L1=汽相量L2
pA A pA0
1 xA
A
t
§9.2 二元物系的汽液相平衡
说明:
(1)相平衡曲线必落在对角 线的上方;Why? 因为yx
y1
y x 1( 1)x
(2) 越远离1,也就愈
有利于蒸馏操作---------- y
越大,相平衡曲线偏离对
vA
pA xA
vB
pB xB
显 然 对 理 想 溶 液 , 根 据 拉 乌 尔 定 律 有 :
Ap0 A,BpB 0
什 么 是 相 对 挥 发 度 ?
相对挥发度 v A vB
pA pB
xA xB
yA xA yB xB
显然对理想溶液,有:
p
0 A
p
0 B
y x 1( 1)x
满 足 理 想 气 体 状 态 方 程 、 道 尔 顿 分 压 定 律
1、理想溶液
p A P A yp B P BP y p A p B
在全部浓度范围内都服从拉乌尔定律的溶液称为理想溶液。
在组分A、B组成的理想溶液中,则有: fAAfBBfAB
只有物性和结构相似,且分子大小也相近的物系才符合 拉乌尔定律,如苯-甲苯、甲醇-乙醇、烃类同系物组成 的溶液等等
t gy
溶 液 ( A+B) 加热
pAP yfx,t 在 一 定 的 温 度 下 pAfx
p B P 1 y g x ,t
pBgx
§9.2 二元物系的汽液相平衡 一、理想物系的汽液相平衡
汽 相 为 理 想 气 体 、 液 相 为 理 想 溶 液 的 体 系 , 称 为 。
第4讲 蒸馏

6.下列关于利用蒸馏法淡化海水的说法正确的是( ) A.蒸馏时应将温度计插入海水中 B.蒸馏时冷水的流向应由上而下 C.利用此法淡化海水获得淡水质量高,但能耗大 D.蒸馏时温度计位置应在离液面 2~3 cm 处
C [ 蒸馏时,温度计水银球处于支管口处;冷却水从下口进上口出。]
7.选择下列合适的实验方法分离或除杂,将相应序号填在横线上。
1210
Hale Waihona Puke (1)若已知 A 与 C 不发生反应,且均不与水反应。
①欲从 A、C 的混合物中分离提纯 C,需进行的操作: a 溶解;b__过__滤____(填操作名称,下同);c__蒸__发__结__晶___。
②上述 a、b、c 操作过程中均需用到的一种玻璃仪器为 _玻__璃__棒___。
(2)从 B 的水溶液中分离出 B 的操作名称为___蒸__馏___。
用自来水制取蒸馏水
• 自来水中含有Cl-,蒸馏水中是否 也含有Cl-呢?
• Cl-的检验 HCl+AgNO3=HNO3+AgCl↓ CaCl2+2AgNO3=Ca(NO3)2+2AgCl↓ NaCl+AgNO3=NaNO3+AgCl↓
Na2CO3+2AgNO3=2NaNO3+Ag2CO3↓ Ag2CO3+2HNO3=2AgNO3+H2O+CO2↑
A.加热升华法 C.蒸发浓缩、冷却结晶 E.蒸馏法 G.点燃法
B.蒸发结晶 D.分液法 F.过滤法 H.洗气法
(1)分离沙子和碘的混合物_______________________________________。 (2)除去 CO 中的 CO2_____________________________________________。 (3)分离水和苯的混合物_________________________________________。 (4)分离酒精和水_______________________________________________。
蒸馏

一、简单蒸馏与平衡蒸馏 1、简单蒸馏 2、平衡蒸馏(闪蒸)
特点:简单蒸馏和平衡蒸馏——
一次部分汽化
二、精馏原理
精馏——多次部分汽化与多次部分冷凝
一次汽化与一
次冷凝的t-y-x图
y3
y 2
B
x x2 x1 3
tF
2 x3 x
y3
A
x1 x2
对角线
y=x 为辅助曲线
y-x曲线上各点具有不同
的温度;
平衡线离对角线越远,挥 发性差异越大,物系越易分 离。 0 即:在一定压力下,给出一个物质A在液相 pA yA x A 浓度x,其在饱和状态时(温度),则A在汽 p总 相中的浓度y?
上次课内容
蒸馏的概念:蒸馏、精馏、轻(重)组分,简 单蒸馏、平衡蒸馏,二组分蒸馏,常压蒸馏等 纯组分的饱和蒸汽压 (平衡时) 理想液体液体混合物平衡时上方蒸汽压(拉乌 尔定律) pA=pA0·A x t-y-x图(两条线,三个区域) 温度上升及下降时变化 0 0 0 p pB p A p pB t-y-x x xA 0 0 y p A pB 0 0 p p A pB x 汽液平衡关系式 y 1 ( 1) x
两式相减
Vy Lx Dx D
——两操作线的原始方程
(V V ) y ( L L) x ( DxD WxW )
而我们知
DxD WxW FxF
整理后得:
( L L qF )
'
(V ' V (q 1) F )
——q线方程 例7-3p269
上次课内容
y 1 y
蒸馏
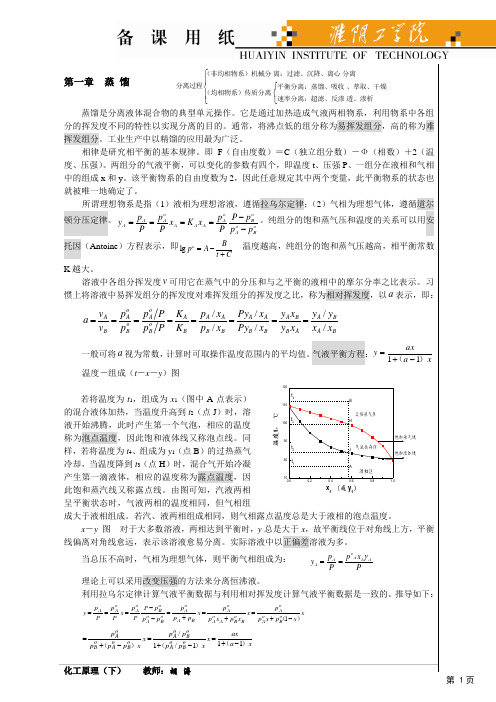
q 线方程或进料方程: y q x xF
q 1 q 1
,代表两操作线交点的轨迹方程,是通过点(xF,xF)
的直线,其斜率为 q 。图解理论板层数的方法称为麦克布-蒂利法,简称 M-T 法。
q 1
有时从塔顶出来的蒸气先在分凝器中部分冷凝,冷凝液作为回流,未冷凝的蒸气再用全凝器 冷凝,凝液作为塔顶产品。因为离开分凝器的气相与液相可视为互相平衡,故分凝器也相当于一 层理论板。此时精馏段的理论板层数应比相应的梯级数少一。
精馏塔内装有若干层塔板或填充一定高度的填料,还需要塔底再沸器和塔顶冷凝器。再沸器
的作用是提供一定量的上升蒸气流,冷凝器的作用是提供塔顶液相产品及保证有适宜的液相回流,
因而精馏塔能连续稳定地进行。
n 层塔板附近(上层 n-1;下层 n+1):tn+1>tn-1;xn<xn-1;yn>yn+1 。即离开第 n 板的液相中易 挥发组分的浓度较加入该板时的减低,而离开的气相中易挥发组分浓度又较进入的增高。
90
t
2
J
80 t
1
A
70
0.0
0.2
0.4
0.6
0.8
1.0
x
y
1
1
成大于液相组成。若汽、液两相组成相同,则气相露点温度总是大于液相的泡点温度。
x-y 图 对于大多数溶液,两相达到平衡时,y 总是大于 x,故平衡线位于对角线上方,平衡
线偏离对角线愈远,表示该溶液愈易分离。实际溶液中以正偏差溶液为多。
就被唯一地确定了。
所谓理想物系是指(1)液相为理想溶液,遵循拉乌尔定律;(2)气相为理想气体,遵循道尔
蒸馏

现场
32
连续精馏流程图
组成:
塔体、塔板(填料)、再沸器、 冷凝器
温度分布规律
塔底温度最高,越往上温度 越低,塔顶温度最低。
气液组成的变化规律
越往上易挥发组分含量越高, 越往下难挥发组分含量越高。
理论板
离开塔板的气液两相达到平 衡状态且液相组成均匀一致 时,该塔板称为理论板。
演示
37
xn
xn 1 yn 1 yn
第四节 双组分连续精馏计算
38
物料衡算
F—原料(液)摩尔流量,kmol/h; D—馏出液摩尔流量,kmol/h; W—釜残液摩尔流量,kmol/h; 总物料衡算 易挥发组分的物料衡算
D xD F xF
F D W
D F ( xF xW ) xD xW
连续精馏流程图
35
动画演示
36
塔板的作用
以第n层板为例来说明塔板的作用, 其上为第n-1层板,其下为第n+1层 板。 来自n-1层板组成为xn-1 的液体与来 自n+1层板组成为yn+1的蒸汽在第n层 板上接触。 由于xn-1 与yn+1 不平衡,而且蒸汽的 温度(tn+1 )比液体的温度(tn-1 ) 高,所以,组成为yn+1 的蒸汽在第n 层板上部分冷凝,并使xn-1的液体部 分汽化。
0 A
0 B
22
气液相平衡方程 (相对挥发度α表示)
当压力不太高时,根据分压定律有:
A pA / x A B pB / x B
yA xA 1 xA 1 yA
p yA / x p yB / x
A B
x y 1 ( 1) x
蒸馏

蒸馏过程仿真蒸馏是一种热力学的分离工艺,它利用混合液体或液-固体系中各组分沸点不同,使低沸点组分蒸发,再冷凝以分离整个组分的单元操作过程,是蒸发和冷凝两种单元操作的联合。
与其它的分离手段,如萃取、吸附等相比,它的优点在于不需使用系统组分以外的其它溶剂,从而保证不会引入新的杂质。
不同组分液体具有不同的沸点,是蒸馏最基本的理论依据。
在相同温度下,液体上方各个组分蒸气的分压也有所不同。
参考二元单相液体的相图,当由液体A和B按一定比例配成的混合液(设A的浓度为c1)经过加热后到达沸点线,然后通过无差异的气液平衡(从1到2),在生成的气相中得到A的含量为c2的混合气;该气体经过降温冷凝后收集便得到具有新组成(A浓度为c2)的液体。
按图例来讲,就是左侧的A组分被提纯了(因为C2大于c1)。
蒸馏有两种形式:1.简单蒸馏,如制造蒸馏水以去处其中溶解的固体杂质;制造蒸馏酒以浓缩酒精,去除部分水分;2.精馏,也叫分馏,在一个设备中进行多次部分汽化和部分冷凝,以分离液态混合物,如将石油经过分馏可以分离出汽油、柴油、煤油和重油等多种组分。
蒸馏设备是一种在高真空条件下进行的分离技术。
具有蒸馏温度低,体系真空度高,物料受热时间短,分离程度高等特点;且分离过程不可逆,没有沸腾鼓泡现象。
非凡适用于分离高沸点、热敏性和易被氧化的物质,已被广泛应用于医药行业的维生素和中草药有效成分-的提取、石油化工、食品工业、化妆品工业和农业等各行各业。
分子蒸馏设备(molecular distillation equipment)分子蒸馏亦称短程蒸馏.它是一项较新的尚未广泛应用于工业化生产的液-液分离技术.其应用能解决大量常规蒸馏技术所不能解决的问题.分子蒸馏与常规蒸馏技术相比有以下特点:1.普通蒸馏是在沸点温度下进行分离操作:而分子蒸馏只要冷热两个面之间达到足够的温度差.就可以在任何温度下进行分离.因而分子蒸馏操作温度远低于物料的沸点.2.普通蒸馏有鼓泡.沸腾现象:而分子蒸馏是液膜表面的自由蒸发.操作压力很低.一般为0.1-1Pa数量级,受热时间很短.一般仅为十秒至几十秒.3.普通蒸馏的蒸发和冷凝是可逆过程.液相和气相之间处于动态相平衡,而在分子蒸馏过程中.从加热面逸出的分子直接飞射到冷凝面上.理论上没有返回到加热面的可能性.所以分子蒸馏没有不易分离的物质.一套完整的分子蒸馏设备主要包括:分子蒸发器、脱气系统、进料系统、加热系统、冷却真空系统和控制系统。
蒸馏

每一块塔板是一个混合 分离器。
足够多的板数可使各组 分较完全分离。
(4) 精馏过程的回流
•
回流的作用: 提供不平衡的气液两相,是构成气液两相传质的 必要条件。 精馏的主要特点就是有回流。
回流包括:
塔顶回流液
塔底回流汽
三、精馏过程的基本计算
1.全塔物料衡算的方法
F D W Fx F Dx D Wx W
D, xD F, xF
式中:F、D、W—原料液、 塔顶馏出液、塔底釜残液的 流量,kmol/h xF、xD、xW—原料液、塔 顶馏出液、塔底釜残液的组 成,摩尔分率
W, xW
2.精馏岗位其他工艺计算
(1)精馏成品收率的计算 精馏成品收率是指精馏实际产品量与原 料中该组分的质量之比,以百分数表示。 计算公式为:
蒸馏单元 介绍完毕
谢谢大家!
t~y
t~x
液相区 tB
理想溶液气液相平衡
将温度为t5,组成为y1(点 E)的过热蒸汽冷却,当温 度降到t4时(点D),混和气 开始冷凝,产生第一滴液 体,因此饱和蒸汽线又称 露点线,对应的液相组成 为x1。
因此只有将液体部分汽化,才能起到分离作用。 所以蒸馏操作必须在气液两相共存区内进行。
三、 简单蒸馏
蒸馏
蒸馏的主要内容
一、 二、 三、 四、 五、 六、
概述 蒸馏基本原理和简单蒸馏 精馏原理与流程 精馏设备 精馏的操作 特殊蒸馏
概述
蒸馏是分离液体混合物典型的单Fra bibliotek操作。
1.蒸馏分离的依据
将液体混合物部分气化,利用其中各组分挥发度不同 的特性而达到分离目的的单元操作。 这种分离操作是通过液相和气相间的质量传递来实现 的。例如:03区轻沸塔C-350进料为DOX与少量轻沸物 甲醇等的混合液,在塔的底部控制温度77℃,塔顶控 制温度72℃,操作压力微正压。由于甲醇的沸点沸 64.8 ℃,较DOX的沸点75℃低,即其挥发度较DOX的 高,故甲醇较DOX易于从液相中气化出来。经过蒸馏, 使甲醇等轻组分和DOX(重组分)得以分离,从而在 塔底得到高纯度的DOX。
什么是蒸馏

什么是蒸馏蒸馏是一种常用的分离和精炼技术,能够有效分离出由混合体组成的溶液中的有效成分。
它广泛应用于化学,制药,食品工业以及国防军事领域,为提高人们的生活水平和国家安全提供了重要技术支持。
本文就蒸馏技术及其应用做出如下介绍。
一、蒸馏的定义蒸馏是一种将物质分离的技术,通过蒸除溶液中的一部分物质,将溶剂和溶质以不同的温度分离提炼出来。
蒸馏到底是分离物质还是精炼物质,取决于溶液的原始状态。
例如,水中溶解的盐如果被蒸除,那么就是分离技术;但如果水中溶解的汽油被蒸除,那么就是精炼技术。
二、蒸馏的基本原理蒸馏是通过滴定法或温度分离手段来达到蒸发和凝结分离技术的。
其基本原理是利用液体的蒸发温度和液体的凝结温度,将液体中的元素蒸发、凝结并收集的方法。
当液体的蒸发温度低于液体的沸点时,蒸气就能够在液体表面自由蒸发;当液体的凝结温度低于液体的凝结点时,液体的蒸气就能够自由凝结并收集。
当蒸除的温度低于液体的沸点时,液体中溶质的溶解度会降低,可以达到分离液体中不同溶质的目的。
三、蒸馏的类型蒸馏技术有很多种,其中常用的蒸馏技术分为减压蒸馏、凝结蒸馏两种:(1)减压蒸馏减压蒸馏是将液体充入容器,经过蒸馏塔将其减压蒸发,使液体蒸发温度降低,使其中的部分溶质从液体中蒸发而出,然后在冷凝器处接收和收集溶质的技术。
(2)凝结蒸馏凝结蒸馏是采用冷却凝结的方法,通过将液体冷却到凝结温度,使液体中的一部分物质凝结,然后将成液体的物质抽出的技术。
四、蒸馏的应用(1)工业蒸馏蒸馏技术广泛用于各种工业生产,如炼油厂和石油化工厂蒸馏提纯原料油、馏分油以及生产汽油和柴油等产品;而制药工业也采用蒸馏技术来提纯有效药物;食品业也采用蒸馏技术来处理原料汁液。
(2)核武器防护蒸馏技术广泛用于国防科技领域,如核武器防护材料的生产,采用蒸馏技术可以将原料中的有效成分进行分离和精炼,从而实现防护效果。
五、总结蒸馏是一种技术,能够有效分离出由混合体组成的溶液中的有效成分。
第一章蒸馏

第一章蒸馏一、是非题1、全塔效率和单板效率的计算基准相同,都是基于所需要的理论板数的概念进行讨论的。
(×)2、相对挥发度愈大,则相平衡曲线偏离对角线愈远,分离愈困难。
(×)3、组成不同的物料之间混合即返混,对于分离过程是一个不利的工程因素。
(√)4、对于精馏塔,若塔内操作压强降低,可使液体沸腾温度下降,从而避免在再沸器中使用高温载热体。
(√)5、精馏塔全回流时,其回流比为无穷大,全塔无精馏段和提馏段之分。
(√)6、在全凝器中,气液两相呈气液平衡状态,因此全凝器相当于一层理论板。
(×)7、回流比的数值由设计者选定,从耗能角度考虑宜取低限,对难分离的物系应取高限。
(√)8、在进行精馏操作时,在塔板上由于液体流径长,造成塔板上有明显的浓度差异,使气体分布不均匀而可能使塔板的单板效率超过100%。
(√)9、简单蒸馏又称微分蒸馏,也是一种单级蒸馏过程。
(√)10、平衡时气液两相的组成之间的关系称为相平衡关系。
它取决于体系的热力学性质,是蒸馏过程的热力学基础和基本依据。
(√)12、在混合物中各组分间挥发能力的差异定义为相对挥发度。
(×)13、简单蒸馏又称为微分蒸馏,属于间歇操作过程。
(√)14、液相(或气相)混合物连续通过节流闪蒸或膨胀或将混合气进行部分冷凝,使物流达到一次平衡的蒸馏过程,称之简单蒸馏。
(×)15、连续精馏广泛应用于石油、化工、轻工等工业生产中,是液体混合物分离中首选分离方法。
(√)16、简单蒸馏相当于分批多次采用一个理论塔板进行蒸馏,故同一理论板相当多次发挥作用。
(√)17、闪蒸相当于总进料一次通过一个理论板,进行次分离。
分离效果不及简单蒸馏。
(√)18、精馏过程中,传热、传质过程同时进行,属传质过程控制。
(√)轻组分产品。
(√)19、在精馏段,气相在上升的过程中,气相轻组分不断得到精制,在气相中不断地增浓,在塔顶获20、在提馏段,其液相在下降的过程中,其轻组分不断地提馏出来,使重组分在液相中不断地被浓缩,在塔底获得重组分的产品。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
根据道尔顿定律,我们可以推出一个很重要的 结论:混合气体中每个组分气体的分压等于混 合气体的总压乘以该气体在混合气体中所占的 分子数。例如:第i组分气体的分压可用下式来表 示: Pi=P总Yi 在压力不高的情况下,此定律可以应用于液体 上方的蒸汽混合物。当气液相平衡时,溶液上 方蒸汽混合物的总压力等于混合物中各个组分 的蒸汽分压之和。用公式表示为: P总=ΣPi
图6-4 硝酸水溶液的相图
三、挥发度与相对挥发度 气液相组成除相图表示外,还可以用相对挥发度来表示。 1、挥发度:气相中某一组分的蒸汽分压和与之平衡的液相 中的该组份摩尔分率之比,以符号 表示。
对于A和B组成的双组分混合液有:
pA pB A B xB xA A , B —— 组份A,B的挥发度;
2、平衡蒸馏 平衡蒸馏又称闪蒸,是一个连续稳定 过程,在恒定温度与压力下,蒸汽与 釜液处于平衡状态,即平衡蒸馏在闪 蒸器内通过一次部分汽化使混合液得 到一定程度的分离,属于定常连续操 作,适合于大批量生产且物料只需粗 分离的场合。
3、精馏 精馏是多次而且同时运用部分气化和 部分冷凝的方法,使混合液较完全分 离,获得接近纯组分的单元操作。
蒸馏方式
一、简单蒸馏 简单蒸馏定义:使混合液在蒸馏釜中逐渐受热气化, 并不断将生成的蒸气引入冷凝器内冷凝,以达混合 液中各组分得以部分分离的方法。 是一个非定常稳定过程,特点是:塔顶塔底组成不 是一对平衡组成。适合于混合物的粗分离,特别适 合于沸点相差较大而分离要求不高的场合,例如原 油或煤油的初馏。
注意:
在一定外压下,纯组分的饱和蒸汽压与外压相等时, 液体开始沸腾,其对应的温度称为沸点,可见,外 压一定时,纯组分的沸点为一定值。在一定外压下, 液体混合物的沸腾温度称为泡点,泡点与混合物的 组成有关。在(t-x-y)图上可见,表示不同组成液体 混合物的泡点温度(从x=0到x=1.0)为泡点曲线。 在该曲线上,对应x=0(即xA=0,xB=1.0)的温度为B 组分的沸点;对应x=1.0(即xA=1.0,xB=0) 的温度 曲线为A组分的沸点。
t-x-y 图与蒸馏原理
tE
E
xE
xF
yE
2、x-y 图
•平衡线位于对角线的上方,平衡线偏离对角线愈 远,表示该溶液愈易分离。
图6-1 苯-甲苯体系的T-x图
露点
气体混合物在压力不变的条件下降温冷却, 当冷却到某一温度时,产生的第一个微小 的液滴,此温度叫做该混合物在指定压力 下的露点温度,简称露点。处于露点温度 下的气体称为饱和气体。从精馏塔顶蒸出 的气体温度,就是处在露点温度下。值得 注意的是:第一个液滴不是纯组分,塔时 露点温度下与气相平衡的液相,其组成有 相平衡关系决定。由此可见,不同组成的 气体混合物,塔的露点是不同的。
泡点
液体混合物在一定压力下加热到某一温度 时,液体中出现的第一个很小的气泡,即 刚开始沸腾时的温度叫该液体在指定压力 下的泡点温度,简称泡点。处于泡点温度 下的液体称为饱和液体,即精馏塔的釜温 温度。应该说明,这第一个很小的气泡, 也不是纯组分,它的组成也是有相平衡关 系决定的。
沸点
当纯液体物质的饱和蒸汽压等于外压时, 液体就会沸腾,此时的温度叫做该液体在 指定压力下的沸点。纯物质的沸点是随外 界压力的变化而改变的。当外界压力增大 时,沸点升高,外界压力降低时,沸点降 低。对于纯物质来说,在一定压力下,泡 点、露点、沸点均为一个数值。
2、气液平衡相图 1)温度组成图(t-y-x图)图6-1 图中有两条曲 线,曲线①为饱和液体线(或泡点线)。曲 线②为饱和蒸气线或露点线,可由露点方程 得到。这两条曲线将图形分成三个区域:分 别为液相区,气液共存区和过热蒸气区。
1、温度—组成(
tx y
图)
三个区 两条线 三种点
表示混合液的平
2)相平衡图(y-x图)
在一定外压下,气相组成y和与之平衡的液相 组成x之间的关系,称气液相平衡图。y-x图 可通过t-x-y图作出,图6-2是苯-甲苯混合液的 y-x图。
图6-2 苯-甲苯体系的相平衡曲线
四、二组分非理想溶液的汽液相平衡
在工业生产中,理想溶液很少,原因在于同 种分子间的作用力与异种分子间的作用力不 同,因偏差有正有负,故将溶液分为对拉乌 尔定律具有正偏差的溶液和具有负偏差的溶 液。
⑴、定义 把液体混合物进行多次部分气化,同 时又把产生的蒸汽多次部分冷凝,就 能分离为所要求组分的操作过程称为 精馏。
⑵、精馏原理 精馏的基本原理是利用混合物中各组 分的挥发度不同,从精馏塔底加热物 料,产生上升蒸汽与塔顶冷凝下来的 回流液在塔板上进行充分的逆流接触, 发生传质传热过程,使易挥发组分气 化进入气相,难挥发组分冷凝进入液 相,如此反复多次使混合物中的各组 分充分得到分离的过程。
根据拉乌尔定律和道尔顿分压定律,可得泡点方
程
:
xA
p pB P PA
o o
上式称为泡点方程,该方程描述平衡物系的温 度与液相组成的关系。可得露点方程式:
pA p x p P p yA 0 P P P pA p
0 A A 0 A
0 B 0 B
上式称为露点方程式,该方程描述平衡物系的温度与气相 组成的关系。 在总压一定的条件下,对于理想溶液,只要溶液的饱和温 度已知,根据A,B组分的蒸气压数据,查出饱和蒸汽压PA0, PB0, 则可以采用泡点方程确定液相组成xA,采用式露点方程 确定与液相呈平衡的气相组成yA。
对于i组分在溶液上方的蒸汽分压Pi也可 根据拉乌尔定律确定,即: pi=PiXi 与道尔顿分压定律 pi=P总Yi结合,可得 PiXi= P总Yi
即: Yi= PiXi/ P总 为拉乌尔定律与道尔顿定律联合式
1、气液相平衡 汽液相平衡,是指溶液与其上方蒸汽达到平衡时气液两 相间各组分组成的关系。理想溶液的汽液相平衡服从拉 乌尔(Raoult)定律。 因此对含有A、B组分的理想溶液可 以得出: PA=PAoxA PB=PBoxB= PBo(1-xA) 式中: PA, PB —— 溶液上方A和B两组分的平衡分压, Pa; PAo,PBo —— 同温度下,纯组分A和B的饱和蒸汽压, Pa; xA ,xB —— 混合液组分A和B的摩尔分率。 理想物系气相服从道尔顿分压定律,既总压等于各组分 分压之和。 对双组分物系: P=PA+PB 式中: P—— 气相总压,Pa ; PA和PB —— A,B组分在气相的分压,Pa。
或写成:
yA xA yB xB
相对挥发度α值的大小,表示气相中两组分的浓度 比是液相中浓度比的倍数。所以α值可作为混合物采 用蒸馏法分离的难易标志, 若α大于1, y>x,说明该溶 液可以用蒸馏方法来分离, α越大, A组分越易分离; 若α=1,则说明混合物的气相组分与液相组分相等; 则普通蒸馏方式将无法分离此混合物;α<1, 则重新 定义轻组分与重组分,使α >1。
第一节
二元组分理想溶液的气液相平衡
拉乌尔定律:拉乌尔定律是从实践中总结出的一 条重要定律。该定律指出,在一定温度下,气液 相平衡时,溶液上方任意组分所具有的分压,等 于该组分在相同温度下的饱和蒸汽压乘以该组分 在液相中的分子数。用数学式表示: PA=PAoxA PB=PBoxB= PBo(1-xA) 式中: PA, PB —— 溶液上方A和B两组分的平衡 分压,Pa; PAo,PBo —— 同温度下,纯组分A和B的饱和蒸 汽压,Pa; xA ,xB —— 混合液组分A和B的摩尔分率。
蒸馏
姚永宁 2013-8-15
一、蒸馏依据
原理:将液体混合物部分气化,利用混合物 中各组分的挥发度不同使各组分得以分离。 其中沸点低的组分为易挥发组分(轻组分)、 沸点高的组分为难挥发组分(重组分) 蒸出冷凝液–––馏出液。蒸出后剩余的混合液 –––釜残液。
二、蒸馏分类
1、按操作方法分:连续蒸馏、间歇蒸馏 2、按蒸馏方法分:简单蒸馏(分离要求不高)、 平衡蒸馏(闪蒸、)精馏、特殊精馏(恒沸精馏、 萃取精馏)。 3、按组分数分:双组分蒸馏、多组分蒸馏、复杂 系蒸馏。 4、按操作压力分:常压、减压(热敏性物料)、 加压。
两条线
衡温度和气相组 成之间的关系, t-y线,
露点线
泡点线
表示混合液的平 衡温度和液相组
成之间关系,tx线 。
三个区
过热蒸汽区
两相区 液相区
沸点
泡点 x越大,易挥 发组分的含量 越高,泡点温 度越低。 露点 y越大,易挥 发组分含量越 高,露点温度 越低。
.
汽液两相处于 平衡时,两相 温度相同此时, 气相组成大于 液相组成; 当气液两相组 成相同时,气 相露点温度总 是高于液相的 泡点温度。
由此可见,A组分在气相中所具有的分压 Pa的数值只与该组分的饱和蒸汽压(或说成温 度)及它在液相中的浓度有关。当温度固定时, 饱和蒸汽压数值固定,气相中组分的分压与该 组分在液相中的浓度(分子分数)成正比,当 浓度固定时,气相中组分的分压与饱和蒸汽压, 也就是温度成正比。 拉乌尔定律是在精馏中广泛应用的一个定 律,通过它可以作出“压力—组成图”,进一 步作出“沸点—组成图”,借助这些图可以了 解精馏过程的基本原理,体现精馏操作的基本 方法。
相对挥发度α,对理想溶液来自PA PB0 0
对非理想溶液a可由实验测定。用相对挥发度表示的相平 衡方程
x y 1 ( 1) x
可用于计算理想溶液的汽、液平衡组成。当在操作温度范 围内(即操作温度的上、下限之间)物系的相对挥发度变 化不大时,可取其平均值(即视α为常数)进行计算。
