化工原理第四章
化工原理 第四章 传热

6
2. 对流
有温差的流体(或内部)作宏观移动和混合,将热量从高 温物体传向低温物体的现象,称对流传热。
特点:流体各部分间有相对位移,热对流仅发生在流体中。
自然对流:温度、密度不同引起。 强制对流:外力引起。
7
说明: 同一种流体中可能同时发生自然对流和强制对 流; 化工过程中,流体流过固体表面时的传热是包 含了热传导和热对流的联合过程,称对流传热; 对流传热与流体流动状况密切相关。
Cp
2. 流体对流起因
强制对流
自然对流
升力 (1- 2)g= 2g t
强制对流速度大,大。
3. 流体流动状态
4. 流体相态变化
5. 传热面的形状、相对位置及尺寸____特征尺寸
37
对流传热过程的分类及准数关联
由于对流传热的多样性,有必要将问题分类加以研究。
对流传热
有相变传热
41
四、流体无相变时对流传热系数的经验关联式
(一)流体在管内作强制对流 1. 圆形直管强制湍流的给热系数 流体在圆形直管内作强制湍流时,对于低粘度流体,则有
Nu 0.023Re0.8Prn
式中n值与热流方向有关,
当流体被加热时,n=0.4,
n取不同的数值,这是为了反映 热流方向对给热系数的影响。
推动力 热阻
总传热系数、传热面积、推动力是传热过程三大要素。
将热阻记为R,则Q=tm/R
下面将分别讨论传热基本原理及传热系数的计算。
12
第二节 热传导 一、傅立叶定律
1.温度场和温度梯度 1) 温度场 某一时刻物体或系统内各点的温度分布总和。
t f x, y, z,
化工原理第四章传热

一、基本概念
热负荷Q’:工艺要求,同种流体需要温升或温降 时,吸收或放出的热量,单位J。 传热速率Q:热流量,单位时间内通过换热器的整 个传热面传递的热量,单位 J/s或W。 热流密度q:热通量,单位时间内通过单位传热面 积传递的热量,单位 J/(s. m2)或W/m2。
接触的表面温度相等,各等温 面皆为同心圆柱面。
r1 r2 r3 r4
t2t1 t3 t4
多层圆筒壁的热传导计算,可参照多层平壁。 对于第一、 二、三层圆筒壁有
Q
2L1
t1 t2 ln r2
r1
Q
2L2
t2 t3 ln r3
r2
Q
2L3
t3 t4 ln r4
r3
根据各层温度差之和等于总温度差的原则,整理上三式可得
温度梯度是向量,其方向垂直于等温面,并以温度增加 的方向为正。
2 傅立叶定律
傅立叶定律是热传导的基本定律,它指出:单位时间内传
导的热量与温度梯度及垂直于热流方向的截面积成正
比,即
dQdAt
x
式中 Q——单位时间传导的热量,简称传热速率,w A——导热面积,即垂直于热流方向的表面积,m2
λ——导热系数(thermal conductivity),w/m.k。
Am
A1
A2 2
3.圆筒壁内的温度分布
上限从
r2 Qdr
t22rldt
r1
t1
rr2时 , tt2 改为 rr时 , tt
Q 2lt t1ln r r 1
Qr t t1 2lln r 1
t~r成对数曲线变化(假设不随t变化)
4.平壁:各处的Q和q均相等; 圆筒壁:不同半径r处Q相等,但q却不等。
化工原理第四章传热

4-2.2
平面壁的稳态热传导
t Q R
dt Q A d
单层平面壁的稳态热传导
t1
△t
1、过程分析 假设Ⅰ:一维稳态热传导,即t=f(x) 假设Ⅱ:无限大平壁 A 2、模型 Q (t t )
1 2
A
Q
t2
可改写为:
t t Q A R
Am,3 2 rm,3l
Ф
t4
数学模型
★
1 1 Am,1
t1
t4
其中,
t1
Am,1 2 rm,1l Am,2 2 rm,2l
rm ,1
t4 Ф
r r r2 r1 r r rm ,2 3 2 rm ,3 4 3 r r r4 ln 2 ln 3 ln r1 r2 r3
非稳态传热——传热面各点温度t、传热速率Q 、热通量q等 物理量不仅为位置的函数,同时也随时间而改变。 Q, q, t……=f (x,y,z, τ)
化工原理
等温面 在温度场中,温度相同的各点组成的面。
等温面
温度梯度 等温面法线方向上的温度变化率。
t1>t2
对于一维稳定温度场, t=f(x),温度梯度表示为:
★ Q
t t t R 2 lrm Am
其中,
r2 r1 rm r ln 2 r1
Am 2 rml
rm——半径的对数平均值;当r2/r1<2时,rm≈ (r1+r2)/2
化工原理
多层圆筒壁的热传导
Q t1 t4 t t 3 2 R Am 2 Am,2 3 Am,3
dt grad (t ) d
化工原理第四章

(2)2<Rep<500,过渡区(阿仑定律区)C D
(3)500<Rep<2×105,湍流区(牛顿定律区) C D 0.44 (4) Rep>2×105,湍流边界层区 边界层内的流动也转变为湍流,流体动能增大使边界层分离 点向后移动,尾流收缩、形体曳力骤然下降,实验结果显示 此时曳力系数下降且呈现不规则的现象,CD 0.1。
xi p a 1 ai 6 比表面相等 xi d pi
6 d pm a
1
p
1 xi d pi
1
对于非球形颗粒,按同样的原 则可得
d pm
xi d eai
xi d Ai eVi
沉降速度 力系数CD
u t2 d 2 p
4 dp p g ut 3 C D
u t 由颗粒与流体综合特性决定,包括待定的曳
自由沉降与沉降速度(Free settling and settling velocity) 对于一定的颗粒-流体体系,ut一定,与之对应的颗粒雷 诺数 Rep 也一定。 根据对应的 Rep ,可得到不同颗粒雷诺数范围 内 ut 的计算式: 2 d p p g ut (1)Rep<2,层流区(斯托克斯公式) 18
2
流体静压强对整个球体表面的作用力在流 动方向上的分量Fn为:
Fn d cos p
2
0
0
r R
R
2
sin d
3 u d p gR cos cos R 2 sin cos d 2 R 0 0
2
化工原理 第四章 传热过程

• 传导传热的机理 • 一个物体的两部分存在温差,热就要从高温部分 向低温部分传递,直到各部分的温度相等为止, 这种传热方式就称为传导传热(或热传导)。 • 传导传热的本质是物体内部微观粒子的热运动而 引起的热量传递。物质的三态均可以充当热传导 介质,但导热的机理因物质种类不同而异,具体 为: • 固体金属:自由电子运动在晶格之间; • 液体和非金属固体:晶格结构的振动;即分子、 原子在其平衡位置的振动。 • 气体:分子的不规则运动。
第四章 传热过程 §4-1 概述 4-1.1 化工生产中的传热过程 1、传热过程在化工生产中的应用 例如:蒸发、蒸馏、干燥、结晶等 由于化工生产过中传热过程的普遍性,使得换热 设备的费用在总投资费用中所占的比重甚高。据 统计:在一般石油化工企业中占30~40% 在炼油厂中占40~50%。因此,认识传热过程, 掌握一般换热设备运行的规律,充分利用反应热、 余热、废热,对化工生产具有十分重要的意义。
r2 t 2 t1 ln 2l r1
r2 t1 t 2 ln 2l r1 t1 t 2 2l r2 ln r1
• 上式即为单层圆筒壁的导热速率方程。 • 在圆筒壁内找一个合理的平均导热面积Am , 或与Am对应的平均半径 rm ,这样圆筒壁的导 热速率就可按平壁来处理。 • 将(4)分子分母同乘以(r2-r1)
r1 2
术平均值代替,误差不超过4%,在工程上是允 许的。
r1 r2 rm 2
• 4、多层圆筒壁的导热 • 热量是由多层壁的最内壁传导到最外壁, 要依次经过各层,所以多层圆筒壁的传热, 可以看成是各单层壁串联进行的热量传递。
r2 r3
r1
• 对于稳定传热
• 对第一层
1 2 3
化工原理第四章

4.1 液液相平衡
(2)杠杆规则
如图4-2所示,将质量为 krg、组成为
xS 的混合物系R与质量为e kg、组成为
y
x、A
A、
y、xB、B
y,S
的混合物系E相混合,得到一个质量为m kg、组成
为 z A 、z B、 z的S 新混合物系M,其在三角形坐标图
中分别以点R、E和M表示。M点称为R点与E点的和
称为共轭相,联结两共轭液相相点的直线称为联 结线,如图4-3中的RiEi线(i=0,1,2,……n)。显然 萃取操作只能在两相区内进行。
图4-3 溶解度曲线
4.1.2 三角形相图
溶解度曲线可通过下述实验方法得到:在一定温度下, 将组分B与组分S以适当比例相混合,使其总组成位于 两相区,设为M,则达平衡后必然得到两个互不相溶的 液加层入,适其量相的点溶为质RA0并、E充0。分在混恒合温,下使,之向达此到二新元的混平合衡液,中静 置加分入层溶后质得A,到重一复对上共述轭操相作,,其即相可点以为得R到1、nE+11,对然共后轭继相续的 相由点两R相i、变E为i (i一=0相,1时,2,,…其…组n成),点当用加K入表A示的,量K使点混称合为液混恰溶好点 或分层点。联结各共轭相的相点及K点的曲线即为实验 温度下该三元物系的溶解度曲线。
4.1.2 三角形相图
设溶质A可完全溶于B及S,但B与S为部分互溶, 其平衡相图如图4-3所示。此图是在一定温度下 绘制的,图中曲线R0R1R2RiRnKEnEiE2E1E0称为溶 解度曲线,该曲线将三角形相图分为两个区域: 曲线以内的区域为两相区,以外的区域为均相区。
位于两相区内的混合物分成两个互相平衡的液相,
4.1 液液相平衡
三角形坐标图内任一点代表一个三元混合物系。例如M点即表示由A、B、S三个组 分组成的混合物系。其组成可按下法确定:过物系点M分别作对边的平行线ED、HG 、KF,则由点E、G、K可直接读得A、B、S的组成分别为: =0.4、=0.3、=0.3;也可由 点D、H、F读得A、B、S的组成。在诸三角形坐标图中,等腰直角三角形坐标图可直 接在普通直角坐标纸上进行标绘,且读数较为方便,故目前多采用等腰直角三角形 坐标图。在实际应用时,一般首先由两直角边的标度读得A、S的组成及,再根据归 一化条件求得。
化工原理第四章传热

λ3A
因△t = t1-t4 = △t1+ △t2+ △t3
△t b1 b2 b3 + + λ1A λ2A λ3A
△t
Q=
=
∑ Ri
i=1
3
总推动力
=
总热阻
[例4-2]已知:耐火砖 :b1=150mm λ1=1.06 W/(m· ℃) 保温砖: b2=310mm λ2=0.15 W/(m· ℃) 建筑砖 :b3=240mm λ3=0.69 W/(m· ℃) t1=1000℃,t2=946℃
解:(a)每米管长的热损失
q1= Q l = r2 1 ln r1 λ1 2π(t1 – t4) r3 1 ln + r2 λ2 r4 1 + ln r3 λ3
r1=0.053/2=0.0265, r2=0.0265+0.0035=0.03 r3=0.03+0.04=0.07,r4=0.07+0.02=0.09 q1=191
Q q1= =2πλ l
t1-t2 r2 ln r1
可见,当比值r2/r1一定时,q1与坐标r无关
上式也可改写为单层平壁类似形式的计 算式:
2πl(r2 - r1)λ(t1 - t2)
2πr2l (r2 - r1)ln 2πr1l (A2 - A1)λ(t1 - t2) λ = = Am(t1-t2) A2 b (r2 - r1)ln A1
=
△t
R
传热推动力 = 热阻
也可写成: Q q= A
λ (t1-t2) = b
[例4-1] 现有一厚度为240mm的砖壁,内 壁温度为600℃,外壁温度为150℃。试求 通过每平方米砖壁壁面的导热速率(热流 密度)。已知该温度范围内砖壁的平均热 导率λ=0.6W/(m. ℃ )。 解:
化工原理 第四章 传热过程超详细讲解

泡沫保温 材料
三、平面壁的稳定热传导——特点
1 单层平面壁,如P105图
∴ A
(t1 t 2) At
例4-11 Δtm逆 =54.9℃ Δtm并=39.1℃ Δtm逆 /Δtm并=54.9/39.1 =1.404 在Φ, K相同时:A并/A逆=Δtm逆/Δtm并>1 A并>A逆 在A, K相同时:Φ逆/Φ并=Δtm逆 /Δtm并>1 Φ逆>Φ并 据Φ=MCpΔt`,在Φ相同时,逆流可减少热载体的用量, 即M逆<M并。
(2)Δt1/Δt2 =R1/R2=
即各层的温降与其热阻成正比。
1 2 t1 t4 (3) t 2 t 1 t3 t2 t2 2 3 i A 1 A2 2 i 1 i
——可求夹层间的温度。
(4)在不知A时, 可求单位传热面积的传热速率—热流密度
五、总传热系数K
∴单层
1 1 K rm rm rm r 2 r1 rm 1 r 1 2 r 2 1r 1 2 r 2
多层圆简壁一般不用Φ=KAm (T- t) 的形式,而直接使用公式。
i
rmi
ri 1 ri 1 ln ln ri 1 ri ri ri
对数平均半径。当r2 /r1<1.2 时,可用算术
平均半径 rm=(r2+r1)/2代替。
2 、多层圆简壁 如图:各层都相当于单层圆筒壁,仿多层平面壁推导有:
化工原理 第四章

第二节 过滤
若滤饼需要洗涤,可将洗水压人洗水通道,经洗涤板 角端的暗孔进入板面与滤布之间。此时,应关闭洗涤板下 部的滤液出口,洗水便在压力差推动下穿过一层滤布及整 个厚度的滤饼,然后再横穿另一层滤布,最后由过滤板下 部的滤液出口排出,这种操作方式称为横穿洗涤法,其作 用在于提高洗涤效果。洗涤结束后,旋开压紧装置并将板 框拉开,卸出滤饼,清洗滤布,重新组合,进入下一个操 作循环。 板框压滤机优点是构造简单,制造方便、价格低;过 滤面积大,可根据需要增减滤板以调节过滤能力;推动力 大,对物料的适应能力强,对颗粒细小而液体较大的滤浆 也能适用。缺点是间歇操作,生产效率低;卸渣、清洗和 组装需要时间、人力,劳动强度大,但随着各种自动操作 的板框压滤机的出现,这一缺点会得到一定程度的改进。
第二节 过滤
(2)多孔性固体介质 是素瓷、金属或玻璃的烧结物、 塑料细粉粘结而成的多孔性塑料管等, 适用于含粘软性 絮状悬浮颗粒或腐蚀性混悬液的过滤,一般可截留粒径1~ 3μm的微细粒子。 (3)粒状介质 是由各种固体颗粒(砂石、木炭、石棉) 或非编织纤维(玻璃棉等)堆积而成。适用于深层过滤,如 制剂用水的预处理。 (4)微孔滤膜,是由高分子材料制成的薄膜状多孔介 质。适用于精滤,可截留粒径0.01μm以上的微粒,尤其适 用于滤除0.02~10μm的混悬微粒。
第二节 过滤
图4-4 滤板和滤框
第二节 过滤
2.转鼓真空过滤机 转筒真空过滤机为连续式真空过滤设备,如图4-5所示。 主机由滤浆槽、篮式转鼓、分配头、刮刀等部件构成。篮 式转鼓是一个转轴呈水平放置的圆筒,圆筒一周为金属网 上履以滤布构成的过滤面,转鼓在旋转过程中,过滤面可依 次浸入滤浆中。转筒的过滤面积一般为5~40m2,浸没部分 占总面积的30%~40%,转速约为0.1~3r/min。转鼓内沿径 向分隔成若干独立的扇形格,每格都有单独的孔道通至分 配头上。转鼓转动时,籍分配头的作用使这些孔道依次与 真空管及压缩空气管相通,因而,转鼓每旋转一周,每个扇 形格可依次完成过滤、洗涤、吸干、吹松、卸饼等操作。
化工原理

Q ──热冷流体放出或吸收的热量,W; cph,cpc ──热冷流体的比热容, J/(kg. ℃) ;
h1,h2 ──冷流体的进出口焓,J/kg;
H1,H2 ──热流体的进出口焓, J/kg 。
相变时
若热流体为饱和蒸汽,当冷凝时有相的变化,但是冷 凝液在饱和温度下离开换热器。冷流体无相变化。
Q Wh rh Wc c pc t 2 t1
A
2)较大温差记为t1,较小温差记为t2; 3)当t1/t2<2,则可用算术平均值代替
t m (t1 t 2 ) / 2
4)当t1=t2
t m t1=t 2
2、错流、折流时的 t m
t m t m
'
t ' m :逆流时的平均温度差
f ( P, R, 流型)
t 对流
(1)管外对流
dQo o dAo (T Tw )
(2)管壁热传导
dQ壁
(3)管内对流
b
dAm (Tw t w )
dQi i dAi (t w-t )
dQ dQo dQ壁 dQi
对于稳定传热
T Tw Tw t w t w t T t dQ 1 b 1 1 b 1 o dAo dAm i dAi o dAo dAm i dAi
T t dQ 1 KdA
1 1 b 1 KdA o dAo dAm i dAi
式中 K——总传热系数,W/(m2· K)。
讨论:
1.当传热面为平面时,dA=dAo=dAi=dAm
1 1 b 1 K o i
2.以外表面为基准(dA=dAo):
化工原理第四章 传热及传热设备..

4.2 热传导
4.2.5 圆筒壁的稳定热传导 二、多层圆筒壁
第一层
第二层
盐城工学院
第三层
Q
2L(t1 tn1 ) in 1 ln ri1
i1 i
ri
-----通式
可写成与多层平壁计算公式相仿的形式:
Q
t1 t4
b1
b2
b3
1 Am1
2 Am 2
3 Am3
Am1、 Am2 、Am3分别为各层 圆筒壁的对数平均面积。
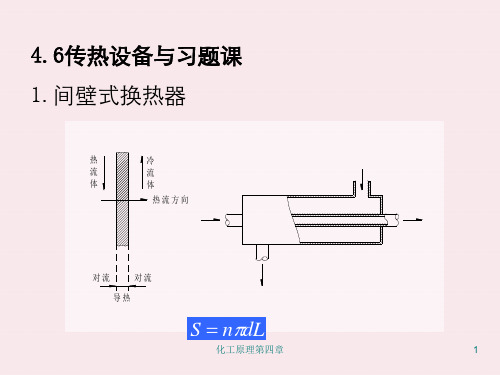
主要特点:冷热两种流体被一固体间壁所隔开,在 换热过程中,两种流体互不接触,热量由热流体通 过间壁传给冷流体。以达到换热的目的。
优点:传热速度较快,适用范围广,热量的综合利 用和回收便利。
缺点:造价高,流动阻力大,动力消耗大。
典型设备:列管式换热器、套管式换热器。
适用范围:不许直接混合的两种流体间的热交换。
解:(1)每米管长的热损失
r1=0.053/2=0.0265m r2=0.0265+0.0035=0.03m r3=0.03+0.04=0.07 m r4 =0.07+0.02=0.09 m
=191. 4 W/m
第四章 传热及传热设备
(2)保温层界面温度t3
盐城工学院
解得:t3=131.2℃
第四章 传热及传热设备
热导率
纯金属 金属合金 液态金属 非金属固体 非金属液体 绝热材料 气体
100~1400 50~500 30~300 0.05 ~50 0.5~5 0.05~1 0.005~0.5
可见,在数值上: 金属 非金属 液体 气体
第四章 传热及传热设备
盐城工学院
4.2 热传导
化工原理 第四章 传热

注意→气体很小,有利于保温、绝热,如玻璃棉。
传热-热传导
3. 平壁导热 ① 单层平壁
dt Q S dx x 0,t t1;
x b,t t2; t1 t2
Q
S
b
t1 t2
Q
单层平壁导热
假设→①稳态、一维导热。 ②λ不随温度变化。 ③不计热损失。
⑴ 给热是集热对流和热传导于一体的耦合过程。 ⑵ R集中在层流内层→ 层流内层厚度↓是强化给热的主要途径。
传热-对流传热
② 热边界层 热边界层→即温度边界层,指壁面附近处具有温度梯度的流体薄层。
dt dQ dS dy w
dQ tw t dS
dt dt tw t dy w t dy w
⑴
平板上的热边界层
dt t不变时, t , dy w
。
⑵ 流体在管内流动时,热边界层与流动边 ⑴ 热边界层边缘处→ 界层类似。不同的是,经历进口段和完全 t t 0.99 t t 发展区后,温度分布随管长渐变为平坦, < ⑵ 热边界层厚度→ 。 继而温度梯度消失,直至传热停止。
dQ T Tw dS
Q S t
R
1 S
① →平均给热系数。 ② 流体温度→流动横截面上的平均温度。 ③ 若热流体走管内,冷流体走环隙, dQ i T Tw dSi o tw t dSo
④ 给热研究的内核→不同给热情况下,α 的大小、影响因素及其计算式。
n
bi
mi
Q
2 πL t1 t4 1 r2 1 r3 1 r4 ln ln ln 1 r1 2 r2 3 r3
化工原理第四章 流体通过颗粒层的流动

第四章流体通过颗粒层的流动思考题∆一、试证明:流体以层流状态通过管道时,其阻力损失ρ与单位流体体积所具有的表面积(S/V)2呈正比。
二、床层颗粒的当量直径是以什么原则确定的,为什么?三、床层模型与实际床层在哪些物理量上是等效的?四、数学模型法的基本步骤是什么?五、表面过滤时,真正起过滤作用的是什么?六、过滤过程的特点是什么?为什么可用康采尼方程描述其速率?七、影响过滤速率的因素有哪些?八、试讨论各种条件下滤液量、过滤时间、过滤压差∆过滤常数K的相互关系?九、洗涤过程的特点是什么?如何确定洗涤速率(dq/dτ)w?第四章流体通过颗粒层的流动第一节概述一、颗粒床层的分类分类:固定床----颗粒静止;(催化反应,过滤)流化床----颗粒悬浮(沸腾床)二、考察内容:流体通过颗粒(固定床)的压降(h f)三、流体通过颗粒床流动的本质特征1.流体在由大量粒群组成的封闭的固体边界内流动,属管流;2.当颗粒较细时,床层内流速一般极慢(爬流),属层流形态;3.流体所接触的颗粒几何边界极其复杂,难以准确描述。
(三大因素)第二节 颗粒床层的特性§2-1 单颗粒特性(影响流动通道)一、球形颗粒 体积:36pd V π=表面积:2pd S π=比表面积:pdV S a 6/==对球形颗粒,直径d p 即可描述其全部外表特征 二、非球形颗粒工程上用当量直径d e 来描述非球形颗粒特征(等效性不同) 1. 体积当量直径(球非V V =)ππVd dV V ev ev6633球非=⇒==2. 表面积当量直径(S 非=S 球)ππSd dS S es es=⇒==2球非3. 比表面积当量直径(α非=α球)球形度(球形系数),令6,/665.02223球非---==∴=⎪⎪⎭⎫ ⎝⎛⎪⎪⎭⎫ ⎝⎛===∴==⇒==ψψψψeves evea es ev ev es ev esev ea ea ea d d d d d d d d d d dS V d V S a ad d a aψ的几何意义:同体积下,球形颗粒的表面积与非球形颗粒的表面积之比(ψ≤1)球形颗粒:d p (一个参数)非球形颗粒:S, a ; (通常:d ev ,ψ)(两个参数) 简便:d ev =d ee ea e ese d d a d d S dV ψψπππ666223=====§2-2颗粒群的特征粒度分布测量:筛分法,显微镜法,沉降法等。
化工原理第四章
化工原理第四章
11
化工原理第四章
12
(2)U型管换热器 特点:管内清洗困难
化工原理第四章
13
(3)浮头式换热器 结构较为复杂,成本高,消除了温差应力,应用广泛。
化工原理第四章
14
2.板式换热器
1)夹套式换热器
化工原理第四章
15
Ø 结构:夹套式换热器主要用于反应过程的加热 或冷却,是在容器外壁安装夹套制成。
Ø 优点:结构简单。
Ø 缺点:传热面受容器壁面限制,传热系数小。 为提高传热系数且使釜内液体受热均匀,可在釜 内安装搅拌器。也可在釜内安装蛇管。
化工原理第四章
16
2)板式换热器
化工原理第四章
17
化工原理第四章
18
化工原理第四章
19
3)螺旋板式换热器(逆流)
化工原理第四章
20
化工原理第四章
21
化工原理第四章
42
4.7.3 各种间壁式换热器的比较和传热的强 化途径
1.各种间壁式换热器的比较
视具体情况,综合考虑择优选定。
化工原理第四章
43
(1)加大流速; (2)增强流体的扰动; (3)在流体中加固体颗粒; (4)采用短管技术; (5)防止结垢和及时清除垢层。 原则:抓住影响强化传热的主要矛盾,结合设备结 构、动力消耗、检修操作等,采取经济合理的强化 方法。
Ø 优点:结构简单,便于防腐,能承受高压。
Ø 缺点:由于容器体积比管子的体积大得多,因此管外 流体的表面传热系数较小。为提高传热系数,容器内 可安装搅拌器。
化工原理第四章
6
(2)喷淋式
化工原理第四章
7
Ø 结构:多用于冷却管内的热流体。将蛇管成排 地固定于钢架上,被冷却的流体在管内流动,冷 却水由管上方的喷淋装置中均匀淋下,故又称喷 淋式冷却器。
化工原理 第四章 固体流态化

p (1 ) u 2 1.75 3 L da
或
p a(1 ) 2 0.2917 u 3 L
(三)通用计算公式——欧根方程 若将康采尼公式与布拉克-普拉默公式叠加,即可得适用于各种流动 状况下的压降计算式,称为欧根公式:
p (1 )2 u (1 ) u 2 150 1.75 3 3 2 L da da
fF 150 Re p (1 ) 1.75
第二节 固体的流态化
一、床层的流态化过程
三个阶段:固定床、流化床、颗粒输送。
(a) (b) (c) (d) (e)
L
Lm
气体Байду номын сангаас液体 (低速)
Lmf
L
气体或液体
液体
气体
气体或液体 (高速)
图3-30 不同流速下床层状态的变化:(a)固定床(b)流化开始 (c)散式流化床(d)聚式流化床(e)水力或气力输送
• 沟流 指流体在通过床层时直接经过床层中的沟道走短路,造成流体与 固相颗粒不能均匀接触的现象。在发生沟流现象时,部分颗粒区不能 发挥相应的效能,不利于传热、传质以及化学反应过程的进行。 • 对固定床,沟流现象通常发生在床层直径与颗粒直径之比较小、空隙 率很大的场合下,可通过控制床层直径与颗粒直径之比得到解决。对 流化床,颗粒粒度过细、密度大、易粘连,床径大,流体初始分布不 均匀等都易引起沟流现象。 • 综上所述,对流化床可通过测定和观测压降的变化来判断操作的正常 与否。正常情况下,压降的波动范围小,当床层压降低于正常值(单 位面积上颗粒的净重力)时,则可能发生沟流现象;若压降大幅度起 伏则表明发生了腾涌现象。
(三)两种不正常操作现象 • 腾涌(节涌)、沟流
化工原理 第四章

4 气体吸收教学要求:掌握吸收单元操作分离气体混合物的依据、目的,吸收操作过程的分类和流程,掌握吸收过程的汽液相平衡关系、传质机理和吸收速率方程式,掌握吸收过程的物料平衡--操作线方程式和吸收剂用量计算;掌握吸收塔填料层高度的计算;掌握吸收操作型问题的分析方法与计算;了解板式吸收塔塔板数的确定方法;了解高浓度气体吸收、非等温吸收和多组分吸收的基本过程。
教学重点:费克定律与扩散系数; 气体在液体中溶解度、亨利定律;吸收速率方程;双膜理论;总传质系数与分传质系数;吸收塔的操作计算:吸收剂用量与最小液气比的计算。
教学难点:总传质系数与分传质系数的关系及计算。
4.1 概述4.1.1化工生产中的传质过程传质分离过程:利用物系中不同组分的物理性质或化学性质的差异来造成一个两相物系,使其中某一组分或某些组分从一相转移到另一相,达到分离的目的,这一过程称为传质分离过程。
以传质分离过程为特征的基本单元操作在化工生产中很多,如:(1)气体吸收选择一定的溶剂(外界引入第二相)造成两相,以分离气体混合物。
如用水作溶剂来吸收混合在空气中的氨,它是利用氨和空气在水中溶解度的差异,进行分离。
(2)液体蒸馏对于液体混合物,通过改变状态,如加热气化,使混合物造成两相,它是利用不同组分挥发性的差异,进行分离。
(3)固体干燥对含一定湿分(水或其它溶剂)的固体提供一定的热量,使溶剂汽化,利用湿分压差,使湿分从固体表面或内部转移到气相,从而使含湿固体物料得以干燥。
(4)液-液萃取向液体混合物中加入某种溶剂,利用液体中各组分在溶剂中溶解度的差异分离液体混合物,在其分离过程中,溶质由一液相转移到另一液相。
(5)结晶对混合物(蒸汽、溶液或熔融物)采用降温或浓缩的方法使其达到过饱和状态,析出溶质,得到固体产品。
(6)吸附利用多孔固体颗粒选择性地吸附混合物(液体或气体)中的一个组分或几个组分,从而使混合物得以分离。
其逆过程为脱附过程。
(7)膜分离利用固体膜对混合物中各组分的选择性渗透从而分离各个组分。
化工原理第04章03-2019-11-6
dV
d
终
恒压操作时
dV
d
终
KA2 2(V Ve
)
V 2 2VVe
2(V Ve )
( 因V 2+2VVe=KA2τ)
W
VW dV
d W
当Ve=0时,
P PW
W
8(V Ve ) V 2 2VVe
VW
W
P PW
W
8VW V
3.回转真空过滤机
ΔP一定,q
K qe2 qe
K
n
qe2
(因
K
2P
r
)
n
A 2a 2
17.7 2 0.6352
22个
这样可行吗?
(V+V饼)Φ=V饼(1-ε)
V饼
1
V
10 0.015 1 0.5 0.015
0.309m 3
n
V饼 ba 2
0.309 0.025 0.6352
31个
取31个
例2 一板框压滤机在恒压下进行过滤,水悬浮液含
固量0.1kg固体/kg悬浮液,滤饼空隙率ε=0.4, ρp=5000
kg/m3, qe=0,若过滤10分钟,则得滤液1.2m3,试问: ①当τ=1h, V=? ②过滤1小时后的滤饼体积; ③过滤1小时后,用0.1V的水洗涤,
τW=? (操作压强不变)
解:① w = 0.1, ε=0.5, τ=10min, V=1.2m3
V2=KA2τ
(由 V 2+2VVe=KA2τ )
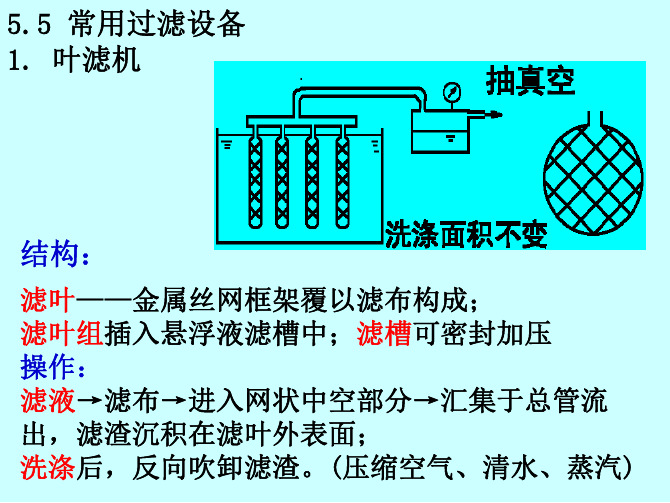
5.5 常用过滤设备 1. 叶滤机
结构:
滤叶——金属丝网框架覆以滤布构成; 滤叶组插入悬浮液滤槽中;滤槽可密封加压 操作: 滤液→滤布→进入网状中空部分→汇集于总管流 出,滤渣沉积在滤叶外表面; 洗涤后,反向吹卸滤渣。(压缩空气、清水、蒸汽)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH4 C2H4 C2H6 CClF3 CO2 N2O HCl C2H2 C3H6 C3H8 CCl2F2
16.4 28.05 30.07 104.46 44.01 44.01 36.46 26.04 42.08 44.1 120.91
Generally, ρ of solvent
solubility of solute ;
2.
Historical Background
More and more processing have been doing these years Petroleum Industry, Coal Chemical Industry, Medical Industry , Perfume (Essential Oil , Aroma) Industry. Tobacco Industry (De-nicotine), much more in Food Industry Theory of SFE ( to be going to ) are being perfected. Design equipment for Industry use.
D ( cm2 / s )
0.1 ~ 0.4
(0.2~2.0) ×10-5 0.7 ×10-3
µ
( g /s·cm)
(1 ~ 3) ×10-4 (0.2~ 3) ×10-2 (1 ~ 3) ×10-4 (3 ~ 9) ×10-4
SF p=pc , T=Tc p=4pc, T=Tc
0.2 ×10-3
That is why the supercritical fluid have such a powerful solvability for solute ; The rate of mass transfer would be much higher .
P SF
Supercritical
Critical point: The liquid–gas line extends to the point where the properties of liquid and vapor become identical.
Critical point
fluid
The typical properties of different states had been determined as shown in table 1. The critical properties of several substance had been determined experimentally as shown in Table2:
2.Historical Background
Domestic workers operated the SFE studies from the end of1980`s last century. Guo Mingxue et al. (1989-1990)using SC-CO2for extracting citrus oil (essencial oil) form citrus fruit. Several workers extracted pigment from peel plant by SFE technology.
Selectivity of SF can be adjusted by changing pressure ;
P SF
Supercritical
Sublimation S freeze drying ; Fusion line S crystallization
G for
Pc
Critical point
fluid
Liquid
C
L for
Gas
Triple Point
Tc
T
§ 8-2 Fundamental Principles and Characteristics of SFE
Substance
Molecular Weight
Tc(oC)
- 82.1 9.7 32.4 28.8 31.1 36.5 51.4 36.0 92.3 96.8 111.5
Pc(atm) Vc(cm3/mol)
45.8 50.5 48.3 39.0 72.8 71.7 81.6 62.0 45.0 42.0 39.56
1. Introduction ( to be continuous )
Because SFE behaves such a lot of those advantages as mentioned above. SFE can extract or recover high quality products from natural materials.
Diffusion Coefficient D :
DSF == 100 D Liquid .
Table 1 Typical Properties of Different States
Phase
Gas(normal T,P) Liquid(----T,P)
ρ ( g/ml )
(0.6~2)×103 0.6 ~1.6 0.2 ~ 0.5 0.4 ~ 0.9
1. Introduction ( to be continuous )
Quite a lot of applications for SFE procession have been done since end of 70th decade of the last century. e.g. Decaffeinating (coffee tea,1981) ; Deodorization (oils, fat, brewer`s yeast,1979) ; Aroma recovery (Tobacco, Hops, Spices, Apples coffee, 78-82) ; Pigment recovery (Citrus oil fruits) .
2. Historical Background
More than one hundred years ago (1879) Hannay & Hogarth confirm that some metal halogenides is soluble in SF-ethanol and salt may separate out when operating pressure is decreased. In 50th decade of the last century, Feddy and Elgin proposed that compression of a gas over a mixture of compounds could selectively dissolve one compound, permitting it to be removed from the mixture. Those had been done on the basis of Drancis~s (1954) studies in solubilities and phase equilibrium of fatty acids and high molecular weight alcolhols in supercritical ethylene.
§8-2 Fundamental Principles and Characteristics of SFE
P
I. Supercritical Fluids ( SF )
1. Phase Diagram of a Pure Substance Figure 1. shows a generalized Pc pressure-temperature phase diagram for a pure substance : Triple point ( S. L. G. 3 phases
coexist ) ; Gas G,
Triple Point Critical point
SF
Supercritical fluid
Liquid
C
Vapor pressure line L for distillation
Tc
T
§ 8-2 Fundamental Principles
and Characteristics of SFE
Critical point
SF
Supercritical fluid
Pc Liquid
C
Gas
Triple Point
Tc
T
3. The properties of supercritical fluid Density ρ : P ρ Viscosity µ :
P
µ
ρLiquid ; == µ Gas ;
Pc Liquid
C
Gas
Triple Point
Tc
T
§ 8-2 Fundamental Principles and
Characteristics of SFE
P
2. Supercriegion on the phase diagraph where the both of temperature and pressure are higher than critical point’s is defined supercritical fluid (SF)
2.Historical
Background
In almost the same time(1957-1960) , Russian workers using SC-light hydrocarbone for the deaspholting of petroleum; the extracting of lanlin from grease and the removal of ozocerite wax from its oras.
