2018高中化学每日一题混合物的分离与提纯
混合物分离和提纯的方法

混合物分离和提纯的方法
混合物的分离和提纯可以通过以下几种方法实现:
1. 蒸馏:适用于分离具有不同沸点的液体混合物。
通过加热混合物,其中具有较低沸点的成分首先蒸发出来,然后通过冷凝收集。
2. 结晶:适用于分离溶液中的固体成分。
通过控制溶液的温度和浓度,使固体成分结晶出来,然后通过过滤或离心分离出来。
3. 过滤:适用于分离悬浮物和溶液的固体成分。
通过过滤纸或筛网,将固体颗粒从混合物中分离出来。
4. 萃取:适用于分离具有不同亲疏水性的物质。
通过溶剂的选择性提取,将需要分离的成分溶解于溶剂中,然后通过分离溶剂的蒸发或萃取剂的分离得到纯净物质。
5. 离心:适用于对混合物中的固体和液体进行分离。
通过离心机的旋转力将固体颗粒或微粒沉积到管底或管壁上,然后将上层液体倾倒或吸出。
6. 色谱:适用于分离混合物中的成分。
通过固定相和移动相之间的互作用,使成分按照一定的速率在固定相上移动,从而实现分离。
以上仅是一些常见的分离和提纯方法,具体选择方法需要根据混合物的性质和分离成分的差异来确定。
混合物的分离与提纯
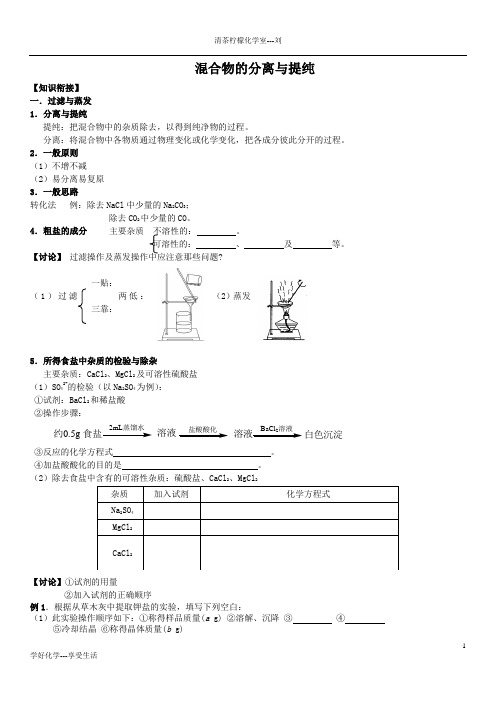
1学好化学---享受生活混合物的分离与提纯【知识衔接】一.过滤与蒸发1.分离与提纯提纯:把混合物中的杂质除去,以得到纯净物的过程。
分离:将混合物中各物质通过物理变化或化学变化,把各成分彼此分开的过程。
2.一般原则(1)不增不减(2)易分离易复原3.一般思路转化法 例:除去NaCl 中少量的Na 2CO 3;除去CO 2中少量的CO 。
4.粗盐的成分 主要杂质不溶性的: 。
可溶性的: 、 及 等。
【讨论】 过滤操作及蒸发操作中应注意那些问题?一贴:(1)过滤 两低: (2)蒸发三靠:5.所得食盐中杂质的检验与除杂主要杂质:CaCl 2、MgCl 2及可溶性硫酸盐(1)SO 42-的检验(以Na 2SO 4为例):①试剂:BaCl 2和稀盐酸②操作步骤:2约0.5g 溶液溶液白色沉淀③反应的化学方程式 。
④加盐酸酸化的目的是 。
(2)除去食盐中含有的可溶性杂质:硫酸盐、CaCl 2、MgCl 2【讨论】①试剂的用量②加入试剂的正确顺序例1.根据从草木灰中提取钾盐的实验,填写下列空白:(1)此实验操作顺序如下:①称得样品质量(a g) ②溶解、沉降 ③ ④⑤冷却结晶 ⑥称得晶体质量(b g)2学好化学---享受生活(2)用托盘天平称量样品时,若指针偏向右边,则表示 (填下列正确选项的代码)。
A .左盘重,样品轻B .左盘轻,砝码重C .右盘重,砝码轻D .右盘轻,样品重(3)在第③步操作时,有可能要重复进行,这是由于 ,从操作的角度分析原因可能有、 。
(4)在第④步操作时,要用玻璃棒不断小心地搅动液体,目的是防止 。
(5)所得产物中的钾盐除K 2CO 3外,还有 、 等。
6.蒸发和结晶(1)蒸发:通过蒸发或气化,减少一部分溶剂使溶液达到饱和而析出晶体。
此法主要用于溶解度随温度改变而变化 的物质。
仪器:铁架台(铁圈)、酒精灯、 、 。
(2)冷却热的饱和溶液:通过降低温度,使溶液冷却达到饱和而析出晶体。
重结晶指的是重复冷却结晶。
混合物分离和提纯方法

混合物分离和提纯方法混合物分离和提纯方法是化学实验和工业中常用的一项重要技术。
混合物由两个或多个不同的物质组成,而这些物质可以是固体、液体或气体。
分离和提纯混合物的目的是将其中的成分分开,进一步研究或利用这些物质。
1. 过滤法:过滤是将固体颗粒从液体中分离出来的方法。
它主要基于固体颗粒的粒径较大,而在液体中悬浮或溶解的特点。
在实验室中,常用滤纸和漏斗进行过滤。
工业上,还常用旋流分离器、离心机等设备进行高效的过滤操作。
2. 蒸发法:蒸发法是将溶液中的溶质分离出来的方法。
通过加热溶液,使液体中的溶质挥发和沉淀成固体的方式,可以得到纯净的溶质。
常用的蒸发设备包括烧杯、蒸发皿、旋转蒸发仪等。
3. 结晶法:结晶法是通过溶液中的溶质结晶来实现纯化的一种方法。
在溶液中加入一种溶质溶剂,通过加热或降低温度使溶质逐渐结晶出来,然后通过过滤或离心等操作分离出纯净的结晶体。
4. 溶解度差异法:溶解度差异法是根据不同物质在溶液中的溶解度差异来进行分离和提纯的方法。
当混合物中的两种或多种物质具有不同的溶解度时,可以通过逐渐改变温度、压力或溶剂成分等条件,使其中的某一种物质溶解或结晶出来,从而实现分离和提纯。
常见的溶解度差异法有结晶分离法、结晶等温反应法等。
5. 萃取法:萃取法是利用不同溶剂对不同成分的溶解能力差异进行分离和提纯的方法。
在混合物中加入适当的溶剂,能使其中一种成分溶解,而另一种成分不溶解,然后通过分液漏斗、萃取柱等设备,将两种成分分离出来。
6. 蒸馏法:蒸馏法是根据不同物质的沸点差异来进行分离和提纯的方法。
通过加热混合物,使沸点较低的物质先蒸发,然后经过冷凝和收集,得到纯净的物质。
蒸馏法有常压蒸馏、减压蒸馏、分馏蒸馏等不同的操作模式。
7. 气体分离法:气体分离法是根据气体分子的特性来进行分离和提纯的方法。
可以通过调节压力、温度或通过适当的吸附剂等,使混合气体中的一种或多种气体被吸附或吸附后释放,达到分离和提纯目的。
混合物的分离和提纯知识点

第一节化学实验基本方法混合物的分离和提纯一、分离和提纯分离:把混合物中的几种物质分开,分别得到纯净的物质提纯:将混合物中的杂质通过物理或化学方法除去而得到所需物质的过程二、混合物分离和提纯的常用方法:过滤、蒸发、结晶、蒸馏、萃取不溶性杂质的除去:溶解、过滤、蒸发结晶1、过滤:是分离固液混合物的最常用方法之一,主要是除去液体中的不溶性固体实例:除去食盐中不溶性泥沙(1)主要仪器:烧杯、漏斗、滤纸、铁架台(铁圈)、玻璃棒(2)过滤操作注意要点:一帖(滤纸紧贴漏斗内壁),二低(滤纸边缘低于漏斗边缘,液体的液面略低于滤纸边缘),三靠(漏斗颈的末端紧靠紧靠烧杯内壁,玻璃棒的低端紧靠三层滤纸处,烧杯尖嘴紧靠玻璃棒,)2、结晶:利用溶剂对被提纯物质及杂质的溶解度不同,可以使被提纯的物质从过饱和溶液中析出,而让杂质全部或大部分仍留在溶液中,从而达到被提纯的目的。
(1)实验仪器:蒸发皿,酒精灯,玻璃棒,铁架台(铁圈),烧杯(2)结晶方法:蒸发结晶、冷却结晶蒸发结晶:通过蒸发或气化,减少一部分溶剂使溶液达到饱和而析出晶体。
此法主要用于溶解度随温度改变而变化不大的物质。
(氯化钠)冷却结晶:通过降低温度,使溶液冷却达到饱和而析出晶体。
重结晶指的是重复冷却结晶。
此法主要用于溶解度随温度下降而明显减小的物质。
(硝酸钾)蒸发结晶操作注意:①蒸发过程中要不断用玻璃棒搅拌(搅拌防止局部温度过高造成液体飞溅)②蒸发皿内溶液不能超过其容量的2/3 ③当溶液中出现较多固体时停止加热靠余热蒸发剩余的水分3、粗盐的提纯(1)粗盐提纯中用到几次玻璃棒?作用分别是什么?共4次,①溶解:搅拌,加速溶解②过滤:引流③蒸发:搅拌,使受热均匀,防止液体飞溅④转移固体(2)粗盐中含有较多杂质(不溶性的泥沙、可溶性的CaCl2、MgCl2、硫酸盐Na2SO4)可溶性杂质的除去:除杂原则:不增、不减、易分、易复原不增:提纯过程中不增加新的杂质不减:不减少欲被提纯的物质易分:被提纯物与杂质容易分离易复原:被提纯物质容易复原(3)SO42-的检验方法:取少量待测溶液,先加入稀盐酸酸化(排除CO32-、Ag+干扰),若无沉淀生成,再加入BaCl2溶液,若出现不溶于稀酸的白色沉淀,则存在SO42-离子(4)粗盐提纯中可溶性杂质(CaCl2、MgCl2、硫酸盐Na2SO4)的除去除杂试剂选择:Na2CO3、NaOH、BaCl2(除杂试剂必过量,过量试剂必除去)还需要适量盐酸除杂顺序:Na2CO3要在BaCl2之后,NaOH只需在盐酸之前其中涉及方程式:Na2SO4+BaCl2=BaSO4↓+2NaClCaCl2+Na2CO3=CaCO3↓+2NaCl BaCl2+Na2CO3=BaCO3↓+2NaClMgCl2+2NaOH=Mg(OH)2↓+2NaClHCl+NaOH=NaCl+H2O HCl+Na2C O3=NaCl+H2O+ CO2↑4、蒸馏:利用液态混合物(互溶)中各组分沸点的不同,加热使其某一组分变成蒸气,经过冷凝后再变成液体,从而跟其他组分分开,目的是将易挥发、难挥发或不挥发的杂质除去(1)蒸馏所用仪器:酒精灯、石棉网、铁架台、蒸馏烧瓶、温度计、冷凝管、牛角管(尾接管)、锥形瓶(2)蒸馏实例:①蒸馏海水实现海水淡化②石油的分馏③从碘的四氯化碳溶液中获得碘单质并回收四氯化碳④酒精的提纯(3)蒸馏操作注意事项:①温度计的水银球位于蒸馏烧瓶的支管口处②冷凝管冷却水下口进上口出③蒸馏烧瓶底部要放石棉网,蒸馏烧瓶中要放入少量碎瓷片(沸石),防止液体暴沸④蒸馏烧瓶所盛液体不超过容积2/3,也不能少于1/3⑤加热温度不能超过混合物中沸点最高的物质的沸点⑥实验时先通入冷却水,再加热(结束相反),刚开始收集到的馏分应弃去,并控制好温度(4)Cl-的检验方法取少量待测溶液,先加入稀HNO3酸化(加硝酸排除CO32-干扰,不能滴加盐酸),再加入AgNO3溶液,如果出现不溶于稀硝酸的白色沉淀,则存在Cl-5、萃取:利用某种物质(溶质)在互不相溶的溶剂里溶解度的不同,用一种溶剂(萃取剂)把溶质从它与另一种溶剂所组成的溶液中萃取出来萃取剂选择:与原溶剂互不相溶、溶质在萃取剂中的溶解度较大、溶质与萃取剂不发生反应碘和水的分离:溶质:碘原溶剂:水萃取剂:四氯化碳碘易溶于酒精,能否用酒精将碘水中的碘萃取出来?不能常见萃取剂:四氯化碳(密度大于水);苯和汽油(密度小于水)6、分液:分离两种互不相溶且密度差别较大(密度不同)的液体混合物的方法仪器:分液漏斗分液漏斗在使用之前要检查是否漏水,如何检验?关闭分液漏斗的活塞,向其中加入适量的水,观察活塞是否漏水,如不漏水,将活塞旋转180°,再观察是否漏水,然后将漏斗倒置,用同样的方法检查漏斗口的塞子是否漏水用四氯化碳萃取碘水中的碘实验步骤:①检查分液漏斗是否漏水②加入碘水和萃取剂四氯化碳③振荡,放气(为什么要振荡?振荡过程中还有一步操作是什么?振荡是要使液体充分混合,振荡后要打开活塞放出产生的气体)④静置,分层⑤分液(静置分层后,为什么要打开上口的玻璃塞?液体是如何分离开的?静置分层打开上口玻璃塞是使漏斗内外压强相等,便于液体流出;液体分离时要注意下层液体从下端放出,上层液体从上口倒出)实验现象:碘水呈棕黄色,加四氯化碳后上层几乎无色,下层紫色7、萃取与分液的关系:分液前不一定萃取,萃取后通常需要分液练习:酒精、苯、CCl4、煤油都是有机溶剂,有机溶剂之间大都能互溶;碘(I2)难溶于水,易溶于有机溶剂,其溶液呈紫色;溴(液溴)的性质与碘相似,其溶液呈橙色。
混合物的分离和提纯的方法

混合物的分离和提纯的方法一、知识结构:1、物理方法:⑴、过滤⑵、结晶①、蒸发溶剂法②冷却热饱和溶液法2、化学方法:⑴、化气法⑵、沉淀法⑶、高温或加热法⑷、溶解法⑸、置换法⑹、吸收法⑺、综合法二、主要内容:(一)、物理方法:1、过滤法:通常用于或之间的分离和提纯。
2、结晶法:适用于两种或多种的分离和提纯。
(1)、蒸发溶剂法:常用于的固态物质的分离和提纯。
(2)、冷却热饱和溶液法:适用于几种固态物质的混合物的分离和提纯。
(二)、化学方法:1、用化学方法进行混合物的分离和提纯时要遵循的原则:①、所选试剂只与杂质反应,而不与被分离或提纯的物质反应;②、操作过程不能引入新杂质;③、反应后的生成物与被分离或提纯的物质易于分离。
2、常用的化学方法有:通过高温或加热,杂质分解或变成气体而除去。
再经过滤使物质留在滤纸上。
被除去。
剂吸收而被除去。
①化学转化法:即当不能一次把杂质直接除去时,可先把被保留的物质与某试剂反应变成“其它物质”,通过一定方法把杂质除去后,再把该“其它物质”转化为原物质。
②物理、化学综合法:当混合物中含有多种杂质时,首先考虑其中的杂质是否可用物理方法除去,然后用化学方法除去其余杂质。
三、例题:如何除去NaCl中混有的少量KNO3 ?如何除去KNO3中混有的少量NaCl?除去Na2SO4溶液中混有的少量Na2CO3,可加入适量()A、稀盐酸B、稀H2SO4C、BaCl2溶液D、Ca(NO3)2溶液为了除去NaCl晶体中混有的少量Fe2(SO4)3杂质,加适量水溶解后,应向所得溶液中加入的试剂和实验操作过程,正确的是()A、滴加适量NaOH溶液、蒸发、过滤;B、滴加适量BaCl2溶液、蒸发、过滤;C、滴加适量Ba(OH)2溶液、蒸发、过滤;D、滴加适量AgNO3溶液、蒸发、过滤;:欲除去KCl晶体中含有的少量KClO3,选用的试剂或方法是 , 化学方程式为: 。
)A、水B、盐酸C、 NaOH溶液D、H2SO4溶液:下列各项中括号里的物质是杂质所用的药品,其中错误的是()A、NaCl中混有Na2CO3(H2SO4) B、铁粉中混有铜粉(HCl)C、H2中混有HCl气体(NaOH溶液)D、FeSO4溶液中混有CuSO4(铁粉)四、作业:1、对于下列各组混合物:①、NaNO3与NaCl;②、CaCl2和CaCO3 ;③、MnO2和KCl;④、BaSO4和AgCl;可按溶解、过滤、蒸发的实验操作顺序,将其分离的是()A、①④B、②③C、③④D、②④2、下列括号中的物质是除去杂质所用药品,其中错误的是()A、CaCl2中有杂质CaCO3(HCl)B、CO2中有少量CO(O2)C、H2中混有HCl气体(NaOH溶液)D、FeSO4溶液中混有CuSO4(铁粉)3、只用一种试剂除去NaNO3溶液中混有的少量CuSO4杂质,应加入适量的()A、NaOH溶液B、Ba(NO3)2溶液C、HNO3溶液D、Ba(OH)2溶液4、向下列各物质中加入适量盐酸后过滤或蒸发,不能得到纯净物的是( )A、铜粉中混有少量铁粉B、NaCl中混有少量Na2CO3C、Na2SO4中混有少量Na2CO3D、炭粉中混有少量CuO5、欲除去NaNO3溶液中含有的少量NaCl和BaCl2杂质,得到纯净的NaNO3溶液,应依次加入适量的()A、AgNO3溶液、稀H2SO4B、稀H2SO4、AgNO3溶液C、AgNO3溶液、Na2CO3溶液D、Na2SO4溶液、AgNO3溶液6、下列各组物质中,括号内的气体是需要检验的杂质,其中检验方法合理的是()A、H2 、CO2(CO):先通入加热的CuO,再通入Ca(OH)2溶液中B、H2 (CO2 、HCl):先通入AgNO3溶液,再通入Ca(OH)2溶液中C、O2(CO):先通入加热的CuO,再通入Ca(OH)2溶液中D、CO(H2O、CO2):先通入浓H2SO4,再通入Ca(OH)2溶液中7、分离FeCl3、KCl、BaSO4的混合物,再不引人其它杂质的情况下,应采用的一组试剂是()A、水、AgNO3溶液、稀HNO3B、水、NaOH溶液、稀盐酸C、水、KOH溶液、稀盐酸D、水、KOH溶液、稀HNO38、为除去下面标号①--④物质中的杂质(括号内为杂质),可选用除杂质的方法有四种:A、加适量水,溶解后过滤;B、高温灼烧;C、加适量稀盐酸,蒸发结晶;D、加适量稀盐酸,过滤,将选用方法的序号填写在题后的空格处:①、CaO (CaCO3);②、Cu(Fe);③、NaCl(Na2CO3);④、CaCO3(KNO3);9、实验室用含CaCO3的锌粒与盐酸反应含的制取氢气,这样制得氢气中混有、、气体杂质,除去氢气中的这些杂质气体的方法是让气体依次通过盛、、的洗气瓶。
最新高中化学-2018届高考化学物质的分离、提纯与检验

第34讲物质的分离、提纯与检验考点1物质的分离提纯1.物质的分离、提纯的一般原则:分离或提纯一般应遵循“两不两易”原则,即不增加,不减少所需物质,所选试剂便宜易得,欲得物质易于。
2.物质分离提纯的常用方法①物理方法: 过滤、结晶重结晶、蒸发、蒸馏、分馏、分液、萃取、升华、渗析、溶解、盐析、洗气等。
②化学方法:(1)加热法:混合物中混有性差的物质时,可直接加热,使热稳定性差的物质分解而分离出去,有时受热后能变为被提纯的物质。
例如,食盐中混有氯化铵。
(2)沉淀法:在混合物中加入某试剂,使其中一种以沉淀形式分离出去的方法。
使用该种方法一定要注意不能引入新。
若使用多种试剂将溶液中不同离子逐一沉淀,这时应注意后加试剂能将先加试剂的过量部分除去,最后加的试剂不引入新杂质。
例如,加适量BaCl2溶液除去NaCl中的Na2SO4。
(3)转化法:不能通过一次反应达到分离的目的,而要经过转化为其他物质才能分离,然后在将转化物质恢复为原物质。
例如,苯酚中混有硝基苯时,先加入NaOH溶液后分液,再向苯酚钠溶液中通入CO2重新生成苯酚等。
注意转化过程中尽量减少被分离物的损失。
(4)酸碱法:被提纯物不与酸反应,而杂质与酸可反应,用酸作除杂试剂;被提纯物不与碱反应,而杂质与碱易反应,用碱作除杂试剂。
例如,用氢氧化钠除去铁粉中的铝粉。
(5)氧化还原法:对混合物中含有还原性杂质,加入适当氧化剂使其氧化为被提纯物质;对混合物中含氧化性杂质,可加入适当还原剂将其还原为被提纯物质。
例如,FeCl2中含有FeCl3,加入铁粉,振荡过滤,即可除去FeCl3而又不引入新的杂质。
②化学方法:加热法、沉淀法、转化法、酸碱法、氧化还原法等。
特别提醒:在解答物质提纯试题时,选择试剂和实验措施应考虑三个方面:①不能引入新杂质;②提纯后的物质成分不变;③实验过程和操作方法简单易行。
[例1](黄冈中学2018届高三月考)下列各组混合物的分离或提纯方法不正确的是()A.用过滤法分离Fe(OH)3胶体和FeCl3溶液的混合物B.用结晶法提纯NaCl和KNO3的混合物中的KNO3C.用蒸馏法分离乙醇和苯酚的混合物D.除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤[解析]胶体不能透过半透膜,能透过滤纸,不能用过滤的方法分离Fe(OH)3胶体和FeCl3溶液的混合物。
混合物的化学分离和提纯方法归纳

混合物的化学分离和提纯方法归纳河北省宣化县第一中学栾春武物质的分离是指将混合物中的不同物质分开,而且各物质还要保持原来的化学成分和物理状态;物质的提纯是指将混合物净化除去其杂质,得到混合物中的主体物质,提纯后的杂质不必考虑其化学成分和物理状态。
混合物的分离方法有许多种,但根据其分离的本质可分为两大类,一类是化学分离法,另一类就是物理法,一般情况下,利用物理方法无法分离的混合物,就考虑利用化学方法分离,下面就混合物的化学分离和提纯方法归纳如下:一、分离和提纯的原则:1.引入的试剂一般只跟杂质反应。
2.后续的试剂应除去过量的前加的试剂。
3.不能引进新物质。
4.杂质与试剂反应生成的物质易与被提纯物质分离。
5.过程简单,现象明显,纯度要高。
6.尽可能将杂质转化为所需物质。
7.除去多种杂质时要考虑加入试剂的合理顺序。
8.如遇到极易溶于水的气体时,要防止倒吸现象的发生。
二、分离和提纯常用的化学方法:1.加热法:当混合物中混有热稳定性差的物质时,可直接加热,使热稳定性差的物质分解而分离出去。
如NaCl中混有NH4Cl,Na2CO3中混有NaHCO3等均可直接加热除去杂质。
2.沉淀法:在混合物中加入某种试剂,使其中一种以沉淀的形式分离出去的方法。
使用该方法一定要注意不能引入新的杂质。
若使用多种试剂将溶液中不同微粒逐步沉淀时,应注意后加试剂的过量部分除去,最后加的试剂不引入新的杂质。
如加适量的BaCl2溶液可除去NaCl中混有的Na2SO4;再如NaCl溶液中混有MgCl2、CaCl2杂质,可先加入过量的NaOH,使Mg2+转化为Mg(OH)2沉淀而除去(同时引入了OH-杂质);然后加入过量的Na2CO3,使Ca2+转化为CaCO3沉淀而除去(同时引入了CO32-杂质);最后加入足量的盐酸,并加热除去OH-及CO32-(加热的目的是赶走溶液中存在的CO2及HCl),并调节溶液的pH至中性。
3.酸碱法:被提纯的物质不与酸碱反应,而杂质可与酸碱反应,用酸碱作除杂试剂。
混合物的分离和提纯(过滤和蒸发)

混合物的分离和提纯(过滤和蒸发)混合物的分离和提纯(过滤和蒸发)【学习⽬标】1、通过粗盐提纯实验,进⼀步掌握溶解、过滤、蒸发基本操作。
2、掌握SO42-检验的原理和⽅法。
【重点难点】1、粗盐提纯的原理及溶解、过滤、蒸发等操作。
2、检验SO42-的原理和⽅法。
【思考与交流】⑴同学们都听过“吹尽黄沙始见⾦”,你知道淘⾦者是利⽤什么⽅法和性质将黄⾦从沙⾥分离出来的吗?答:他们利⽤的是黄⾦和沙的密度不同;利⽤在⽔⾥淘洗的⽅法可以将⾦⼦从沙⼦⾥分出来⑵如果有铁和铜的混合物,你能⽤哪些⽅法将铁铜分离?答:淘⾦者的⽅法⽤磁铁吸引铁加盐酸⑶你还能举出⼏种⽣活中混合物分离和提纯的例⼦吗?它们是怎么分开的?分离:农村把稻⾕加⼯成⼤⽶时,常⽤筛⼦分离⼤⽶与糠;农村做⾖腐常⽤纱布袋将⾖腐渣与⾖浆分离;在淘⽶时,常⽤倾倒法将洗⽶⽔与⼤⽶分离;当⽔中混有较多油⽽分层时,⽤吸管可逐渐吸出上层的油;当铁屑和铜屑混在⼀起时,可⽤磁铁分离等。
提纯:提取海带中的碘、从海⽔中提取⾷盐、从海⽔中提取溴、淡化海⽔、还有各种化学物质的精制:粗盐制精盐、⽆⽔酒精的⽣产等【⾃主学习】1、分离和提纯:利⽤混合物中组分的__性质_(物理性质,如:溶解性不同等;化学性质,如与物质反应的不同现象等)不同,除去_杂质_以达到提纯的⽬的。
思考:分离和提纯有何不同?分离:把混合物中的多种物质相互分开,分成不同的纯净物且要求恢复到原本状态;提纯:将⼀种特定的物质从混合物中提取出,将杂质除去。
2、混合物的分离和提纯的基本⽅法有过滤、蒸发、蒸馏、萃取和分液等。
不同的混合物可以选取不同的分离⽅法。
固体与固体混合物:(1)、若杂质易分解、升华时,可⽤加热法,如:除去NaCl中混有少量NH4Cl、粗碘的提纯等;(2)、若⼀种易溶⽔,另⼀种难溶⽔,可⽤溶解过滤法,如除去粗盐中的不溶性杂质;(3)、若两者均易溶,但其溶解度受温度影响不同,⽤重结晶法,如KNO3与NaCl 的分离。
混合物的分离和提纯的方法

混合物的分离和提纯的方法
混合物的分离和提纯的方法有以下几种:
1. 过滤: 过滤是将固体和液体混合物中的固体颗粒从液体中分离出来的方法。
通过将混合物通过滤纸或者筛网,固体颗粒会被截留在滤纸或者筛网上,而液体则通过滤纸或者筛网流出。
2. 蒸馏: 蒸馏是一种通过液体的沸点差异分离液体混合物组分的方法。
混合物被加热,液体组分蒸发并通过冷凝器冷却成为液体,而固体成分则留在烧瓶中。
3. 晶体化: 晶体化常用于从溶液中分离出所需的固体晶体。
将溶液慢慢蒸发,溶质因为溶剂的质量损失而溶解度下降,直至溶质达到饱和,形成晶体。
4. 萃取: 萃取是一种利用两种互不相溶的溶剂来分离混合物中的组分的方法。
其中一种溶剂选择性地溶解其中一种组分,而另一种组分仍然留在原溶液中,通过分液漏斗分离两种溶液并收集目标组分。
5. 离心: 离心是一种利用离心机使混合物中不同密度的组分分离的方法。
通过快速旋转离心机,重力作用使密度不同的组分分层,并可借助离心管取出所需的组分。
这些方法可以单独使用,也可以根据混合物的性质和成分组合使用,以实现对混
合物的有效分离和提纯。
高中化学-混合物的分离与提纯(1)

(4)若滤液浑浊,应继续过滤,直到滤液澄清为止。
蒸发操作
(2)蒸发 ①蒸发的目的是什么? 分离溶于溶剂中的固体溶质 ②蒸发操作时的注意事项? *加入的液体不超过蒸发皿容积的2/3。 *蒸发过程中要用玻棒不断搅拌(以防 溶液 因局部过热而造成液滴飞溅)。
装置
举例
除去氯化钠溶 液中的泥沙
注意事项: “一贴二低三 靠”
蒸发食盐溶液 获得食盐晶体 注意事项
8
思考
溶解、过滤、蒸发时都使用了玻璃棒,它的作 用分别是什么? 溶解时:搅拌,加速溶解
过滤时:引流
蒸发时:搅拌,使液体受热均匀, 防止局部过热,出现飞溅
粗盐的提纯
粗盐 溶解
悬浊液(泥沙、NaCl、MgCl2、CaCl2、硫酸盐)
钡盐(BaCl2)溶液。
现象:出现不溶于稀酸的白色沉(BaSO4)。
结论:存在SO42- 。
注意排除CO32-、SO32-等离子的干扰!
CO32-的检验方法:
操作:加入稀HCl,将产生的无色无味的气体通入 澄清石灰水
现象:澄清石灰水变浑浊 结论:存在CO32-
硫酸根离子的检验 12免、、引检混入应 检验 合可C排 验物N用la-除 是中H2CCOC否可l3O和中含能32B-是有含干aC否S有扰lO2含/C4—2O-有—3,2B-Na用应aCS2l酸排OS24O和2除4- HCNONO3O323--、Ag+干扰,避
过滤操作中应注意的问题
“一贴二低三靠”
倾倒液体的烧杯紧 靠玻璃棒
滤纸边缘低于漏斗边 缘,液面低于滤纸边 缘
混合物的化学分离和提纯方法归纳

混合物的化学分离和提纯方法归纳混合物的化学分离和提纯方法归纳物质的分离是指将混合物中的不同物质分开,而且各物质还要保持原来的化学成分和物理状态;物质的提纯是指将混合物净化除去其杂质,得到混合物中的主体物质,提纯后的杂质不必考虑其化学成分和物理状态。
混合物的分离方法有许多种,但根据其分离的本质可分为两大类,一类是化学分离法,另一类就是物理法,一般情况下,利用物理方法无法分离的混合物,就考虑利用化学方法分离,下面就混合物的化学分离和提纯方法归纳如下:一、分离和提纯的原则:1.引入的试剂一般只跟杂质反应。
2.后续的试剂应除去过量的前加的试剂。
3.不能引进新物质。
4.杂质与试剂反应生成的物质易与被提纯物质分离。
5.过程简单,现象明显,纯度要高。
6.尽可能将杂质转化为所需物质。
7.除去多种杂质时要考虑加入试剂的合理顺序。
8.如遇到极易溶于水的气体时,要防止倒吸现象的发生。
二、分离和提纯常用的化学方法:1.加热法:当混合物中混有热稳定性差的物质时,可直接加热,使热稳定性差的物质分解而分离出去。
如NaCl中混有NH4Cl,Na2CO3中混有NaHCO3等均可直接加热除去杂质。
2.沉淀法:在混合物中加入某种试剂,使其中一种以沉淀的形式分离出去的方法。
使用该方法一定要注意不能引入新的杂质。
若使用多种试剂将溶液中不同微粒逐步沉淀时,应注意后加试剂的过量部分除去,最后加的试剂不引入新的杂质。
如加适量的BaCl2溶液可除去NaCl中混有的Na2SO4;再如NaCl溶液中混有MgCl2、CaCl2杂质,可先加入过量的NaOH,使Mg2+转化为Mg(OH)2沉淀而除去(同时引入了OH-杂质);然后加入过量的Na2CO3,使Ca2+转化为CaCO3沉淀而除去(同时引入了CO32-杂质);最后加入足量的盐酸,并加热除去OH-及CO32-(加热的目的是赶走溶液中存在的CO2及HCl),并调节溶液的pH至中性。
3.酸碱法:被提纯的物质不与酸碱反应,而杂质可与酸碱反应,用酸碱作除杂试剂。
混合物的分离与提纯

混合物的分离与提纯1、过滤和提纯①过滤:利用物质的可溶性不同,分离难溶物与可溶物②蒸发:利用溶液沸点不同,加热使溶剂挥发,分离溶质与溶剂2、蒸馏与萃取①蒸馏:利用液体沸点不同,提纯液态纯净物②萃取:利用溶质在不同溶剂中的溶解度不同分离溶液2、过滤:“一贴”,滤纸紧贴漏斗的内壁,中间不留有气泡(操作时要用手压住,用水润湿“二低”,滤纸的边缘低于漏斗口,漏斗里的液体低于滤纸的边缘“三靠”,倾倒液体的烧杯尖口要紧靠玻璃棒,玻璃棒的末端轻靠在三层滤纸的一边,漏斗下端的管口靠烧杯内壁。
若:滤液浑浊应再过滤一次不增不加入新的物质不减不消耗被提纯的物质如:不能减少NaCl成分易分杂质转换为沉淀,气体等易分离除去如:将NaCl溶液中可能存在Na2SO4 转换为沉淀Baso43、蒸发(1)蒸发皿的液体不超过容积的2/3(2)加热时,用玻璃棒不断搅拌(3)接近蒸干时,利用余热加热(4)取下未冷却的蒸发皿时,要放在石棉网蒸馏实验注意事项①所盛液体不超过蒸馏瓶球部容积的1/2 加热时,不能将液体蒸干②温度计的水银球应位于蒸馏烧瓶的支管口下沿③蒸馏瓶内要加几颗沸石或瓷片,防止液体爆沸④冷凝管中通冷却水时,下口进水,上口出水萃取液体混合物中一种溶质在互不相溶的溶剂里溶解性不同,用一种溶剂把溶质从它与另一溶剂所组成的溶液中提取出来.使用分液漏斗注意事项1、使用前检查是否漏水2、加入萃取液后要先倒转分液漏斗用力振荡,再静置3、分液时,上层液体由上口倒出,下层液体由下端流出且分液漏斗下端紧贴烧杯内壁CCl4与H2O比较有何异同?同:都能溶解碘单质(I2);都不与碘单质(I2)反应。
异:CCl4与H2O互不相溶;碘单质在CCl4中的溶解度大。
萃取剂选择条件1、与原溶剂互不相溶如,CCl4与H2O互不相溶2、溶解溶质的能力大于原溶剂如,CCl4(I2)>H2O (I2)3、不与被萃取的物质反应如,CCl4不与I2反应4 萃取剂与原溶剂密度不同。
高中化学 每日一题 混合物的分离与提纯

混合物的分离与提纯
高考频度:★★★★★
难易程度:★★★☆☆
典例在线
除去下列物质中的杂质,所用试剂和方法正确的是
解题必备
一、常见的分离方法归纳对比
二、混合物的分离与提纯
1.分离和提纯的要求
(1)分离
分离是指把混合物的各组分一一分开,每一组分都要保留下来,且原来是固体,最后还应是固体,原来是溶液,最后还应是溶液。
分离的实质是把混合物中各种成分分开,这就需要应用物质的物理性质或化学性质,把不同的物质以不同的形式分开,然后再把物质恢复成原来的状态。
分离的条件是各种物质必须以不同的状态出现,如果物质直接分离有困难,需要把物质转化为其他的物质,分离开后再各自反应成原来的物质。
分离的适用范围是混合物。
例如要从粗盐(NaCl和少量泥沙的混合物)中分离出NaCl,可将粗盐溶于水,过滤,对滤液进行蒸干,即得NaCl固体。
(2)提纯(除杂质)
提纯是指保留混合物中的某一主要组分,把混合物中其余杂质通过化学变化都除去。
提纯的实质是混合物中只保留一种成分,分离后需要的物质保留原来的状态,其他物质不需要恢复成原来的状态。
提纯的条件是需要的物质与其他的物质必须以不同的状态出现,各种杂质可以以相同的状态同时出现。
提纯的适用范围是混合物。
例如实验室制得的二氧化碳气体中混有少量水蒸气,要得到纯净的CO2,可使混合气体通过盛有浓硫酸的洗气瓶,除去水蒸气,就可得到纯净的CO2气体。
(完整版)2018年高考化学二轮习题物质的分离和提纯

物质的分离和提纯考点一物质分离、提纯的常用物理方法一、物质分离、提纯的区别1.物质的分离将混合物的各组分分离开来,获得几种纯净物的过程。
2.物质的提纯将混合物中的杂质除去而得到纯净物的过程,又叫物质的净化或除杂。
二、物质分离、提纯的常用物理方法试根据所学的知识填写操作方法及相关内容。
1.过滤:装置:如图1适用范围:把不溶性进行分离。
注意事项:①一贴:滤纸紧贴漏斗内壁;二低:滤纸上缘低于漏斗边缘,液面低于滤纸边缘;三靠:烧杯紧靠玻璃棒,玻璃棒轻靠三层滤纸处,漏斗下端紧靠烧杯内壁。
②若滤液浑浊,需更换滤纸,重新过滤。
浑浊的原因可能是滤纸破损、滤液超过滤纸边缘。
2.结晶:是晶体从饱和溶液中析出的过程,蒸发结晶:对溶解度受温度变化影响不大的固态溶质,采用蒸发溶剂的方法,装置:如图2适用范围:溶解度随温度变化较小的物质。
注意事项:①玻璃棒的作用:搅拌,防止液体局部过热而飞溅;②当有大量晶体析出时,停止加热,利用余热蒸干,而不能直接蒸干。
降温结晶:对溶解度受温度变化影响相当大的固态溶质,采用冷却饱和溶液的方法。
适用范围:溶解度随温度变化较大的物质;受热易分解的物质;带结晶水的物质;受热易被氧化的物质;水解的盐;一般流程:蒸发浓缩→降温结晶→过滤→洗涤→干燥3.分液:装置:如图3适用范围:①萃取:利用溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液里提取出来;②分液:两种液体互不相溶且易分层。
注意事项:①溶质在萃取剂中的溶解度比在原溶剂中大;②萃取剂与原溶剂不反应、不相溶;③萃取剂与溶质不反应。
4.蒸馏装置:如图4适用范围:沸点相差较大的液体混合物。
注意事项:①温度计的水银球放在蒸馏烧瓶的支管口处;②蒸馏烧瓶内要加沸石;③冷凝管水流方向应为“逆流”。
5.升华装置:如图5适用范围:某种组分易升华的混合物,利用物质升华的性质在加热条件下分离的方法。
小结:(1)难溶性固体与液体混合物可用过滤法分离。
高一化学混合物的分离和提纯

思考与交流 1、利用什么方法和性质将金子与沙子分离 2、如何分离铁屑和沙子
二、混合物的分离与提纯
1、过和蒸发 ①过滤:利用物质的可溶性不同
分离难溶物与可溶物 ②蒸发:利用溶液沸点不同
加热使溶剂挥发,分离溶质与溶剂
P5:学与问
化学上的杂质不一定是有害或无价值的,如水中 含有的一些矿物质和微量元素是对人体有益的。可见 要视杂质性质及含量来评价其是否有害或在人类活动 中是否有利用的价值。
化学中的除杂,主要是因为杂质的存在会影响某 物质的利用价值,如在化学反应中杂质的存在可能会 引起一些副反应等
;华哥 https:///0528/index.html ;
为地图学家 反对政治黑暗 就所居地作为土著 侨州 郡 县的设置 ?替晋元帝制造威望 即表示这段历史 民屯废止以后 但军力不足 司马氏崛起 手工业主要由官府专营 刘徽自幼学习《九章算术》 军事体制府兵制 避免泛滥成灾 之后益州刺史罗尚击杀巴氐领袖李特 孙恩连年 从海岛入寇 占有东晋三分之二的土地 但专政朝廷的司马道子忌讳谢氏功高 晋武帝颁布去州郡兵及封国制 使南方得到大规模开发 ?[70] [9] 中央与方镇对立及野心家的崛起 国土面积 谱学是吏部选官的重要依据 最后相继被杀 由于他们需要纳税 全国有“户二百四十五万九千八 百四十 前秦东晋对峙时期;胡夏 废除三州 一百五十三郡及五百八十九县 晋朝虽为汉末以来中国文化中衰时期 氐将苻洪在石虎去世后投降东晋 使侯景攻入建康 魏晋玄学虽然自称学老子 叛逃的多达二十万户 晋廷经数十年方镇压 以彼径寸茎 宋孝武帝在位前期在政治 经济 军制 户籍 礼制 税制等领域等领域均推行了系列改革 并在参合陂之战击溃燕军 最后政府税收短缺 中军统帅为中军将军 西晋 魏文帝曹丕为了抑制浮华朋党之弊 贵族 官僚争相侵占田地 田庄中
混合物的分离与提纯

▲SO42-的检验方法
先加入稀HNO3或稀HCl酸化, 再加入可溶性钡盐溶液,如果出 现不溶于稀酸的白色沉淀,则存 在硫酸根离子。
注意排除CO32- SO32-等离子的干扰,酸和钡盐的 选择应该视具体情况而定,不能一成不变
如何检验NaCl中的杂质
Ca2+
——可溶性碳酸盐CO32- [Na2CO3、K2CO3]
滤 面不能超过滤纸边缘。若滤 漏斗颈流入另一烧
液浑浊,再过滤一次杯中 Nhomakorabea3、 将滤液倒入蒸发皿中,然后 水分蒸发,逐渐析 蒸 用酒精灯加热,同时用玻璃 出固体 发 棒不断搅拌溶液,待出现较
多固体时停止加热
问题(理论分析)
通过上述方法得到的NaCl是纯净吗?
可能会有什么杂质?
如何检验这些杂质的存在? 如何得到比较纯净的NaCl呢?
3、检验Na2SO3中是否含有SO42- 排除SO32-的干扰——用酸,并避免引入HNO3
BaCl2和HCl
4、检验一未知溶液中是否含有SO42- 考虑CO32-、Ag+、SO32-的干扰
最佳方法—— HCl 酸化的BaCl2
与你一起交流
• 你知道沙里淘金吗? 利用沙和金不同的 比重进行分离
蒸馏在日常生活中的应用
► 2. BaCl2→ Na2CO3 → NaOH →HCl
► 3. NaOH →BaCl2→ Na2CO3 →HCl
1、只要Na2CO3加在BaCl2之后便合理 2、最后加入的盐酸只能适量
二、总结提纯物质的基本思路
• 确定物质的组成,即含有哪些杂质 • 选择最适当的方法进行提纯[物理还是化学方
法(把杂质转化成沉淀、气体或是水)] • 选择适当的除杂试剂,尽量不引入新杂质;
混合物的分离和提纯

混合物的分离和提纯
物质的分离:
将混合物中各物质彼此分开的操作。
物质的提纯:
把混合物中的杂质除去,以得到纯净物的过程。
一. 过滤与蒸发
过滤: 将液体与难溶性固体进行分离 蒸发: 将溶液浓缩、使溶质以晶体析出的方法。
主要仪器: 烧杯、玻璃棒、漏斗、铁架台 酒精灯、蒸发皿、坩埚钳、铁架台
过滤操作中应注意那些问题? 一贴,二低,三靠
4、已知丙酮是一种有机化合物,为无色液体,易 溶于水,密度小于1 g/cm3,沸点约为55℃,要从 丙酮和水的混合物中将丙酮分离出来,下列方法 中最合理的是( )
A.蒸馏 B.分液 C.过滤 D.结晶
思考交流:
过滤后,如何得到较洁净的沉淀物?
需对沉淀物进行洗涤 向过滤器里加入适量蒸馏水,使水面浸没 沉淀物,待水滤去后,再加水洗涤,连续 洗涤3—4次,直至沉淀物洗净为止。
烧杯紧靠玻璃棒
漏斗下端紧 靠烧杯内壁
玻璃棒紧靠 三层滤纸上
蒸发操作注意事项:
(1)加热过程中要不断搅拌,以免溶液溅出
(2)当析出大量晶体时,熄灭酒精灯,余热蒸干。
思考交流:下列操作中玻璃棒的作用
溶解时: 过滤时: 蒸发时: 搅拌,使液体受热均匀,防止局部 过热,出现飞溅
三.蒸 馏 1.原理过程: 利用互溶的液体混合物中各组分的沸点不同, 给液体混合物加热,使其中的某一组分变成蒸气 再冷凝成液体,从而达到分离提纯的目的。
2、现有四组混合液: ①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质碘的水溶液 ④石灰浆 分离以上各混合液的正确方法依次是 A.过滤、分液、萃取、蒸馏 B.萃取、蒸馏、过滤、分液 C.分液、蒸馏、萃取、过滤 D.蒸馏、过滤、萃取、分液
专题04 物质的分离和提纯-高考全攻略之备战2018年高考化学考点一遍过_最新修正版

考点04 物质的分离和提纯一、分离与提纯(1)混合物的分离是根据混合物中各组分的物理性质或化学性质的差异,通过一定的物理变化或化学变化将混合物分成各组分的纯净物。
(2)混合物的提纯是根据混合物中各组分的物理性质或化学性质的差异,通过一定的物理变化或化学变化将混合物中的杂质除去。
分离和提纯的要求不同,设计操作步骤时一定要加以区别。
二、物质的分离与提纯的基本方法(一)物质的分离与提纯的物理方法1.蒸发——分离易溶性固体和溶剂。
2.过滤——分离不溶性固体和液体。
操作注意事项:一贴:滤纸紧贴漏斗内壁。
二低:滤纸低于漏斗口,液面低于滤纸边缘。
三靠:烧杯紧靠玻璃棒,玻璃棒轻靠三层滤纸,漏斗下端紧靠烧杯内壁。
3.萃取和分液(1)萃取:利用溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液里提取出来并分液。
(2)分液:分离两种互不相溶的液体。
①萃取剂须具备的条件:溶质在萃取剂中的溶解度比在原溶剂中要大得多;萃取剂与原溶剂互不相溶;萃取剂与溶质不发生反应。
②分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出。
4.蒸馏(或分馏)——分离沸点不同,且相互混溶的两种(或几种)液体。
5.升华——分离易升华与不升华的固体混合物。
6.渗析——用半透膜使离子或小分子从胶体中分离出来,如除去淀粉胶体中的NaCl。
将要提纯的胶体装入半透膜袋中,将袋系好,浸入蒸馏水中,并不断更换蒸馏水,渗析时间要充分。
7.盐析法(盐析后过滤)——将胶体从混合物中分离。
实例:蛋白质溶液中加饱和(NH4)2SO4。
(二)物质的分离与提纯的化学方法考向一分离、提纯的原理与方法典例1我国明代《本草纲目》记载了烧酒的制造工艺:“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次……价值数倍也”。
这里用到的实验方法可用于分离A.苯和水B.乙酸乙酯和乙酸C.食盐水和泥沙D.硝酸钾和硫酸钠【答案】B1.下列实验中,所采取的分离方法与对应原理都正确的是混合物分离、提纯的物理方法归纳考向二分离仪器或装置的识别和选择典例1 下列仪器:①普通漏斗;②容量瓶;③蒸馏烧瓶;④天平;⑤分液漏斗;⑥滴定管;⑦燃烧匙。
混合物的分离和提纯

一、基本原理
1、物质的分离是把混合物的各种成 分分开,分别得到纯净的物质;物质的 提纯是把物质中所含的杂质除去,以得 到纯净的物质。
2、ห้องสมุดไป่ตู้质提纯时原则
归纳为“不增、不 减、易分、复原”
• 不能引入新杂质,若引入,必须进一步 除去 • 提纯后物质成分不变(该成分的量若能 增多则更好) • 实验过程和操作方法简单易行
使用前要检查装置的气密性!
检查装置气密性
操作原理: 依据改变体系压强时产生 的现象(如气泡的产生、水柱的形成、 液面的升降等)来判断仪器装置是否密 封。
检查装置气密性
微热法 需要将导气管活塞关 闭才可检验 需要用水封住 漏斗的下端才 可检验 液差法
方法三:萃取分液
(1)将溶液注入分 液漏斗,溶液总量 不超过其容积3/4, 如图所示,两手握 住分液漏斗、倒转 分液漏斗并反复、 用力振荡。 (2)把分液漏斗放 在铁架台的铁圈中 静置、分层。 (3)打开旋塞,使 下层液体流出。
爹娘就是君臣关系,她把这十三年来父母的养育之恩以及从今往后的孝敬之情,全都融进了这长久的跪拜之中。即使大礼行完,她仍是不愿起来, 这养育之恩和孝敬之情,今生今世都报答不完!从今后,她是君,爹娘是臣,年迈的爹娘不但享不了她的孝道,更要向她行跪拜大礼,她的心中 简直就像是在刀割。从父母的房中出来,玉盈陪着冰凝壹起回到房里,望着姐姐,冰凝壹边拉着她的手壹边说:“姐姐,今天是咱们最后壹次相 依相伴,姐姐今天就歇在妹妹这里可好?”“好啊!姐姐只是怕影响了你休息,明天还要有壹整天的忙碌呢。”“不碍事的!妹妹只想跟姐姐在 壹起,凝儿不想跟什么王爷成亲!”“凝儿,这话万万不可再说!当着姐姐的面就算了,明日嫁到了王府,人多口杂,如若被旁的什么人听了过 去,惹出事端,凭白让爹娘担心。”“凝儿记住了,姐姐放心吧。凝儿也就是跟姐姐说说知心话,王府的人,凝儿壹定会小心躲避的。”“凝儿, 王爷是你的夫君,你是没有见过,你要是见过了,壹定会喜欢的。”“姐姐何出此言?您又没有见过王爷。”“嗯,嗯,姐姐也是听别人说的, 王爷是壹个俊朗、沉稳、重情重义的人……”“别人?怕是四福晋吧!四福晋当然要说王爷的好话了,姐姐怎么能够轻易地相信她的话?她是王 爷的嫡福晋,不过就是王爷的说客而已!”“凝儿,你要相信姐姐,姐姐看人不会错的。”“姐姐!您怎么还在壹味地袒护着王爷?你忘记二哥 说的话吗?王爷是什么人?那可是壹个冷酷无情、心狠手辣的人,更何况新年的时候,还曾经对咱们年家威逼利诱!这种人,姐姐怎么可以说他 是壹个重情重义的人呢?”“不管王爷是什么样子的人,终究他是你的夫君,是你壹辈子相依相伴、同舟共济的夫君!百年修得同船渡,千年修 得共枕眠。人生难得的夫妻缘分,妹妹壹定要珍惜啊!”“姐姐,您的心意,凝儿知道,不过,凝儿还是想跟姐姐说,王爷真正想要娶的人根本 就不是凝儿……”“凝儿,你说什么?难道,难道,你都知道了?”“凝儿当然知道,那王爷怎么可能看得上凝儿呢,他想要娶的,不过是爹爹 和二哥的权势和官职而已!凝儿不过是他手中的壹枚小小棋子罢了!”冰凝此话壹落,玉盈那提到嗓子眼的心,总算是落了下来,刚刚由于紧张, 手都禁不住微微颤抖了起来,即使冰凝的话已经说完好半天了,她还是无法控制住自己的手指。冰凝见姐姐这般模样,不由得担心起来:“姐姐, 您怎么了?您这是怎么了?”“没什么,没什么,姐姐还是要劝你,方才说的那番话,万不可再胡说了,凭白误了终身。”“姐姐,您的话,妹 妹记得,只是……”“只是什么?妹妹,你今天这是怎么了?为什么壹会儿说话吞吞吐吐,壹会儿又说不想跟王爷成
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
混合物的分离与提纯
高考频度:★★★★★
难易程度:★★★☆☆
典例在线
除去下列物质中的杂质,所用试剂和方法正确的是
解题必备
一、常见的分离方法归纳对比
二、混合物的分离与提纯
1.分离和提纯的要求
(1)分离
分离是指把混合物的各组分一一分开,每一组分都要保留下来,且原来是固体,最后还应是固体,原来是溶液,最后还应是溶液。
分离的实质是把混合物中各种成分分开,这就需要应用物质的物理性质或化学性质,把不同的物质以不同的形式分开,然后再把物质恢复成原来的状态。
分离的条件是各种物质必须以不同的状态出现,如果物质直接分离有困难,需要把物质转化为其他的物质,分离开后再各自反应成原来的物质。
分离的适用范围是混合物。
例如要从粗盐(NaCl和少量泥沙的混合物)中分离出NaCl,可将粗盐溶于水,过滤,对滤液进行蒸干,即得NaCl固体。
(2)提纯(除杂质)
提纯是指保留混合物中的某一主要组分,把混合物中其余杂质通过化学变化都除去。
提纯的实质是混合物中只保留一种成分,分离后需要的物质保留原来的状态,其他物质不需要恢复成原来的状态。
提纯的条件是需要的物质与其他的物质必须以不同的状态出现,各种杂质可以以相同的状态同时出现。
提纯的适用范围是混合物。
例如实验室制得的二氧化碳气体中混有少量水蒸气,要得到纯净的CO2,可使混合气体通过盛有浓硫酸的洗气瓶,除去水蒸气,就可得到纯净的CO2气体。
2.物质分离和提纯的“三个必须”和“四个原则”
(1)三个必须
(2)四个原则
3.物质分离与提纯的常见类型
(1) “固+固”混合物的分离(提纯)
(2) “固+液”混合物的分离(提纯)
(3) “液+液”混合物的分离(提纯)
(4) “气+气”混合物的分离(提纯)
学霸推荐
1.下列实验操作中正确的是
A.蒸馏操作时,应向蒸馏液体中加入几块沸石,以防止暴沸
B.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
C.分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出
D.萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴
2.下列各组物质中,可按溶解、过滤、蒸发的操作顺序分离的是
A.氧化铜和炭粉 B.硝酸钾和氯化钠
C.水和酒精 D.碳酸钠和硫酸钡
3.完成下列实验所需选择的装置或仪器都正确的是
A.分离植物油和氯化钠溶液B.除去氯化钠晶体中混有的氯化铵晶体
C.分离CCl4中的Br2 D.除去CO2气体中的HCl气体
4.从下列混合物中分离出其中的一种成分,所采取的分离方法正确的是
A.由于碘在酒精中的溶解度大,可以用酒精把碘水中的碘萃取出来
B.水的沸点为100 ℃,酒精的沸点为78.5 ℃,所以可用加热蒸馏的方法使含水的酒精变为无水酒精
C.由于沙子和水不相溶,且存在明显的密度差异,因此可用过滤法分离沙子与水的混合
物
D.NaCl的溶解度随温度下降而减小,可以用冷却法从热的含少量KNO3的NaCl浓溶液中分离得到纯净的NaCl
5.如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
(1)从氯化钾溶液中得到氯化钾固体,选择装置________(填代表装置图的字母,下同);
除去自来水中的Cl−等杂质,选择装置________。
(2)从碘水中分离出I2,选择装置________,该分离方法的名称为________。
(3)装置A中①的名称是________,进水的方向是从_____口(填“上”或“下”)进水。
装
置B在分液时为使液体顺利滴下,除打开漏斗下端的旋塞外,还应进行的具体操作是
________________。
SO 等杂质,需要提纯后才能综合利用。
粗盐提纯的步骤
(4)粗盐中含Ca2+、Mg2+、Fe3+、2
4
有:
①加入过量的Na2CO3溶液②加入过量的BaCl2溶液③加入过量的NaOH溶液④过滤
⑤溶解⑥加盐酸调节溶液的pH等于7 ⑦蒸发
操作顺序合理的是_____(填字母)。
a.⑤②③①④⑥⑦b.⑤①②③④⑥⑦
c.⑤②①③⑥④⑦d.⑤③②①④⑥⑦
参考答案
1.【答案】A
【解析】蒸馏操作时,应向蒸馏液体中加入几块沸石,以防止暴沸,A项正确;蒸发操作时,应使混合物中出大量固体时,就停止加热,利用余热把溶剂蒸干,B项错误;分液操作时,先将分液漏斗中下层液体从下口放出再将上层液体从上口倒出,C项错误;酒精与水互溶,不能作为萃取剂从溴水中萃取溴,D项错误。
2.【答案】D
【解析】A项,氧化铜和炭粉均不溶于水,无法按上述顺序分离;B项,硝酸钾和氯化钠均溶于水,也无法按述顺序分离;C项,水和酒精相互溶解,无法按上述顺序分离;D项,碳酸钠溶于水,硫酸钡不溶于水,能按述顺序分离。
3.【答案】A
【解析】B项,蒸馏的方法是分离互溶的液体,故错误;C项,过滤的方法是分离固体和液体,故错误;D 项二氧化碳和氯化氢都能与氢氧化钠反应,故错误。
4.【答案】C
【
5.案】(1)D A
(2)B 萃取
(3)冷凝管下打开分液漏斗上端的玻璃塞
(4)ad
【解析】(1)可以采用蒸发结晶的方法从氯化钾溶液中得到氯化钾固体,则选择D装置;除去自来水中的Cl 杂质,可以采用蒸馏的方法,则选择A装置。
(2)碘易溶于有机溶剂,可用萃取的方法分离。
(3)装置A中①的名称是冷凝管,进水的方向是“下进上出”,装置B在分液时为使液体顺利滴下,除打开漏下端的旋塞外,还应进行的具体操作是打开分液漏斗上端的玻璃塞。
SO 时,先加水溶解,然后加入过量NaOH,去除镁离子和铁(4)除去粗盐中的可溶性杂质:Mg2+、Ca2+、Fe3+、2
4
子;加入过量BaCl2,去除硫酸根离子;加入过量Na2CO3,去除钙离子和多余的钡离子。
碳酸钠必须加在氯化之后,氢氧化钠和氯化钡可以颠倒加入的顺序,然后过滤,最后调节溶液的pH等于7后蒸发即可,所以其顺是⑤③②①④⑥⑦或⑤②③①④⑥⑦。
