细胞核膜蛋白提取方法
膜蛋白提取

1分离组织膜蛋白的方法:1、取组织,加入10ml Buffer A 于冰上充分匀浆。
2、J6-HC离心机800rpm,4℃离心10min后,所得上清液转入超速离心管。
3、100000g,4℃离心1hr。
弃去上清,沉淀用适量的Buffer B重悬,冰上孵育2hr后分装至EP管,Eppendorf台式离心机10000rpm,4℃离心30min。
4、收集所得上清液即为膜组份。
Buffer A:0.32M 蔗糖,5mM Tris-HCl(PH 7.5),120mM KCl,1mM EDTA,1mM EDTA, 0.2mM PMSF, 1ug/ml Leupeptin, 1ug/ml Pepstatin A, 1ug/ml Aprotinin。
冰上预冷。
Buffer B:20mM HEPES(PH 7.5),10%甘油,2% Triton X-100, 1mM EDTA, 1mM EDTA, 0.2mM PMSF, 1ug/ml Leupeptin, 1ug/ml Pepstatin A, 1ug/ml Aprotinin。
冰上预冷。
2取约0.1g肝组织,加入2ml粉碎缓冲液,冰浴中超声粉碎,每次20秒,间隔30秒,共3次,4°c 105xg条件下离心2小时,上清液为胞浆蛋白,沉淀部分加入1ml胞膜蛋白提取液,超声粉碎,4°c 105xg条件下离心2小时,上清液为胞膜蛋白。
样品蛋白含量测定采用酚试剂法。
3我们实验室提取膜蛋白的方法如下:1.将细胞种于T75 或T175的培养瓶中培养数天,细胞铺满瓶底后,吸去培养液。
将PBS/EDTA 溶液(NaCl:0.1M,NaH2PO4:0.01M,EDTA:0.04%)加入量以覆盖细胞为止,置于培养箱或在超净台内消化3~5分钟,如仍未脱落瓶底,用吸管吹打,使细胞完全脱落。
2.收集细胞悬液于10毫升或50毫升的离心管中,1000rpm离心10分钟,去上清液。
细胞膜蛋白的提取

细胞膜蛋白的提取1. 引言细胞膜蛋白是细胞膜上的蛋白质,它们在细胞的结构和功能中起着重要的作用。
细胞膜蛋白具有多种功能,包括细胞识别、信号转导、运输和通道形成等。
为了研究细胞膜蛋白的结构和功能,科学家需要从细胞中提取这些蛋白质。
本文将介绍细胞膜蛋白的提取方法和步骤。
2. 细胞膜蛋白的提取方法2.1 细胞膜蛋白的提取原理细胞膜蛋白是细胞膜上的蛋白质,与细胞膜紧密结合。
因此,提取细胞膜蛋白需要破坏细胞膜,并保持蛋白质的完整性。
常用的细胞膜蛋白提取方法包括机械破碎法、化学溶解法和超声波法等。
2.2 机械破碎法机械破碎法是一种常用的细胞膜蛋白提取方法。
其步骤如下:1.制备细胞悬浮液:将培养的细胞收集,并用缓冲液洗涤,得到细胞悬浮液。
2.破碎细胞:将细胞悬浮液置于低温条件下,加入适量的缓冲液,然后用高速搅拌器或超声波破碎仪破碎细胞,使细胞膜破裂。
3.离心:将破碎后的细胞悬浮液进行离心,分离出上清液和沉淀。
4.收集上清液:将上清液转移到新的离心管中,这个上清液中含有细胞膜蛋白。
2.3 化学溶解法化学溶解法是另一种常用的细胞膜蛋白提取方法。
其步骤如下:1.制备细胞悬浮液:将培养的细胞收集,并用缓冲液洗涤,得到细胞悬浮液。
2.加入溶解剂:向细胞悬浮液中加入适量的溶解剂,如磷酸盐缓冲液或甘油,使细胞膜破裂。
3.搅拌:将细胞悬浮液与溶解剂充分混合,并用搅拌器搅拌一定时间,使细胞膜蛋白溶解在溶液中。
4.离心:将溶解后的细胞悬浮液进行离心,分离出上清液和沉淀。
5.收集上清液:将上清液转移到新的离心管中,这个上清液中含有细胞膜蛋白。
2.4 超声波法超声波法是一种快速、高效的细胞膜蛋白提取方法。
其步骤如下:1.制备细胞悬浮液:将培养的细胞收集,并用缓冲液洗涤,得到细胞悬浮液。
2.加入超声波溶解剂:向细胞悬浮液中加入适量的超声波溶解剂,如磷酸盐缓冲液,使细胞膜破裂。
3.超声波处理:将细胞悬浮液置于超声波处理器中,进行超声波处理,使细胞膜破裂。
提取膜蛋白的方法

提取膜蛋白的方法提取膜蛋白是一项关键的实验步骤,用于研究膜蛋白的结构和功能。
本文将介绍几种常用的膜蛋白提取方法。
1. 浸泡法浸泡法是一种简单的膜蛋白提取方法。
将细胞或组织样品置于适当的缓冲液中,如磷酸盐缓冲液或生理盐水中,并加入一些溶解剂(如阴离子洗涤剂)以破坏膜结构。
浸泡一段时间后,离心以分离出溶液中的膜蛋白。
2. 磷脂双层溶液法磷脂双层溶液法利用磷脂双层膜的特性来提取膜蛋白。
首先,将细胞或组织样品放入含有磷脂双层的液体中。
磷脂双层膜与细胞膜相似,可吸附并保持膜蛋白的结构和功能。
然后,用洗涤液洗涤磷脂双层,使膜蛋白释放到洗涤液中。
3. 超声法超声法是一种物理方法,通过超声波的能量来提取膜蛋白。
将细胞或组织样品置于含有缓冲液的管中,并使用超声波处理。
超声波的能量可以破坏细胞膜结构,使膜蛋白溶解到缓冲液中。
然后,对溶液进行离心,将膜蛋白分离出来。
4. 酸碱提取法酸碱提取法利用pH的变化来提取膜蛋白。
首先,将细胞或组织样品放入酸性或碱性溶液中,并搅拌。
酸性或碱性环境可以破坏细胞膜结构,使膜蛋白溶解到溶液中。
然后,通过调整pH值,使膜蛋白沉淀,进一步提纯。
5. 亲水基质法亲水基质法是一种通过亲水基质与疏水膜蛋白的选择性结合来提取膜蛋白的方法。
细胞或组织样品与亲水基质接触,亲水基质与细胞膜的亲水区域结合,使膜蛋白释放到溶液中。
然后,通过离心和洗涤步骤来分离和纯化膜蛋白。
这些方法在膜蛋白的研究中应用广泛,但根据具体的实验目的和样品特性,可以选择适合的方法进行膜蛋白提取。
实验中还应注意选择合适的缓冲液、溶液浓度和温度,并结合离心、洗涤等步骤进行蛋白的纯化和分离。
此外,需要根据实验目的选择合适的检测方法,如SDS-PAGE、Western blot等来确定提取的膜蛋白的质量和纯度。
总之,膜蛋白提取是膜生物学研究的重要一环,不同方法适用于不同的样品和实验要求。
正确选择和操作提取方法可以高效地提取膜蛋白,并为后续研究提供可靠的样品。
蛋白-细胞核蛋白提取方法

提取细胞核蛋白的步骤:1.向培养细胞的平皿中加入少量(保证在 TUBE内能放下)冷PBS(或1*D-Hanks)2.,用细胞刮刀尽可能多的刮下细胞,收集到的离心管中。
在预冷的离心机中,4度,1000rcf,1-3分钟,沉降细胞。
为尽可能多的获得细胞,可将一次离心后的上清再重复刮细胞一次;2. 将细胞重悬于cell lysis buffer中(加入体积106细胞/200uL,体积估计方法还是没确定,should be sufficient; 一般就是一个10cm平皿加1ml cell lysis buffer),添加蛋白酶抑制剂;先破细胞膜,得到细胞核(没有用B DOUNCE);冰上放置(不震荡,可偶尔用枪轻吹)30分钟至1小时(此时核膜没有破,有核染色为证),充分裂解;cell lysis buffer:5mM PIPES pH 85mM KCL, % NP40, 1% protein inhibitor;3. 4度,1000rcf,20分钟,上清为胞质蛋白(蛋白浓度比较低,如需要检测,建议先浓缩一下),沉淀为细胞核;此时可以将沉淀冻存于-70℃;4. 将沉淀重悬于100-200 ul nucleai lysis buffer(体积视目的蛋白表达丰度而定,一般50-100ul)中,添加蛋白酶抑制剂,冰上放置30分钟至1小时(每5分钟震荡一次),充分裂解;可以观察到沉淀慢慢消失,溶液变澄清;nucleai lysis buffer:成分同SDS lysis buffer;50mM Tris-Cl pH , 10mM EDTA, 1% SDS, 1% protein inhibitor;5. 四度,最大转速离心,10分钟以上(尽可能沉淀完全),上清即为细胞核蛋白;。
膜蛋白提取

1分离组织膜蛋白的方法:1、取组织,加入10ml Buffer A 于冰上充分匀浆。
2、J6-HC离心机800rpm,4℃离心10min后,所得上清液转入超速离心管。
3、100000g,4℃离心1hr。
弃去上清,沉淀用适量的Buffer B重悬,冰上孵育2hr后分装至EP管,Eppendorf台式离心机10000rpm,4℃离心30min。
4、收集所得上清液即为膜组份。
Buffer A:0.32M 蔗糖,5mM Tris-HCl(PH 7.5),120mM KCl,1mM EDTA,1mM EDTA, 0.2mM PMSF, 1ug/ml Leupeptin, 1ug/ml Pepstatin A, 1ug/ml Aprotinin。
冰上预冷。
Buffer B:20mM HEPES(PH 7.5),10%甘油,2% Triton X-100, 1mM EDTA, 1mM EDTA, 0.2mM PMSF, 1ug/ml Leupeptin, 1ug/ml Pepstatin A, 1ug/ml Aprotinin。
冰上预冷。
2取约0.1g肝组织,加入2ml粉碎缓冲液,冰浴中超声粉碎,每次20秒,间隔30秒,共3次,4°c 105xg条件下离心2小时,上清液为胞浆蛋白,沉淀部分加入1ml胞膜蛋白提取液,超声粉碎,4°c 105xg条件下离心2小时,上清液为胞膜蛋白。
样品蛋白含量测定采用酚试剂法。
3我们实验室提取膜蛋白的方法如下:1.将细胞种于T75 或T175的培养瓶中培养数天,细胞铺满瓶底后,吸去培养液。
将PBS/EDTA 溶液(NaCl:0.1M,NaH2PO4:0.01M,EDTA:0.04%)加入量以覆盖细胞为止,置于培养箱或在超净台内消化3~5分钟,如仍未脱落瓶底,用吸管吹打,使细胞完全脱落。
2.收集细胞悬液于10毫升或50毫升的离心管中,1000rpm离心10分钟,去上清液。
核与胞质蛋白提取方法
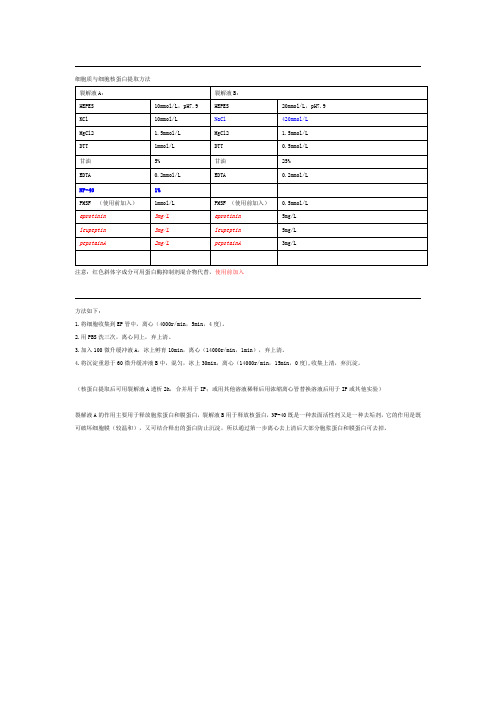
细胞质与细胞核蛋白提取方法
注意:红色斜体字成分可用蛋白酶抑制剂混合物代替,使用前加入
方法如下:
1.将细胞收集到EP管中,离心(4000r/min,5min,4度)。
2.用PBS洗三次,离心同上,弃上清。
3.加入100微升缓冲液A,冰上孵育10min,离心(14000r/min,1min),弃上清。
4.将沉淀重悬于60微升缓冲液B中,混匀,冰上30min,离心(14000r/min,15min,0度),收集上清,弃沉淀。
(核蛋白提取后可用裂解液A透析2h,合并用于IP;或用其他溶液稀释后用浓缩离心管替换溶液后用于IP或其他实验)
裂解液A的作用主要用于释放胞浆蛋白和膜蛋白,裂解液B用于释放核蛋白,NP-40既是一种表面活性剂又是一种去垢剂,它的作用是既可破坏细胞膜(较温和),又可结合释出的蛋白防止沉淀,所以通过第一步离心去上清后大部分胞浆蛋白和膜蛋白可去掉。
细胞核蛋白提取技巧

细胞核蛋白提取技巧
细胞核蛋白提取是一项重要的实验技术,用于研究细胞内的核蛋白结构和功能。
以下是一种常用的细胞核蛋白提取技巧:
1.细胞培养和收获:首先,将所需细胞培养至适当的密度,
并在培养基中加入适当的培养条件。
接下来,使用适当的
方法(例如离心或胶原酶消化)将细胞收获。
2.细胞裂解:将收获的细胞用适当的细胞裂解缓冲液(例如
低盐缓冲液)裂解。
可以通过机械方法(如均质器或声波
处理器)或化学方法(如洗涤剂或酶)来裂解细胞。
3.细胞核分离:通过离心,将裂解的细胞分为上清液和沉淀。
上清液中含有细胞质蛋白,而沉淀中主要包含细胞核。
4.细胞核裂解:将细胞核沉淀用适当的细胞核裂解缓冲液
(例如高盐缓冲液)进行裂解。
同样,可以使用机械或化
学方法来裂解细胞核。
5.清除细胞核残渣:通过离心等方法,去除裂解细胞核残渣,
以获得纯净的细胞核蛋白上清液。
6.蛋白浓缩:将获得的细胞核蛋白上清液进行浓缩,以获得
足够的蛋白量。
常用的方法包括酒精沉淀、有机溶剂沉淀、离心滤膜等。
7.蛋白质定量:使用合适的蛋白质定量方法(如Lowry法、
Bradford法或BCA法)对细胞核蛋白进行定量。
8.蛋白存储:将浓缩的细胞核蛋白分装并冻存于-80°C的冰
箱中,以备后续实验使用。
以上是一种常用的细胞核蛋白提取技巧,具体的实验流程和步骤会因实验目的和细胞类型的不同而略有差异。
膜蛋白的提取方法

膜蛋白的提取方法
膜蛋白的提取方法通常包括以下几个步骤:
1. 细胞裂解:将包含膜蛋白的细胞或组织用不同的方式进行裂解,例如超声波处理、酸碱处理、高压处理等。
2. 膜蛋白分离:通过离心、过滤等方法将膜蛋白分离出来。
3. 纯化:采用膜层联萃取、柱层析、电泳等方法对膜蛋白进行纯化。
4. 确认:通过蛋白质定量、SDS-PAGE、Western blot等方法验证膜蛋白的存在和纯度。
常见的膜蛋白提取方法有:
1. 酸性洗涤法:利用低pH值时,膜蛋白和膜脂亲性增强的特性,将细胞裂解物在酸性条件下洗涤获得膜蛋白。
2. 有机溶剂提取法:利用膜蛋白亲性较强的有机溶剂,如丙酮、甲醇等,将膜蛋白从细胞裂解物中提取出来。
3. 离心法:通过离心分离膜细胞,从而获得膜蛋白。
4. 免疫亲和层析法:利用特异性抗体将目标膜蛋白从混合蛋白中分离纯化。
以上方法的选择需根据具体情况来定,不同的细胞类型或膜蛋白性质有着不同的最佳提取方法。
(完整word版)膜蛋白提取

1分离组织膜蛋白的方法:1、取组织,加入10ml Buffer A 于冰上充分匀浆。
2、J6-HC离心机800rpm,4℃离心10min后,所得上清液转入超速离心管。
3、100000g,4℃离心1hr。
弃去上清,沉淀用适量的Buffer B重悬,冰上孵育2hr后分装至EP管,Eppendorf台式离心机10000rpm,4℃离心30min。
4、收集所得上清液即为膜组份。
Buffer A:0.32M 蔗糖,5mM Tris-HCl(PH 7.5),120mM KCl,1mM EDTA,1mM EDTA, 0.2mM PMSF, 1ug/ml Leupeptin, 1ug/ml Pepstatin A, 1ug/ml Aprotinin。
冰上预冷。
Buffer B:20mM HEPES(PH 7.5),10%甘油,2% Triton X-100, 1mM EDTA, 1mM EDTA, 0.2mM PMSF, 1ug/ml Leupeptin, 1ug/ml Pepstatin A, 1ug/ml Aprotinin。
冰上预冷。
2取约0.1g肝组织,加入2ml粉碎缓冲液,冰浴中超声粉碎,每次20秒,间隔30秒,共3次,4°c 105xg条件下离心2小时,上清液为胞浆蛋白,沉淀部分加入1ml胞膜蛋白提取液,超声粉碎,4°c 105xg条件下离心2小时,上清液为胞膜蛋白。
样品蛋白含量测定采用酚试剂法。
3我们实验室提取膜蛋白的方法如下:1.将细胞种于T75 或T175的培养瓶中培养数天,细胞铺满瓶底后,吸去培养液。
将PBS/EDTA 溶液(NaCl:0.1M,NaH2PO4:0.01M,EDTA:0.04%)加入量以覆盖细胞为止,置于培养箱或在超净台内消化3~5分钟,如仍未脱落瓶底,用吸管吹打,使细胞完全脱落。
2.收集细胞悬液于10毫升或50毫升的离心管中,1000rpm离心10分钟,去上清液。
膜蛋白的分离方法

膜蛋白的分离方法
膜蛋白是一类位于细胞膜上的蛋白质,它们在细胞的代谢、信号传递、物质运输等方面起着重要作用。
以下是一些常见的膜蛋白分离方法:
1.超速离心法:利用超速离心机产生的强大离心力,将细胞膜和膜蛋白分离开来。
这种方法常用于制备纯净的细胞膜和膜蛋白。
2.电泳法:通过电泳技术,可以根据膜蛋白的电荷性质和分子量大小,将其分离开来。
电泳法包括聚丙烯酰胺凝胶电泳(PAGE)和十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)等。
3.层析法:层析法是一种基于膜蛋白物理化学性质差异的分离方法。
常用的层析技术包括凝胶过滤层析、离子交换层析、亲和层析等。
4.浮选分离法:利用浮力密度的差异,通过离心使不同密度的膜蛋白在溶液中分层,从而实现分离。
5.免疫沉淀法:基于抗体与抗原的特异性结合,使用特异性抗体将目标膜蛋白从混合物中沉淀出来。
6.密度梯度离心法:根据膜蛋白的密度差异,将其在密
度梯度介质中进行离心分离。
7.膜蛋白提取试剂盒:市面上有一些商业化的膜蛋白提取试剂盒,它们通常结合了多种分离技术,简化了膜蛋白的提取过程。
需要根据具体的实验需求和膜蛋白的特性选择合适的分离方法。
在膜蛋白分离过程中,需要注意保持膜蛋白的活性和稳定性,避免蛋白质的变性和降解。
膜蛋白纯化方法

膜蛋白纯化方法
膜蛋白是一类在生物体内广泛存在的蛋白质,它们扮演着许多重要的生物学功能角色。
由于其特殊的结构和生物学功能,膜蛋白的纯化一直是生物化学和分子生物学领域中的热门话题。
以下是几种常用的膜蛋白纯化方法:
1. 磷脂层萃取法:膜蛋白主要存在于生物体细胞膜中,因此利用磷脂层分离膜蛋白是一种常见的纯化方法。
该方法的基本原理是通过磷脂的亲水性和疏水性来分离膜蛋白。
2. 隔离膜蛋白的膜片:将膜蛋白采集到膜片上,然后离子交换或凝胶过滤来纯化膜蛋白。
该方法适用于小规模的样品。
3. SDS-PAGE:SDS-PAGE是一种凝胶电泳技术,可用于分离和纯化蛋白质。
在SDS-PAGE中,蛋白质会被SDS包裹并带有负电荷,从而使蛋白质分子按照大小分离。
4. 亲和层析法:亲和层析法是一种利用特定亲和性标记物分离蛋白质的方法。
例如,可以使用亲合柱将含有膜蛋白的混合物分离出来。
这些方法都有各自的优缺点,具体的选用方法需要根据实验要求和条件来确定。
- 1 -。
细胞膜蛋白的提取

细胞膜蛋白的提取
细胞膜蛋白的提取可以通过以下步骤进行:
1. 细胞收集:从所需的细胞类型中收集足够数量的细胞。
可以使用细胞培养方法培养细胞,或者从活体组织中分离细胞。
2. 细胞破碎:将细胞用适当的方法破碎,以释放细胞内的蛋白。
可以使用机械方法(如超声波破碎器或高压细胞击碎器)或化学方法(如洗涤液或界面活性剂)来破碎细胞。
3. 蛋白质提取:使用适当的缓冲液或溶液将细胞破碎物悬浮并离心,以去除细胞碎片和细胞核。
随后,可以使用不同的方法来提取膜蛋白,例如溶解细胞膜并提取蛋白。
4. 蛋白质纯化:使用不同的技术来纯化细胞膜蛋白。
这包括以蛋白质的特定性质为基础的方法,例如亲和层析、凝胶过滤层析、离子交换层析等。
5. 蛋白质浓缩:将纯化的细胞膜蛋白浓缩到所需的浓度。
可以使用蛋白质浓缩技术,例如氨基酸纤维柱、浓缩管或旋转蒸发器等。
6. 蛋白质鉴定:利用蛋白质检测方法,如SDS-PAGE、Western blotting或质谱分析等,确定提取的蛋白质的纯度和数量。
细胞膜蛋白的提取过程需根据实验目的和具体需求来选择和优化各个步骤。
细胞核蛋白提取技巧

细胞核蛋白提取技巧1. 选择合适的细胞裂解液:细胞裂解液的选择对于细胞核蛋白的提取至关重要。
通常使用含有低浓度盐、洗涤剂和蛋白酶抑制剂的缓冲液。
一些常用的细胞裂解液包括 RIPA 缓冲液、NP-40 缓冲液等。
根据不同的细胞类型和实验需求,可以尝试不同的细胞裂解液。
2. 控制裂解条件:在细胞裂解过程中,需要控制适当的条件,以确保细胞核的完整性。
避免过度裂解,以免破坏细胞核结构。
可以通过调整裂解液的组成、裂解时间和温度等参数来优化裂解条件。
3. 使用适当的离心方法:离心是分离细胞核和细胞质的常用方法。
在细胞核蛋白提取过程中,可以使用低速离心去除细胞碎片和细胞质,然后使用高速离心沉淀细胞核。
选择合适的离心速度和时间,以确保细胞核的沉淀和细胞质的去除。
4. 添加核蛋白提取试剂:为了提高细胞核蛋白的提取效率,可以添加一些核蛋白提取试剂。
这些试剂可以帮助溶解细胞核膜和核内蛋白质,从而提高提取产量和质量。
常用的核蛋白提取试剂包括 SDS、NaCl 等。
5. 注意蛋白酶抑制剂的使用:在细胞核蛋白提取过程中,蛋白酶的活性可能会导致蛋白质的降解。
为了保护细胞核蛋白的完整性,需要添加适当的蛋白酶抑制剂。
常用的蛋白酶抑制剂包括 PMSF、AEBSF 等。
6. 控制温度和时间:在细胞核蛋白提取过程中,温度和时间的控制也很重要。
避免高温和长时间处理,以免引起蛋白质的变性和降解。
通常,细胞核蛋白提取可以在 4°C 下进行,以保持蛋白质的稳定性。
7. 离心清洗:在细胞核蛋白提取后,为了去除残留的杂质和洗涤剂,可以进行离心清洗步骤。
使用适当的缓冲液进行离心清洗,以确保细胞核蛋白的纯度。
8. 储存和保存:提取的细胞核蛋白应尽快进行下游分析。
如果需要储存,应将细胞核蛋白保存在适当的缓冲液中,并在-80°C 或更低温度下保存。
避免反复冻融,以免影响蛋白质的稳定性。
以上是一些细胞核蛋白提取的技巧。
在实际操作中,需要根据具体的实验需求和细胞类型进行适当的调整和优化。
膜蛋白——精选推荐

膜蛋白的提取:用冰浴1×PBS洗两次,加入细胞裂解液(step⌝ 1),刮下细胞;用27-Gauge针头吹吸5次,冰上静置5min;⌝4℃,3000g,离心10min,取上清进行下一步离心,沉淀保留(其中含有细胞碎片和细胞核);⌝4℃,12000g,离心10min,取上清进行下一步离心,沉淀保留(其中含有线粒体,内质网等细胞浆成分);⌝4℃,130000g,离心30min,将上清收集至另一Eppendorf管内(其中含有其它胞浆蛋白);⌝用膜蛋白裂解液(step⌝ 2)溶解沉淀(其中含有细胞膜蛋白);于95℃变性5min,将所有样品(各步沉淀)保存于-80℃。
⌝1 细胞质膜资料1895年,Overton从研究细胞透性得出"细胞膜由连续的脂类物质组成"。
1925年Gorter&Grendel:用脂单分子膜技术测定细胞膜中脂分子的总面积,提出:"细胞膜是由双层脂分子组成"。
1935年Danielli&Davson:从测定膜的表面张力得出细胞膜的"三明治结构模型",即蛋白质-脂-蛋白质。
1959年Robertson:用电镜观察生物膜提出"单位膜模型",将膜的分子结构与超微机构统一起来厚度:2(暗)+3.5(亮〕+2(暗)=7.5细胞质膜的主要功能概括如下:(1) 为细胞的生命活动提供相对稳定的内环境;(2) 选择性的物质运输,包括代谢底物的输入与代谢产物的排除,其中伴随着能量的传递;(3) 提供细胞识别位点,并完成细胞内外信息跨膜传递;(4) 为多种酶提供结合位点,使酶促反应高效而有序地进行;(5) 介导细胞与细胞、细胞与基质之间的连接;质膜参与形成具有不同功能的细胞表面特化结构。
2 膜蛋白虽动物细胞主要有9种膜脂,而膜蛋白的种类繁多,多数膜蛋白分子数目较少,但却赋予细胞膜非常重要的生物学功能。
根据膜蛋白分离的难易及其与脂分子的结合方式,膜蛋白可分为两大类型:外在膜蛋白、内在膜蛋白。
膜蛋白抽提[5篇模版]
![膜蛋白抽提[5篇模版]](https://img.taocdn.com/s3/m/130473090166f5335a8102d276a20029bc646353.png)
膜蛋白抽提[5篇模版]第一篇:膜蛋白抽提二、蛋白抽提谈及蛋白分离,我们想到:超速离心,盐析法、超滤法、凝胶过滤法、等电点沉淀法、离子交换层析、亲和层析、吸附层析、逆流分溶、酶解法……有时这些方法常常组合到一起对特定的物质进行分离纯化。
由于蛋白质种类繁多,不同的蛋白质由于结构和组成的差异,其溶解度也各不相同.根据蛋白质的溶解特性,同时可选择不同的溶剂提取,分为水溶液提取和有机溶剂提取.但是针对膜蛋白的提取与细胞质蛋白,核蛋白提取不同之处在于它是嵌在膜中的,水溶性不好,基本方法就是用不同的离心速度去掉胞质蛋白等,最后用去污剂把蛋白从膜中释放出来。
膜蛋白分离纯化的重要步骤是选择适当的增溶用表面活性剂,一般常用的有胆酸盐,CHAPS(一种离子去污剂),Emulgen和Lubrol等表面活性剂。
1、分离膜蛋白的方法(原则性):4)顺序抽提法:根据细胞蛋白溶解性的差异,用具有不同溶解能力的蛋白溶解液进行抽提的方法。
用Tris碱溶液裂解细胞提取高溶解性蛋白;把未溶解的pellet用标准液溶解提取高疏水性蛋白;最后用含复合表面活性剂的蛋白溶解液,最后可以再次抽提前两次抽提后不能溶解的膜蛋白。
5)centrifugal protein extraction原理:高渗的蛋白裂解液让细胞溶涨破裂后,超高速离心评价:尽管分级(胞浆和胞膜)之间有清洗的步骤,但是可溶蛋白组分和膜蛋白组分之间仍然有不少重复的点.该方法相较MOLLOY MP教授在1998年electrophoresis上发表的分级抽提法减去了第一步(用tris抽提水溶性蛋白)和最后一步(极难溶蛋白),在操作上也作了简化,总而言之是一种不错的方法。
(codegreen)6)detergent-based:提取时先裂解液裂胞膜(选用不同的去污试剂是关键),梯度离心分离细胞器(ER),然后分级抽提方法。
例如,去掉细胞器之后的DEBRIS就是核膜,再裂解得到核膜蛋白。
核与胞质蛋白提取方法

细胞质与细胞核蛋白提取方法
注意:红色斜体字成分可用蛋白酶抑制剂混合物代替,使用前加入
方法如下:
1.将细胞收集到EP管中,离心(4000r/min,5min,4度)。
2.用PBS洗三次,离心同上,弃上清。
3.加入100微升缓冲液A,冰上孵育10min,离心(14000r/min,1min),弃上清。
4.将沉淀重悬于60微升缓冲液B中,混匀,冰上30min,离心(14000r/min,15min,0度),收集上清,弃沉淀。
(核蛋白提取后可用裂解液A透析2h,合并用于IP;或用其他溶液稀释后用浓缩离心管替换溶液后用于IP或其他实验)
裂解液A的作用主要用于释放胞浆蛋白和膜蛋白,裂解液B用于释放核蛋白,NP-40既是一种表面活性剂又是一种去垢剂,它的作用是既可破坏细胞膜(较温和),又可结合释出的蛋白防止沉淀,所以通过第一步离心去上清后大部分胞浆蛋白和膜蛋白可去掉。
胞质蛋白或核蛋白提取方法

胞质蛋白或核蛋白提取方法实验目的从细胞和动物组织制备核蛋白和胞浆蛋白。
实验试剂核蛋白/胞质蛋白提取试剂盒。
实验步骤(一)细胞蛋白提取(1)取5-10×106个细胞,在4℃,500×g条件下离心2-3 min,小心吸取培养基,尽可能吸干,收集细胞。
(2)用冷PBS洗涤细胞2次,每次洗涤后尽可能吸干上清。
(3)每20 μL冷的Buffer A,2 μL蛋白酶抑制剂混合物,高速涡旋振荡15 s,置冰上10 min。
(4)再次高速涡旋振荡5 s,然后在4℃,16000×g条件下离心5 min。
(5)快速将上清吸入另一预冷的干净离心管,即可得到胞浆蛋白,请置于冰上或-80℃冰箱保存备用。
(6)在沉淀中加入200 μL冷的Buffer B,2 μL蛋白酶抑制剂混合物,高速涡旋振荡15 s。
(7)置冰上40 min,每隔10 min高速涡旋振荡15 s。
(8)在4℃,16000×g条件下离心10 min。
(9)快速将上清吸入另一预冷的干净离心管,即可得到核蛋白。
(二)组织蛋白提取(1)取适量组织样本剪碎,加冷PBS,用组织匀浆器匀浆至无明显肉眼可见固体(或用液氮研磨),置冰上5 min,小心将上清吸入另一预冷的干净离心管。
(2)在4℃,500×g条件下离心2-3 min,弃上清。
(3)按照细胞蛋白的提取方法的第三步骤往下操作即可。
(4)上述蛋白提取物请分装后于-80℃冰箱保存备用。
注意事项(1)实验过程中的所有试剂须预冷;所有器具须放-20℃冰箱预冷。
(2)整个过程须保持样品处于低温状态。
biovision膜蛋白提取

biovision膜蛋白提取BioVision膜蛋白提取膜蛋白是细胞膜的主要组成成分,具有重要的生物学功能。
它们参与细胞信号传导、物质运输以及细胞间相互作用等关键过程。
为了研究膜蛋白的结构和功能,科学家们开发了多种方法来提取膜蛋白。
其中,BioVision膜蛋白提取试剂盒是一种常用的工具,它可以高效地从细胞中提取膜蛋白。
BioVision膜蛋白提取试剂盒采用一种特殊的离子洗涤剂和蛋白酶抑制剂的组合,能够迅速破坏细胞膜,并保护膜蛋白不被降解。
该试剂盒的提取步骤简单、操作方便,适用于各种类型的细胞,包括哺乳动物细胞、昆虫细胞和酵母细胞等。
使用BioVision膜蛋白提取试剂盒提取膜蛋白的步骤如下:1. 细胞培养:首先,将所需的细胞培养在适当的培养基中,使其达到指定的生长状态。
2. 细胞收集:收集细胞后,用磷酸盐缓冲液洗涤细胞,去除培养基和杂质。
3. 细胞裂解:将洗涤后的细胞加入BioVision提取试剂,充分裂解细胞膜,释放膜蛋白。
可以通过旋转离心等方法加速细胞裂解过程。
4. 膜蛋白提取:离心裂解后的细胞,将上清液转移到新的离心管中,以去除细胞碎片和细胞核等杂质。
上清液中富含膜蛋白。
5. 蛋白质浓度测定:使用蛋白质浓度检测试剂盒,测定提取的膜蛋白的浓度。
根据需要,可以调整蛋白质的浓度。
BioVision膜蛋白提取试剂盒的优势在于其高效性和可靠性。
该试剂盒能够完整地提取细胞膜中的蛋白质,并保持其天然的结构和功能。
此外,BioVision提供的试剂盒还具有良好的稳定性和重复性,可以在不同实验条件下反复使用。
膜蛋白提取是研究细胞生物学和蛋白质功能的关键步骤之一。
BioVision膜蛋白提取试剂盒的出现,为科学家们提供了一种高效、方便的方法来提取膜蛋白。
通过使用这种试剂盒,研究人员可以更深入地探究膜蛋白的功能和相互作用,从而推动细胞生物学和生物医学研究的进展。
BioVision膜蛋白提取试剂盒是一种有效的工具,可用于从细胞中提取膜蛋白。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
储存条件: 蛋白提取液2-8℃保存;蛋白酶抑制剂-20℃保存。
有效期: 一年。
产品简介: 贝博核膜蛋白提取试剂盒提供全套试剂,适用于从各种原代或传代细胞中提取细胞核的
膜蛋白。提取过程简单方便,可在1 小时内完成。制备的核膜蛋白不仅纯度高,保持天然活 性,而且绝少交叉污染。提取的蛋白可用于Western Blotting、转录活性分析、Gel shift 凝 胶阻滞实验、免疫共沉淀、酶活性测定等蛋白研究。
本试剂盒中不含有EDTA,与金属螯和层析等下游应用兼容。 本试剂盒提取的蛋白不可用于 2D 电泳。如下游实验需要用于 2D 电泳,请使用贝博其 他货号的试剂盒。 产品特点: 1、 使用方便,从细胞中提取蛋白不需经过研磨、反复冻融、超声破碎等前处理。 2、 将蛋白提取的时间缩短至 1 小时。 3、 含蛋白稳定剂,提取的蛋白稳定。 4、 紫外检测蛋白浓度时,背景干扰低。 5、 蛋白酶抑制剂抑制了蛋白的降解,蛋白酶抑制剂配方优化。蛋白酶抑制剂混合物包 含 6 种独立的蛋白酶抑制剂;每一种抑制剂可特异性抑制某一种或几种蛋白酶活性。 该混合物优化的组成使其可以抑制几乎所有重要的蛋白酶活性,包括丝氨酸蛋白 酶、半胱氨酸酸蛋白酶、天冬氨酸蛋白酶、丙氨酰-氨基肽酶等。 使用方法: 1. 提取液制备:每 500ul 冷的提取液 A 和 B 中分别加入 2ul 蛋白酶抑制剂混合物, 混匀后置冰上备用。 2. 取 5-10×106 个细胞①,在 4℃,500×g 条件下离心 2-3 分钟,小心吸取培养基, 尽可能吸干,收集细胞。 3. 用冷 PBS 洗涤细胞两次,每次洗涤后尽可能吸干上清。 4. 细胞沉淀中加入 400μl 冷的提取液 A,高速涡旋振荡 15 秒,置冰上振荡 15 分 钟。 5. 在 4℃,12000×g 条件下离心 5 分钟。 6. 弃上清。 7. 在沉淀中加入 500μl 冷的提取液 B,高速涡旋振荡 15 秒,置冰上振荡 20 分钟。
8. 37℃水浴 10 分钟。 9. 在 37℃② 1000×g 离心 5 分钟。 10. 此时溶液分为两层,小心吸掉上层③,留着备用分析,分离出管底部下层大约 50ul 液体。 11. 用 80-150ul 溶解液 C 稀释该下层溶液,即得细胞核膜蛋白样品。 12. 将上述蛋白提取物定量后分装于-80℃冰箱保存备用或直接用于下游实验③。
