提取细胞全蛋白操作方法
蛋白提取方法

蛋白提取方法蛋白是生物体内一种重要的有机化合物,具有多种生物学功能。
在生物医学研究、食品工业、药物研发等领域,蛋白的提取和纯化是非常重要的工作。
本文将介绍几种常见的蛋白提取方法,希望能对相关领域的研究人员有所帮助。
1. 细胞裂解法。
细胞裂解法是一种常见的蛋白提取方法,它通过破坏细胞膜,释放细胞内的蛋白质。
通常采用机械方法(如超声波破碎、高压破碎)或化学方法(如洗涤剂裂解)来实现细胞裂解。
这种方法操作简单,提取效率较高,适用于大多数类型的细胞。
2. 亲和层析法。
亲和层析法是一种通过蛋白与特定配体之间的亲和作用来实现蛋白提取的方法。
常用的亲和层析配体包括金属离子、抗体、亲和标记物等。
通过将这些配体固定在固定相上,再将混合蛋白溶液通过柱子进行层析,从而实现对目标蛋白的选择性提取。
这种方法对蛋白的纯化效果较好,但成本较高。
3. 凝胶过滤法。
凝胶过滤法是一种通过分子大小差异实现蛋白提取的方法。
通常采用多孔性凝胶作为固定相,将混合蛋白溶液通过凝胶柱进行层析,从而实现对蛋白的分离和提取。
这种方法操作简单,对蛋白的形态和功能影响较小,适用于对蛋白分子大小要求较高的应用场景。
4. 盐析法。
盐析法是一种通过蛋白与盐溶液中离子相互作用的差异实现蛋白提取的方法。
在盐浓度逐渐增大的过程中,蛋白质的溶解度会发生变化,从而实现对蛋白的分离和提取。
这种方法操作简单,成本较低,适用于对蛋白的选择性提取要求不高的场景。
5. 超滤法。
超滤法是一种通过膜的孔径大小选择性分离蛋白的方法。
通常采用超滤膜将混合蛋白溶液进行过滤,从而实现对蛋白的提取。
这种方法操作简单,对蛋白的分离效果较好,但需要注意膜的选择和操作条件的控制。
总结。
蛋白提取是生物医学研究、食品工业、药物研发等领域中的重要工作。
本文介绍了几种常见的蛋白提取方法,包括细胞裂解法、亲和层析法、凝胶过滤法、盐析法和超滤法。
每种方法都有其特点和适用场景,研究人员可以根据具体的实验要求选择合适的方法进行蛋白提取工作。
蛋白提取实验步骤

蛋白提取实验步骤:1、细胞总蛋白提取A、对于悬浮细胞: 离心收集细胞,每106细胞加250 ul RIPA (在使用前数分钟内加入蛋白酶抑制剂),振荡。
如果需要提高蛋白浓度,可以适当减少细胞总蛋白提取试剂体积。
B、对于贴壁细胞:a、用TBS冲洗细胞2-3次。
最后一次彻底吸干残留液。
b、加入适当体积的 RIPA(使用前数分内加入蛋白酶抑制剂)于培养板、瓶内3-5分钟。
期间反复晃动培养板、瓶,使试剂与细胞充分接触。
c、用细胞刮刀将细胞及试剂刮下,收集到1.5ml离心管中。
C、冰浴30min,期间用移液器反复吹打,确保细胞完全裂解。
D、12000g离心5min,收集上清,即为总蛋白溶液。
2、组织蛋白提取:A、组织块用冷TBS洗涤2-3次,去除血污,剪成小块置于匀浆器。
加入10倍组织体积本试剂(使用前数分钟内加入蛋白酶抑制剂)冰上彻底匀浆。
如果需要提高蛋白浓度,可以适量减少该试剂体积。
B、将匀浆液转移至1.5ml离心管中,振荡。
冰浴30min,期间用移液器反复吹打,确保细胞完全裂解。
C、12000g离心5min,收集上清,即为总蛋白溶液。
1、组织尽可能新鲜,若不能及时提蛋白,组织标本应保存在-80℃冰箱,并避免反复冻融。
2、全程必须在冰上进行,避免蛋白降解。
3、蛋白酶抑制剂在水溶液中不稳定,需在RIPA使用前数分钟加入蛋白酶抑制剂。
4、裂解过程中如有溶液粘稠现象可用移液器(200μl)反复吹打,或再加入适量裂解液以保证充分裂解。
5、总蛋白溶液不稳定(蛋白酶依旧有活性)可在-80℃短时间保存,建议立即加入蛋白上样缓冲液变性后与-20℃保存,避免反复冻融。
蛋白提取实验步骤

蛋白提取实验步骤:1、细胞总蛋白提取A、对于悬浮细胞: 离心收集细胞,每106细胞加250 ul RIPA (在使用前数分钟内加入蛋白酶抑制剂),振荡。
如果需要提高蛋白浓度,可以适当减少细胞总蛋白提取试剂体积。
B、对于贴壁细胞:a、用TBS冲洗细胞2-3次。
最后一次彻底吸干残留液。
b、加入适当体积的 RIPA(使用前数分内加入蛋白酶抑制剂)于培养板、瓶内3-5分钟。
期间反复晃动培养板、瓶,使试剂与细胞充分接触。
c、用细胞刮刀将细胞及试剂刮下,收集到1.5ml离心管中。
C、冰浴30min,期间用移液器反复吹打,确保细胞完全裂解。
D、12000g离心5min,收集上清,即为总蛋白溶液。
2、组织蛋白提取:A、组织块用冷TBS洗涤2-3次,去除血污,剪成小块置于匀浆器。
加入10倍组织体积本试剂(使用前数分钟内加入蛋白酶抑制剂)冰上彻底匀浆。
如果需要提高蛋白浓度,可以适量减少该试剂体积。
B、将匀浆液转移至1.5ml离心管中,振荡。
冰浴30min,期间用移液器反复吹打,确保细胞完全裂解。
C、12000g离心5min,收集上清,即为总蛋白溶液。
1、组织尽可能新鲜,若不能及时提蛋白,组织标本应保存在-80℃冰箱,并避免反复冻融。
2、全程必须在冰上进行,避免蛋白降解。
3、蛋白酶抑制剂在水溶液中不稳定,需在RIPA使用前数分钟加入蛋白酶抑制剂。
4、裂解过程中如有溶液粘稠现象可用移液器(200μl)反复吹打,或再加入适量裂解液以保证充分裂解。
5、总蛋白溶液不稳定(蛋白酶依旧有活性)可在-80℃短时间保存,建议立即加入蛋白上样缓冲液变性后与-20℃保存,避免反复冻融。
蛋白提取实验步骤

蛋白提取实验步骤:1、细胞总蛋白提取A对于悬浮细胞:离心收集细胞,每106细胞加250 Ul RlPA (在使用前数分钟内加入蛋白酶抑制剂),振荡。
如果需要提高蛋白浓度,可以适当减少细胞总蛋白提取试剂体积。
B对于贴壁细胞:a用TBS冲洗细胞2-3次。
最后一次彻底吸干残留液。
b加入适当体积的RIPA (使用前数分内加入蛋白酶抑制剂)于培养板、瓶内3-5分钟。
期间反复晃动培养板、瓶,使试剂与细胞充分接触。
c、用细胞刮刀将细胞及试剂刮下,收集到1.5ml离心管中。
C冰浴30min,期间用移液器反复吹打,确保细胞完全裂解。
D 12000g离心5min,收集上清,即为总蛋白溶液。
2、组织蛋白提取:A组织块用冷TBS洗涤2-3次,去除血污,剪成小块置于匀浆器。
加入10倍组织体积本试剂(使用前数分钟内加入蛋白酶抑制剂)冰上彻底匀浆。
如果需要提高蛋白浓度,可以适量减少该试剂体积。
B将匀浆液转移至1.5ml离心管中,振荡。
冰浴30min,期间用移液器反复吹打,确保细胞完全裂解。
C 12000g离心5min,收集上清,即为总蛋白溶液。
1、组织尽可能新鲜,若不能及时提蛋白,组织标本应保存在-80 C 冰箱,并避免反复冻融。
2、全程必须在冰上进行,避免蛋白降解。
3、蛋白酶抑制剂在水溶液中不稳定,需在RIPA使用前数分钟加入蛋白酶抑制剂。
4、裂解过程中如有溶液粘稠现象可用移液器(200 μ l )反复吹打,或再加入适量裂解液以保证充分裂解。
5、总蛋白溶液不稳定(蛋白酶依旧有活性)可在-80 C短时间保存,建议立即加入蛋白上样缓冲液变性后与-20 C保存,避免反复精品佳作,安心下载,放心使用冻融。
遇到失意伤心事,多想有一个懂你的人来指点迷津,因他懂你,会以我心,换你心,站在你的位置上思虑,为你排优解难。
一个人,来这世间,必须懂得一些人情事理,才能不断成长。
就像躬耕于陇亩的农人,必须懂得土地与种子的情怀,才能有所收获。
一个女子,一生所求,莫过于找到一个懂她的人,执手白头,相伴终老。
细胞组织裂解(提蛋白)方法

细胞组织裂解(提蛋白)方法编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(细胞组织裂解(提蛋白)方法)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为细胞组织裂解(提蛋白)方法的全部内容。
蛋白匀浆缓冲液:50 mM Tris—HCl (pH7。
5) 150 mM NaCl 5 mM EDTA 1 % NP-40 1 mM PMSF操作步骤直接用这个进行组织匀浆然后于10000 rpm 离心20分钟收集上清作SDS-PAGE电泳从染色的情况来看所得到的总蛋白纯度都不错条带比较清晰。
我是作的小鼠八种常规组织也包括肾脏在内.将抽提好的蛋白分装后直接放在负八十保存。
上样大概3~8ul每孔都可以的具体看个人需要。
70v 浓缩,150v分离第二种方法裂解液配方: 尿素:8M CHAPS:4%DTT:65mM(现加) PMSF:1mM(现加)MiliQ 水操作步骤:取300mg样品在液氮环境下研磨,加入1ml裂解液混匀,室温静置1小时(实验证明改为匀浆更好,蛋白降解轻),15000g离心1小时,取上清测定蛋白质浓度。
在裂解液中加IPG buffer有两个作用:1,增强蛋白质的溶解性2,可以结合核酸,在沉淀的时候予以除去。
建议最好加,浓度从0。
5—2%不等(这取决于您样品蛋白质的难溶程度)。
IPG buffer 是载体两性电解质,IPG buffer另外一个作用是促进蛋白质溶解的,所以IEF前一定要加,裂解液中没有IPG buffer可以么?(可以的,最后上胶条的时候可以再加)不过,我觉得液氮研磨以后,最好是粗离心一下,把一些结缔组织给离心掉(150g既可)然后再加裂解液。
细胞蛋白提取方法

单层贴壁细胞总蛋白的提取1. 倒掉培养液,并将瓶倒扣在吸水纸上使吸水纸吸干培养液(或将瓶直立放置一会儿使残余培养液流到瓶底然后再用移液器将其吸走)。
2. 每瓶细胞加3ml 4℃预冷的PBS(0.01M pH7.2~7.3)。
平放轻轻摇动1min洗涤细胞,然后弃去洗液。
重复以上操作两次,共洗细胞三次以洗去培养液。
将PBS弃净后把培养瓶置于冰上。
3. 【配制裂解试剂,现用现配制】按1ml RIPA + 25μl PMSF(100mM)+ 110μl Pi(PhosSTOP磷酸酶抑制剂),摇匀置于冰上。
(PMSF要摇匀至无结晶时才可与裂解液混合。
)4. 每瓶细胞加100 μl的裂解液,用干净的刮棒将细胞刮于培养瓶的一侧(动作要快),于冰上裂解30 min,为使细胞充分裂解培养瓶要经常来回摇动。
5. 裂解完后,然后用枪将细胞碎片和裂解液移至1.5ml离心管中。
(整个操作尽量在冰上进行)6. 于4℃下12000rpm离心15 min。
(提前开离心机预冷)7. 将离心后的上清分装转移倒0.6ml的离心管中放于-80℃保存。
PhosSTOP磷酸酶抑制剂(stock solution)配制方法:1片PhosSTOP+1ml RIPA,充分溶解后按110ul封装9管。
-20℃保存有效期6月,4℃保存有效期1月。
BCA法测定蛋白浓度检测试剂准备:1.BCA工作液(室温)2.RIPA(1ml)(4℃)3.蛋白工作液(0.5mg/ml)(4℃)4.96-Well板5.冰盒6.待测样品(4℃)操作步骤:1. 根据样品数量,按50体积BCA试剂A加1体积BCA试剂B(50:1)配制适量BCA工作液,充分混匀。
2. 标准孔加样3. 待测样品稀释20倍,19μl RIPA + 1μl(待测样品)4. 测定本底,20μl RIPA加3孔,取平均值。
5. 各孔加入200μl BCA工作液,37℃放置20分钟。
蛋白提取方法及注意事项

组织蛋白提取材料准备:组织、冰块、称、超声匀浆器、试剂各种试剂比例:PMSF:Lysis Buffer = 1:1001、将组织称重,减去EP管重量2、每100mg组织加入1mL(1mg ,10ul)试剂,冰上裂解半小时3、匀浆(注意低温操作),开20秒,关2秒,共打20次,每次用水冲洗,擦干,超声完后放冰上4、将匀浆液移至1.5mL预冷离心管5、离心,12000转,4℃,30分钟6、取上清至新的预冷的EP管7、BCA定量8、放入—80℃线粒体蛋白提取材料准备(放冰盒中):线粒体试剂、EP管、EP管中的组织、枪头、PBS1、用冷PBS清洗细胞2次,洗后吸干上清2、加入A200uL,放冰上10分钟3、匀浆30-40次,每次用清水清洗匀浆器头4、离心500rpm,4℃,5分钟5、将上清移至离心管6、离心1100rpm,4℃,20分钟7、沉淀中加入200uLB,混匀8、离心1100rpm,4℃,20分钟9、弃上清10、加入80-150uL裂解液,放冰上20分钟,每隔5分钟高速震荡15秒,11、得线粒体蛋白12、定量后放-80℃冰箱。
细胞总蛋白提取材料准备:试剂(—20℃)、细胞培养板、EP管(已标记)均放置于冰盒中操作,以防止蛋白降解。
1、吸掉培基2、加入PBS,约1ml/孔左右,用手晃匀3、约5min后倒去PBS,并用枪将PBS尽量吸尽4、加入试剂,摇床振荡10分钟,再置冰上10分钟。
培养器皿面积(cm2)培养液量(ml)细胞量裂解液(ul)96 孔培养板0.32 0.1 10524孔培养板 2 1.0 5×10512孔培养板 4.5 2.0 1066孔培养板9.6 2.5 2.5×106803.5 cm 培养皿8 3.0 2×1066 cm 培养皿21 5.0 5.2×10632010 cm 培养皿55 10.0 13.7×10680025cm2培养瓶25 5.0 5×10675cm2培养瓶75 15~30 2×1075、用黄色枪头将各孔中cell刮下,保证孔底部分都要刮到,根据分组将细胞悬液吸入各个EP管中。
细胞总蛋白提取方法
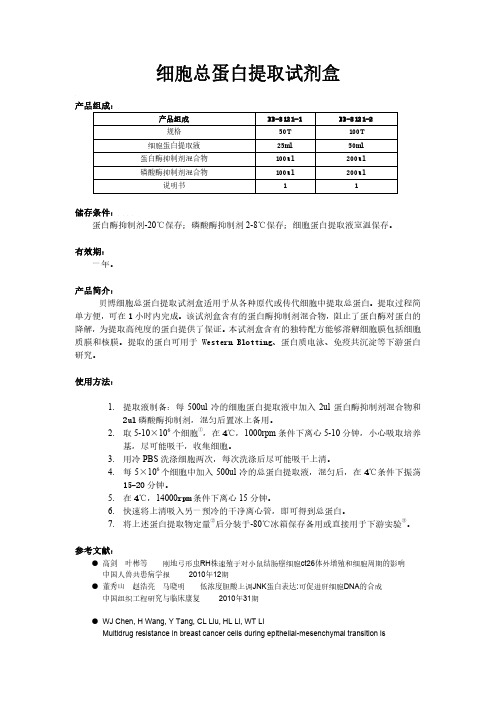
产品号 BB-3101 BB-3102 BB-3104 BB-3411 BB-3501 BB-3121 BB-3122 BB-3123 BB-3125 BB-3126 BB-3105 BB-3181 BB-3183 BB-3187
产品 磷酸化蛋白富集试剂盒 膜蛋白提取试剂盒 活性蛋白提取试剂盒 BCA 蛋白定量试剂盒 植物核蛋白提取试剂盒 细菌膜蛋白提取试剂盒 植物总蛋白提取试剂盒 植物膜蛋白提取试剂盒 蛋白酶抑制剂混合物 真菌蛋白提取试剂盒 磷酸酶抑制剂混合物 细菌蛋白提取盒(2D 电泳用) 酵母蛋白提取盒(2D 电泳用) 线粒体蛋白提取盒(2D 电泳用)
modulated by breast cancer resistant protein Chin. J. Cancer. 2010. 29(2):159-165
相关产品:
产品 总蛋白提取试剂盒 核蛋白提取试剂盒 膜/胞浆/核蛋白分步提取试剂盒 Bradford 蛋白定量试剂盒 ECL 化学发光检测试剂盒 细胞蛋白提取试剂盒 组织蛋白提取试剂盒 细菌蛋白提取试剂盒 酵母蛋白提取试剂盒 昆虫蛋白提取试剂盒 磷酸化蛋白提取试剂盒 总蛋白提取试剂盒(2D 电泳用) 植物蛋白提取盒(2D 电泳用) 细菌膜蛋白提取盒(2D 电泳用)
中国人兽共患病学报
2010年12期
● 董秀山 赵浩亮 马晓明 低浓度胆酸上调JNK蛋白表达:可促进肝细胞DNA的合成源自中国组织工程研究与临床康复
2010年31期
● WJ Chen, H Wang, Y Tang, CL Liu, HL Li, WT Li Multidrug resistance in breast cancer cells during epithelial-mesenchymal transition is
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
细胞全蛋白提取步骤
①吸取培养基,预冷PBS清洗细胞三次,细胞刮刮脱细胞,收集至离心管,1000rpm离心5分钟。
洗涤后的细胞转移至洁净EP管,
②冰上操作,配制细胞裂解液,1ml Lysis,Buffer中加入10 μl磷酸酶抑制剂、
1 μl蛋白酶抑制剂、5μl 100mM的PMSF。
混匀后冰上保存数分钟待用。
③在洗涤好的细胞中按照每107个细胞加入1ml细胞裂解液的比例,加入细胞裂解液。
200μl移液器反复吹打,至蛋白析出。
④4℃摇床,温和振摇15分钟。
⑤14000rpm,4℃离心15分钟,上清即为细胞全蛋白提取物。
⑥BCA法测蛋白浓度。
蛋白分装后保存于-70℃冰箱,避免反复冻融。
提取细胞全蛋白整个过程中所有使用的物品及试剂均需预冷,防止蛋白降解。
