2009-10-15 2-2-离子反应
15离子反应与离子方程式书写

15. 离子反应与离子方程式的书写一、知识梳理(一)离子反应1、概念:溶液中有离子参与的化学反应称之为离子反应2、场所:水溶液中3、条件:①产生沉淀↓②产生弱电解质③产生气体↑④发生氧化还原反应⑤发生双水解反应⑥发生络合反应4、实质:有离子浓度的降低(二)离子方程式1、概念:用实际参加反应的离子符号来表达的化学反应方程式。
2、书写步骤写:正确写出反应的化学方程式拆:将强酸、强碱、可溶性盐拆成离子形式,其它均保留化学式删:删去方程式两边等数量的相同微粒(离子或分子)查:检查式子两边原子数、电荷数、电子数是否相等3、意义:离子方程式所表示的不仅仅是一个化学反应,而是一类化学反应二、典例分析例题1、下列离子方程式不正确的是()A.氢氧化钡溶液跟盐酸反应OH—+H+=H2OB.三氯化铁溶液跟过量氨水反应Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+C.小苏打溶液跟烧碱溶液反应HCO3—+OH—=CO32—+H2OD.氯气通入冷水中Cl2+H2O=Cl—+ClO—+2H+考点:离子方程式的书写.分析:A、强酸强碱中和生成可溶性的盐,反应的实质是:OH—+H+=H2O;B、氨水电离出的氢氧根可以和三价铁反应生成红褐色沉淀;C、碳酸氢盐可以和强碱反应转化成碳酸盐;D、次氯酸是一种弱酸,不能拆成离子形式.解答:A、氢氧化钡是强碱,盐酸是强酸,生成的氯化钡是一种可溶性的盐,故A正确;B、三氯化铁溶液跟过量氨水反应实质是:氨水电离出的氢氧根和三价铁反应生成红褐色沉淀,并且氢氧化铁不溶于氨水,故B正确;C、碳酸氢钠可以和烧碱反应转化成碳酸钠,除水外,均为易溶于水的物质,故C正确;D、次氯酸是一种弱酸,不能拆成离子形式,应为:Cl2+H2O=Cl—+HClO+H+,故D错误.故选D.点评:本题是一道有关离子方程式的书写正误判断的题目,是现在高考的热点.三、实战演练1、(2009•海淀区一模)下列离子方程式书写正确的是()A.氯气与水反应:Cl2+H2O=2H++Cl—+ClO—B.铝与氢氧化钠溶液反应:Al+2OH—=[Al(OH)4]—+H2↑C.氢碘酸溶液中滴入少量双氧水:2I—+2H++H2O2=I2+2H2OD.工业上用三氯化铁溶液腐蚀印刷电路板:2Fe3++3Cu=3Cu2++2Fe2、下列反应的离子方程式书写正确的是()A.碳酸钙与盐酸反应:CO32—+2H+=H2O+CO2↑B.稀H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑C.氢氧化钡溶液与稀H2SO4反应:Ba2++SO42—=BaSO4↓D.氯化铜溶液与铁粉反应:Cu2++Fe=Fe2++Cu3、下列离子方程式书写正确的是()A.实验室用大理石和盐酸制取CO2:CO32—+2H+=H2O+CO2↑B.铁和盐酸反应制氢气:2Fe+6H+=2Fe3++3H2↑C.AlCl3溶液中加入过量NaOH溶液:Al3++3OH—=Al(OH)3↓D.SiO2与NaOH溶液反应:SiO2+2OH—=SiO32—+H2O4、下列反应的离子方程式书写中,正确的是()A.硫酸与氢氧化钡在溶液中反应:Ba2++SO42—═BaSO4↓B.用Cl2将苦卤中的Br—氧化:Cl2+Br—═Cl—+Br2C.用小苏打治疗胃酸过多:HCO3—+H+═CO2↑+H2OD.用FeCl3溶液腐蚀铜箔制造印刷电路板:Fe3++Cu═Fe2++Cu2+5、下列化学方程式中,能用离子方程式SO42—+Ba2+═BaSO4↓来表示的是()A.BaCO3+H2SO4=BaSO4↓+H2O+CO2↑B.BaCl2+Na2CO3=BaCO3↓+2NaClC.Ba(OH)2+CuSO4=Cu(OH)2↓+BaSO4↓D.BaCl2+Na2SO4=BaSO4↓+2NaCl6、下列反应的离子方程式书写正确的是()A.把金属钠放入水中:2Na+2H2O=2Na++2OH—+H2↑B.用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑C.硫酸与氢氧化钡在溶液中反应:Ba2++OH—+H++SO42—═BaSO4↓+H2OD.铜与稀硝酸反应:Cu+4H++NO3—═Cu2++NO↑+2H2O7、下列离子方程式正确的是()A.钠跟水反应:Na+2H2O=Na++2OH—+H2↑B.向AlCl3溶液中加入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+C.盐酸与碳酸钙反应制备二氧化碳:CO32—+2H+=CO2↑+H2OD.硫酸溶液与氢氧化钡溶液反应:H++OH—=H2O8、下列离子方程式正确的是()A.用大理石跟稀盐酸制二氧化碳:CO32—+2H+=H2O+CO2↑B.Cu丝伸入到AgNO3溶液中:Cu+2Ag+=Cu2++2AgC.H2SO4溶液中滴入Ba(OH)2溶液:Ba2++OH—+H++SO42—=BaSO4↓+H2OD.用食醋除去水瓶中的水垢:CO32—+2CH3COOH=2CH3COO—+CO2↑+H2O9、下列离子方程式正确的是()A.铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑B.Al(OH)3沉淀中滴加盐酸:Al(OH)3+H+=Al3++H2OC.碳酸氢钠溶液中加入氢氧化钠:HCO3—+OH—=CO32—+H2OD.碳酸钙与稀硝酸反应:CO32—+2H+=CO2↑+H2O10、下列离子方程式正确的是()A.氯气溶于水:Cl2+H2O=2H++Cl—+ClO—B.过氧化钠与水反应:2Na2O2+2H2O=4Na++4OH—+O2↑C.向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH—=Al(OH)3↓D.铜与稀硝酸反应:Cu+NO3—+4H+=Cu2++NO↑+2H2O11、下列离子方程式正确的是()A.锌与稀硫酸反应:Zn+H+═Zn2++H2↑B.铜与硝酸银溶液反应:Cu+Ag+═Cu2++AgC.碳酸钙与盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2OD.硫酸与氢氧化钡溶液混合:SO42—+Ba2+═BaSO4↓12、下列反应不能用离子方程式:CO32—+2H+=CO2↑+H2O表示的是()A.Na2CO3+2HCl=2NaCl+CO2↑+H2OB.K2CO3+2HNO3=2KNO3+CO2↑+H2OC.K2CO3+H2SO4=K2SO4+CO2↑+H2OD.CaCO3+2HCl=CaCl2+H2O+CO2↑13、下列离子方程式书写正确的是()A.氢氧化钠溶液中加入醋酸:H++OH—═H2OB.向稀硫酸溶液中投入铁粉:2Fe+6H+═2Fe3++3H2↑C.向碳酸钠溶液中加入盐酸:CO32—+2H+═H2O+CO2↑D.氧化铜溶于盐酸:O2—+2H+═H2O14、能正确表示下列化学反应的离子方程式的是()A.澄清的石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H2OB.铜片插入硝酸银溶液中Cu+Ag+=Cu2++AgC.氢氧化钡溶液与稀硫酸的反应OH—+H+=H2OD.碳酸钙溶于稀盐酸中CaCO3+2H+=Ca2++H2O+CO2↑15、下列反应的离子方程式,正确的是()A.氯气通入水中Cl2+H2O=2H++Cl—+ClO—B.将大理石投入稀盐酸CO32—+2H+=H2O+CO2↑C.在稀硫酸中加入Ba(OH)2溶液H++OH—+SO42—+Ba2+=H2O+BaSO4↓D.向硫酸铜溶液中加入氢氧化钡溶液Cu2++SO42—+Ba2++2OH—=BaSO4↓+Cu(OH)2↓ 16、下列离子方程式与化学反应事实一致的是()A.硫酸铜溶液与氢氧化钡溶液反应:Cu2++2OH—═Cu(OH)2↓B.石灰石溶于盐酸:CO32—+2H+═H2O+CO2↑C.硫酸溶液与氢氧化钾溶液反应:H++OH—═H2OD.硝酸银溶液与氯化钠溶液反应:AgNO3+Cl—═AgCl↓+NO3—17、能正确表示下列反应的离子方程式的是()A.向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3—=3Fe3++2H2O+NO↑B.铜与浓硝酸反应:Cu+NO3—+4H+=Cu2++NO↑+2H2OC.氯化铵溶液和浓氢氧化钠溶液混合后加热:NH4++OH—NH3•H2OD.碳酸氢铵溶液与足量氢氧化钠溶液混合后加热:NH4++OH—NH3↑+H2O 18、(2013•汕头一模)下列离子方程式书写正确的是()A.将铜屑加入Fe3+溶液中:Fe3++Cu=Fe2++Cu2+B.NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH—NH3↑+H2OC.稀硝酸和过量的铁屑反应:3Fe+8H++2NO3—=3Fe3++2NO↑+4H2OD.KI溶液与H2SO4酸化的H2O2溶液混合:2I—+H2O2+2H+=2H2O+I219、下列离子方程式正确的是()A.碳酸氢钠溶液与少量石灰水反应HCO3—+Ca2++OH—=CaCO3↓+H2OB.氯化铵与氢氧化钠两种浓溶液混合加热OH—+NH4+H2O+NH3↑C.氢氧化镁与稀硫酸反应H++OH—=H2OD.单质铜与稀硝酸反应Cu+2H++2NO3—=Cu2++2NO↑+H2O20、下列离子方程式书写正确的是()A.往NaSiO3溶液中加入盐酸:2Na++SiO32—+2H+=H2SiO3↓+2Na+B.氯气与烧碱溶液反应:Cl2+2OH—=Cl—+ClO—+H2OC.稀硫酸滴在铁片上:Fe+6H+=2Fe3++3H2↑D.铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag21、能正确表示下列反应的离子方程式是()A.将铜屑加入Fe3+溶液中:2Fe3++Cu═2Fe2++Cu2+B.将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2OC.将氯化亚铁溶液和稀硝酸混合:Fe2++4H++NO3—═ Fe3++2H2O+NO↑D.将铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑22、下列离子方程式正确的是()A.澄清石灰水与稀盐酸反应:Ca(OH)2+2H+═Ca2++2H2OB.钠与水反应:Na+2H2O═Na++2OH—+H2↑C.铜片插入硝酸银溶液中:Cu+Ag+═Cu2++AgD.大理石溶于醋酸的反应:CaCO3+2CH3COOH═Ca2++2CH3COO—+CO2↑+H2O 23、下列离子方程式正确的是()A.氢氧化钡溶液与盐酸的反应:OH—+H+=H2OB.澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2OC.铜片插入硝酸银溶液中:Cu+Ag+=Cu2++AgD.碳酸钙溶于稀盐酸中:CO32—+2H+=H2O+CO2↑24、下列反应的离子方程式书写正确的是()A.稀H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑B.碳酸钙与盐酸反应:CO32—+2H+=H2O+CO2↑C.石英与烧碱溶液反应SiO2+2OH—═SiO32—+H2OD.氯化铜溶液与铁粉反应:Cu2++Fe=Fe3++Cu25、下列离子方程式书写正确的是()A.少量的金属钠投入水中:2Na+2H2O═2Na++2OH—+H2↑B.铝片投入稀盐酸中:Al+6H+═Al3++3H2↑C.氢氧化钡溶液与稀硫酸混合:Ba2++SO42—═BaSO4↓D.碳酸钙溶液与盐酸反应CO32—+2H+═H2O+CO2↑26、下列离子方程式正确的是()A.澄清的石灰水与稀盐酸反应Ca(OH)2+2H+═Ca2++2H2OB.钠与水的反应Na+2H2O═Na++2OH—+H2↑C.铜片插入硝酸银溶液中Cu+Ag+═Cu2++AgD.大理石溶于盐酸的反应CaCO3+2H +═Ca2++CO2↑+H2O27、下列反应的离子方程式正确的是()A.NaHCO3溶液与醋酸:CO32—+2CH3COOH=2CH3COO—+H2O+CO2↑B.硝酸银溶液与铜:Cu+Ag+=Cu2++AgC.将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2OD.用醋酸除水垢:2CH3COOH+CaCO3=Ca2++2CH3COO—+H2O+CO2↑28、下列离子方程式中,正确的是()A.碳酸氢钠溶液与稀硫酸混合:CO32—+2H+=CO2↑+H2OB.大理石溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2OC.CO2气体通入CaCl2溶液中:Ca2++CO2+H2O=CaCO3↓+2H+D.稀H2SO4和Ba(OH)2溶液反应:2H++SO42—+Ba2++2OH—=BaSO4↓+2H2O 29、下列离子方程式中,书写正确的是()A.NaHCO3溶液中加入盐酸:CO32—+2H+═H2O+CO2↑B.盐酸中加入碳酸钙:CO32—+2H+═H2O+CO2↑C.AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓D.铜片加入三氯化铁溶液中:Cu+2Fe3+═2Fe2++Cu2+30、下列离子方程式的书写正确的是()A.实验室用大理石和稀盐酸制取CO2:2H++CO32—=CO2↑+H2OB.实验室用二氧化锰和浓盐酸制取Cl2:MnO2+4HCl(浓) Mn2++Cl2↑+2H2O+2C1—C.C12与NaOH溶液反应:Cl2+2OH—=C1—+ClO—+H2OD.实验室用硅酸钠溶液和稀盐酸制取硅酸胶体:2H++SiO32—=H2SiO3↓31、离子方程式H++OH—=H2O可表示的化学反应是()A.盐酸和氢氧化钡的反应B.硝酸和氢氧化镁的反应C.硫酸和氢氧化钡的反应D.盐酸和氢氧化铜反应32、下列离子方程式中,错误的是()A.将氨通入盐酸中:NH3+H+=NH4+B.在NaOH溶液中滴入几滴NH4Cl溶液:NH4++OH—=NH3↑+H2OC.将少量铜屑放入浓硝酸中:Cu+4H++2NO3—=Cu2++2NO2↑+2H2OD.将稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑33、下列反应的离子方程式中,正确的是()A.稀硫酸滴在银片上:2Ag+2H+=2Ag++H2↑B.稀硫酸与氢氧化钡溶液混合:SO42—+Ba2+=BaSO4↓C.稀硝酸滴在大理石上:CaCO3+2H+=Ca2++H2CO3D.氧化铁与稀盐酸混合:Fe2O3+6H+=2Fe3++3H2O34、下列离子方程式中正确的是()A.将盐酸滴入氢氧化铜悬浊液中H++OH—=H2OB.将小苏打溶液加入醋酸中HCO3—+H+=CO2↑+H2OC.将锌片投入到CuSO4溶液中Zn+Cu2+=Zn2++CuD.将Fe粉投入稀硫酸中2Fe+6H+=2Fe3++3H2↑35、能用离子方程式H++OH—=H2O表示的反应是()A.稀醋酸和氢氧化钠溶液反应B.稀硝酸和氢氧化镁反应C.稀盐酸和澄清的石灰水反应D.稀硫酸和氢氧化钡溶液反应36、下列离子方程式正确的是()A.硫酸铁溶液中放入铁片:Fe3++Fe=2Fe2+B.二氧化碳通到澄清石灰水中:CO2+2OH—=CO32—+H2OC.AlCl3溶液中加入足量的氨水Al3++3OH—=Al(OH)3↓D.用食醋除碳酸钙水垢2CH3COOH+CaCO3=Ca2++2CH3COO—+CO2↑+H2O37、下列反应的离子方程式正确的是()A.氢氧化铜加到盐酸中:Cu(OH)2+2H+=Cu2++2H2OB.往碳酸钡中滴加稀盐酸:CO32—+2H+=CO2↑+H2OC.往氨水中滴加氯化铝:Al3++3OH—=Al(OH)3↓D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42—+H++OH—=BaSO4↓+H2O38、下列离子方程式中正确的是()A.铝与稀盐酸反应:Al+2H+═Al3++H2↑B.氯气与氢氧化钠溶液反应:Cl2+2NaOH═H2O+Cl—+ClO—+2Na+C.钠与水反应:2Na+2H2O═2Na++2OH—+H2↑D.在氢氧化钠溶液中加入过量稀盐酸:OH—+HCl═H2O+Cl—39、可以用离子方程式H++OH—=H2O来表示的化学反应是()A.硝酸和Ba(OH)2溶液的反应B.盐酸和Cu(OH)2的反应C.醋酸和NaOH溶液的反应D.稀硫酸和Ba(OH)2溶液的反应。
原创1:2.2.2 离子反应及其发生的条件

CO32-+2H+= CO2↑+ H2O
离子反应及其发生的条件
总结感第悟9 页
二、离子反应发生的条件 (1)反应生成____沉__淀__;
(2)反应生成___气__体__;
(3)反应生成___水__。
三、离子大量共存基本判断
(1)生成沉淀(难溶或微溶的物质) Ca2+与SO42-,Ba2+与CO32-等
混合前,溶液中各存在哪些离子?请写出电离方程式
混合后,宏观上看到什么现 象?
KCl=K++Cl-
微观上分析?
CuSO4=Cu2++SO42BaCl2=Ba2++2Cl-
Ba2++ SO42 -=BaSO4 ↓
反应的实质
离子反应及其发生的条件
一、离子方程式的书写步骤: Ⅰ.写:正确写出反应的化学方程式(注意条件与配平)
总结感第悟6 页
Ⅱ.拆:易溶于水、易电离的化合物拆成离子形式,其它仍用化学式表示。
Ⅲ.删:删去方程式两边不参加反应的离子。 Ⅳ.查:检查方程式两边各元素的原子个数和电荷总数是否相等
一写、二拆、三删、四查
离子反应及其发生的条件
请写出Ca(OH)2和HCl、KOH和HCl反应的离子方程式。
活学活第用7 页
2.下列离子在无色酸性溶液中能大量存在的是:( C) A. Cu2+ 、 K+、 Cl- 、 B. K+、OH-、 ClC. Na+ 、 K+、 SO42- D. Na+ 、 NO3- 、 CO32-
离子反应及其发生的条件Fra bibliotek总结感第悟11 页
(4)离子共存中附加隐含条件的应用规律
脑缺血再灌注后血脑屏障损伤机制及药物保护作用的研究进展_李蕾

·专题·脑缺血再灌注后血脑屏障损伤机制及药物保护作用的研究进展李蕾1,许栋明2,王文1,王培昌1,艾厚喜1,张丽1,李林1[摘要]脑缺血再灌注导致血脑屏障破坏,从而引起脑出血和脑水肿。
与此同时机体内释放大量的细胞和化学因子可以调控血脑屏障的开放。
目前研究表明,脑缺血再灌注后血脑屏障损伤的主要机制为炎症因子的浸润,蛋白酶的水解作用以及水通道蛋白的开放等。
通过对以上机制的深入研究有助于开发新的脑保护药物,并进一步明确各种脑保护药物的治疗靶点和疗效。
[关键词]脑缺血再灌注;血脑屏障;药物;综述Advance in Damage Mechanism on Blood Brain Barrier after C erebral Ischemia-reperfusion and Neuroprotective Drugs(review)L I L ei,XU Dong-ming,WAN G Wen,et al.X uanwu Hospital o f Capital Medica l University;Torch Hi gh Technology Ind ustry Dev elopment Center,T he Ministry o f Science and T echnology o f the P.R.C.,Beij ing100038,ChinaA bstract:Cerebr al ischemia-reperfusio n results in breakdow n on co nst ruction and function o f blood brain bar rie r,leading to hemo rr hag e tra nsfo rmatio n and br ain edema.A t the same time,g ener ous cy tokines and chemokines r eleased after cerebra l ischemia-reperfusion can regula te the o pening o f the blood brain barrier.M any current studie s show ed that the majo r damag e mechanisms on bloo d brain bar rie r a re inflammatory infiltratio n,pr oteolysis,o pening aquapo rin and so o n.T he deep r esear ch on the mechanism con-tributes to explore new neuro pr otective dr ug s,and fur ther identify the targ et and therapeutic effec t o f drug trea tme nt.Key words:cer ebral ischemia-re perfusio n;bloo d brain bar rier;drug;review[中图分类号]R743.3[文献标识码]A[文章编号]1006-9771(2009)10-0901-04[本文著录格式] 李蕾,许栋明,王文,等.脑缺血再灌注后血脑屏障损伤机制及药物保护作用的研究进展[J].中国康复理论与实践,2009,15(10):901—904.缺血性脑血管病是临床常见的危重疾病,占脑卒中总数的75%~85%。
2009-2010实施部份重要国家、行业标准
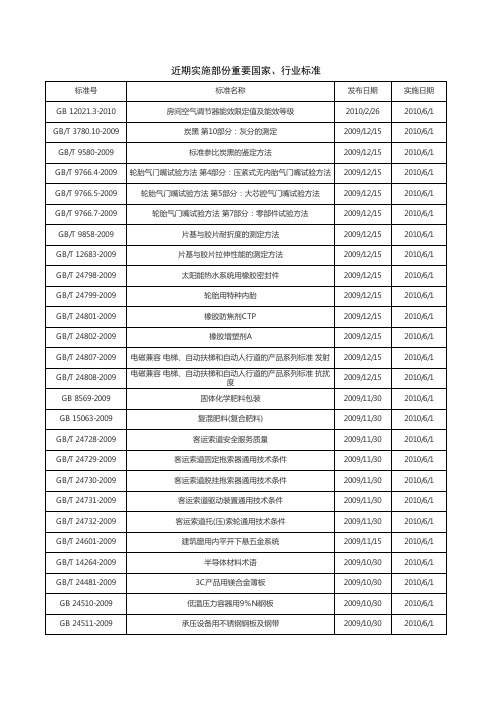
2009-10-30 2009-10-30 2009-9-30 2009-9-30 2009-9-30 2009-9-30 2009-9-30 2009-9-30 2009-9-30 2009-9-30 2009-9-30 2009-9-30 2009-9-30 2009-7-17 2009-7-17 2010-1-14 2010-1-14 2010-1-14 2009-12-4 2009-12-4 2009-12-4 2009-12-4 2009-12-4 2009-12-4 2009-12-4 2009-12-4 2009-12-4 2009-12-4
2009-12-10 2009-12-10 2009-12-4 2009-12-4 2009-12-4 2009-12-4 2009-12-4 2009-12-4 2009-12-4 2009-12-4 2009-12-4 2009-12-4 2009-12-4 2009-12-4 2009-12-4 2009-12-4 2009-12-4 2009-12-4 2009-12-4 2009-12-4 2009-12-4 2009-12-4 2009-12-4 2009-12-4 2009-12-4 2009-12-4 2009-12-4 2009-12-4
牙膏工业用单氟磷酸钠 牙膏工业用磷酸氢钙 室内装饰装修材料 溶剂型木器涂料中有害物质限量 家用和类似用途器具耦合器 第1部分:通用要求 家用和类似用途器具耦合器 第2部分:家用和类似设备用互连 耦合器 家用和类似用途器具耦合器 第2部分:靠器具重量啮合的耦合 器 家用及类似用途机电式接触器 医用软聚氯乙烯管材 建筑用外墙涂料中有害物质限量 汽车涂料中有害物质限量 室内装饰装修材料 水性木器涂料中有害物质限量 家用双层床 安全 第1部分:要求 家用双层床 安全 第2部分:试验 饰面石材用胶粘剂 中空玻璃用硅酮结构密封胶 铝合金衬塑复合管材与管件 水处理用臭氧发生器 超高分子聚乙烯钢骨架复合管材 石棉纱、线 石棉绳 石棉布、带 隔膜石棉布 电绝缘石棉纸 石棉纸板 石棉片 树脂装饰砖 陶瓷用硅酸锆 轻质陶瓷砖
国家标准批准发布公告2009年第2号(总第142号)--批准224项国家标准的公告

2009-09-01
70
GB/T 23270.2-2009
信息与文献 开放系统互连 馆际互借应用协议规范 第2部分:协议实施一致性声明(PICS)条文
2009-03-13
2009-09-01
71
GB/T 23271-2009
二硫化钼
2009-01-05
2009-11-01
72
GB/T 23272-2009
运动保护装备要求 第1部分:登山动力绳
2009-02-06
2009-07-01
68
GB/T 23269-2009
信息与文献 开放系统互连 馆际互借应用服务定义
2009-03-13
2009-09-01
69
GB/T 23270.1-2009
信息与文献 开放系统互连 馆际互借应用协议规范 第1部分:协议说明书
基于文件的电子信息的长期保存2009-03-32009-09-01
23
GB/T 23284-2009
缩微摄影技术 16mm和35mm卷式缩微胶片使用的影像标记(光点)
2009-03-13
2009-09-01
24
GB/T 23305.3-2009
造船 船体结构单元的拓扑 第3部分:单元间的关系
2009-03-09
气缸 成品检验及验收
2009-03-16
2009-11-01
52
GB/T 23253-2009
液压传动 电控液压泵 性能试验方法
2009-03-16
2009-11-01
53
GB 23254-2009
货车及挂车 车身反光标识
2009-03-06
2009-07-01
国家标准批准发布公告2009年第8号(总第148号)--关于批准265项国家标准和4项标准样品的公告

国家标准批准发布公告2009年第8号(总第148号)--关于批准265项国家标准和4项标准样品的公告
文章属性
•【制定机关】国家质量监督检验检疫总局(已撤销),国家标准化管理委员会•【公布日期】2009.07.27
•【文号】国家标准批准发布公告2009年第8号[总第148号]
•【施行日期】2009.07.27
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】标准化
正文
国家标准批准发布公告
(2009年第8号总第148号)
国家质量监督检验检疫总局、国家标准化管理委员会批准以下265项国家标准和4项标准样品,现予以公布(见附件)。
2009年7月27日。
离子反应方程式

离子反应方程式
离子反应方程式是描述化学反应中离子之间相互作用的表达式。
在离子反应中,化学物质可以进行离子的组合或分解,形成新的化合物或离子。
离子反应方程式的编写需要考虑离子的电荷、数量以及化学反应的平衡等因素。
一般情况下,离子反应方程式由离子的化学式和符号来表示。
以氯化铜和氢氧化钠反应为例,可以用离子反应方程式来描述:CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
在这个反应中,氯化铜(CuCl2)和氢氧化钠(NaOH)发生离子交换,生成了氢氧化铜(Cu(OH)2)和氯化钠(NaCl)。
离子反应方程式中的每个离子都需要按照其电荷和数量进行平衡。
在上述例子中,氯化铜的配位数为2,氢氧化钠的数量为2,因此反应式中需要加上系数2来平衡离子。
对于更复杂的离子反应,会涉及到更多离子和化学物质的组合和分解。
在编写方程式时,需要根据反应的实际情况进行配平。
离子反应方程式可以帮助化学家研究化学反应的性质和过程,从而进一步理解化学变化的规律和机制。
通过分析离子反应方程式,可以推测反应物和生成物的性质以及反应过程中的离子交换和配位变化等情况。
总结起来,离子反应方程式是化学反应中离子之间相互作用的描述
表达式。
它可以通过平衡离子的电荷和数量,来准确地描述化学反应
的过程和产物。
离子反应方程式在化学研究和实验中扮演着重要角色,有助于深入理解化学反应的本质和规律。
2009第22届中国化学会全国高中生化学竞赛(省级赛区)试卷及答案

第1题 (20分)1-1 F 4Si -N(CH 3)3 + BF 3 → F 3B -N(CH 3)3 + SiF 4 ; F 3B -N(CH 3)3 + BCl 3 → Cl 3B -N(CH 3)3 + BF 3BCl 3 > BF 3 > SiF 4 顺序错误不给分 (2分) 1-2 (1)BFFF分子构型为平面三角形,不画成平面形不给分 (0.5分) sp 2(0.5分)H 3C33分子构型为三角锥形, 不画成三角锥形不给分 (0.5分) sp 3(0.5分)(2)CH 3H 3C H 3CFB FF B :sp 3 (1分)+ (1分)CH 3H 3C H 3CFFFFSi ,sp 3d (1分)+ (1分)1-3 BCl 3 + 3H 2O = B(OH)3+ 3HCl 不配平不给分 (1分) BCl 3 + C 5H 5N = Cl 3B-NC 5H 5或BCl 3 +N=Cl 3N(1分)1-4BeCl Clsp结构简式和杂化轨道各0.5分 (1分)BeClBeClClCl结构简式1.5分sp 2杂化轨道0.5分 (2分)ClBeCl Be结构简式1.5分sp 3杂化轨道0.5分画成Cl BeCln 也得分(2分)1-5只有画出7配位的结构简式才能得满分,端基氮不配位得0分,二级氮不配位得1分 (2分)Cr 的氧化态为+4(1分)1-6MnOC CCH 3CO CO O3(1分)不要求配体的位置Mn 的氧化态为+1(1分)第2题 (6分) 下列各实验中需用浓HCl 而不能用稀HCl 溶液,写出反应方程式并阐明理由。
2-1 SnCl 2 + 2HCl = SnCl 42- + 2H +不配平不给分 (1分)浓HCl 的作用是形成SnCl 42-,可防止Sn(OH)Cl 的形成,抑制SnCl 2水解。
(1分) 写配平的水解方程式,加浓盐酸平衡向左移动,抑制水解 也得分2分2-2 MnO 2 + 4HCl = MnCl 2 + Cl 2 + 2H 2O不配平不给分 (1分)加浓HCl 利于升高MnO 2的氧化电位,降低Cl -的还原电位,使反应正向进行。
离子反应离子方程式整理

离子反应离子方程式整理1.有水参加的离子反应⑴Na2O2投入水中Na2O2+H2O=4Na++4OH-+O2↑⑵Na投入水中2Na+2H2O=2Na++2OH-+H2↑⑶氯气通入水中Cl2+H2O=(可逆)H++Cl-+HClO⑷FeCl3溶液滴入沸水中Fe3++3H2O=(△可逆)Fe(OH)3(胶体)+3H+⑸AlCl3溶液与NaAlO2、NaCO3、NaHCO3的双水解反应①Al3++3AlO2-+6H2O=4Al(OH)3↓②2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑③Al3++3HCO32-=Al(OH)3↓+3CO2↑⑹氯碱工业2Cl-+2H2O=(通电)Cl2↑+H2↑+2OH-2、有碱参加的离子反应⑴稀NH4Cl溶液中滴入NaOH溶液①混合NH4++OH-=NH3·H2O②共热NH4++OH-=(△)NH3↑+H2O⑵Al投入NaOH溶液中2Al+2OH-+6H2O=2AlO2-+3H2↑⑶用NaOH溶液吸收氯气Cl2+2OH-=Cl-+ClO-+H2O⑷AlCl3溶液滴入NaOH溶液中①少量Al3++3OH-=Al(OH)3↓Al(OH)3+OH-=AlO2-+H2O②后续3AlO2-+Al3++6H2O=4Al(OH)3↓⑸澄清石灰水中通入CO2①少量Ca++2OH-+CO2=CaCO3↓+H2O②过量OH-+CO2=HCO3-⑹NaHSO4溶液中滴入Ba(OH)2溶液2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O⑺向Ca(HCO3)2溶液中滴入NaOH溶液①少量HCO3-+Ca2++OH-=CaCO3↓+H2O②过量2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+H2O⑻向NH4HCO3溶液中滴入过量NaOH溶液NH4++HCO3-+2OH-=NH3·H2O+CO32-+H2O3.有酸参加的离子反应⑴MnO2与浓盐酸共热制氯气MnO2+2Cl-+4H+=(△)Mn2++Cl2↑+2H2O⑵稀硝酸与Fe反应①少量Fe+4H++NO3-=Fe3++NO↑+2H2O②过量3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O⑶H2S气体通入FeCl3溶液中2Fe3++H2S=2Fe2++S↓+H2O⑷Fe2O3与HI反应+I2+3H2O⑸Ca(ClO)2溶液中通入CO2、SO2 ①少量-Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO过量ClO-+CO2+H2O=2HClO+HCO3-②Ca2++ClO-+SO2+H2O=CaSO4↓+Cl-+2H+⑹饱和NaCO3溶液中通入CO22Na++CO32-+CO2+H2O=2NaHCO3⑺NaAlO2溶液中通入CO2①少量2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-②过量AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-4.其它盐溶液的离子反应⑴FeBr2溶液中通入Cl2①少量②过量2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-⑵FeCl3溶液腐蚀铜2Fe3++Cu=2Fe2++Cu2+⑶NaAlO溶液与NaHCO3溶液混合AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-。
物化A试卷答案

暨 南 大 学 考 试 试 卷一、选择题(共25小题,每小题1分,总共25分;请将正确的选项填入题后的括号内)1. ΔH =Q p 适用于下列哪个过程? ( ) (A) 理想气体从107 Pa 反抗恒压105 Pa 膨胀到105 Pa (B) 101325 Pa 下电解CuSO 4 (C) 0 ℃、101325 Pa 下冰融化成水(D) 气体从298 K 、101325 Pa 可逆变化到373 K 、101325 Pa2. 某绝热封闭体系在接受了环境所作的功之后,温度 ( ) (A) 一定升高 (B) 一定降低 (C) 一定不变 (D) 随接受功多少而定3. 将某理想气体从温度T 1加热到T 2,若此变化为非恒容途径,则其热力学能 的变化ΔU 应为何值? ( ) (A) ΔU = 0 (B) ΔU = C V (T 2-T 1) (C) ΔU 不存在 (D) ΔU 等于其他值4. 理想气体混合过程中,下列体系的性质,不正确的是( )∆∆∆∆S H G UC)(A) >0 (B) =0=0 ((D) =05. 理想气体可逆定温压缩过程中,错误的有( )∆∆∆=0 (B) =0 (C) <0 (D) =0(A)S U Q H体6. 理想气体自状态p1V1T1恒温膨胀至p2V2T1。
此过程的ΔA与ΔG有什么关系?( ) (A) ΔA>ΔG(B) ΔA<ΔG(C)ΔA=ΔG(D) 无确定关系7. 糖可以顺利溶解在水中,这说明固体糖的化学势与糖水中糖的化学势比较,高低如何?( )(A)高(B) 低(C) 相等(D) 不可比较8. 比较如下两筒氮气化学势的大小(γ为逸度系数), 答案应为( )(A) μ1> μ2(B) μ1<μ2(C)μ1=μ2(D) 不能比较其相对大小9. 关于偏摩尔量,下面的说法中正确的是( )(A) 偏摩尔量的绝对值都可以求算(B) 系统的容量性质才有偏摩尔量(C) 同一系统的各个偏摩尔量之间彼此无关(D) 没有热力学过程就没有偏摩尔量10. 已知下列反应的平衡常数:H2(g) + S(s) = H2S(s) ①K1;S(s) + O2(g) = SO2(g) ②K2。
09-10期末

北京化工大学2009——2010学年第二学期《有机化学》(72学时)期末考试试卷班级:姓名:学号:分数:一、用系统命名法命名化合物1-10,必要时标明构型(R/S,顺/反或Z/E),写出化合物11-15的结构。
每题1分,共15分。
二、选择题(每题只有一个答案,每题1分,共20分)1. 下列化合物沸点最高的是( ) A. 正戊烷;B. 氯代丙烷;C. 丁醛;D. 丁醇2. 在水中溶解度最大的是:( )A. B. C. D.C 2H 5OC 2H 5n-C 4H 9OH CH 3(CH 2)2CH 3CH 3CH 2CH 22H 5O3. 下列化合物酸性最大的是( )A. 对硝基苯甲酸 B 对甲氧基苯甲酸 C 苯甲酸 D 苯酚 4. 下列化合物碱性最强的是( )A. 对硝基苯胺B. 苯胺C. 乙酰苯胺D. 对氯苯胺5.下列自由基的稳定性由大到小的顺序为( )CH 3CH 2CCH 2CH 2CH 2CH 3CH 3CH 2CHCHCH 3CH 2CH 3CH 3CH 2CCH 2CH 3CH 2CH 3(1)(2)(3)A .(1)>(2)>(3)B. (2)>(1)>(3)C. (3)>(2)>(1)6. 与溴发生加成反应,活性从大到小顺序正确的是:()a.乙烯;b.丙烯;c.氯乙烯;d.溴乙烯A.d>c>a>b;B.b>c>d>a;C.a>c>d>b;D.b>a >d>c7. 按照亲核性从强到弱顺序正确的是:()a. C2H5O-b. HO-c. C6H5O-d. CH3COO-A.d>c>a>b;B.a>b>c>d;C.c>d>b>a;D.a>b>d>c 8. S N1机理水解速率最快的是:()A.叔丁基溴B.正丁基溴C.仲丁基溴D.异丁基溴9. 下列不是S N2反应特征的是:()A.反应速率与亲核试剂浓度有关B.反应物发生Walden构型转化C.极性溶剂明显加快反应速率D.空间位阻影响反应速率10. 下列化合物与HCN加成,反应速率从大到小顺序正确的是:()a. 苯乙酮b. 苯甲醛c. 一氯乙醛d. 三氯乙醛A.d>c>a>b;B.d>c>b>a;C.a>b>c>d;D.c>d>a>b11. 下列化合物能发生碘仿反应的是()A. 2-甲基丁醛B. 正丙醇C. 2-戊酮D. 丙醇12. 在无水AlCl3催化下,下列化合物不能与乙酰氯反应的是()A. 苯磺酸B. 苯C. 苯酚D. 甲苯13. 根据休克尔规则,下列结构中不具有芳香性的是()A.NH B. C. D.OOO14. 下列化合物发生水解反应活性从大到小顺序正确的是()a. 丙酰氯b. 丙酸酐c. 丙酰胺d. 丙酸乙酯A.b > c > d > a;B.b > a > c > d;C.a > b > d > c;D.d > c > b > a15. 下列化合物与卢卡斯试剂发生S N1反应,其快慢顺序正确的是()a. 2-丁烯-1-醇b. 1-丁醇c. 2-丁醇d. 叔丁醇A.d > a > c > b;B.a > c > d > b;C.c > a > b > d;D.a > d > c > b 16. 具有旋光性的化合物是()A.COOHHH OHHO COOHB. C.D.17.反-1-甲基-4-叔丁基环己烷的优势构象是:()A.B.C.D.18. 能够与费林试剂发生反应产生砖红色沉淀的是( ) A. PhCOCH 3 B. PhCHO C. CH 3COOH D. CH 3CH 2CHO19.下列化合物与AgNO 3/乙醇溶液反应,速率最快的是 ( )CH 2ClCH 2ClHClClABCD20. 硝基苯在过量的Zn/盐酸条件下还原主要产物为( ) A .氢化偶氮苯 B. 偶氮苯 C. 苯胺D.重氮盐三、完成下列反应(每空1分,共30分)四、写出下列反应的反应机理(6分)1.CH 3hvCl 2/CH2Cl+HCl2. CH 2CH 2CHO 2CH2CHO-CHO+H 2O五、用简单的化学方法鉴别下列各组化合物(6分)1、A. 环丙烷 B. 环戊烷 C. 环戊烯 D. 1-戊炔2、A. 丙醛 B. 丙酮 C. 丙醇 D. 丙醚六、结构推断题(5分)1mol某烃A,分子式为C7H10,能加3mol溴,与银氨溶液反应生成白色沉淀。
金电解精炼

金电解精炼的理论基础2010-10-15 11:51:50 浏览:901 次我要评论[导读]金的电解可在氯化金和氰化金溶液中进行,为了安全起见,现今世界各国金的电解几乎都采用E.沃耳维尔(Wohlwill)1874年拟定的氯化金电解法,故而称沃耳维尔法。
此法是在大的电流密度和高浓度三氯化金的电解液中进行。
随着过程的进行,粗金阳极被溶解,而于阳极析出电解纯金金的电解可在氯化金和氰化金溶液中进行,为了安全起见,现今世界各国金的电解几乎都采用E.沃耳维尔(Wohlwill)1874年拟定的氯化金电解法,故而称沃耳维尔法。
此法是在大的电流密度和高浓度三氯化金的电解液中进行。
随着过程的进行,粗金阳极被溶解,而于阳极析出电解纯金。
沃耳维尔法,是在氯化金液的电解槽中装入粗金阳极和纯金阳极。
通入电流后,阳极的金和杂质溶解,而在阴极析出纯金。
因而,可以认为电解过程是在:Au(阴极)|HAuCl4,HCl,H2O,杂质|Au,杂质(阳极)的电化学系统中进行的。
此外,溶电解液中的络酸(HAuCl4),还可部分水解(尽管在高酸浓度下不显著)成HAuCl3OH:HAuCl4+H2O HAuCl3OH+HCl由于电解液中存在HAuCl4、HAuCl3OH、HCl和H2O,它们在溶液中可离解成如下的离子:H2O H++OH-HCl H++Cl-HAuCl4H++AuCl4-AuCl3Au3++3Cl-HAuCl3OH H++AuCl3OH-AuCl4Au3++4Cl-AuCl3OH Au3++3Cl-+OH-这些离子的存在,相应地在阳极和阴极上可能发生如下反应。
在阳极上:Au-3e Au3+(1)2OH--2e H2O+O2(2)Cl--e Cl2(3)〔AuCl4〕--e AuCl3+Cl2(4)2〔AuCl3OH〕--2e2AuCl3+H2O+O2(5)Au-e Au (6)上述反应除(1)和(6)式外,其余均为有害反应。
中南大学高分子化学试题-2009

中南大学考试试卷2009 -- 2010 学年上学期时间100分钟高分子物理与化学课程64学时3.5 学分考试形式:闭卷专业年级:材料化学2007级总分100分,占总评成绩70%高分子化学部分(50分):注:此页不作答题纸,请将答案写在答题纸上一、填空题(本题20分,每小题0.5分)1、一个聚合反应通常需要几个小时完成,在自由基聚合反应中是为了(1),在缩聚反应中是为了(2),而在活性阴离子聚合中是为了(3)和(4)。
2、苯乙烯-丙烯腈自由基共聚,(r1=0.41,r2=0.04),共聚反应属于(5)共聚。
自由基活性(6)大于(7)。
如要得到F1=0.62的共聚物,可采取(8),因为(9);如要得到F1=0.3的共聚物,可采取(10)。
3、在离子聚合反应过程中,活性中心与反离子之间的结合有几种形式:(11)、(12)、4、典型的乳液聚合的特点是(15)和(16),主要的组分是(17)、(18)、(19)、(20)。
5、影响开环聚合的难易程度的因素:(21)、(22)、(23)。
6、Ziegler-Natta引发剂的由(24)和(25)构成,例如丙烯的配位聚合的引发剂是(36)和(37)乙烯的配位聚合的引发剂是(36)和(37)8、自由基聚合产生的自动加速效应时,双基终止几率(33),自由基寿命(34),出现这种现象的原因是(35)。
10、自由基聚合链终止的形式为(38),阳离子聚合主要通过向(39)转移而终止,阴离子聚合在非极性溶剂中可以成为(40)聚合。
11、线型缩聚的核心问题是:体型缩聚的关键问题是;所有缩聚反应共有的特征是:12、在自由基聚合的缩聚反应中,分别用(36)和(37)表示聚合反应进行的程度13、根据基团和聚合度的变化,聚合物的化学反应可以分为(36)、()和(37)。
二、选择题(本题15分,每小题1分)。
1、两种单体的Q值和e值越接近,就越A. 难以共聚B. 倾向于交替共聚C. 倾向于理想共聚D. 倾向于嵌段共聚2、聚氨酯通常是由两种单体反应获得,他们是A. 己二醇和二异氰酸酯B. 己二胺和二异氰酸酯C. 己二胺和己二酸二甲酯D. 三聚氰胺和甲醛3、合成橡胶通常采用乳液聚合反应,主要因为乳液聚合A. 不易发生凝胶反应B. 散热容易C. 易获得高分子量的聚合物D. 以水作介质价廉无污染4、合成线性酚醛树脂预聚物的催化剂应选用A. 草酸B. 氢氧化钙C. 过氧化氢D. 正丁基锂5、在聚合物的热降解过程中,单体回收率最高的聚合物是A. 聚苯乙烯B. 聚乙烯C. 聚丙烯酸甲酯D. 聚四氟乙烯6、在自由基聚合反应中导致聚合速度与引发剂浓度无关的可能原因是发生了A. 双基终止B. 单基终止C. 初级终止D. 扩散控制终止7、在具有强溶剂化作用的溶剂中进行阴离子聚合反应时,聚合速度将随反离子的体积增大而:A. 增加B. 不变C. 下降D. 无规律变化8、在合成丁苯橡胶的聚合反应中,分子量调节剂应选用A. 十二烷基硫醇B. 四氯化碳C. 对苯二酚D. 十二烷基磺酸钠9、能用阳离子和阴离子聚合获得高分子的聚合物的单体是A. 环氧丙烷B. 三氧六烷C. 环氧乙烷D. 四氢呋喃10、在通常的聚合反应中,从单体到聚合物总是发生体积收缩,但有一类单体聚合时,体积会膨胀,它是A. 螺烷原酸酯B. 四氢呋喃C. 环氧乙烷D. 己内酰胺11、高密度聚乙烯与低密度聚乙烯的制备方法不同,若要合成高密度聚乙烯,应采用A. BuLiB. TiCl4-AlEt3C. SnCl4-H2OD. 萘+钠12、同时可以获得高聚合速度和高分子量的聚合方法是A. 溶液聚合B. 悬浮聚合C. 乳液聚合D. 本体聚合13、丁基橡胶通常用硫磺作硫化剂,而不用过氧化物,只是因为A. 反应不易控制B. 产生的自由基会引起链断裂C. 毒性大D. 过氧化物价格昂贵14、取代苯乙烯进行阳离子聚合,活性最大的单体是A. 对甲氧基苯乙烯B. 对甲基苯乙烯C. 对氯苯乙烯D. 间氯苯乙烯15、对缩聚反应的特征说话错误是A. 无特定活性种B. 不存在链引发、链增长、链终止等基元反应C. 转化率随时间明显提高D. 在反应过程中,聚合度稳步上升三、简答题(本题6分)1、商品聚苯乙烯的自由基聚合、三聚甲醛的阳离子开环聚合以及己内酰胺的阴离子开环聚合皆存在诱导期,他们在本质上有何不同?怎样消去诱导期?2、在乙酸乙烯酯进行自由基聚合时,若加入少量苯乙烯会出现什么现象?为什么?3、有机玻璃、聚苯乙烯、聚乙烯以及聚氯乙烯热解的特点和差异?、四、计算题(本题12分,每小题6分)1、用1mol的1,4-丁二醇同1mol的己二酸反应,希望得到数均相对分子质量为5000的聚酯:(1)求获得该相对分子质量的聚酯的反应程度(2)若加入相当于己二酸物质的量1%的乙酸,为了生产得到数均相对分子质量为5000的聚酯,要求的反应程度是多少?2、苯乙烯在60℃下,AIBN存在下引发聚合,测得Rp=0.255×10-4mol·L-1·s-1,Xn=2460,偶合终止,忽略向单体链转移,问(1)动力学链长υ=?(2)引发速率Ri=?。
2009药学有机化学期末试卷(公办)[A]答案
![2009药学有机化学期末试卷(公办)[A]答案](https://img.taocdn.com/s3/m/00b2e5a3b0717fd5360cdc4a.png)
温州医学院 2009-2010 学年第二学期 2009年级公办药学专业《有机化学1》期末试卷(A )答案(卷面100分)考试日期: 2010 年7 月 6 日 考试时间: 1:30-3:30 考试方式: 闭卷考试说明: 1、请将所有答案全部填涂在答题卡上,写在试卷上一律无效。
2、请在答题卡上填涂好姓名、班级、课程、考试日期、试卷类型(A )和考号。
试卷一一.单项选择题(本大题共45题,共45分。
)1、下列化合物中哪些可能有顺反异构体?( A )A 、 CHCl=CHClB 、CH 2=CCl 2C 、1-戊烯D 、2-甲基-2-丁烯 2、CH 3CH=CHCH 3与CH 3CH 2CH=CH 2 是什么异构体?BA 、 碳架异构;B 、位置异构;C 、官能团异构;D 、互变异构; 3、的Z 、E 及顺、反命名是:DA 、Z ,顺;B 、E ,顺;C 、Z ,反;D 、E ,反; 4、下列化合物的名称中,正确的是:( A )A .2,4-二甲基-2-戊烯;B .3,4-二甲基-4-戊烯;C .2-甲基-3-丙基-2-戊烯;D .反-2-甲基-2-丁烯。
5、下列化合物不能使酸性高锰酸钾褪色的是( C ) A 、 1-丁烯 B 、 甲苯 C 、 丙烷 D 、 2-丁醇6、HBr 与3,3-二甲基-1-丁烯加成生成2,3-二甲基-2-溴丁烷的反应机理是什么?AA : 碳正离子重排;B :自由基反应 ;C : 碳负离子重排;D :1,3迁移 7、下列四个反应中哪个属于自由基历程:CClCH 2CH 2CHClCH2BrCH 2CH 3CH 2ClCH 2CH3CH 3CH 2CH 2CN8、关于2-丁烯的两个顺反异构体,下列说法正确的是:( A )A .顺-2-丁烯沸点高;B .反-2-丁烯沸点高;C .两者一样高;D .无法区别其沸点。
9、炔烃和烯烃的化学性质比较相似,但炔烃有一种特殊的化学反应:亲核加成反应,你认为炔烃和下列化合物的反应中,哪一种是亲核加成反应:( D ) A . 和水加成;B .和HCl 加成;C .和卤素加成;D .和甲醇加成 10、丙烯与HCl 加成,有过氧化物存在时,其主要产物是(B )A : CH 3CH 2CH 2ClB :CH 3CHClCH 3C : CH 2ClCH=CH 2D : B ,C 各一半11、鉴别环丙烷,丙烯与丙炔需要的试剂是( A )A .AgNO 3的氨溶液;KMnO 4溶液; B. HgSO 4/H 2SO 4; KMnO 4溶液 C. Br 2的CCl 4溶液;KMnO 4溶液; D. AgNO 3的氨溶液。
福建省南平市邵武第三中学2022年高三化学模拟试题含解析

福建省南平市邵武第三中学2022年高三化学模拟试题含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. 已知HCN的电离常数K=6.2×10﹣10.用物质的量都是0.1mol的HCN和NaCN混合后配成1L溶液,经测定溶液呈碱性.则下列关系式正确的是()A.c(CN﹣)>c(Na+)B.c(CN﹣)>c (HCN)C.c(HCN)+c(CN﹣)=0.2mol?L﹣1 D.c(CN﹣)+c(OH﹣)=0.1 mol?L﹣1参考答案:C考点:盐类水解的应用;弱电解质在水溶液中的电离平衡;离子浓度大小的比较..专题:电离平衡与溶液的pH专题;盐类的水解专题.分析:物质的量都是0.1mol的HCN和NaCN配成1L混合溶液,已知溶液呈碱性,根据溶液电中性的原则,溶液中存在c(CN﹣)+c(OH﹣)=c(Na+)+c(H+),溶液应呈碱性,则有c(H+)<c(OH﹣),c(CN﹣)﹣)<c(Na+),结合电荷守恒、物料守恒等知识解答该题.解答:解:A.根据溶液电中性的原则,溶液中存在c(CN﹣)+c(OH﹣)=c(Na+)+c (H+),溶液呈碱性则有c(H+)<c(OH﹣),c(CN﹣)﹣)<c(Na+),故A错误;B.混合溶液呈碱性,说明酸的电离程度小于酸根离子水解程度,则c(HCN)>c(CN ﹣),故B错误;C.因c(Na+)=0.1mol/L,依据物料守恒,c(CN﹣)+c(HCN)=2c(Na+),则c(CN ﹣)+c(OH﹣)=0.2mol/L,故C正确;D.c(CN﹣)+c(OH﹣)=c(Na+)+c(H+),c(Na+)=0.1mol/L,c(CN﹣)+c(OH﹣)>0.1 mol?L﹣1,故D错误.故选C.点评:本题考查离子浓度大小比较,题目难度中等,注意把握离子浓度大小的方法,解题时注意守恒思想的应用.2. 还原沉淀法是处理含铬(Cr2O72﹣和CrO42﹣)废水常用方法,过程如下:CrO42﹣Cr2O72﹣Cr3+Cr(OH)3已知废水中Cr的含量为26.0g?L﹣1,当溶液中离子浓度小于10﹣5mol/L时认为离子已经沉淀完全,常温下,K sp[Cr(OH)3]=1×10﹣32.有关叙述中不正确的是()A.上述三个转化中只有一个涉及氧化还原反应B.第二步离子方程式为:Cr2O72﹣+14H++6Fe2+=2Cr3++7H2O+6Fe3+C.处理含铬废水可使用强碱Ba(OH)2,也可以使用弱碱氨水D.当pH≥5时,废水中铬元素沉淀完全参考答案:C【考点】氧化还原反应.【分析】A.第二步反应中Cr、Fe元素的化合价发生变化;B.酸性条件下,Cr2O72﹣与Fe2+发生氧化还原反应;C.用强碱Ba(OH)2会引入杂质;D.根据K sp[Cr(OH)3]=c(Cr3+)×c3(OH﹣)计算.【解答】解:A.第二步反应为Cr2O72﹣+14H++6Fe2+=2Cr3++7H2O+6Fe3+,反应中Cr、Fe 元素的化合价发生变化,属于氧化还原反应,故A正确;B.酸性条件下,Cr2O72﹣与Fe2+发生氧化还原反应生成铬离子和三价铁离子,其反应的离子方程式为:Cr2O72﹣+14H++6Fe2+=2Cr3++7H2O+6Fe3+,故B正确;C.用强碱Ba(OH)2调节pH会引入杂质Ba2+,Ba2+是重金属离子会污染水,故C错误;D.当溶液中离子浓度小于10﹣5mol/L时认为离子已经沉淀完全,当pH=5时,溶液中c (OH﹣)=10﹣9mol/L,K sp[Cr(OH)3]=c(Cr3+)×(10﹣9)3=1×10﹣32,则c(Cr3+)=10﹣5mol/L,所以当pH≥5时,c(Cr3+)≤10﹣5mol/L,即废水中铬元素沉淀完全,故D正确.故选C.【点评】本题考查难溶电解质的溶解平衡,侧重于学生的分析能力和计算能力的考查,注意把握相关计算公式的运用,难度中等.3. 下列离子方程式正确的是A.澄清的石灰水与盐酸反应: Ca(OH)2- +2H+ = Ca2+ + 2H2OB.钠与水的反应: Na + 2H2O = Na++ 2OH- + H2↑C.Na2SiO3溶液中通入过量的CO2: SiO32-+CO2+H2O =H2SiO3↓+CO32-D.大理石溶于醋酸的反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O参考答案:D略4. 材料与化学密切相关,表中对应系错误的是A解析:金刚石是由碳元素组成的单质,而不是三氧化铝,A项错误。
无机结合料稳定材料试验规程2009

无机结合料稳定材料的物理力学 试验方法
无机结合料稳定材料弯拉强度试验方法; 无机结合料稳定材料劈裂模量试验方法; 无机结合料稳定材料弯拉模量试验方法; 无机结合料稳定材料干缩试验方法; 无机结合料稳定材料温缩试验方法;
无机结合料稳定材料疲劳试验方法; 无机结合料稳定材料室内动态抗压回弹模量 试验方法; 无机结合料稳定材料冻融试验方法; 无机结合料稳定材料抗渗试验方法; 无机结合料稳定材料抗冲刷试验方法; 无机结合料稳定材料振动成型试验方法。
关内容。 • ⑨振动压实方法应增加适用范围。
2008年1月底,编写组发出了《公路工程无机 结合料稳定材料试验规程》(修订)征求意 见稿,进行全国范围的征求意见。
接受并修改的问题
• 根据专家意见增加了术语、符号和代号;对每个 试验的内容进行了规范化,并对原试验规程的部 分试验内容和化学试验相关内容增加了“精密度 和允许差”;将标准养生温度统一为温度 20℃±2℃,相对湿度在95%以上。
3 1095.01 1046.33 1045.01 4.7 4.8 16 1241.58 1185.2 1181.5 4.8 5.1
4 1187.26 1132.42 1131.42 4.8 4.9 17 1110.67 1060.14 1059.23 4.8 4.9
5 1162.4 1106.72 1105.62 5 5.1 18 1069.45 1022.54 1021.58 4.6 4.7
修订的主要内容
归结为三类试验方法
• 原材料 • 取样、成型和养生 • 物理、力学
试验 原 取样、成型 物理、 内容 材料 和养生 力学
总数 15
6
14
原有 方法
5
1
4
基础化学期末试卷A(20091)
上海海洋大学试卷姓名:学号:专业班名:一、是非题(在以上表格中,正确的以(+)表示,错误的以(-)表示。
共20分) 1.某+3价离子的基态电子排布式为1s 22s 22p 63s 23p 63d 5,则该元素在周期表处于第VIII 族。
2.分子中原子的氧化数可能为分数。
3.EDTA 与所有金属离子都形成1:1的配合物。
4.极性化学键组成的分子也可能是非极性分子。
5.氧化剂氧化数降低的半反应叫氧化反应。
6.在酸性介质中,用KMnO 4溶液滴定草酸盐,滴定应开始快些,到滴定终点时减速。
7.[Ag(NH 3)2]+和[AgY]3-的配位数分别为2和1。
8.同一周期中,p 区元素比s 区元素原子电负性大。
9.原电池中,反应体系的化学能转化为电能。
10.共价键具有方向性和饱和性。
11.实际用到的电极电势数值都是相对值。
12.氢原子中,不存在3d 轨道。
13.高锰酸钾标准溶液配制过程中,应使用托盘天平称量高锰酸钾的质量。
14.根据能斯特方程可知,电极电势与氧化数不发生变化的物质浓度无关。
15.在EDTA 配位滴定中,pH 值愈大,酸效应系数愈大。
16.电极电势数值越负,则氧化型物质氧化性越弱,还原型物质还原性越强。
17.洪特规则是指电子在等价轨道上分布时,总是尽可能以自旋相反的方向分占各轨道。
18.n 级配位反应的总反应稳定常数θf K 与累积稳定常数的关系: ⋅⋅=21ββθf K 。
19.判断氧化还原反应能否被用于滴定分析的标准是:条件电极电位差大于0.5伏特。
20.在1s 轨道附近,有可能发现3s 电子出现。
二、选择题 (将正确答案填入以上表格相应的空格中。
共20分) 1.下列电子运动状态可以存在的是:A 、n =2,l =3,m =0,m s =+1/2B 、 n =4,l =2,m =0,m s =+1/2C 、n =2,l =2,m =+2,m s =+1/2D 、n =3,l =1,m =+2,m s =+1/2 2.原电池符号中,“|”表示 A 、盐桥 B 、 物质浓度 C 、两相界面 D 、无任何意义 3.下列物质中,不适宜做配位体的是:A 、CN -B 、H 2OC 、S 2-D 、+4NH4.EDTA 分子中配位原子的个数为:A 、2B 、4C 、6D 、85、以C 2O 42-沉淀Ca 2+时,加入过量的C 2O 42-使Ca 2+沉淀更完全,这是利用:A 、配位效应B 、酸效应C 、盐效应D 、同离子效应 6.具有sp 3等性杂化轨道类型的分子空间构型是: A 、平面正方型 B 、平面三角型 C 、正四面体 D 、正八面体 7.影响配合物类型的因素包括:A 、中心离子的电子构型B 、中心离子的电荷C 、配体种类D 、以上全对 8.下列物质的沸点最高的是:A 、H 2OB 、H 2SC 、NH 3D 、PH 39.当两个原子轨道沿着键轴方向以平行或“肩并肩”方式重叠,形成的共价键称为:A 、σ键B 、π键C 、氢键D 、杂化轨道 10.实验测定结果显示,CO 2分子为直线型结构,则C 原子杂化类型为:A 、sp 杂化B 、 sp 2 杂化C 、 sp 3 杂化D 、 sp 4杂化 11.下列方法不能提高指定滴定剂的配位滴定选择性的是:A 、控制溶液pHB 、选用更好的金属指示剂C 、加入掩蔽剂D 、以上全否 12.反应3A 2+ + 2B → 3A + 2B 3+在标准状态下电池电动势为1.8V ,某浓度时反应的电池电动势为1.6V ,则此时该反应的lgK θ值为: A 、059.08.13⨯ B 、059.06.13⨯ C 、059.08.16⨯ D 、059.06.16⨯ 13.下列电子构型的原子中,电负性最小的是:A 、2s 22p 3B 、2s 22p 4C 、2s 22p 5D 、2s 22p 6 14.KMnO 4溶液滴定Na 2C 2O 4,达到化学计量点时,下列说法正确的是:A 、溶液中两电对MnO 4-/Mn 2+和CO 2/C 2O 42-的电极电势相等B 、溶液中两电对MnO 4-/Mn 2+和CO 2/C 2O 42-的电极电势不相等C 、溶液中不存在MnO 4-和C 2O 42-离子 D 、此时溶液显示KMnO 4颜色 15.已知:ϕθCr 2O 72-/Cr 3+=1.33V ,ϕθFe 3+/Fe 2+=0.77V ,ϕθI 2/I - =0.54V ,下列还原型物质还原能力强弱次序正确的是:A 、 Cr 3+ > I - > Fe 2+B 、 Fe 2+ > Cr 3+ > I -C 、 I - > Fe 2+ > Cr 3+D 、 Cr 3+ > Fe 2+ > I -16.根据四个量子数,可以推断出各电子层所能容纳电子的最大容量为:A 、 n 2B 、 2n 2C 、 3n 2D 、 4n 2 17.为了获得纯净而易过滤、洗涤的晶形沉淀,下面哪项操作是错误的:A 、沉淀反应宜在适当稀的溶液中进行B 、沉淀反应宜在热溶液中进行C 、沉淀反应宜在不断搅拌下,逐滴加入沉淀剂D 、沉淀完成后,应马上过滤洗涤,不用陈化18.HF 和H 2O 分子之间存在的分子间相互作用包括:A 、色散力B 、色散力、诱导力C 、色散力、诱导力、取向力D 、色散力、诱导力、取向力、氢键19.氧化还原滴定中,分别用0.2mol ·L -1的Sn 2+溶液滴定0.1mol ·L -1的Fe 3+溶液和用0.02mol ·L -1的Sn 2+溶液滴定0.01mol ·L -1的Fe 3+溶液,两种情况下,滴定突跃的关系是:A 、相同B 、前者较大C 、后者较大D 、无法判断 20.对于配离子正确的说法是:A 、稳定常数越大,则稳定性越高B 、中心金属离子电荷越高,则越易形成更高配位数的配离子C 、配位原子电负性越大,则稳定性越高D 、各级累积稳定常数相乘,即得到总稳定常数三、填空题(每一空格1分,共20分)。
分析化学期末考试试题

分析化学期末考试试题2008—2009第一学期分析化学期末试题(A)一、选择题 ( 每题2分,共40分 )1(可以用下列中哪些方法减小分析测定中的偶然误差…( )。
A(进行对照试验 B(进行空白试验 C(进行仪器校准 D(增加平行试验的次数 2.为标定KMnO4溶液的浓度宜选择的基准物是---------- ( ) A Na2S2O3 B Na2SO3C FeSO4?7H2OD Na2C2O4 3(已知某标准NaOH溶液在保存过程中吸收了少量CO2,用此溶液标定HCl溶液的浓度,若以酚酞为指示剂,则对所标定的HCl溶液的浓度的影响是( )A.偏高B.偏低C.无影响D.难预测4. 0.05 mol/L SnCl2溶液 10 mL 与 0.10 mol/L FeCl3溶液 20 mL 相混合,平衡时体系的电,,,,, (Fe3+/Fe2+)= 0.68 V, , (Sn4+/Sn2+)= 0.14 V] ( ) 位是[已知此条件时A 0.14 VB 0.32 VC 0.50 VD 0.68 V5. 以下溶液稀释10倍时,pH改变最小的是---------------------------- ( )A 0.1mol/L HAcB 0.1mol/L NH4AcC 0.1mol/L NaAcD 0.1mol/L NH4Cl6(当金属离子M和N共存时,欲以EDTA滴定其中的M,若 CM=10CN,TE=0(1,,pM=0(2,则要求lgK为…( )A 5B 6C 4D 77. (1) 用 0.02 mol/L KMnO4溶液滴定 0.1 mol/L Fe2+溶液 (2) 用 0.002mol/L KMnO4溶液滴定 0.01 mol/L Fe2+溶液,上述两种情况下其滴定突跃将是 ------ ( )A 一样大B (1)>(2)C (2)>(1)D 缺电位值, 无法判断 8采用BaSO4重量法测Ba2+时,洗涤沉淀用的洗涤剂是( )A 稀H2SO4B 稀HClC 冷水D 乙醇9 pH=4时有莫尔法滴定含量,将使结果( )A 偏高B 偏低C 忽高忽低D 无影响10用同一NaOH溶液分别滴定体积相等的H2SO4和HAc溶液,消耗的体积相等,说明H2SO4和HAc两溶液中的( )A.氢离子浓度(mol/L下同)相等;B. H2SO4和HAc溶液的浓度相等;C. H2SO4浓度为HAc溶液浓度的1/2;D.两个滴定的pH突跃范围相同。
2-2离子反应

2、附加隐含条件的应用规律:
⑴溶液无色透明时,则溶液中一定没 有色离子。
常见的有色离子:Cu2+、Fe3+、Fe2+、 MnO4-等
⑵强碱性溶液中肯定不存在与OH-反 应的离子。
⑶强酸性溶液中肯定不存在与H+反 应的离子。
例:书本 P28
书写离子方程式应注意的问题:
⑴凡非溶液中进行的反应一般不能写 离子方程式。
如:NH4Cl固体与Ca(OH)2固体混合加热,只能 写化学方程式。即:
2NH4Cl(固)+Ca(OH)2(固)△=CaCl2+2NH3↑+2H2O
⑵单质、氧化物在离子方程式中一律写
化学式;弱酸(HF、H2S、HClO、H2SO3 等)、弱碱(NH3·H2O)等难电离物质写 化学式;难溶于水的物质(如CaCO3、 BaSO3、FeS、BaSO4、Fe(OH)3等)写化 学式。
⑶多元弱酸的酸式盐的酸根离子在离 子方程式中不能拆开写。
例:1、NaHCO3与盐酸反应: HCO3-+H+==H2O+CO2↑
2、KHSO4与BaCl2反应: SO42-+Ba2+==BaSO4↓
练习:写出下列反应的离子方程式:
1、SO2气体溶于足量氢氧化钠溶 液 SO2 + 2OH- == SO32- + H2O
一、电解质和非电解质: 电解质:在水溶液里或熔化状态下能
够导电的化合物。 如:酸、碱、盐等
非电解质:无论是水溶液里或是 熔化状态下都不导电的化合物。
如:蔗糖、酒精等
想一想: 下列物质哪些是电解质?哪些是非电解 质?哪些能导电?
①金属铜 ②固态NaCl ③O2 ④H2SO4 ⑤碳棒 ⑥酒精水溶液 ⑦KOH水溶液 ⑧熔融状态的KNO3 ⑨葡萄糖 电解质:②④⑧
氟乙酰胺检验方法(化学法)

1.目的为规范和指导本实验室使用化学法对氟乙酰胺的检验,特制定本作业指导书。
2.范围适用于本实验室使用化学法对氟乙酰胺的检验工作。
3.方法步骤3.1检材处理3.1.1固体或半固体检材,可用有机溶剂直接提取法,一般常用甲醇或乙醇浸泡,在50-60℃水浴上温浸1-2h。
如用其它有机溶剂时,可在提取容器中充分振荡,然后过滤,滤液置60℃水浴上蒸发至近干,用适量甲醇溶解残渣,溶液供检验用;3.1.2液体检材,可直接用氯仿等有机溶剂提取或用透析法处理,也可用在水浴上蒸去水分后再用甲醇浸出;3.1.3尿液相直接用扩散盒吸收法收集进行比色测定或用氟离子选择电极法直接测定氟含量;3.1.4内脏组织检材,将组织绞碎捣乱,用碳酸钠和醋酸镁做固定剂,用灼烧法破坏,把有机氟转变成无机氟,再测定氟的含量。
3.2检验方法3.2.1异羟肟酸铁反应:[原理]:在碱性条件下,氟乙酰胺与羟胺反应,生成异羟肟酸,进一步与高铁离子反应,生成紫色异羟肟酸铁铬合物。
[试剂]:(1)100g/L盐酸羟胺溶液;(2)100g/L氢氧化钠溶液;(3)5%盐酸溶液;(4)10g/L三氯化铁溶液。
[操作]:取检材提取液10mL浓缩成1mL于试管中,加100g/L盐酸羟胺0.5mL,再用100g/L氢氧化钠溶液调成碱性,于酒精灯上缓缓加热至沸,放冷后,加5%盐酸调至pH3-4,再加一滴10g/L三氯化铁溶液,如有氟乙酰胺存在,则显紫红色。
3.2.2纳氏试剂反应:[原理]: 氟乙酰胺在强碱性条件下,可水解生成氨,而与纳氏试剂反应,生成桔红色沉淀。
[试剂]: 纳氏试剂[操作]:取1-2mL经处理后的检体水溶液于试管中,加纳氏试剂1-2mL,如含氟乙酰胺,则会有下列呈色反应:淡黄→亮黄→深黄→棕黄→桔红色沉淀。
如含量较高,可立即变黄,短时间就出现红棕色沉淀。
1.目的为规范和指导本实验室用化学法对毒鼠强的检验,特制定本作业指导书。
2.范围适用于本实验室用化学法对毒鼠强的检验工作。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2-2-离子反应
〖知识全貌〗
1、电解质与非电解质
电解质:指在溶液中或熔化状态下能够导电的化合物
非电解质:指在溶液中或熔化状态下都不能够导电的化合物
2、强电解质与弱电解质
强电解质:指能够完全电离的电解质
弱电解质:指只能部分电离的电解质
2、离子反应及其发生的条件
离子反应:在溶液中(或熔化状态)有离子参加或生成的反应。
本质:反应物的某些离子浓度减小。
离子反应发生的条件:(1)生成难溶的物质;(2)生成难电离的物质;(3)生成挥发性的物质;(4)发生氧化还原反应;(5)生成络离子。
离子方程式:用实际参加反应的离子符号来表示反应的式子叫离子方程式。
意义:不仅代表某一个具体的反应;还表示同一类型的离子反应。
〖知识精析〗
一、电解质与非电解质
1、电解质指在溶液中或熔化状态下能够导电的化合物,包括酸、碱、盐、水、金属氧化物。
例如:
HCl、CH3COOH、NaOH、NH3·H2O、Na2SO4、BaSO4、H2O、Na2O、Al2O3等
2、非电解质指在溶液中或熔化状态下都不能够导电的化合物,包括多数有机物、非金属氧化物、非
酸性气态氢化物等。
例如:乙醇、蔗糖、SO2、CO2、NH3等。
3、电解质、非电解质都是指化合物,单质和混合物既不是电解质,也不是非电解质。
4、电解质不一定导电。
例如:强碱和盐等离子化合物在固态时,酸在固态或液态时,没有自由移动
的离子,不能够导电。
5、不能导电的物质不一定是非电解质,能导电的物质不一定是电解质。
例如:氯单质、铜、石墨
6、电解质一定指本身含有离子或能生成离子的化合物。
有些化合物的水溶液能导电,但溶液中的离
子不是它本身电离产生的,不属于电解质,而是属于非电解质,如CO2、SO2、SO3、NH3等,但它们与水反应生成的产物H2CO3、H2SO3、H2SO4、NH3·H2O本身能够电离,是电解质。
二、强电解质与弱电解质
1、强电解质指能够完全电离的电解质,包括强酸、强碱、大部分盐(含难溶性盐)、碱性氧化物等
2、弱电解质指只能部分电离的电解质,包括弱酸、弱碱、水、两性氢氧化物等
3、电解质的强弱与其溶解性无关。
例如:难溶性盐如BaSO4等因溶于水的部分可以完全电离,故属
于强电解质;可溶性盐如HgCl2、Pb(Ac)2等溶解时只有部分电离,故属于弱电解质。
4、电解质强弱与溶液导电性没有必然联系。
导电性强弱与溶液中离子浓度大小有关。
强电解质溶液
的导电能力不一定强,弱电解质溶液的导电能力不一定弱。
二、离子反应及其发生的条件
1、离子反应的概念、本质和条件
⑴概念:在溶液中(或熔化状态)有离子参加或生成的反应。
⑵本质:反应物的某些离子浓度减小。
⑶条件:
①生成难溶的物质
A.常见的难溶物
a.一些金属、非金属:Fe、Cu、S、Si等
b.某些氧化物:Al2O3、CuO、SiO2等
c.难溶的酸:H2SiO3
d.难溶的碱:Mg(OH)2、Al(OH)3、Cu(OH)2、Fe(OH)3等
e.难溶的盐:AgCl、AgBr、AgI、CaCO3、BaCO3、BaSO4、Ca3(PO4)2等
B.当有关离子浓度足够大时,生成微溶物的反应也能发生。
常见的微溶物有Ca(OH)2、CaSO4、
Ag2SO4、MgCO3等。
②生成难电离的物质
A.常见的难电离的物质:HF、H2CO3、CH3COOH、NH3·H2O、H2O、C6H5OH等
B.反应规律:强酸制弱酸,强碱制弱碱。
③生成挥发性的物质。
例如:2H+ + SO32—== SO2↑+H2O
④发生氧化还原反应。
例如:2Fe3+ + Cu == 2Fe2+ + Cu2+2Fe3+ + 2I—=== 2Fe2+ + I2
⑤生成络离子。
例如:Ag+ + 2NH3→[Ag(NH3)2]+
2、书写离子方程式的几条规定
离子方程式:用实际参加反应的离子符号来表示反应的式子叫离子方程式。
离子方程式的意义:不仅代表某一个具体的反应;还表示同一类型的离子反应。
⑴凡非溶液中进行的反应,一般不能写离子方程式。
例如:NH4Cl固体和Ca(OH)2固体混合加热,
不能写成离子方程式。
⑵弱酸、弱碱、难溶性物质、单质、氧化物、气体、水在离子方程式中一律写化学式。
例如:难溶
性物质如CaCO3、BaSO3、FeS、PbS、BaSO4、Fe(OH)3等
⑶多元中强酸(或弱酸)的酸式酸根离子在离子方程式中不能拆开写。
例如:HSO3—、H2PO4—、HPO42
—、HCO
—、HS—等
3
⑷对于微溶物的处理有三种情况:
①在生成物中有微溶物析出时,微溶物用化学式表示。
②当反应物里有微溶物处于溶液状态(稀溶液),写成离子的形式
③当反应物里有微溶物处于浊液或固态时,写成化学式。
例如:往石灰乳中加入Na2CO3溶液:
Ca(OH)2 + CO32—= CaCO3↓+ 2OH—
⑸操作顺序或反应物相对量不同时离子方程式不同(完全反应的反应物符合配比关系)
3、离子方程式正误判断(“七看”)
⑴看离子反应是否符合客观事实,不可主观臆造产物及反应;
⑵看“=”“↑”“↓”等是否正确;
⑶看表示各物质的化学式是否正确;
⑷看是否漏掉反应的离子;
⑸看原子个数、电荷数是否相等;
⑹看反应物或产物的配比是否正确;(完全反应的反应物符合配比关系)
⑺看是否符合题设条件及要求
4、离子能否共存问题
离子反应的实质是反应物中的某些离子浓度的减少,并不是反应物的所有离子浓度都降低。
⑴当离子间有下列情况,则说明离子不能共存。
①生成难溶物或微溶物
②生成气体或挥发性物质
③生成难电离的物质
④发生氧化还原反应
⑤不能与H+或OH—共存的离子有:弱酸的酸式酸根离子、能组成弱酸弱碱盐的离子等(例如:
NH4+和CO32—、NH4+和NO2—)
⑥发生双水解反应的离子不能大量共存。
例如:Al3+、Fe3+分别与CO32—、HCO3—、AlO2—、S2—
等
⑦形成配合物,离子不能大量共存。
⑵附加隐含条件
①溶液为无色透明时,则溶液中肯定没有有色离子。
常见有色离子是:Fe2+(淡绿色)、Fe3+(棕
黄色)、Cu2+(蓝色)、MnO4—(紫色)等
②由水电离出来的[H+]=10—10mol/L,此溶液可能呈酸性,也可能呈碱性。
