2010执业药师考试辅导:国家药品标准
执业药师资格考试(药学专业知识一)考纲要求考点精讲与历年真题详解(药品质量与药品标准)

第十章药品质量与药品标准【考纲要求】【要点详解】一、药品标准与药典1.国家药品标准(1)国家药品标准的效力国家药品标准具有法律的效力,是国家为保证药品质量所制定的关于药品的规格、检验方法以及生产工艺的技术要求,也是药品的生产、经营、使用、检验和监督管理部门共同遵循的法定依据。
(2)国家药品标准的组成①《药品标准》全称为《中华人民共和国卫生部药品标准》或《国家食品药品监督管理局药品标准》,简称为“部颁标准”或“局颁标准”。
②《中华人民共和国药典》③药品注册标准药品注册标准是指国家食品药品监督管理部门批准给申请人特定药品的标准。
生产或销售该药品的企业必须执行注册标准。
(3)国家药品标准的制订原则检查项目有针对性;检查方法有科学性;标准限度有合理性。
2.国际药品标准(1)美国药典(USP)1980年起《美国国家处方集》(NF)并入USP,合称为美国药典-国家处方集(USP -NF)。
USP-NF每年发行1版,最新版本为2016年5月1日生效的USP39-NF34。
该药典共分为4卷,其基本内容包括:凡例、通则和标准正文。
(2)英国药典(BP)《英国药典》是英国制药标准的唯一法定来源。
最新版本为BP(2016)。
该药典分为6卷,其基本内容包括:凡例、正文、附录和索引。
(3)欧洲药典(Ph.Eur.或EP)《欧洲药典》出版周期为3年,最新版为2013年7月出版、2014年1月1日生效的第8版。
该药典分为2卷。
第一卷收载有凡例、通则、制剂通则、指导原则等;第二卷为药品标准。
(4)日本药典(JP)日本药典的名称是《日本药局方》(JP),目前,JP每5年发行1版,最新版是2016年4月1日生效的第17版,记为JP17。
JP收载内容包括:凡例、原料药通则、制剂通则、通用试验方法、正文、红外光谱集、紫外-可见光谱集、指导原则、附录(原子量表)。
3.中国药典(1)主要内容①基本介绍a.名称《中华人民共和国药典》,简称《中国药典》,英文名称为Pharmacopoeia of The People’s Republic of China,简称为Chinese Pharmacopoeia,缩写为ChP。
2010年国家执业药师资格考试大纲药事管理与法规科目
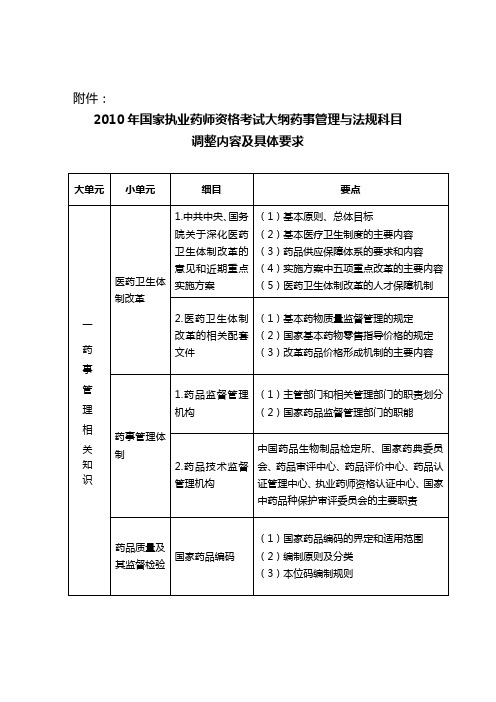
药品质量及其监督检验
国家药品编码
(1)国家药品编码的界定和适用范围
(2)编制原则及分类
(3)本位码编制规则
二药事管理法规
最高人民法院、最高人民检察院关于办理生产、销售假药、劣药刑事案件具体应用法律若干问题的解释
(3)列入国家基本药物目录药品的条件
(4)不能纳入国家基本药物目录遴选的范围
(5)从国家基本药物目录中调出的情形
三药学职业道德
中国执业药师协会对执业药师的道德要求
中国执业药师职业道德准则及其适用指导
(1)救死扶伤,不辱使命
(2)尊重患者,平等相待
(3)依法执业,质量第一
(4)进德修业,珍视声誉
(5)尊重同仁,密切协作
附件:
2010年国家执业药师资格考试大纲药事管理与法规科目
调整内容及具体要求
大单元
小单元
细目
要点
一药事管理相关知识
医药卫生体制改革
1.中共中央、国务院关于深化医药卫生体制改革的意见和近期重点实施方案
(1)基本原则、总体目标
(2)基本医疗卫生制度的主要内容
(3)药品供应保障体系的要求和内容
(4)实施方案中五项重点改革的主要内容
生产、销售假药、劣药刑事案件的认定
(1)生产、销售假药“足以严重危害人体健康”、“对人体健康造成严重危害”及“对人体健康造成特别严重危害”的认定标准
(2)生产、销售的劣药被使用后“对人体健康造成严重危害”及“后果特别严重”的认定标准
(3)医疗机构知情使用假药、劣药以销售假药、劣药罪追究刑事责任
执业药师《西药一》第10章考点:药品质量与药品标准

执业药师《西药一》第10章考点:药品质量与药品标准《药学专业知识一》第十章——药品质量与药品标准药品质量是指能满足规定要求的特征总和,表现在以下五个方面1、有效性;2、安全性;3、稳定性;4、均一性;5、经济性。
药品标准是指国家药品监督管理局颁布的《中华人民共和国药典》、药品注册标准和其他药品标准,其内容包括质量指标、检验方法以及生产工艺等技术要求。
药品标准的研究与确立必须体现其科学内涵,只有统筹考虑药品的有效性及安全性指标,重视方法的针对性才能发挥好药品标准控制药品质量的技术支撑作用。
药典是一个国家记载药品标准、规格的法典,一般由国家药品监督管理局主持编纂、颁布实施,国际性药典则由公认的国际组织或有关国家协商编订。
制定药品标准对加强药品质量的监督管理、保证质量、保障用药安全有效、维护人民健康起着十分重要的作用。
药品标准是药品现代化生产和质量管理的重要组成部分,是药品生产、供应、使用和监督管理部门共同遵循的法定依据。
药品质量的内涵包括三方面:真伪、纯度、品质优良度。
三者的集中表现是使用中的有效性和安全性。
因此,药品标准一般包括以下内容:法定名称、来源、性状、鉴别、纯度检查、含量测定、类别、剂量、规格、贮藏、制剂等等。
《中华人民共和国药典》(简称《中国药典》)是2015年6月5日由中国医药科技出版社出版的图书,是由国家药典委员会创作的。
《中国药典》分为四部出版:一部收载药材和饮片、植物油脂和提取物、成方制剂和单味制剂等;二部收载化学药品、抗生素、生化药品以及放射性药品等;三部收载生物制品;四部收载通则,包括:制剂通则、检验方法、指导原则、标准物质和试液试药相关通则、药用辅料等。
药品企业为保证其药品质量而设立的质量管理机构,负责药品生产全程质量监督,负责物料审核,产品放行,现场检查。
主要检验药品含量,纯度等。
常用检验仪器有,高效液相色谱仪,气相色谱仪,紫外可见光分度计等。
2019年国家对与药品管理工作直接密切相关的调整:将原国家工商行政管理总局的职责,原国家质量监督检验检疫总局的职责,原国家药品监督管理总局的职责,国家发展和改革委员会的价格监督检查与反垄断执法职责,商务部的经营者集中反垄断执法以及国务院反垄断委员会办公室等职责整合,组建国家市场监督管理总局,为国务院直属机构。
执业药师继续教育2

课程2:2010年版《中国药典》的修订情况及主要特点《中国药典》是国家为保证药品质量可控、确保人民用药安全有效而依法制定的药品法典,是药品研制、生产、经营、使用和管理都必须严格遵守的法定依据,是国家药品标准体系的核心,是开展国际交流与合作的重要内容。
全面提高《中国药典》及其他国家药品标准已成为提升医药监管水平,保障人民群众切身利益,促进医药产业健康发展的迫切需要。
2010年版《中国药典》是新中国成立60年来组织编制的第九版药典,新版药典是在总结历版药典经验的基础上,特别是在药品质量与安全受到广泛关注、药品专项整治工作深入的新形势下开展的。
编制工作在国家局的领导下,国家药典委员会组织全国各有关单位,坚决贯彻科学发展观、践行科学监管理念,紧密围绕2010版《中国药典》编制大纲所确立的指导思想、基本原则、任务目标,充分利用近年来国内外药品标准资源,积极开展工作,为进一步加强药品监督管理提供了强有力的技术支撑。
2010版《中国药典》编制工作遵循以下原则:一是提高药品质量、维护公众健康的原则。
二是继承、发展与创新相结合的原则,要继承中医药传统文化,发展中药标准化工作成果;要提高我国新药的质量水平和国际竞争力。
三是科学、实用和规范相结合的原则。
四是坚持标准先进性的原则,对于多企业生产的同一品种,标准的制定要做到“就高不就低”。
要加快与国际标准接轨的步伐,提高我国药品的国际竞争力,努力将我国中医药优势技术提升为国家标准。
一、基本概况2010年版《中国药典》仍分为三部出版,一部为中药(药材、饮片与提取物、成药),二部为化学药(化学、抗生素、生化、放射药),三部为生物制品(细菌、病毒、血液制品、生物技术产品)。
(一)品种2010年版《中国药典》收载品种4567余种,其中新增1386种,尽管药典科研项目与品种工作开展较早,但很大程度收载了国家基本药物目录品种和国家医疗保险目录品种。
药典一部收载药材和饮片、植物油脂和提取物、成方制剂和单味制剂等,品种共计2165种,其中新增1019种(包括439个饮片标准),修订634种。
中药的鉴定-执业药师考试辅导《中药鉴定学》第四章讲义1

正保远程教育旗下品牌网站美国纽交所上市公司(NYSE:DL) 上医学教育网做成功医学人执业药师考试辅导《中药鉴定学》第四章讲义1第四章中药的鉴定第一节中药鉴定的依据“国务院药品监督管理部门颁布的《中华人民共和国药典》和部颁药品标准为国家药品标准”。
国家药品标准为法定的药品标准。
除国家药品标准外,各省、自治区、直辖市颁发的中药饮片炮制规范亦为法定药品标准。
另外,各省、自治区、直辖市颁发的地方药品标准,亦为该地区中药鉴定的依据。
一、国家药品标准国家药品标准包括《中华人民共和国药典》和《中华人民共和国卫生部药品标准》。
(一)《中华人民共和国药典》(简称《中国药典》)《中国药典》是国家监督管理药品质量的法定技术标准。
它规定了药品的来源、质量要求和检验方法,是全国药品生产、供应、使用和检验等单位都必须遵照执行的法定依据。
《中国药典》一经颁布实施,其同品种的上版标准或其原国家标准即同时停止使用。
中华人民共和国成立以来,《中国药典》先后共颁布了九版。
《中国药典》2010年版共载药4567种。
(二)《中华人民共和国卫生部药品标准》(简称《部颁药品标准》)部颁药品标准也由国家药典委员会编纂出版,是补充在同时期该版药典中未收载的品种或内容,与《中国药典》同属国家药品标准,也是全国各有关单位必须遵照执行的法定药品标准。
与药材相关的主要有:1.中药材部颁标准如《中华人民共和国卫生部药品标准》(中药材第一册),载药101种,1991年颁布;《中华人民共和国卫生部药品标准》(藏药第一册),载药136种,1995年颁布;《中华人民共和国卫生部药品标准》(蒙药分册),载药57种,1998年颁布;《中华人民共和国卫生部药品标准》(维吾尔药分册),载药202种,1999年颁布等。
2.进口药材部颁标准我国常用的进口药材约50种,现行版为2004年再次根据药典品种的变化进行修订并执行的《儿茶等43种进口药材质量标准》。
二、地方药品标准(一)各省、自治区、直辖市中药材标准各省、自治区、直辖市制订的中药材标准,收载的药材多为国家药品标准未收载的品种而为各省、自治区或直辖市的地区性习惯用药,该地区的药品生产、供应、使用、检验和管理部门必须遵照执行,而对其他省区无法定约束力,但可作为参照执行的标准。
2010版中国药典

2010版中国药典凡例总则一、《中华人民共和国药典》简称《中国药典》,依据《中华人民共和国药品管理法》组织制定和颁布实施。
《中国药典》一经颁布实施,其同品种的上版标准或其原国家标准即同时停止使用。
《中国药典》由一部、二部、三部及其增补本组成,内容分别包括凡例、正文和附录。
除特别注明版次外,《中国药典》均指现行版《中国药典》。
本部为《中国药典》二部。
二、国家药品标准由凡例与正文及其引用的附录共同构成。
本部药典收载的凡例、附录对药典以外的其他中药国家标准具同等效力。
三、凡例是为正确使用《中国药典》进行药品质量检定的基本原则,是对《中国药典》正文、附录及与质量检定有关的共性问题的统一规定。
四、凡例和附录中采用的“除另有规定外”这一用语,表示存在与凡例或附录有关规定不一致的情况时,则在正文中另作规定,并按此规定执行。
五、正文中引用的药品系指本版药典收载的品种,其质量应符合相应的规定。
六、正文所设各项规定是针对符合《药品生产质量管理规范》(Good Manufacturing Practices, GMP)的产品而言。
任何违反GMP 或有未经批准添加物质所生产的药品,即使符合《中国药典》或按照《中国药典》没有检出其添加物质或相关杂质,亦不能认为其符合规定。
七、《中国药典》的英文名称为Pharmacopoeia of The People’s Republic of China, 英文简称Chinese Pharmacopoeia;英文缩写为Ch.P.。
正文八、正文系根据药物自身的理化与生物学特性,按照批准的处方来源、生产工艺、贮藏运输条件等所制定的、用以检测药品质量是否达到用药要求并衡量其质量是否稳定均一的技术规定。
九、正文项下根据品种和剂型不同,按顺序可分别列有:(1)品名(包括中文名称、汉语拼音与英文名);(2)有机药物的结构式;(3)分子式与分子量;(4)来源或有机药物的化学名称;(5)含量或效价规定;(6)处方;(7)制法;(8)性状;(9)鉴别;(10)检查;(11)含量或效价测定;(12)类别;(13)规格;(14)贮藏;(15)制剂等。
执业药师考试药物分析复习资料汇总资料

执业药师考试药物分析复习资料汇总资料执业药师考试药物分析复习资料汇总资料(1)第一章药典的知识第一节国家药品标准一、药品质量标准的制订国家药品标准是国家为保证药品质量所制定的对于药品的质量指标、检验办法以及生产工艺的技术要求,是药品生产、经营、使用、检验和药品监管治理部门共同遵循的法定依据。
我国现行的药品标准有:国家药典(中国药典)、局标准(国家食品药品监督治理局药品标准)。
制订药品质量标准的原则:1、坚持质量第一的原则。
2、制订质量标准要有针对性。
3、检验办法的挑选应“准确,灵敏,简便,快速”的原则。
4、质量标准杂质中的限度,即保证质量和符合生产实际制订。
二、国家药品标准的要紧内容(一)名称中文名称按照《中国药品通用名称》(CADN)命名,是药品法定名称。
对属于某一相同药效的药物命名,应采纳该类药物的词干。
幸免采纳有关解剖学、生理学、病理学、药理作用或治疗学给患者以暗示的药名。
英文名按照国际非专利药名(INN)确定或拉丁文名。
(二)药物结构式 (三)分子式和分子量:小数点后第二位(四)来源或化学名称(五)含量或效价规定原料药——分量百分数抗生素或生化药品——效价单位制剂——标示量百分含量(六)性状1.外观、臭、味:具有鉴不意义,在一定程度上反映药物内在质量2.溶解度:药物重要物理性质,在质量标准中用术语表示,药典凡例对术语有明确规定。
3.物理常数:熔点、比旋度、折光率、粘度等(七)鉴不:鉴不药物真伪的重要依据,鉴不办法有物理办法、化学办法和生物学办法等。
(八)检查:包括有效性、均一性、纯度要求和安全性四个方面内容。
安全性包括无菌、热原、细菌内毒素等。
有效性检查指和疗效相关,但在鉴不、纯度检查和含量测定中别能有效操纵的项目。
均一性要紧是检查制剂的均匀程度。
纯度要求是对药物中的杂质举行检查,普通为限量检查,别需要测定其含量。
(九)含量测定:用规定办法测定药物中有效成分的含量,常用办法有化学分析法、仪器分析法、生物学办法和酶化学办法等。
执业药师之药分总结

药分第一章国家药品标准国家药品标准:国家为保证药品质量所制定的关于药品规格、检验方法以及生产工艺的技术要求,是药品生产、经营、使用、检验和监督管理部门共同遵循的法定依据。
药品标准的组成:《药典》、《药品标准》、《药品注册标准》药典的缩写:中国药典—Ch. P 日本药局方—JP美国药典—USP 欧洲药典—Ph. Eur英国药典—BP药典的沿革:1953版、1963版、1977版、1985版、1990版、1995版、2000版、2005版、2010版(现行版、共9版)药典分三部:一部:中药材及饮片、植物油脂和提取物、成方制剂和单味制剂-----------中药二部:化学药品、抗生素、生化药品、放射性药品及其制剂、药用辅料-化药三部:生物制品-------------------------------------------------------------------生物制品药典组成:凡例:基本原则、共性问题的统一规定。
正文:品名、有机药物的机构式、分子式与分子量、来源或有机药物的化学名称、含量获效价的规定、处方、制法、性状、鉴别、检查、含量或效价测定、类别、规格、贮藏与制剂等。
附录:制剂通则、通用检测方法、指导原则。
凡例中规定:避光:不透光;阴凉处:<20℃;密闭:防止灰尘;凉暗处:避光并<20℃;密封:防止风化、吸潮或异物进入;凉处:2-10℃;熔封:熔封或严封常温:10-30℃。
标准品:生物检定、抗生素或生化药品,按效价单位IU(或µg)计;对照品:按干燥品或无水物精确度:0.1g(0.06-0.14g);精密称定:准确至千分之一;2g(1.5-2.5g);称定:百分之一;2.0g(1.95-2.05g);约:不超过±10%2.00g(1.995-2.005g)。
精密量取:移液管的要求正文中:名称:中文名称(按中国药品通用名称,CADN);中文名称汉语拼音;英文名称(国际非专利药名,INN)性状:外观、臭、味;溶解度;物理常数(相对密度、馏程、熔点、凝点、比旋度、折光率、黏度、吸收系数、碘值、皂化值、酸值)鉴别:辨别真伪检查:安全性:无菌、热源、细菌内毒素;有效性:制酸力、含氟量、乙炔基、粒度;均一性:重量差异、含量均匀度;纯度:一般杂质(水分、氯化物、硫酸盐、铁盐、重金属、砷盐)特殊杂质(阿司匹林中游离水杨酸、异烟肼中游离肼)含量测定:化学分析法或仪器分析法—含量测定,含量百分数%;生物学方法或酶化学方法—效价测定,效价单位。
国家药品标准及《中国药典》2010

-品种与附录) ❖ 第一、必须坚持保障药品质量、维护人民健康的原则-良好
质量是防病治病、医药产业又快又好发展的最重要前提,药 品质量标准的建军立应该遵循 ❖ 第二、必须坚持继承、发展、创新的原则-加强对中医药精 华完整准确的继承与发展,注重中药的整体作用、多组分多 靶点的协同作用,避免简单地以某一组分代替多组份进而在 标准制定中片面追求一种成分含量测定的作法。应注重建立 并创新中药质量标准体系。促进科学研究与标准化的有效结 合。(据粗略统计,医药科技成果转化率仅为17%)
❖ 第九届药典委员会主任委员 ❖ 邵明立
❖ 副主任委员 ❖ 马晓伟 卫生部副部长 ❖ 吴 浈 国家食品药品监管局副局长 ❖ 于文明 国家中医药管理局副局长 ❖ 陈新年 总后卫生部副部长
❖ 执行委员会
❖ 25个专业委员
一、工作目标
❖ 目标之一是要按期高水平完成《中国药典》 2010年版编制工作
❖ 第一、对于《中国药典》收载的品种,采取 更新与淘汰并举的措施收载范围应覆盖国家 基本药物品种,保障人民基本用药的质量
❖ 第六,同期编译好《中国药典》英文版,开展国际交流与合 作
❖ 第七,完成配套丛书的编制工作。要同期出版《药品红外光 谱集》、中国药品通用名称》、《临床用药须知》、《国家 药品标准工作手册》、《药典注释》、《中药材显微鉴别、 薄层鉴别图谱》等配套书籍,全面地落实好药品质量管理及 标准化工作
一、工作目标与工作原则
procedures,and appropriate acceptance criteria,……acceptable for its intended use. ❖ 2)Specifications-are one part of a total comtrol strategy designed to ensure product quality and consistency.Other parts of this strategy include thorough product characterization during development,and adherence to Good Manufacturing Practices;e.g.suitable facilities,a validated manufacturing process,validated test procedure,raw material testing,in-process testing,stability testing,etc. ❖ 3)Specifications-are chosen to confirm the quality of the drug substance and drug product rather than to estabish full characterization
执业药师《中药一》第一章:中药与药品质量标准

执业药师《中药一》第一章:中药与药品质量标准第一章中药与药品质量标准1.我国已知最早的药学专著是《神农本草经》。
2.首创按药物自然属性分类的本草著作是《本草经集注》。
3.我国第一部官修本草,也是世界上第一部药典的是《新修本草》。
4.我国现存最完整的本草的是《证类本草》。
5.古代本草著作中载药数最多的著作是《本草纲目》。
6.创古本草新增药物之冠的著作是《本草纲目拾遗》。
7.载药数最多且后五卷为民族药专卷的著作是《中华本草》。
8.中药药性理论的内容包括为:四气(定性)、五味(定能)、升降浮沉(定趋势)、归经(定位)、有毒无毒(偏性)。
9.寒凉性的药物所示效用有清热、泻火、凉血、解热毒。
若应用不当,伤阳助寒。
10.温热性的药物所示效用有温里散寒、补火助阳、温经通络、回阳救逆。
若应用不当,伤阴助火。
11.五味中酸的功效是能收、能涩。
作用为收敛固涩(五味子)、生津(木瓜)、安蛔(乌梅)。
若应用不当,会有收敛邪气的不良效用。
12.五味中苦的功效是能泄、能燥、能坚。
作用为通泄(大黄)、降泄(苦杏仁、代赭石)、清泄(黄连、栀子);燥湿(苍术、厚朴、黄柏、苦参);坚阴(黄柏、知母)、坚厚肠胃(黄连)。
若应用不当,会有伤津、伐胃的不良效用。
13.五味中甘的功效是能补、能缓、能和。
作用为补虚、缓急、和中、调和药性(甘草)。
若应用不当,会有腻膈碍胃的不良效用。
14.五味中辛的功效是能散、能行。
作用为发散(荆芥、薄荷)、行气(香附)、活血(川芎)。
若应用不当,会有耗气伤阴的不良效用。
15.五味中咸的功效是能软、能下。
作用为软坚散结(昆布、海藻、鳖甲)、泻下通便(芒硝)。
高血压、动脉硬化者、脾虚便溏者慎用。
16.中药饮片的检查项目有杂质、灰分、水分、微生物、有害物质。
17.中药饮片的杂质要求中煨制品含药屑、杂质≤3%。
18.中药饮片的水分要求为一般炮制品水分含量宜在7%~13%。
19.七情配伍包括单行、相须、相使、相畏、相杀、相恶、相反。
执业药师考试问答题资料

执业药师考试问答题资料1.什么是药品?药品是指用于预防.治疗.诊断人的疾病.有目的地调节人的生理机能,并规定有适应症或者功能主治.用法和用量的物质。
2.药品包括哪些?包括中药材.中药饮片.中成药.化学原料药及其制剂.抗生素.生化药品.放射性药品.血清.疫苗.血液制品和诊断药品等。
3.药品的四性?a.专属性;b.两重性;c.质量的重要性;d.药品的限时性。
4.国家药品标准包括?a.《中华人民共和国药典》一.二部;b.中国生物制品规程;c.国家药品监督管理局颁布的药品标准。
5.中药:是中药材及其饮片和中成药的总称。
6.西药:主要指以化学合成的方法,或从天然产物中提取的有效成分而制成的药物。
7.成药:以一种或多种药物为原料做成的有一定剂型,另起通俗专名,可不经医师处方而直接供患者使用的药物。
8.生药:动植物的全部.部分或其分泌物经简单加工处理而成的药物,如大黄.麝香等。
9.生化药品:指从动物.植物和微生物体中提取分离的天然物质,也包括用生物合成和化学合成法制备的上述物质。
10.生物制品:指用微生物学.免疫学与生物化学的理论和方法制成的菌苗.疫苗.类毒素.抗毒素及血液制品。
11.新药:是指化学结构.组成或作用与已知的药物有某种不而且有一定的临床使用价值或理论研究意义的药物。
特药:指的是具有特定用途的药物,包括诊断用药.特异性解毒药.眼科.皮肤科.妇产科.口腔科用药等。
12.常用剂型的种类:注射剂.片剂.溶液剂.糖浆剂.栓剂.软膏剂.胶囊剂.气雾剂.丸剂.颗粒剂。
13.根据药品的来源分为:天然类.化学类.混合类。
14.根据药品的化学成份可分为:有机药品类.无机药品类.生药类.其他生物性药品类。
15.国家药品标准,是指国家为保证药品质量所指定的质量指标.检验方法以及生产工艺等技术要求,包括国家药品监督管理局颁布的《中华人民共和国药典》药品注册标准和其他药品标准。
16.药品与非药品.内服药与外用药应分开存放;易串味的药品.中药材.中药饮片以及危险品等应与其他药品分开存放。
执业西药师:药学专业知识-【基础精讲班】课件 第10章

国家执业药师资格考试
主讲老师:杨杨
第10章 药品质量与药品标准
第1节 药品标准与药典
一、国家药品标准 (一)国家药品标准的效力与组成 国家药品标准,主要包括《中华人民共和国药典》、《药品标准》 和药品注册标准。 (二)国家药品标准的制定原则★★ (1)针对性:检测项目的制订要有针对性。 (2)科学性 (3)合理性
2.光谱鉴别法 分光光度法常用的波长范围中, 200nm-400nm为紫外光区; 400nm-760nm为可见光区; 760nm-2500nm为近红外光区;
2.5-25μm(按波数计为4OOO-400cm-1)为中红外光区。
常用的分光光度法主要有紫外-可见分光光度法和红外分光光度法。 (1)紫外-可见分光光度法 (2)红外分光光度法 红外吸收光谱图中常见的吸收峰按其所体现的结构特征信息可分 为官能团区(4000-1-1300cm-1) 和指纹区(1300-400cm-1)
性状
外观 溶解度 物理常数
三度
三值 物理常数
两点
一馏率
嗅
味
相对密度 比旋度 黏度 碘值 酸值 皂化值 熔点 凝点 馏程 折光率 吸收系数
7.鉴别 指用规定的试验方法辨识药品与名称的一致性,即辨识药品的真 伪。 注意:对已知物。如果是判断优劣,不属于鉴别范围。 1.化学法:显色反应、沉淀反应、气体生成反应、焰色反应 2.物理化学法 仪器分析方法:紫外-可见分光光度法、红外分光光度法、色谱法 3.生物学法
请继续关注,精彩课程内容待续……
第10章 药品质量与药品标准
第2节 药品质量检验与体内药物检测
药品检验工作的基本程序 ★ 取样 ↓
性状 ↓
检验 ↓
鉴别 ↓
药品标准的组成

药品标准的组成
药品标准一般由以下几个方面的要素组成:
1. 药物名称和成分:标准中会明确规定药品的通用名称、化学名称、药物成分及其含量等信息,以确保药品的准确鉴别和质量控制。
2. 药品规格和质量标准:标准中会详细规定药品的规格、形态、颜色、气味、味道等特征,以及药品的质量要求,如含量、杂质限度、纯度等指标。
3. 药品制备方法:标准中会描述药品的制备方法和过程,包括原料选择、药物加工、配方比例、加工条件等,以确保药品的制备过程符合要求,保证质量稳定可靠。
4. 药品包装和贮存要求:标准中会明确规定药品的包装材料、包装方式、包装容量,以及药品的贮存条件和保质期等要求,以确保药品在包装和贮存过程中的安全性和稳定性。
5. 药品标签和说明书要求:标准中会规定药品标签中需要包含的信息,如药品名称、剂型、用途、用法用量、不良反应等,以及药品说明书的内容和格式要求,以确保药品使用的安全和合理。
6. 药品检测方法和标准:标准中会包含药品的质量检测方法和标准,如理化性质测试、药效学评价、微生物检测等,以确保药品质量的准确和可靠。
以上是常见的药品标准的组成要素,不同类型的药品标准可能会有一些差异。
202X年执业药师《药学专业知识一》第十章考点

202X年执业药师《药学专业知识一》第十章考点参加执业药师考试的同学们注意啦,为你整理“202X年执业药师《药学专业知识一》第十章考点”,供大家参考学习,希望广大考生放松心态,从容应对,正常发挥。
更多考试资讯我们网站的更新哦!考点一:药品标准与药典1.国家药品标准:《中华人民共和国药典》、《药品标准》、药品注册标准2.国家药品标准的制定原则:针对性、科学性(“准确、灵敏、简便、快速”)、合理性3.药典英文缩写① 《美国药典》USP② 《英国药典》BP③ 《日本药典》JP④ 《欧洲药典》EP⑤ 《中国药典》ChP4. 中国药典① 一部中药② 二部化学药③ 三部生物制品④ 四部凡例、通则、药用辅料品种正文⑤ 增补本5. 《中国药典》标准体系构成① “凡例”:基本原则,共性问题的统一规定② 通则主要收载制剂通则、通用方法/检测方法和指导原则③ 正文是药品标准的主体考点二:药品储藏条件① 阴凉处≤20℃;② 凉暗处避光并温度≤20℃;③ 冷处2℃~10℃;④ 常温10℃~30℃。
考点三:精确度① “0.1g” → ±0.04 → 0.06~0.14g② “2g” → ±0.5 → 1.5~2.5g③ “2.0g” → ±0.05 → 1.95~2.05g④ “2.00g”→ ±0.005 → 1.995~2.005g精密称重(千分之一);称定(百分之一)考点四:化学鉴别法1. 颜色反应2.沉淀反应丙二酰脲的银盐反应:巴比妥类+碳酸钠+硝酸银→白色沉淀(一银盐和二银盐)巴比妥类(含丙二酰脲结构)斐林试剂反应:葡萄糖+碱性酒石酸铜→红色沉淀(氧化亚铜)葡萄糖、果糖、麦芽糖(还原性糖)3.气体生成反应尼可刹米+氢氧化钠:二乙胺臭气(你可杀了它,免得跑出来放臭气!) 考点五:光谱、色谱鉴别法与杂质检查1. 紫外-可见分光光度法:紫外光区(200nm~400nm)可见光区(400nm~760nm)2. 红外分光光度法:官能团区(4000cm-1~1300cm-1)指纹区(1300cm-1~400cm-1)3. 杂质检查考点六:含量与效价测定考点七:药品检验取样考点八:体内药物检测1. 血样:全血、血浆(含抗凝剂)、血清(不含抗凝剂)2. 常用抗凝剂:肝素3. 血样的保存:短期保存(冰箱冷藏4℃)、长期保存(-20℃或-80℃冷冻贮藏)4. 需检测血药浓度① 个体差异大:三环类抗抑郁药② 非线性动力学特征:苯妥因钠③ 治疗指数小、毒性反应强的药物:普鲁卡因胺④ 毒性反应不易识别:地高辛、洋地黄苷⑤ 特殊人群用药:氨基糖苷类抗生素⑥ 常规剂量下没有疗效或出现毒性反应⑦ 合并用药发生异常⑧ 长期用药⑨ 药物过量或中毒。
执业药师考试黄金考点第二节药品质量标准

第一章药品与药品质量标准第二节药品质量标准一、药品标准体系(一)我国药品标准体系的组成国家药品标准是我国法定的药品标准,具有法律效力。
国务院药品监督管理部门颁布的《中华人民共和国药典》和药品标准为国家药品标准。
别外,我国的药品标准体系还包括药品注册标准和企业药品标准。
1.中国药典C hP现行版2020年版由国家药典委员会负责制定和修订一部分三类收载中药药材和饮片植物油脂和提取物成方制剂和单味制剂二部分两部分收载化学药品化药、抗生素、生化药品及制剂放射性药物制剂三部收载生物制品预防类治疗类诊断类生物制品通则、总论四部收载通则和药用辅料增补本2.药品注册标准药品注册标准不得低于国家药品标准的相关规定3.企业药品标准非法定标准要高于或等于国家药品标准(二)中国药典的主要结构与内容1.凡例凡例是对《中国药典》正文、通则与药品质量检定有关的共性问题的统一规定2.正文3.通则通则是对药品质量指标的检测方法或原则的统一规定(三)国际药品标准1.美国药典U SP或USP-NF每年1版现为2019版2.欧洲药典P h.Eur或EP三年一版每年发行3个增补本3.日本药典也称《日本药局方》J P五年一版二、药品标准质量要求(一)中国药典标准体系1.凡例对正文与通则有法定约束力2.通则定量分析法内标法外标法加校正因子的主成分自身对照法不加校正因子的主成分自身对照法面积归一法3.正文(二)中国药典的基本要求1.性状外观溶解度易溶1g在不到10ml中溶解溶解1g在10-不到30ml中溶解微溶1g在100-不到1000ml中溶解不溶1g在10000ml不能完全溶解物理常数熔点镏程凝点黏度碘值酸值2.鉴别一般鉴别官能团有机或无机酸根金属离子特殊鉴别收载于《中国药典》正文各品种的鉴别项下,系根据反映该药品的某些物理、化学或生物学等特性所选用的特定方法。
(1)化学鉴别法颜色变化产生荧光产生沉淀生成气体(2)光谱鉴别法1)紫外可见分光光度法2)红外分光光度法具有指纹一样的特征专属几乎没有两个化合物具有相同的红外光谱(3)色谱鉴别法是分析混合物的最有效手段平面色谱法纸色谱法薄层色谱法T CL用于鉴别的色谱法主要是高效液相色谱法(HPLC)保留时间tR作用鉴别依据(4)生物学方法主要用于抗生素和生化药品的鉴别3.检查《中国药典》检查项下包括药品的安全性与有效性的试验方法和限度、均一性与纯度等制备工艺要求等内容,检查项可分为一般检查与特殊检查。
执业药师考试药学专业知识一之药品与药品质量标准(三)考点讲解

基本要求 考点 《中国药典》的基本要求考点14 《中国药典》的 1.性状:外观、臭味、溶解度及物理常数。
2.鉴别:真伪,化学、光谱、色谱、生物学方法。
3.检查:优劣。
安全性和有效性检查。
4.含量或效价测定:化学、仪器分析和生物活性测定。
对于原料药:有效物质的重量百分数(%); 对于抗生素或生化药品:效价单位(国际单位IU); 如未规定上限时,系指不超过101.0%(百里挑一)。
对于制剂:含量占标示量的百分率。
原料药首选滴定分析法。
制剂/复方制剂首选色谱分析法。
抗生素微生物检定法包括管碟法和浊度法。
国家药品标准物质包括标准品、对照品、对照药材、对照提取物、参考品共5种。
标准品—用于生物检定或效价测定的标准物质(三生),量值按效价单位(或μg)计,以国际标准品标定; 对照品—采用物理化学方法进行鉴别、检查或含量测定时使用的标准物质(化学药品),量值一般按照纯度计。
标准品、对照品等类似和平行的情况,经常会交叉互换,需辨别清楚。
如对因/对症、量反应/质反应、作用/效应、激动药/拮抗药等。
贮藏条件汇总:注意精确对应,不要超标储存 遮光:用不透光容器包装,如棕色容器或黑纸包裹的无色透明、半透明容器;避光:避免日光直射; 密闭:用可防止尘土及异物进入的容器包装; 密封:用可防止风化、吸潮、挥发或异物进入的容器包装; 熔封或严封:用可防止空气、水分的侵入与微生物污染的容器或适宜的材料包装; 阴凉处:不超过20℃;凉暗处:避光并不超过20℃; 冷处:2℃~10℃;常温:10℃~30℃; 室温(实验室):25℃±2℃。
X型题 阿司匹林药品质量标准收载的内容中,属于鉴别项的有 A.本品为白色结晶或结晶性粉末;无臭或微带醋酸臭;遇湿气即缓缓水解 B.本品在乙醇中易溶,在三氯甲烷或乙醚中溶解,在水或无水乙醚中微溶 C.取本品约0.1g,加水10ml,煮沸,放冷,加三氯化铁试液1滴,即显紫堇色 D.本品的红外光吸收图谱应与对照的图谱(光谱集)一致 E.炽灼残渣不得过0.1%(通则0831)『正确答案』CD『答案解析』AB属于性状项下内容,E属于检查项下内容。
中国药品检验标准操作规范2010年版中药补充部分04中药片剂

中药片剂片剂系指提取物、提取物加饮片细粉或饮片细粉与适宜辅料混匀压制或用其他适宜方法制成的圆片状或异形片状的制剂,有浸膏片、半浸膏片和全粉片等。
片剂以口服普通片为主,另有含片、咀嚼片、泡腾片、阴道片、阴道泡腾片和肠溶片等。
对片剂的质量要求,除外观应完整光洁,色泽均匀,有适宜的硬度,以及各品种项下规定的检查项目外,还应检查“重量差异”、“崩解时限”和“微生物限度”。
此外,阴道片还应检查“融变时限”,阴道泡腾片检查“发泡量”。
“重量差异”检查法1 简述本法适用于片剂的重量差异检查。
2 仪器与用具2.1 分析天平感量0.1mg(适用于平均片重在0.30g以下的片剂)或感量1mg(适用于平均片重0.30g或0.30g以上的片剂)。
2.2 扁形称量瓶。
2.3 弯头或平头手术镊。
3 操作方法3.1 取空称量瓶,精密称定重量;再取供试品20片,置此称量瓶中,精密称定。
两次称量值之差即为20片供试品的总重量,除以20,得平均片重(m)。
3.2 从已称定总重量的20片供试品中,依次用镊子取出1片,分别精密称定重量,得各片重量。
4 注意事项4.1 在称量前后,均应仔细查对药片数。
称量过程中,应避免用手直接接触供试品。
已取出的药片,不得再放回供试品原包装容器内。
4.2 遇有检出超出重量差异限度的药片,宜另器保存,供必要时的复核用。
4.3 糖衣片应在包衣前检查片芯的重量差异,符合规定后方可包衣。
包衣后不再检查重量差异。
4.4 薄膜衣片在包衣后也应检查重量差异。
5 记录与计算5.1 记录每次称量数据。
5.2 求出平均片重(m),保留三位有效数字。
5.3 按下表规定的重量差异限度,求出允许片重范围(m±m×重量差异限度)。
平均重量重量差异限度0.3g以下±7.5%0.3g或0.3g以上±5%5.4 遇有超出允许片重范围并处于边缘者,应再与标示片量或平均片量相比较,计算出该片重量差异的百分率,再根据上表规定的重量差异限度作为判定的依据(避免在计算允许重量范围时受数值修约的影响)。
