2017年仿制药行业一致性评价分析报告
仿制药一致性评价

仿制药一致性评价仿制药一致性评价是指在原创药产品的专利保护期过期后,其他公司可以申请仿制该药物的生产和销售,其仿制药要求具有与原创药物相同的质量、安全性和有效性。
为了确保仿制药的一致性和可替代性,需要进行一致性评价。
一致性评价的目的是通过对比仿制药与原创药的药物质量、药剂学性质、生物等效性和临床疗效等方面进行全面评估,确认仿制药与原创药的一致性,以确保患者在服用仿制药后能够获得与原创药相同的疗效和安全性。
一致性评价包括药品质量一致性评价和仿制药生物等效性评价两个方面。
药品质量一致性评价主要采用物理化学性质的测定和对生物药性质进行研究,通过对比分析原创药和仿制药的质量特征参数和化学结构特征参数是否一致来评价。
例如,通过测定药物的溶解度、纯度、稳定性和含量等参数的一致性,来确认仿制药的质量。
仿制药生物等效性评价是仿制药和原创药在生物利用度、药物分布、药动学和药效学等方面进行比较和评估。
生物等效性评价常采用体外和体内实验方法结合的方式进行,包括体外药物释放、溶出和体内血药浓度测定等。
通过比较仿制药和原创药在药物浓度时间曲线、峰值、曲线下面积等方面的差异,评估仿制药是否与原创药的生物利用度和药效具有一致性。
一致性评价的基本要求是基于科学原则,数据可比性和客观性。
评价结果应该可以量化地证明仿制药与原创药的一致性,以便医药监管部门作出准确的决策,确保患者的用药安全。
需要注意的是,尽管仿制药与原创药在化学结构上不完全相同,但其在未成为仿制药之前,经过了严格的质量控制和临床试验,并被证明具有一致的生物等效性。
因此,仿制药的一致性评价并不是要求仿制药与原创药在所有方面都完全相同,而是要求其在关键的效果和安全性方面与原创药具有一致性。
最后,为了确保仿制药的质量和一致性,医药监管部门需要建立完善的监管制度和标准,对仿制药上市前和上市后进行严格的监督和检验,从而保障患者的用药安全和疗效。
总而言之,仿制药一致性评价是一项重要的药物评价工作,旨在确保仿制药具有与原创药相同的质量、安全性和有效性,以保障患者的用药安全和疗效。
170825总局关于仿制药质量和疗效一致性评价工作有关事项的公告(2017年第100号)

总局关于仿制药质量和疗效一致性评价工作有关事项的公告(2017年第100号)颁布时间:20170825为做好仿制药质量和疗效一致性评价工作(以下简称一致性评价),现就有关事宜公告如下:一、为便于企业选择参比制剂,国家食品药品监督管理总局将把《关于落实〈国务院办公厅关于开展仿制药质量和疗效一致性评价的意见〉有关事项的公告》(2016年第106号)所附289个品种的原研企业药品列出清单并向社会公布,供企业选择参比制剂时参考。
清单分为已在中国境内上市和未在中国境内上市两类。
建议企业按以下顺序选择其一作为参比制剂备案:(一)原研药品:进口原研药品、经审核确定的原研企业在中国境内生产上市的药品、未进口原研药品;(二)在原研企业停止生产的情况下,可选择美国、日本或欧盟获准上市并获得参比制剂地位的药品。
对国家食品药品监督管理总局已公布的参比制剂,建议企业按照公布的参比制剂开展研究,未备案的无需再备案;对已公布的参比制剂存疑的,可向国家食品药品监督管理总局药品审评中心提出异议并说明理由,国家食品药品监督管理总局召开专家咨询委员会会议公开审议,并公开审议结果。
二、企业报国家食品药品监督管理总局备案的参比制剂全部向社会公开。
对国家食品药品监督管理总局未公布参比制剂的品种,由国家食品药品监督管理总局组织专家咨询委员会讨论后区别情况提出如下指导性意见:(一)可以确认符合参比制剂条件的;(二)存疑的;(三)明显不符合条件的。
对于(二)(三)两种情况是否继续进行研究或重新选择参比制剂,由企业自主决定并承担相应的责任。
三、企业自行从境外采购的参比制剂产品,在提交一致性评价资料时需提供购买凭证、产品包装及说明书等材料,或以其他适当方法证明所用参比制剂是标明企业的产品。
企业发现所使用的参比制剂产品为假冒产品的,应终止正在进行的研究工作,已申报的,应及时向国家食品药品监督管理总局药品审评中心报告并撤回一致性评价申请,视情况免于责任;监管部门发现企业使用的参比制剂产品为假冒产品的,应及时通报相关企业,终止审评审批;已批准上市的要撤销批准文件并向社会公开信息,责成企业作出解释并根据情况立案调查。
仿制药一致性评价

五、一致性评价的现状及影响
国家组织11城市联合采购,加速替代原研
1、11城市外,联盟范围或继续扩大 国家明确以联盟地区公立医疗机构为集中采购主体,探索跨区域联盟集中带量采购。并 提出逐步扩大集中采购的覆盖范围、鼓励各省跟标 2、意在“相互竞争,仿制药替代原研” 实行招标采购( ≥3家)、议价采购( 2家)、谈判采购( 1家)。招标采购原研产品若想 中标,面临价格大幅跳水。 3、以60%-70%的“量”换“价”,多举措确保落地使用 此次“带量采购”是有实际采购量保证的带量采购,一旦中标,即获取11个城市年度药 品总用量的6到7成的市场分额,并且为了确保“量”的落实,方案多措并举,提高企业降价 意愿 4、集采价格即统一的医保支付标准,引导患者用药习惯 《方案》明确对原研药和通过一致性评价的仿制药实行统一的医保支付标准, 若低价仿 制药中标,原研药也将以仿制药的集采价格作为医保支付标准,由于“超出支付标准的部分 由患者自付”,这或将引导患者形成合理的用药习惯。
需开展临床有效性试验和存在特殊情形 基本药物
口服固体制剂 2007年后上市基本药物口服制剂 不同剂型、不同规格 不同酸根、不同碱基
其他化学药品口服固体 制剂
自第一家品种通过后,三年后不再受理申请。
三、仿制药的基本概括(仿制药与原研药的一致性)
化学物质 一致性 1
API 杂质 颗粒
产品功能 一致性 2
五、一致性评价的现状及影响
8月,江西连发两则通知,对“未通过一致性评价,且已有其他3家企业 通过一致性评价”的6个企业的药品暂停挂网资格,目前已涉及了3个品种: 富马酸替诺福韦二吡呋酯片、蒙脱石散、苯磺酸氨氯地平片。
通用名 规格包装 生产企业 处理 原因
蒙脱石散
富马酸替诺福韦二吡呋酯片 苯磺酸氨氯地平片
我对仿制药质量和疗效一致性评价的认识

我对仿制药质量和疗效一致性评价的认识随着医药行业的快速发展,仿制药的生产和销售也越来越受到关注。
众所周知,仿制药是指在原研药产品专利期满后,其他企业按照原研药的质量、疗效、安全性、稳定性等标准生产的药品。
因此,仿制药的质量和疗效一致性评价显得尤为重要。
仿制药质量一致性评价仿制药的质量一致性评价是指仿制药在生产过程中是否符合标准要求。
一般来说,仿制药的质量一致性评价主要包括药品的成分、制剂工艺、质量控制等方面。
这些方面的评价对于确保仿制药的质量水平和稳定性至关重要。
在仿制药质量一致性评价中,药品的成分是评价的重点之一。
药品成分的评价可以从原研药和仿制药的成分结构、含量及比较等方面来进行。
除此之外,制剂工艺也是仿制药质量评价的重要方面。
对于仿制药来说,制剂工艺的合理性和严格性能够直接影响到药品生产过程和产品质量,进而影响到那些需要使用仿制药的患者健康。
仿制药疗效一致性评价仿制药的疗效一致性评价指的是仿制药和原研药在临床疗效上是否具有一致性。
由于仿制药生产的环节相对简单且成本较低,若没有进行疗效一致性评价,那么就有可能出现疗效不同的情况,直接危及患者的健康和安全。
仿制药的疗效评价通常包括动物药效实验、人体药代动力学研究和人体临床试验等多个方面。
其中,人体临床试验是最重要的一个方面,因为它能够直接反映出仿制药的疗效与原研药的差异。
通过人体临床试验,可以对仿制药涉及的疾病、治疗方法和用药量进行比较,从而评价仿制药与原研药的疗效是否一致。
仿制药质疗一致性评价的意义检测仿制药的质量和疗效一致性很重要,这对于保证患者的安全和健康至关重要。
正确评价仿制药的质疗一致性,有以下几方面重要的作用:保证患者用药的安全药品质疗一致性评价可以确保仿制药的质量水平和稳定性,从而使得患者能够更加放心使用仿制药,提高患者用药的安全性和稳定性。
保持市场公平竞争仿制药和原研药都是药品市场的重要组成部分,仿制药的质疗一致性评价可以保证市场上的公平竞争,促进药品市场的良性发展。
注射剂仿制药一致性评价现状与分析

注射剂仿制药一致性评价现状与分析摘要:在治疗患者过程中,通过将注射剂注射到人体,能够提升治疗效果,同时具有起效速度快特点。
但是也会发生不足,导致患者容易产生一些不良反应。
文中将注射剂仿制药作为研究,分析一致性评价的技术要点,在分析过程中,结合我国注射剂仿制药的现状进行分析,希望能够为日后注射剂仿制药的评价等内容奠定基础。
关键词:注射剂仿制药;一致性评价;现状分析前言:注射剂具有多种种类,通过将药物注射到人体,与普通口服药物方式相比较,治疗风险较高[1]。
根据国家药品监测报告显示,采用静脉注射药剂的方式,存在的不良反应超过55%以上,口服药物出现的不良反应仅占3.1%以上。
现如今,由于受到其他因素的影响,因此大部分医院都会通过注射药进行治疗,为了提升安全性,国家注射药物提出更高要求,开展一致性评价方式,文中对此进行分析。
1注射剂仿制药一致性评价现状在2019年,公布了24批化学药品仿制剂的参比制剂目录,在仿制药一致性评价过程中,最为重要的内容是确定参比制剂,公布大批量注射剂参比制剂,是审评的关键要素[2]。
同时,也是为了支撑一致性评价工作的有效开展。
参比制剂部分已经公布,还有部分未公布,由于生产厂家不会供应给市场,因此无法获得参比制剂,导致参比制剂一致性评价工作受到限制,注射剂仿制药一致性评价比较可观。
自2017年开始,相关管理部门已经发布了一致性评价的标准,自2018年以来,很多厂家都申报注射剂仿制药的一次性评价,受理申请在2019年已经承办439个,涉及的厂家超过90个注射剂,仿制药的品种达到120以上。
由此可见注射剂仿制药的一致性评价已经得到开展,通过梳理受审信息发现,受理的总量达到40%以上。
2019年以来,已经收录的注射剂仿制药达到13条以上,其中包含的种药品种类有9个,结合化学药品进行分类,通过对药品的质量和疗效进行评价,发现其数量较为可观,因此可以证明一致性评价注射剂药品,工作得到展开。
仿制药一致性评价

仿制药一致性评价 Revised by Petrel at 2021仿制药一致性评价一:背景信息1)2016年2月6日,国务院颁布了国办发【2016】8号文件“国务院办公厅关于开展仿制药质量和疗效一致性评价的意见”,随后国家又在短时间内连续颁布了一系列关于仿制药一致性评价工作的相关文件和指南,真正拉开了仿制药产品质量和疗效一致性评价工作的序幕。
2)根据国家仿制药一致性评价政策和时限要求,289种基本药物要求在2018年底完成评价,其他仿制药产品若能成为“首名”或“前三名”,对市场和经济意义重大。
否则,则存在较大风险失去市场甚至文号不保。
二:认识与建议虽然国家提出了明确的时间要求和评价原则,但当前的法规并不具体,企业左右为难。
公司基于长期从事药政法规研究的工作经验,我们对本轮要求的认识如下:1)不等不靠、主动研究。
2)要充分重视对产品的信息回顾与整理,重视仿制药评价的整体策划,为开展研究工作打基础。
3)重视药学研究。
仿制药研究的重点是药学部分,也是国家评价仿制药质量的重要内容,CMC是重中之重,必须先行。
4)时间紧迫仿制药一致性评价,尤其是基本药物的评价看起来还有2年多时间,实际分解后留给企业的时间已经非常紧张,即使一切顺利也需要20-25个月。
5)逐步开展,分段进行。
仿制药一致性评价是一个综合工程,链条长,费用高。
尤其是早年完成注册的产品,注册研究与申报资料更加薄弱,适合先初步摸索产品质量现状再进行系统深入的研究。
6)仿制药一致性评价应分为四个阶段开展三:优势与业绩仿制药一致性评价工作是一个系统工程,需要完整的服务链条和资源配置,包括CMC研发实验室、动物GLP实验室、BE临床实验基地、生化分析实验室和注册服务团队,以及良好的公共资源,并且各个环节都要有经验丰富的技术团队与完善的质量管理体系,要经得起注册现场核查与临床现场核查。
1)咨询拥有的优势包括以下几方面:建立了高水平配置的国家级CMC研发实验室,拥有专业的研发人员和十多年药品研发经验,为中国三大医药技术研究成果转化平台之一,国家基本药物标准溶出度曲线制作承担单位之一;合作动物GLP实验室,比格犬等大动物试验不是问题;集团内拥有BE临床试验基地与通过FDA审计的生化分析实验室(海口、长春、南京3个BE基地),BE试验优先快速安排;18年丰富经验的注册团队,轻松化解技术难题。
浅述仿制药一致性评价的意义、现状、问题及建议

浅述仿制药一致性评价的意义、现状、问题及建议1.仿制药质量与疗效一致性评价的意义1.1根本性地提升我国仿制药质量我国是一个发展中国家,同时也是个仿制药大国,国内企业生产的化学药产品绝大多数为仿制药。
以前批准上市的药品没有与原制药一致性评价的强制性要求,导致许多仿制药与原研药有差距,为了根本性地提升我国仿制药质量,从2012年开始,国家药监部门提出了仿制药质量和疗效一致性评价(以下简称“一致性评价”)的系统性工程。
1.2减小国家支付医保的压力与原研药相比,仿制药的研发投入相对较低且无需高风险、高成本的临床研究,因此价格较低。
这也意味着在医疗成本持续增长的当前,仿制药替代原研药成为全球的大势所趋。
2015年有统计数据显示,国内销售额前300位的品种中有122个是外资品种,其中绝大多数已过专利期,且大多已被列入2009版医保目录。
仅这些原研品种被仿制药所取代,理论上即可节省280亿~420亿元。
从医保的压力看,毋庸置疑,目前三明医改的热议初衷既是源于医保支付的压力,而基于国内仿制药产业现状分析,通过一致性评价工作优选国内优秀仿制药,甚至进一步达到提升国内仿制药制剂工艺的目的,短期配合招标政策的倾斜,无疑对解决医保支付压力具有立竿见影的效果。
1.3减小患者支付药费的压力原研药专利过期,相对低价仿制药进入市场,能够降低患者负担。
据美国仿制药协会的统计,2016年仿制药在美国医药市场上占据了89%的处方量,而原研药仅占11%左右。
从用药金额上,2016年仿制药仅占美国处方药处方金额的26%,原研药占据了74%的金额。
由此可见仿制药价廉物美的特性。
美国仿制药协会统计数据显示,仿制药在过去10年内为美国患者节约1.67万亿美元的药品费用,仅2016年就节省了2530亿美元的费用。
尽管2000年出台的《药品政府定价办法》规定“已过发明过专利保护期的原研制药比通过药品GMP认证的企业生产的仿制药品,针剂差价率不超过35%,其他剂型不超过30%”,但实际上,因“唯底价是取”的各地招标政策以及国内仿制药质量差异性,导致原研药与仿制药的价格差异巨大。
国家食品药品监管总局通告2017年第49号——关于发布仿制药质量和疗

国家食品药品监管总局通告2017年第49号——关于发布仿制药质量和疗效一致性评价品种分类指导意见的通告
【法规类别】药品管理
【发文字号】国家食品药品监管总局通告2017年第49号
【发布部门】国家食品药品监督管理总局
【发布日期】2017.03.28
【实施日期】2017.03.28
【时效性】现行有效
【效力级别】部门规范性文件
国家食品药品监管总局通告
(2017年第49号)
关于发布仿制药质量和疗效一致性评价品种分类指导意见的通告
为规范仿制药质量和疗效一致性评价工作,国家食品药品监督管理总局组织制定了《仿制药质量和疗效一致性评价品种分类指导意见》,现予发布。
特此通告。
附件:仿制药质量和疗效一致性评价品种分类指导意见
国家食品药品监管总局
2017年3月28日附件
仿制药质量和疗效一致性评价品种分类指导意见
为进一步推动仿制药质量和疗效一致性评价(以下简称一致性评价)工作的开展,现对品种的分类情况提出如下指导意见:。
仿制药一致性评价制度浅析

二、仿制药一致性评价的方法
仿制药总体质量有保证,但部分产品与原研药存在一定 差距,主要体现在体外溶出度和体内生物等效性的指标上, 这两项指标是反映药品等效的重要指标,评判方法也与此相 对应分为体外评价和体内评价两方面。 (一)体外溶出度 仿制药生产企业需要将待评价的品种与参比制剂同时进 行体外溶出实验,比较2种产品在4种不同溶出介质中的溶出 曲线,根据f2因子法进行相似性分析,以达到仿制药与参比 制剂在不同介质中溶出行为的一致目的。 (二)体内生物等效性 人体内环境复杂,仅依靠体外溶出曲线不能完国家药品安全“十二五”规划解读./WS01/ CL1749/69666.html. [2] 国务院关于印发国家药品安全“十二五”规划的通知 . http:// /WS01/CL1749/69672.html. [3] 国家食品药品监督管理局关于开展仿制药质量一致性评价工作 的通知. /WS01/CL1749/78516.html.
制药的药效与参比制剂一致性, 通过研究体外溶出行为达到相似后的品种,报国家食品 药品监督管理总局备案后可开展生物等效性试验。生物等效 性试验是一致性评价的重要组成部分,通过生物等效性试验 对仿制药的再评价具有重要意义。
三、仿制药一致性评价的重要意义
( 一 ) 提升制药行业整体水平 , 保证公众用药安全有 效[3] 我国医药产业的集中度仍比较低,缺乏规模效益,普遍 存在小、散、乱的现象;医药生产企业高质量产品和创新产 品供应不足,具有自主知识产权及世界影响力的产品很少; 种类繁多的同质化产品难以保证药品质量,导致国药公信力 降低,以至于很多老百姓不得不跑到国外去购买药品。经过 此次一致性评价后的上市仿制药品,在质量和疗效上与原研 药品一致,临床上可与原研药品可以相互替代,百姓用药的 有效性也能随之得到保障。 (二)推动制药行业供给侧改革,促进医药经济结构调 整和产业升级 提高仿制药质量能够推动药品生产领域的结构性改革, 改变现在原研药在有的大医院药品销售比达到80%的局面, 有利于降低医药总费用支出,有利于淘汰落后产能,提高仿 制药的竞争力。医药企业通过开展仿制药一致性评价,也有 利于创新,提高行业集中度。 (三)增强我国医药产业国际竞争力,促进国产药品走 向世界 一致性评价对我国医药产业来说 , 是一次大浪淘沙的 过程,有利于提升医药行业发展质量,进一步推动医药产业 国际化。借助一致性评价的开展实施,将持续提高我国的药 用辅料、包材以及仿制药质量,加快我国医药产业的优胜劣 汰、转型升级步伐,提升我国制剂生产水平,进一步推动我 国制剂产品走向国际市场,提高国际竞争能力。
我国仿制药与原研药的一致性评价

医 药 论 坛
・
我 国仿制药 与原研 药 的一致性评价
郁庆华
( 上 海 医药行 业协 会
中图分类号 : R 9 5 1 文献标识码 : C
上海
2 0 0 0 0 3)
文章编 号 : 1 0 0 6 — 1 5 3 3 ( 2 0 1 3 ) 0 5 - 0 0 3 5 - 0 3
服务水平 、降低 医疗支 出 、维护广 大公众健康 等方 面具
有 良好 的经济效 益和社会 效益 。比如我 国恒瑞药业 生产
前 ,为获 得药 品上市 的行 政审批 ,仿 制药研制者 可 以合 法地不 经专利权 人许可 而使用他人 专利 ,即可 以制造专
利产品或者使用专利方法 【 6 】 。美国于 1 9 8 4年通过 H a t e c h .
药 ; 国家对未来 通过仿制 药一致 性评价 的品种在 药 品招
标 、定价 等方 面有何 区别 政策 ; 企业 目前 应如何 开展工 作等 。本 文就仿 制药存在 的意义 、仿制药 质量评价 和影 响仿制药 质量 的因素 ,以及 国家 近期拟开 展 的仿 制药与 原研药 的一致性 评价工 作等 内容 作一 阐述 ,供 医药工作
评价 。这是一 场 由国家 部署 的逐 步提 高仿 制药质 量和坚 决淘 汰达不 到国际标 准品种 的重 大活 动 ,它正在 成为制
主 ,仿 制药为辅 的市场 ,但随着 医疗 费用上涨 ,2 0 0 3 年 6月 1 8 E t 美国F D A发 布 了 “ 药 品专利 登记及 新药 申请 管理规定 ” ,这是 促进仿 制药发展及使用的新 政策 ,主要 为 了鼓励 仿制药快 速面世并合理使用 。F D A在仿制药 品
节省消费者 3 5 0 亿美元 的药费支 出。
总局关于仿制药质量和疗效一致性评价工作有关事项的公告(2017年第100号)

一、为便于企业选择参比制剂,国家食品药品监督管理总局将把《关于落实〈国务院办公厅关于开展仿制药质量和疗效一致性 评价的意见〉有关事项的公告》(2016年第106号)所附289个品种的原研企业药品列出清单并向社会公布,供企业选择参比制剂 时参考。清单分为已在中国境内上市和未在中国境内上市两类。建议企业按以下顺序选择其一作为参比制剂备案:
(三)在欧盟、美国或日本上市但未在中国境内上市的,经临床研究证实无种族差异的,可使用境外上市申报的生物等效性研 究、药学研究数据等技术资料向国家食品药品监督管理总局提出上市申请;可能存在种族差异的,应开展相应的临床试验。审评通 过的视同通过一致性评价。
(四)上述技术资料,应是用于向欧盟、美国或日本监管部门申请上市的完整研究数据,包括药学研究数据、生物等效性试验 资料等,应符合中国现行技术指导原则要求并需接受国家食品药品监督管理总局现场检查。对提供虚假的证明文件、资料、样品或 者以其他欺骗手段取得药品批准证明文件的,撤销批准证明文件。
总局关于仿制药质量和疗效一致性评价工作有关事项的公告(2017年第100号)
国家食品药品监督管理局网站 2017-08-25 21:10
总局关于仿制药质量和疗效一致性评价工作有关事项的公告(2017年第100号) 2017年08月25日 发布
为做好仿制药质量和疗效一致性评价工作(以下简称一致性评价),现就有关事宜公告如下:
十七、对企业申报的一致性评价申请,审评结论均向社会公开。对通过一致性评价的品种,向社会公开其产品说明书、企业研 究报告及生物等效性试验数据,涉及企业生产工艺及其参数等技术秘密的,按照国家食品药品监督管理总局有关规定执行。具体标 准由国家食品药品监督管理总局药品审评中心另行规定。对未通过一致性评价的品种,将在公布不予通过决定的同时说明不予通过 的理由。
药监局2017年度药品审评报告
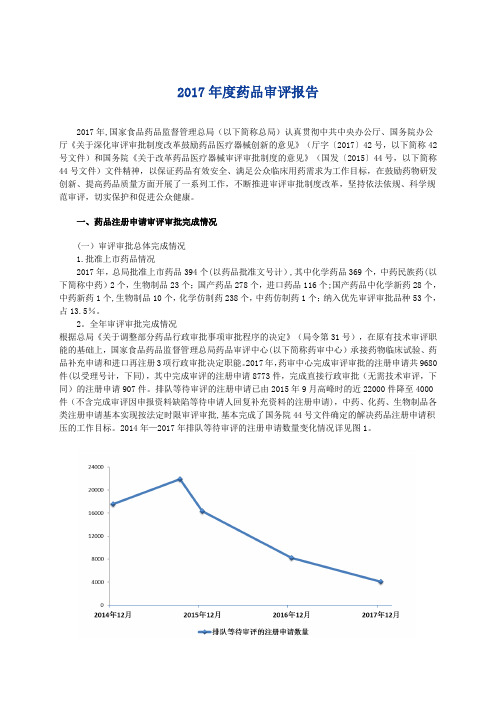
2017年度药品审评报告2017年,国家食品药品监督管理总局(以下简称总局)认真贯彻中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号,以下简称42号文件)和国务院《关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号,以下简称44号文件)文件精神,以保证药品有效安全、满足公众临床用药需求为工作目标,在鼓励药物研发创新、提高药品质量方面开展了一系列工作,不断推进审评审批制度改革,坚持依法依规、科学规范审评,切实保护和促进公众健康。
一、药品注册申请审评审批完成情况(一)审评审批总体完成情况1.批准上市药品情况2017年,总局批准上市药品394个(以药品批准文号计),其中化学药品369个,中药民族药(以下简称中药)2个,生物制品23个;国产药品278个,进口药品116个;国产药品中化学新药28个,中药新药1个,生物制品10个,化学仿制药238个,中药仿制药1个;纳入优先审评审批品种53个,占13.5%。
2。
全年审评审批完成情况根据总局《关于调整部分药品行政审批事项审批程序的决定》(局令第31号),在原有技术审评职能的基础上,国家食品药品监督管理总局药品审评中心(以下简称药审中心)承接药物临床试验、药品补充申请和进口再注册3项行政审批决定职能。
2017年,药审中心完成审评审批的注册申请共9680件(以受理号计,下同),其中完成审评的注册申请8773件,完成直接行政审批(无需技术审评,下同)的注册申请907件。
排队等待审评的注册申请已由2015年9月高峰时的近22000件降至4000件(不含完成审评因申报资料缺陷等待申请人回复补充资料的注册申请),中药、化药、生物制品各类注册申请基本实现按法定时限审评审批,基本完成了国务院44号文件确定的解决药品注册申请积压的工作目标。
2014年—2017年排队等待审评的注册申请数量变化情况详见图1。
图1 2014年—2017年排队等待审评的注册申请数量变化情况完成审评的申请中,化药注册申请为7729件,约占全部审评完成量的88%.各类药品注册申请审评完成情况详见图2。
药监局2017年度药品审评报告

药监局2017年度药品审评报告2017年度药品审评报告2017年,国家食品药品监督管理总局(以下简称总局)认真贯彻中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号,以下简称42号文件)和国务院《关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号,以下简称44号文件)文件精神,以保证药品有效安全、满足公众临床用药需求为工作目标,在鼓励药物研发创新、提高药品质量方面开展了一系列工作,不断推进审评审批制度改革,坚持依法依规、科学规范审评,切实保护和促进公众健康。
一、药品注册申请审评审批完成情况(一)审评审批总体完成情况1.批准上市药品情况2017年,总局批准上市药品394个(以药品批准文号计),其中化学药品369个,中药民族药(以下简称中药)2个,生物制品23个;国产药品278个,进口药品116个;国产药品中化学新药28个,中药新药1个,生物制品10个,化学仿制药238个,中药仿制药1个;纳入优先审评审批品种53个,占13.5%。
2.全年审评审批完成情况根据总局《关于调整部分药品行政审批事项审批程序的决定》(局令第31号),在原有技术审评职能的基础上,国家食品药品监督管理总局药品审评中心(以下简称药审中心)承接药物临床试验、药品补充申请和进口再注册3项行政审批决定职能。
2017年,药审中心完成审评审批的注册申请共9680件(以受理号计,下同),其中完成审评的注册申请8773件,完成直接行政审批(无需技术审评,下同)的注册申请907件。
排队等待审评的注册申请已由2015年9月高峰时的近22000件降至4000件(不含完成审评因申报资料缺陷等待申请人回复补充资料的注册申请),中药、化药、生物制品各类注册申请基本实现按法定时限审评审批,基本完成了国务院44号文件确定的解决药品注册申请积压的工作目标。
2014年-2017年排队等待审评的注册申请数量变化情况详见图1。
仿制药质量和疗效一致性评价doc

仿制药质量和疗效一致性评价doc1.引言随着社会经济的发展和医疗需求的增加,仿制药在全球范围内得到了广泛的应用。
仿制药的质量和疗效一致性评价是保证仿制药质量和疗效与原研药相一致的重要环节。
本文旨在探讨仿制药质量和疗效一致性评价的相关内容。
2.仿制药质量一致性评价质量一致性评价是保证仿制药质量稳定和一致的关键环节。
它通过对仿制药与原研药进行综合分析,包括物理化学性质、药物活性、纯度和稳定性等方面的指标进行比较,评估其是否达到一致性要求。
常用的评价方法包括质量分析、药效评价和药代动力学研究等。
2.1物理化学性质的评价物理化学性质是药物质量评价的基础。
通过对仿制药和原研药参比品进行物理化学性质的比较,可以评估仿制药是否具备一致性。
常用的物理化学性质评价指标包括外观、溶解度、PH值、含量测定和氧化物含量等。
2.2药物活性的评价药物活性评价是评估仿制药疗效一致性的重要内容。
通过临床试验或非临床试验等方法,比较仿制药和原研药在动物模型中的药物活性差异,进一步评估仿制药是否具备与原研药一致的疗效。
2.3纯度的评价纯度是药物质量评价的关键指标之一、通过对仿制药和原研药参比品进行纯度分析,包括杂质含量、杂质结构和杂质对人体的毒性等方面的评估,可以判断仿制药是否具备一致性。
2.4稳定性的评价稳定性是评价药物质量的重要方面。
通过对仿制药和原研药的稳定性研究,包括在不同温度、湿度和光照条件下的稳定性实验,可以评估仿制药是否具备与原研药一致的稳定性。
3.仿制药疗效一致性评价疗效一致性评价是保证仿制药与原研药具有相似疗效的重要环节。
它通过对仿制药和原研药的比较研究,包括药物活性、安全性和有效性等方面的评估,确定仿制药是否具备与原研药一致的疗效。
3.1药物活性的评价药物活性评价是评估仿制药疗效一致性的重要内容。
通过临床试验或非临床试验等方法,比较仿制药和原研药在人体或动物模型中的药物活性差异,进一步评估仿制药是否具备与原研药一致的疗效。
2017年度药品审评报告

2017年度药品审评报告2018年03月22日发布2017年,国家食品药品监督管理总局(以下简称总局)认真贯彻中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号,以下简称42号文件)和国务院《关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号,以下简称44号文件)文件精神,以保证药品有效安全、满足公众临床用药需求为工作目标,在鼓励药物研发创新、提高药品质量方面开展了一系列工作,不断推进审评审批制度改革,坚持依法依规、科学规范审评,切实保护和促进公众健康。
一、药品注册申请审评审批完成情况(一)审评审批总体完成情况1.批准上市药品情况2017年,总局批准上市药品394个(以药品批准文号计),其中化学药品369个,中药民族药(以下简称中药)2个,生物制品23个;国产药品278个,进口药品116个;国产药品中化学新药28个,中药新药1个,生物制品10个,化学仿制药238个,中药仿制药1个;纳入优先审评审批品种53个,占13.5%。
2.全年审评审批完成情况根据总局《关于调整部分药品行政审批事项审批程序的决定》(局令第31号),在原有技术审评职能的基础上,国家食品药品监督管理总局药品审评中心(以下简称药审中心)承接药物临床试验、药品补充申请和进口再注册3项行政审批决定职能。
2017年,药审中心完成审评审批的注册申请共9680件(以受理号计,下同),其中完成审评的注册申请8773件,完成直接行政审批(无需技术审评,下同)的注册申请907件。
排队等待审评的注册申请已由2015年9月高峰时的近22000件降至4000件(不含完成审评因申报资料缺陷等待申请人回复补充资料的注册申请),中药、化药、生物制品各类注册申请基本实现按法定时限审评审批,基本完成了国务院44号文件确定的解决药品注册申请积压的工作目标。
2014年-2017年排队等待审评的注册申请数量变化情况详见图1。
仿制药项目评估分析报告

仿制药项目评估分析报告目录前言 (4)一、组织架构与人力资源配置 (4)(一)、人员资源需求 (4)(二)、员工培训与发展 (6)二、技术方案与建筑物规划 (8)(一)、设计原则与仿制药项目工程概述 (8)(二)、建设选项 (9)(三)、建筑物规划与设备标准 (10)三、仿制药项目基本情况 (12)(一)、仿制药项目名称及仿制药项目单位 (12)(二)、仿制药项目建设地点 (12)(三)、调查与分析的范围 (13)(四)、参考依据和技术原则 (14)(五)、规模和范围 (15)(六)、仿制药项目建设进展 (15)(七)、原材料与设备需求 (17)(八)、环境影响与可行性 (18)(九)、预计投资成本 (19)(十)、1仿制药项目关键技术与经济指标 (20)(十一)、1总结与建议 (21)四、仿制药项目投资主体概况 (22)(一)、公司概要 (22)(二)、公司简介 (23)(三)、财务概况 (23)(四)、核心管理层介绍 (24)五、战略合作与合作伙伴关系 (25)(一)、合作战略与目标 (25)(二)、合作伙伴选择与评估 (25)(三)、合同与协议管理 (27)(四)、风险管理与纠纷解决 (27)六、法律与合规事项 (28)(一)、法律合规与风险 (28)(二)、合同管理 (29)(三)、知识产权保护 (29)(四)、法律事务与合规管理 (29)七、投资方案 (30)(一)、仿制药项目总投资构成分析 (30)(二)、建设投资构成 (31)(三)、资金筹措方式 (32)(四)、投资分析 (33)(五)、资金使用计划 (34)(六)、仿制药项目融资方案 (35)(七)、盈利模式和财务预测 (37)八、营销策略与品牌推广 (38)(一)、营销策略制定 (38)(二)、产品定位与定价策略 (40)(三)、促销与广告战略 (41)(四)、品牌推广计划 (42)九、市场与供应链管理 (44)(一)、供应链策略 (44)(二)、供应商关系管理 (44)(三)、存货与库存管理 (44)(四)、客户关系管理 (45)(五)、物流与分销策略 (45)十、风险评估与应对策略 (45)(一)、仿制药项目风险分析 (45)(二)、风险管理与应对方法 (47)十一、仿制药项目监督与评估 (49)(一)、仿制药项目监督体系 (49)(二)、绩效评估与指标 (50)(三)、变更管理与调整 (51)(四)、定期报告与审计 (52)十二、社会责任与可持续发展 (52)(一)、社会责任策略 (52)(二)、可持续发展计划 (53)(三)、社会参与与贡献 (53)前言本报告是关于仿制药项目运营管理的评价分析,通过对仿制药项目的关键指标和运营流程进行细致分析,旨在发现问题和优化运营效率。
仿制药一致性评价相关药物晶型的问题分析

仿制药一致性评价相关药物晶型的问题分析杜冠华;吕扬【期刊名称】《医药导报》【年(卷),期】2017(36)6【摘要】该文通过讨论仿制药一致性评价中存在的有关问题,分析了药物晶型在药品质量中的作用和对疗效一致性的影响,探讨药物晶型评价的方法和疗效的关系,阐述疗效相关评价指标的建立和提高技术水平的重要性,并对药品质量标准的建立提出疗效控制的要求,为一致性评价过程中技术研究提供基于药物晶型的相关信息.%This study discussed problems in consistency assessment of generic drugs and analyzed effect of polymorphs on drug quality and its influence on consistency of curative efficiency.Relationship between evaluation method of polymorphs and curative efficiency was investigated.It showed that establishment of curative efficiency related evaluation indicators was necessary and improvment of techniques was important.Drug quality criteria should be added with requirement of curative efficiency control.Related information based on polymorphs could be provided for technical research in consistency assessment.【总页数】4页(P593-596)【作者】杜冠华;吕扬【作者单位】中国医学科学院北京协和医学院药物研究所,北京 100050;中国医学科学院北京协和医学院药物研究所,北京 100050【正文语种】中文【中图分类】R926【相关文献】1.晶云药物扎根药物晶型研发,撬动创新药、仿制药市场 [J], 石晗旭2.具有仿晶界型铁素体/粒状贝氏体复相组织的大截面钢筋 [J], 杨福宝;徐平光;王建平;白秉哲;方鸿生3.仿晶界型铁素体/贝氏体低碳锰钢的组织和力学性能 [J], 李龙;丁桦;杜林秀;宋红梅;郑芳4.奥氏体形变对仿晶界型铁素体/粒状贝氏体复相钢组织和强韧性能的影响 [J], 王建平;杨志刚;白秉哲;方鸿生;冯勇;徐洪庆5.铌、钛微合金化仿晶界型铁素体/粒状贝氏体复相钢的形变诱导铁素体相变的研究 [J], 黄海冰;白秉哲;冯勇;徐洪庆因版权原因,仅展示原文概要,查看原文内容请购买。
仿制药一致性评价的可视化分析

仿制药一致性评价的可视化分析高亚;蔺小艳;李戟玭;马雪妮;陈葛舒逸;吴琼慧;田金徽【期刊名称】《中国药物评价》【年(卷),期】2017(34)4【摘要】目的:利用可视化的方法评价我国学者发表的仿制药一致性评价研究的现状.方法:计算机检索中国生物医学文献数据库、中国知网、万方数据库,检索获得仿制药一致性评价的研究.由2位研究者按照纳入与排除标准独立筛选出仿制药一致性评价的研究,用BICOMS-2分析软件对省份、作者及其单位进行抽取和整理并生成共现矩阵,对关键词生成词篇矩阵和共现矩阵,利用NetDraw和gCLUTO1.0分别绘制网络关系图和进行聚类分析.结果:最终纳入仿制药一致性评价及相关研究105篇,研究数量在年代、期刊、作者、作者单位、省份分布方面不平衡,主要作者分为2个主要的合作团体,作者单位也为2个主要的研究团队,作者之间存在一定的联系,但合作有待加强,研究主题主要有3个.结论:近年来,我国仿制药一致性评价的研究数量大致呈现增长趋势,参与作者不多,发文量多的作者也不多,且作者的合作仍需进一步增强.研究主题仍需进一步拓展.【总页数】5页(P241-245)【作者】高亚;蔺小艳;李戟玭;马雪妮;陈葛舒逸;吴琼慧;田金徽【作者单位】兰州大学循证医学中心,兰州大学基础医学院,甘肃兰州730000;兰州大学循证医学中心,兰州大学基础医学院,甘肃兰州730000;兰州大学循证医学中心,兰州大学基础医学院,甘肃兰州730000;兰州大学循证医学中心,兰州大学基础医学院,甘肃兰州730000;兰州大学循证医学中心,兰州大学基础医学院,甘肃兰州730000;兰州大学循证医学中心,兰州大学基础医学院,甘肃兰州730000;兰州大学循证医学中心,兰州大学基础医学院,甘肃兰州730000;甘肃省循证医学与临床转化重点实验室,甘肃兰州730000【正文语种】中文【中图分类】R95;R181【相关文献】1.推进仿制药一致性评价提升行业发展水平——仿制药质量和疗效一致性评价有关政策解读 [J], ;2.推进仿制药一致性评价提升行业发展水平——仿制药质量和疗效一致性评价有关政策解读 [J], 国家食品药品监督管理总局3.基于仿制药一致性评价的制药工程专业实验改革探讨 [J], 刘雄; 向夏芸4.博弈论视角下仿制药一致性评价中制药企业与监管者的决策行为研究 [J], 李勇;邢影影5.食药总局发布《仿制药质量和疗效一致性评价受理审查指南(需一致性评价品种)》《仿制药质量和疗效一致性评价受理审查指南(境内共线生产并在欧美日上市品种)》通告 [J],因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2017年仿制药行业一致性评价分析报告
2017年7月
目录
一、一致性评价:2016年3月正式启动,政策推动的仿制药高质量化运动 (4)
1、2016年3月,国务院正式出台意见,拉开一致性评价的序幕 (4)
2、2016年5月,CDFA落实一致性评价工作 (5)
二、一致性评价的流程:主要包括PE/BE试验两个部分 (6)
1、BE试验:比照试验药和参照药的药代动力学曲线和血药浓度曲线 (7)
2、一致性评价三个可以跟踪的节点:参比制剂备案,BE备案,现场检查 .. 8
3、一致性评价:单品种完整周期32个月,成本约500万元 (10)
三、一致性评价的进展:参考三个节点,大部分药企进入参 (10)
1、参比制剂备案:老牌普药企业备案品种最多 (10)
2、BE备案分析:仅有少部分企业进入该阶段,全国完成约200 个备案 (12)
3、BE现场检查:目前估计在两位数左右,预计2018年前后才有企业正式通
过一致性评价 (13)
4、BE试验优胜者分析:直接跨过药学阶段 (13)
四、一致性评价政策对企业的影响:CRO进入业绩兑现阶段 (16)
1、未来一年行业趋势判断 (16)
(1)BE试验放量,临床CRO进入业绩兑现阶段 (16)
(2)药厂处于主题投资阶段 (16)
2、首仿药:未来三年受益优先采购 (17)
3、普药:未来五到十年,受益门槛提高 (18)
4、制剂出口:优先审评机会大于BE (20)
2016 年3 月国务院正式出台一致性评价意见, 2016 年5 月CDFA 落实一致性评价工作2016 年3 月开始随着国务院关于一致
性评价的8 号文下达,CFDA 不断出台有关一致性评价的政策法规,关于仿制药一致性评价的程序、流程逐渐明朗,参比制剂和临床试验基地的瓶颈逐步开始解决。
国家规定289 的目录原则上在2018 年底前完成一致性评价;对289 个品种以外的化学药品仿制口服制剂限定在首家完成的三年内
完成;通过仿制药评价的品种,国务院要求医保和采购给以一定扶持。
一致性评价的三个节点——参比制剂备案,BE 备案,现场检查“一致性”是指仿制药与原研药或参比制剂的治疗等效,包括药学等同和生物等效;BE 试验是一致性评价的核心,跟踪三大节点能了解药企一致性评价的进展情况;一致性评价大致需要花费32 个月的时间和500 万元的成本。
在一致性评价的过程中,参比制剂备案,BE备案,现场检查是三个可以跟踪的节点,据此来判断行业的进度。
大部分药企进度保持在参比制剂备案阶段,小部分进入BE 阶段,2018 年前后预计有企业正式完成截止2017 年6 月份,共有5320 条参比制剂备案记录,其中传统普药企业备案品种最多;BE 备案平台共公布195 条备案记录;完成BE 的企业还十分稀少,预计2018 年前后才有企业正式通过一致性评价;信立泰和京新药业进展较快,已完成BE 试验。
CRO 企业、普药龙头、首仿药将受益于一致性评价。
未来一年。
