苦参、山豆根植物中主要生物碱药学研究进展
苦参的药理活性研究进展

苦参的药理活性研究进展【关键词】苦参苦参(Sophoraflavescens Ait)为豆科槐属植物,是我国历史悠久的传统药物之一,其性味苦寒,归心、肝、肾、大肠、膀胱经,具有清热燥湿,祛风杀虫,利尿的功能。
用于热痢、便血、黄疸、尿闭、赤白带下、阴痒、湿疹、湿疮、皮肤搔痒、疥疮麻风、外治滴虫性阴道炎。
其主要成分为苦参碱matrine,氧化苦参碱oxymatrine等多种生物碱类成分,苦参醇kurarinol、苦参丁醇kuraridinol 等多种黄酮类成分,另含氨基酸类,挥发油类,糖类,有机酸类,内酯类成分等。
近几年,对苦参化学成分和生物活性的研究不断深入,现将国内外对苦参药理活性的研究现状综述如下。
1 抗肿瘤活性肿瘤的发生和发展不仅是肿瘤细胞增殖和分化异常所致,而且还是肿瘤细胞异常凋亡的结果。
因此,抑制肿瘤细胞增殖,诱导肿瘤细胞分化和凋亡,对临床治疗肿瘤有一定的指导意义。
近几年的研究表明,苦参对恶性葡萄胎、绒癌、子宫癌、埃氏腹水瘤和淋巴内癌细胞都有不同程度的抑制和消灭作用,苦参碱对肿瘤细胞具有选择性杀伤作用,还能通过改变细胞核酸的分子序列,抑制肿瘤的生长,而且这种影响是广泛的、多部位的。
研究表明,用苦参碱治疗各种晚期癌肿,能减轻症状,延长存活期,且不破坏正常白细胞的产生,甚至能升高白细胞,提高机体抵抗力,这是许多治疗药物难以达到的。
对苦参碱在抗肿瘤机制方面的研究概括起来其抗肿瘤活性主要表现在以下几个方面。
抑制肿瘤细胞增殖苦参碱能有效抑制人肝癌细胞株HepG2的增殖。
MTT试验显示,苦参碱对HepG2抑制作用有时间剂量依赖性。
随着作用时间延长和药物浓度的增加,HepG2细胞存活率明显降低,细胞DNA合成亦相应降低。
病理学研究表明,苦参碱可抑制肝癌HepG2细胞的增殖,并具有直接杀伤作用。
其作用机制是苦参碱抑制部分肿瘤细胞从G期进入S期,从而抑制其增殖。
诱导肿瘤细胞分化和凋亡苦参碱不仅能抑制细胞增殖并促进其良性分化,还能诱导肿瘤细胞的凋亡。
苦参生物碱的临床及药理研究进展

结果 有效率 为 6 .% 。苦参 液 ( 35 主要成分 为 氧化
I 1o 2
苦 参 碱 ) 化 吸人佐 治 小 儿哮 喘急性 发 作 01 雾 ,治疗 组 i 4
喘急 、肺部哮鸣音 、湿罗音的消失时 间均优 于对照 组 。证明该药确实可控制 哮喘的发作 。实验研 究发
时 用 氧化 苦 参 碱 防 治 ,病理 检 查 及 计 算 机 图 象 分 析
感者对各种激发因子具有气道高反应性 , 并可 引起气 道缩窄。临床上应用苦参水煎剂作哮 喘发作期治疗
l3 】l
,
发现氧化苦参碱能抑制胶原合成 ,抑制肝 内纤维组 织 增 生 ,大 剂 量 治 疗 组 (0m / g 作 用 更 为 明 显 6 g k ) 同时氧化苦参碱可抑制肝组织内炎症活动度 , 下调血清透明质酸 、Ⅳ型胶原、T F “水平 。 N 一
样 性 的。苦参碱 能 明显减低 异位 节律 性 ,对 离 体右 心
房的自律性也能 明显对抗。对大鼠心电图作用表现为
P—R 间 期延 长 ,也 能 使 Q—T c间 期 延 长 。 据 此 认 为 ,负性 自律性 、负性传导 、负性 频率 的作用 可 能是
病毒蛋白质合成的抑制。现已有临床应用苦参碱治疗
维普资讯
中药新药与临床 药理 20 02年 5月弟 1 3卷第 3期
苦参生物碱 的临床及药 理研 究进展
焦 霞,沈其 昀 ( 上海第二医科大学附属仁济医院呼吸科.上海 200 ) 00 1
摘要 :苦参生物碱 具有抗 律 失常、抗病毒 、抗肝 纤维化 、抗 炎、平喘、免疫调 节厦抗肿 瘤等多种药理作用 ,其 制
力作用 ,故ห้องสมุดไป่ตู้于慢性心衰合并心律失常亦有较好的疗
苦参生物碱的研究进展

类化合 物。从苦参根 、茎 、叶和花 中共分离出 23种生物碱 。苦参 生 物碱 大多数是喹诺里西 啶类,极少数为双哌 啶类 。喹诺里西 啶生 物
2.6对 中枢神经系统药理研究 耿群美报道药理实验结果表 明,苦参碱与氧化苦参 碱有类似 安
碱 多数为苦 参碱型 生物碱,另有三种 金雀花碱 型,三种无 叶豆 碱型, 定作用,二药对 中枢有抑制作用,并与脑 中递质 C2氨基 丁酸和甘 氨
用定量较准确的高效液相色谱 法进行含量控制 。
赖 关 系 。
制剂 的质量控制研究 ,目前主要采 取测 定苦参总碱或 总碱 中主 2.5对心肌功能的影响 要代表 成分苦参 碱 、氧化苦参 碱 的含量 作为质量 控制标 准,主要 测 季勇报 道在离体 豚 鼠工 作心脏上 ,观察苦参 碱对 心功能 的作 定方法有酸碱滴 定法 、薄层 比色法 、酸性染料结合测定法 、双波长薄 用。研究表明:0.1,1.0,10 mo 1/L ,可浓度依赖性增 强心脏 的收缩
胞 的 免 疫 功 能 活 性 均 有 抑 制 作 用 。
【5】冯亚珍,周蓉,魏新峰 .苦参对 小鼠免疫功 能的抑制作用fJ1.河 南中
2.4 抗柯 萨奇 B病毒主要研究
医,1997,17(5):277—278.
陈婷婷[63报 道,当苦参总碱浓度 在 200 Lg/m l一3.125 Lg,m l 【6】陈婷婷,陈曙霞,刘晶星.苦参总碱有效成分对柯萨奇 B病毒感染
生 TN F以及致死性肝炎 的影响 。结果表 明可降低血清 TNF和 ALT 肝 纤 维 化 的 实验 研 究『J1.肝 脏 ,2002,7(1):2—4.
水平及 小 鼠对致死毒性 的敏感 性,并 可在体外抑制诱 导的经 PA 预 [2】蔡雄,王 国俊,瞿 瑶 .苦参素注射液治疗慢 性 乙肝 l临床 疗效分析[J].
苦参生物碱的药理研究进展

529-535.[13] BarstR J,Langleben D,FrostA,et a.l S itaxsen tan t h erapy for pu-lm onary arterialhyp ertensi on.A m JR esp ir Crit CareM ed,2004,169:441-447.[14] S i ngh TP,Roh itM,Grove A,et a.l A rand om ized,p l acebo-con-trolled.doub led -bli nd crossover to study t o eval uate the effi cacyof oral sil den afil t herapy i n severe pu l m onary artery hypert en si on.H ypertension,2006,l5l(4):851-855.[15] Sastry BK,N arasi m h an C,Roddy NK,et a.l C li n ical effi cacy o f si-lden afil i n p ri m ary p u l m on ary h ypertensi on:a rando m i zed,p lacebo-OUR-tro ll ed,double-b li nd,crossover st udy.J Am Co il Card i o,l2004,43(7):1149-1153.[16] Fu ku m ot o Y,M at ob a T,Ito A,et a.l A cute vas od il at or effect o f aRho2k inase i nh i b it or,fasudi,l i n pati en t sw it h severe pu l m onary hy-perten si on.H ear,t2005,91:391-392.[17] N is h i m ura T,Vasz at L T,Fau l J L.S i m vastati n rescues rats f ro mf atal pu l m onary hyperten si on by i nduci ng apop t osis of n eoi n ti m als m oot h m uscl e cells.C i rcu l ation,2003,108:1640-1645.[18] G irgis RE,L i D,Zhan X,et al.A ttenuati on of ch ron i c hypox i cpu l m onary hyp ertensi on by si m vast atn.Am J Physi o lH eart C ircPhysi o,l2003,285:938-945.[19] Kwak B,M u l haup tF,My itS,et a.l Stati n s as a ne w l y recogn iz edt ype of i m muno m odu l ator.N atM ed,2000,6:1399-1402.[20] Lee JH,Lee DS,K i m EK,et al.S i m vast ati n i nh i b its ci garettes-m ok i ng-i nduced e mphyse ma and pu l m onary hyp ertension i n ratl ungs.Am JR esp i r Crit Care M ed,2005,172:987-993.苦参生物碱的药理研究进展刘雪花摘要 苦参生物碱是豆科植物苦参的主要有效成分,碱是一类具有与苦参次碱-15-酮(m atri d i ne-15-ketone)基本化学结构相似的化合物,属于四环的喹嗪啶类(qui nolizi d i ne),分子骨架可看作二个喹嗪啶环的稠合体。
苦参药理学研究新进展

苦参药理学研究新进展前言苦参是一种传统草药,被广泛用于亚洲的中药治疗各种疾病,特别是皮肤病和风湿病。
近年来,随着现代药学技术的发展,对苦参所含的化学成分和其药理学活性的研究不断深入。
本文将简要概述苦参药理学研究的新进展。
苦参的生物活性成分苦参所含的主要生物活性成分为黄酮类化合物,包括苦参素、异黄酮、芦丁、山茱萸甙等。
这些化合物具有多种药理活性,如抗氧化、抗炎、抗肿瘤、抗菌、解热、镇痛等等。
抗氧化活性自由基是引起多种疾病的主要原因之一,如癌症、心脏病和中风。
苦参所含的化合物具有非常强的抗氧化活性,可以中和自由基,预防这些疾病的发生。
研究表明,苦参素可以通过抗氧化作用减轻脐静脉缺血导致的胎儿脑损伤。
抗炎活性苦参所含的芦丁和苦参素具有很好的抗炎活性,可以减轻炎症反应。
研究表明,这些天然化合物对慢性阻塞性肺疾病、类风湿性关节炎和骨质疏松等炎症性疾病有一定的治疗作用。
抗肿瘤活性苦参所含的异黄酮具有非常强的抗肿瘤活性。
它们可以通过对肿瘤细胞的凋亡、细胞周期的阻碍、细胞迁移的抑制等多种方式抑制肿瘤生长。
研究表明,苦参素对人类乳腺癌细胞具有抑制作用。
抗菌活性苦参所含的化合物对多种细菌、真菌、病毒和原虫具有一定的抗菌作用。
研究表明,苦参素可以通过抑制肺炎链球菌的DNA聚合酶和改变其细胞膜来达到抗菌的效果。
其他活性苦参还具有一系列其他的药理活性,如解热、镇痛、抑制纤溶酶等作用。
研究表明,苦参素可以减轻高渗脑病和改善骨质疏松症的症状。
临床应用目前,苦参药理学研究的的新进展已经被应用到了多个领域,如治疗癌症、心脑血管疾病、皮肤病和风湿病等。
例如,在乳腺癌细胞治疗方面,苦参素可以增强阿霉素和多柔比星的抗癌效果;在心血管疾病治疗方面,苦参素可以改善急性冠状动脉综合征患者的预后。
总结综上所述,苦参具有多种生物活性成分,包括抗氧化、抗炎、抗肿瘤、抗菌、解热、镇痛等作用。
目前,它已经成为了传统中药利用的重要来源之一,并且在临床应用中表现出很好的应用前景。
苦豆子生物碱的研究进展

苦豆子生物碱的研究进展发表时间:2014-01-14T11:36:51.670Z 来源:《医药前沿》2013年11月第33期供稿作者:韩玉刚张浩[导读] 此外,苦参碱还试用于治疗病毒性肝炎、病毒性心肌炎。
韩玉刚张浩(解放军第206医院临床药学科吉林通化 134000)苦豆子(sophora alopecuroides L)是豆科槐属植物,别名苦豆根、苦甘草、西豆根、苦豆草、欧苦参等,我国西北省区及中亚细亚一带均有分布。
药用根、根茎、全草及种子,味苦性寒,有清热解毒、祛风燥热、止痛杀虫等作用。
近年来的研究发现,其还有抗癌、抗炎、抗菌的作用。
关于化学成分的研究的研究已有报道,为了更好的开发利用该资源,我们对其种子中生物碱成分的研究和药理作用的研究。
已有报道鉴定的生物碱有氧化苦参碱(oxymatrine OMT)、氧化槐果碱(oxysophocarpine OSC)、苦参碱(matrine MT)、槐果碱(sophocarpine SC)、槐定碱(sophoridine SRI)和槐胺碱(sophoramine SA)、莱曼碱(lehmannine LEH)、苦豆碱(aloperine ALC)。
现将近几年苦豆子类生物碱在抗炎方面的资料进行综述如下。
杨志伟等发现苦参总碱、苦豆总碱具有明显而独特的抗柯萨基B3组病毒(CVB3)的作用,通过对(CVB3)与各个药物在37℃作用2小时,然后测定病毒的TCID50。
结果提示苦参总碱和苦豆总碱能有效的抑制CVB3繁殖,两总碱主要效应可能是直接灭活游离病毒以及进入细胞内发挥抗病毒作用。
而且具有免疫调节功能。
此外,苦参碱还试用于治疗病毒性肝炎、病毒性心肌炎。
李凡等的研究发现苦豆碱对多种致炎剂所引起的急性炎症和Ⅲ,Ⅳ型变态反应有显著的抑制作用。
从免疫的角度对其进行研究。
苦豆碱有抑制巨噬细胞产生包细胞介毒1(IL-2)的作用(p<0.01),并能直接抑制小鼠脾细胞增殖反应,同时能抑制脾细胞对豆蛋白A(CorA)诱导的T细胞增殖反应(p<0.01),对多种致炎剂诱发的动物炎症有拮抗作用。
苦参中生物碱的提取及纯化工艺研究进展

苦参中生物碱的提取及纯化工艺研究进展苦参(Sophora flavescens Aiton)是一种常见的中药材,广泛应用于传统药物和中成药中。
苦参中的生物碱是其主要活性成分,具有抗菌、抗炎、抗肿瘤等药理作用。
因此,提取和纯化苦参中的生物碱具有重要的研究价值和应用前景。
本文将综述苦参中生物碱的提取和纯化工艺研究进展。
苦参中主要含有多种生物碱,如苦参碱、苦参素、大黄素等。
目前,常用的提取方法主要包括水煎膏剂提取法、溶剂提取法和微波辅助提取法等。
水煎膏剂提取法是一种常见的传统提取方法,主要通过将苦参粉末与水煎煮,然后浓缩、过滤和析出等步骤获得苦参提取物。
水煎膏剂提取法操作简单、成本低廉,但其提取效果有限,且存在易受环境条件影响、提取物稳定性差等缺点。
溶剂提取法是一种常规的苦参提取方法,常用的溶剂包括乙醇、甲醇、乙酸乙酯等。
该方法可以显著提高提取效果,但同时也会带来一些问题,如溶剂残留、环境污染等。
因此,需要对溶剂提取法进行优化和改进,减少对环境的影响。
微波辅助提取法是近年来发展起来的一种新型提取方法,其主要原理是利用微波的加热作用加速提取过程。
微波辅助提取法具有提取速度快、提取效果好的优点,已经在苦参提取中得到了广泛应用。
然而,目前关于苦参微波辅助提取法的研究仍较少,有待进一步深入研究。
苦参中生物碱的纯化工艺主要包括溶剂分配法、硅胶柱层析法、高效液相色谱法等。
其中,溶剂分配法是一种常用的纯化方法,通过溶剂的不同极性和沸点差异,实现苦参中生物碱的纯化。
硅胶柱层析法是一种较为经典的纯化方法,通过利用硅胶的吸附和解吸作用,将苦参中生物碱与其他杂质分离。
高效液相色谱法是一种高效、快速的纯化方法,已经得到了广泛应用。
值得注意的是,纯化工艺的选择需要根据苦参中生物碱的性质和目标纯度的要求来确定。
总的来说,针对苦参中生物碱的提取和纯化工艺,目前已有多种方法和技术可供选择。
然而,仍然存在一些问题需要进一步研究和改进,如提取效果和纯化效果的提高、环境友好性等。
苦参生物碱抗肿瘤机理研究进展

苦参生物碱抗肿瘤机理研究进展前言随着社会的进步和技术的发展,人们对于健康的重视程度也越来越高。
其中,癌症成为了最受关注的疾病之一。
为了寻找抗癌的有效方法,科学家们进行了大量的研究,其中,苦参生物碱抗肿瘤机理研究备受关注。
苦参生物碱概述苦参生物碱是一种在苦参中广泛存在的生物活性成分,它可以通过提取和分离得到。
苦参生物碱具有多种生物活性,包括抗炎、抗氧化、抗肿瘤等作用。
其中,其抗肿瘤作用被广泛关注。
苦参生物碱抗肿瘤机理研究苦参生物碱的抗肿瘤机理研究已经经历了很长时间。
研究者通过多种途径探讨了苦参生物碱的抗肿瘤机制。
抑制肿瘤细胞增殖苦参生物碱可以通过抑制肿瘤细胞增殖来发挥其抗癌作用。
研究发现,苦参生物碱可以抑制多种癌细胞的增殖,并且对于不同类型的肿瘤细胞具有不同的抑制效果。
促进肿瘤细胞凋亡苦参生物碱可以通过促进肿瘤细胞凋亡来发挥其抗癌作用。
研究发现,苦参生物碱可以促进肿瘤细胞凋亡和程序性死亡,从而抑制肿瘤的生长和扩散。
抑制肿瘤血管生成苦参生物碱可以通过抑制肿瘤血管生成来发挥其抗癌作用。
研究发现,苦参生物碱可以抑制肿瘤血管生成,并且对于不同类型的肿瘤细胞具有不同的抑制效果。
其他机制除了上述机制外,苦参生物碱的抗肿瘤作用还与其他机制有关。
例如,苦参生物碱可以改变肿瘤细胞的生长环境、干扰细胞的信号传导、调节肿瘤细胞的代谢等。
发展前景目前,苦参生物碱的抗肿瘤作用已经获得了广泛的关注和应用。
随着研究的不断深入,其研究前景也变得越来越广阔。
将来,苦参生物碱或许可以成为一种新型的抗癌药物,在临床上得到更广泛的应用。
结论苦参生物碱作为一种抗肿瘤活性成分,其抗癌作用已经得到了广泛的研究。
通过抑制肿瘤细胞增殖、促进肿瘤细胞凋亡、抑制肿瘤血管生成等多种机制发挥其抗癌作用。
苦参生物碱的应用前景也非常广阔,未来或许可以成为一种新型的抗癌药物,为人类健康做出更大的贡献。
苦参和山豆根黄酮类成分及其生物活性的比较研究

苦参和山豆根黄酮类成分及其生物活性的比较研究苦参和山豆根均为常用的清热解毒中药,苦参为豆科槐属植物苦参Sophora flavescens的根,山豆根为同属越南槐S. tonkinensis的根及根茎。
两种药材药用部位相近,化学成分相似,都含有喹喏里西啶类生物碱、异戊烯基类黄酮和齐墩果烯型三萜等成分,但临床应用却明显不同:山豆根制剂多内服,治疗急慢性咽炎等;苦参制剂多外用,治疗皮肤病和妇科疾病。
本课题组曾对苦参和山豆根的生物碱及黄酮部位进行指纹图谱研究,发现两种药材生物碱部位聚类图互相交错,无法区分;而黄酮部位图谱却差异明显,各自归为一类。
因此,系统研究两种药材的黄酮成分及其生物活性,可望明确苦参山豆根具有不同药理作用的活性物质基础,为进一步研究开发找到新的方向。
本文采用天然药化、分析化学等手段对苦参和山豆根中黄酮类成分进行了系统分离,并对分离得到的黄酮成分进行了细胞毒、抗补体和抗菌等多方面生物活性测试;采用LC/MS对苦参山豆根中黄酮成分进行了定性分析,并测定了其中多个活性黄酮的含量;另外,还考察了苦参山豆根黄酮类成分在人工胃液和人工肠液中的稳定性,主要研究结果如下:1.苦参和山豆根黄酮类成分研究1.1苦参乙酸乙酯部位黄酮成分研究:采用柱色谱和制备薄层色谱等方法从苦参乙醇提取物的乙酸乙酯萃取部位分离鉴定了29个化合物,其中20个为黄酮成分,它们分别是:光果甘草宁(SF-1)、Sophoraflavanone B(SF-2)、异腐醇(SF-3)、Sophoraflavanone G(SF-4)、苦参酮(SF-5)、Leachianone A(SF-6)、Kushenol T(SF-7).三叶豆紫檀苷(SF-8)、高丽槐素(SF-9)、大豆素(SF-10)、金雀异黄素(SF-11)、芒柄花素(SF-12)、毛蕊异黄酮(SF-13)、野靛黄素(SF-14)、Pseudoindorin(SF-15)、黄腐醇(SF-16)、7,9,2’,4’-四羟基-8-异戊烯基-5-甲氧基查耳酮(SF-17)、苦参啶(SF-18)、降脱水淫羊藿素(SF-19)和7,4’-二羟基黄酮(SF-20)。
苦参的化学成分及药理的研究进展
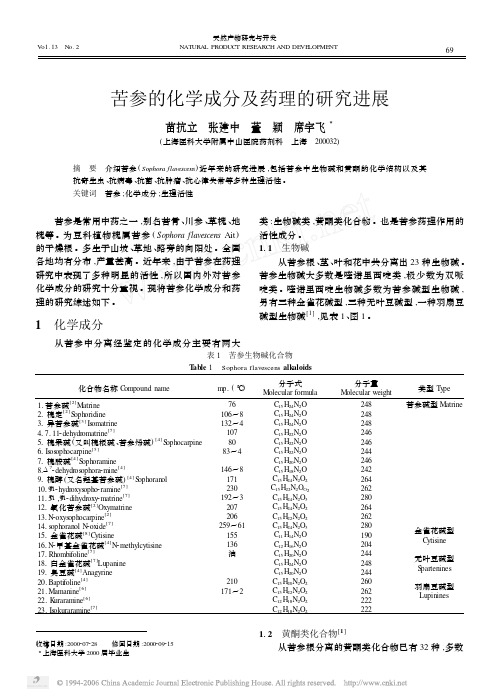
天然产物研究与开发 V o1.13 N o.2NAT URA L PRODUCT RESE ARCH AND DE VE LOPME NT 苦参的化学成分及药理的研究进展苗抗立 张建中 董 颖 席宇飞3(上海医科大学附属中山医院药剂科 上海 200032)摘 要 介绍苦参(Sophora flavescens)近年来的研究进展,包括苦参中生物碱和黄酮的化学结构以及其抗寄生虫、抗病毒、抗菌、抗肿瘤、抗心律失常等多种生理活性。
关键词 苦参;化学成分;生理活性 苦参是常用中药之一,别名苦骨、川参、草槐、地槐等。
为豆科植物槐属苦参(Sophora flavescens Ait)的干燥根。
多生于山坡、草地、路旁的向阳处。
全国各地均有分布,产量甚高。
近年来,由于苦参在药理研究中表现了多种明显的活性,所以国内外对苦参化学成分的研究十分重视。
现将苦参化学成分和药理的研究综述如下。
1 化学成分从苦参中分离经鉴定的化学成分主要有两大类:生物碱类,黄酮类化合物。
也是苦参药理作用的活性成分。
111 生物碱从苦参根、茎、叶和花中共分离出23种生物碱。
苦参生物碱大多数是喹诺里西啶类,极少数为双哌啶类。
喹诺里西啶生物碱多数为苦参碱型生物碱,另有三种金雀花碱型,三种无叶豆碱型,一种羽扇豆碱型生物碱[1],见表1、图1。
表1 苦参生物碱化合物T able1 Sophora flavescens alk aloids化合物名称C ompound name mp.(℃)分子式M olecular formula分子量M olecular weight类型T ype1.苦参碱[2]Matrine76C15H24N2O248苦参碱型Matrine 21槐定[2]S ophoridine106~8C15H24N2O24831异苦参碱[3]Is omatrine132~4C15H24N2O248417.112dehydromatrine[7]107C15H22N2O24651槐果碱(又叫槐根碱、苦参烯碱)[4]S ophocarpine80C15H22N2O24661Is os ophocarpine[5]83~4C15H22N2O24471槐胺碱[4]S ophoramine C15H20N2O24681Δ72dehydros ophora2mine[4]146~8C15H18N2O24291槐醇(又名羟基苦参碱)[4]S ophoranol171C15H24N2O22641019α2hydroxys opho2ramine[7]230C15H22N2O O22621115α,9α2dihydroxy2matrine[7]192~3C15H24N2O3280121氧化苦参碱[2]Oxymatrine207C15H24N2O2264131N2oxys ophocarpine[2]206C15H22N2O2262141s ophoranol N2oxide[7]259~61C15H24N2O3280 151金雀花碱[8]Cytisine155C11H14N2O190金雀花碱型Cytisine161N2甲基金雀花碱[4]N2methylcytisine136C12H16N2O204171Rhombifoline[7]油C15H20N2O244 181白金雀花碱[7]Lupanine C15H24N2O248无叶豆碱型S partenines191臭豆碱[4]Anagyrine C15H20N2O24420.Baptifoline[4]210C15H20N2O226021.Mamanine[6]171~2C15H22N2O2262羽扇豆碱型Lupinines22.K uraramine[6]C12H18N2O222223.Is okuraramine[7]C12H18N2O2222收稿日期:2000207228 修回日期:2000209215 3上海医科大学2000届毕业生112 黄酮类化合物[1]从苦参根分离的黄酮类化合物已有32种,多数96图1 苦参生物碱结构Fig.1 The structure of Sophra flavescens alk aloids为二氢黄酮和二氢黄酮醇类,少数为黄酮类、黄酮醇类、异黄酮类、查耳酮类和双环系黄酮类,其中仅有kushenol J 、trifolirhizin 和kushenol O 三种化合物为甙,见表2、图2。
苦参现代研究进展

苦参现代研究进展苦参(Sophora flavescens)是传统中药材中常用的药用植物之一,也是中医常用的清热解毒、活血祛瘀药材。
它属于豆科植物,主要分布于中国、朝鲜和日本等地。
近年来,由于苦参中含有丰富的生物活性成分,其药理学和医学研究逐渐得到了广泛的关注和重视。
以下是苦参现代研究的一些重要进展:苦参中主要活性成分的研究:苦参中主要含有苦参碱、苦参酮、咯哩酮类、黄酮类、黄降类以及多种植物生物碱等活性成分。
这些成分具有广泛的生物活性,如抗炎、抗菌、抗氧化、抗肿瘤、抗病毒等作用。
目前有关苦参中主要活性成分的提取和分离研究已经取得了一系列进展,为进一步研究苦参的药理学作用提供了重要的基础。
苦参的抗肿瘤作用研究:苦参中的活性成分具有很好的抗肿瘤作用。
研究发现,苦参碱能够通过调节肿瘤细胞凋亡、细胞周期、抑制肿瘤血管生成等多种机制对肿瘤生长产生抑制作用。
此外,苦参中的苦参酮也被证明具有抗肿瘤活性。
因此,苦参作为一种潜在的抗肿瘤药物吸引了广泛的研究兴趣。
苦参的抗炎和免疫调节作用研究:苦参中的多种活性成分具有显著的抗炎和免疫调节作用。
研究发现,苦参酮可以通过抑制炎症介质的释放,减轻炎症反应。
此外,苦参中的黄酮类化合物具有抗氧化和抗炎作用,可以调节免疫系统功能,提高机体的免疫力。
因此,苦参被认为是一种具有抗炎和免疫调节作用的潜在药物。
苦参对心血管疾病和代谢性疾病的影响研究:近年来的研究表明,苦参具有一定的降血脂、降血压和抗动脉粥样硬化作用,能够改善心血管疾病患者的病情。
此外,苦参对于糖尿病、肝脏疾病等代谢性疾病也具有一定的治疗效果。
这些研究结果进一步验证了苦参具有多种药理学功效的潜力。
苦参的副作用和毒性研究:虽然苦参具有多种药理学功效,但其研究过程中也发现了一些不良反应和毒性。
苦参中的一些活性成分具有一定的毒性,例如苦参碱对中枢神经系统有一定的抑制作用。
因此,在临床应用苦参时需要谨慎选择剂量,并结合患者的具体情况进行合理应用。
苦参现代研究进展

苦参现代研究进展(综述)苦参为豆科植物苦参( Sophora flavescens Ait . ) 的干燥根。
苦参味苦、性寒。
归心、肝、胃、大肠、膀胱经。
随着分离技术的发展,苦参中的成分在被慢慢的发现中,很多已经明确的有效成分在被不断的研究,已经确定的药理作用也有很多。
随着人们的对身体健康的关注度提高、养生保健意识增强,毒副作用小,药效明显的中药越来越受人们的青睐,苦参就是其中一种现在就以现代苦参研究中的化学成分、药理作用、有效成分的提取及质量控制做一综述。
1 化学成分苦参中化学成分主要有生物碱类、黄酮类、三萜皂苷类以及醌类化合物。
除外苦参中还含有多种氨基酸、脂肪酸等成分,但是这些都无明显的药理作用故而研究较少。
1.1生物碱类苦参碱、氧化苦参碱、槐果碱、槐胺碱、槐定碱、N-氧化槐根碱、槐醇碱、N-甲基野定碱等,其中以前五种为目前认为的具有主要药理活性的生物碱[1]。
苦参中的生物碱类为最主要的成分,是苦参的重要有效成分,有多种药理作用。
《中国药典》(2010版)规定,苦参干燥品中苦参碱、氧化苦参碱的总含量不得低于1%,可见这两种成分在苦参中的重要性。
1.2黄酮类化合物包括:二氢黄酮、黄酮醇、二氢黄酮醇、苦参新醇、苦参查耳酮、苦参醇等。
1.3三萜皂苷类化合物包括:苦参皂苷(Ⅰ、Ⅱ、Ⅲ、Ⅳ)、大豆皂苷等。
1.4醌类化合物包括:苦参醌A等。
2 药理作用苦参作为一种传统的中药具有清热解毒、燥湿利尿、祛风杀虫等作用。
现代研究表明苦参具有杀菌消毒、抗寄生虫、抗心律失常、抗心肌缺氧、抗肿瘤等作用。
苦参碱、氧化苦参碱为诸多药理作用的活性成分。
2.1杀菌消毒张顺合等[2]研究发现苦参对细菌繁殖体、病毒、真菌(霉菌)具有消毒作用。
苦参提取物的杀菌消毒作用对皮肤无刺激性,致敏性低,符合现代的消毒杀菌理念。
2.2抗寄生虫现在研究表明苦参对多种寄生虫有抵抗作用。
殷袜隆等[3]经过试验发现苦参碱能抑制棘球绦虫的正常代谢,从而起到抗棘球绦虫的作用。
苦参的药理研究进展

苦参的药理研究进展中药苦参(Sophora flavescens Ait)具有清热燥湿、杀虫、利尿等功效。
治热毒血痢、肠风带血、赤白带下、黄疸尿闭、疳积、皮肤瘙痒、阴疮湿痒、烫伤、疥廯麻风;外治滴虫性阴道炎[1]。
其主要成分苦参素(Kushenin)是一类含有苦参次碱15酮基本结构的化合物,其中氧化苦参碱(Oxymatrine)含量在98%以上;还含有苦参醇(Kurarinol)、苦参丁醇(Kuraridinol)等多种黄酮类成分;另含有氨基酸类、挥发油类、糖类、有机酸类、内酯类等成分。
现代药理研究结果显示,苦参素具有抗炎、免疫抑制、抗病毒、抗生育、对心功能影响、中枢抑制等药理作用。
现将药理作用简要综述如下。
1 对肝病的作用1.1 抗肝炎病毒作用:研究证实,苦参素具有明显、明确的抗乙型肝炎病毒(HBV)和抗肝纤维化的双重作用。
陈亚军[2]用其治疗慢性乙肝患者40例,并与对照组40例疗效进行比较,结果HBeAg转阴率为35%,HBV-DNA转阴率为38%,明显优于对照组(P<0.05),表明苦参素具有良好的抗病毒作用。
其具体表现在:(1)可抑制含HBV基因转染的细胞分泌HBsAg和HBeAg;(2)可抑制HBV转基因小鼠抗原的表达[3];(3)显著降低鸭HBV(DHBV)感染鸭血清DHBV-DNA水平。
1.2 抗肝损伤作用:苦参素对各种肝损伤有一定的保护作用,可用于肝功能损伤较重并伴有黄疸的患者[4]。
目前认为,乙型肝炎的肝损伤并非因HBV在肝细胞内繁殖引起,而是通过宿主的免疫应答反应引起。
苦参素不仅抑制HBV的复制,还对感染后免疫系统具有双向调节作用,从而减轻肝损伤程度。
此外,苦参素可阻断肝细胞的异常凋亡,对实验性小鼠肝衰竭具有保护作用。
1.3 抗肝纤维化作用:肝纤维化是慢性肝病发展为肝硬化的中间环节和共同病理过程,因此延缓或阻止肝纤维化的形成,对防治肝硬化具有重要意义。
有研究表明[5],应用苦参素(实验组)的肝组织增生程度明显低于肝纤维模型组,其胶原含量及胶原的mRNA表达均低于免疫诱导型肝纤维化模型组大鼠,表明其有减轻肝脏炎症活动度、抑制肝内胶原合成及抗肝纤维化作用。
苦参的化学成分和药理作用研究进展

苦参的化学成分和药理作用研究进展标签:苦参;化学成分;药理作用;研究进展1化学成分1.1生物碱类苦参生物碱大多数是喹诺里西啶类,极少数为双哌啶类。
已从苦参中分离出生物碱41个,按其骨架类型分为以下几种:苦参碱型30个,金雀花碱型3个,臭豆碱型4个,羽扇豆碱型1个,双哌啶型2个,以及l,4二氮杂茚满型1个。
主要包括苦参碱、氧化苦参碱、羟基苦参碱、槐定碱、异槐定碱、异苦参碱、别苦参碱、槐果碱、槐胺碱、槐醇、氧化槐醇、异槐果碱、金雀花碱、羽扇豆碱、臭豆碱、黄叶槐碱、苦参胺碱、异苦参胺碱等[1]。
1.2黄酮类到目前为止,苦参中黄酮类化合物共分离得到108个黄酮类化合物,其中大部分化合物的A环上存在有异戊烯基侧链。
多数为二氢黄酮和二氢黄酮醇类,少数为黄酮类、黄酮醇类、异黄酮类、查耳酮类和双环系黄酮类。
按黄酮化合物的骨架来分,主要类型有:二氢黄酮类31个,黄酮醇类12个,二氢黄酮醇类12个,查耳酮类5个,异黄酮类21个,二氢异黄酮类3个,高异黄酮类2个,紫檀素类12个,二聚黄酮类2个和其他黄酮类化合物7个[2]。
1.3脂肪酸类和挥发油类脂肪酸类成分有乙酸甲酯、十二烷酸甲酯、芥子酸十六酯等[3]。
挥发油类有己醛、正壬酸、1-辛烯-5-醇等47个成分,为苦参特殊香气提供了物质参考[4]。
1.4其他类化合物苦参中还含有氨基酸类、糖类、三萜及三萜皂苷类、木脂素类、酚酸类等化学成分[5~7]。
2药理作用2.1对心脏的作用2.1.1抗心律失常韦祎等[8]以乌头碱为参照药物,采用膜片钳全细胞记录技术记录钠离子通道电流(INa),观察不同浓度苦参碱对豚鼠乳头肌细胞钠离子通道电流影响的实验研究表明苦参碱能抑制INa电流,呈浓度依赖性,浓度较高时抑制INa电流作用减弱,表现为双向调节的药理作用。
苦参碱抗心律失常作用具有作用温和、持续时间长的优点。
苦参对心脏具有负性频率负性自律性及负性传导作用,是一种非特异性“奎尼丁样”作用,推测通过影响心肌细胞膜钾钠离子的传递系统,延长其绝对不应期,降低其应激性,从而抑制异位起博点,发挥抗心律失常作用。
苦参生物碱药理作用研究进展

苦参生物碱药理作用研究进展【关键词】苦参苦参(Sophora flavescens Ait)为豆科植物槐属苦参的根,为常用中药,具有清热燥湿、祛风杀虫之功效。
现代药理研究表明,苦参生物碱具有抗肿瘤、抗炎、抗心律失常等方面的活性,本文通过计算机网络检索方法,查阅了国内近十年来有关其所含生物碱药理活性方面的研究报道,作一综述,为进一步深层次开发和利用苦参这一传统中药提供理论依据。
1 对心血管系统的作用1.1 对心脏的作用阮长武等[1]实验设对照组、内皮素组(ET组)、苦参碱组(MA组:ET+MA)共3组。
每组设4只平行瓶,重复4次实验。
细胞培养第5天加ET、MA,浓度分别为1.0×10-6 mol/L、3.0×10-6 mol/L,作用24 h,采用测定心肌细胞直径、数目、3H-亮氨酸掺入率及分子杂交的方法,观察内皮素对培养大鼠心肌细胞肥大及肌球蛋白基因表达的影响,并用苦参碱治疗。
结果内皮素显著促进心肌细胞直径增大(P<0.05)及3H-亮氨酸掺入率的增加(P<0.01),并诱导心肌细胞β-肌球蛋白基因表达,α-肌球蛋白基因表达相应减少,苦参碱显著抑制内皮素致心肌细胞肌球蛋白基因同功蛋白病理性转换作用。
金英等[2]选用封闭群大鼠50只,雄性,体重(266±31)g,随机分为5组,通过测定清醒大鼠心肌缺血及再灌注损伤不同时期心电图、酶活性改变及缺血区面积,观察到槐胺碱13.3 mg/kg和15 mg/kg能显著缩小心肌梗塞范围。
1.2 抗心律失常作用李进禧等[3]将SD大鼠乳鼠12只消毒后,取出心室肌,用冰Hanks 液,剪成约1 mm3小块,加入无菌胰蛋白酶溶液,放置于磁力搅拌器上,消化10 min,用DMEM培养基加小牛血清(小牛血清含量为10%)终止胰蛋白酶的消化,用DMEM培养基加小牛血清调整心肌细胞数为5×105/mL,将已经消毒好的盖玻片放于6孔培养板中,把心肌细胞细胞悬液5 mL滴入培养板孔中,使之盖满盖玻片,放置于培养箱中(5%CO2、37 ℃)培养24 h,随机分为10组,负载Fura2/AM,在不同的条件下(培养液中分别加维拉帕米、氯化钾、不同剂量的苦参碱等),应用图象分析系统,测定心肌细胞内钙荧光强度的变化,间接测定苦参碱对钙内流的影响。
苦参碱类生物碱抗病毒活性实验研究进展

苦参碱类生物碱抗病毒活性实验研究进展苦参碱类生物碱是以苦参碱为代表的化学结构相似的一类生物碱。
这一类生物碱还包括氧化苦参碱、槐果碱、槐定碱、槐醇碱、槐胺碱、氧化槐果碱、莱曼宁等,他们广泛存在于豆科植物苦参 ( S.flavescens Ait ),苦豆子(S. alopecuroides L)及广豆根(S. subprostrata Chun et T.Chen)中,是这几种常用中草药的主要有效成分【1】。
由于这几种中草药的主体成分相似,所以,他们在药效上也很接近,都具有清热、燥湿、杀虫、利尿等功效,其作用广泛,效果明显【2】。
1 对 HepG 2.2.15 细胞株的抗病毒作用HepG 2.2.15 细胞株[表达乙型肝炎病毒(HBV)的人肝细胞]为体外抗HBV 药物的筛选细胞模型。
该细胞株是1976 年Sells 等通过共转染的方法将克隆的HBV DNA及抗G418 抗体质粒导入人肝癌细胞株 HepG2 之中建立成功的。
这种细胞株导入了HBV DNA可表达全部病毒标志,能长期稳定地向培养上清液中分泌HBsAg(乙肝表面抗原)、 HBeAg(乙肝e 抗原)和完整的Dane颗粒(乙型肝炎病毒大球形颗粒),并能产生大量的病毒复制中间体。
同时转染细胞具有新霉毒抗性的选择表性遗传性,能使其宿主在含有新霉毒的类似物G-418 的选择培养基中得以生长,而转染不成功的细胞由于不具备新霉毒抗性的筛选标志而被淘汰。
该细胞株的建立为研究乙肝病毒的结构和功能、基因表达和调控以及体外抗HBV 药物的初筛提供了有效的模型,HepG2.2.15 细胞株已经成为国内外通用的细胞模型,广泛用于体外抗HBV 药物的筛选。
HBsAg 和HBeAg 是HepG 2.2.15 细胞分泌到培养上清液中的可溶性蛋白质,能够间接地反映病毒复制状况。
观察HepG 2.2.15 细胞分泌HBV 抗原的变化,可以判断药物的疗效。
但是应用HepG2.2.15 细胞模型研究抗HBV药物也有局限性,虽然它再现了HBV在肝细胞的复制和表达,但脱离了机体免疫系统对HBV 产生影响的环境。
苦参药理学研究新进展

苦参药理学研究新进展苦参是一种常见的传统中药材,来自于苦参科草本植物,其种子可用于制备中药苦参等。
已有许多研究显示,苦参具有抗炎、解毒、抗氧化、抗肿瘤等生物学活性,广泛应用于肿瘤、炎症和感染等疾病的治疗。
本文将介绍苦参在这些领域的新研究进展。
抗炎作用苦参具有显著的抗炎作用,近年来越来越多的研究发现,苦参中一些化合物能够通过调节免疫系统和炎症反应来发挥其抗炎作用。
其中青酸乙酯(MAT)是一种由苦参种子提取的化合物,已被证明具有明显的抗炎活性。
研究表明,MAT可抑制亚硝酸盐诱导的人多形核白细胞(PMN)和巨噬细胞的氧化突发反应(ROS)和超氧化物歧化酶(SOD)活性,有效减轻炎症反应。
此外,MAT还可以通过抑制NF-κB 和MAPK 信号通路来抑制炎症反应。
解毒作用苦参有明显的解毒作用,它能够减少化学物质、生物毒素和放射性物质等毒素对人体的危害。
苦参中的苦参碱是其解毒作用的关键物质。
苦参碱能够通过丝裂原活化蛋白激酶(MAPK)信号通路来诱导巨噬细胞内的草酰乙酰辅酶 A 合酶(ACSL)的表达,从而调节NF-κB 和p38 MAPK 信号通路,从而减少毒素对细胞的损伤和死亡。
抗氧化作用抗氧化作用是苦参另一个重要的生物学活性,它可以通过清除自由基、减少氧化应激和维持内环境稳定性等多种途径减少氧化性损伤。
研究发现苦参种子中的化合物麻黄噻唑啉、绿原酸酯和芸香甙等均具有良好的抗氧化作用。
最近的研究表明,麻黄噻唑啉可以通过激活AMPK信号通路来诱导脂肪酸氧化和线粒体能量代谢,从而增加线粒体数量和活力,并减少细胞脂质和蛋白质的氧化,表明其具有很强的抗氧化作用。
抗肿瘤作用苦参具有广泛的抗肿瘤活性,研究表明,苦参中的苦参酮、青金酚、白色素和咖啡酸等成分具有抗肿瘤作用。
苦参中的化合物能够通过抑制细胞生长、诱导细胞凋亡、阻止细胞周期进展等多种途径来发挥抗肿瘤作用。
其中,苦参酮具有很强的抗癌活性,可以通过抑制血管生成和调节肿瘤微环境来防止肿瘤生长和扩散。
苦参、山豆根植物中主要生物碱药学研究进展

3 C n ro rgE au tni n u Poic ,e i A h i 30 2 C ia . et r u vlai A h i rv eHf , n u ef D o n n e 2 0 2 , hn )
A src: n x at u f a o n e r ia o e os f a lao si Sf v cn n . n i nimei l l th v b tatMayet c dp r ctnaddt mn tnm t d i a li . ae e adS t k s d a pa s ae r e i i i e i h om n k d n l ss o n s e c n
b e u e n s mma ie . h e e a tat l sp b ih d i e e ty a swe e c l c e rz d T er l v n ri e u l e n rc n e r r ol td,a ay e c s e n z d,a n e n o c u e . h xsi g l e a l  ̄a g d a d c n l d d T e e it i r — n t t r e mo t u f ain o tlS p o a ak od ,h w v r h e a a in o n me l ao d r e s T e d t r i ain o — u e a sl p r i t f oa o h r a i s o e e ,t e s p t f mo o r ak li s a e l s . h e e n t fms r y i c o t l l r o m o
o l i s gfr . ae e n .ok nipat. f i c ui f vs n a dS tni s l s cn a l n o Sl cs e n s n
苦参及山豆根主要生物碱镇痛抗炎作用研究

苦参及山豆根主要生物碱镇痛抗炎作用研究
钱利武;戴五好;周国勤;王丽丽;汪海孙
【期刊名称】《中成药》
【年(卷),期】2012(034)008
【摘要】目的探讨苦参及山豆根中苦参碱、氧化苦参碱、槐果碱、氧化槐果碱、槐定碱、鹰爪豆碱、N-甲基金雀花碱、野靛碱等主要生物碱的镇痛及抗炎活性.方法采用二甲苯致小鼠耳廓肿胀及小鼠腹腔毛细血管通透性实验、醋酸致小鼠扭体反应等实验动物模型,研究化合物抗炎镇痛的活性.结果苦参碱、槐定碱镇痛作用相对较强;氧化苦参碱、槐果碱、鹰爪豆碱对耳肿胀抑制明显;苦参碱、槐杲碱、槐定碱能明显抑制小鼠腹腔毛细血管通透性.结论大部分苦参碱型生物碱具有一定程度的镇痛抗炎活性,而金雀花型及鹰爪豆型生物碱活性较弱,同时毒性较强.
【总页数】4页(P1593-1596)
【作者】钱利武;戴五好;周国勤;王丽丽;汪海孙
【作者单位】安徽省药物研究所,安徽合肥230022
【正文语种】中文
【中图分类】R285.5
【相关文献】
1.离子交换树脂分离纯化山豆根中苦参碱和氧化苦参碱的实验研究 [J], 李克;王曙东;吴龙琴;汤淏
2.苦参、山豆根植物中主要生物碱药学研究进展 [J], 戴五好;钱利武;杨士友;周国
勤
3.山豆根和苦参生物碱类成分UPLC/Q-TOF MSE比较研究 [J], 曾祖平;郭智;彭冰;沈胜楠;夏方博;刘亚旻;潘瑞乐
4.牛心朴子生物碱的镇痛抗炎作用试验 [J], 张永康;何生虎;李勇
5.苦参生物碱成分的研究——Ⅱ、氧化苦参碱及其它生物碱成分的分离 [J], 白世泽;何继华;杨泽铨;饶尔昌
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
苦参、山豆根植物中主要生物碱药学研究进展戴五好;钱利武;杨士友;周国勤【摘要】该文综述了药用植物苦参、山豆根主要生物碱分离纯化及含量测定研究进展.对近年来国内外发表的相关文献进行收集、分析整理及归纳.现有文献多为苦参总碱的纯化,而涉及单体生物碱的分离较少;在含量测定方面多以苦参碱、氧化苦参碱等为质控指标,不尽合理.应加强对苦参、山豆根中生物碱的结构多样性、毒理及构效关系等研究,以扩大这类植物活性成分的开发利用,确保临床用药安全可靠有效.%Many extracted purification and determination methods of main alkaloids in S.flavescens and S. tonkinensis medical plants have been summarized. The relevant articles published in recent years were collected , analyzed , arranged and concluded. The existing literature are mostly purification of total Sophora alkaloids. however, the separation of monomer alkaloids are less. The determination of matrine , oxymatrine as quality control indicators is not reasonable in S.flavescens and S. tonkinensis plants. The structure diversity , toxicology and structure-activity relationship of those alkaloids should be strengthened in order to utilize resources and ensure safety and validity of clinical using forS.flavescens and S. tonkinensis plants.【期刊名称】《安徽医药》【年(卷),期】2011(015)009【总页数】4页(P1057-1060)【关键词】苦参;山豆根;生物碱【作者】戴五好;钱利武;杨士友;周国勤【作者单位】安徽中医学院,安徽,合肥,230031;安徽省药物研究所,安徽,合肥,230022;安徽省药品评审中心,安徽,合肥,230022;安徽省药物研究所,安徽,合肥,230022【正文语种】中文苦参为双子叶植物纲豆科槐属植物(S.flavescens Ait.)的干燥根[1]。
具有清热燥湿,杀虫,利尿等功效,分布范围广。
山豆根系双子叶植物纲豆科植物越南槐(S.tonkinensis Gapnep.)的干燥根及根茎[2]。
功效为清热解毒、消肿利咽。
苦参及山豆根均为我国常用中药,现代药物化学研究显示苦参、山豆根的主要药效活性成分为生物碱类化合物,本文就从其结构类型、提取分离、含量测定等方面作一综述。
自20世纪七八十年代以来,研究人员陆续从苦参的根、茎、花等不同部位分离出20多种以上的生物碱类成分。
苦参中生物碱主要有:苦参碱(Matrine)、氧化苦参碱(Oxymatrine)、槐果碱(Sophocarpine)、氧化槐果碱(Oxysophocarpine)、槐定碱(Sophoridine)、N-甲基金雀花碱(N-methy-cytisine)、赝靛叶碱(Baptifoline)、右旋别苦参碱(Allomatrine)、右旋异苦参碱(I-somatrine)、右旋槐花醇(Sophoranol)、左旋槐根碱(Sophocarpine)、左旋槐胺碱(Sophoramine)、左旋臭豆碱(Anagyrine)、右旋黄叶槐碱(mamanine)、allomatrine等。
从结构上看苦参生物碱中苦参碱、氧化苦参碱、槐果碱、槐定碱等大都为喹诺里西啶类,少数为双哌啶类[3,4]。
山豆根中主要生物碱类化合物有:苦参碱、氧花苦参碱、甲基金雀花碱、槐果碱、氧化槐果碱、金雀花碱(Cytisine)、臭豆碱(Anagyrine)、槐安(Sophovamine)及槐醇(Sophovauol)等。
综上所述,苦参、山豆根所含生物碱有以下几个类型:苦参碱型、金雀花碱型、无叶豆碱型、羽扇豆碱型[4,5]。
其中苦参碱和槐定碱互为异构体,氧化苦参碱是苦参碱的氧化物,主要结构类型及代表生物碱如图1所示。
从苦参类生物碱结构上看,其结构母核中均含有两个氮原子。
一个为酰胺氮,碱性弱,另一个为叔胺氮,呈碱性,因此苦参碱类化合物相当于一元碱。
苦参碱的溶解性较为特殊,既能溶于水,又能溶于氯仿、乙醚、乙醇等亲脂性溶剂。
相关苦参、山豆根药用植物中生物碱类成分的提取分离纯化的文献较多,大多以稀酸水渗漉,酸水提取液通过强酸性阳离子交换树脂提取生物碱。
雷湘等[6]采用乙醇浓度、用量、提取时间、次数等条件为因素,对苦参碱的提取工艺进行正交实验,用盐酸浓度、氨水的pH值、洗脱剂乙醇的浓度为因素,对纯化工艺进行正交实验,得出药材用60%的乙醇回流提取三次,每次6倍量的溶剂提取1.5 h,0.5%的稀盐酸处理提取物,氨水碱化,三倍柱体积的80%乙醇洗脱;敖道夫等[7]通过正交试验,优选出75%乙醇8倍量,提取1 h,为苦参总碱提取工艺;王英姿等[8]采用均匀实验设计,以苦参碱、氧化苦参碱、苦参总碱、高效液相色谱(HPLC)总面积、干浸膏为指标综合评判,得出苦参半仿生提取法工艺条件为:三煎用水的pH 值依次为2.20、7.46、8.98,三煎总计时间为4 h;杨光义等[9]也采用均匀设计法优选山豆根SBE法工艺条件,其条件为:三煎用水PH 依次为4.5、7.5、9.0,煎煮时间依次为 1.5、0.75、0.75;王欣、单玉等人[10,11]分别对苦参总碱的最佳提取、富集工艺进行了考察,得出最佳提取工艺是用0.2%盐酸、渗漉一次调中性,沉淀,过滤,滤液通过732型阳离子交换树脂柱,用5%氨水洗脱最佳富集工艺是上样溶液质量浓度为0.14 g·L-1,以1%Na2CO31 BV·h-1洗脱,收集17 BV;梁燕明等[12]在山豆根提取苦参碱实验中,采用传统提取方法和CO2超临界萃取提取,并用液相色谱检测含量,临界萃取方法萃取的苦参碱的含量高于传统提取方法;代龙[13]考察了不同洗脱剂对苦参碱、氧化苦参碱和总生物碱洗脱率的影响,得出3 mol·L-1氯化钠溶液效果最优,盐酸溶液次之,氨性乙醇溶液居中,氨水溶液最差,等。
近年来高速逆流色谱法(HSCCC)广泛应用于天然产物的分离纯化,但关于苦参生物碱类化合物分离报道较少。
最近有学者[14]应用新型的液液分配技术和高速逆流色谱法对苦参生物碱类成分的分离制备进行探讨;Ling JY等[15]采用氯仿∶甲醇∶2.3 ×10-2mol·L-1NaH2PO4(27.5∶20∶12.5)为分离体系,通过高速逆流色谱法分离到苦参碱、氧化槐果碱、氧化苦参碱3种生物碱,经HPLC测定纯度均在95%以上。
3.1 比色法比色法在苦参、山豆根药用植物中生物碱含量测定中有广泛应用。
李建伟等[16]将苦参的酸水提取液用氢氧化钠溶液调节至中性后,依次加pH=7.6缓冲溶液,溴代麝香草酚蓝指示液、氯仿混合振摇,静置分层,于413 nm波长处测定氯仿层吸收度,可用于苦参药材的质量控制;邵晶等[17]采用此法用苦参总生物碱的浓度50%乙醇溶液,用氧化苦参碱作为对照品,在pH=7.0时加入2.0 ml的溴麝香草酚蓝,在417 nm处测其最大吸光度,测得不同产地苦参药材中总生物碱含量差异较大,该条件下可准确地测定苦参药材中总生物碱的含量;在克痢灵颗粒的质量控制中,陈菲等[18]应用此法在415 nm处测定其吸光度,该法操作简便、灵敏度高、结果准确,可应用于克痢灵颗粒的质量控制。
3.2 薄层扫描法随着制板、点样、展开等操作设备及仪器性能的改进,薄层扫描法(TLCS)在灵敏度、精密度与准确度方面都有了很大提高。
钟丽梅等[19]采用薄层扫描法测定山豆根浸膏中苦参碱的含量;布日额等[20]采用薄层扫描法测定苦参中的苦参碱和氧化苦参碱的含量;潘莹等[21]采用双波长薄层扫描法测定广西四个不同地区的山豆根中氧化苦参碱的含量,为制定广西山豆根的质量控制方法提供了依据。
3.3 毛细管电泳法毛细管电泳(CE)是近年来发展最快的分析方法之一,在生物碱测定中越来越常用。
仝战旗等[22]采用毛细管电泳法,作为复方苦参结肠溶胶囊中氧化苦参碱的质量控制方法;在苦参药材及夜夜安洗液的质量控制中,王桂芳等[23]也建立一种用高效毛细管电泳同时测定苦参药材及其复方制剂夜夜安洗液中3种生物碱含量的方法。
3.4 高效液相色谱法高效液相色谱法(HPLC)能同时分离并测定多种化学成分,具有灵敏度高,稳定性好,高分辨率等优点,广泛应用于药物有效成分的含量测定。
目前采用HPLC方法研究山豆根、苦参药材及其有关制剂的质量控制的报道较多,现将相关文献综述如表1所示。
生物碱类化合物是一类生物来源广泛、结构类型多样、药理活性显著的天然产物,为国内外药物前体筛选的重点领域之一。
目前国内外对苦参及山豆根中生物碱研究较多,主要集中于总碱的提取工艺、含量测定及活性研究等方面,取得了一定的研究成果。
作为治疗咽喉及皮肤、妇科等疾病的传统中药,山豆根及苦参在我国的应用源远流长。
现代药理学研究表明,山豆根及苦参的生物碱类成分还具有抗病毒、抗肿瘤、抗炎、调节免疫、抗过敏等活性,为一类具有非常广阔应用前景的药物前体化合物。
尽管苦参碱类化合物在细胞及动物水平的实验中显示良好的活性,但在毒理学及化合物结构多样性等方面研究较少,需要在予以重视和完善。
目前生物催化与生物转化技术正在迅速向药物创制领域渗透,尤其在具复杂结构天然产物的减毒增效和结构修饰研究中有着显著的优势。
在今后可结合化学方法,对苦参碱类化合物进行结构改造,探讨苦参碱类化合物构效关系,这将有助于快速筛选出高效低毒的新药先导化合物,也是符合目前中国国情的新药创制模式。
【相关文献】[1]黄璐琦,王永炎.中药材质量标准研究[M].北京:人民卫生出版社,2006:299-302.[2]国家药典委员会.中国药典:一部[S].北京:中国医药科技出版社,2010:25.[3]张东方,信颖.中药现代分离技术[M].沈阳:辽宁大学出版社,2006:115.[4]郑虎占,董泽宏,佘靖.中药现代研究与应用第三卷[M].北京:学苑出版社,1998:2696 -7.[5]沈映君.中药药理学[M].北京:人民卫生出版社,2000:259.[6]雷湘,巩晓宇,王巍,等.纯化苦参碱的提取工艺研究及质量标准的建立[J].亚太传统医药,2009,5(4):13 -5.[7]敖道夫,巴达拉胡,布日额.正交实验法优选苦参总碱提取工艺[J].内蒙古民族大学学报:自然科学版,2009,24(1):76 -8.[8]王英姿,惠建国,张兆旺,等.用均匀设计优选苦参半仿生提取法工艺条件[J].天津中医药,2010,27(1):66-8.[9]杨光义,叶方,雷震,等.均匀设计法优选山豆根半仿生提取工艺[J].中国药师,2010,13(12):1765 -6.[10]王欣,于喜水.非注射用苦参总碱的最佳提取工艺[J].中医药学报,2009,37(4):58 -9. [11]单玉,胡北.苦参中总生物碱的富集工艺研究[J].辽宁中医杂志,2010,37(3):513 -4. [12]梁燕明,郭伟.山豆根中苦参碱不同提取方法的对比研究[J].化工技术与开发,2008,37(4):17 -9.[13]代龙.阳离子交换树脂法不同洗脱剂纯化苦参总碱的工艺研究[J].现代中药研究与实践,2009,23(3):45 -7.[14]王新宏,范广平,安睿.苦参生物碱的高速逆流色谱法制备研究——色谱参数和仪器参数的最佳化[J].中草药,2000,31(11):816-7.[15]Ling JY,Zhang GY,Cui ZJ,et al.Supercritical fluid extraction of quinolizidine alkaloids from Sophora flavescens Ait.and purification by high-speed counter-current chromatography[J].J Chromatogr A,2007,1145(1 -2):123 -7.[16]李建伟.酸性染料比色法测定苦参药材中总生物碱的含量[J].长治医学院学报,2007,21(5):331 -5.[17]邵晶,倪京满,郭玫,等.苦参药材中总生物碱含量的测定[J].安徽农业科学,2008,36(36):15950 -1.[18]陈菲,盛柳青.酸性染料比色法测定克痢灵颗粒中总生物碱含量[J].中国医药导报,2009(35):47-8.[19]钟丽梅,夏步云,邵燕虹.薄层扫描法测定山豆根浸膏中苦参碱含量[J].中国现代药物应用,2007(1):15-6.[20]布日额,其其格玛,东格尔道尔吉.薄层扫描法测定苦参中的苦参碱和氧化苦参碱的含量[J].中国民族医药杂志,2005,11(2):29-30.[21]潘莹,江海燕,王芸.广西山豆根药材的质量分析[J].时珍国医国药,2009,20(7):1653 -4.[22]仝战旗,高建义,陈丙跃.高效毛细管电泳法测定复方苦参结肠溶胶囊中氧化苦参碱[J].中草药,2010,41(5):725 -6.[23]王桂芳,张守尧,郭正国,等.高效毛细管电泳法测定苦参药材及其制剂夜夜安洗液中3种生物碱的含量[J].药物分析杂志,2000,20(5):331 -3.[24]黄颖,蔡乐,欧敏,等.HPLC法测定广西产山豆根氧化苦参碱的含量[J].中国中医药咨讯,2010,3(1):18.[25]袁祥慧,李绪伦.高效液相色谱法同时测定山豆根中苦参碱和氧化苦参碱含量[J].中国药业,2008,17(14):31 -2.[26]国家药典委员会.中国药典:一部[S].北京:中国医药科技出版社,2010:25-30.[27]丁佩兰.山豆根和苦参化学成分的比较研究[D].上海:复旦大学,2004.[28]国家药典委员会.中国药典:一部[S].北京:中国医药科技出版社,2010:188-9.[29]刘倩,刘永刚,郑玉胜,等.苦参药材中4种生物碱的含量测定[J].时珍国医国药,2006,17(11):2211 -2.[30]田吉,何兵,雷素娟,等.HPLC法测定苦参中苦参碱的含量[J].泸州医学院学报,2008,31(3):258 -61.[31]王春燕.HPLC法测定苦参中苦参碱的含量[J].首都医药,2011,18(2):48 -9.[32]徐今宁,蒋贵昱,汤建华.苦参药材高效液相指纹图谱分析方法研究[J].河北北方学院学报:医学版,2008,25(2):15 -8.[33]吴春红,唐卫文.HPLC法测定苦参药材中苦参碱的含量[J].药物分析杂志,2005,28(7):1147 -9.[34]李毅,王飞,吴民.苦参药材质量标准研究[J].中成药,2011,33(2):363 -4.[35]李贺,张振秋,董晓茜,等.HPLC法测定苦茂滴丸中苦参的5个生物碱含量[J].药物分析杂志,2010,30(4):626 -8.[36]胡北,单玉,张振秋,等.HPLC法同时测定苦参中5种生物碱的含量[J].中药材,2009,320(10):1556 -7.[37]靳如义,廖雪梅,罗忠圣,等.HPLC法测定苦参总碱中苦参碱与氧化苦参碱的含量[J].药物分析杂志,2008,28(2):297 -9.[38]张爱华,张悦晗.高效液相色谱法同时分离测定氧化苦参碱、槐定碱、槐胺碱、苦参碱、槐果碱[J].药物分析杂志,2008,28(6):964-6.[39]田娟,王维皓,高慧敏,等.HPLC测定复方苦参注射液中苦参碱、槐定碱和氧化苦参碱的含量[J].中国中药杂志,2007,32(3):222-3.[40]汪秀月.HPLC法测定消糜栓中苦参碱的含量[J].安徽医药,2010,14(7):778 -9. [41]毕映燕,胡芳弟,封士兰,等.高效液相色谱法同时测定复方当归栓中5种活性组分的含量[J].中国中药杂志,2010,35(18):2402-5.[42]张成颖,弥宏,赵宏峰,等.HPLC测定前列康泰胶囊中的苦参碱与氧化苦参碱[J].华西药学杂志,2010,25(4):476 -7.[43]曹玉梅,朱自红.HPLC法测定山豆根含量的研究[J].中国伤残医学,2010,18(6):113 -4.[44]罗德啟.高效液相色谱法测定痒葏洗剂中苦参碱和氧化苦参碱的含量[J].医药导报,2011,30(1):103 -4.[45]任永红,冯绍华.HPLC法测定康妇灵片中苦参碱和氧化苦参碱的含量[J].安徽医药,2009,13(2):154 -5.。
