苦参的化学成分和药理作用研究进展
苦参的药理活性研究进展

苦参的药理活性研究进展【关键词】苦参苦参(Sophoraflavescens Ait)为豆科槐属植物,是我国历史悠久的传统药物之一,其性味苦寒,归心、肝、肾、大肠、膀胱经,具有清热燥湿,祛风杀虫,利尿的功能。
用于热痢、便血、黄疸、尿闭、赤白带下、阴痒、湿疹、湿疮、皮肤搔痒、疥疮麻风、外治滴虫性阴道炎。
其主要成分为苦参碱matrine,氧化苦参碱oxymatrine等多种生物碱类成分,苦参醇kurarinol、苦参丁醇kuraridinol等多种黄酮类成分,另含氨基酸类,挥发油类,糖类,有机酸类,内酯类成分等。
近几年,对苦参化学成分和生物活性的研究不断深入,现将国内外对苦参药理活性的研究现状综述如下。
1 抗肿瘤活性肿瘤的发生和发展不仅是肿瘤细胞增殖和分化异常所致,而且还是肿瘤细胞异常凋亡的结果。
因此,抑制肿瘤细胞增殖,诱导肿瘤细胞分化和凋亡,对临床治疗肿瘤有一定的指导意义。
近几年的研究表明,苦参对恶性葡萄胎、绒癌、子宫癌、埃氏腹水瘤和淋巴内癌细胞都有不同程度的抑制和消灭作用,苦参碱对肿瘤细胞具有选择性杀伤作用,还能通过改变细胞核酸的分子序列,抑制肿瘤的生长,而且这种影响是广泛的、多部位的。
研究表明,用苦参碱治疗各种晚期癌肿,能减轻症状,延长存活期,且不破坏正常白细胞的产生,甚至能升高白细胞,提高机体抵抗力,这是许多治疗药物难以达到的。
对苦参碱在抗肿瘤机制方面的研究概括起来其抗肿瘤活性主要表现在以下几个方面。
抑制肿瘤细胞增殖苦参碱能有效抑制人肝癌细胞株HepG2的增殖。
MTT试验显示,苦参碱对HepG2抑制作用有时间剂量依赖性。
随着作用时间延长和药物浓度的增加,HepG2细胞存活率明显降低,细胞DNA合成亦相应降低。
病理学研究表明,苦参碱可抑制肝癌HepG2细胞的增殖,并具有直接杀伤作用。
其作用机制是苦参碱抑制部分肿瘤细胞从G期进入S期,从而抑制其增殖。
诱导肿瘤细胞分化和凋亡苦参碱不仅能抑制细胞增殖并促进其良性分化,还能诱导肿瘤细胞的凋亡。
苦参药理作用研究进展

苦参药理作用研究进展原雪,郭凯(中国药科大学生命科学与技术基地 ,江苏南京, 210038)E-mail:guokai3042@摘要: 目前,已经从苦参中分离得到生物碱、黄酮、挥发油和脂肪酸等多种成分,具有心血管、神经系统以及肝脏、皮肤等方面广泛的药理活性。
本文阐述了近年来对其药理活性的研究进展,为进一步研究和开发利用苦参提供参考。
关键字:苦参,药理作用,不良反应苦参为豆科多年生落叶亚灌木植物苦参Sophora flavescens Ait.的干燥根。
英文名为Lighiyellow Sophora Root,又名苦甘草、苦参草、苦豆根、西豆根、苦平子、野槐根、山槐根、干人参、苦骨等,是我国的传统中药之一。
我国各地均产,春秋两季采收,切片,晒干生用。
苦参性苦、寒。
有清热燥湿,杀虫,利尿的功效。
用于热痢,便血,黄疸尿闭,赤白带下,阴肿阴痒,湿疹,湿疮,皮肤瘙痒,疥癣麻风;外治滴虫性阴道炎。
不宜与藜芦同用。
由于其重要的药用价值和广泛的药理作用,苦参越来越引起人们的关注。
苦参的主要成分是氧化苦参碱、苦参碱、槐果碱等生物碱成分,二氢黄酮及二氢黄酮醇类等黄酮类成分,这是苦参目前发现的主要有效成分,也是多年来国内外学者广泛研究深入探讨的对象。
此外苦参还含有多种挥发油和脂肪酸等。
本文就近年来国内外对苦参主要药理作用的研究成果作一概述[1]。
1. 苦参药理作用1.1保肝作用苦参碱有抗肝炎、抗肝损伤、改善肝脏微循环、促进肝细胞再生、抑制乙肝病毒复制和免疫抑制作用。
1.1.1抗肝炎有关研究证明,苦参素能抑制乙肝病毒,促进肝功能恢复。
苦参素在体外试验中,发现对含有 HBV 基因的 2.2.15 细胞株分泌 HBsAg 有显著的抑制作用。
在乙肝病毒全基因组转基因小鼠动物模型中,抗乙肝病毒功能的研究表明,苦参素在体内确有抗乙肝病毒作用,可降低乙肝病毒转基因小鼠肝脏内 HBsAg、HBeAg 的含量[2]。
苦参碱抗乙型肝炎病毒的机理目前尚不明确,有学者认为其可能与调节机体免疫功能,增强Th淋巴细胞功能,改善和纠正免疫紊乱状态,使免疫系统识别和清除病毒的能力增强。
苦参药理学研究新进展

苦参药理学研究新进展前言苦参是一种传统草药,被广泛用于亚洲的中药治疗各种疾病,特别是皮肤病和风湿病。
近年来,随着现代药学技术的发展,对苦参所含的化学成分和其药理学活性的研究不断深入。
本文将简要概述苦参药理学研究的新进展。
苦参的生物活性成分苦参所含的主要生物活性成分为黄酮类化合物,包括苦参素、异黄酮、芦丁、山茱萸甙等。
这些化合物具有多种药理活性,如抗氧化、抗炎、抗肿瘤、抗菌、解热、镇痛等等。
抗氧化活性自由基是引起多种疾病的主要原因之一,如癌症、心脏病和中风。
苦参所含的化合物具有非常强的抗氧化活性,可以中和自由基,预防这些疾病的发生。
研究表明,苦参素可以通过抗氧化作用减轻脐静脉缺血导致的胎儿脑损伤。
抗炎活性苦参所含的芦丁和苦参素具有很好的抗炎活性,可以减轻炎症反应。
研究表明,这些天然化合物对慢性阻塞性肺疾病、类风湿性关节炎和骨质疏松等炎症性疾病有一定的治疗作用。
抗肿瘤活性苦参所含的异黄酮具有非常强的抗肿瘤活性。
它们可以通过对肿瘤细胞的凋亡、细胞周期的阻碍、细胞迁移的抑制等多种方式抑制肿瘤生长。
研究表明,苦参素对人类乳腺癌细胞具有抑制作用。
抗菌活性苦参所含的化合物对多种细菌、真菌、病毒和原虫具有一定的抗菌作用。
研究表明,苦参素可以通过抑制肺炎链球菌的DNA聚合酶和改变其细胞膜来达到抗菌的效果。
其他活性苦参还具有一系列其他的药理活性,如解热、镇痛、抑制纤溶酶等作用。
研究表明,苦参素可以减轻高渗脑病和改善骨质疏松症的症状。
临床应用目前,苦参药理学研究的的新进展已经被应用到了多个领域,如治疗癌症、心脑血管疾病、皮肤病和风湿病等。
例如,在乳腺癌细胞治疗方面,苦参素可以增强阿霉素和多柔比星的抗癌效果;在心血管疾病治疗方面,苦参素可以改善急性冠状动脉综合征患者的预后。
总结综上所述,苦参具有多种生物活性成分,包括抗氧化、抗炎、抗肿瘤、抗菌、解热、镇痛等作用。
目前,它已经成为了传统中药利用的重要来源之一,并且在临床应用中表现出很好的应用前景。
苦参 调研报告

苦参调研报告苦参(学名:Sophora flavescens)是一种传统中草药,也被称为黄芩、黄柏等,属于豆科植物。
苦参广泛分布于中国、朝鲜和日本等地,是一种常见的药用植物。
其根部含有丰富的生物活性成分,被用于治疗多种疾病和症状,如炎症、感染、肿瘤等。
本调研报告通过文献综述和实地走访的方式,对苦参的药理作用、临床应用和市场前景进行了研究和分析。
1. 苦参的药理作用苦参的主要活性成分包括黄酮类化合物、黄酮苷和生物碱等。
其中,黄酮类化合物具有多种生物活性,包括抗氧化、抗炎、抗菌、抗肿瘤等作用。
研究表明,苦参提取物可以抑制多种细菌和真菌的生长,对多种病原微生物具有明显的抗菌作用。
同时,苦参还可以抑制炎症反应的发生,减轻炎症症状。
此外,苦参的生物碱成分对肿瘤细胞具有一定的抑制作用,有望用于肿瘤的治疗。
2. 苦参的临床应用苦参在临床应用中被广泛用于治疗多种疾病和症状。
例如,苦参提取物可以用于治疗皮肤炎症和感染,如湿疹、皮炎、痤疮等。
此外,苦参还可以用于治疗炎症性肠病和关节炎等疾病,能够缓解炎症症状和改善患者的生活质量。
研究还发现,苦参对肝炎病毒的抑制作用较强,可以用于治疗肝炎等肝脏疾病。
3. 苦参的市场前景随着人们对草药的研究和应用不断深入,苦参作为一种传统药用植物,具有广阔的市场前景。
其丰富的药理活性和多种临床应用,为苦参的进一步开发和利用提供了有力支持。
据统计,苦参及其提取物在全球医药市场的销售额逐年增长,预计将继续保持良好的增长势头。
目前,苦参已经成为一些中药制剂的重要组成部分,并且逐渐出现在多个领域的药物研发中。
然而,苦参的开发和应用还存在一些问题,如药物有效成分的提取和纯化技术、质量标准的制定和控制等。
因此,进一步加强苦参的研究和开发,优化药物制剂的研发和生产工艺,提高其质量和安全性,有助于推动苦参的市场发展和应用推广。
总之,苦参作为一种传统草药,具有广泛的药理作用和临床应用。
随着人们对中药的重视和需求的增加,苦参在医药市场中的地位和影响力将不断提升。
苦参化学成分与药理作用研究进展

苏佳昇,李晓霞,蒋雅娴,等.苦参化学成分与药理作用研究进展[J ].湖北农业科学,2021,60(1):5-9.收稿日期:2020-01-15基金项目:广西科技重大专项(桂科AA18126003)作者简介:苏佳昇(1995-),男,湖南常德人,在读硕士研究生,研究方向为中药、民族药的新剂型、新制剂,(电话)131****5650(电子信箱)****************;通信作者,王志萍(1965-),女,广西三江人,教授,主要从事中药、民族药的新剂型、新制剂的研制与开发,(电子信箱)****************。
苦参(Sophorae flavescentis radix )为豆科植物苦参(Sophora flavescens Ait .)的干燥根。
苦参喜阳,在中国分布较广,在广西、内蒙古、河南、河北、四川、云南等地均有分布,具有很长的用药历史,其主要生于山坡、沙地草坡灌木林中或田野附近,海拔1500m 以下。
印度、日本、朝鲜、俄罗斯西伯利亚地区也有分布[1]。
《本草纲目》记载:“苦参、黄柏之苦寒,皆能补肾,盖取其苦燥湿,寒除热也。
热生风,湿生虫,故又能治风杀虫。
惟肾水弱而相火胜者用之相宜,若火衰精冷,真元不足,及年高之人不可用也。
”《神农本草经》记载:“主心腹结气,症瘕积聚,黄疸,溺有余沥,逐水,除痈肿,补中,明目止泪。
”《滇南本草》记载:“凉血,解热毒,疥癞,脓窠疮毒。
疗皮肤瘙痒,血风癣疮,顽皮白屑,肠风下血,便血。
消风,消肿毒,痰毒。
”苦参性寒,味苦,归心、肝、胃、大肠、膀胱经,用于热痢,便血,黄疸尿闭,赤白带下,阴肿阴痒,湿疹,湿疮,皮肤瘙痒,疥癣麻风,外治滴虫性阴道炎等症[2]。
苦参根中主要含有生物碱类和黄酮类成分,其他成分占比相对较少[3]。
近年来,许多研究表明苦参还具有抗炎、抗肿瘤、抑菌、镇痛等多种药理活性[4,5]。
本文总结了苦参的化学成分、药理作用和临床应用的研究进展,以期为苦参的进一步研究和开发利用提供参考。
苦参的化学成分和药理作用研究进展

云 南 中 医 中 药 杂志
2 0 1 5 年第3 6卷第6期
苦 参 的化 学 成 分 和 药 理 作 用研 究进 展
张钟媛
( 天 津 市津 南区 中 医医院 ,天津 3 0 0 0 0 0 )
关键 词 :苦参 ; 化 学成分 ; 药理作 用; 研 究进展 中图分类号 : R 2 8 文献标 志码 : A 文章编 号 : 1 0 0 7— 2 3 4 9 ( 2 0 1 5 ) 0 6—0 1 0 4— 0 3
3 —4 .
[ 1 2 ] 马少丹 , 阮时宝 .久泻宁颗粒对 大鼠溃疡性结肠炎细胞 凋亡及其 调控蛋 白影响的研究 [ J ] .山西 中医, 2 0 1 1 , 2 7 ( 1 2 ) : 4 2— 4 5 .
[ 1 3 ] 张涛 , 施斌 , 谢 建 群 .清 肠 栓 对 溃 疡 性 结 肠 炎 结 肠 粘 膜 固 有 层 淋 巴细 胞 凋 亡 影 响 的 实 验 研 究 [ J ] .浙 江 中 医 杂 志 , 2 0 0 6 , 4( 1 2) :
性结肠 炎 大 鼠的 影 响 [ J ] .中 华 中 医药 杂 志 , 2 0 0 9, 2 4( 1 O) :
1 33 7 —1 3 3 9 .
[ 1 O ] 王营 , 李晓军 . 半夏泻心汤对溃疡性结肠炎大 鼠模型 胃肠激素 的
影响[ J ] .中国老年学杂志 , 2 0 1 l , 7 ( 3 1 ) : 2 7 1 5—2 7 1 6 . [ 1 1 ] 王浩 , 徐明 , 张广新 .葛 根芩连 汤对溃疡 性结肠 炎模型 大鼠结肠 黏膜 B c l 一2 、 B a x 的影 响 [ J ] .湖 北 中 医杂 志 , 2 0 1 1 , 3 3( 1 1 ) :
苦参中黄酮类成分及其药理作用研究现状

苦参中黄酮类成分及其药理作用研究现状标签:苦参;黄酮类化合物;化学结构;药理活性;综述苦参为豆科槐属植物苦参Sophora flavescenes Ait.的干燥根,主治热痢便血、阴肿阴痒、湿疹、皮肤瘙痒,外用治疗滴虫性阴道炎等。
黄酮类成分是苦参中重要的化学成分,具有抗炎、抗肿瘤、抗心率失常、抗滴虫和抗菌等作用。
为全面了解苦参中黄酮类化合物的研究状况,笔者对近10年来有关苦参中黄酮的化学结构类型和药理作用研究作一综述,旨在为完善建立苦参中黄酮类成分的质量标准研究提供参考。
1 结构类型及紫外光谱吸收特征苦参黄酮中的异戊烯基侧链包括A、B、C、D、E(见图1)以及2种与苯环成吡喃环形式共7种类型,这是苦参区别于同属其他植物最明显的化学结构特征。
大多数化合物则多以薰衣草基(lavandulyl)的分枝异戊烯基侧链其羟基化形式存在于A环的C-8位上。
1.1 二氢黄酮类化合物包括Alopecurone G[1]和Isobavachin[2]。
其取代基的类型和位置特征如下:A环8-位多为异戊二烯基侧链,7-位多为OH基。
B环3’-位多为OH基。
紫外光谱特征:带Ⅱ的范围为270~295 nm,带Ⅰ为300~330 nm。
碳谱信号特征:化合物结构中C环的核磁信号特征C=O在188.0~197.0(s),C-2为75.0~80.3(d),C-3为2.8~44.6(t)。
二氢黄酮类结构可视为黄酮基本母核的2、3位双键被氢化而成。
1.2 二氢黄酮醇类化合物二氢黄酮醇类(如Sophoronol[2])具有黄酮醇类的2、3位被氢化的基本母核,且常与相应的黄酮醇共存于一植物中,C环的3-位均为OH基取代,A环7-位多为羟基和甲氧基。
紫外光谱特征:带Ⅱ吸收范围为270~295 nm,带Ⅰ为300~330 nm。
碳谱信号特征:二氢黄酮醇类化合物结构中的C环的信号C=O 在188.0~197.0(s)、C-2为82.7(d),与二氢黄酮类相似,C-3在71.2(t),比二氢黄酮类更偏低场。
苦参的化学成分及药理的研究进展
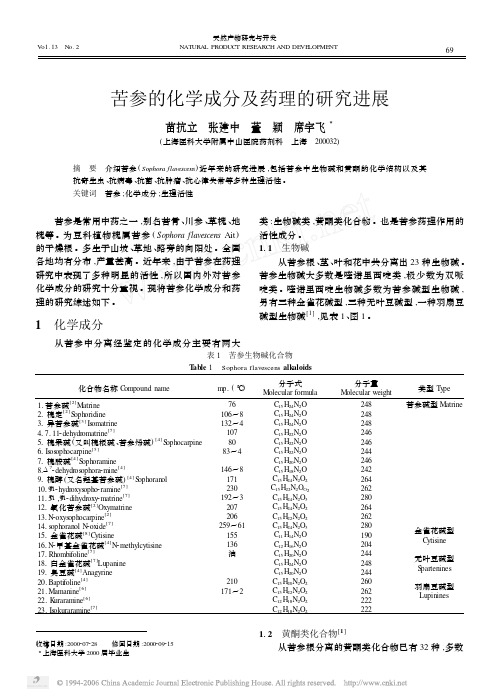
天然产物研究与开发 V o1.13 N o.2NAT URA L PRODUCT RESE ARCH AND DE VE LOPME NT 苦参的化学成分及药理的研究进展苗抗立 张建中 董 颖 席宇飞3(上海医科大学附属中山医院药剂科 上海 200032)摘 要 介绍苦参(Sophora flavescens)近年来的研究进展,包括苦参中生物碱和黄酮的化学结构以及其抗寄生虫、抗病毒、抗菌、抗肿瘤、抗心律失常等多种生理活性。
关键词 苦参;化学成分;生理活性 苦参是常用中药之一,别名苦骨、川参、草槐、地槐等。
为豆科植物槐属苦参(Sophora flavescens Ait)的干燥根。
多生于山坡、草地、路旁的向阳处。
全国各地均有分布,产量甚高。
近年来,由于苦参在药理研究中表现了多种明显的活性,所以国内外对苦参化学成分的研究十分重视。
现将苦参化学成分和药理的研究综述如下。
1 化学成分从苦参中分离经鉴定的化学成分主要有两大类:生物碱类,黄酮类化合物。
也是苦参药理作用的活性成分。
111 生物碱从苦参根、茎、叶和花中共分离出23种生物碱。
苦参生物碱大多数是喹诺里西啶类,极少数为双哌啶类。
喹诺里西啶生物碱多数为苦参碱型生物碱,另有三种金雀花碱型,三种无叶豆碱型,一种羽扇豆碱型生物碱[1],见表1、图1。
表1 苦参生物碱化合物T able1 Sophora flavescens alk aloids化合物名称C ompound name mp.(℃)分子式M olecular formula分子量M olecular weight类型T ype1.苦参碱[2]Matrine76C15H24N2O248苦参碱型Matrine 21槐定[2]S ophoridine106~8C15H24N2O24831异苦参碱[3]Is omatrine132~4C15H24N2O248417.112dehydromatrine[7]107C15H22N2O24651槐果碱(又叫槐根碱、苦参烯碱)[4]S ophocarpine80C15H22N2O24661Is os ophocarpine[5]83~4C15H22N2O24471槐胺碱[4]S ophoramine C15H20N2O24681Δ72dehydros ophora2mine[4]146~8C15H18N2O24291槐醇(又名羟基苦参碱)[4]S ophoranol171C15H24N2O22641019α2hydroxys opho2ramine[7]230C15H22N2O O22621115α,9α2dihydroxy2matrine[7]192~3C15H24N2O3280121氧化苦参碱[2]Oxymatrine207C15H24N2O2264131N2oxys ophocarpine[2]206C15H22N2O2262141s ophoranol N2oxide[7]259~61C15H24N2O3280 151金雀花碱[8]Cytisine155C11H14N2O190金雀花碱型Cytisine161N2甲基金雀花碱[4]N2methylcytisine136C12H16N2O204171Rhombifoline[7]油C15H20N2O244 181白金雀花碱[7]Lupanine C15H24N2O248无叶豆碱型S partenines191臭豆碱[4]Anagyrine C15H20N2O24420.Baptifoline[4]210C15H20N2O226021.Mamanine[6]171~2C15H22N2O2262羽扇豆碱型Lupinines22.K uraramine[6]C12H18N2O222223.Is okuraramine[7]C12H18N2O2222收稿日期:2000207228 修回日期:2000209215 3上海医科大学2000届毕业生112 黄酮类化合物[1]从苦参根分离的黄酮类化合物已有32种,多数96图1 苦参生物碱结构Fig.1 The structure of Sophra flavescens alk aloids为二氢黄酮和二氢黄酮醇类,少数为黄酮类、黄酮醇类、异黄酮类、查耳酮类和双环系黄酮类,其中仅有kushenol J 、trifolirhizin 和kushenol O 三种化合物为甙,见表2、图2。
苦参现代研究进展

苦参现代研究进展苦参(Sophora flavescens)是传统中药材中常用的药用植物之一,也是中医常用的清热解毒、活血祛瘀药材。
它属于豆科植物,主要分布于中国、朝鲜和日本等地。
近年来,由于苦参中含有丰富的生物活性成分,其药理学和医学研究逐渐得到了广泛的关注和重视。
以下是苦参现代研究的一些重要进展:苦参中主要活性成分的研究:苦参中主要含有苦参碱、苦参酮、咯哩酮类、黄酮类、黄降类以及多种植物生物碱等活性成分。
这些成分具有广泛的生物活性,如抗炎、抗菌、抗氧化、抗肿瘤、抗病毒等作用。
目前有关苦参中主要活性成分的提取和分离研究已经取得了一系列进展,为进一步研究苦参的药理学作用提供了重要的基础。
苦参的抗肿瘤作用研究:苦参中的活性成分具有很好的抗肿瘤作用。
研究发现,苦参碱能够通过调节肿瘤细胞凋亡、细胞周期、抑制肿瘤血管生成等多种机制对肿瘤生长产生抑制作用。
此外,苦参中的苦参酮也被证明具有抗肿瘤活性。
因此,苦参作为一种潜在的抗肿瘤药物吸引了广泛的研究兴趣。
苦参的抗炎和免疫调节作用研究:苦参中的多种活性成分具有显著的抗炎和免疫调节作用。
研究发现,苦参酮可以通过抑制炎症介质的释放,减轻炎症反应。
此外,苦参中的黄酮类化合物具有抗氧化和抗炎作用,可以调节免疫系统功能,提高机体的免疫力。
因此,苦参被认为是一种具有抗炎和免疫调节作用的潜在药物。
苦参对心血管疾病和代谢性疾病的影响研究:近年来的研究表明,苦参具有一定的降血脂、降血压和抗动脉粥样硬化作用,能够改善心血管疾病患者的病情。
此外,苦参对于糖尿病、肝脏疾病等代谢性疾病也具有一定的治疗效果。
这些研究结果进一步验证了苦参具有多种药理学功效的潜力。
苦参的副作用和毒性研究:虽然苦参具有多种药理学功效,但其研究过程中也发现了一些不良反应和毒性。
苦参中的一些活性成分具有一定的毒性,例如苦参碱对中枢神经系统有一定的抑制作用。
因此,在临床应用苦参时需要谨慎选择剂量,并结合患者的具体情况进行合理应用。
苦参现代研究进展

苦参现代研究进展(综述)苦参为豆科植物苦参( Sophora flavescens Ait . ) 的干燥根。
苦参味苦、性寒。
归心、肝、胃、大肠、膀胱经。
随着分离技术的发展,苦参中的成分在被慢慢的发现中,很多已经明确的有效成分在被不断的研究,已经确定的药理作用也有很多。
随着人们的对身体健康的关注度提高、养生保健意识增强,毒副作用小,药效明显的中药越来越受人们的青睐,苦参就是其中一种现在就以现代苦参研究中的化学成分、药理作用、有效成分的提取及质量控制做一综述。
1 化学成分苦参中化学成分主要有生物碱类、黄酮类、三萜皂苷类以及醌类化合物。
除外苦参中还含有多种氨基酸、脂肪酸等成分,但是这些都无明显的药理作用故而研究较少。
1.1生物碱类苦参碱、氧化苦参碱、槐果碱、槐胺碱、槐定碱、N-氧化槐根碱、槐醇碱、N-甲基野定碱等,其中以前五种为目前认为的具有主要药理活性的生物碱[1]。
苦参中的生物碱类为最主要的成分,是苦参的重要有效成分,有多种药理作用。
《中国药典》(2010版)规定,苦参干燥品中苦参碱、氧化苦参碱的总含量不得低于1%,可见这两种成分在苦参中的重要性。
1.2黄酮类化合物包括:二氢黄酮、黄酮醇、二氢黄酮醇、苦参新醇、苦参查耳酮、苦参醇等。
1.3三萜皂苷类化合物包括:苦参皂苷(Ⅰ、Ⅱ、Ⅲ、Ⅳ)、大豆皂苷等。
1.4醌类化合物包括:苦参醌A等。
2 药理作用苦参作为一种传统的中药具有清热解毒、燥湿利尿、祛风杀虫等作用。
现代研究表明苦参具有杀菌消毒、抗寄生虫、抗心律失常、抗心肌缺氧、抗肿瘤等作用。
苦参碱、氧化苦参碱为诸多药理作用的活性成分。
2.1杀菌消毒张顺合等[2]研究发现苦参对细菌繁殖体、病毒、真菌(霉菌)具有消毒作用。
苦参提取物的杀菌消毒作用对皮肤无刺激性,致敏性低,符合现代的消毒杀菌理念。
2.2抗寄生虫现在研究表明苦参对多种寄生虫有抵抗作用。
殷袜隆等[3]经过试验发现苦参碱能抑制棘球绦虫的正常代谢,从而起到抗棘球绦虫的作用。
苦参的药理研究进展

苦参的药理研究进展中药苦参(Sophora flavescens Ait)具有清热燥湿、杀虫、利尿等功效。
治热毒血痢、肠风带血、赤白带下、黄疸尿闭、疳积、皮肤瘙痒、阴疮湿痒、烫伤、疥廯麻风;外治滴虫性阴道炎[1]。
其主要成分苦参素(Kushenin)是一类含有苦参次碱15酮基本结构的化合物,其中氧化苦参碱(Oxymatrine)含量在98%以上;还含有苦参醇(Kurarinol)、苦参丁醇(Kuraridinol)等多种黄酮类成分;另含有氨基酸类、挥发油类、糖类、有机酸类、内酯类等成分。
现代药理研究结果显示,苦参素具有抗炎、免疫抑制、抗病毒、抗生育、对心功能影响、中枢抑制等药理作用。
现将药理作用简要综述如下。
1 对肝病的作用1.1 抗肝炎病毒作用:研究证实,苦参素具有明显、明确的抗乙型肝炎病毒(HBV)和抗肝纤维化的双重作用。
陈亚军[2]用其治疗慢性乙肝患者40例,并与对照组40例疗效进行比较,结果HBeAg转阴率为35%,HBV-DNA转阴率为38%,明显优于对照组(P<0.05),表明苦参素具有良好的抗病毒作用。
其具体表现在:(1)可抑制含HBV基因转染的细胞分泌HBsAg和HBeAg;(2)可抑制HBV转基因小鼠抗原的表达[3];(3)显著降低鸭HBV(DHBV)感染鸭血清DHBV-DNA水平。
1.2 抗肝损伤作用:苦参素对各种肝损伤有一定的保护作用,可用于肝功能损伤较重并伴有黄疸的患者[4]。
目前认为,乙型肝炎的肝损伤并非因HBV在肝细胞内繁殖引起,而是通过宿主的免疫应答反应引起。
苦参素不仅抑制HBV的复制,还对感染后免疫系统具有双向调节作用,从而减轻肝损伤程度。
此外,苦参素可阻断肝细胞的异常凋亡,对实验性小鼠肝衰竭具有保护作用。
1.3 抗肝纤维化作用:肝纤维化是慢性肝病发展为肝硬化的中间环节和共同病理过程,因此延缓或阻止肝纤维化的形成,对防治肝硬化具有重要意义。
有研究表明[5],应用苦参素(实验组)的肝组织增生程度明显低于肝纤维模型组,其胶原含量及胶原的mRNA表达均低于免疫诱导型肝纤维化模型组大鼠,表明其有减轻肝脏炎症活动度、抑制肝内胶原合成及抗肝纤维化作用。
苦参中黄酮类化合物的化学成分分析及药理研究进展

综 述 苦参中黄酮类化合物的化学成分分析及药理研究进展侯立强1,李伟男2,冯宇飞2,张 蕾2,杨志欣2(1.黑龙江中医药大学附属第二医院,黑龙江哈尔滨150001;2.黑龙江中医药大学药学院,黑龙江哈尔滨150040)[关键词] 苦参;黄酮类化合物;化学成分;药理作用doi :10.3969/j.issn.1008-8849.2020.18.028[中图分类号] R282.7 [文献标识码] A [文章编号] 1008-8849(2020)18-2050-03[通信作者] 杨志欣,E -mail :zhixin.y@ [基金项目] 黑龙江省自然科学基金项目(H2017066) 近年来,随着祖国医学的大力发展,人们对中药的认识也逐渐加深。
苦参作为一种中药,其本身具有清热、利尿、抗氧化过敏、抗心律失常以及抗炎和抗镇痛等作用,因而已被用作消炎药、驱虫药以及止泻药等方面[1]。
在人们对中药认识逐渐加深的过程中,对苦参中的化学成分有了更为深入的研究,尤其是对苦参中黄酮类化合物中化学成分和药理作用的研究。
为进一步探究其应用价值,本研究将苦参中黄酮类化合物的化学成分分析及药理研究进展综述如下。
1 苦 参苦参属豆科植物,味苦、性寒,是常用中药,也是常用的蒙药。
苦参的生长区域主要在河南、河北、山东以及新疆等地。
苦参中的化学成分主要包括两大类,即生物碱和黄酮类化合物[2]。
生物碱的主要成分为苦参碱、氧化苦参碱、槐根碱以及槐定碱等。
目前,已从苦参根中分离出高达100多种黄酮类化合物。
依据黄酮类化合物骨架,其化学成分主要包括二氢黄酮类、异黄酮类、二氢异黄酮类、查尔酮类、黄酮醇类、二氢黄酮醇类以及双黄酮类等。
但大部分黄酮类化合物主要以薰衣草基的分支异戊烯基侧链的羟基化形式存在A 环的C -8位上。
2 苦参中黄酮类化合物的化学成分2.1 二氢黄酮类化合物 此类化合物主要包括两种,即Isobavachin 和Alopecurone G。
苦参的化学成分及药理作用研究进展

化学工程师Chemical Engineer2021年第3期Sum306No.3综述D01:10.16247/ki.23-1171/tq.20210358苦参的化学成分及药理作用研究进展苏丽丽(天津大学药物科学与技术学院,天津300072)摘要:苦参是一种传统中药,所含的化学成分在抗肿瘤、抗炎镇痛、抗菌、抗病毒、抗心律失常、增强免疫功能等方面均表现出一的药理作用,也得泛的B本对苦参的化学成分及其药作用的研究行概2为今后一步发利用苦参供论参考科学B关键词:苦参k化学成分l药理作用l研究中图分类号:R285.5文献标识码:AAdvances in the study of chemical constituents and pharmacological effects of Sophora flavescens Ait.SU Li-li(School of Pharmaceutical Science and Technology,Tianjin University,Tianjin300072,China) Abstract:As a traditional Chinese medicine,Sophora flavescens contains a variety of chemical components which play significant effect in anti-tumor,antibacterial,anti-inflammatory and analgesic,anti-virus,anti-arrhythmia and improving immune function.Therefore,it attracts widespread attentions.In order to provide theoretical reference and scientific basis for further exploration and utilization of Sophora flavescens,this paper summarizes the new progress in the research of its chemical constituents and pharmacological effects.Key words:Sophora flavescens;chemical composition;pharmacological action;research progress苦参(Sophora flavescens Ait.)是)科植物苦参的干燥根,为圆柱形,长10~30cm,直径1~6.5cm,外部灰棕色,味苦性寒。
苦参的化学成分、药理作用及炮制方法的研究进展

doi:10.11751/ISSN.1002-1280.2019.10.10苦参的化学成分㊁药理作用及炮制方法的研究进展王圳伊1,王露露2,张晶1,2∗(1.吉林农业大学中药材学院,长春130118;㊀2.长春科技学院医药学院,长春130600)[收稿日期]2019-06-25㊀[文献标识码]A㊀[文章编号]1002-1280(2019)10-0071-09㊀[中图分类号]S853.7[摘㊀要]㊀苦参是一种传统中药,其主要成分为黄酮类及生物碱类物质,具有清热解毒,抗炎镇痛等药理作用,其炮制方法众多㊂本文就国内外近些年对苦参的化学成分,药理作用及加工炮制方法的研究进展进行了综述,为对其进一步开发利用提供参考㊂[关键词]㊀苦参;化学成分;药理作用;炮制方法;综述作者简介:王圳伊,硕士研究生,从事天然产物化学研究㊂通讯作者:张晶㊂E-mail:zhjing@163.comAdvancesinResearchonChemicalConstituents,PharmacologicalEffectsandProcessingMethodsofSophoraFlavescensWANGZhen-yi1,WANGLu-lu2,ZHANGJing1,2∗(1.CollegeofChineseMedicinalMaterials,JilinAgricultureUniversity,Changchun130118,China;2.collegeofmedicine,ChangchunUniversityofscienceandtechnology,Changchun130600,China)㊀㊀Correspondingauthor:ZHANGJing,E-mail:zhjing@163.com.Abstract:SophoraflavescensisatraditionalChinesemedicine.Itiscomposedofflavonoidsandalkaloids.Ithasthepharmacologicaleffectsofclearingawayheat,detoxification,anti-inflammationandanalgesia.Therearemanyprocessingmethods.Inthispaper,theresearchprogressofchemicalconstituents,pharmacologicaleffectsandprocessingmethodsofSophoraflavescensinrecentyearsathomeandabroadwerereviewed,whichcouldprovidereferenceforitsfurtherdevelopmentandutilization.Keywords:Sophoraflavescens;chemicalcomposition;pharmacologicaleffects;processingmethod;review㊀㊀苦参是豆科(Leguminosae)槐属(Sophora)植物苦参(SophoraeflavescentisAit)的干燥根,别名苦豆子,干人参,山槐根等,‘神农本草经“将其列为中品[1]㊂苦参喜阳,在我国分布较广,在内蒙古㊁河南㊁河北㊁安徽㊁山东㊁山西㊁贵州以及四川等地均有种植,其具有很长的用药历史, 苦以味名,参以功名 是‘本草纲目“对苦参的评价[2]㊂苦参根中主要含有黄酮类及生物碱类成分,其它成分占比相对较少[3],其性寒,味苦,具有清热解毒,抗炎镇痛,抗肿瘤等多种药理活性[4-5]㊂古代苦参入药有众多炮制手段,现代多经产地加工后入药[6]㊂作者对近些年来国内外关于苦参的化学成分㊁药理作用及炮制方法等方面的相关研究进展进行综述,旨在更深入的开发利用苦参中的活性物质㊂1 苦参的化学成分近年来,随着对苦参药理活性研究的不断深入,关于苦参化学成分的研究也越来越广泛㊂苦参的化学成分主要包括黄酮类㊁生物碱类㊁苯丙素类㊁脂肪酸类㊁萜类等[7]㊂苦参根中化学成分众多[8],黄酮类和生物碱类被认为是其主要的生物活性成分[3]㊂1.1㊀黄酮类成分㊀迄今为止从苦参根中分离出的黄酮类成分的骨架包括二氢黄酮类,二氢黄酮醇类,查尔酮类,异黄酮类,二氢异黄酮类,高异黄酮类[9]㊂其中以二氢黄酮和二氢黄酮醇类成分居多[10]㊂1.1.1㊀二氢黄酮类㊀二氢黄酮为黄酮类C2-3位的双键氢化后的衍生物㊂苦参中含有众多二氢黄酮类化合物,主要包括苦参醇A㊁B㊁E㊁F㊁P㊁Q㊁R㊁S㊁T㊁U㊁V㊁W㊁苦参黄素㊁异苦参黄素㊁2ᶄ-甲氧基苦参酮㊁苦参醇㊁降基参醇㊁新苦参醇㊁异黄腐醇㊁勒奇黄烷酮A㊁G㊁槐黄酮B㊁G㊁K㊁L㊁(+)-降基参醇酮㊁柚皮素㊁5-甲氧基-7,2ᶄ,4ᶄ-三羟基-8-异戊烯基-黄烷酮㊁柚皮素⁃7⁃O⁃β⁃D⁃葡萄糖基-4ᶄ⁃O⁃β⁃D⁃葡萄糖苷㊁(2S)-7,4ᶄ-二羟基-5-甲氧基-8-(γ,γ-二甲烯丙基)-二氢黄酮㊁4ᶄ-羟基茄红素,8-(3-羟甲基-2-丁烯烯基)-5,7,2ᶄ,4ᶄ-四羟基黄酮㊁槐黄烷酮B㊁K㊁G㊁L㊁2,3-二羟基-4ᶄ-甲氧基二氢黄酮⁃7⁃O⁃β⁃D⁃木糖-(1ң6)⁃β⁃D⁃吡喃葡萄糖苷㊁7-羟基-4ᶄ-甲氧基-二氢黄酮-3ᶄ-O⁃β⁃D⁃吡喃葡萄糖苷等[11-27]㊂1.1.2㊀二氢黄酮醇类㊀二氢黄酮醇类为黄酮类C2-3位的双键氢化后且在黄酮基本母核的C3位上连有羟基㊂近年来,国内外学者从苦参中分离得到多种二氢黄酮醇类化合物,主要包括苦参醇H㊁I㊁J㊁K㊁L㊁M㊁N㊁X㊁考萨莫醇A㊁(2R,3R)-8-薰衣草基-5,7,4ᶄ-三羟基-2ᶄ-甲氧基二氢黄酮醇㊁(2R,3R)-8-异戊烯基-7,2ᶄ,4ᶄ-三羟基-5-甲氧基二氢黄酮醇㊁(2R,3R)-8-异戊烯基-7,4ᶄ-二羟基-5-甲氧基二氢黄酮醇等[28-32]㊂1.1.3㊀黄酮醇类㊀黄酮醇类是指含有2-苯基-3-羟基(或含氧取代)苯骈γ-吡喃酮(2-苯基-3-羟基-色原酮)类化合物,是各类黄酮化合物中数量最多㊁分布最广泛的一类㊂苦参中的黄酮醇类化合物主要包括苦参醇C㊁G㊁5-甲基苦参醇C㊁去甲去水淫羊藿黄素㊁异去水淫羊藿黄素㊁槐黄醇㊁8-薰衣草醇山奈酚㊁8-异戊烯基山奈酚㊁5-去羟山奈酚㊁槲皮素㊁芦丁㊁柠檬苦素㊁去甲去水淫羊藿黄素㊁异去水淫羊藿黄素等[11-17]㊂1.1.4㊀查尔酮类㊀查尔酮别名为二苯基丙烯酮,是天然产物中常见的一类化合物㊂苦参中分离出的查尔酮类化合物主要为苦参啶㊁苦参醇D㊁苦参二醇㊁黄腐酚㊁2ᶄ,4-二羟基-4ᶄ,6ᶄ-二甲氧基查尔酮㊁环苦苷㊁狭叶槐查尔酮等[12,22,39]㊂1.1.5㊀异黄酮类㊀异黄酮,是植物苯丙氨酸代谢过程中,由肉桂酰辅酶A侧链延长后环化形成以苯色酮环为基础的酚类化合物,其3-苯基衍生物即为异黄酮㊂苦参中的异黄酮类化合物众多,主要为芒柄花黄素㊁苦参醇O㊁3ᶄ-羟基苦参醇O㊁大豆素㊁大豆素⁃7⁃O⁃β⁃D⁃木糖⁃(1ң6)⁃β⁃D⁃吡喃葡萄糖苷㊁3ᶄ-羟基-4ᶄ-甲氧基-异黄酮⁃7⁃O⁃β⁃D⁃芹糖-(1ң6)-β⁃D⁃吡喃葡萄糖苷㊁3ᶄ⁃甲氧基-4ᶄ-羟基-异黄酮⁃7⁃O⁃β⁃D⁃木糖-(1ң6)⁃β⁃D⁃吡喃葡萄糖苷㊁4ᶄ-羟基-异黄酮⁃7⁃O⁃β⁃D⁃芹糖-(1ң6)⁃β⁃D⁃吡喃葡萄糖苷㊁3ᶄ-甲氧基-4ᶄ-羟基-异黄酮⁃7⁃O⁃β⁃D⁃芹糖-(1ң6)⁃β⁃D⁃吡喃葡萄糖苷㊁3ᶄ,4ᶄ-二羟基-异黄酮⁃7⁃O⁃β⁃D⁃吡喃葡萄糖苷㊁4ᶄ-羟基-5ᶄ-甲氧基-异黄酮-3ᶄ-O⁃β⁃D⁃吡喃葡萄糖苷㊁4ᶄ-甲氧基-异黄酮⁃7⁃O⁃β⁃D⁃芹糖-(1ң6)⁃β⁃D⁃吡喃葡萄糖苷㊁芒柄花苷㊁5,4ᶄ-二羟基-异黄酮⁃7⁃O⁃β⁃D⁃芹糖-(1ң6)⁃β⁃D⁃吡喃葡萄糖苷㊁5,4ᶄ-二羟基-异黄酮⁃7⁃O⁃β⁃D⁃木糖-(1ң6)⁃β⁃D⁃吡喃葡萄糖苷㊁5-羟基-4ᶄ-甲氧基-异黄酮⁃7⁃O⁃β⁃D⁃木糖-(1ң6)⁃β⁃D⁃吡喃葡萄糖苷㊁5-羟基-4ᶄ-甲氧基-异黄酮⁃7⁃O⁃β⁃D⁃芹糖-(1ң6)⁃β⁃D⁃吡喃葡萄糖苷㊁7-甲氧基-4ᶄ-羟基异黄酮㊁毛蕊异黄酮㊁假黄连苷元㊁假白屈菜素⁃7⁃O⁃β⁃D⁃木糖-(1ң6)⁃β⁃D⁃吡喃葡萄糖苷㊁赝靛黄素㊁赝靛黄素⁃7⁃O⁃β⁃D⁃木糖-(1ң6)⁃β⁃D⁃吡喃葡萄糖苷等[19-27]㊂1.1.6㊀二氢异黄酮类㊀二氢异黄酮类又称异黄烷酮,此类化合物可看作是异黄酮类C2-C3双键被氧化的一类化合物㊂近年来,从苦参中分离出的二氢异黄酮类化合物主要有L-高丽槐素㊁紫檀素㊁三叶豆紫檀苷㊁三叶豆紫檀-6ᶄ-单乙酸酯㊁3-羟基-4-甲氧基-8,9-亚甲基二氧基紫檀烷㊁高丽怀素⁃7⁃O⁃β⁃D⁃芹糖-(1ң6)⁃β⁃D⁃吡喃葡萄糖苷㊁苦参素㊁美迪紫檀素-3-O⁃β⁃D⁃芹糖-(1ң6)⁃β⁃D⁃吡喃葡萄糖苷㊁苦参素A㊁B㊁C㊁D㊁7-羟基-4ᶄ-甲氧基-二氢黄酮-3ᶄ-O⁃β⁃D⁃吡喃葡萄糖苷㊁2,3-二羟基-4ᶄ-甲氧基二氢黄酮⁃7⁃O⁃β⁃D⁃木糖-(1ң6)⁃β⁃D⁃吡喃葡萄糖苷㊁2,3-二羟基-4ᶄ-甲氧基二氢黄酮⁃7⁃O⁃β⁃D⁃芹糖-(1ң6)⁃β⁃D⁃吡喃葡萄糖苷等[27-39]㊂1.1.7㊀高异黄酮类㊀高异黄酮类化合物与异黄酮相比,其在B环和C环之间多了一个-CH2-的结构,从苦参中分离出的此类化合物较少㊂研究人员从苦参中分离出2,3,4ᶄ-三羟基-高异黄酮⁃7⁃O⁃β⁃D⁃吡喃葡萄糖苷和2,3–二羟基-4ᶄ-甲氧基-高异黄酮-7-O-木糖苷两种高异黄酮㊂1.1.8㊀双黄酮类㊀双黄酮类化合物是由二分子黄酮衍生物通过C-C键或C-O-C键聚合而成的二聚物㊂研究人员从苦参中分离出槐黄素A和槐黄素B两个双黄酮㊂1.1.9㊀其他㊀苦参中还含有其他黄酮类化合物,主要包括5,7-二羟基-8-薰衣草基黄酮㊁5,7-二羟基-8(r,r-二甲基烯丙基)黄酮㊁苜蓿内酯㊁sophoradione㊁墨沙酮-4-O⁃β⁃D⁃吡喃葡萄糖苷等[22,30]㊂1.2㊀生物碱类成分㊀至今,已从苦参中分离出众多生物碱,包括喹诺里西啶类生物碱,哌啶类生物碱,甾体类生物碱[40-49]㊂其中,喹诺里西啶类包括苦参碱㊁氧化苦参碱㊁异苦参碱㊁别苦参碱㊁顺式新苦参碱㊁反式新苦参碱㊁槐果碱㊁氧化槐果碱㊁槐定碱㊁异槐定碱㊁槐醇㊁氧化槐醇㊁臭豆碱㊁金雀花碱㊁N-甲基金雀花碱㊁17β-羟基槐定碱㊁(+)-9α-羟基苦参碱㊁(-)-14β-羟基苦参碱㊁9α-羟基槐果碱㊁9α-羟基氧化槐果碱㊁12α-羟基槐果碱㊁7,11-去氢苦参碱㊁槐胺碱㊁9α-羟基槐胺碱㊁莱曼碱㊁7,8-二去氢槐胺碱㊁13,14-二去氢槐定碱㊁5α-羟基槐果碱㊁5α,9α-二羟基苦参碱㊁异槐果碱㊁菱叶黄花碱㊁羽扇豆碱㊁5,6-去氢羽扇豆碱㊁赝靛叶碱㊁黄叶槐碱㊁(-)-9α-hydroxy-7,11-de⁃hydromatrine㊁(-)-leontalbinineN-oxide㊁(-)-12-乙基槐胺㊁tetrahydroneosophoramine㊁N-氧化槐根碱㊁右旋别苦参碱㊁右旋异苦参碱㊁右旋槐花醇㊁(+)槐花醇-N-氧化物㊁左旋槐根碱㊁左旋槐胺碱㊁鹰嘴豆素A㊁5,6-去氢白羽扇豆碱等[40-46]㊂哌啶类包括异苦参胺碱[47]和苦参胺碱[48]㊂甾体类生物碱为flavascensine[49]㊂1.3㊀苯丙素类成分㊀近年来,从苦参中分离出的苯丙素类化合物有松柏苷[38],枸橼苦素A㊁B,伞形花内酯,紫丁香苷,(3R,4S)-6,4ᶄ,-二羟基-7-甲氧基香豆素,7-甲氧基香豆素[39],5ᶄ-甲氧基-二氢去氢二愈创木基,二氢去氢二愈创木基[50],(+)-紫丁香树脂酚,(3R,4S)-6,4ᶄ-5,7,3ᶄ,5ᶄ-四甲氧基-3,4-二氢芳基柰二酸-(二)-十六烷酯[36],芥子酸[51]㊂1.4㊀萜类及甾醇类成分㊀从苦参中分离出的萜类成分有大豆皂苷㊁苦参皂苷Ⅰ㊁Ⅱ㊁Ⅲ㊁Ⅳ㊁羽扇豆烯酮㊁β-香树酯醇[52]㊂甾醇类有β-谷甾醇和大豆甾醇B[51]㊂1.5㊀其他成分㊀除上述成分外,苦参中还含有脂肪酸类㊁醌类以及氨基酸类物质[52],牛克彦等[53]利用GC-MS分析得到12个脂肪酸,其中亚麻酸和亚油酸为人体必需脂肪酸,且含量较高㊂醌类如苦参醌A[54]㊂氨基酸主要为脯氨酸和天冬氨酸等十余种[55]㊂2 苦参的药理作用目前,对苦参的基础研究较多,苦参碱与氧化苦参碱的抗炎镇痛,抗肿瘤[2]的效果显著,现将苦参中活性成分的药理作用概括如下㊂2.1㊀抗炎镇痛㊀钱利武[56]等研究结果发现,苦参碱能有效缓解小鼠耳廓肿胀,40mg/kg的苦参碱能有效减少小鼠扭体次数并缓解因醋酸刺激腹腔黏膜引起的疼痛反应,苦参具有一定的抗炎镇痛作用㊂据报道[57],苦参中的黄酮类化合物能抑制慢性炎症反应和抑制促炎分子COX-2,iNOS和IL-6,在一定程度上有助于体内的抗炎活性,表明其可能有治疗风湿性关节炎等慢性炎症性疾病的潜力㊂2.2㊀抗肿瘤㊀据报道[58],苦参总黄酮是抗肿瘤的有效药物,其能够有效抑制小鼠H22肝癌㊁Lewis肺癌㊁S180肉瘤生长,同时使人非小细胞肺癌H460和人食管癌Eca-109裸小鼠移植肿瘤生长缓慢㊂从苦参中分离的去甲基羟色胺,通过抑制增殖,迁移和侵袭,在U87MG细胞中显示出抗肿瘤活性[59]㊂氧化苦参碱通过改变细胞周期和凋亡调节因子的表达,有效抑制恶性胶质瘤细胞的增殖和侵袭,促进其凋亡,为恶性胶质瘤提供了一种新的治疗策略[60]㊂2.3㊀对免疫系统的影响㊀呙爱秀等[61]通过给免疫低下小鼠注射苦参碱,发现其能增强网状内皮系统吞噬廓清能力,抑制T淋巴细胞酯酶染色率,增强免疫低下小鼠非特异性免疫,并明显抑制其细胞免疫㊂有研究表明[62],苦参多糖参与了体外的免疫调节作用,表现出强大的免疫增强特性,如增强腹膜巨噬细胞的吞噬活性,提高NO的产量并激活iNOS活性㊂2.4㊀抑菌作用㊀杜思邈等[63]研究发现苦参总黄酮和总生物碱提取物对金黄色葡萄球菌,大肠埃希菌,白色葡萄球菌等菌株具有抑菌及杀菌作用㊂孙磊等[64]通过药敏实验发现,苦参总生物碱抑菌作用强于各单体生物碱,且对金黄色葡萄球菌的抑菌效果最强㊂李媛媛等[65]对氧化苦参碱的抑菌活性进行检测,结果显示氧化苦参碱可以抑制大肠埃希菌的生长,其抑菌作用可随氧化苦参碱用药时间的增长与用药剂量的增加而增强㊂张爱君等[66]采用液体稀释法研究氧化苦参碱对耐甲氧西林葡萄球菌和甲氧西林敏感金黄色葡萄球菌的作用,结果显示氧化苦参碱对两者均有抑菌作用,体外抗菌活性很高㊂2.5㊀抗病毒作用㊀病毒由一种核酸分子(DNA或RNA)与蛋白质构成或仅由蛋白质构成(如朊病毒)㊂陈佳欣[67]报道,这4种苦参碱类生物碱在100㊁200mg/L浓度时能抑制HepG-2.2.15分泌HBsAg㊁HBeAg和细胞内乙肝病毒的DNA复制,其中槐定碱抗乙肝病毒作用优于氧化苦参碱㊁苦参碱和槐果碱,也优于同浓度的拉米夫定,且氧化苦参碱更为安全㊁有效㊂2.6㊀其他㊀此外,苦参中活性成分还有多种其他药理作用㊂2014年,Xu等研究人员[68]发现硫代苦参碱能够显著抑制肝纤维化的形成,并且能够降低相关联的蛋白激酶B(ProteinKinaseB,Akt)的磷酸化㊂肖瑛等[69]研究表明氧化苦参碱可抑制大鼠的血糖上升,能够预防因糖尿病引发的并发症㊂JeongGS[70]等检测苦参薰衣草基黄烷酮(2S)-2ᶄ-甲氧基苦参酮㊁槐黄烷酮G对谷氨酸诱导的小鼠海马神经元细胞系中HT22细胞永生化细胞氧化应激的保护作用,结果表明,苦参中黄酮化合物可能经由HO-1的诱导作用对谷氨酸所致神经毒性产生保护作用㊂3 苦参的加工炮制方法苦参传统炮制方法众多,现代多经产地加工后入药[71]㊂3.1㊀加工方法㊀麻印莲等[71]研究发现产地加工方法在苦参饮片加工炮制过程中能够缩短的软化时间,维持饮片质量的稳定,是一种满足饮片规范化生产的优良炮制方法㊂岳琳等[72]比较了苦参一体化加工与传统加工方式生产的饮片功效,发现两者在解热和抗炎等方面存在相似性,而且一体化加工方式缩短了生产周期并保证了饮片质量,有效地规范了苦参饮片的生产,具有广泛应用推广价值㊂3.2㊀切制㊀传统的苦参炮制工艺多以少泡多润为原则,会导致其质量良莠不齐,临床疗效产生差异[73]㊂李月侠[74]等通过正交实验设计得出苦参最佳切制工艺为浸泡30min,闷润至透,切片厚度3mm,干燥温度为80ħ㊂此工艺能够有效保证苦参饮片的质量㊂3.3㊀炒制㊀江海燕[75]等研究表明苦参炮制品中以炒炭品的苦参碱含量最高,生品含量最低;氧化苦参碱以生品含量最高,而炒炭品含量最低㊂常楚瑞[76]等对苦参不同炮制品的生物总碱含量进行测定,并建立苦参生物碱HPLC指纹图谱,发现不同炒制方法会影响苦参生物碱的含量,其中麸炒有利于苦参生物碱的提取,炒炭使生物总碱含量降低;HPLC结果表明苦参生品及7种炮制品之间指纹图谱存在一定差异,主要表现在化学成分含量的增加或者减少,说明苦参不同炮制方法对其含主要化学成分只有量变无质变影响,可以为苦参炮制工艺的优化提供参考依据㊂3.4㊀醋制㊀研究人员[77]发现口服使用苦参生品的乙醇提取物具有急性口腔毒性特征,采用酒制和醋制苦参的方法可减轻这种毒性作用,实验证明炮制过的苦参乙醇提取物因降低其金雀花碱的含量而提高临床应用㊂3.5㊀酒炙㊀夏艺等[78]采用HPLC法测定酒炙苦参中苦参碱㊁氧化槐果碱㊁氧化苦参碱三种生物碱的含量,结果表明酒炙苦参饮片与苦参饮片相比,苦参碱和氧化槐果碱的含量变化不明显,但氧化苦参碱的含量明显减低,说明酒炙对苦参中生物碱成分的含量确有影响,并且有必要对酒炙苦参饮片进行质量控制,但这种含量与药性之间的相关性尚待进一步研究㊂4㊀展㊀望国内外的研究人员对苦参的化学成分,药理作用等进行了大量研究,取得了一定的成果,人们对苦参的需要也越来越多㊂随着苦参需求量的日益增加,苦参资源的保护也应被重视㊂为此,建立规范化栽培种植基地是保护苦参资源的有效手段之一㊂苦参药理活性的研究应该与中医理论相结合,从苦参多种化学成分中找到苦参传统功效的物质基础,如苦参的清热燥湿的活性成分㊁杀虫和利尿作用的物质基础等及其生物碱生物活性研究的范围,也提高了其生物活性研究的意义和价值㊂此外,还需加强对苦参的质量控制㊂首先,加强对苦参药材及其饮片质量的监督管理,制定苦参药材栽培种植㊁采收加工㊁炮制与储藏的生产管理规范㊂因此,我们需要在中医药理论的指导下,加强对苦参活性成分,药理作用及炮制方法的研究,合理开发资源,推动中医药产业的蓬勃发展㊂参考文献:[1]㊀中国科学院‘中国植物志“编辑委员会.中国植物志,第40卷[S].EditorialBoardoftheChineseFloraoftheChineseAcademyofSciences.FloraofChina,Volume40[S].[2]㊀国家药典委员会.中国人民共和国药典(一部)[M].北京:中国医药科技出版社,2015:203.ChinesePharmacopoeiaCommission.PharmacopoeiaofthePeo⁃pleᶄsRepublicofChina(PartI)[M].Beijing:ChinaMedicalScienceandTechnologyPublishingHouse,2015:203.[3]㊀WuY,ShaoQ,ZhenZ,etal.Determinationofquinolizidineal⁃kaloidsinSophoraflavescensanditspreparationusingcapillarye⁃lectrophoresis[J].BiomedicalChromatography,2010,20(5):446-450.[4]㊀AslıTetikVardarlı,ZekeriyaDüzgün,ErdemC,etal.MatrineinducedG0/G1arrestandapoptosisinhumanacuteT-celllym⁃phoblasticleukemia(T-ALL)cells[J].Bosnianjournalofbas⁃icmedicalsciences/Udruzenjebasicnihmediciniskihznanosti=AssociationofBasicMedicalSciences,2017,18(2):141-149.[5]㊀WengZ,ZengF,ZhuZ,etal.ComparativeanalysisofsixteenflavonoidsfromdifferentpartsofSophoraflavescensAit.byultrahigh-performanceliquidchromatography-tandemmassspec⁃trometry.[J].JournalofPharmaceutical&BiomedicalAnalysis,2018,156:214-220.[6]㊀李丽杰,李冬梅,侯言凤.苦参炮制方法的探讨[J].黑龙江医药科学,2000,23(6):28-29.LiLJ,LiDM,HouYF.Studyontheprocessingmethodofso⁃phoraflavescens[J].HeilongjiangMedicineandPharmacy,2000,23(6):28-29.[7]㊀李丹,左海军,高慧媛,等.苦参的化学成分[J].沈阳药科大学学报,2004,21(5):346-348.LiD,ZuoHJ,GaoHY,etal.Studyonthechemicalconstitu⁃entsofSophoraflavescensAit.[J].JShenyangPharmUniv,2004,21(5):346-348.[8]㊀HeX,FangJ,HuangL,etal.SophoraflavescensAit.:Tradi⁃tionalusage,phytochemistryandpharmacologyofanimportanttraditionalChinesemedicine.[J].JournalofEthnopharmacolo⁃gy,2015,172:10-29.[9]㊀陈磊,刘怡,梁生旺.苦参化学成分研究[J].广东药学院学报,2011,27(5):471-473.ChenL,LiuY,LiangSW.StudyonchemicalconstituentsfromSophoraflavescens[J].JournalofGuangdongPharmaceuticalCollege,2011,27(5):471-473.[10]MamgainS.PhenologicalobservationandconservationofSophoramollisRoyle(Papilionaceae)anendangeredmulti-purposeleg⁃umeofNorthWestHimalaya[J].Taiwania,1999,44(1):137-144.[11]HoonKJ,SookCI,KangSY,etal.KushenolAand8-pre⁃nylkaempferol,tyrosinaseinhibitors,derivedfromSophoraflaves⁃cens[J].JournalofEnzymeInhibitionandMedicinalChemistry,2018,33(1):1048-1054.[12]WuLJ,MiyaseT,UenoA,etal.StudiesontheconstiutentsofSophoraflavescensAit.II[J].ChemPharmBull,1985,33(8):3231-3236.[13]PuLP,ChenHP,CaoMA,etal.TheantiangiogenicactivityofKushecarpinD,anovelflavonoidisolatedfromSophoraflaves⁃censAit[J].LifeSciences,2013,93(21):791-797.[14]HwangJS,LeeSA,HongSS,etal.Monoamineoxidaseinhib⁃itorycomponentsfromtherootsofSophoraflavescens[J].Ar⁃chivesofPharmacalResearch,2005,28(2):190-194.[15]KuroyanagiM,ArakawaT,HirayamaY,etal.AntibacterialandantiandrogenflavonoidsfromSophoraflavescens.[J].JournalofNaturalProducts,1999,62(12):1595-1599.[16]HatayamaK,KomatsuM.StudiesontheconstituentsofSophoraspecies.V.contituentsoftherootofSophoraangustifoliaSiebetZucc.(2)[J].ChemPharmBull,1971,19(10):2126-2131.[17]KyogokuK,HatayamaK,KomastuM.ConstituentsofaChinesecrudedrugKushen(therootofSophoraflavescens).Isolationoffivenewflavonoidsandformononetin[J].ChemPharmBull,1973,21(12):2733-2738.[18]YuQ,ChengN,NiX.Identifying2prenylflavanonesaspoten⁃tialhepatotoxiccompoundsintheethanolextractofSophorafla⁃vescens.[J].JournalofFoodScience,2014,78(11):1830-1834.[19]姚丽,张东,易红,等.野生与栽培苦参药材的黄酮含量比较[J].中国实验方剂学杂志,2017,23(12):58-64.YaoL,ZhangD,YiH,etal.ComparisonofFlavonoidsinCulti⁃vatedandWildSophoraeFlavescentisRadix[J].ChineseJournalofExperimentalFormulas,2017,23(12):58-64.[20]刘怡,孟江,陈磊.苦参黄酮类成分HPLC指纹图谱研究[J].中药新药与临床药理,2013,24(03):282-285.LiuY,MengJ,ChenL.StudyonHPLCFingerprintofFla⁃vonoidsinRadixSophorae[J].TraditionalChinesemedicineandclinicalpharmacology,2013,24(03):282-285.[21]何常明.苦参和山豆根黄酮类成分及其生物活性的比较研究[D].复旦大学,2010.HeCM.ComparativeStudiesonFlavonoidsandtheirBioactivi⁃tiesofSophoraFlavescensandS.tonkinensis[D].FudanUniver⁃sity,2010.[22]ShenCC,LinTW,HuangYL,etal.PhenolicConstituentsoftheRootsofSophoraflavescens[J].JNatProd,2006,69(8):1237-1240.[23]李巍,梁鸿,尹婷,等.中药苦参主要黄酮类成分的研究[J].药学学报,2008,43(8):833-837.LiW,LiangH,YinT,etal.MainflavonoidsfromSophorafla⁃vescenes[J].JournalofPharmacy,2008,43(8):833-837.[24]刘鹏飞,邓天昇,侯相林,等.苦参黄酮的提取及其抗氧化能力研究[J].日用化学工业,2011,41(3):200-203.LiuPF,DengTS,HouXL,etal.Antioxidantactivityinex⁃tractsfromSophoraflavescens[J].Dailychemicalindustry,2011,41(3):200-203.[25]KangSS,KimJS,SonKH,etal.AnewprenylatedflavanonefromtherootsofSophoraflavescens[J].Fitoterapia,2000,71(5):511-515.[26]ZhuH,YangYN,FengZM,etal.SophoflavanonesAandB,twonovelprenylatedflavanonesfromtherootsofSophoraflaves⁃cens[J].BioorganicChemistry,2018,79:122-125.[27]HuangR,LiuY,ZhaoLL,etal.AnewflavonoidfromSophoraflavescensAit.[J].NaturalProductResearch,2017,31(19):2228-2233.[28]ShiYR,LeeHS,KimYK,etal.DeterminationofisoprenylandlavandulylpositionsofflavonoidsfromSophoraflavescensbyNMRexperiment[J].ArchivesofPharmacalResearch,1997,20(5):491-495.[29]Cortés,Edwar,Méndez,Luciana,MataEG,etal.Synthesisof3-aryl-1,2,4-benzotriazinesviaintramolecularcyclizationofsolid-supportedo-hydrazidoanilines[J].MolecularDiversity,2012,16(4):839-846.[30]ZhangL,LiangX,XiaoSS,etal.CharacterizationofflavonoidsintheextractofSophoraflavescensAit.byhigh-performanceliq⁃uidchromatographycoupledwithdiode-arraydetectorandelec⁃trosprayionizationmassspectrometry[J].JournalofPharmaceuti⁃cal&BiomedicalAnalysis,2007,44(5):1019-1028.[31]曹美爱.苦参化学成分及生物活性研究[D].兰州大学,2007.CaoAM.StudiesonthechemicalconstituentsandbiologicalofSophoraflavescensAition[D].LanzhouUniversity,2007.[32]HuK,ZhangJY,ZanK,etal.Qualitativeandquantitativee⁃valuationofMicroctisFolium(theleavesofMicrocospaniculataL.)byhighperformanceliquidchromatographycoupledwithdi⁃odearraydetectionandelectrosprayionizationtandemmassspec⁃trometry[J].AnalyticalMethods,2014,6(17):6850-6859.[33]ZhuXN,CaoWW,LiMJ.PreparativeSeparationofFlavonesfromSophorajaponicabyHigh-SpeedCounter-currentChro⁃matography[J].NaturalProductResearch&Development,2012,24:1833-1836.[34]ShinHJ,KimHJ,KwakJH,etal.APrenylatedFlavonol,Sophoflavescenol:APotentandSelectiveInhibitorofcGMPPhos⁃phodiesterase5[J].BioorganicandMedicinalChemistryLetters,2002,12(17):2313-2316.[35]丁佩兰,陈道峰.苦参酚性成分的研究[J].亚太传统医药,2005(3):79-83.DingPL,ChenDF.StudiesonPhenolicComponentsofSophoraflavescens[J].Asia-PacificTraditionalMedicine,2005(3):79-83.[36]赵月珍.苦参化学成分及质量控制研究[D].中南大学,2008.ZhaoYZ.StudiesonChemicalConstituentsandQualityControlofSophoraflavescensAit[D].CentralSouthUniversity,2008.[37]刘斌,石任兵.苦参汤乙醇提取物中黄酮部位的化学成分[J].北京中医药大学学报,2007,30(4):263-267.LiuB,ShiRB.Chemicalprinciplesinflavonoidfractionofalco⁃holextractfromKushenDecoction[J].JournalofBeijingUniver⁃sityofTraditionalChineseMedicine,2007,30(4):263-267.[38]张翅,李安平.苦参中非生物碱类成分研究[J].中国中药杂志,2013,38(20):3520-3524.ZhangC,LiAP.Non-alkaloidcomponentsfromSophorafla⁃vescens[J].ChinaJournalofChineseMateriaMedica,2013,38(20):3520-3524.[39]张昌浩,白龙义明,李镐.苦参化学成分研究[J].延边大学医学学报,2010,27(4):471-473.ChenL,LiuY,LiangSW.StudyonthechemicalconstituentsoftheSophoraflavescensAit[J].JournalofMedicalScienceYan⁃bianUniversity,2010,27(4):471-473.[40]LiD,LiF,WangL,etal.TheChineseherbalmedicineSophoraflavescensactivatespregnaneXreceptor.[J].DrugMetabolism&DispositiontheBiologicalFateofChemicals,2010,38(12):2226-2231.[41]黄琦,屈玟珊,高世军,等.苦参生物碱和黄酮体外抑菌活性比较[J].广东药科大学学报,2016,32(5):577-581.HuangQ,QuWS,GaoSJ,etal.Comparisonofinvitroanti⁃bacterialactivityofalkaloidsandflavonoidsofSophoraflavescensAit[J].JournalofGuangdongPharmaceuticalUniversity,2016,32(5):577-581.[42]林定威.苦参根部化学成分分析[D].中原大学,2006.LinDW.AnalysisofChemicalConstituentsinRootsofSophoraflavescens[D].chungyuanchristianuniversity,2006.[43]胡艳丽,郭丽,贾晓红.苦参总碱分离纯化方法的研究[J].食品科学,2007,28(01):32-36.HuYL,GuoL,JiaXH.StudyonSeparationandPurificationTechnologyofSophoraalopecuroidesL.[J].foodscience,2007,28(01):32-36.[44]徐铭泽.苦参生物碱分离纯化工艺研究[D].哈尔滨商业大学,2015.XuMZ.StudyonSeparationandPurificationprocessoftotalal⁃kaloidsfromSophoraflavescensAit[D].HarbinUniversityofCommerce,2015.[45]张黄琴,朱振华,钱大玮,等.山西产苦参花中生物碱类和黄酮类成分的分析与评价[J].中国中药杂志,2016,41(24):4621-4627.ZhangHQ,ZhuZH,QianDW,etal.AnalysisandevaluationofalkaloidsandflavonoidsinflowerofSophoraflavescensfromShanxiprovince[J].ChineseJournalofTraditionalChineseMedicine,2016,41(24):4621-4627.[46]付起凤,曹琦,吕邵娃,等.正交法优化苦参中苦参生物碱的超声提取工艺[J].中医药信息,2015,32(01):11-13.FuQF,CaoQ,LvSW,etal.OrthogonalOptimizationofUltra⁃sonicExtractionTechnologyofSophoraAlkaloidinRadixSopho⁃raeFlavescentis[J].InformationofTraditionalChineseMedi⁃cine,2015,32(01):11-13.[47]LiWH,WangYZ,LuoSX,etal.Studyontransdermalmech⁃anismofSophoraflavescensalkaloidsnanoemulsionsandnanoe⁃mulsion-basedgels[J].ChineseTraditional&HerbalDrugs,2017,48(3):484-489.[48]张爱华,张悦晗.高效液相色谱法同时分离测定氧化苦参碱㊁槐定碱㊁槐胺碱㊁苦参碱㊁槐果碱[J].药物分析杂志,2008,28(06):964-966.ZhangAH,ZhangYH.HPLCSimultaneousSeparationandde⁃terminationofSophoridine,Matrine,oxymatrine,Sophoramine,Sophocarpine[J].JournalofPharmaceuticalAnalysis,2008,28(06):964-966.[49]LiuXJ,CaoMA,LiWH,etal.AlkaloidsfromSophoraflaves⁃censAition[J].Fitoterapia,2010,81(6):524-527.[50]李小珍,晏永明,庄小翠,等.云南寻甸产臭参中化学成分研究[J].天然产物研究与开发,2017,29(11):1858-1866.LiXZ,YanYM,ZhuangXC,etal.CompoundsfromCodo⁃nopsispilosulaProducedinXundianofYunnanProvince[J].ResearchandDevelopmentofNaturalProducts,2017,29(11):1858-1866.[51]张俊华,赵玉英,刘沁舡.苦参化学成分的研究[J].中国中药杂志,2000,25(1):37-39.ZhangJH,ZhaoYY,LiuQC.StudiesontheChemicalCon⁃stituentsfromSophoraflavescensAit[J].ChinaJournalofChi⁃neseMateriaMedica,2000,25(1):37-39.[52]孙保帅,杨君,赵文杰.苦参子仁油的理化特性及脂肪酸组成分析[J].粮油加工,2009(09):59-60.SunBS,YangJ,ZhaoWJ.PhysicochemicalPropertiesandFat⁃tyAcidCompositionofSophoraflavescensSeedOil[J].Grainandoilprocessing,2009(09):59-60.[53]牛克彦,赵保堂,王俊龙,等.苦参脂肪酸组成成分的GC-MS分析[J].甘肃科技,2009,25(4):57-59.NiuKY,ZhaoBT,WangJL,etal.AnalysisofFattyAcidsinSophoraflavescensbyGC-MS[J].GansuScienceandTechnol⁃ogy,2009,25(4):57-59.[54]郭智.基于UPLC-ESI-QTof的山豆根㊁苦参化学成分比较及柴胡不同提取方法柴胡皂苷a㊁d变化的研究[D].北京协和医学院,2014.GuoZ.StudiesonchemicalconstituentsofS.tonkinensisandS.flavescens,andTransformationofSaikosaponina,dinDifferentExtractingMethodbyUsingUPLC-ESI-QTof[D].PekingU⁃nionMedicalCollege,2014.[55]马志刚,鄢波,黄兴奇,等.苦参凝集素蛋白基因的分离克隆(英文)[J].植物学报(英文版),2001,43(8):821-825.MaZG,YanB,HuangXQ,etal.CloningandSequencingofaLectinProteinGenefromtheRootsofSophoraflavescens[J].JournalofBotany(EnglishEdition),2001,43(8):821-825.[56]钱利武,戴五好,周国勤,等.苦参及山豆根主要生物碱镇痛抗炎作用研究[J].中成药,2012,34(8):1593-1596.QianLW,DaiWH,ZhouGQ,etal.Analgesicandanti-in⁃flammatoryeffectsofmainalkaloidsfromSophoraflavescensandSophorajaponicaroot[J].Chinesepatentmedicine,2012,34(8):1593-1596.[57]JinJH,KimJS,KangSS,etal.Anti-inflammatoryandanti-arthriticactivityoftotalflavonoidsoftherootsofSophorafla⁃vescens[J].JournalofEthnopharmacology,2010,127(3):589-595.[58]蒋征奎,李晓,张新峰.中药苦参在小鼠体内的抗肿瘤作用[J].陕西中医,2018,39(03):279-281.JiangZK,LiX,ZhangXF.Antitumoreffectofradixsophoraeflavescensinmice[J].ShaanxiTraditionalChineseMedicine,2018,39(03):279-281.[59]KangCW,KimNH,JungHA,etal.DesmethylanhydroicaritinisolatedfromSophoraflavescens,showsantitumoractivitiesinU87MGcellsviainhibitingtheproliferation,migrationandinva⁃sion[J].EnvironmentalToxicology&Pharmacology,2016,43:140-148.[60]ZhiboD,LigangW,XiaoxiongW,etal.Oxymatrineinducescellcyclearrestandapoptosisandsuppressestheinvasionofhu⁃manglioblastomacellsthroughtheEGFR/PI3K/Akt/mTORsig⁃nalingpathwayandSTAT3[J].OncologyReports,2018,40(2):867-876.[61]呙爱秀,黄兴国,雷黎明.苦参碱对免疫功能低下小鼠免疫功能的影响[J].中国现代药物应用,2008,2(11):7-9.GuoAX,HuangXG,LeiLM.ImmunologicalFunctionsAf⁃fectedbyMatrineinImmunocompromisedMice[J].ModernChi⁃nesedrugapplication,2008,2(11):7-9.[62]BaiL,ZhuLY,YangBS,etal.Antitumorandimmunomodu⁃latingactivityofapolysaccharidefromSophoraflavescensAit[J].InternationalJournalofBiologicalMacromolecules,2012,51(5):705-709.[63]杜思邈,马丽强,孙俊杰,等.苦参提取物体外抗菌实验研究[J].中医药学报,2010,38(3):74-76.DuSM,MaLQ,SunJJ,etal.StudyoninvitroAntibacterialActivityofExtractsfromSophoraflavescensAit[J].JournalofTraditionalChineseMedicine,2010,38(3):74-76.[64]孙磊,郭江玉,闫彦,等.苦参化学成分及其生物碱抑菌活性研究[J].辽宁中医药大学学报,2017(11):51-55.SunL,GuoJY,YanY,etal.StudyontheChemicalConstitu⁃entsandAntibacterialActivityofRadixSophora[J].JournalofLiaoningUniversityofTraditionalChineseMedicine,2017(11):51-55.[65]李媛媛,阎旭,李墨林,等.氧化苦参碱体外抑菌活性的研究[J].中国微生态学杂志,2012,24(3):244-245.LiYY,YanX,LiML,etal.Studyonthebacteriostasiseffectofoxymatrineinvitro[J].ChineseJournalofMicroecology,2012,24(3):244-245.[66]张爱君,赵清国,哈丽娜,等.氧化苦参碱对耐甲氧西林金黄色葡萄球菌体外抗菌活性的实验研究[J].包头医学院学报,2013(3):11-13.ZhangAJ,ZhaoQGHaLN,etal.AnExperimentalStudyofInVitroAntibacterialEffectsofOxymatrine(OMT)againstMe⁃thicillin-resistantStaphylococcusAureus[J].JournalofBaotouMedicalCollege,2013(3):11-13.[67]陈佳欣.苦参碱类生物碱抗乙型肝炎病毒作用及其机制研究[D].2016.ChenJX.Theresearchoftheanti-hepatitisBviruseffectandmechanismofMatrinealkaloids[D].2016.[68]XuWH,HuHG,TianY,etal.BioactivecompoundrevealsanovelfunctionforribosomalproteinS5inhepaticstellatecellacti⁃vationandhepaticfibrosis.[J].Hepatology,2014,60(2):648-660.[69]肖瑛,曾令萍,张莹莹,等.氧化苦参碱对糖尿病大鼠肾组织TLR4及炎症因子表达的影响[J].中国现代医学杂志,2018,28(5):11-17.XiaoY,ZenLP,ZhangYY,etal.Effectofoxymatrineonex⁃pressionsofTLR4andinflammatoryfactorsinkidneytissueofdi⁃abeticrats[J].ChinaJournalofModernMedicine,2018,28(5):11-17.[70]JeongGS,LiB,LeeDS,etal.LavandulylFlavanonesfromSo⁃phoraflavescensProtectMouseHippocampalCellsagainstGluta⁃mate-InducedNeurotoxicityviatheInductionofHemeOxygen⁃ase-1[J].Biological&PharmaceuticalBulletin,2008,31(10):1964-1967.[71]麻印莲,李丽,张村,等.苦参饮片产地加工方法探讨[J].中国实验方剂学杂志,2011,17(16):57-59.MaYL,LiL,ZhangC,etal.ResearchonHabitatProcessesMethodofSophoraflavescens[J].ChinJExpTraditMedForm,2011,17(16):57-59.[72]岳琳,王岚,刘颖,等.产地加工与饮片炮制一体化对苦参饮片主要功效的影响[J].中国实验方剂学杂志,2017(12):31-35.YueL,WangL,LiuY,etal.EffectofIntegrationofHabitatProcessingandPiecesProcessingonMainEfficiencyofSophoraeFlavescentisRadixProducts[J].ChinJExpTraditMedForm,2017(12):31-35.[73]邓捷圆,胡馨,张英华,等.正交设计法优选苦参炮制工艺的研究[J].中成药,2011,33(7):1206-1208.DengJY,HuX,ZhangYH,etal.StudyonOptimumProcess⁃ingTechnologyofSophoraflavescensbyOrthogonalDesign[J].Chinesepatentdrug,2011,33(7):1206-1208.[74]李月侠,吴飞,金传山.正交法优选苦参切制工艺研究[J].亚太传统医药,2015,11(2):34-36.LiYX,WuF,JinCS.StudyonOptimumCuttingTechnologyofSophoraflavescensbyOrthogonalMethod[J].Asia-PacificTraditionalMedicine,2015,11(2):34-36.[75]江海燕,陈勇,张辉.苦参不同炮制品中苦参碱和氧化苦参碱含量测定[J].中成药,2001(3):31-33.JiangHY,ChenY,ZhangH.DeterminationofMatrineandOxrmatrineinDifferentProductsofRadixSophoraeFlavescentis[J].Chinesepatentdrug,2001(3):31-33.[76]常楚瑞,陆平祝,龙庆德,等.苦参不同炮制品生物总碱含量测定及HPLC指纹图谱研究[J].中国民族民间医药杂志,2018,27(4):14-17.ChangCR,LuPZ,LongQD,etal.ResearchonContentsAl⁃kaloidsandHPLCFingerprintsofDifferentProcessedSophorafla⁃vercensAit[J].ChineseJournalofEthnomedicineandEthno⁃pharmacy,2018,27(4):14-17.[77]ZhangC,JieC,ZhangJ,etal.DifferentprocessingmethodschangetheoraltoxicityinducedbySophoraalopecuroidesseedsandthecontentsoffivemaintoxicalkaloidsfromtheethanolex⁃tractsdeterminedbyavalidatedUHPLC–MS/MSassay[J].RevistaBrasileiraDeFarmacognosia,2018,10(2):1-8.[78]夏艺,毛芬兰,向苏,等.HPLC法测定酒炙苦参中三种生物碱的含量[J].中国药师,2018,21(1):146-148.XiaY,MaoFL,XiangS,etal.DeterminationofThreeAlka⁃loidsinWine-processedSophoraFlavescensbyHPLC[J].Chi⁃naPharm,2018,21(1):146-148.(编辑:陈希)。
苦参注射液的研究概况.

苦参注射液的研究概况苦参注射液的主要成分为氧化苦参碱,还含有极少量的氧化槐果碱[1]。
该生物碱源于豆科槐属植物苦参(Sophorae flavescents Ait)的干燥根,即中药苦参(radix sophorae flavescents),我国各地均产,为常用中药,性寒,味苦。
具有清热、杀毒、利尿的功效。
现常用于细菌性痢疾、心率失常、皮肤病、肝病等的[2]。
1 化学成分及理化性质:苦参所含化学成分主要有生物碱和黄酮类化合物,生物碱主要有苦参碱(matrine)和氧化苦参碱(oxymaatrine),此外还有羟基苦参碱(hydroxymatrine)、N-甲基金雀花碱(N-methylcytisine)、去氢苦参碱(sophocarpin)、槐根碱等。
从苦参分离的黄酮类化合物已有32种,多数为二氧黄酮和二氢黄酮醇类,少数为黄酮类、黄酮醇类、异黄酮类、查耳酮类和双环系黄酮类[3]。
氧化苦参碱为无色正方体状结晶(丙酮),熔点为207~208℃(分解)。
含一分子结晶水的氧化苦参碱的熔点为77~78℃。
氧化苦参碱为苦参碱的N-氧化合物,具有氮氧半极性配位键,其亲水性比苦参碱更强,易溶于水,难溶于乙醚[4]。
2 药理作用:近年来,在对氧化苦参碱大量的药理和临床研究中,人们发现其具有抗毒、抗炎、抗肿瘤作用及对中枢神经系统的镇静、镇痛解热降温作用和强心、降压、抗心率失常等多种药理作用特别是对慢性肝炎的治疗取得很好的疗效,且不良反应较少[5],该制剂已被广泛应用于临床。
2.1 抗病毒:苦参具有明显的抗肝炎病毒作用。
宋宝君[6]将120例慢性乙型肝炎患者随机分为对照组和治疗组。
对照组患者单纯给予常规保肝药物治疗;治疗组在给予常规保肝药物治疗的同时加用苦参素治疗。
观察两组患者临床疗效及肝功能、纤维化指标、HBV-M、HBV-DNA定量情况。
结果对照组总有效率为66.7%,治疗组为85%,两组比较有显著性差异(P<0.05)。
苦参药理学研究新进展

苦参药理学研究新进展苦参是一种常见的传统中药材,来自于苦参科草本植物,其种子可用于制备中药苦参等。
已有许多研究显示,苦参具有抗炎、解毒、抗氧化、抗肿瘤等生物学活性,广泛应用于肿瘤、炎症和感染等疾病的治疗。
本文将介绍苦参在这些领域的新研究进展。
抗炎作用苦参具有显著的抗炎作用,近年来越来越多的研究发现,苦参中一些化合物能够通过调节免疫系统和炎症反应来发挥其抗炎作用。
其中青酸乙酯(MAT)是一种由苦参种子提取的化合物,已被证明具有明显的抗炎活性。
研究表明,MAT可抑制亚硝酸盐诱导的人多形核白细胞(PMN)和巨噬细胞的氧化突发反应(ROS)和超氧化物歧化酶(SOD)活性,有效减轻炎症反应。
此外,MAT还可以通过抑制NF-κB 和MAPK 信号通路来抑制炎症反应。
解毒作用苦参有明显的解毒作用,它能够减少化学物质、生物毒素和放射性物质等毒素对人体的危害。
苦参中的苦参碱是其解毒作用的关键物质。
苦参碱能够通过丝裂原活化蛋白激酶(MAPK)信号通路来诱导巨噬细胞内的草酰乙酰辅酶 A 合酶(ACSL)的表达,从而调节NF-κB 和p38 MAPK 信号通路,从而减少毒素对细胞的损伤和死亡。
抗氧化作用抗氧化作用是苦参另一个重要的生物学活性,它可以通过清除自由基、减少氧化应激和维持内环境稳定性等多种途径减少氧化性损伤。
研究发现苦参种子中的化合物麻黄噻唑啉、绿原酸酯和芸香甙等均具有良好的抗氧化作用。
最近的研究表明,麻黄噻唑啉可以通过激活AMPK信号通路来诱导脂肪酸氧化和线粒体能量代谢,从而增加线粒体数量和活力,并减少细胞脂质和蛋白质的氧化,表明其具有很强的抗氧化作用。
抗肿瘤作用苦参具有广泛的抗肿瘤活性,研究表明,苦参中的苦参酮、青金酚、白色素和咖啡酸等成分具有抗肿瘤作用。
苦参中的化合物能够通过抑制细胞生长、诱导细胞凋亡、阻止细胞周期进展等多种途径来发挥抗肿瘤作用。
其中,苦参酮具有很强的抗癌活性,可以通过抑制血管生成和调节肿瘤微环境来防止肿瘤生长和扩散。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
苦参的化学成分和药理作用研究进展标签:苦参;化学成分;药理作用;研究进展1化学成分1.1生物碱类苦参生物碱大多数是喹诺里西啶类,极少数为双哌啶类。
已从苦参中分离出生物碱41个,按其骨架类型分为以下几种:苦参碱型30个,金雀花碱型3个,臭豆碱型4个,羽扇豆碱型1个,双哌啶型2个,以及l,4二氮杂茚满型1个。
主要包括苦参碱、氧化苦参碱、羟基苦参碱、槐定碱、异槐定碱、异苦参碱、别苦参碱、槐果碱、槐胺碱、槐醇、氧化槐醇、异槐果碱、金雀花碱、羽扇豆碱、臭豆碱、黄叶槐碱、苦参胺碱、异苦参胺碱等[1]。
1.2黄酮类到目前为止,苦参中黄酮类化合物共分离得到108个黄酮类化合物,其中大部分化合物的A环上存在有异戊烯基侧链。
多数为二氢黄酮和二氢黄酮醇类,少数为黄酮类、黄酮醇类、异黄酮类、查耳酮类和双环系黄酮类。
按黄酮化合物的骨架来分,主要类型有:二氢黄酮类31个,黄酮醇类12个,二氢黄酮醇类12个,查耳酮类5个,异黄酮类21个,二氢异黄酮类3个,高异黄酮类2个,紫檀素类12个,二聚黄酮类2个和其他黄酮类化合物7个[2]。
1.3脂肪酸类和挥发油类脂肪酸类成分有乙酸甲酯、十二烷酸甲酯、芥子酸十六酯等[3]。
挥发油类有己醛、正壬酸、1-辛烯-5-醇等47个成分,为苦参特殊香气提供了物质参考[4]。
1.4其他类化合物苦参中还含有氨基酸类、糖类、三萜及三萜皂苷类、木脂素类、酚酸类等化学成分[5~7]。
2药理作用2.1对心脏的作用2.1.1抗心律失常韦祎等[8]以乌头碱为参照药物,采用膜片钳全细胞记录技术记录钠离子通道电流(INa),观察不同浓度苦参碱对豚鼠乳头肌细胞钠离子通道电流影响的实验研究表明苦参碱能抑制INa电流,呈浓度依赖性,浓度较高时抑制INa电流作用减弱,表现为双向调节的药理作用。
苦参碱抗心律失常作用具有作用温和、持续时间长的优点。
苦参对心脏具有负性频率负性自律性及负性传导作用,是一种非特异性“奎尼丁样”作用,推测通过影响心肌细胞膜钾钠离子的传递系统,延长其绝对不应期,降低其应激性,从而抑制异位起博点,发挥抗心律失常作用。
王雪芳等[9]通过观察正常灌流液、低镁灌流液和低镁+苦参碱灌流液对豚鼠左心室流出道慢反应自律细胞动作电位0相幅值(APA),50%复极化时间(APD50),90%复极化时间(APD90),4相自动去极速度(Vmax),自发放电率(RPF)的影响,研究苦参碱对低镁诱发豚鼠心律失常的电生理影响及苦参碱抗心律失常作用。
结果显示苦参碱能拮抗低镁诱发的心律失常,提示苦参碱对治疗低镁性左心室流出道慢反应自律细胞异常电生理所诱发的心律失常有显著疗效。
王雪芳等[10]通过观察休克血浆致离体豚鼠心室肌细胞动作电位的影响以及不同浓度苦参碱的影响作用,进一步研究苦参碱对实验性豚鼠心室肌细胞在休克血浆(SP)影响下的电生理效应,以及苦参碱(Matrine)的心肌细胞保护作用。
结果显示休克血浆对豚鼠心室肌细胞动作电位的变化具有明显的影响,苦参碱具有剂量依赖性的干预作用。
更多还原苦参碱对休克血浆致豚鼠心室肌细胞的电生理也有影响,可以明显对抗休克血浆引起的动作电位幅值、超射升高,与其影响细胞内外Na+和Ca2+浓度有关。
2.1.2抗心肌细胞纤维化沈祥春等[11]采用冠状动脉结扎术复制大鼠急性心肌梗死模型,研究氧化苦参碱(OMT)对大鼠急性心肌梗死诱发实验性心肌纤维化的保护作用及对TGF-β-Smads信号通路的影响。
结果提示TGF-β1,TβR1,Smad2,Smad3,Smad4 mRNA表达明显增加,而Smad7 mRNA的表达显著降低,与Sham组比较,差异显著。
结果表明OMT能显著抑制急性心肌梗死8周后诱发的实验性心肌纤维化,抑制TGF-β1,TβR1,Smad2,Smad3,Smad4 mRNA 表达的上调和增加Smad7 mRNA的表达。
显示OMT对急性心肌梗死诱发实验性心肌纤维化具有一定的抑制作用,其作用机制与TGF-β-Smads信号系统密切相关。
2.2抗肿瘤韩思奇[12]通过对180例恶性胸腔积液患者随机分为试验组及对照组,试验组采用复方苦参配合顺铂进行治疗,对照组单纯采用顺铂进行治疗。
试验组患者治疗有效率为87.8%明显高于对照组的55.6%。
试验组患者毒副反应发生例数明显低于对照组(P<0.05);试验组患者治疗后kamofsky评分以及体重提高例数明显高于对照组(P<0.05)。
结论显示对恶性胸腔积液患者采用复方苦参配合顺铂进行治疗可明显改善患者预后,提高患者生存质量。
王晓燕等[13]通过建立可视化大肠癌移植瘤模型,动态观察苦参碱对裸鼠体内SW480-EGFP 实体瘤生长的影响,观察苦参碱(Matrine)对裸鼠的体内抑瘤作用。
研究结果显示苦参碱对裸鼠SW480-EGFP实体瘤具有明显的抑瘤效应,但低剂量苦参碱对裸鼠移植瘤的生长抑制能力较弱,而高剂量则能显著抑制肿瘤生长。
苦参碱高浓度组还可以减缓裸鼠体重下降趋势,提高裸鼠的生存质量。
病理形态学观察显示苦参碱的体内抑瘤活性可能与其能够直接杀死肿瘤细胞,诱导肿瘤细胞凋亡有关。
李海军[14]通过采用倒置显微镜下观察细胞形态学变化;TRAP-ELISA法检测端粒酶活性;免疫细胞化学法检测MCF-7 细胞中Fas、VEGF蛋白表达情况来研究苦参碱对人乳腺癌MCF-7细胞Fas、VEGF及端粒酶活性的影响。
结果表明苦参碱对乳腺癌细胞有明显的生长抑制作用和促凋亡作用,可能是通过上调Fas蛋白表达、抑制端粒酶活性诱导乳腺癌细胞凋亡及通过下调VEGF蛋白表达,抑制肿瘤血管形成等实现的。
尚剑等[15]采用不同浓度苦参碱与顺铂作用于骨肉瘤MG63细胞,用MTT法检测其对MG63细胞增殖抑制来研究不同浓度苦参碱单独或联合顺铂对骨肉瘤细胞MG63细胞增殖的影响以及作用机制。
结果表明苦参碱对骨肉瘤MG63细胞的凋亡有明显的诱导作用,苦参碱不仅能直接杀伤细胞,而且能抑制CaspaSe信号通路,从而抑制肿瘤细胞的增殖,抑制率具有剂量依赖性与时间依赖性。
2.3抗病原微生物尹长江等[16]使用金银花、黄连、黄芩、苦参等10种常见中草药的水提取无菌药液,采用打孔法测定中草药提取液对从临床标本中分离耐甲氧西林金黄色葡萄球菌(MRSA)的抑菌圈大小,通过2倍稀释法测定中草药提取液对MRSA的最小抑菌浓度(MIC)和最小杀菌浓度(MBC)。
结果显示苦参对MRSA临床株具有一定的抗菌作用。
秦静英等[17]采用标准琼脂平板对倍稀释法测定大黄素、黄连素、苦参碱、黄芩苷等对敏感性和耐药性大肠杆菌的最低抑菌浓度(MIC),观察中药提取物对敏感性和耐药性大肠杆茵的抑制作用。
结果显示苦参碱对敏感性大肠杆菌的MIC是64 μg/mL;对耐药性大肠杆菌的MIC是128 μg/mL。
表明苦参碱对敏感性和耐药性大肠杆菌有一定抑制作用。
黄衍强等[18]采用标准琼脂平板对倍稀释法测定大黄素、黄连素、苦参碱、黄芩苷等对耐药幽门螺杆菌的最低抑菌浓度(MIC),检测低于MIC 药物作用菌株后反应孔的吸光度(A)值,并通过共聚焦显微镜观察耐药幽门螺杆菌生物膜形成情况,观察中药提取物对耐药幽门螺杆菌生物膜形成的影响。
结果显示苦参碱对耐药幽门螺杆菌的MIC是128 μg/mL,苦参碱64 μg/mL 时,共聚焦显微镜下生物膜形成明显较少。
提示苦参碱对耐药幽门螺杆菌有抑制作用,浓度<50% MIC 能明显抑制菌株生物膜形成。
邸大琳等[19]表明苦参水煎液对大肠杆菌、金黄色葡萄球菌、甲型链球菌、乙型链球菌、痢疾杆菌、维自痢沙门氏杆菌以及变形杆菌均有明显抑制作用。
2.4抗炎作用张小超等[20]通过小鼠耳廓肿胀、大鼠足跖肿胀模型,观测苦参胶囊抗炎消肿作用,同时检测苦参胶囊对小鼠腹腔毛细血管通透性的影响;运用小鼠热板法及醋酸扭体方法评价苦参胶囊的镇痛作用。
结果扭体试验表明中、高剂量的苦参胶囊明显较少小鼠扭体次数,热板法显示1和2 g/kg的苦参胶囊于给药后60 ~120 min均显著延长小鼠置入圆筒至开始舔后足时间。
小鼠耳廓肿胀法表明高、中剂量的苦参胶囊均明显减轻小鼠耳廓肿胀度;大鼠足跖肿胀模型显示中、高剂量的苦参胶囊于末次给药后1~4 h均可减轻足跖肿胀度。
高、中剂量的苦参胶囊显著降低小鼠腹腔毛细血管通透性。
结论显示苦参胶囊可减轻腹泻和小肠推进,具有镇痛抗炎作用并降低毛细血管通透性。
2.5抗肝损伤作用张玲等[21]报道,苦参素能改善乙肝患者肝纤维化程度,同时对HBV有抑制作用,说明苦参碱具有抗免疫性肝损伤的作用。
实验发现,苦参碱对巨噬细胞、肝枯否细胞分泌的IL-l,IL-6,TNF-α有明显抑制作用,因此苦参碱有抗肝纤维化的作用[22]。
2.6其他作用苦参还具有免疫抑制作用、免疫促进作用、抗过敏作用以及对神经系统的抑制作用[22]。
3小结苦参是中医临床比较常用的中药之一,味苦,性寒,具有清热燥湿、杀虫、利尿等功效。
近年来的研究表明,苦参含有生物碱类、黄酮类、脂肪酸类、挥发油类、氨基酸类、糖类、三萜及三萜皂苷类、木脂素类等多种化学成分,其中主要化学活性成分为苦参碱、氧化苦参碱、黄酮类等化学成分。
苦参的主要药理作用有抗心律失常、抗心肌纤维化、抗肿瘤、抗炎、抗病原微生物、抗肝损伤以及对免疫系统和神经系统的调节作用等。
通过对苦参研究的综述,为该药进一步的开发和研究提供参考。
参考文献:[1]张翅,马悦,高慧敏,等.苦参化学成分研究进展[J].中国实验方剂学杂志,2014,20(4):205-214.[2]姚梅芬,张思巨,李琳,等.苦参中黄酮类成分及其药理作用研究现状[J].中国中医药信息杂志,2013,20(3):110-112.[3]王秀坤,李家实,魏璐雪.苦参中脂肪酸成分的研究[J].中药材,1994,17(5):34-35.[4]王秀坤,李家实,魏璐雪.苦参挥发油成分的研究[J].中国中药杂志,1994,19(9):552~553.[5]曹美爱.苦参化学成分及生物活性研究[D].兰州:兰州大学,2007.[6]赵月珍.苦参化学成分及质量控制研究[D].湖南:中南大学,2008.[7]李丹,左海军,高慧援,等.苦参的化学成分[J].沈阳药科大学学报,2004,21(5):346.[8]韦祎,唐汉庆,李晓华.苦参碱对豚鼠心室肌细胞钠离子通道电流的影响[J].中国实验方剂学杂志,2013,19(20):199-202.[9]王雪芳,刘艳明,马建伟,等.苦参碱对低镁诱发豚鼠左心室流出道心律失常的电生理效应[J].时珍国医国药,2011,22(1):146-147.[10]王雪芳.苦参碱对异丙肾上腺素致豚鼠心律失常的保护作用[C].第十二次中国中西医结合微循环学术会议论文集.南京:中国中西医结合学会,2012.[11]沈祥春,杨钰萍,徐旖旎,等.基于TGF-β-Smads信号的氧化苦参碱干预急性心肌梗死诱发实验性大鼠心肌纤维化的研究[J].中国中药杂志,2012,37(5):632-636.[12]韩思奇.复方苦参配合顺铂胸腔灌注对恶性胸腔积液疗效观察[J].医学临床研究,2013,30(6):1191-1193.[13]王晓燕,梁磊,谢林英,等.苦参碱的体内抑瘤作用及机制研究[J].时珍国医国药,2013,24(4):831-832.[14]李海军,王俊明,田亚汀,等.苦参碱对MCF-7细胞Fas、VEGF及端粒酶活性的影响[J].中国中西医结合杂志,2013,33(9):1247-1251.[15]尚剑,何礼,戴佳伊,等.苦参碱对骨肉瘤MG63细胞凋亡及Caspase蛋白表达的影响[J].中医药学报,2013,4l(4):48-52.[16]尹长江,路国兵,赵长祺,等.常见抗菌中草药对耐甲氧西林金黄色葡萄球菌的抑菌作用[J].时珍国医国药,2013,24(6):1380-1381.[17]秦静英,李晓华,黄衍强,等.中药提取物对敏感性和耐药性大肠杆菌的抑制作用[J].现代医药卫生,2013,29(10):1477-1478.[18]黄衍强,黄干荣,李晓华,等.中药提取物对耐药幽门螺杆菌生物膜形成的影响[J].医药导报,2013,32(11):1407-1409.[19]邸大琳,李法庆,陈蕾,等.苦参体外抑菌作用的研究[J].时珍国医国药,2006,17(10):1974.[20]张小超,申莹,陈鹏,等.苦参胶囊抗炎镇痛作用研究[J].昆明医科大学学报,2013,34(2):4-10.[21]张玲,马韵,黄绍标,等.苦参素注射液治疗慢性肝炎的组织病理学分析[J].中华肝脏病杂志,2003,11(1):45.[22]李丽丽,金哲雄.苦参现代研究进展[J].黑龙江医药,2012,25(5):671-674.。
