EDU-细胞增殖检测.doc
EDU染色

Edu掺入法检测细胞增殖
1.取对数生长期细胞,以每孔4000个细胞接种于96孔板中,培养至对数生长期;
2.用细胞培养基按1000:1的比例稀释Edu溶液(试剂A),制备适量50μM的Edu培养基;
3.每孔加入100μL 50μM Edu培养基孵育1h,弃培养基;
4.PBS清洗细胞1~2次,每次5分钟;
5.每孔加入100μL细胞固定液(即含4%多聚甲醛的PBS)室温孵育30min;
6.每孔加入2mg/mL甘氨酸,脱色摇床孵育5min后,弃甘氨酸溶液;
7.每孔加入100μLPBS,脱色摇床清洗5min,弃PBS;
8.每孔加入100μL渗透剂(0.5%Triton X-100的PBS)脱色摇床孵育10min;PBS清洗1次,5min;
9.每孔加入100μL的1mg/mL DAPI,避光、室温、脱色摇床孵育10min,弃染色反应液;
10.每孔每次加入100μLPBS清洗1~3次;染色完成后,荧光显微镜检测。
细胞增殖检测方法

细胞增殖检测方法
细胞增殖是细胞数量的增加和分裂的过程,对于检测细胞增殖的方法有很多种。
以下是一些常见的细胞增殖检测方法:
1. 细胞计数:通过显微镜观察和手工计数细胞数量,或使用自动化细胞计数仪进行细胞计数。
2. 细胞增殖染料:使用细胞增殖染料,如溴化乙锭(BrdU)或五溴乙酰胺(EdU),将其添加到培养基中,然后检测细胞摄取或转化这些染料的程度,以评估细胞增殖。
3. MTT试验:MTT(3-(4,5-二甲基噻唑-2-基)-2,5-二苯基-2H-四唑酮)试验通过测量细胞的代谢活力来评估细胞增殖。
MTT试剂会被活细胞还原为紫色的甲基噻唑咪唑离子,可以使用分光光度计测量产生的紫色产物的吸光度来确定细胞的增殖能力。
4. 细胞周期分析:通过流式细胞术检测细胞的DNA含量,可以确定细胞处于哪个细胞周期阶段,并评估细胞的增殖能力。
5. 细胞增殖标记:通过使用荧光标记物或融合蛋白来标记增殖细胞。
例如,使用荧光标记的抗体来检测细胞核内的增殖相关标记物,如Ki-67。
6. 实时细胞分析:使用实时细胞分析系统,如X-Celligence系统,可以通过记录电极传感器阻抗的变化来监测细胞的生长和扩张情况,从而评估细胞增殖。
这些方法可以单独或结合使用,以获得更全面和准确的细胞增殖信息。
EdU

[ 关键词] E d U; B r d U; 细 胞 增 殖 [ 中 图分 类 号 ] R 一 1 [ 文献标识码 ] A [ 文章编号] 1 6 7 1 — 8 3 4 8 ( 2 0 1 5 ) 3 2 — 4 5 8 1 — 0 3 A5 4 9细 胞 上 进 行 了 测 试 _ 1 。 。 An d e r s e n等 _ 2 的研 究 发 现 ,
E d U 使 用 浓 度 很 可 能 会 限制 其 对 细胞 增 殖 的影 响 。
3 B r d U 检 测 增 殖 细 胞 的 特 点 及 原 理
B r d U 是 另 一 种 嘧 啶类 似 物 , 其 化 学 结 构 特 点 是 溴 替 代 了
E d U是一种胸 腺嘧 啶核苷 的类 似物 , 其 化 学 结 构 特 点 是 脱 氧 胸 腺 嘧 啶 环 上 与 5位 C原 子 相 连 的 甲 基 被 乙 炔 基 取 代 , 在 s期 细 胞 增 殖 时 可 作 为 底 物 掺 入 到 正 在 复 制 的 D N A 链 中,
结 合其 他 细 胞标 记 物 进 行 双 重 染 色 , 可 判 断细 胞 种 类 及 增 值 速 度, 对 研 究 细 胞 动 力 学 有 重 要 意 义 。 目前 , B r d U 标 记 新 合 成 DNA 的 方法 在 动 物 细 胞 组 织 的 肿 瘤 生 物 学 、 遗传学 、 分 子 生 物
通 过 与 染 料 的 共 轭 反 应 可 以 进 行 高 效 快 速 的 细 胞 增 殖 检 测 ] , 其 中, 乙炔 基 能 够 与 一 种 荧 光 标 记 的小 分 子 叠 氮 化 合 物
EDU检测细胞增殖

Brdu中文全名5-溴脱氧尿嘧啶核苷,为胸腺嘧啶的衍生物,可代替胸腺嘧啶在DNA合 成期(S期),活体注射或细胞培养加入,而后利用抗Brdu单克隆抗体,ICC染色,显示增 殖细胞。同时结合其它细胞标记物,双重染色,可判断增殖细胞的种类,增殖速度,对研 究细胞动力学有重要意义。
MTT检测法
MTT检测法主要反映细胞的能量代谢,是检测细胞增殖活力的一种简便准确的方法, 其原理是在活细胞生长和增殖过程中,线粒体内的脱氢酶可将黄色的MTT分解成兰紫色的 甲(Formazan),生成的甲量的多少与细胞的数量和细胞的活力成正比。
羟基荧光素二醋酸盐琥珀酰亚胺脂(CFSE)检测法
C10311 Cell-LightTM EdU 流式细胞仪检测试剂盒 Tel: 028-81391685、13679094941
Ribobio
Cell-Light™ EdU 动物实验 3) 在组织水平上EdU对增殖细胞的标记
Ribobio
EdU适用于人、小鼠、大鼠等活体注射,全面分析组织或器官的细胞 增殖情况,适用于石蜡或冰冻组织切片检测,对活体无副作用。
Ribobio
Cell-Light™ EdU 试验流程
检测方法简便,只需三步即可分 析细胞增殖数据: 1)EdU孵育样品; 2)细胞固定化; 3)Apollo®染料检测EdU。
Tips:
1.建议使用50μM EdU培养基孵育,但您可 以在预实验时根据细胞类型和实验目的,以 一系列浓度(10~100μM)的EdU培养基孵育进 行优化,细胞能太密,一般60%-70%。 2.不同细胞类型之间有一定差异,可以先做 一个时间梯度,找出合适的孵育时间。 3.由于细胞之间的差异,最佳EdU的终浓度 和培养时间可根据具体实验调整,(50μM EdU 培养基用细胞培养液以1:2000的比例稀释 EdU溶液)。 4. EdU孵育时间>24小时宜采用较低浓度, 而EdU孵育时间<45分钟宜采用较高浓度。 检测和DNA染色草种、孵育注意避光。 6.固定好的细胞,不染色,在4℃可存放1个 月。组织切片如暂不检测就不要脱蜡。
细胞增殖 检测方法

细胞增殖检测方法细胞增殖是指细胞在生物体内不断分裂和繁殖的过程,是生物体生长和发育的基础。
检测细胞增殖的方法有很多种,以下将详细介绍几种常见的细胞增殖检测方法。
首先,细胞计数法是最常用的细胞增殖检测方法之一。
细胞计数法主要通过显微镜观察和数数的方式,计算细胞的数量来反映细胞增殖的情况。
可以通过细胞染色或细胞标记技术使细胞在显微镜下更易于观察和区分。
细胞计数法通常需要使用专业的细胞计数仪或显微相机来帮助实施,具有操作简单、结果准确等特点。
其次,MTT法是一种在体外细胞培养中常用的细胞增殖检测方法。
MTT法基于细胞中还原剂细胞线粒体呼吸将黄色硫代唑盐(MTT)还原为紫色的可溶性产物,最后通过比色法测定细胞数目和细胞活力。
MTT法操作简单、结果稳定可靠,广泛应用于药物筛选和细胞增殖研究中。
另外,细胞增殖标记法是通过标记DNA合成阶段的细胞来检测细胞增殖的方法。
常见的细胞增殖标记法有Brdu法和EDU法。
这两种方法都是通过标记新合成的DNA分子来反映细胞增殖情况,Brdu法利用抗体检测Brdu标记的DNA,而EDU法则利用稳定的EDU(5-乙炔基-2'-脱氧尿苷)分子和荧光染料的结合来检测标记的DNA。
由于这两种方法都需要使用荧光染料或抗体检测,因此需要显微镜或流式细胞仪等设备来进行检测。
此外,细胞增殖检测还可以通过测定细胞凋亡(细胞死亡)来间接反映细胞增殖情况。
细胞凋亡是细胞自身程序性死亡的一种形式,常使用TUNEL(DNA末端标记术)法或Annexin V/PI双染法来检测细胞凋亡。
这些方法通过标记DNA 断裂或细胞膜破损来区分凋亡细胞和正常细胞,并通过荧光染料或抗体检测来反映细胞凋亡的程度。
细胞凋亡的明显增加往往意味着细胞增殖的受抑制。
总的来说,细胞增殖检测方法的选择应根据具体实验的目的、条件和资源来决定。
不同的方法各有优势和局限性,需要结合实际情况进行选择。
在细胞增殖检测中,细胞计数法是最常用的方法,MTT法和细胞增殖标记法是常见的体外检测方法,而通过检测细胞凋亡来间接反映细胞增殖情况也是一种有效的方法。
检测细胞增殖能力的方法

检测细胞增殖能力的方法细胞增殖能力是生物学和医学研究中极为重要的指标,它反映了细胞的生长、繁殖和生命活力。
本文将详细介绍几种常用的检测细胞增殖能力的方法,以供研究者参考。
一、MTT法MTT法(甲基噻唑基四唑法)是一种经典的检测细胞增殖的方法。
其原理是利用活细胞内的琥珀酸脱氢酶将MTT还原为蓝紫色的甲臜,甲臜的量与活细胞数成正比。
具体步骤如下:1.将细胞接种于96孔板中;2.加入MTT溶液,培养一定时间;3.弃去上清,加入DMSO溶解甲臜;4.使用酶标仪测定吸光度,判断细胞增殖能力。
二、CCK-8法CCK-8法(细胞计数试剂盒-8)与MTT法类似,但操作更简便,毒性更低。
CCK-8试剂在细胞内被还原后生成橙色的甲臜,通过测定吸光度可以评估细胞增殖能力。
三、EdU法EdU法(5-乙炯基-2"-脱氧尿嘧啶法)是一种新兴的细胞增殖检测方法。
EdU是胸腺嘧啶类似物,可以代替胸腺嘧啶插入到DNA中。
通过荧光显微镜或流式细胞仪检测EdU标记的DNA,可以评估细胞增殖情况。
四、Brdu法Brdu法(5-溴脱氧尿嘧啶法)与EdU法类似,也是一种检测细胞增殖的经典方法。
Brdu在细胞周期中代替胸腺嘧啶插入DNA,通过免疫荧光或免疫组化方法检测Brdu标记的DNA,从而评估细胞增殖能力。
五、细胞计数法细胞计数法是最直接的检测细胞增殖能力的方法。
通过细胞计数板或流式细胞仪对细胞进行计数,可以直接得到细胞数量,从而判断细胞增殖能力。
六、其他方法除了以上几种方法外,还有其他检测细胞增殖能力的方法,如:1.克隆形成实验:通过测定细胞克隆的形成数量来评估细胞增殖能力;2.细胞周期分析:利用流式细胞仪检测细胞周期各阶段的细胞比例,间接反映细胞增殖能力;3.报告基因法:通过构建带有报告基因的细胞株,检测报告基因的表达水平来评估细胞增殖能力。
综上所述,检测细胞增殖能力的方法多种多样,研究者可以根据实验需求和条件选择合适的方法。
EDU实验步骤

EdU细胞增殖(细胞成像)EdU是一种胸腺嘧啶核苷类似物,其连有的炔烃基团在天然化合物中很少见,能够在DNA复制时期代替胸腺嘧啶(T)渗入正在合成的DNA分子中,通过基于Apollo®荧光染料与EdU的特异性反应即可直接并准确地检测出DNA复制活性,广泛应用于细胞增殖、细胞分化、生长与发育、DNA修复、病毒复制等方面的研究,尤其适合进行siRNA、miRNA、小分子化合物及药物的细胞增殖筛选实验。
荧光显微镜检测方法(以96孔板,A549贴壁细胞为例)细胞培养取对数生长期细胞,以每孔4×103~1×105细胞接种于96孔板中,培养至正常生长阶段。
药物处理(可选)客户可以根据实验需要进行各种药物处理。
EdU标记1.1 用细胞培养基按1000:1的比例稀释EdU溶液(试剂A),制备适量50μM EdU培养基;注:1)EdU浓度与孵育时间相关,短时间孵育(<2h)宜采用高浓度(10~50 μM),长时间孵育(>24h)宜采用低浓度(1~10μM);2)如果需配置10μM EdU培养基,需调整为5000:1稀释比例;3)配置好的培养基的保存时间取决于培养基的性质。
注:1)*表示贴壁细胞通常采用的培养容器,EdU培养基与染色反应液用量以覆盖细胞为宜;2)悬浮细胞EdU用量依据培养体积而定。
1.2 每孔加入100μL 50μM EdU培养基孵育2小时,弃培养基;注:1)最佳孵育时间与细胞周期相关(表2),大多数细胞系均可采用2小时孵育时间;2)EdU培养基用量以没过细胞为宜,但需要保证EdU孵育时间内的营养物质持续供给(表1);1.3 PBS清洗细胞1~2次,每次5分钟。
注:清洗目的是将未渗入DNA的EdU洗脱,清洗方式依据不同的细胞类型而定,贴壁不牢的细胞请降低清洗强度。
注:1)EdU孵育时间取决于细胞周期,一般为细胞周期的1/10至1/5,但大多数细胞系均可采用2h孵育时间。
细胞增殖实验word版

细胞增殖检测方法细胞增殖检测通常是检测分裂中的细胞数量或者细胞群体发生的变化。
目前细胞增殖检测主要分为五类:DNA合成检测、代谢活性检测、细胞数量检测、细胞增殖相关抗原检测和ATP 浓度检测。
在这些方法中作何选择,主要取决于所研究的细胞类型和研究方案。
1.DNA合成检测这是目前实验室中检测细胞增殖最准确可靠的方式。
该法是将放射性标记的3H-胸腺嘧啶与细胞一同孵育,这样新增殖细胞的DNA中就会掺入放射性标记,经洗脱后可用闪烁计数器检测。
该方法耗时长,而且有个明显的弊端就,即使用和处理放射性物质既麻烦又不安全。
不过,可以使用5-溴-2-脱氧尿苷BrdU来进行类似实验,因为BrdU也同样可以掺入到新合成的DNA中。
但这样就需要进行额外的实验步骤,先孵育特异性BrdU单抗和带标记的二抗,然后再进行比色法、化学发光检测或荧光信号检测等步骤。
该方法的优点就是不再需要放射性物质。
BrdU标记很适合免疫组化IHC、免疫细胞化学IC、细胞内ELISA、流式细胞分析和高通量筛选。
2.代谢活性检测检测细胞群体的代谢活性也可以反映细胞增殖的情况。
在细胞增殖过程中脱氢酶的活性会增加,因此其底物四唑盐或Alamar Blue在代谢活跃的细胞环境中会逐渐减少,形成能够改变培养基颜色的甲臜染料。
可以通过低配置或高配置的分光光度计和酶标仪来读取含染料培养基的吸光度,从而衡量细胞的代谢活性,检测细胞增殖的情况。
四种最常见的四唑盐是:MTT、XTT、MTS和WST1。
MTT在标准的细胞培养基中是不溶的,而且其生成的甲臜晶体需要溶解在DMSO或者异丙醇中。
因此,MTT 主要作为终点检测方法。
其他三种盐与Alamar Blue一样,都是可溶且无毒。
它们可以作为连续监控手段来跟踪细胞增殖的动态改变。
其中XTT的效率较低,需要添加额外的因子;WST1更灵敏有效,与其他盐相比能够更快显色;Alamar Blue 的灵敏度也很高,只要微孔板的孔中有100个细胞就能够检测到。
EDU
EdU(5-Ethynyl-2'-deoxyuridine)是一种胸腺嘧啶核苷类似物,其连有的炔烃基团在天然化合物中很少见,能够在DNA复制时期代替胸腺嘧啶(T)渗入正在合成的DNA分子中,基于Apollo荧光染料与EdU的特异性反应即可直接并准确地检测出DNA复制活性,广泛应用于细胞增殖、细胞分化、生长与发育、DNA损伤修复、病毒繁殖等方面的研究,尤其适合进行siRNA、miRNA、小分子化合物及各种药物的细胞增殖及活力筛选实验。
细胞增殖是评价细胞活性、代谢、生理和病理状况的重要指标。
EdU(5-Ethynyl-2'-deoxyuridine)是一种胸腺嘧啶核苷类似物,其连有的炔烃基团在天然化合物中很少见,能够在DNA复制时期代替胸腺嘧啶(T)渗入正在合成的DNA分子中,基于Apollo荧光染料与EdU的特异性反应即可直接并准确地检测出DNA复制活性,广泛应用于细胞增殖、细胞分化、生长与发育、DNA损伤修复、病毒繁殖等方面的研究,尤其适合进行siRNA、miRNA、小分子化合物及各种药物的细胞增殖及活力筛选实验。
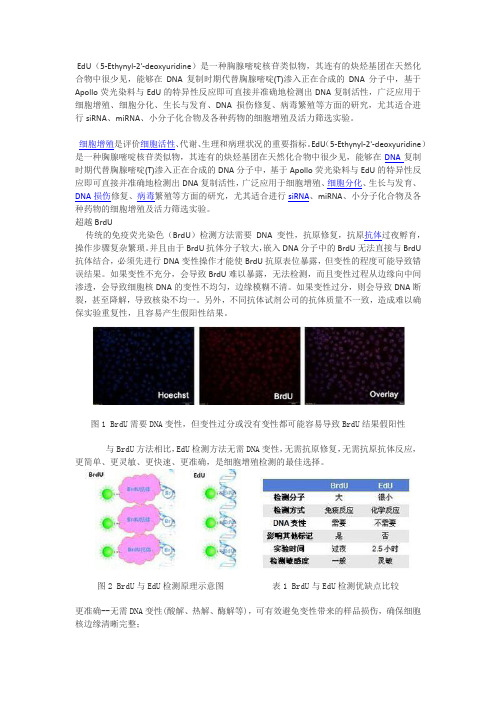
超越BrdU传统的免疫荧光染色(BrdU)检测方法需要DNA变性,抗原修复,抗原抗体过夜孵育,操作步骤复杂繁琐。
并且由于BrdU抗体分子较大,嵌入DNA分子中的BrdU无法直接与BrdU 抗体结合,必须先进行DNA变性操作才能使BrdU抗原表位暴露,但变性的程度可能导致错误结果。
如果变性不充分,会导致BrdU难以暴露,无法检测,而且变性过程从边缘向中间渗透,会导致细胞核DNA的变性不均匀,边缘模糊不清。
如果变性过分,则会导致DNA断裂,甚至降解,导致核染不均一。
另外,不同抗体试剂公司的抗体质量不一致,造成难以确保实验重复性,且容易产生假阳性结果。
图1 BrdU需要DNA变性,但变性过分或没有变性都可能容易导致BrdU结果假阳性与BrdU方法相比,EdU检测方法无需DNA变性,无需抗原修复,无需抗原抗体反应,更简单、更灵敏、更快速、更准确,是细胞增殖检测的最佳选择。
流式细胞仪检测细胞增殖方法有哪些

流式细胞仪检测细胞增殖方法有哪些?在生物学和医学研究中,细胞增殖是一个关键过程,对于理解生命活动的基本规律以及疾病的发病机理具有重要意义。
随着科技的发展,流式细胞仪作为一种高效、灵敏的分析工具,广泛应用于细胞增殖的检测。
流式细胞仪通过快速分析单个细胞,可以对细胞周期、细胞增殖活性、细胞凋亡等多个方面进行研究。
本文将探讨流式细胞仪在检测细胞增殖方面的主要方法,包括但不限于溴脱氧尿苷(BrdU)掺入法、细胞周期蛋白检测法以及细胞大小分析法等,为读者提供全面的技术应用概览。
流式细胞仪检测细胞增殖方法:1、3H(氚离子)掺入法原理:是在细胞DNA合成时,用3H脱氧胸腺嘧啶核苷代替普通的脱氧胸腺嘧啶核苷掺入新合成的DNA中,增殖的细胞因为掺入3H而具有放射性,通过定量检测样品细胞的放射性大小而反映细胞的增值活性缺点:1)使用的是具有放射性的同位素,操作较为复杂,同时需要采取放射性保护措施2)低比例高活跃增殖和高比例低活跃增殖可能得到的是相同的结果,用此方法无法进行鉴别3)此方法无法进一步得到具有活性的增值细胞用于下一步的研究4)此方法时间较短,无法检测加入前细胞的增殖情况,而且检测到放射性只能说明细胞DNA合成,而不能提供合成DNA的细胞是否进入增殖阶段的信息2、相对计数法原理:将对照组和各实验组控制在相同条件下直接计数然后比较计数结果得到增殖结论注意点:对照组与实验组每种细胞所加浓度必须相同,每组至少设置3个复孔,这样每个孔可以得到1个细胞数,将3个复孔取平均值后就是这个组的结果。
如果同时需要得到每孔目标细胞增殖后的绝对参数,在每孔细胞中加入1*105PE标记的人工微球作为内参收集各组的细胞于EP管中,注意必须尽量将各组的所有细胞都收集起来。
标记需要计数细胞的标志表型的荧光素偶联抗体,4℃静置30minPBS洗涤一次,洗去游离的抗体3、示踪染料标记法示踪染料与细胞结合的方式:1)能够与细胞内的蛋白质上的氨基发生非特异性的共价结合2)能够非特异性地嵌入细胞膜的脂质双分子层中与细胞发生非共价性结合原理:示踪染料的荧光信号都很强,当细胞分裂时,母细胞内的染料会被平均分配到子细胞中,细胞荧光信号会被减弱一半,所以通过检测减弱的、发射示踪染料荧光信号的细胞比例就可以判断细胞增殖的强弱。
细胞增殖凋亡检验方法汇总

细胞增殖、凋亡-检测方法汇总1.直接计数法面单粗暴、傻瓜式的检查方法!利用计数板或计数仪得出细该数目•然后对数目逬行比较。
方法需要对不同时间原的细胞分别固定•而后在光疑下计数,可绘制出细胞生长曲线。
而具不足之处在于无法区分壇蓿细胞与非增殖抵胞,下适合样品奴星參和评估特定亚群的情况。
2「H・TdR渗入法OH腺龜碇核百(TdR )是DNA持有的滅基「也是DNA合成的必需物氐用同位素中标记TdR即3H-TdR作为DNA合成的前体渗入DNA合成代谢过程,通过液体闪烁计数器可迴走细胞的放射性强虐,间接放映出细胞增殖情况。
该方法优点在于敏感性高”客观性强,盍每性好.但是爲要一走设备集件,也存在放时性核素污染问题。
3、Brdu/EdU检测法Brdu&EdU均是胸腺嚅睫的衍生物r均可代替胸腺嚅噪在DNA合成期掺入细胞中。
不同的是J Brdu检测法可利用B「du专性抗体和具他細胞标记物对细'进行双重染色,可判断増殖细胞的种类及増殖速度,不仅适用于体外实验也能用于活体实验。
这个方法最大的缺点需要变性DNA才能与抗体结合,破坏了DNA双链结构r导致染色弥散、准确性降低等问题。
EdU检测法则基于EdU与Apollo荧光染料的特异性反应检测DNA复制活性r适用于细胞増殖、细胞标记示踪筈方IEI的研究,尤其适合进行siRNA、miRNA、小分子化合物及其他药物的筛选实验。
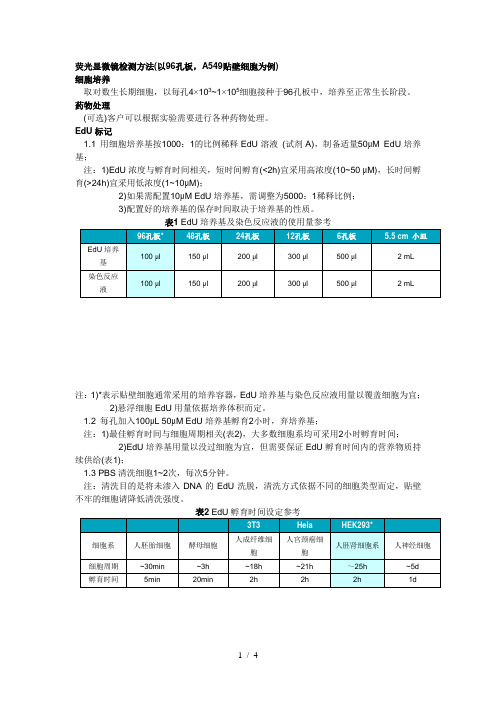
EdU检测染料只有BrdU抗体大小的1/500,®田胞内很容易就扩散,无需DNA变性。
rdU与EdU检测优缺点综合比较BrdU EdU 检测分子大很小检测方式免疫反应化学反应影响其他标记是否DNA变性需要不需要实验时间过夜 2.5小时检测灵敏度一般灵敏4、WITT检测法&CCK8检测法MTT检测法反映细胞的能臺代谢「是检测细胞増殖活力的一种简便准确方法°其原理是在活纟田胞生长和增殖过程中,线粒体内的脱氢酶可将黄色的MTT分解为蓝紫色的水不溶性的甲瓒(Formazan ),并沉积在细胞中(死细胞无此功能。
细胞增殖 检测方法

细胞增殖检测方法
细胞增殖是指细胞数量的增加。
检测细胞增殖可以通过多种方法,其中常用的方法包括:
1. 细胞计数:使用显微镜观察细胞培养物中的细胞数量,并通过计数来得出细胞增殖情况。
2. 晶紫染色法:晶紫染色可以染色细胞核,通过观察染色后细胞数量的增加来判断细胞增殖情况。
染色后的细胞可以在显微镜下观察,并可以使用图像处理软件进行图像分析。
3. DNA含量分析:细胞增殖时DNA含量也会增加,可以通过荧光染料如荧光素琥珀酰胺(Propidium Iodide)染色,使用流式细胞仪来分析DNA含量。
4. 噻吩蓝染色法(MTT法):MTT法使用噻吩蓝(MTT)染料可以评估细胞活性和增殖能力。
活细胞将MTT染料转化为紫色的内盐,通过溶解细胞并测量溶液的吸光度来确定细胞增殖情况。
5. 细胞增殖标记物:细胞增殖标记物如脱氧尿苷(BrdU)或5-乙酰基-2'-脱氧尿苷(EdU)可以被细胞吸收并集成到新合成的DNA中。
这样,在染色时可以使用抗-BrdU或抗-EdU抗体染色,并通过观察标记物阳性细胞的数量来评估细胞增殖情况。
以上方法都可以用于检测细胞增殖情况,选择适合实验需求的方法进行研究。
需要注意的是,不同的方法可能具有不同的准确性和敏感性,因此在实验设计和数据分析过程中需要谨慎操作。
细胞增殖凋亡检验方法

细胞增殖凋亡检验方法细胞增殖和凋亡是细胞生物学中两个重要的过程,对于细胞生长、发育和疾病发展起着关键作用。
因此,研究细胞增殖和凋亡的检验方法对于揭示相关生物学过程以及发现新的治疗靶点具有重要意义。
本文将介绍几种常用的细胞增殖和凋亡检验方法。
一、细胞增殖检验方法1.MTT法MTT法(3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四氮唑溴化物)是一种常见的细胞增殖检验法。
MTT可以在活细胞内还原生成紫色的福尔马因酸化物,通过测定细胞活性来评估细胞增殖情况。
该方法的优点是简便、快速、应用广泛,但只能评估细胞整体增殖情况。
2. Bromodeoxyuridine(BrdU)标记法BrdU标记法是一种侵入法,可以评估细胞的DNA合成和增殖。
细胞在培养基中加入BrdU,细胞会将其代入新合成的DNA链中。
然后,可以使用抗BrdU抗体来检测BrdU标记的细胞。
该方法对于细胞周期和增殖动力学的研究非常有用。
标记法EdU标记法是一种新兴的细胞增殖检验方法。
与BrdU类似,EdU也是一种DNA合成的标记物,但是与BrdU相比,EdU标记更加简单快速。
EdU可以通过与荧光染料的偶联来进行检测,对于多通道染色非常适用。
1. Annexin V-FITC/PI染色法Annexin V-FITC/PI染色法是一种常用的细胞凋亡检验方法。
Annexin V是一种钙离子依赖性磷脂酰丝氨酸的结合蛋白,在凋亡过程中会在细胞表面表达。
PI是一种DNA染料,用于区分凋亡和坏死细胞。
该方法可以通过流式细胞术或荧光显微镜来评估细胞的凋亡程度。
2. DNA Laddering检测法DNA Laddering检测法是一种检测凋亡的传统方法。
在细胞凋亡过程中,核酸会被酶切为200-300bp的碎片,形成明显的DNA阶梯状图案。
该方法通过DNA琼脂糖凝胶电泳来检测DNA断裂情况。
3.TUNEL法TUNEL法(dUTP尾部标记法)是一种直接检测DNA断裂的方法。
EDU-细胞增殖检测
荧光显微镜检测方法(以96孔板,A549贴壁细胞为例)细胞培养取对数生长期细胞,以每孔4×103~1×105细胞接种于96孔板中,培养至正常生长阶段。
药物处理(可选)客户可以根据实验需要进行各种药物处理。
EdU标记1.1 用细胞培养基按1000:1的比例稀释EdU溶液(试剂A),制备适量50μM EdU培养基;注:1)EdU浓度与孵育时间相关,短时间孵育(<2h)宜采用高浓度(10~50 μM),长时间孵育(>24h)宜采用低浓度(1~10μM);2)如果需配置10μM EdU培养基,需调整为5000:1稀释比例;3)配置好的培养基的保存时间取决于培养基的性质。
表1 EdU培养基及染色反应液的使用量参考注:1)*表示贴壁细胞通常采用的培养容器,EdU培养基与染色反应液用量以覆盖细胞为宜;2)悬浮细胞EdU用量依据培养体积而定。
1.2 每孔加入100μL 50μM EdU培养基孵育2小时,弃培养基;注:1)最佳孵育时间与细胞周期相关(表2),大多数细胞系均可采用2小时孵育时间;2)EdU培养基用量以没过细胞为宜,但需要保证EdU孵育时间内的营养物质持续供给(表1);1.3 PBS清洗细胞1~2次,每次5分钟。
注:清洗目的是将未渗入DNA的EdU洗脱,清洗方式依据不同的细胞类型而定,贴壁不牢的细胞请降低清洗强度。
表2 EdU孵育时间设定参考注:1)EdU孵育时间取决于细胞周期,一般为细胞周期的1/10至1/5,但大多数细胞系均可采用2h孵育时间。
孵育时间越长,细胞增殖数量就越多;2)*考虑到细胞培养基、温度、湿度、光线等其他因素的影响,具体实验的细胞群体细胞周期会有所变化。
表3细胞实验EdU孵育浓度及时间参考注:如果您有采用BrdU进行实验的经验,可以参照BrdU实验的相关参数进行EdU实验。
细胞固定化2.1 每孔加入50μL 细胞固定液(即含4% 多聚甲醛的PBS)室温孵育30分钟,弃固定液;注:1)低浓度的多聚甲醛有利于细胞结构的保持,当需要抗体染色时,需采用Triton X-100透化细胞以利于抗体进入细胞内。
edu检测细胞增殖原理

edu检测细胞增殖原理
细胞增殖原理是指细胞分裂过程中所发生的实质变化。
这个过程分两个步骤:G1期(启动期)、S期(DNA复制期)、G2期(准备分裂期)和M期(细胞本身的分裂期)。
在G1期,细胞开始作用基因,产生各种蛋白质,把细胞备好做准备进入S期。
S期持续时间最长,细胞开始进行DNA复制,产生2个DNA对,以便在最后的M期,将旧细胞分裂为2个新细胞,即完成细胞增殖。
G2期涉及细胞质的变化,以便备战细胞分裂,例如核质的增加,改变细胞的形状以及生物膜的变化。
最后一个步骤M期,细胞核内容物分裂而形成2个新的细胞核,细胞膜分裂为两个新的细胞,从而完成细胞的增殖。
细胞增殖实验

细胞增殖检测方法细胞增殖检测通常是检测分裂中的细胞数量或者细胞群体发生的变化。
目前细胞增殖检测主要分为五类:DNA合成检测、代谢活性检测、细胞数量检测、细胞增殖相关抗原检测和ATP 浓度检测。
在这些方法中作何选择,主要取决于所研究的细胞类型和研究方案。
1.DNA合成检测这是目前实验室中检测细胞增殖最准确可靠的方式。
该法是将放射性标记的3H-胸腺嘧啶与细胞一同孵育,这样新增殖细胞的DNA中就会掺入放射性标记,经洗脱后可用闪烁计数器检测。
该方法耗时长,而且有个明显的弊端就,即使用和处理放射性物质既麻烦又不安全。
不过,可以使用5-溴-2-脱氧尿苷BrdU来进行类似实验,因为BrdU也同样可以掺入到新合成的DNA中。
但这样就需要进行额外的实验步骤,先孵育特异性BrdU单抗和带标记的二抗,然后再进行比色法、化学发光检测或荧光信号检测等步骤。
该方法的优点就是不再需要放射性物质。
BrdU标记很适合免疫组化IHC、免疫细胞化学IC、细胞内ELISA、流式细胞分析和高通量筛选。
2.代谢活性检测检测细胞群体的代谢活性也可以反映细胞增殖的情况。
在细胞增殖过程中脱氢酶的活性会增加,因此其底物四唑盐或Alamar Blue在代谢活跃的细胞环境中会逐渐减少,形成能够改变培养基颜色的甲臜染料。
可以通过低配置或高配置的分光光度计和酶标仪来读取含染料培养基的吸光度,从而衡量细胞的代谢活性,检测细胞增殖的情况。
四种最常见的四唑盐是:MTT、XTT、MTS和WST1。
MTT在标准的细胞培养基中是不溶的,而且其生成的甲臜晶体需要溶解在DMSO或者异丙醇中。
因此,MTT主要作为终点检测方法。
其他三种盐与Alamar Blue一样,都是可溶且无毒。
它们可以作为连续监控手段来跟踪细胞增殖的动态改变。
其中XTT的效率较低,需要添加额外的因子;WST1更灵敏有效,与其他盐相比能够更快显色;Alamar Blue的灵敏度也很高,只要微孔板的孔中有100个细胞就能够检测到。
edu实验解读

EDU实验是一种用于研究细胞增殖、细胞分化、生长与发育、DNA损伤修复、病毒复制、细胞标记示踪等方面的技术。
通过EDU实验,可以定量测定细胞增殖速率和细胞周期,还可以研究细胞分化和细胞凋亡等现象。
在EDU实验中,通常会在特定的培养条件下,将标记有EDU的核苷酸引入细胞中,通过与DNA的结合,标记出DNA复制的区域。
随后,通过一系列的固定、洗涤和染色步骤,使用抗体检测出标记的DNA区域,最终通过显微镜观察和图像分析技术,对细胞的增殖情况进行定量分析。
通过EDU实验,可以获得许多有价值的信息,例如细胞增殖速率、细胞周期各时相的长度、细胞分化的方向和程度、细胞凋亡的发生和分布等。
这些信息对于理解细胞生命活动的规律和机制具有重要的意义,对于研究疾病的发生和发展机制、药物研发和癌症治疗等领域也具有广泛的应用价值。
edu细胞增殖实验原理

edu细胞增殖实验原理
细胞增殖实验是一种用于研究生物细胞生长的基础实验。
它是通
过在适宜的培养条件下,通过定期观察和计数细胞的数量和形态变化,来研究细胞分裂和生长的过程。
在实验中,通常采用细胞培养技术,将细胞种植在营养丰富的培
养基中,确保细胞具有足够的营养和生长条件。
然后在特定时间点,
使用显微镜观察细胞的增殖情况,计数细胞数量和评估其形态变化。
细胞增殖实验的主要原理是通过研究不同条件下细胞增殖的变化,来推测影响细胞生长和正常功能的因素。
例如,可以研究不同营养成
分对细胞生长的影响,探索某些药物或遗传学变异对细胞增殖和功能
的影响等。
在实验过程中,需要注意一些因素以保证实验结果的准确性和可
靠性。
首先,需要使用高品质的培养基及其他细胞培养试剂,以确保
细胞生长环境的稳定性和一致性。
此外,还需定期检查细胞培养条件,包括温度、湿度、氧气和二氧化碳浓度等环境参数。
同时,还需用显
微镜进行精确地观察和定量测量细胞生长状态,以保证实验数据的准
确性和可重复性。
总之,细胞增殖实验是生物学研究中最基础的实验之一。
通过定
量和定性地研究细胞生长和分裂的变化,可以得出某些生化、生物物
理和遗传学方面的结论,这对深入理解细胞功能和疾病发生机制有重
要意义。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
荧光显微镜检测方法(以 96孔板, A549 贴壁细胞为例)细胞培养取对数生长期细胞,以每孔4×10 3~1 ×10 5细胞接种于 96孔板中,培养至正常生长阶段。
药物处理(可选 )客户可以根据实验需要进行各种药物处理。
EdU 标记1.1 用细胞培养基按1000 : 1 的比例稀释EdU 溶液(试剂A) ,制备适量50 μM EdU 培养基;注: 1)EdU 浓度与孵育时间相关,短时间孵育(<2h) 宜采用高浓度(10~50 μM),长时间孵育(>24h) 宜采用低浓度 (1~10 μM) ;2)如果需配置 10 μM EdU 培养基,需调整为 5000 : 1 稀释比例;3)配置好的培养基的保存时间取决于培养基的性质。
表 1 EdU 培养基及染色反应液的使用量参考EdU 培养100 μl150 μl200 μl300 μl500 μl 2 mL 基染色反应100 μl150 μl200 μl300 μl500 μl 2 mL 液注:1)* 表示贴壁细胞通常采用的培养容器,EdU 培养基与染色反应液用量以覆盖细胞为宜;2)悬浮细胞 EdU 用量依据培养体积而定。
1.2 每孔加入 100 μL 50 μM EdU 培养基孵育 2 小时,弃培养基;注: 1) 最佳孵育时间与细胞周期相关(表 2) ,大多数细胞系均可采用2小时孵育时间;2)EdU 培养基用量以没过细胞为宜,但需要保证EdU 孵育时间内的营养物质持续供给 (表 1);1.3 PBS 清洗细胞 1~2 次,每次 5 分钟。
注:清洗目的是将未渗入DNA 的 EdU 洗脱,清洗方式依据不同的细胞类型而定,贴壁不牢的细胞请降低清洗强度。
表 2 EdU 孵育时间设定参考细胞系人胚胎细胞酵母细胞人成纤维细人宫颈癌细人胚肾细胞系人神经细胞胞胞细胞周期~30min ~3h ~18h ~21h ~25h ~5d 孵育时间5min 20min 2h 2h 2h 1d注: 1)EdU 孵育时间取决于细胞周期,一般为细胞周期的采用 2h 孵育时间。
孵育时间越长,细胞增殖数量就越多;1/10 至 1/5 ,但大多数细胞系均可2)* 考虑到细胞培养基、温度、湿度、光线等其他因素的影响,具体实验的细胞群体细胞周期会有所变化。
表 3 细胞实验EdU 孵育浓度及时间参考Salic A, et al . PNAS . 2008 NIH3T3, Hela 10 nM~10 μM 1 hrCappella P, et al. Cytometry A . 2008 HL-60, A2780,1~10 μM 30 min U2OSChehrehasa F, et al. J Neurosci Methods .Neurospheres 1~20 μM 24 hr 2009Limsirichaikul S, et al. Nucleic Acids Res .Primary fibroblasts 10 μM 1,2,4 hr 2009Warren M, et al . Dev Dyn . 2009 Chick embryos 10 μM~2 mM 4 hrYu Y, et al . J Immunol Methods . 2009 Spleen cells 50 μM 24 hrMomcilovi ? O, et al . Stem Cells . 2009 Human ES cells 10 μM 30 minCinquin O, et al . PNAS . 2010 emb-30 1 μM 12 hrHan W, et al . Life Sci . 2009 VSMC 50 μM 2 hrHuang C, et al . J Genet Genomics . 2010 ESC 50 μM 2 hrHua H, et al. Nucleic Acids Res . 2011 fission yeast10 μM 3 hr strainsLv L, et al . Mol Cell Biochem . 2011 EJ cells 50 μM 4hrYang S, et al . Biol Reprod . 2011 GC cells 50 μM 2 hrZhang YW, et al . Nucleic Acids Res . 2011 U2OS, HT29 30 μM 90 minGuo T, et al . PloS One . 2011 HIT-T15 50 μM 4hrZeng T, et al . PloS One . 2011 MCF-10A 25 μM 2hrDing D, et al . Int Orthop . 2011 C3H10T1/2 10 μM 24hrZeng W, et al . Biomaterials . 2011 EPC 50 μM 4hrXue Z, et al . J Cell Biochem . 2011 SGC7901 25 μM 24hrPeng F, et al. Lasers Med Sci . 2011 MSC 50 μM 2hrLi D, et al . J Biol Chem . 2011 HCC 50 μM 2hr注:如果您有采用BrdU 进行实验的经验,可以参照BrdU 实验的相关参数进行EdU 实验。
细胞固定化2.1每孔加入50μL细胞固定液(即含 4% 多聚甲醛的PBS) 室温孵育 30分钟,弃固定液;注:1) 低浓度的多聚甲醛有利于细胞结构的保持,当需要抗体染色时,需采用Triton X-100透化细胞以利于抗体进入细胞内。
2) 可采用其他方式进行细胞固定。
2.2每孔加入50μL 2 mg/mL甘氨酸,脱色摇床孵育 5 分钟后,弃甘氨酸溶液;注:目的是中和多聚甲醛,保证染色反应体系,当采用其他方式进行细胞固定时可酌情省略此步骤;2.3每孔加入100μL PBS,脱色摇床清洗5分钟,弃PBS ;2.4 ( 加强 )每孔加入 100 μL 渗透剂 (0.5% TritonX-100的PBS)脱色摇床孵育10分钟;PBS清洗1次, 5分钟。
注:当实验需要进行其他抗体染色时,或由于某些细胞类型对染料的吸附性较高,可能需要增强细胞膜通透性。
普通细胞可以省略。
Apollo染色3.1每孔加入100μL的1X Apollo ?染色反应液(表3),避光、室温、脱色摇床孵育30分钟后,弃染色反应液;注: 1) 染色液用量与细胞量相关,以覆盖细胞为宜(表1) ;2) 孵育时间可以进行适当调整,调整范围为10~30 分钟。
表 4 Apollo ? 染色反应液的配置参考(现用现配 )1 去离子水469 μL 938 μL 4.69 mL 9.38 mL2 Apollo ?反应缓冲液(试剂 B) 25 μL 50 μL 250 μL 500 μL3 Apollo ?催化剂溶液(试剂 C) 5 μL 10 μL 50 μL 100 μL4 Apollo ?荧光染料溶液(试剂 1.5 μL 3 μL 15 μL 30 μLD)5 Apollo ?缓冲添加剂(试剂 E) 5 mg 9 mg 44 mg 88 mg注: 1)* 表示通常配制的Apollo ? 反应液的体积足以进行5~ 10 个孔 (96 孔板 )染色;2) 按顺序配制适量1X Apollo ? 染色反应液,以免破坏正常的反应体系(现用现配,30 分钟用完 );3)试剂 E 为白色粉末,较易氧化,使用后请旋紧管盖,如试剂出现棕黄色,则需更换;粉末较难准确称量,称量误差范围可稍微放宽,但不应超过±20% 。
3.2加入100 μL 渗透剂 (0.5% TritonX-100 的PBS) 脱色摇床清洗2~3 次,每次10分钟,弃渗透剂;3.3 ( 加强 )每孔每次加入100 μL 甲醇清洗 1~2 次,每次 5 分钟; PBS 清洗 1次,每次 5 分钟。
注:由于某些细胞对染料的吸附性较高,需采用加强方式洗脱以降低染料背景。
普通实验可以省略。
DNA 染色4.1用去离子水按100 :1 的比例稀释试剂F,制备适量1X Hoechst33342 反应液,避光保存;4.2每孔加入100 μL 1X Hoechst 33342 反应液,避光、室温、脱色摇床孵育30 分钟后,弃染色反应液;4.3每孔每次加入100 μL PBS 清洗 1~3 次;4.4客户可选择进行其他染色步骤,否则每孔加入100 μL PBS 保存待用。
其他染色 (自备 )(可选 )客户可以根据实验需要进行细胞表面或细胞内抗原的抗体染色(注:染料兼容性请参照表 4)。
图像获取及分析建议染色完成后立即进行观测 ;如果条件限制,请避光 4℃湿润保存待测,但不应超过 3 天。
注:调试仪器时,请将曝光时间调整为30ms 左右,尽量不要 >1s 。
表 5 配套染料的相关波长信息C00031* Apollo ? 567 550 nm 565 nm Cy3 C00041 Apollo ? 643 653 nm 667 nm Cy5 C00033* Hoechst 33342 350 nm 461 nm DAPI注: 1)* 荧光显微镜宜采用Hoechst 33342及Apollo ? 567进行DNA复制活性检测;2) 激光共聚焦显微镜采用Apollo ? 567 或 Apollo ? 643 均可。
