37高中化学58个精讲_(37)_铁和铁的化合物
高三化学 铁和铁的化合物 知识精讲 人教版

高三化学铁和铁的化合物知识精讲人教版一. 本周教学内容:铁和铁的化合物二. 重点、难点:1. 常识性介绍过渡元素的概念2. 掌握铁的化学性质3. 理解铁盐和亚铁盐的相互转变4. 了解铁的氧化物和氢氧化物5. 掌握铁离子的检验方法三. 具体内容:1. Fe+O2=2. Fe+H2O=3.Fe+S=4. Fe+Cl2=5. Fe+H2SO4=6. Fe+CuSO4=7. FeO+HCl=8. Fe2O3+HCl=9. Fe3O4+HCl=10. FeO+HNO3=11. Fe2O3+HNO3=12. Fe2O3+CO=13. Fe2++Cl2=14. Fe3++Fe=15. Fe3++SCN-=16. Fe3++H2O=17. FeCl3+H2S=18. FeCl3+Na2S=19. FeCl3+Na2S(过量)=20. FeCl3+HI=21. FeCl3+NaI=22. FeCl3+SO2+H2O=23. FeBr2+Cl2=24. FeI2+Cl2=25. FeI2+Br2=26. FeSO4+Cl2=27. FeCl2+Br2=28. FeCl2+NaOH=29. FeCl3+NaOH=30. FeCl3+NH3·H2O=31.=+HCl OH Fe 2)( 32.=++O H O OH Fe 222)( 33. =+HCl OH Fe 3)( 34. =+32)(HNO OH Fe 35. =3)(OH Fe 36. FeS 2+O 2=【典型例题】[例1] 要证明某溶液中不含Fe 3+而可能含有Fe 2+进行如下实验操作时最佳顺序为( )① 加入足量氯水 ② 加入足量KMnO 4溶液 ③ 加入少量NH 4SCN 溶液 A. ①③ B. ③② C. ③① D. ①②③解析:加入NH 4SCN 证明无Fe 3+,再加Cl 2水,如有Fe 2+则可被氧化为Fe 3+而使NH 4SCN 变红色。
高中化学知识点:铁及其化合物

高中化学知识点:铁及其化合物高中化学知识点:铁及其化合物铁的存在和主要性质铁是一种活泼的元素,具有较强的还原性,主要化合价为+2价和+3价。
它在自然界中广泛存在,并且在生活中有着重要的应用。
铁的化学性质铁与非金属单质的反应包括与氧气、氯气和硫的反应。
在常温下,铁会被氧气腐蚀生成铁锈,其中主要成分为Fe2O3·xH2O。
当加热时,铁会与氧气反应生成Fe3O4.铁还可以与氯气和硫反应生成FeCl3和FeS。
在与水的反应中,常温下铁不会与水反应,但在高温条件下,铁会与水蒸气反应生成Fe3O4和H2.铁还可以与酸反应,包括与非氧化性酸和氧化性酸的反应。
与非氧化性酸反应时,铁会被氢离子还原成Fe2+离子,并释放出氢气。
与氧化性酸反应时,铁会被氧化成Fe3+离子,并释放出氮氧化物和水。
铁还可以与某些盐溶液反应,包括与CuSO4溶液反应生成Cu和FeSO4,以及与FeCl3溶液反应生成Fe2+和Fe3+离子。
铁的重要化合物铁的氧化物包括FeO、Fe2O3和Fe3O4.这些化合物可以与盐酸反应生成Fe2+离子和水。
FeO还可以与硝酸反应生成Fe(NO3)3、NO和H2O。
铁的氢氧化物包括Fe(OH)2和Fe(OH)3.这些化合物可以与H+反应生成Fe2+或Fe3+离子和水。
在空气中,Fe(OH)2会迅速被氧气氧化成Fe(OH)3,现象是白色固体变成红褐色固体。
此外,氧化亚铁(FeO)、氧化铁(Fe2O3)和四氧化三铁(Fe3O4)也是铁的重要氧化物,它们分别呈黑色粉末、红棕色粉末和磁性氧化铁黑色晶体。
Fe2+、Fe3+→Fe+2Fe3+→3Fe2+、Fe+2H+→Fe2++H2↑点燃Fe→Fe3O4的两个反应:3Fe+2O2→Fe3O4高温3Fe+4H2O(g)→Fe3O4+4H2铁的三种氧化物,两种氢氧化物,两种离子的颜色:FeO与Fe3O4均为黑色,Fe2O3为红棕色;Fe(OH)2为白色,Fe(OH)3为红褐色;Fe2+为浅绿色,Fe3+为棕黄色。
高一化学铁的化合物知识点

高一化学铁的化合物知识点铁的化合物知识点铁是一种常见的金属元素,在自然界中广泛存在,并且在日常生活和工业生产中有着重要的应用价值。
在化学中,铁还可以与其他元素形成各种化合物,这些化合物在科学研究和工业生产中都起着重要的作用。
本文将介绍一些关于铁的化合物的知识点。
1. 氧化物铁可以与氧反应形成多种氧化物,其中最常见的是氧化铁。
氧化铁根据氧化态的不同可以分为三种类型:FeO,Fe2O3和Fe3O4。
- FeO是一种亚铁氧化物,其中铁的氧化态为+2。
它是黑色的固体,在高温下可以由氧化铁的还原反应制备。
- Fe2O3是一种三铁氧化物,其中铁的氧化态为+3。
它具有红色的颜色,被广泛应用于颜料和陶瓷工业。
- Fe3O4是一种混合氧化物,其中铁的氧化态既有+2又有+3。
它是黑色的磁性固体,常用于磁性材料的制备。
2. 氢化物铁与氢也可以反应形成氢化铁。
氢化铁是一种非常活泼的化合物,具有剧烈的反应性。
它可以与酸类反应产生氢气,并且在空气中很快氧化生成氢氧化铁。
3. 硫化物铁与硫也会发生反应生成硫化铁。
硫化铁具有黑色的外观,常用于磨料和润滑剂的生产。
4. 碳酸盐铁的碳酸盐包括碱式碳酸铁和绿矾。
碱式碳酸铁是一种白色的固体物质,常用于制备其他铁化合物。
绿矾是一种常见的铁矾矿,它具有绿色的颜色,并且可以用于木材的防腐和皮革的鞣制。
5. 铁和酸的反应铁可以与酸发生反应,产生相应的盐和氢气。
铁和硫酸反应生成硫酸亚铁,铁和盐酸反应生成氯化亚铁。
总结:铁是一种重要的金属元素,在化学中可以与氧、氢、硫以及酸类等其他元素形成各种化合物。
这些铁的化合物在工业生产和科学研究中起着重要的作用。
熟悉铁的化合物知识点有助于我们更好地理解和应用化学知识。
高中化学-铁和铁的化合物教案

高中化学-铁和铁的化合物教案-CAL-FENGHAI.-(YICAI)-Company One1铁和铁的化合物教案一、教学目标:知识目标:1、知道铁的物理性质,理解铁的化学性质2、了解铁的氧化物和氢氧化物;3、理解铁盐和亚铁盐的相互转变;4、掌握铁离子的检验方法。
能力目标:1、通过演示实验,培养学生的观察能力;2、培养学生分析问题的方法,提高综合运用知识的能力。
德育目标:1、通过实验现象的观察和总结,2、培养学生实事求事的科学精神。
二、教学重点:铁的化学性质;铁盐和亚铁盐的转变;铁离子的检验。
三、教学难点:二价铁和三价铁的相互转化。
四、教学内容:第一课时铁的性质[引言]我国的劳动人民在春秋时期就会冶铁,比欧洲早近2000年,并且我国铁矿石的储量居世界第一,从1996年开始我国年钢产量连续超1亿吨,居世界首位。
人类使用铁已有好几千年的历史了,目前已发现的金属虽然已有90种,但其中应用最广泛、用量最多的仍然是铁。
小到铁钉,大到桥梁、铁道、舰船、车辆和各种机械等,都需要大量的钢铁来制造。
就连动植物体内也含有铁,人体内缺铁会导致缺铁性贫血。
这节课我们一起来研究铁和铁的化合物。
[板书]第二节铁和铁的化合物[讲]首先大家回忆地壳中含量最多的元素是什么元素含量最多的金属元素呢位于第二位的金属呢地壳中铁含量为4.65%,位于金属中第二位。
[板书]一、铁单质1.含量:4.65%[讲]铁是我们天天都见的物质,那么铁在自然界中是以什么形态存在呢?她在自然界中可以以单质形态存在,更多的以+2价和+3价的化合态存在。
单质的铁主要以陨铁形式存在,化合态的铁在自然界中主要以铁矿石的形式存在,如铁矿石(FeS2)、赤铁矿(Fe2O3)、磁铁矿(Fe3O4)。
[板书]2.存在状态:单质:陨铁化合态:铁矿石(FeS2)、赤铁矿(Fe2O3)、磁铁矿(Fe3O4)2[讲]根据你们所熟悉的铁制品,铁有哪些物理性质呢?[板书]3.物理性质:银白色,有金属光泽,质软;具有良好的延展性;是电和热的良导体;密度是7.86g/cm3;熔点1535℃;沸点是2750℃4.特性:能被磁体吸引,具铁磁性.[讲]我们日常见到的铁大多数为合金,而纯铁为银白色,有金属光泽,质软;具有良好的延展性;是电和热的良导体;能被磁体吸引,具铁磁性.学习一种物质,我们不但要知道它的物理性质,更重要的是学习它的化学性质。
高中化学铁和铁的化合物专题(二)

铁和铁的化合物专题(二)三、Fe2+和Fe3+之间相互转化及检验从Fe2+和Fe3+的结构可知:Fe3+通常只有氧化性,Fe2+既具有氧化性又具有还原性。
上述微粒通过跟一定的氧化剂或还原剂发生氧化还原反应,才能实现不同价态的铁相互转化,如下图:氧化剂:Cl2、O2、HNO3、KMnO4、H2O2还原剂:Fe、Cu、I-、S2-、H2S1.学习铁及其化合物的性质要注意:(1)抓价态:从铁元素三种价态的相互转化(铁三角关系)去认识铁及其化合物间的氧化—还原反应规律.(2)想属类:如铁是一种比较活泼的过渡金属,氧化亚铁、氧化铁为碱性氧化物,氢氧化亚铁、氢氧化铁为不溶性弱碱,氯化铁为强酸弱碱盐,由此去分析理解它们各自所具有的性质.2.铁元素的原子在化学反应中,当遇弱氧化剂(如S、H+、Cu2+、I2等)时,铁只能失去最外层的两个电子,而生成+2价铁的化合物,当遇到强氧化剂(如Cl2、Br2、HNO3等)时,铁原子可以再失去次外层上的一个电子而生成+3价铁的化合物.3.具体反应有:(1)Fe2+→Fe3+①2Fe2++Cl2=2Fe3++2C l-(在亚铁盐溶液中通入氯气,溶液由浅绿色变为棕黄色)。
②4Fe2++O2+4H+=4Fe3++2H2O(亚铁盐溶液在空气中容易变质,如绿矾露置于空气中则是:12FeSO4+3O2=4Fe2(SO4)3+2Fe2O3)③3Fe2++NO3-+4H+=3Fe3++2H2O+NO↑④5Fe2++MnO4-+8H+=5Fe3++4H2O+Mn2+如在FeCl2溶液中滴加酸性KMnO4溶液,溶液由浅绿色变棕黄色,在酸性KMnO4溶液滴加FeCl2溶液,溶液由紫红变棕黄。
⑤2Fe2++H2O2+2H+=2Fe3++2H2O(2)Fe3+→Fe2+①2Fe3++S2-=2Fe2++S,如在FeCl3溶液中滴加适量的Na2S溶液,溶液变浑浊,滤去沉淀则滤液为浅绿色;如加入过量的Na2S溶液,,则又有黑色沉淀生成(FeS),向Fe3+溶液中通入H2S气体的离子方程式为:2Fe2++H2S=2Fe3++2H++S↓。
铁和铁的化合物课件

配位反应机理
配位反应
铁的化合物可以与配位体发生配位反应,形成稳定的配位化合物。
配位数
在配位反应中,铁原子可以与多个配位体形成配位键,形成不同配 位数的配位化合物。
配位效应
配位反应会影响铁化合物的溶解度、稳定性、颜色和磁性等性质, 从而影响其在不同应用领域中的表现。
THANKS
感谢观看
铁化合物如氧化铁、硫酸铁等也常用于钢铁工业中,作为颜料、脱硫剂、催化剂 等。
农业肥料
01
铁元素是植物生长所必需的微量 元素之一,对于叶绿素合成和植 物光合作用具有重要作用。
02
铁化合物如硫酸亚铁、氯化亚铁 等常作为农业肥料使用,补充土 壤中铁元素的不足,促进植物健 康生长。
医药领域
铁元素在人体内具有重要生理功能, 是血红蛋白、肌红蛋白等的重要组成 部分,参与氧的运输和细胞呼吸过程。
氯化铁
总结词
氯化铁是一种具有强腐蚀性的铁化合物,主要用于制造染料 和催化剂等。
详细描述
氯化铁是一种棕黄色的结晶或粉末,具有强烈的腐蚀性,因 此需要谨慎处理。在工业上,氯化铁主要用于制造染料、油 漆和催化剂等产品,同时也是一种有效的金属蚀刻剂。
硝酸 铁
总结词
硝酸铁是一种易溶于水的铁化合物, 主要用于制备其他铁盐和作为分析试 剂。
铁的物理性质
颜色与状态
纯铁是银白色的金属,具有金属光泽, 常温下为固态。
密度与硬度
铁的密度约为7.87g/cm³,硬度较高, 具有良好的延展性和导电性。
铁的化学性质
氧化还原反应
铁在常温下能与空气中的氧气反应生成氧化铁,是一种典型的变价金属,能发 生多种氧化还原反应。
与酸反 应
铁和铁的化合物知识点总结
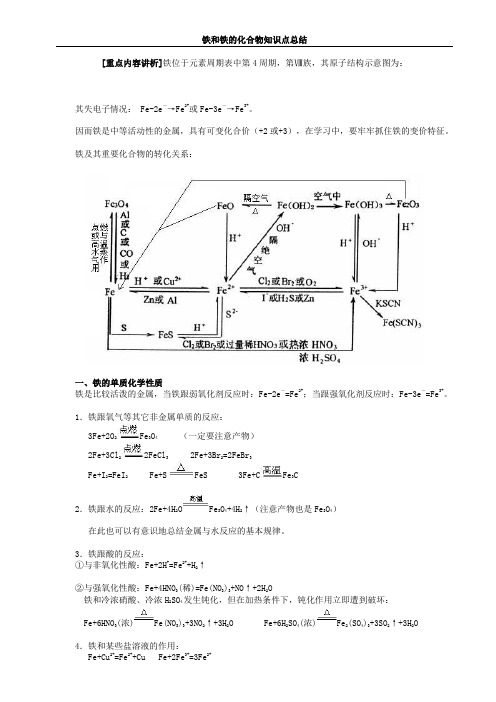
[重点内容讲析]铁位于元素周期表中第4周期,第Ⅷ族,其原子结构示意图为:其失电子情况: Fe-2e-→Fe2+或Fe-3e-→Fe3+。
因而铁是中等活动性的金属,具有可变化合价(+2或+3),在学习中,要牢牢抓住铁的变价特征。
铁及其重要化合物的转化关系:一、铁的单质化学性质铁是比较活泼的金属,当铁跟弱氧化剂反应时:Fe-2e-=Fe2+;当跟强氧化剂反应时:Fe-3e-=Fe3+。
1.铁跟氧气等其它非金属单质的反应:3Fe+2O2Fe3O4 (一定要注意产物)2Fe+3Cl22FeCl3 2Fe+3Br2=2FeBr3Fe+I2=FeI2 Fe+S FeS 3Fe+C Fe3C2.铁跟水的反应:2Fe+4H2O Fe3O4+4H2↑(注意产物也是Fe3O4)在此也可以有意识地总结金属与水反应的基本规律。
3.铁跟酸的反应:①与非氧化性酸:Fe+2H+=Fe2++H2↑②与强氧化性酸:Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O铁和冷浓硝酸、冷浓H2SO4发生钝化,但在加热条件下,钝化作用立即遭到破坏:Fe+6HNO3(浓)Fe(NO3)3+3NO2↑+3H2O Fe+6H2SO4(浓)Fe2(SO4)3+3SO2↑+3H2O4.铁和某些盐溶液的作用:Fe+Cu2+=Fe2++Cu Fe+2Fe3+=3Fe2+这些反应在除杂、鉴别等方面都有一定作用,要理论联系实际,领会和理解反应实质。
二、铁的氧化物,三、铁的氢氧化物1.Fe(OH)2可由易溶性的亚铁盐跟碱溶液起反应制得。
Fe(OH)2为白色絮状沉淀,易被空气中O2迅速氧化成Fe(OH)3。
因此,白色絮状沉淀能迅速变成灰绿色,最终变成红褐色。
Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3制备时:(1)要将滴管口插入硫酸亚铁液面下,再滴入NaOH溶液;(2)配液时可用加热的方法尽可能除去溶解氧;(3)可在液面加少许汽油或苯等有机溶剂,以隔绝空气。
铁和铁的化合物知识精讲

第二节铁和铁的化合物单质 ----- 水反h 站亠瘦反应—“铁二角"—F 出F F 針的检验(一)铁的单质1. 物理性质:铁与其他金属一样,具有金属的通性。
纯铁为银白色,质软,重金属。
铁位于第四周期第忸族, 是过渡金属,有4个电子层,最外层有 2个电子,从它的结构 可以看出,铁容易失去最外层的 2个电子,同时次外层的1个电子也经常参加反应, 因此具 有还原性:Fe 2e Fe 22. 化学性质:(1) 与非金属反应 ①02: ② Cl 2 : ③ S :(2) 铁与水的反应(3)铁与酸的反应(4)铁与盐的反应知识导图制备一F P (OH)厂 合EA 氢氣花£」与盐溶液反应—F/的还性一 的氧化性FeO -1 FezOs - Fc ;iOi 氣化物胶休Fe 3e Fe 3(二)铁的重要化合物 1.2. 铁的氧化物 (1) 不溶于水,不与水反应 (2) 与酸反应 铁的氢氧化物Fe 330H Fe 220H4Fe(0H )2Fe(OH)3 Fe(OH)2 02 2H 2O (红褐色)(白色)4Fe(OH)3铁化合物和亚铁化合物的相互转换3. (三)Fe 3+的检验S 应后溶于水能与Fe 3+反应,又能证明Fe 3+具有氧化性的微粒是(SCN ②Fe ③Fe 2+ ④Cu ⑤ tS⑥OHA. [例6] 离子是(A.只有 Fe 2+B.只有 Fe 3+C.有 Fe 2+和 Cu 2+D.有 Fe 3+和 Cu 2+[例7]根据图中现象和转化推断 A B 、C D E 、F 、G 各是什么物质?写出①②反应的离子方程式,③④反应的化学方程式。
D 黑色沉淀its 邑度 应呈董色注黄色況&[例8]40g 铁粉投入到500g 稀HNO 中,若两物质恰好完全反应( HNO 的还原产物为NC ), 求此稀HNO 的溶质质量分数和生成的气体在标准状况下的体积?【典型例题】[例1]将适量铁粉放入三氯化铁溶液中,完全反应后,溶液中的 反应的Fe 3+和未反应的Fe 3+的物质的量之比是()A.2:3B. 3:2C. 1:2D. 1:1[例2]将括号内的气体通入对应的溶液(或水中),气体只作氧化剂,反应后得一种澄清溶液的是()氢氧化钠溶液(二氧化硫) 水(二氧化氮) Fe 3+和Fe 2+浓度相等。
【化学课件】高三化学专题复习-铁和铁的化合物

已知某种硫酸盐可以用来治疗缺铁性贫血,
2019/4/11
金塔县中学
焦世军
16
1、做老师的只要有一次向学生撒谎撒漏了底,就可能使他的全部教育成果从此为之毁灭。——卢梭 2、教育人就是要形成人的性格。——欧文 3、自我教育需要有非常重要而强有力的促进因素——自尊心、自我尊重感、上进心。——苏霍姆林斯基 4、追求理想是一个人进行自我教育的最初的动力,而没有自我教育就不能想象会有完美的精神生活。我认为,教会学生自己教育自己,这是一种 最高级的技巧和艺术。——苏霍姆林斯基 5、没有时间教育儿子——就意味着没有时间做人。——(前苏联)苏霍姆林斯基 6、教育不是注满一桶水,而且点燃一把火。——叶芝 7、教育技巧的全部奥秘也就在于如何爱护儿童。——苏霍姆林斯基 8、教育的根是苦的,但其果实是甜的。——亚里士多德 9、教育的目的,是替年轻人的终生自修作准备。——R.M.H. 10、教育的目的在于能让青年人毕生进行自我教育。——哈钦斯 11、教育的实质正是在于克服自己身上的动物本能和发展人所特有的全部本性。——(前苏联)苏霍姆林斯基 12、教育的唯一工作与全部工作可以总结在这一概念之中——道德。——赫尔巴特 13、教育儿童通过周围世界的美,人的关系的美而看到的精神的高尚、善良和诚实,并在此基础上在自己身上确立美的品质。——苏霍姆林斯基 14、教育不在于使人知其所未知,而在于按其所未行而行。——园斯金 15、教育工作中的百分之一的废品,就会使国家遭受严重的损失。——马卡连柯 16、教育技巧的全部诀窍就在于抓住儿童的这种上进心,这种道德上的自勉。要是儿童自己不求上进,不知自勉,任何教育者就都不能在他的身 上培养出好的品质。可是只有在集体和教师首先看到儿童优点的那些地方,儿童才会产生上进心。——苏霍姆林斯基 17、教育能开拓人的智力。——贺拉斯 18、作为一个父亲,最大的乐趣就在于:在其有生之年,能够根据自己走过的路来启发教育子女。——蒙田 19、教育上的水是什么就是情,就是爱。教育没有了情爱,就成了无水的池,任你四方形也罢、圆形也罢,总逃不出一个空虚。班主任广博的爱 心就是流淌在班级之池中的水,时刻滋润着学生的心田。——夏丐尊 20、教育不能创造什么,但它能启发儿童创造力以从事于创造工作。——陶行知
高考化学58个精讲铁和铁的化合物知识点的实际运用

考点37铁和铁的化合物1.复习重点1.铁单质的化学性质2.铁的重要化合物的氧化还原性;3.Fe(Ⅱ)、Fe(Ⅲ)的相互转化是高考的热点。
2.难点聚焦一、铁的结构和性质1. 铁是26号元素,位于第四周期第Ⅷ族,属于过渡元素。
原子结构示意图:主要化合价:+2,+32.铁在金属的分类中属于黑色金属,重金属,常见金属。
纯净的铁是光亮的银白色金属,密度为7.86g/㎝3,熔沸点高,有较好的导电、传热性,能被磁铁吸引,也能被磁化。
还原铁粉为黑色粉末。
3.铁是较活泼的金属元素,在金属活动性顺序表中排在氢的前面。
①跟非金属反应: 点燃 点燃 △ 3Fe+2O 2 == Fe 3O 4 2Fe+3Cl 2 ==2FeCl 3 Fe+S= FeS Fe+I 2= FeI 2②跟水反应: 3Fe+4H 2O= Fe 3O 4+4H 2↑③跟酸作用:Fe+2H +=Fe 2++H 2↑(遇冷浓硝酸、浓硫酸钝化;与氧化性酸反应不产生H 2,且氧化性酸过量时生成Fe 3+)④与部分盐溶液反应:Fe+Cu 2+=Fe 2++Cu Fe+2Fe 3+=3Fe 2+3.4.炼铁和炼钢的比较渡金属。
过渡金属的密度一般比较大,熔沸点较高,有较高的硬度、较好的延展性和机械加工性能,较好的导电、导热性能和耐腐蚀性能。
过渡元素的原子最外层电子数不超过两个,在化学反应中,最外层和次外层都容易失去电子,因此过渡元素有可变化合价。
所以当Fe与弱氧化剂反应时,只失去最外层上的2个电子,形成Fe2+;当Fe与强氧化剂反应时,还能进一步失去次外层上的一个电子,形成Fe3+。
这就是铁在其化合物中通常显+2价或+3价的原因。
则Fe发生化学反应能得到+2价还是+3价,需看参加反应的氧化剂的强弱,有时还要看反应物的量之间的关系。
例如:①铁在O2中燃烧的,一定要在集气瓶低留有少量的水或一层沙子,防止瓶子被炸裂;②Fe与S反应中Fe 只能失去其最外层的2个电子而变成+2价,反应开始后撤去酒精灯,反应可以继续进行,说明反应放热;③Fe在Cl2中燃烧时不但能失去最外层的2个电子,而且还可失去次外层的1个电子后成+3价,说明氧化性Cl2>S;④在高温时能与C、P、Si等化合。
铁及其铁的化合物.ppt

我国科学家参与研制的阿尔法磁谱仪随美国 发现号航天飞机升入太空,开始了探索宇宙 中是否存在“反物质”和“暗物质”的研究工作。 根据所学的知识推测制造阿尔法磁谱仪核心 部件的材料是 ( )
A.FeO C.Fe3O4
B.Fe2O3 D.Fe
【答案】 C
2024/10/9
实验-9:FeCl3、FeSO4分别加入NaOH溶液
FeCl3
FeSO4
加入NaOH 溶液产生 的现象
产生红褐色的 沉淀
先有白色的沉淀, 迅速变成灰绿色, 最后变成红褐色。
离子 方程式
Fe2++2OH-=Fe(OH)2 ↓ Fe3++3OH-=Fe(OH)3 ↓ 4=Fe(OH)2+O2+2H2O
4Fe(OH)3
3.铁的氢氧化物
颜色
Fe(OH)2 白色
2、铁的氧化物
化学式 俗名
颜色、状态
FeO
氧化亚铁 黑色粉末
Fe2O3
氧铁化红铁 红棕色粉末
Fe3O4
磁四性氧氧化化三铁铁 黑色晶体
水中溶解性
不溶
不溶
不溶
化学性质 FeO+2HCl
Fe2O3+6HCl Fe3O4+8HCl=FeCl2
(碱性氧化物) =FeCl2+H2O =2FeCl3+3H2O +2FeCl3+4H2O
Fe(OH)3 红褐色
溶解性 与盐酸反应 (离子方程式)
不溶于水 Fe(OH)2+2H+=== Fe2++2H2O
不溶于水
Fe(OH)3+3H+=== Fe3++3H2O
:将下列物质的颜色和用途或性质连接起来。
第三节 铁和铁的化合物(一) 化学课件

古 代 铁 工 具
赤铁矿:Fe2O3 磁铁矿:Fe3O4 褐铁矿:2Fe2O3· 3H2O 菱铁矿:FeCO3
(1)铁位于元素周期表中第四周期第Ⅷ族 (2)铁的原子结构
Fe 14 2
Fe-2e=Fe2+
Fe-3e=Fe3+。
铁元素的化合价为+2价或+3价。
一、铁单质 (一)铁的物理性质 1.银白色,有金属光泽,质软
K Ca Na Mg Al Zn Fe……
冷水
热水
碱和H2
水蒸气
氧化物和H2
与水反应越来越难
比较:它们的生成物相同吗?
3、铁跟酸的反应
非氧化性酸
(1)铁与盐酸反应:
有弱氧化性(H+)
(2)铁与稀硫酸的反应:
反应实质: Fe + 2H+=== Fe2++ H2↑
(3)铁与硝酸,浓硫酸的反应?
氧化性酸 具有强氧化性
4、与某些盐溶液反应
(1)Fe3+ 【实验】向FeCl3溶液中加入少量铁粉 现象:黄色褪去 原理:2Fe3++Fe=3Fe2+ (2)Cu2+ Fe+Cu2+=Fe2++Cu
化学性质小结
S
Fe
I2 H+ Cu2+
弱氧化剂ห้องสมุดไป่ตู้
O2、H2O
强氧化剂
O2 Cl2 Br2 HNO3 H2SO4(浓)
Fe2+ Fe3+
二、铁的氧化物
名称
FeO
氧化亚铁
Fe3O4
四氧化三铁
Fe2O3
三氧化二铁
俗名
无
磁性氧化铁
铁红
色态
黑色粉末
黑色晶体
铁和铁的化合物课件【推荐下载】

铁和铁的化合物课件铁和铁的化合物一、铁的性质1.物理性质2.化学性质二、铁的化合物1.铁的氧化物2.铁的氢氧化物3.铁化合物和亚铁化合物间的相互转变4.Fe3+的检验内容提要纯净的铁是光亮的银白色金属。
密度是7.86g/cm3。
熔点是1535℃,沸点是2750℃。
纯铁的抗蚀能力相当强,但通常用的铁,都含有碳和其它元素,使它的熔点显着降低,抗蚀能力也减弱,铁有延展性和导热性,能导电,但比铜、铝都差。
能被磁体吸引,在磁场作用下,自身也能产生磁性。
铁的物理性质一、铁跟氧气和其它非金属的反应1.放在氧气里灼烧,生成黑色的四氧化三铁。
2.跟其它非金属反应铁的化学性质二、铁跟水的反应常温下,铁跟水不反应,但是,在水和空气里的氧气以及二氧化碳等的共同作用下,铁容易生锈而被腐蚀。
氢氧化亚铁的制取:实验现象:滴入氢氧化钠溶液后,开始析出白色絮状沉淀,白色絮状沉淀迅速变为灰绿色,最后变成红褐色。
氢氧化亚铁在空气中氧化成了氢氧化铁。
铁的化合物氢氧化铁溶液在氯化铁溶液中滴加氢氧化钠,生成氢氧化铁。
第一步:取出少量氢氧化钠。
第二步:将氢氧化钠滴加到氯化铁中。
氢氧化钠溶液氯化铁溶液氢氧化铁的制取可溶性盐与碱反应,生成红褐色的氢氧化铁沉淀,反应方程式如下:氢氧化铁溶液氢氧化铁的制取在氯化铁溶液中滴加氢氧化钠,生成氢氧化铁。
第一步:取出少量氢氧化钠。
第二步:将氢氧化钠滴加到氯化铁中。
铁化合物和亚铁化合物间的相互转变——铁的化合物氯化铁溶液Fe3+的检验Fe(SCN)3溶液硫氢化钾溶液第一步:从试剂瓶中取出少许硫氢化钾溶液。
第二步:往氯化钾溶液中,滴加硫氢化钾溶液,氯化钾溶液变红。
Fe(SCN)3溶液Fe3+的检验硫氢化钾溶液第一步:从试剂瓶中取出少许硫氢化钾溶液。
第二步:往氯化铁溶液中,滴加硫氢化钾溶液,氯化铁溶液变红。
第三步:往氯化亚铁溶液中,滴加硫氢化钾溶液,氯化亚铁溶液不变色。
FeCl2。
高二化学铁和铁的化合物知识精讲1 人教版

高二化学铁和铁的化合物知识精讲 人教版一. 本周教学内容: 铁和铁的化合物一. Fe 遇不同强度氧化剂反应若氧化剂氧化性比Fe 3+强,则被氧化成Fe 3+,如: 23223Fe Cl FeCl +−→−∆若氧化剂氧化性比Fe 3+弱,则被氧化成Fe 2+,如 Fe S FeS +−→−∆Fe I FeI +−→−22∆二. 铁化合物与亚铁化合物的相互转变 123.Fe Fe ++−→−−−−−失电子与氧化剂反应常见氧化剂有:Cl 2、Br 2、O 2、HNO 3、浓H 2SO 4、H 2O 2、KMnO 4(H +)溶液、HClO 、K 2Cr 2O 7溶液等。
6322422433FeSO Cl Fe SO FeCl +→+() 2. Fe Fe ++−→−−−−−32得电子与还原剂反应常见还原剂有:H 2S 、HI 、S 2-、I -、SO 2、Mg 、Al 、Zn 、Fe 、Cu 等。
22322Fe Cu Cu Fe ++++→+【疑难解析】恰好能溶解28g Fe 的热浓HNO 3,最多能溶解Cu 的质量为________g 。
解析:Fe 和浓HNO 3常温时钝化,加热时可以反应。
由于HNO 3是强氧化剂,它可以将Fe 氧化成Fe 3+,但同时若有过量的Fe ,则Fe 可将生成的Fe 3+还原成Fe 2+,所以Fe 和HNO 3反应后的氧化产物可能有三种情况:(1)Fe(NO 3)3; (2)Fe(NO 3)3和Fe(NO 3)2;(3)Fe(NO 3)2到底是哪种情况,取决于起始时Fe 和HNO 3的相对量的多少。
依题意分析,要求28g Fe 消耗HNO 3的量为最大值,由电子转移守恒可知,应保证氧化产物都为Fe(NO 3)2,即:Fe HNO Fe NO NO H O +−→−+↑+42233222()()浓∆Cu HNO Cu NO NO H O +−→−+↑+42233222()()浓∆ 即:Fe ~4HNO 3(浓)~Cu 得m (Cu )=32g 其实我们也可以直接用电子转移守恒计算:28562642g g mol m Cu /()⨯=⨯m Cu g ()=32【例题详解】例1. 将热的铁片分别放入下列足量的溶液中,使溶液质量减轻的有( ) A. 浓HNO 3B. FeCl 3C. H 2SO 4D. AgNO 3解析:判断溶液质量是否减轻,依据是比较质量增加和质量减少值的大小。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
考点37铁和铁的化合物1.复习重点1.铁单质的化学性质2.铁的重要化合物的氧化还原性;3.Fe(Ⅱ)、Fe(Ⅲ)的相互转化是高考的热点。
2.难点聚焦一、铁的结构和性质1.铁是26号元素,位于第四周期第Ⅷ族,属于过渡元素。
原子结构示意图:主要化合价:+2,+32.铁在金属的分类中属于黑色金属,重金属,常见金属。
纯净的铁是光亮的银白色金属,密度为7.86g/㎝3,熔沸点高,有较好的导电、传热性,能被磁铁吸引,也能被磁化。
还原铁粉为黑色粉末。
3.铁是较活泼的金属元素,在金属活动性顺序表中排在氢的前面。
①跟非金属反应:点燃点燃△3Fe+2O2 == Fe3O4 2Fe+3Cl2 ==2FeCl3 Fe+S= FeSFe+I2= FeI2②跟水反应: 3Fe+4H2O= Fe3O4+4H2↑③跟酸作用:Fe+2H+=Fe2++H2↑(遇冷浓硝酸、浓硫酸钝化;与氧化性酸反应不产生H2,且氧化性酸过量时生成Fe3+)④与部分盐溶液反应:Fe+Cu2+=Fe2++Cu Fe+2Fe3+=3Fe2+3.生铁与钢的比较铁的合金生铁钢含碳量2%~4.3% 0.03%~2%其它杂质含硅、锰、硫、磷较多含硅、锰少量,硫和磷几乎没有机械性能硬而脆、无韧性硬而韧、有弹性机械加工可铸不可锻可铸、可锻、可压延4.炼铁和炼钢的比较炼铁炼钢原料铁矿石、焦炭、石灰石、空气生铁、空气(或纯氧、氧化铁)、生石灰、脱氧剂化学原理在高温下用还原剂从铁矿石里还原出来在高温下用氧化剂把生铁里过多的碳和其它氧化为气体或炉清除去主要反应①还原剂的生成C+O2CO2CO2+C高 温2CO②铁的还原Fe2O3+3CO高 温2Fe+3CO2③炉渣的生成CaCO3高 温CaO+CO2CaO+SiO2高 温CaSiO3①氧化:2Fe+O2高 温2FeOFeO氧化铁水里的Si、Mn、C等。
如C+FeO高 温Fe+CO②造渣:生成的硅锰氧化物得铁水里的硫、磷跟造渣材料反应形成炉渣排出。
③脱氧,并调整Mn、Si含量2FeO+Si高 温2Fe+SiO2主要设备高炉转炉1.过渡元素位于周期表中中部从ⅢB~ⅡB族十个纵行,分属于第四周期至第七周期。
过渡元素都是金属,又叫过渡金属。
过渡金属的密度一般比较大,熔沸点较高,有较高的硬度、较好的延展性和机械加工性能,较好的导电、导热性能和耐腐蚀性能。
过渡元素的原子最外层电子数不超过两个,在化学反应中,最外层和次外层都容易失去电子,因此过渡元素有可变化合价。
所以当Fe与弱氧化剂反应时,只失去最外层上的2个电子,形成Fe2+;当Fe与强氧化剂反应时,还能进一步失去次外层上的一个电子,形成Fe3+。
这就是铁在其化合物中通常显+2价或+3价的原因。
则Fe发生化学反应能得到+2价还是+3价,需看参加反应的氧化剂的强弱,有时还要看反应物的量之间的关系。
例如:①铁在O2中燃烧的,一定要在集气瓶低留有少量的水或一层沙子,防止瓶子被炸裂;②Fe与S反应中Fe只能失去其最外层的2个电子而变成+2价,反应开始后撤去酒精灯,反应可以继续进行,说明反应放热;③Fe在Cl2中燃烧时不但能失去最外层的2个电子,而且还可失去次外层的1个电子后成+3价,说明氧化性Cl2>S;④在高温时能与C、P、Si 等化合。
2.铁的合金一般地说,含碳量在2%~4.3%的铁的合金叫做生铁。
生铁里除含碳外,还含有硅、锰以及少量的硫、磷等,它可铸不可煅。
根据碳的存在形式可分为炼钢生铁、铸造生铁和球墨铸铁等几种。
一般地说,含碳量在0.03%~2%的铁的合金叫做钢。
钢坚硬有韧性、弹性,可以锻打、压延,也可以铸造。
钢的分类方法很多,如果按化学成分分类,钢可以分为碳素钢和合金钢两大类。
碳素钢就是普通的钢。
合金钢也叫特种钢,是在碳素钢是适当地加入一种或几种,如锰、铬、镍、钨、铜等合金元素而制成的。
合金元素使合金钢具有各种不同的特殊性能。
3.炼铁(1)反应原理:利用氧化——还原反应,在高温下,用还原剂(主要是CO)把铁从铁矿石里还原出来。
(2)原料:铁矿石、焦炭、石灰石和空气(3)设备:高炉(4)生产过程①还原剂的生成C+O2点 燃 CO2 CO2+C ∆ 2CO②铁矿石还原成铁Fe2O3+3CO ∆ 2Fe+3CO2↑③除脉石、炉渣的形成CaCO3高 温CaO+CO2↑SiO2+CaO高 温CaSiO34.炼钢(1)设备:氧气顶吹转炉(2)主要原料:炼钢生铁、生石灰、氧气。
(3)反应原理:利用氧化还原反应,在高温下,用氧化剂把生铁中过多的碳和其它杂质氧化为气体或炉渣除去。
(4)炼钢时的主要反应:①氧化剂的生成,热能的来源 2Fe+O2高 温2FeO②降低碳的含量 C+FeO高 温CO+Fe③除去S、P等杂质④加硅铁、锰铁、铝除剩余FeO——脱氧2FeO+Si高 温2Fe+SiO2二、铁的氧化物和氢氧化物1.铁的氧化物的比较铁的氧化物FeO Fe2O3Fe3O4俗称铁红磁性氧化铁色、态黑色粉末黑色晶体红棕色粉末铁的价态+2 +3 +2、+3水溶性难溶于水稳定性不稳定性6FeO+O2=2Fe3O4稳定稳定与酸的反应FeO+2H+=Fe2++H2O Fe2O3+6H+=2Fe3++3H2OFe3O4+8H+=2Fe3++Fe2++4H2O与CO的反应Fe x O y+yCO=xFe+yCO2制取高温熔融,过量的铁与氧气反应Fe(OH)3的分解2Fe(OH)3=Fe2O3铁在氧气中燃烧3Fe+2O2=Fe3O42Fe+O2=2FeO +3H2O2.铁的氢氧化物的比较Fe(OH)2Fe(OH)3物理性质白色,难溶于水的固体红褐色,难溶于水的固体化学性质(1)与非氧化性强酸反应Fe(OH)2+2H+=Fe2++2H2O(2)与氧化性酸反应3Fe(OH)2+10HNO3=3Fe(NO3)3+NO↑+8H2O(3)空气中放置被氧化4Fe(OH)2+2H2O+O2=4Fe(OH)3(1)与酸反应Fe(OH)3+3H+=Fe3++3H2O (2)受热分解2Fe(OH)3=Fe2O3+3H2O制备①煮沸蒸馏水,赶走溶解的氧气②煮沸NaOH溶液,赶走溶解的氧气③配制FeSO4溶液,加少量的还原铁粉④用长滴管将NaOH溶液送入FeSO4溶液液面以下Fe2++2OH-=Fe(OH)2↓将NaOH溶液滴入Fe2(SO4)3溶液中Fe3++3OH-=Fe(OH)3↓1. Fe3O4是复杂的化合物,经研究证明,在Fe3O4晶体中有1/3的Fe是+2价,有2/3的Fe是+3价,可看成FeO·Fe2O3,实际应写成Fe(FeO2)2,即铁酸亚铁盐,不是一般的氧化物。
2.Fe(OH)2和Fe(OH)3从溶液中析出的现象不同,前者是白色絮状沉淀,后者是红褐色沉淀。
而Fe(OH)2极不稳定,易被氧化成Fe(OH)3,反应现象是:白色→灰绿色→红褐色。
若要观察到白色的Fe(OH)2沉淀,需要创造以下条件:(1)排除亚铁盐溶液里的Fe3+离子,以免Fe3+离子直接与OH-结合生成Fe(OH)3。
(2)尽量排除溶液中溶解的氧气(绝对排除是办不到的),以减慢生成的Fe(OH)2被氧化成Fe(OH)3的速度。
反应要用新制备的亚铁盐溶液,并放入少量的铁以防止Fe3+离子产生。
亚铁盐溶液与碱溶液在混合前分别加热以排除溶有的空气,然后,把碱溶液沿着试管壁加入盛亚铁盐溶液的试管中,或把滴管尖嘴直接插入液面下再加入碱溶液,可观察到白色絮状沉淀。
三、Fe、Fe2+和Fe3+之间相互转化及检验从Fe、Fe2+和Fe3+的结构可知:Fe只有还原性,Fe3+通常只有氧化性,Fe2+既具有氧化性又具有还原性。
上述微粒通过跟一定的氧化剂或还原剂发生氧化还原反应,才能实现不同价态的铁相互转化,如下图(常称为铁三角):FeCl2CO Fe3+ CO O2Zn Cu2+ H2 HNO3I-、I2、S Al KMnO4Cl2、O2、HNO3、KMnO4、H2O2Fe2+ Fe、Cu、I-、S2-、H2S Fe3+(溶液为绿色)(溶液为棕黄色)1.学习铁及其化合物的性质要注意:(1)抓价态:从铁元素三种价态的相互转化(铁三角关系)去认识铁及其化合物间的氧化—还原反应规律.(2)想属类:如铁是一种比较活泼的过渡金属,氧化亚铁、氧化铁为碱性氧化物,氢氧化亚铁、氢氧化铁为不溶性弱碱,氯化铁为强酸弱碱盐,由此去分析理解它们各自所具有的性质.2.铁元素的原子在化学反应中,当遇弱氧化剂(如S、H+、Cu2+、I2等)时,铁只能失去最外层的两个电子,而生成+2价铁的化合物,当遇到强氧化剂(如Cl2、Br2、HNO3等)时,铁原子可以再失去次外层上的一个电子而生成+3价铁的化合物.3.具体反应有:(1)Fe2+→Fe3+①2Fe2++Cl2=2Fe3++2Cl-(在亚铁盐溶液中通入氯气,溶液由浅绿色变为棕黄色)。
②4Fe2++O2+4H+=4Fe3++2H2O(亚铁盐溶液在空气中容易变质,如绿矾露置于空气中则是:12FeSO4+3O2=4Fe2(SO4)3+2Fe2O3)③3Fe2++NO3-+4H+=3Fe3++2H2O+NO↑④5Fe2++MnO4-+8H+=5Fe3++4H2O+Mn2+如在FeCl2溶液中滴加酸性KMnO4溶液,溶液由浅绿色变棕黄色,在酸性KMnO4溶液滴加FeCl2溶液,溶液由紫红变棕黄。
⑤2Fe2++H2O2+2H+=2Fe3++2H2O(2)Fe3+→Fe2+①2Fe3++S2+=2Fe2++S,如在FeCl3溶液中滴加适量的Na2S溶液,溶液变浑浊,滤去沉淀则滤液为浅绿色;如加入过量的Na2S溶液,,则又有黑色沉淀生成(FeS),向Fe3+溶液中通入H2S 气体的离子方程式为:2Fe2++H2S=2Fe3++2H++S↓。
②2Fe3++SO32-+2H2O=2Fe2++SO42-+2H+③2Fe3++Fe=3Fe2+,在FeSO3溶液中往往要加铁的原因是可以防止Fe2+被氧化为Fe3+。
④2Fe3++Cu=2Fe2++Cu2+,电路板的制作是利用FeCl3溶液与裸露的铜反应。
⑤2Fe3++2I-=2Fe2++I24.Fe2+和Fe3+的检验(1)Fe2+的检验:方法一:滴加KSCN溶液,无明显现象,再滴加新制氯水,溶液立即变红色。
方法二:滴加NaOH溶液,生成白色絮状沉淀,该沉淀迅速变为灰绿色,最后变为红褐色。
(2)Fe3+的检验:方法一:滴加KSCN溶液或NH4SCN溶液,溶液立即变为血红色。
方法二:滴加NaOH溶液,出现红褐色沉淀。
1.Fe2+和Fe3+的相互转化Fe2+有还原性,高锰酸钾、重铬酸钾、过氧化氢等氧化剂能把它氧化成Fe3+:MnO -4+5Fe 2++8H +=Mn 2++5Fe 3++4H 2O--272O Cr +6Fe 2++14H +=2Cr 3++6Fe 3++7H 2O H 2O 2+2Fe 2++2H +=2F 3++2H 2O在酸性溶液中,空气中的氧也能把Fe 2+氧化:4Fe 2++O 2+4H +=4Fe 3++2H 2O在碱性溶液中,Fe 2+的还原性更强,它能把NO -3和NO -2还原成NH 3,能把Cu 2+还原成金属铜.Fe 3+具有氧化性,它能把I -氧化成I 2:2Fe 3++2I -=2Fe 2++I 2在无线电工业上,常利用FeCl 3溶液来刻蚀铜,制造印刷线路,它们反应的化学方程式是:2Fe 3++Cu=2Fe 2++Cu 2+因此,铜在氯化铁溶液中能作还原剂,而FeCl 3是氧化剂.Fe 3+在酸性溶液中容易被H 2S 、SnCl 2等还原成Fe 2+:2Fe 3++H 2S=2Fe 2++S ↓+2H +2F 3++Sn 2+=2Fe 2++Sn 4+Fe 3+还能被金属铁还原:2Fe 3++Fe=3Fe 2+在亚铁盐溶液中加入铁钉可防止Fe 2+被氧化为Fe 3+.2.Fe 2+和Fe 3+的颜色Fe 2+在水溶液中通常以水合离子[Fe(H 2O)6]2+形式存在,呈淡绿色,并存在下列平衡:[Fe(H 2O)6]2++H 2O [Fe(H 2O)5OH ]++H 2O +这个平衡的pK=9.5,水解的程度很小,溶液近于中性.Fe 3+在酸性溶液中,通常以淡紫色的[Fe(H 2O)6]3+形式存在.三氯化铁以及其他+3价铁盐溶于水后都发生显著的水解,实质是+3价水合铁离子的水解.只有在PH=0左右时,才有[Fe(H 2O)6]3+存在(但由于有阴离子的存在,会生成其他的络离子,影响淡紫色的观察).当PH 为2~3时,水解趋势很明显.它们的水解平衡如下:[Fe(H 2O)6]3++H 2O [Fe(H 2O)5(OH)]2++H 3O +K=10-3.05[Fe(H 2O)5(OH)]2++H 2O [Fe(H 2O)4(OH)2]++H 3O +K=10-3.26生成的碱式离子呈黄色,它可聚合成二聚体: 2[Fe(H 2O)6]3+ [Fe 2(H 2O)8(OH) 2]4++2H 3O +K=10-2.91二聚体是借OH -为桥把2个Fe 3+连结起来形成的多核络离子.溶液的PH 越高,水解聚合的倾向越大,最后逐渐形成胶体,析出红综色水合氧化铁沉淀。
