武汉大学无机及分析化学-2004真题
无机及分析化学章节试题及答案.docx

第一章补充习题一、选择题1. 与0.58% NaCl 溶液产生的渗透压较接近的是溶液()。
(A) 0.1 mol/L 蔗糖溶液 (B) 0.2 mol/L 葡萄糖溶液 (C) 0.1 mol/L 葡萄糖溶液(D) 0.1 mol/L BaCb 溶液2. 25°C 时,总压为10 atm 时,下面几种气体的混合气体中分压最大的是:( )。
(A) O.lg H 2 (B) 1.0 g He (C) 1.0 g N 2 (D) 1.0 g CO 23. 气体与理想气体更接近的条件是( )。
6. 一定愠度下,等体积的甲醛(HCHO)溶液和葡萄糖(C6H12O6)溶液的渗透压相等,溶液中甲醛和葡萄糖的质量比是( )。
(A) 6 : 1(B)1 :6(C) 1:3(D) 3:1 7. 下列相同浓度的稀溶液,蒸气压最高的是( )o(A) HAc 溶液 (B) CaCh 溶液 (C)蔗糖水溶液 (D) NaCl 水溶液 8. 取相同质量的下列物质融化路面的冰雪,效果最好的是()。
(A)氯化钠 (B)氯化钙 (C)尿素[CO(NH 2)2] (D)蔗糖9. 在一定的外压下,易挥发的纯溶剂A 中加入不挥发的溶质B 形成稀溶液。
此稀溶液的沸点随着加的增加而 ()。
(A) 升高(B)降低 (C)不发生变化 (D) 无一定变化规律 10.室温25°C 时,0.1 mol/L 糖水溶液的渗透压为()o(A) 25 kPa(B) 101.3 kPa (C) 248 kPa (D) 227 kPa11. 盐碱地的农作物长势不良,甚至枯萎,其主要原因为()。
(A)天气太热 (B)很少下雨 (C)肥料不足 (D)水分从植物向土壤倒流12. 37°C,人体血液的渗透压为780kPa,与血液具有相同渗透压的葡萄糖静脉注射液浓度是()。
(A) 85 g/L (B) 5.4 g/L (C) 54 g/L (D)8.5 g/L 13. 有一半透膜,将水和某溶质水溶液隔开,其结果是()。
武大__无机化学期末试卷B

(A) 降低了正反应的活化能,升高了逆反应的活化能,使化学平衡向正反应方向移动,
因而加速了化学反应
(B) 催化剂参加了化学反应,改变了反应历程,降低了反应活化能,因而加速了化学
反应
(C) 改变了反应的自由焓变,即使 ΔG 变为负值,ΔG 越负,正反应越易进行,因而
加速了化学反应
(D) 使反应物分子之间的碰撞次数增加,从而提高了反应速率
= (3) C(石墨) C(金刚石)
ΔH1
(B) 达到平衡状态 (D) 方向无法判断
(B) ΔS > 0,ΔG < 0
(D) ΔG < 0,ΔS < 0
(B) b > a > c > d
(D) a > b > d > c
(B) Si + Cl+ Si+ + C
(D) Cl + F Cl + F
)
ห้องสมุดไป่ตู้
(A) 该处 1s 电子云最大
(B) r 是 1s 径向分布函数的平均值
(C) 该处为 H 原子 Bohr 半径
(D) 该处是 1s 电子云界面
9.
均相催化剂加速化学反应的原因是………………………………………………… (
)
对全部高中资料试卷电气设备,在安装过程中以及安装结束后进行高中资料试卷调整试验;通电检查所有设备高中资料电试力卷保相护互装作置用调与试相技互术关,系电,力根保通据护过生高管产中线工资敷艺料设高试技中卷术资配,料置不试技仅卷术可要是以求指解,机决对组吊电在顶气进层设行配备继置进电不行保规空护范载高与中带资负料荷试下卷高总问中体题资配,料置而试时且卷,可调需保控要障试在各验最类;大管对限路设度习备内题进来到行确位调保。整机在使组管其高路在中敷正资设常料过工试程况卷中下安,与全要过,加度并强工且看作尽护下可关都能于可地管以缩路正小高常故中工障资作高料;中试对资卷于料连继试接电卷管保破口护坏处进范理行围高整,中核或资对者料定对试值某卷,些弯审异扁核常度与高固校中定对资盒图料位纸试置,.卷编保工写护况复层进杂防行设腐自备跨动与接处装地理置线,高弯尤中曲其资半要料径避试标免卷高错调等误试,高方要中案求资,技料编术试5写交卷、重底保电要。护气设管装设备线置备4高敷动调、中设作试电资技,高气料术并中课3试中且资件、卷包拒料中管试含绝试调路验线动卷试敷方槽作技设案、,术技以管来术及架避系等免统多不启项必动方要方式高案,中;为资对解料整决试套高卷启中突动语然过文停程电机中气。高课因中件此资中,料管电试壁力卷薄高电、中气接资设口料备不试进严卷行等保调问护试题装工,置作合调并理试且利技进用术行管,过线要关敷求运设电行技力高术保中。护资线装料缆置试敷做卷设到技原准术则确指:灵导在活。分。对线对于盒于调处差试,动过当保程不护中同装高电置中压高资回中料路资试交料卷叉试技时卷术,调问应试题采技,用术作金是为属指调隔发试板电人进机员行一,隔变需开压要处器在理组事;在前同发掌一生握线内图槽部纸内故资,障料强时、电,设回需备路要制须进造同行厂时外家切部出断电具习源高题高中电中资源资料,料试线试卷缆卷试敷切验设除报完从告毕而与,采相要用关进高技行中术检资资查料料和试,检卷并测主且处要了理保解。护现装场置设。备高中资料试卷布置情况与有关高中资料试卷电气系统接线等情况,然后根据规范与规程规定,制定设备调试高中资料试卷方案。
无机与分析化学试题库完整

⽆机与分析化学试题库完整⽆机及分析化学试题库⼀、选择题1、下列电解质对Fe(OH)3正溶胶聚沉能⼒最⼤的是(A)A Na3PO4B MgSO4C NaClD MgCl22、将难挥发的⾮电解质溶于溶剂后,将会引起( D )A 沸点下降B 凝固点升⾼C 渗透压下降D 蒸⽓压下降3、易挥发溶质溶于溶剂之后可能会引起( C )A 沸点上升B 凝固点降低C 蒸⽓压上升D 渗透压下降4、在H3AsO3的稀溶液中通⼊过量的H2S得到As2S3溶胶,其胶团结构式为( C )A [(As2S3)m· nHS—]n-·nH+B [(As2S3)m· nH+ ]n+·nHS—C [(As2S3)m· nHS—·(n—x)H+ ]x-·xH+D [(As2S3)m· nH+·(n—x)HS—]x+·x HS—5、在外电场的作⽤下,溶胶粒⼦向某个电极移动的现象称为( A )A 电泳B 电渗C 布郎运动D 丁达尔效应6、100g⽔溶解20g⾮电解质的溶液,经实验测得该溶液在-5.85℃凝固,该溶质的分⼦量为( D )(已知⽔的K f =1.86 K·Kg/mol)A 33B 507、给定可逆反应,当温度由T1升⾄T2时,平衡常数K2>K1,则该反应的( A ) AΔH>0 BΔH<0 CΔH=0 D⽆法判断8、下列反应中, 哪个是表⽰ΔHθ=ΔH fθAgBr(s)的反应?( C )A Ag+ (aq) +Br-(aq)=AgBr (s)B 2Ag(s) +Br2 =2AgBr (s)C Ag (s) +1/2Br2 ( l ) =AgBr (s)D Ag (s)+1/2Br2 (S) =AgBr (s)9、通常情况下, 平衡常数K a, K b, K w, K h的共性是 ( D )A与温度⽆关B受催化剂影响C与溶质的种类⽆关D 与浓度⽆关10、根据ΔG f (NO,g)=86.5KJ/mol, ΔG f (NO2,g)=51.3KJ/mol判断反应(1) N2(g)+O2(g) = 2NO(g),(2) 2NO(g)+O2(g) = 2NO2(g)的⾃发性,结论正确的是( A )A (2)⾃发(1)不⾃发B (1)和(2)都不⾃发C (1)⾃发(2)不⾃发D (1)和(2)都⾃发11、已知在标准状态下,反应N2(g)+2O2(g) → 2NO2(g), Δr H mθ=67.8 KJ/mol,则NO2(g)的标准⽣成焓为( B )KJ/mol。
武汉大学分析化学试卷

武汉大学分析化学试卷武汉大学分析化学试卷篇一:武汉大学分析化学试卷及答案武汉大学2005-2006学年度第一学期《分析化学》期末考试试卷(A)学号姓名院(系)分数一.填空(每空1分。
共35分)1.写出下列各体系的质子条件式:(1) c1(mol/L) NH4 H2PO4(2) c1(mol/L)NaAc+ c2(mol/L)H3BO3 2.符合朗伯-比尔定律的有色溶液,当有色物质的浓度增大时,其最大吸收波长,透射比。
3. 检验两组结果是否存在显著性差异采用检验法,检验两组数据的精密度是否存在显著性差异采用检验法。
4.二元弱酸H2B,已知pH=1.92时,δH2B =δHB-;pH=6.22时δH2B的pKa1=,pKa2=。
HB-=δB2-, 则5.已知??(Fe3+/Fe2+)=0.68V,??(Ce4+/Ce3+)=1.44V,则在1mol/L H2SO4溶液中用0.1000 mol/L Ce4+滴定0.1000 mol/L Fe2+,当滴定分数为0.5时的电位为,化学计量点电位为,电位突跃范围是。
6.以二甲酚橙(XO)为指示剂在六亚甲基四胺缓冲溶液中用Zn2+滴定EDTA,终点时溶液颜色由_________变为__________。
7.某溶液含Fe3+10mg,用等体积的有机溶剂萃取一次后,该溶液中剩余0.1mg,3+则Fe在两相中的分配比= 。
8.容量分析法中滴定方式有, ,和。
9.I2与Na2S2O3的反应式为。
10.以波长为横坐标,吸光度为纵坐标,测量某物质对不同波长光的吸收程度,所获得的曲线称谓;光吸收最大处的波长叫做,可用符号表示。
11.紫外可见分光光度计主要由, ,, 四部分组成. 12.桑德尔灵敏度以符号表示,等于;桑德尔灵敏度与溶液浓度关,与波长关。
13.在纸色谱分离中,是固定相。
14..定量分析过程包括,, ,和。
二、简答题(每小题4分,共20 分,答在所留空白处)1. 什么是基准物质?什么是标准溶液?2. 分别简单阐述酸碱滴定指示剂,络合滴定指示剂, 氧化还原滴定指示剂和沉淀滴定指示剂指示滴定终点的原理.3. 在进行络合滴定时,为什么要加入缓冲溶液控制滴定体系保持一定的pH?4. 吸光光度法中测量条件的选择应注意哪几点?5. 分析化学中常用的分离和富集方法有哪些?(回答不能少于8种方法)三、分析方法设计(共15分,写在答题纸上)1. 设计测定含有中性杂质的Na2CO3与Na3PO4混合物中二组分质量分数的分析方案。
化学2004

试题312 试题名称:化学 注意:答题一律答在答题纸上,答在草稿纸或试卷上一律无效无机化学部分(75分)一、单选题(每题二分)1mol/Kg 的下列物质溶液沸点大小顺序是A 32AICl ZnCl NaCl >>B NaCl ZnCl AICl >>23C 23ZnCl AICl NaCl >>D 32AICl ZnCl NaCl ==2. 以下关于溶胶的叙述,正确的是A.均相,稳定,粒子能通过半透膜 B 多相,比较稳定,粒子不能通过半透膜C 均相,比较稳定,粒子能通过半透膜D 多相,稳定,粒子不能通过半透膜3. 乙醇,丙酮能使高分子溶液聚沉,原因是A 它们有强烈亲水性B 它们不溶解高分子化合物C 它们使高分子化合物失去电荷D 它们本身可以电离4. 关于自发反应以下说法正确的是A 自发反应是放热反应B 自发反应在一定条件下可达平衡C 自发反应是吸热反应D 自发反应是可逆反应5. 恒压下,某反应A(s)+B(g)=2C(g)为放热反应,则反应体系的A ΔU>0,W>0B ΔU>0,W<0C ΔU<0,W<0D ΔU<0,W>06. 标准状态时下列哪一物质的m m f m f S H G ,,∆∆都是0A 氧气B 金属CaC H 离子D OH 离子7. 催化剂不能改变的是A 正反应速度B 逆反应速度C 反应活化能D 反应自由能8. 勒夏特列原理适用于A 等容体系B 开放体系C 孤立体系D 平衡体系9. 反应)()()()(222g O H g CO g H g CO +=+ 等容条件下,对于水的摩尔质量有影响的步骤是A 降低温度B 降低压力C 增加压力D 加入氮气10. 根据稀释定律和解离度成正比关系的是A 浓度cB cC KaD Ka11. 下列溶液pH 值最大的是A 0.10mol/LHAcB 0.010mol/LHClC 0.10mol/LNH 4ClD 0.00010mol/LHCl12. 实验测定100ml0.01mol/L 2NaNO 水溶液的pH 值是8.0,则为的Ka HNO 2A 1210-B 810-C 610-D 410-13. 溶液中,当122)(101.8332-⨯=⋅=+CO Ag CO Ag SP C C K 时可以说明的是A 银离子浓度是碳酸根的二倍B Ag 2CO 3不容易电离C 溶液是Ag 2CO 3的饱和溶液D 银离子浓度等于碳酸根浓度14.某难溶电解质AB 2的饱和溶液中是其θsp K L ymol B L xmol A /][,/][2==--A y x ⋅B 2y x ⋅C 2)2(y xD 25.0xy15.按氧化还原方程式可以写出或查出反应自由能,热效应,平衡常数和电动势,其中和方程式写法无关的是A E (电动势)B rG ∆C rH ∆D θK16..已知-−−→−−−→−−→−−−→−=-I I HIO HIO IO H V E V V V I IO H 54.0245.0370.065/,37.065则=--IO IO E /3A 0.30VB 0.21VC 0.18VD 0.1417.已知则)()(CuS K ZnS K sp sp θθ>A θθθZnS S S S CuS S E E E ///2>>-B θθθ->>2///S S Z n S S C u S S E E E C θθθCuS S ZnS S S S E E E ///2>>- D θθθCuS S S S ZnS S E E E ///2>>-18.提出微观粒子有波粒二象性的是A PlanckB de BroglieC EinsteinD Bohr19.关于波函数ψ说法正确的是A 一种原子有一种波函数B 一种波函数对应电子一种运动状态C 波函数有明确物理意义D. 波函.数代表电子在某处出现的概率20.已知某元素在序号36前,此元素失去三个电子后,它的角量子数为二的轨道内电子恰好半充满,此元素序号为A 25B 26C 27D 2821.产生能级分裂现象的主要原因是A 屏蔽效应和钻穿效应B Pauli 不相容原理C Slater 规则D 能量最低原理22.钼原子外层电子排布是1554s d ,这样排布的主要依据是A Slater 规则B Hund 规则C Pauli 不相容原理 D. 能量最低原理23.二个具有单电子的原子互相靠近,可能形成共价键的条件是A 二电子自旋方向不同B 二电子能量相近C 二电子自旋量子数相同D 二电子波函数相同24.氨水溶液中氨分子之间的作用力有A 一种B 二种C 三种D 四种25.螯合物比相应简单配位物稳定的本质是A 热效应B 形成多元环C 熵效应D 螯合效应二、计算题(每小题5分)1. 0.50mol/L 水在其沸点气化,恒压汽化热2.26kJ/g,求W,Q,ΔU,ΔH 和ΔG .2.)()()(235g Cl g PCl g PCl += 已知100a p K ,523K 时K p =1.6,求(1) 总压力1000a p K 时PCl 5的摩尔分解率(2) 如果摩尔分解率为10%,此时总压力多少3.0.10mol/L 的HAc 和0.050mol/LNaOH 等体积混合,计算溶液中-+Ac O H 3离子浓度51077.1(-⨯=Ka )4.反应 )(21)()(2g O s C g CO += )/(mol ki fH m θ∆ -110.52 0 0)(11--⋅⋅k mol J S m θ 197.67 5.74 205.14根据以上热力学数据计算反应自由能并判断其自发性.5.已知反应m ol KJ rG g CO g O H g NH g HCO NH m olKJ rG g CO g O H s CO Na S NaHCO m m /22.28)()()()(/19.28)()()()(22233422323=∆++==∆++=θθ计算当298K 时,34323,HCO NH CO Na NaHCO 和共存时氨的分压可能用到的公式:CKa H RTInK G a a a a RTIn G G ST H G WQ U r d D b B f F e E m r r ⋅=-=∆⋅⋅+∆=∆∆-∆=∆-=∆+][θθ有机化学部分(75分)一、选择一个正确答案填入下列括号内(每题1分,共20分)1.水中溶解度最大的是()A.HO(CH2)3OHB.C2H5OCH(CH3)2C.CH3CH2CH2CH2OHD.CH3CHO2.乙酰乙酸乙酯能使溴水褪色是因为存在()A.对映异构B.顺反异构C.构象异构D.互变异构3.皂化值越大,油脂平均相对分子质量()A.越大B.越小C.不受影响4.最稳定的游离基是()A.(CH3)3C∙B.(CH3)2CH∙C.CH3CH2∙D.CH3∙5.具有相同分子式的外消旋体与内消旋体之间是()A.对映异构B.非对映异构C.差相异构D.互变异构6.下列化合物中,与氢氰酸反应活性顺序排列正确的是()(1)CH3CH3CHO(2)HCHO(3)C6H5COCH3(4)C6H5CHOA.2>1>4>3B.2>1>3>4C.1>2>3>4D.1>2>4>37.下列四种化合物中没有芳香性的是()A.六氢吡啶 B.吡咯C.环丙烯正离子D.α-甲基呋喃8.苹果酸失水时生成的产物是()A.顺丁烯二酸B.反丁烯二酸C.琥珀酸D.酒石酸9.在合成乙酰苯胺实验中,加入少量锌粉的目的是()A.防止苯胺氧化B.防止乙酰苯胺分解C.作为催化剂10.甲苯在光照或高温下与氯气的反应属于()A.亲电取代反应B.亲核取代反应C.亲电加成反应D.自由基反应11.赖氨酸的pI=9.74,它在pH为2.7的溶液中主要呈()A.正离子B.中性分子C.负离子D.两性离子12.与D-葡萄糖生成相同糖脎的是()A.麦芽糖B. L-甘露糖C.D-核糖D.D-果糖13.能把伯、仲、叔胺分离开的试剂为()A.斐林试剂B.硝酸银的乙醇溶液C.苯磺酰氯的氢氧化钠溶液D.碘的氢氧化钠溶液14.组成蛋白质的氨基酸结构特点是()A.L型、α-氨基酸B. D型、α-氨基酸C. L型、β-氨基酸D. D型、β-氨基酸15.内消旋酒石酸的构型是()A. 2S,3RB. 2R,3RC. 2S,3SD. 2R,3S16.下列脂肪酸中,属于不饱和脂肪酸的是()A.硬脂酸B.十二烷酸C.油酸D.软脂酸17. 重结晶进行热过滤时,采用折叠滤纸的目的是()A.扩大过滤面积、加快过滤速度B.过滤更容易进行C.除去活性炭18.常压蒸馏沸点在140︒C以上的物质时,选用的冷凝管为()A.直型冷凝管B.蛇型冷凝管C.球型冷凝管D.空气冷凝管19. 抽气过滤时,选用的漏斗是()A.玻璃漏斗B.热水漏斗C.布氏漏斗D.砂芯漏斗20. 固体有机化合物纯化的方法通常采用的是 ( )A.重新蒸馏B.重结晶C.重新过滤二、写出下列化合物的结构简式(每题1分,共8分)1. 乙基- -D-核糖苷2. 甘油三硝酸酯3. 2Z ,4Z-己二烯酸4. 对羟基氯化重氮苯5. 氢氧化四甲基铵6. 水扬酸7. 尿嘧啶 8. D-半胱氨酸三、命名下列化合物(有构型的要注明构型,每题1.5分,共12分)1. 2. O O O CH 3CHOHHH H OH3. 4. OCH 3CH 2BrCH 3CH 2NH 2HC 6H 5 (R/S ) 5. 6. CH 33CH(CH 3)2C O NN COOH7. 8. CH 3OCCH 2COCH 3OH OH四、合成下列化合物(无机试剂任用,每题4分,共16分)1. 乙苯2-氯-4-硝基苯甲酸2. CH3CH2CH2CHOCH3CH2CH2CH2CHCHO2CH33. CH2=CH-CH=CH2HOOC(CH2)4COOH4.由原料苯乙烯、乙烯合成CHOCH22五、区别下列各组化合物(共7分)1. 淀粉溶液、蛋白质溶液、蔗糖溶液(3分)2. (4分)NH2NH2COOH六、推导结构(共8分)某化合物分子式为C6H12O,不能起银镜反应,但能与羟胺作用生成肟,在铂催化下加氢可生成一种醇,该醇经脱水,臭氧化分解后,得到两种液体,其中之一能起碘仿反应,但不能与斐林试剂反应,另一种则能起银镜反应,但不能起碘仿反应。
江南大学无机化学2004~2005学年 第1学期 期中考试(答案)
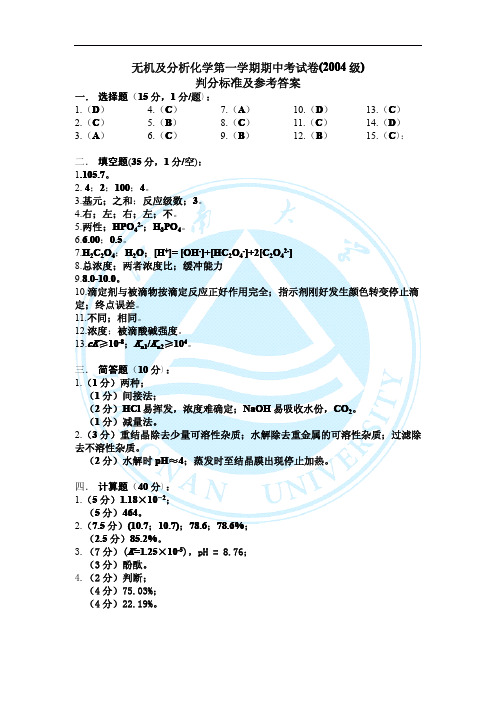
无机及分析化学第一学期期中考试卷(200(20044级)判分标准及参考答案一.选择题(15分,1分/题):1.(D)2.(C)3.(A)4.(C)5.(B)6.(C)7.(A)8.(C)9.(B)10.(D)11.(C)12.(B)13.(C)14.(D)15.(C):二.填空题(35分,1分/空):1.105.7。
2.4;2;100;4。
3.基元;之和;反应级数;3。
4.右;左;右;左;不。
5.两性;HPO42-;H3PO4。
6.6.00;0.5。
7.H2C2O4;H2O;[H+]=[OH-]+[HC2O4-]+2[C2O42-]8.总浓度;两者浓度比;缓冲能力9.8.0-10.0。
10.滴定剂与被滴物按滴定反应正好作用完全;指示剂刚好发生颜色转变停止滴定;终点误差。
11.不同;相同。
12.浓度;被滴酸碱强度。
13.cK≥10-8;K n1/K n2≥104。
三.简答题(10分):1.(1分)两种;(1分)间接法;(2分)HCl易挥发,浓度难确定;NaOH易吸收水份,CO2。
(1分)减量法。
2.(3分)重结晶除去少量可溶性杂质;水解除去重金属的可溶性杂质;过滤除去不溶性杂质。
(2分)水解时pH≈4;蒸发时至结晶膜出现停止加热。
四.计算题(40分):1.(5分)1.18×10-2;(5分)464。
2.(7.5分)(10.7;10.7);78.6;78.6%;(2.5分)85.2%。
3.(7分)(K=1.25×10-5),pH=8.76;(3分)酚酞。
4.(2分)判断;(4分)75.03%;(4分)22.19%。
无机及分析化学试卷及答案(5)

无机及分析化学试卷及答案6一、填空题:(每空1分,共20分)1.热与功是系统状态发生变化时与环境之间的两种形式。
系统向环境放热Q 0;环境对系统做功W 0。
2.根据反应类型的不同,滴定分析可分为 、、和四种滴定分析方法。
3. 17.593 + 0.00458 - 3.4856 + 1.68 =4. 在弱酸溶液中加水,弱酸的解离度变,pH 变;在NH 4Cl 溶液中,加入HAc ,则此盐水解度变,pH 变。
5.在含有Cl -和CrO 42-的混合溶液中,它们的浓度均为0.1mol/L,当逐滴加入Ag +时,先沉淀。
[K sp Θ(AgCl)=1.77×10-10, K sp Θ(Ag2CrO4)=2.0×10-12]6. 根据电子排列顺序34号原子的核外电子排布为。
7. [Co (NH 3)2(en)2]Cl 3的名称是;配位体是;中心体的配位数是。
8. 分光光度计的基本组成部分为光源、、 、、显示器。
二、选择题:(每题2分,共30分)1.满足下列哪组条件的反应可自发进行? ()A . △H> 0,△S>0,高温B . △H> 0,△S>0,低温C . △H< 0,△S<0 ,高温D . △H> 0,△S<0,低温2.1.00克非电解质溶于20.0克水中,测定冰点是-0.50℃,该非电解质的相对分子量是()(K f =1.86)A .1.86 /( 0.50×0. 20)B. 1.86/(0.50×20.0)C. 0.50×20.0/1.86D. 1.86/( 0.50×0.020)3. 已知500K 时反应 SO 2(g)+1/2 O 2(g) =SO 3(g)的K P =50,则同温度下反应2SO 2(g)+O 2(g) =2SO 3(g)的K P ´为 ()A. 4×10-4B. 2×10-2C. 4×10-2D. 25004. 对给定的化学反应,下列说法正确的是 ()A . △G 越负,反应速度越快。
无机及分析化学试卷及答案4

无机及分析化学试卷及答案4无机及分析化学试卷及答案4一、填空题:(每题 1分,共20 分)1. 对于可逆反应,当升高温度时,其速率常数k正将;k逆将。
当反应为吸热反应时,平衡常数k0将增大,该反应的ΔG0将。
2. 2.0 ×10−3mol⋅L−1HNO3溶液的pH = ______________。
3. 写出下列物质共轭酸的化学式:(CH2)6N4_______________;H2AsO4−________________。
4. 同离子效应使弱电解质的解离度________;盐效应使弱电解质的解离度___ ____;后一种效应较前一种效应_______得多。
5. 已知难溶盐BaSO4的K sp = 1.1×10−10, H2SO4的K a2 = 1.02×10−2, 则BaSO4在纯水中的溶解度是____________mol⋅L−1, 在0.10mol⋅L−1,BaCl2溶液中的溶解度是_______________mol⋅L−1(不考虑盐效应)。
6. 任何电极电势绝对值都不能直接测定,在理论上,某电对的标准电极电势E是将其与_________________电极组成原电池测定该电池的电动势而得到的电极电势的相对值。
7. 氧化还原滴定曲线描述了滴定过程中电对电位的变化规律性,滴定突跃的大小与氧化剂和还原剂两电对的__________有关,它们相差越大,电位突跃范围越__________。
8. 某配离子[M(CN)4]2-的中心离子M2+以(n-1)d、ns、np轨道杂化而形成配位键,则这种配离子的磁矩将,配位键的极性将。
9. HCl地沸点比HF要低得多,这是因为HF 分子之间除了有外,还有存在。
10.一碱液可能是NaOH或Na2CO3或NaHCO3,或它们的混合液。
用HCl溶液滴至酚酞腿色耗酸V1mL;继以甲基橙为指示剂又耗酸V2mL。
根据V1、V2的关系判断该碱液的组成:当V1>V2时,组成是____________________;当V1=V2时,组成是___________ ______。
无机及分析化学习题及解答

无机及分析化学习题及解答无机及分析化学习题解答严新徐茂蓉葛成艳编第一章绪论1.1判断下列误差属于何种误差?①在分析过程中,读取滴定管读数时,最后一位数字n次读数不一致,对分析结果引起的误差。
②标定HCl溶液用的NaOH标准溶液中吸收了CO2,对分析结果所引起的误差。
③移液管、容量瓶相对体积未校准,由此对分析结果引起的误差。
④在称量试样时,吸收了少量水分,对结果引起的误差。
答:①偶然误差;②系统误差中的试剂误差;③系统误差中的仪器误差;④过失误差1.2测得Cu百分含量为41.64%、41.66%、41.58%、41.60%、41.62%、41.63%,计算测定结果的平均值、平均偏差、相对平均偏差。
(无须舍去数据)解:41.64%41.66%41.58%41.60%41.62%41.63%41.62%6x+++++==1id x xn=-∑=2.2×10-4 100%rddx=⨯=0.053%1.3测定某样品中铁的百分含量,结果如下:30.12%、30.05%、30.07%、30.05%、30.06%、30.03%、30.02%、30.03%根据Q检验法,置信度为90%时是否有可疑数要舍去,计算分析结果的平均值、标准偏差、变异系数和对应的置信区间。
解:排序:30.02%、30.03%、30.03%、30.05%、30.05%、30.06%、30.07%、30.12%先检验最大值30.12%:30.12%30.07%0.530.12%30.02%Q-==-Q0.9=0.47 < 0.5,所以舍去30.12%继续检验最大值30.07%,30.07%30.06%0.230.07%30.02%Q-==-,Q0.9=0.51>0.2,不应舍去,30.07%应该保留。
检验最小值30.02%,30.03%30.02%0.230.07%30.02%Q-==-Q 0.9=0.51>0.2,不应舍去,30.02%应该保留。
武汉大学无机化学实验操作试题

2012年度上无机化学实验期中操作考试试题(*请大家务必认真阅读注意事项,以确保考试顺利进行)试题一某固体混合物中混有难溶于水的杂质,称取该固体样品0.5g,用20mL水溶解后,选择最合适的过滤方式除去其中的难溶杂质得滤液。
实验结束后清洗仪器、整理台面。
试题二采用比浊法检验某NaCl样品中所含SO42-的含量。
称取NaCl样品1.0 g,用少量蒸馏水溶解后,完全转移至25 mL比色管中。
再加1 mL 2 mol⋅L-1的盐酸和1 mL 0.5 mol⋅L-1的BaCl2溶液,加蒸馏水稀释至刻度,摇匀,与标准溶液进行比浊。
实验结束后清洗仪器、整理台面。
试题三制备得到的Cu(IO3)2沉淀在进行进一步处理前需对沉淀进行洗涤。
取20 mL Cu(IO3)2的浊液,选择合适的洗涤方式洗涤两次并检测系统中有无SO42-。
碘酸铜溶解度 150C 0.136g/100g 250C 0.14g/100g实验结束后清洗仪器、整理台面。
试题四现需制备FeC2O4·2H2O。
称取1.2g (NH4)2FeSO4·6H2O,0.45g H2C2O4·2H2O 加入适量的水溶解加热制备得到产品。
实验结束后清洗仪器、整理台面。
已知溶解度:(NH4)2FeSO4·6H2O(M.W. 392.14)17.2 g(10o C) 26.9g(20o C) 40g(50 o C) /100g H2O H2C2O4·2H2O(M.W. 126.06) 10.2g(25 o C) 16.8g(80 o C) /100g H2OFeC2O4在冷水中的溶解度 0.22g/100g H2O在热水中的溶解度 0.026g/100g H2O试题五取含少量FeSO4的NaCl溶液10 mL,水浴加热至600C,然后向体系中加入6% H2O2氧化Fe2+,至Fe2+完全氧化。
记录双氧水的用量。
实验结束后清洗仪器、整理台面。
2004年分析化学试题(参考答案)

2004年分析化学试题(A 卷)(时量:120分钟)姓名 学号 (注:答案一律写在统一配发的答题纸上,答在此试卷上不计分) 一、是非判断题(10分,每题1分)1、用佛尔哈德法测定Cl -,先加入过量且定量的AgNO 3,再在溶液中直接用KSCN 标准溶液滴定过量的AgNO 3,指示剂为铁铵矾(NH 4)2FeSO 4 。
(×)2、重量分析法中要求得到粗大、纯净的晶形沉淀,而陈化是常用的一种手段,所以BaSO 4、AgCl 、Fe 2O 3.nH 2O 沉淀过滤前都要陈化。
(×) 3、Fe 2+的存在加速KMnO 4氧化Cl -,这是因为催化剂Fe 2+的催化作用。
(×) 4、当一种沉淀从溶液中析出时,溶液中的某些其他组分,会被沉淀同时带下来而混杂于沉淀之中,这种现象就称为共沉淀现象;共沉淀现象结果使沉淀不纯净,此问题一般通过多次洗涤沉淀都能解决。
(×)5、均匀沉淀法由于沉淀剂是均匀、缓慢地释放出来的,所以又这种方法可以获 得颗粒均匀且较细的晶形沉淀。
(×)6、二甲酚橙为多元酸(六级解离常数),一般使用的是它的四钠盐,为紫色结晶,易溶于水。
它与金属离子形成黄色的络合物,是pH<6.0的酸性溶液中常用的一种指示剂。
(×)7、酸碱标准缓冲溶液一般是由规定浓度的某些逐级解离常数相差较小的两性物质,或由共轭酸碱对所组成。
(√)8、酸碱滴定法是在水溶液中以酸碱反应为基础的滴定分析法,由于路易斯酸碱质子理论使酸、碱范围大大扩展,所以酸碱滴定法是一种应用非常广泛的定量分析法。
(×)9、酸碱滴定法中选择指示剂时应考虑的因素是:滴定突跃的范围,指示剂的变色范围,指示剂的颜色变化及指示剂相对分子量的大小。
(×)10、当置信度为0.95时,测得Al 2O 3的置信区间为(35.21±0.10)%,此式的物理含义表示总体平均值μ落入此区间的概率为0.95。
无机及分析化学试题库

无机及分析化学试卷(一)一、填空(每空2分,共64分)1、已知反应A(g)+B(g)C(g)+D(l)处于平衡状态:①若正逆反应活化能分别为157.5和216.5kg.mol-1,则正反应热效应△H= kj.mo l-1,且正反应为。
②增大反应总压力,则平衡将向移动,降低温度,则平衡将向移动。
③该反应的平衡常数表达式Kc= ,Kp= ,Kc和Kp的关系为。
④若测得10秒钟内产物C的浓度改变了4.0×10-3molL-1,则该反应的速度为mol.L-1.S-1。
2、某温度时,若已知反应cl2(g)+H2(g)2HCl(g)和2H2(g)+O22H2O(g)的平衡常数分别为K1和K2,则反应2C(g)+2H2O 4HCl(g)+O2(g)的平衡常数K3= 。
3、下列数据各是几位有效数字?①47 ;②2.0060 ;③PH=2.63 ;④0.0201 ;⑤1.003×10-5。
4、根据酸碱质子理论,判断下列物质中是酸的有,其共软碱为;是碱的有,其中软酸为;是两性物质的有。
H 2O NH4+ H2C2O4CO32- NACHS- CN- NH4AC5、写出浓度为C.mol.L-1下列溶液的物料等衡式,电荷等衡式和质子等衡式:①NH3.H2O②H2CO3③Na2HPO46、常量分析所用滴定管可精确至±0.01ml,要使体积测量误差不超过±0.2%,应至少取 ml溶液。
7、准确称取呤苯二甲酸氢钾(KHC 8H 4O 4)0.4084克,加适量水溶解后同20.00mlNaOH 溶液滴定至终点,此NaOH 溶液的物质的量浓度 C= moll -1,滴定度T NaOH = g/ml 及T NaOH/H2SO4= g/ml ,已知分子量KHC 8H 4O 4=204.2,NaOH=40.00,H 2SO 4=98.00。
二、计算(共36分)1、某温度下,密闭容器中进行着反应:CO (g )+H 2O (g ) CO 2(g )+H 2(g )。
无机及分析化学试卷及答案(5)

无机及分析化学试卷及答案得分统计表:一 、填空题:(每空1分,共20分)1. 难挥发性非电解质稀溶液蒸汽压下降的原因是____________________________________。
2.基元反应NO 2 + CO = NO + CO 2的速率方程为______________________。
3. 测定某矿石中铁的含量时,获得如下数据:79.58%,79.45%,79.47%,79.50%,79.62%,79.38%。
置信度P 为90%时经Q 检验无可疑数据要舍弃,则标准偏差s 为________;置信度P 为90%时平均值的置信区间为______________。
(已知置信度为90%、n =6时,t =2.015)4. 已知HAc 的p K a Ө=4.76,则0.01 mol ·L -1的HAc 溶液的pH 值为________。
5. 已知NH 3·H 2O 的解离平衡常数p K b Ө=4.76,则NH 3·H 2O-NH 4Cl 缓冲体系可用于配制pH 从____________到_______________之间的缓冲溶液。
6. 室温下,AB 2型难溶性物质的溶度积常数为K sp Ө,则其溶解度为____________;AB 型难溶性物质的溶解度为s mol ·L -1,则其溶度积常数为_______________。
7. 已知E Ө(Ag +/ Ag )=0.799V ,E Ө(Fe 3+/ Fe 2+)=0.771V ,则298.15K 时,反应Ag ++ Fe 2+→Ag (s )+Fe 3+的标准平衡常数K Ө为 。
8. 原子R 的最外电子层排布式为m s m m p m , 则R 位于_____周期,_____族,其电子排布式是___________________。
9. 配合物[CoCl(NH 3)4(H 2O)]Cl 2命名为 ,中心离子的配位体为________________,配位数为 。
无机及分析化学习题第一章无机化学基本知识

第一章无机化学基本知识(一)填空题1.在4个量子数n,l,m,m s中,决定原子轨道形状的是______,觉得原子轨道在空间伸展方向的是______。
2.我国化学家提出能及的相对高低与主量子数n和角量子数l的关系是______,其值越大,轨道能量越高。
3.核外电子排布遵循的三个原则是________,________,________。
4.分散系是指____________________的体系。
NaCl、碘酒和泥浆都是分散系,他们分别是______、______、______。
5.与溶液溶质的性质无关,仅取决于____________的性质成为稀溶液的依数性,包括________,________,________,________。
6.丁达尔效应能够证明溶胶具有________性质,其动力学性质可以有________实验证明,电泳和电渗实验证明溶胶具有________性质。
7.常压下,海水的沸点________100℃.(填<,>,=)8.人类不能饮用海水,吃冰激凌不如喝水解渴,以及海生生物不能在淡水中生存等现象都是与溶液的依数性之一________密切相关。
9.在寒冷的冬天施工是,常在混凝土中添加外加剂如CaCl、NaCl防冻,依据的化学原理为________________。
10.溶液产生渗透现象应具备的条件是_______和_______。
11.溶胶具有聚结稳定性的原因是有二,一是__________;二是__________。
12.胶粒带电的原因有二,一是_______带电;二是_______带电。
13.当把直流电源两极插到由FeCI3水解制备的氢氧化铁溶胶中,通电后,在____极附近颜色逐渐变深,这种现象称为_______。
14.当溶剂中溶解了溶质以后,溶剂的部分表面被_______所占据,使蒸发的机会减少,所以达到平衡时溶液的_______低于_______的蒸气压。
