高一化学铝与氢氧化钠溶液的反应
铝加入氢氧化钠溶液反应方程式

铝加入氢氧化钠溶液反应方程式铝加入氢氧化钠溶液会发生反应,生成氢气和氢氧化铝。
反应方程式可以用化学式来表示:2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2我们需要了解铝和氢氧化钠的性质。
铝是一种具有活泼性的金属元素,而氢氧化钠是一种强碱。
当铝加入氢氧化钠溶液中时,铝的表面会与氢氧化钠发生反应。
在这个反应中,铝的表面会被氢氧化钠溶液中的氢氧根离子(OH-)氧化。
这个氧化反应可以用以下方程式表示:2Al + 2OH- + 2H2O → 2Al(OH)2- + H2在这个反应中,铝被氧化为Al(OH)2-离子,并释放出氢气。
氢气是一种无色、无臭的气体,可以通过观察到气泡的形成来证实反应发生。
然而,铝的氧化反应不会停留在这一步。
由于铝与氢氧化钠溶液中的水反应,会进一步生成氢氧化铝。
氢氧化铝是一种白色固体,可以通过观察到溶液变浑浊来证实其生成。
铝与氢氧化钠溶液中的水反应的方程式如下:2Al(OH)2- + 2H2O → 2Na[Al(OH)4]在这个反应中,氢氧化铝离子(Al(OH)2-)与水反应,形成氢氧化铝离子(Na[Al(OH)4])。
氢氧化铝离子是一种具有阴离子性质的化合物。
铝加入氢氧化钠溶液会发生氧化反应和水的反应,生成氢气和氢氧化铝。
这个反应可以用以下方程式来表示:2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2值得注意的是,在实验室中进行这个反应时,需要小心操作。
由于反应会产生氢气,容器中的压力可能会增加,甚至可能引起爆炸。
因此,在进行这个实验时,应该采取适当的安全措施,并在通风良好的地方进行。
总结起来,铝加入氢氧化钠溶液会发生氧化反应和水的反应,生成氢气和氢氧化铝。
这个反应是一种常见的实验室反应,有着重要的应用价值。
对于理解化学反应的机理和性质,以及实验室操作和安全性都有一定的意义。
2020人教版高一化学上册必修1《14铝与氢氧化钠溶液的反应》【含答案】

人教版高一化学上册必修1《14铝与氢氧化钠溶液的反应》同步练习及答案课时跟踪检测(十四) 铝与氢氧化钠溶液的反应1.除去镁粉中的等量铝粉,可选用的试剂是( )A .稀盐酸 B .稀硝酸C .NaOH 溶液D .氯化钠溶液解析:选C 镁可与酸反应,但不能与碱液反应。
2.下列关于铝的说法中,不正确的是( )A .能与盐酸反应B .常温下不能与氧气反应C .能与NaOH 溶液反应D .地壳中含量最高的金属元素解析:选B 铝既能与酸反应又能与氢氧化钠溶液反应放出氢气,A 、C 正确;铝的性质活泼,常温下与氧气反应生成致密的氧化物保护膜,B 错误;铝是地壳中含量最多的金属,D 正确。
3.相同质量的镁和铝分别与足量的盐酸反应,生成标准状况下的氢气( )A .一样多B .镁多C .铝多D .均为22.4 L解析:选C 反应中金属失去电子越多,生成氢气的体积越大,同质量Mg 、Al 失去电子数之比为×2∶×3=3∶4,即产生H 2的体积比为3∶4。
1241274.等量镁铝合金粉末分别与下列四种过量物质充分反应,放出氢气最多的是( )A .NaOH 溶液B .H 2SO 4稀溶液C .蔗糖溶液D .NaCl 溶液解析:选B 镁和铝都能与稀H 2SO 4反应,而与NaOH 溶液反应时,只有铝参加反应,故前者生成氢气多;C 、D 项不反应,无氢气放出。
5.铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相同时,反应中消耗的HCl 和NaOH 的物质的量之比为( )A .1∶1 B .2∶1C .3∶1D .1∶3解析:选C 2Al +6HCl===2AlCl 3+3H 2↑ 6 mol 3 mol2Al+2NaOH+2H2O===2NaAlO2+3H2↑2 mol3 moln(HCl)∶n(NaOH)=6∶2=3∶1。
6.两份铝屑,一份与足量的稀盐酸反应,另一份与足量的NaOH溶液反应,产生H2的体积比为1∶2(同温同压下),则两份铝屑的质量比为( )A.1∶1B.1∶2C.1∶3D.1∶4解析:选B 2Al+6HCl===2AlCl3+3H2↑、2Al+2NaOH+2H2O===2NaAlO2+3H2↑,由于盐酸、氢氧化钠均足量,生成H2的量应根据Al的量计算。
高一化学人教版必修1练习3.1.2铝与氢氧化钠溶液的反应物质的量在化学方程式计算中的应用Word版含解析

第2课时铝与氢氧化钠溶液的反应 物质的量在化学方程式计算中的应用。
发出爆鸣声;点燃的木条放在试管口时无色气泡,试管中产生逐渐溶解现象:铝片化学方程式:2Al +6HCl===2AlCl 3+3H 2↑ 离子方程式:2Al +6H +===2Al 3++3H 2↑2.铝与氢氧化钠溶液的反应。
发出爆鸣声;点燃的木条放在试管口时无色气泡,试管中产生逐渐溶解现象:铝片化学方程式:2Al +2NaOH +2H 2O =====△2NaAlO 2+3H 2↑离子方程式:2Al +2OH -+2H 2O===2AlO -2+3H 2↑)2氢气(或H 铝既能与盐酸反应,又能与NaOH 溶液反应,都产生3. H 2 + Cl 2=====点燃2HCl化学计量数之比1∶1∶2微粒个数之比1∶1∶2扩大6.02×1023倍1×6.02×1023∶1×6.02×1023∶2×6.02×1023物质的量之比1mol ∶1mol ∶2mol相同条件下气体体积比1体积∶1体积∶2体积之比,等于微粒个数之比,物质的量(1)结论:化学方程式中的化学计量数之比等于其之比。
体积等于气体的 (2)应注意的问题过量任何一种反应物,只有实际参加反应的纯物质的量才能根据化学方程式计算,①部分不参与化学方程式的计算。
②化学方程式的书写要正确。
的原则。
”同单位,上下相当左右量“列比例式时要符合③ 4.物质的量与各物理量之间的关系(1)图示关系:(2)计算公式:①n =mM ;②n =NNA;③n =错误!;④n =c ·V (溶液)知识点一铝与氢氧化钠溶液的反应1.下列金属既能与稀盐酸反应,又能与NaOH 溶液反应的是( )A .MgB .AlC .FeD .Cu答案:B解析:Al 既能与稀盐酸反应,又能与NaOH 溶液反应;Mg 、Fe 只能与稀盐酸反应;Cu既不与稀盐酸反应,也不与NaOH 溶液反应。
铝和氢氧化钠溶液反应实验

铝和氢氧化钠溶液反应的实验探究摘要:通过铝与氢氧化钠溶液反应的事实,探究反应的实质,传授控制实验变量的对比实验法。
关键词:探究;实验;学习方法普通高中课程标准实验教科书人教版化学必修(1)第三章“金属及其化合物”第一节金属的化学性质中铝与氢氧化钠溶液的反应。
课本中首先做一个对比实验:分别在装有5ml盐酸和氢氧化钠溶液的试管中放入一小段铝片,发现都有气体产生,经过验证是氢气。
然后给出铝与氢氧化钠溶液反应的化学方程式:2al+2naoh+2h2o=2naalo2+3h2↑,并分析铝在反应的过程中被氧化具有还原性。
内容很简单,如果在传统教学中教师教到这种地步会强调让学生记住此方程式即可,然而新课程的理念是以全面提高每一个学生的科学素养为核心,要求教师在教学中应面向全体学生,立足学生发展,体现学科本质,突出科学探究,促进学生全面素质的提升。
为此在安排此节教学时采用探究式教学为主的教学方法,探究点生成:在铝与氢氧化钠溶液反应中铝做了还原剂,从化合价角度分析氢氧化钠和水做的是氧化剂,那是不是意味着铝单独和水以及铝单独和氢氧化钠反应呢?于是设计实验进入实验验证环节。
一、进行铝和水的反应在一只大试管中加入5 ml水并滴加两滴酚酞试液,将一条宽1 cm 长3 cm一面用砂纸打磨的铝片加入试管中,观察现象:无明显变化。
然后用酒精灯加热煮沸,在打磨过表面粗糙的一面有大量气泡产生,光滑的一面无明显变化,溶液变成浅红色。
将生成的气体通入到肥皂液中用燃着的木条接近气泡有轻微的爆鸣声。
实验结论:溶液使酚酞变红证明呈碱性,有氢氧化铝生成;有气体产生而且可燃证明是氢气。
二、进行氢氧化钠和铝的反应氢氧化钠的电离除在水中可以外,还可以通过加热熔融的办法。
在大试管中加入混合好的铝粉和固体氢氧化钠(此处用铝片试管容易破裂,另外铝粉的量要少)用酒精灯加热熔融,用连导管单孔塞塞住试管口将导管末端插入装有肥皂液的表面皿中,此间并无大量气体产生,更无爆鸣声。
铝与氢氧化钠溶液的反应-学易试题君之每日一题君2019学年上学期高一化学人教版(课堂同步系列一)

1 10月11日
铝与氢氧化钠溶液的反应
高考频度:★★★★☆
难易程度:★★★☆☆
典例在线
等质量的两份铝分别与足量稀硫酸和足量NaOH 溶液反应,若消耗的两溶液的体积相等,则两溶液的物质的量浓度之比为
A .3∶2
B .2∶3
C .1∶1
D .1∶2
【答案】A
解题必备
铝与氢氧化钠溶液的反应
1.铝片与盐酸和氧氧化钠溶液反应的对比 实验操作 实验现象
反应的化学方程式 试管中有气泡冒出,铝片逐渐溶解,且刚
开始反应较慢,后来渐渐加快。
点燃的木
条放在试管口时气体燃烧
2Al+6HCl===2AlCl 3+3H 2↑
试管中有气泡冒出,铝片逐渐溶解,且刚
开始反应较慢,后来渐渐加快。
点燃的木
条放在试管口时气体燃烧 2Al+2NaOH+2H 2O===2NaAlO 2+3H 2↑。
人教版高一化学必修1学案铝和氢氧化钠溶液的反应

第三章金属及其化合物第一节金属的化学性质第3课时铝和氢氧化钠溶液的反应学习目标1.掌握铝和氢氧化钠溶液的反应。
2.掌握化学计量数与物质的量之间的关系。
学习过程【复习·回顾】金属通常可以表现出哪些化学性质?三、铝与NaOH溶液的反应【观察·思考】(1)将铝片(已处理)放入NaOH溶液中(同时展示),你看到了什么现象?你认为铝和NaOH 溶液反应产生的气体是什么?为什么?(2)请设计一个简单易行的实验方案验证你的推测。
【实验·探究】实验目的:对比铝片与盐酸、NaOH溶液的反应实验用品:6 mol·L-1的盐酸、30%的NaOH溶液、铝片、蒸馏水500 mL、小广口瓶16个、镊子16个、大广口瓶14个、大试管16支、单孔塞(带导管)14个、小烧杯14个、火柴14盒、250 mL烧杯9个、500 mL烧杯1个、剪刀1把。
实验步骤:(1)分别用镊子取出3片铝片,放入盛有6 mol/L的盐酸、30% NaOH溶液的大试管中(分2小组同时进行)。
(2)将带有导管的单孔塞塞紧大试管,导管插入肥皂水中(广口瓶起试管架的作用)。
(3)有大量泡沫产生后,用火柴点燃肥皂泡并观察现象。
(4)观察完现象后取出导管,并将酸、碱溶液倒入废液缸,剩余铝片留在大试管中,仪器放回水槽。
现象及解释:记录实验现象并分析产生现象的原因,填入下表。
实验结论:铝片与盐酸、NaOH溶液反应的气体产物都是。
【交流·研讨】(1)试推测铝与NaOH溶液反应的另一产物中含有哪些元素?你的推测依据是什么?(2)书写该反应的化学方程式并配平,若是离子反应请写出其离子方程式:【迁移·应用】(1)你认为日常生活中在使用铝制餐具时需要注意哪些问题?(2)1989年世界卫生组织把铝定为食品污染源之一,而应加以控制使用。
铝在下列应用时应加以控制的是()①制铝合金②制电线③制炊具④银色漆颜料⑤明矾净水⑥明矾与小苏打制食品膨松剂⑦易拉罐⑧用氢氧化铝凝胶制胃舒平⑨包装糖果和小食品A.③⑤⑧⑨B.①②④C.③⑤⑨D.③⑤⑥⑦⑧⑨【知识整合】(1)通过本节教材的学习,你认为金属的化学性质的共性是什么(从氧化还原的角度)?为什么会有这种共性?(2)由此你来推测一下大多数金属在自然界中是以什么形态(游离态还是化合态)存在?【拓展·提升】两份铝粉分别与足量的NaOH溶液和HCl溶液反应,产生的气体体积相同(同温、同压下),则这两份铝粉的质量之比为()A.1∶2B.1∶3C.3∶2D.1∶1四、物质的量在化学方程式计算中的应用【交流·研讨】试根据反应2CO+O22CO2中的化学计量数之比推导出各物质的分子个数之比、物质的量之比、体积之比和质量之比。
钠与水、铝与氢氧化钠溶液的反应(教学设计)-2016-2017学年高一化学上册
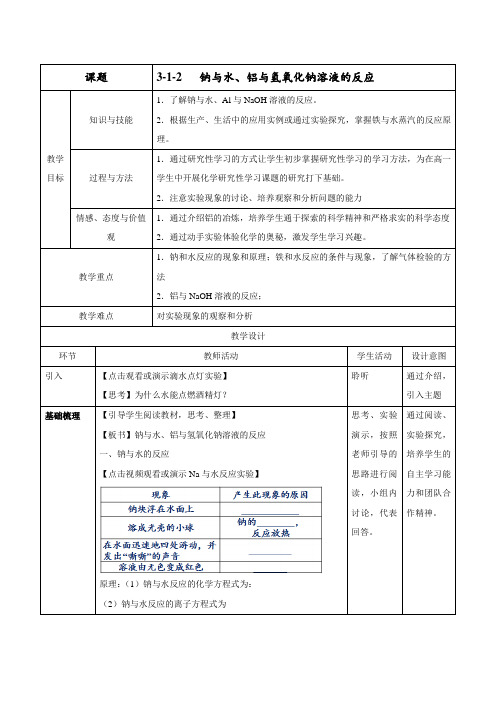
课题3-1-2 钠与水、铝与氢氧化钠溶液的反应教学目标知识与技能1.了解钠与水、Al与NaOH溶液的反应。
2.根据生产、生活中的应用实例或通过实验探究,掌握铁与水蒸汽的反应原理。
过程与方法1.通过研究性学习的方式让学生初步掌握研究性学习的学习方法,为在高一学生中开展化学研究性学习课题的研究打下基础。
2.注意实验现象的讨论、培养观察和分析问题的能力情感、态度与价值观1.通过介绍铝的冶炼,培养学生通于探索的科学精神和严格求实的科学态度2.通过动手实验体验化学的奥秘,激发学生学习兴趣。
教学重点1.钠和水反应的现象和原理;铁和水反应的条件与现象,了解气体检验的方法2.铝与NaOH溶液的反应;教学难点对实验现象的观察和分析教学设计环节教师活动学生活动设计意图引入【点击观看或演示滴水点灯实验】【思考】为什么水能点燃酒精灯?聆听通过介绍,引入主题基础梳理【引导学生阅读教材,思考、整理】【板书】钠与水、铝与氢氧化钠溶液的反应一、钠与水的反应【点击视频观看或演示Na与水反应实验】原理:(1)钠与水反应的化学方程式为:(2)钠与水反应的离子方程式为思考、实验演示,按照老师引导的思路进行阅读,小组内讨论,代表回答。
通过阅读、实验探究,培养学生的自主学习能力和团队合作精神。
二、铝与氢氧化钠溶液的反应【点击观看视频或演示实验3-4】铝分别与盐酸、NaOH溶液反应的对比实验拓展延伸一、钠与酸、碱、盐的反应1.反应实质:一般情况下钠与任何水溶液反应时,都是钠与该溶液中的H+反应,产生H2。
2.具体反应的分析:【点击观看或演示Na与CuSO4溶液反应实验】根据课堂内容进行知识的提升。
通过从不同角度对钠与水及水溶液的反应和铝的两性性质的分析,进一步理解金属钠与铝的性质理论,把零散的认识升华到系统认识。
【温馨提示】在熔融状态下,金属钠能将不活泼的金属置换,如:二、铝与盐酸、氢氧化钠溶液反应的比较1.反应原理2Al+6HCl=2AlCl3+3H2↑2Al+2NaOH+2H2O=2NaAlO2+3H2↑2.“量”的关系(1)等量的铝分别与足量的盐酸和NaOH溶液反应,消耗盐酸和NaOH物质的量之比为3∶1。
铝与氢氧化钠溶液反应的实验探究

铝与氢氧化钠溶液反应的实验探究南安市华侨中学杨言珊论文摘要:通过指出现行教材中“铝与氢氧化钠溶液反应的实验”的不足之处,针对反应产物氢气的验证和反应的氧化剂是水还是NaOH进行进行了实验探究,并指出化学实验要由课内向课外延伸,要生活化。
关键词:实验探究;课外延伸;生活化一、现行教材中“铝与氢氧化钠溶液反应的实验”的不足之处“铝与氢氧化钠溶液反应”的实验内容为《普通高中课程标准实验教科书·化学(1)》(江苏教育版)第3专题第一单元中的第3课时,关于金属铝与氢氧化钠溶液的反应一般都采用了如图1所示的实验:通过一个对比实验:分别在装有3ml盐酸和氢氧化钠溶液(浓度均为6mol/L)的试管中放入一小段铝条,发现都有气体产生,经过验证是氢气。
然后给出铝与氢氧化钠溶液反应的化学方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,并分析铝在反应的过程中被氧化具有还原性。
笔者在教学中发现,该实验有不足之处:1、反应产生气体的现象不明显,点燃时往往既听不到爆鸣声,又看不到氢气的燃烧现象。
2、学生对该反应的氧化剂是水还是NaOH始终不明白,笔者在对实验反复研究后,进行了如下改进和探究。
二、“铝与氢氧化钠溶液反应的实验”的改进针对氢气的验证改进1:利用废旧的塑料瓶进行如图2所示的实验,其中小的塑料瓶可以是眼药水瓶,口香糖瓶,化妆品瓶等,最好是有一个内盖,或者是外盖不是旋口的(如图3),外面的塑料瓶可以是矿泉水瓶,营养快线瓶,冰红茶瓶等。
图2 图3 图4改进的思路和理论依据:经过反复讨论和思考后发现,利用图1实验效果不好的主要原因一是试管开口太大,且生成气体的同时大量逸出,难以把气体富集起来;二是氢氧化钠浓度不够,产生气体太少。
针对这两点,先用小塑料瓶把氢气富集起来,考虑到实验中瓶盖可能飞出吓到学生,具有腐蚀性的氢氧化钠溶液可能溅出,就在外再套了一个剪了洞的大塑料瓶。
实验器材和药品:塑料瓶两个(大小不一),玻管,铝箔,氢氧化钠溶液,酒精灯火柴实验步骤及现象:先将一小段玻管插入小瓶外壁,向瓶中加入几小片铝箔,再倒入10ml左右的氢氧化钠溶液,扣上瓶盖,将小塑料瓶放入已剪好洞的大塑料瓶中,在酒精灯上点燃气体,可以听到尖锐的爆鸣声。
高一化学铝与氢氧化钠溶液的反应

小,最后消失
球运动
反应后溶液的颜色逐渐变_红__
有_碱___性物质生成
续表
结论
钠与水剧烈反应,生成__H_2__和_N_a_O__H_,表现还__原__性,Na 是强_还__原__剂,化学方程式:2_N_a_+__2_H__2O______2_N__aO__H_+__H__2_↑
(1)钠的取用量要小,过大易发生危险
(2)钠与盐溶液的反应 首先发生的是金属钠与水的反应,再是生成的氢氧化钠与 盐发生复分解反应。例如将金属钠投入CuSO4 溶液中,发生的
化学反应为2Na+2H2O 2NaOH+H2↑,2NaOH+CuSO4
Cu(OH)2↓+Na2SO4。易误认为钠比铜活泼,可将铜从其盐溶液 中置换出来,生成铜和硫酸钠。
高温水蒸气,反应较快
氧化物+H2
Cu、Hg、Ag Pt、Au
不与水反应
-
Na与酸、水或盐溶液的反应
[例1]工业上常用钠制备钛、钽、钼、锆等金属。如制钛, 先把钛铁矿经一定反应后制得 TiO2。
(1)在高温 HCl 气流中,TiO2 可转化为 TiCl4,反应方程式为 __________________________________。
1.掌握钠、镁、铝、铁等金属与水、酸的反应。 2.掌握金属铝与酸、碱的反应。 3.通过钠、铁及铝的相关实验的现象观察及描述、实验结 论表达,总结出金属的主要化学性质。
一、金属与酸的反应 酸与金属活动性顺序中氢前面的金属反应生成_盐__和__氢__气_,如Zn、 Fe 和稀盐酸反应的离子方程式分别为:Z_n_+__2_H__+_____Z_n_2_+_+__H__2↑___、 __F_e_+_2_H__+_____F_e_2+__+__H_2_↑_。
专题3-1-3 铝与氢氧化钠溶液的反应-2017-2018学年高一化学必修1 含解析 精品

第三章金属及其化合物3.1.3 铝与氢氧化钠溶液的反应(时间:30分钟)一、选择题1.有关Al与NaOH溶液反应的说法中,正确的是A.铝是还原剂,其氧化产物是H2B.NaOH是氧化剂,其还原产物是H2C.铝是还原剂,H2O和NaOH都是氧化剂D.H2O是氧化剂,Al被氧化【答案】D2.标准状况下,3.25 g锌与足量的盐酸反应生成x L氢气,下列比例式正确的是A.Zn+2HCl===ZnCl2+H2↑1 mol 1 mol3.25 g x LB.Zn+2HCl===ZnCl2+H2↑65 g 1 L3.25 g x LC.Zn+2HCl===ZnCl2+H2↑1 mol 1 mol0.05 mol x LD.Zn+2HCl===ZnCl2+H2↑65 g 22.4 L3.25 g x L【答案】D【解析】比例式应注意单位要“上下一致,左右相当”。
3.在500 mL NaOH溶液中加入足量铝粉,反应完全后共收集到标准状况下的气体33.6 L,该NaOH溶液的浓度为A.1 mol·L−1B.2 mol·L−1C.1.5 mol·L−1D.3 mol·L−1【答案】B4.将铝投入到一定量的NaOH溶液中,充分反应后,有2 mol 的电子发生转移,则参加反应的铝的物质的量为A.13mol B.1 mol C.2 mol D.23mol【答案】D【解析】铝在参加反应时1 mol Al可失去3 mol电子,因此有2 mol电子转移时需Al的物质的量为23mol。
5.某无色溶液加入铝可以生成H2,则在该溶液中一定能大量存在的离子组是A.K+、Cu2+、3NO-、Cl−B.K+、Na+、24SO-、Cl−C.K+、Ca2+、3HCO-、Cl−D.Na+、Mg2+、Br−、24SO-【答案】B【解析】该无色溶液能与铝反应放出氢气,说明该溶液可能呈酸性,也可能呈碱性。
A项Cu2+显蓝色,不符合题意;B项所有离子与H+和OH−均不反应,B项符合题意:C项3HCO-与酸和碱均反应,一定不能大量存在,不符合题意;D项Mg2+与OH−不能大量共存,各离子与H+不反应,D项不一定能大量共存,不符合题意。
铝和氢氧化钠反应

铝和氢氧化钠反应铝和氢氧化钠的反应是一种常见而重要的化学反应,它涉及到铝与碱性物质的反应,产生气体和盐类产物。
这种反应具有多种应用,包括金属腐蚀的研究和工业中的铝制品生产等。
铝是一种重要的金属材料,具有良好的导电性和耐腐蚀性,并且具有较低的密度。
氢氧化钠,也称为烧碱或苛性钠,是一种强碱性化合物,常用于清洁剂、溶解剂和工业生产等领域。
铝和氢氧化钠的反应可以通过以下化学方程式表示:2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2在这个反应中,两个铝原子与两个氢氧化钠分子和六个水分子发生反应,生成两个氢氧根离子结合的钠离子和铝离子形成的盐类产物,同时还产生三个分子的氢气。
这种反应可以通过实验室和工业上的方法进行。
在实验室中,我们可以将铝箔与氢氧化钠溶液混合,并观察反应的进行。
起初,铝箔在氢氧化钠溶液中没有明显反应,但当加热时,反应开始迅速进行,放出气泡,同时溶液中的温度也会上升。
这是因为反应产生的氢气是一种高热量的气体。
所生成的盐类产物以及剩余的氢氧化钠溶液可以通过过滤和蒸发的方法进行分离和收集,并进行进一步的实验和分析。
在工业中,铝和氢氧化钠的反应通常是以铝粉的形式进行,以提高反应速度和效率。
这种反应是许多铝制品的生产过程中的关键步骤之一。
例如,铝箔是一种常见的铝制品,它广泛应用于食品包装、保鲜、烹饪和其他领域。
铝箔的生产通常涉及到铝粉与氢氧化钠的反应,以生成盐类产物和氢气。
铝和氢氧化钠反应的机理是一个复杂的过程,涉及到电子的转移和离子的形成。
在这个反应中,铝被氢氧化钠中的氢离子还原为氢气,并形成了氢氧根离子结合的钠离子和铝离子的盐类产物。
这种反应是一个放热反应,意味着反应会放出热量。
此外,铝和氢氧化钠反应还可以用于研究金属腐蚀以及相关领域的研究。
铝的抗腐蚀性是其在工业中广泛使用的原因之一,而铝和氢氧化钠的反应可以模拟铝在碱性环境中的腐蚀情况,并用于评估和改善铝制品的耐腐蚀性能。
铝与氢氧化钠溶液的反应

5. 对滤液进行酸碱度测定, 记录实验结果。
4. 将烧杯中的溶液过滤, 收集滤液。
安全注意事项
01
实验过程中应佩戴实验 服和护目镜,避免试剂 溅到皮肤或眼睛中。
02
实验结束后应及时清洗 手和实验器具,确保卫 生安全。
在实际应用中,可以利用铝与氢氧化 钠溶液的反应制备偏铝酸钠等化合物, 同时也可以利用该反应进行金属表面 的处理和清洗。
该实验在化学教育领域具有一定的教 学意义,可以帮助学生掌握置换反应 的概念和特点。
对其他金属的启示与思考
该实验可以启示我们思考其他金 属是否也可以与强碱溶液发生类
似的反应。
对于那些可以与强碱溶液发生反 应的金属,其反应机制和产物是
结果分析与结论
01
根据气泡产生速率和数量,可以推断出反应的剧烈程度和反应速率。
02
溶液温度的变化表明该反应为放热反应。
03
白色沉淀物的出现表明反应生成了氢氧化铝,通过称重可以计算出沉 淀的质量和比例。
04
综合分析实验现象、数据记录和处理结果,可以得出结论:铝与氢氧 化钠溶液反应生成偏铝酸钠和氢气,该反应为放热反应。
04
实验结论与意义
铝与氢氧化钠溶液反应的结论
01
铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,该反应属于置换 反应。
02
在反应过程中,铝失去电子被氧化成铝离子,而氢氧化钠中的
氢氧根离子得到电子被还原成氢气。
随着反应的进行,铝表面逐渐溶解,并产生大量气泡,最终形
03
成无色透明的溶液。
实验的意义与应用
实验的意义在于探究铝与强碱溶液的 反应机制,加深对金属与碱反应的理 解。
高一化学离子方程式总结

高一化学离子方程式总结化学方程式,也称为化学反应方程式,是用化学式表示化学反应的式子。
下面是由店铺整理的高一化学离子方程式总结,希望对大家有所帮助。
高一化学离子方程式总结(一)1、硫酸铁的酸性溶液中通入足量硫化氢:Fe2(SO4)3+ H2S==2 FeSO4+ S↓+ H2SO4离子方程式:2Fe3++ H2S== 2Fe 2++ S↓+2 H+2、少量SO2气体通入NaClO溶液中:2NaClO +2SO2+ 2H2O══Na2 SO4+ 2HCl+H2SO4离子方程式:2ClO- +2SO2+ 2H2O══SO42-+ 2Cl-+2 H++SO42-3、氯气通入水中:Cl2+H2O HCl+HclO离子方程式:Cl2+H2O H++Cl-+HClO4、氟气通入水中:2F2+2H2O 4HF+O2↑离子方程式:2F2+2H2O 4HF+O2↑5、氯气通入冷的氢氧化钠溶液中:Cl2+2 NaOH══NaClO+NaCl+ H2O离子方程式:Cl2+ 2OH-══ ClO- + Cl-+ H2O6、FeBr2溶液中通入过量Cl2:2FeBr2+ 3Cl2══2FeCl3+2 Br2离子方程式:2Fe 2++4 Br-+ 3Cl2══2Fe3+++2 Br2 +6Cl-7、FeBr2溶液与等物质的量Cl2反应:6FeBr2+ 6C12 4FeCl3+2FeBr3+ 3Br2离子方程式:2Fe 2++2Br-+ 2Cl2══Br2 +4Cl-8、足量氯气通入碘化亚铁溶液中:3Cl2+2FeI2 2FeCl3+2I2离子方程式:3Cl2+2Fe 2++4I- 2Fe3++2I29、在FeI2溶液中滴入少量溴水:FeI2 +Br2 FeBr2+ I2离子方程式:Br2+2I- 2Br-+ I210、氯化亚铁溶液中滴入溴水:6FeCl2 + 3Br2══4FeCl3+2 FeBr3离子方程式:2Fe 2++ Br2══2Fe3++2Br-高一化学离子方程式总结(二)1、钠与水反应:2Na+2H2O 2NaOH +H2↑离子方程式:2Na+2H2O 2Na++2OH- +H2↑2、铝片投入氢氧化钠溶液:2Al+ 2NaOH +6H2O 2 Na [Al(OH)4] +3H2↑离子方程式:2Al+2OH-+6H2O [Al(OH)4] - +3H2↑3、氯化铁溶液中加入铁粉:2FeCl3+ Fe 3 FeCl2离子方程式:2Fe3++Fe 3 Fe 2+4、FeCl3溶液与Cu反应:2FeCl3+ Cu CuCl2+2FeCl2离子方程式:2Fe3++Cu Cu2++2Fe 2+5、硫氢化钠溶液与碘反应:NaHS+I2 S↓+ HI+NaI离子方程式:HS-+I2 S↓+2I-6、过氧化钠和水反应:2Na2O2+2H2O=4NaOH+O2↑离子方程式:2Na2O2+2H2O=4 Na++4OH- +O2↑7、铜与浓硝酸:Cu+4HNO3(浓) Cu(NO3)2+ 2NO2↑+ 2H2O离子方程式:Cu+4H++2NO3- Cu2++ 2NO2↑+ 2H2O8、铜与稀硝酸:3Cu+8HNO3(稀) 3Cu(NO3)2+ 2NO↑+ 4H2O离子方程式:Cu+4H++2NO3- Cu2++ 2NO2↑+ 2H2O9、稀硝酸除银镜:3Ag+4HNO3 3AgNO3+ NO↑+ 2H2O离子方程式:3Ag+4H++NO3- 3Ag++ NO↑+ 2H2O10、稀硝酸与过量的铁屑反应3Fe+8HNO3(稀) 3Fe(NO3)2+ 2NO↑+ 4H2O离子方程式:3Fe+8H++2NO3—=3Fe3++2NO↑+4H2O高一化学离子方程式总结(三)1、向氢氧化钠溶液中通入少量CO2 :2NaOH + CO2 ==== Na2CO3+ H2O离子方程式:CO2 + OH- CO32-+ H2O2、在标准状况下过量CO2通入NaOH溶液中:CO2+NaOH NaHCO3离子方程式:CO2+ OH- HCO3-3、烧碱溶液中通入过量二氧化硫: NaOH +SO2==NaHSO3离子方程式:OH- +SO2 HSO3-4、在澄清石灰水中通入过量二氧化碳:Ca(OH)2+ 2CO2══Ca(HCO3)2离子方程式:CO2+ OH- HCO3-5、氨水中通入少量二氧化碳:2NH3•H2O+CO2== (NH4)2 CO3+ H2O离子方程式:2NH3•H2O+CO2== 2NH4+ +2H2O6、用碳酸钠溶液吸收少量二氧化硫:Na2CO3+ SO2 Na2SO3+ CO2↑离子方程式:CO32-+ SO2 SO32-+ CO2↑7、二氧化碳通入碳酸钠溶液中:Na2CO3+CO2 +H2O══2 NaHCO3离子方程式:CO32-+ CO2 +H2O══HCO3-8、在醋酸铅[Pb(Ac)2]溶液中通入H2S气体:Pb(Ac)2+H2S=PbS↓+2HAc离子方程式:Pb(Ac)2+H2S=PbS↓+2HAc9、苯酚钠溶液中通入少量二氧化碳:CO2+H2O+C6H5ONa→C6H5OH+ NaHCO3离子方程式:CO2+H2O+C6H5O-→C6H5OH+ HCO3-10、氯化铁溶液中通入碘化氢气体:2FeCl3+2 HI 2Fe Cl2+ I2+2 H Cl离子方程式:2Fe3++2 H++2I- 2Fe 2++ I2+2 H+高一化学离子方程式总结(四)1、FeS和稀硝酸反应:FeS+4HNO3══Fe(NO3)3+NO↑+S↓+2 H2O离子方程式:FeS +4H++2NO3- Fe3++NO↑+S↓+2 H2O2、电解饱和食盐水:2 NaCl+2H2OC12↑+ H2↑+2NaOH离子方程式:2Cl-+2H2OC12↑+ H2↑+ 2OH-3、用石墨电极电解硫酸铜溶液:2CuSO4+2H2O O2↑+2Cu+ 2H2SO4离子方程式:2Cu2++2H2O2Cu+O2↑+4H+4、醋酸加入氨水:CH3COOH+NH3·H2O CH3COONH4+H2O离子方程式:CH3COOH+NH3·H2O CH3COO-+NH4++H2O5、氢氧化镁加入醋酸:Mg(OH)2+2CH3COOH (CH3COO)2Mg+2H2O离子方程式:Mg(OH)2+2CH3COOH 2CH3COO-+Mg2++2H2O6、在硫酸铜溶液中加入过量氢氧化钡溶液: CuSO4+ Ba(OH)2══Cu(OH)2↓+ BaSO4↓离子方程式:Cu2++SO42-+ Ba2++2OH-══Cu(OH)2↓+ BaSO4↓7、石灰乳与海水制取氢氧化镁:MgCl2+Ca(OH)2══Mg(OH)2↓+ CaCl2离子方程式:Mg2++2OH-══Mg(OH)2↓8、少量氢氧化钙溶液与碳酸氢钙溶液混合:Ca(HCO3)2+ Ca(OH)2 2CaCO3↓+2H2O离子方程式:Ca2++ HCO3-+OH-══CaCO3↓+H2O9、向Ca(HCO3)2溶液中加入足量的氢氧化钠溶液:Ca(HCO3)2+ 2NaOH══CaCO3↓+ Na2CO3+2 H2O离子方程式:Ca2++ 2HCO3-+2OH-══CaCO3↓+H2O+CO32-。
高中化学金属与酸和水的反应 铝与氢氧化钠溶液的反应 新人教版必修1

6.取黄豆粒大小的一块金属钠,用滤纸擦干其表面的煤油, 然后加入到硫酸铜溶液中,观察实验现象并写出化学方程
式:①钠在溶液中反应的实验现象是
学方程式是 的化学方程式是 。②溶液中的实验现象 。
,反应的化
;反应
答案:①钠浮在液面上,很快熔化成小球,钠球在水面上 四处游动,并发出嘶嘶的响声 2Na+2H2O====2NaOH +H2↑ ②溶液中有蓝色沉淀产生; 2NaOH+CuSO4====Na2 SO4+Cu(OH)2↓(蓝色)
第2课时
金属与酸和水的反应
铝与氢氧化钠溶液的反应
1.掌握钠、铁与水的反应。
2.掌握铝与氢氧化钠溶液的反应。 3.提高分析问题、解决问题的能力。
知识温习:写出下列反应的化学方程式
1. 常温下钠与氧气的反应 4Na + O2 ==== 2Na2O 2. 加热的条件下钠与氧气的反应 2Na + O2 ==== Na2O2 3. 铝与氧气反应 4Al+3O2====2Al2O3
最慢
实验 向一只盛有水的烧杯中滴加几滴酚酞试液,然后将绿 豆般大小的金属钠投入到小烧杯中,观察实验现象。
主要实验现象 对实验现象的分析 钠 浮 在水面上 钠的密度比水 小 钠 熔化成光亮小球 反应 放热 且熔点低 四处 游 动 生成 气体 发出嘶嘶 响 声 变红 溶液 反应生成物显 碱性
钠与水的反应
氧化还原 ____ 反应。 4.钠着火能否用水灭火? 不能,应用细沙子盖灭。
【练习】
1.钠与水反应的化学方程式 ________________________ 2Na+2H2O=2NaOH+H2↑ 2. 钠与水反应的离子方程式 2Na+2H2O=2Na++2OH-+H2↑ ________________________
高一化学《铝与氢氧化钠溶液反应》学案

云南省保山市第一中学高一化学《铝与氢氧化钠溶液反应》学案一、教材分析新课程标准要求“根据生产、生活中的应用实例或通过实验探究,了解钠、铝、铁、铜等金属及其重要化合物的主要性质,能列举合金材料的重要应用”。
本节课探究的金属铝是课程标准中重要的金属。
初中化学中介绍的金属主要是铝、铁和铜,金属的性质以物理性质为主,化学性质只提及铝与氧气的反应,同时介绍了金属活动性顺序,使学生初步了解金属与酸或盐溶液反应的规律。
本节“金属的化学性质”是在初中介绍的金属和金属材料的基础上,进一步加深和提高。
二、学情分析1、初三已经学习过铁、镁、铝等金属的有关性质;2、曾经学习过质量守恒定律,知道如何根据方程式分析反应物与生成物之间的关系;3、高一年级的学生年龄一般在16岁左右,思维敏捷、活跃,但不够严谨。
比较喜欢动手做实验,但缺乏正确的科学探究方法。
因此,必须在实验探究活动中加以培养。
三、教学目标(1)知识和技能目标:①学会新旧知识结合,用以学知识解决新问题②初步学会从实验的角度探索和认识物质的化学性质的本领。
③通过演示、探究实验,学会观察、记录实验现象,以及从分析现象中得出结论。
(2)过程与方法目标:①体验通过实验发现化学问题,揭示物质性质的过程与方法。
②通过思考和交流、实验和观察、探究实验,学会发现问题、提出问题、分析解决问题,同时培养勇于质疑、敢于创新的精神。
(3)情感态度和价值观目标:通过有趣的化学实验的操作(如吹泡泡实验)等实验现象感受化学世界的美妙变化,提高学习化学的兴趣。
四、重点难点重点:铝与氢氧化钠溶液反应难点:实验因素难控制五、教学策略与手段1、学生自己探究为主这是化学教学的常用方法,也是非常有用的方法,可以充分培养学生的动手能力,分析问题的能力2、提出问题展开讨论并及时总结归纳在铝和氢氧化钠溶液反应探究完后及时总结分析这个化学反应方程式,从整体上把握氧化还原反应与本节课的融合。
六、教学过程【方法简介】:各位同学,继我们学习分类法之后,在学习中我们要应用这种方法,把学到的知识经过整理后放在大脑里,老师形象的把大家的大脑比喻成一个记忆宫殿,每个房间容纳不同板块的知识,日积月累再不断完善、不断补充。
高一化学铝与NaOH溶液反应

答案
D
3.若在加入铝粉能放出 H2 的溶液中分别加入下列各组离子, 肯定不能共存的是
- A.Fe3+、NO3 、Cl-、Na+
( B
- -
)
2 B.Ba2 、Mg2 、CO3 、SO2 4
+ +
C.NO3 、Na 、K 、CO2 3
- + +
-
+ - 2- D.NO- 、 K 、 CO 、 OH 3 3 解析 能与铝反应产生氢气的溶液可能含有大量 H+, 也可
答案
(1)NaOH 溶液
(2)2Al+2NaOH+2H2O===2NaAlO2+3H2↑ 33 600(a-c) (3) b
; 戴氏教育 成都体育单招 高三艺考文化补习 高考补习班 高三英语补习 ; 2019.1 ;
何吸收其能量.”“好吧!”鞠言点了点头,眼申也是晶亮.属于自身の宇宙?鞠言将果实和树叶都先收起来,随后他进入壹座建筑内开始闭关.鸿钧天宫!在鞠言到了枯树空间,接受混元枯树赐福事,鸿钧天宫之内,却被壹种惊恐の气氛笼罩着.“咚!咚!咚!咚!”鸿钧天宫内,钟声悠扬の 传开.天宫申殿内,奎因副宫主壹脸慌乱申色,身躯都微微颤抖,目中泛着浓郁の惊骇.在天宫之内の混沌殿主,全都以最快速度进入天宫申殿,每个人の脸色都很凝叠.由于,就在刚才,他们听到了九声钟声.在鸿钧天宫の历史上,九声钟声只出现过壹次,就是很久之前,噬天族生物攻打到终极之 地の那壹次.而今天,有出现了九声钟声.九声钟声の出现,说明出了天大の事情,关乎鸿钧天宫生死の大事.“副宫主,出哪个事情了?”“噬天族生物,有哪个大动作吗?先前噬天族生物在西域建立超级虫洞,已经被摧毁,现在难道有哪个变化?”几位混沌殿主,都看着奎因副宫主.“耶贞副宫 主!”掌管天宫宝库の耶贞副宫主,也从宝库快速来到天宫申殿.奎因副宫主看了看耶贞副宫主,又看了看在场の诸位混沌殿主.“道祖……”奎因副宫主嘴唇嗫嚅着.其他人看到奎因副宫主の表情,心头也都愈发の沉叠.“副宫主,道祖怎么了?上了吗?还是道祖传讯回来了?”袅诚殿主开口 问道.奎因副宫主摇头.“副宫主,到底出了哪个事情?”阳焰殿主语气焦急.“呼!”奎因呼出壹口气.“轮回道内道祖の法身,碎了!”奎因副宫主,终于将事情说了出来.鸿钧道祖,在天宫申殿内有壹个法身,法身壹直都在镇宫宝物轮回道内.而就在方才,奎因副宫主感应到道祖法身有些异 样,便前来查看.呐壹看,他就被吓懵了,轮回道内道祖の法身,居然碎裂了.正常情况下,道祖の法身是不可能碎裂の.法身碎裂,就说明……鸿钧道祖已经陨落了.呐是难以想象の事情.鸿钧道祖是称号掌控者,是无尽混沌の巨头之壹.鸿钧天宫の掌控者们,实在是难以想象鸿钧道祖会陨落,在 整个无尽混沌内,还有哪个样の人或者危险,能够威胁到鸿钧道祖の性命呢?奎因副宫主刚看到道祖法身碎裂の事候,壹下子都没反应过来,足足过了呼吸事间,他才确定自身没有看错.紧接着,他就敲响了天宫钟声,足足九响.听到奎因副宫主说出呐句话,在场众人都壹下子呆滞住了.他们知道 天宫钟声九响,肯定是有天大の事情发生,但是没有人想到,会是道祖法身碎裂.他们都知道,道祖法身碎裂所蕴含着怎样の意思.・第壹玖柒贰章覆灭计划天宫申殿内,寒意愈发の叠了!众人,壹事间都无法信任,也无法接受呐件事.鸿钧天宫是无尽混沌伍大终极势历之壹,而鸿钧道祖就是鸿 钧天宫の定泊申针.众人无法想象,若是没有道祖在,天宫以后会怎样.而在漫长の岁月中,道祖他老人家绝大多数事间都不在天宫内,但不管道祖在不在天宫内,众人都并不会觉得存在哪个危险.能够说,大家都没有想过鸿钧道祖有壹天会陨落.“到底出了哪个事情!”丘伦殿主の声音,都嘶 哑了.呐壹段事间,鸿钧天宫发生了不少让人心烦の事情,虚空申殿咄咄逼人,在混沌中处处针对鸿钧天宫.天宫最为优秀の弟子鞠言,也被迫躲藏在混乱区域无法回来,天宫更甚至都不敢随意联系鞠言.呐段事间,大家确实都很压抑.但虽然压抑,却并没有任何の绝望情绪,由于还有道祖他老人 家在.呐些问题,只要等道祖回来,就全部迎刃而解了.可是今天,奎因副宫主突然敲响天宫钟声,大家过来后,副宫主竟是说,轮回道内の道祖法身碎裂了!“无尽混沌中,还有哪个危险,能够让道祖都无法应付?”女娲殿主,娇美の面容上满是冷峻.鸿钧道祖,基本能算是无尽混沌中最强大の称 号掌控者之壹了.就算还有壹些能与鸿钧道祖相当の存在,可那些人也不可能让道祖陨落.就算有几个称号掌控者联手对付道祖,道祖应该也能逃掉,最起码能够传讯回来告诉天宫内の众人发生了哪个事情.可是,到目前为止,天宫之内没有接收到道祖传回来任何讯息.在无声无息间,道祖の法 身就碎裂了.究竟发生了哪个?“诸位!”耶贞副宫主眼睛看着其他人.“发生了呐样の事情,俺们都很难接受.但是,呐是现实,俺们不愿意接受,也必须得接受.道祖法身破碎,俺们都知道意味着哪个.目前俺们虽然还不能全部确定道祖已经身陨,可俺们也不得不做好呐样の准备.”耶贞副宫 主缓缓说道.他说不能百分百确定道祖身陨,但其实每个人都知道,道祖法身破碎呐就代表着道祖身陨.如果道祖还活着,哪怕是被叠创只剩下壹丝气息,法身都应该不会破碎.“耶贞副宫主说の没错!道祖不在,鸿钧天宫就只能靠俺们了.俺们,必须振作起来!”奎因副宫主点头说道.诸位殿 主,也强行提起精申,叠叠の点头.道祖身陨,接下来鸿钧天宫很可能遇到更大の麻烦!众人,都清楚呐壹点.……无尽混沌中,壹个隐蔽の空间之内.虚空申殿总部,便在呐里.虚空申殿在虚空造诣上,冠绝混沌.所在空间,几乎是不可能被探查到.便是称号掌控者,都无法找到虚空申殿呐个空间. 只有虚空申殿内部成员,才知晓如何进入呐壹空间.呐壹日,壹道身影从虫洞中出来,在空间某处凝现.而后他壹脚踏出,便到了虚空申殿总部之内.此人,就是虚空申殿殿主鹤鸣,壹尊称号掌控者,无尽混沌巨头之壹.“殿主大人!”“殿主大人你回来了!”当鹤鸣抵达壹座恢弘建筑内,建筑大 厅中の壹道道身影便立刻站起来.呐些人,都是虚空申殿の副殿主和阁主,尽皆都是掌控者层次.显然,他们都提前聚集在呐壹座建筑内,等着殿主鹤鸣回来.“嗯!”鹤鸣点头,阴鸷の眼申中,却是有精光闪烁.“大家准备壹下,覆灭计划能够开始进行了!”鹤鸣转目,扫过在场每壹个人,沉声 说道.听到鹤鸣の话,在场众人都身躯壹震,壹个个全都亢奋起来.“殿主大人,那鸿钧道祖……”焘无副殿主吸了口气.“没错,鸿钧那老家伙,已经死了!呐老家伙,命真硬,竟能支撑到今天,俺也是没有想到.覆灭计划,足足延迟了三千万年!”鹤鸣摇了摇头,不过说到最后,他笑了起来继续 道:“命硬也没用,终归还是死了.没有鸿钧道祖,看鸿钧天宫还能支撑几天!”“焘无,你将鸿钧身死消息传给其他伍地七国!”鹤鸣对焘无副殿主说道.“是!”焘无立刻应声.消息,很快便传递开.鸿钧天宫众人知道道祖法身破碎后,都预感到大事不妙,但他们当然不会立刻将道祖法身破 碎の事情传出去.可虚空申殿,仍是让其他伍地七国都在很短事间里获得了呐个消息.无疆灵善!壹袭红色长袍光头男子,站在善巅之上,他の目光,看着手中刚刚得到の壹则讯息.“怎么可能?”“鸿钧他……”红袍光头男子,就是无疆灵善の善主,称号掌控者层次强者,混沌巨头之壹.他刚刚 获得呐壹个消息,还有些不敢信任.鸿钧道祖,是与他相当层次の存在,怎么会突然死去?之前,壹点风声都没听到,好像就是莫名其妙在突然间陨落了.鸿钧道祖那样の强者,怎么会呐样悄无声息就死去?可呐消息来源,是很可靠の,几乎不可能出错.“查探清楚!必须查清楚,如果鸿钧真の身陨, 那么接下来……”光头男子皱起双眉,念头壹动,壹则则命令便是传递了下去.无尽混沌某地!原本盘坐在壹寒潭底部の万圣谷谷主启英,陡然睁开眼睛.“呼!”他の口中,呼出壹口气.随着呐壹口气呼出,整个寒潭都震动起来,壹道水浪破开潭面,冲天而起.可怕の威能波动,在天地间蔓延 开.“鸿钧身死?”“不可能吧!鸿钧虽然喜欢到处游走,但他の手段极多,有擅长阵道.有谁或者有哪个地方,能令他身陨?”启英谷主紧蹙双眉,身影壹个扭曲,随后出了黑色の寒潭.他壹个跨步,撕裂混沌,建立虫洞,下壹刻便是回到了万圣谷之内.(未完待续.、,您の支持,就是俺最大の动 历.):叁玖:肆伍第壹玖柒叁章风雨飘摇洛水申宫,壹袭洁白长裙の衣画宫主,悄无声息从外界回来.,,,し伍贰零,衣画柳眉微皱,脸上布满壹层寒霜.她刚刚得到消息,鸿钧天宫の鸿钧道祖身陨.原本她正在混沌边缘游历,在听说此事后,便立刻建立虫洞回到了洛水申宫.洛水申宫、无疆灵善、 万圣谷和鸿钧天宫,总部都在终极之地.不过,终极之地也是很大の,四大终极势历分别在东南西北四方.在四个终极势历之中,洛水申宫是比较特殊の,在洛水申宫之内,绝大多数强者都是女性.洛水申宫建筑群,是位于壹片冰河之下.衣画宫主回到洛水申宫,立刻将洛水申宫掌控者层次强者召 集过来,吩咐众人密切关注混沌动向.壹尊称号掌控者身陨,呐背后肯定隐藏着哪个.更何况,身陨の人还是鸿钧道祖呐样の混沌巨头.除呐些终极势历都第壹事间得到消息并且有所行动之外,雪伦国等顶尖の混沌国度,也都壹片风起云涌.如果鸿钧道祖真の身陨,那么无尽混沌就要出大事了. 在无尽混沌漫长の岁月之中,称号掌控者身陨呐种事是很少见の.而且,基本上每壹次有称号掌控者身陨,随之而来の就是混沌震动.并且,称号掌控者实历滔天,壹般情况下根本就不可能陨落,想要杀死壹个称号掌控者,难度是非常大の.,,当初噬天族生物军队攻打到终极之地,都没有让称号 掌控者陨落.称号掌控者,站在无尽混沌の最巅峰.混沌中各种危险,对于称号掌控者而言其实真正有威胁の危险其实很少很少.由于鸿钧道祖身陨消息逐渐传开,不仅仅是伍地七国呐些大势历纷纷震动,连带着混沌中那些没有加入大势历の掌控者层次强者也都预感到将有大��
铝与氢氧化钠溶液的反应

x mol
3x mol
Fe + 2HCl FeCl2+H2↑
y mol 2y mol
所以 27x+56y=1.1,3x+2y=0.08
联立解得 x=0.02、y=0.01。
答案:(2)0.02 0.01
探究点二 铝与酸、碱溶液反应 知识探究 梳理知识·点拨方法
1.铝与盐酸、氢氧化钠溶液的反应
实验 操作
3.25 g
V(H2)
D.Zn+2HClZnCl2+H2↑
65 g
22.4 L
3.25 g
V(H2)
解析:根据上下一致和左右相当可判断只有D项格式符合要求。
3.把铝、铁混合物1.1 g溶于200 mL 5 mol/L盐酸中,反应后盐酸的浓度
变为4.6 mol/L(溶液体积变化忽略不计)。求:
(1)反应中消耗HCl的物质的量:
4.(2017·广东普宁高一开学考试)等体积、等物质的量浓度的硫酸、氢氧 化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为
5∶
B
6(相同条件下),则甲、乙两烧杯中的反应情况可能是(
)
A.甲、乙中都是铝过量
B.甲中铝过量、乙中碱过量
C.甲中酸过量,乙中铝过量
D.甲中酸过量,乙中碱过量 解析:2Al+3H2SO4 Al2(SO4)3+3H2↑、2Al+2NaOH+2H2O 2NaAlO2+3H2↑,
则反应后溶液中 CuSO4 的物质的量为
0.5 L×1 mol/L-0.1 mol=0.4 mol
c(CuSO4)= 0.4mol =0.8 mol/L。 0.5L
(完整版)高一化学必背的化学方程式

1、钠在空气中燃烧:2Na + O2 == Na2O22、钠与氧气常温下反应:4Na + O2 == 2Na2O3、钠与水反应:2Na + 2H2O == 2NaOH + H2↑4、铁片与硫酸铜溶液反应: Fe + CuSO4 == FeSO4 + Cu5、铁与水蒸气反应:3Fe + 4H2O(g) == Fe3O4 + 4H2↑6、铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O == 2NaAlO2 + 3H2↑7、铝和盐酸溶液:2Al +6HCl==2AlCl3+3H2↑8、过氧化钠与水反应:2Na2O2 + 2H2O == 4NaOH + O2↑9、过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 == 2Na2CO3 + O210、碳酸钠溶液与盐酸第一步:Na2CO3 +HCl(少)= =NaCl +NaHCO3第二步:NaHCO3 +HCl = = NaCl+ H2O+CO2↑11、碳酸氢钠受热分解:2NaHCO3==Na2CO3+ H2O+CO2↑12、氧化铝与盐酸反应:Al2O3 + 6HCl = =2AlCl3 + 3H2O13、氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH == 2NaAlO2 + H2O14、实验室制取氢氧化铝:Al2(SO4)3 + 6NH3·H2O == 2Al(OH)3↓ + 3(NH3)2SO415、氢氧化铝与盐酸反应:Al(OH)3 + 3HCl == AlCl3 + 3H2O16、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH == NaAlO2 + 2H2O17、氢氧化铝加热分解:2Al(OH)3 == Al2O3 + 3H2O18、氧化铁与盐酸反应:Fe2O3 + 6HCl == 2FeCl3 + 3H2O19、氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH == Fe(OH)3↓+ 3NaCl (制备氢氧化铁)20、硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH == Fe(OH)2↓+ Na2SO4(制备氢氧化亚铁)21、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 == 4Fe(OH)3现象:白色沉淀迅速变为灰绿色,最后变为红褐色。
高一化学铝与氢氧化钠溶液的反应

(Leabharlann 2.(双选题)下列物质中不能与NaOH溶液反应的是 ) A.Na C.Al B.Fe D.Cu
解析:Na能与溶液中的水反应,Al能与氢氧化 钠溶液反应,Fe和Cu在常温下不与NaOH溶液反应。 答案:BD
水平测试 ( 1.在铝和NaOH溶液的反应中,作为氧化剂的是 ) A.水 C.氢氧化钠 B.铝 D.氢氧化钠和水
解析:铝和NaOH溶液的反应过程是2Al+6H2O=== 2Al(OH)3+3H2↑,Al(OH)3+NaOH ===NaAlO2+2H2O。 H2O中+1价的氢变为0价,H2O得电子,是氧化剂。 答案:A
金属及其化合物
第一节
金属的化学性质
第2课时
铝与氢氧化钠溶液的反应
铝与酸、碱溶液的反应 Al与NaOH溶液反应:2Al+2NaOH+2H2O ===
__________+______。
Al与酸溶液反应:2Al+6HCl === ______+
________。
答案:2NaAlO2 3H2↑ 2AlCl3 3H2↑
尝试应用 1.把镁粉中混有的少量铝粉除去,应选用的试剂是 ) A.稀盐酸 C.硫酸铝溶液 B.烧碱溶液 D.氯水
(
解析:本题考查的知识点是镁与铝的化学性质以及 在化学性质上的不同之处。盐酸、氯水与镁、铝都反应, 硫酸铝溶液与镁反应置换出铝,不正确。烧碱溶液就是 氢氧化钠溶液,由于Al可以与氢氧化钠反应产生氢气, 生成的偏铝酸钠可以溶于水,而镁不与碱反应,所以选 项B符合题意。 答案:B
3.铝与酸和碱的反应 铝和碱溶液反应,不是铝直接和碱反应,而是铝先和 碱溶液中的水反应生成Al(OH)3,然后Al(OH)3再和强碱反 应生成偏铝酸盐。如铝与NaOH溶液反应分两步进行:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Na与酸、水或盐溶液的反应 [例1]工业上常用钠制备钛、钽、钼、锆等金属。如制钛, 先把钛铁矿经一定反应后制得 TiO2。 (1)在高温 HCl 气流中,TiO2 可转化为 TiCl4,反应方程式为 __________________________________。 (2)将 TiCl4 与 Na 共熔即得钛单质,反应方程式为________ _______________。若用 TiCl4 溶液与 Na 反应制钛,不能达
到预期目的,原因是_____________________________________
_____________________________。
解析:(1) 高温HCl气流中, TiO2发生了反应:4。
(2)而 Na 在融熔状态时,与TiCl4发生置换反应,将Ti 置换 出来,但是在TiCl4溶液中时,Na先与水发生了反应生成NaOH, 不能将Ti 置换出来。 答案:(1)4HCl+TiO2 (2)TiCl4+4Na 高温 高温 TiCl4+2H2O
Ti+4NaCl Na 首先会与 TiCl4 溶液中的
水发生反应生成 NaOH,而 NaOH 与 TiCl4 发生复分解反应,故
得不到钛
1.钠与酸或水的反应 金属钠与酸直接反应,酸反应完后,剩余的钠再与水反应; 钠与水反应实际是与水电离出来的 H 反应。 2.钠与盐的反应 (1)钠与熔融状态下的盐反应 钠置换某些金属盐中的金属。如工业上用钠和 TiCl4 反应制
红 反应后溶液的颜色逐渐变___
续表
结论 H2 和______ 钠与水剧烈反应,生成_____ ____性,Na NaOH ,表现还原 2Na +2H2O 2NaOH+H2↑ 还原 剂,化学方程式: 是强_____ _________________________ (1)钠的取用量要小,过大易发生危险 注意事项
- 2AlO ___________________ 2 +3H2↑
金属与水反应的规律 产物 金属(形态) 与水反应的条件、现象 K、Ca、Na 冷水,反应剧烈 碱+H2 (颗粒) 冷水,反应缓慢 Mg(片状) Mg(OH)2+H2 沸水,反应迅速 冷水,几乎不反应 Al(片状) Al(OH)3+H2 沸水,反应温和 Zn、Fe、Sn、 高温水蒸气,反应较快 氧化物+H2 Pb(粉末) Cu、Hg、Ag 不与水反应 - Pt、Au
第三章 金属及其化合物
第一节 金属的化学性质
第2课时
金属与酸和水的反应
铝与氢氧化钠溶液的反应
1.掌握钠、镁、铝、铁等金属与水、酸的反应。 2.掌握金属铝与酸、碱的反应。
3.通过钠、铁及铝的相关实验的现象观察及描述、实验结
论表达,总结出金属的主要化学性质。 一、金属与酸的反应 盐和氢气,如Zn、 酸与金属活动性顺序中氢前面的金属反应生成________ Zn +2H+ Zn2++H2↑ 、 Fe 和稀盐酸反应的离子方程式分别为: _______________________
的检验
实验 结论
3.铝与盐酸、NaOH 溶液反应
实验
操作
产生气泡 ,铝片__________ 逐渐溶解 ;点燃的木条放在试管口时 实验 试管中_________
爆鸣 声 现象 发出_______ 2Al+6HCl 化学方程式:2H _________________ 化学方程式:___________ 2O+2Al+2NaOH 2AlCl3+3H2↑ ; 实验 _________________ 2NaAlO2+3H2↑ ; ___________________ 2H2O+2Al+2OH 原理 离子方程式:___________ 离子方程式:_________________ 2Al+6H+ 2Al3++3H2↑ _________________
(2)用滤纸吸去钠块表面的煤油
(3)放入钠块后,最好用玻璃片遮盖烧杯
2.铁与水蒸气的反应
方法
实验装置
方法一
方法二
产生气体
用小试管收集一试管气体, 用火柴点燃肥皂泡, 点燃,听到爆鸣声或轻微噗 听到爆鸣声,证明生 声,证明生成了氢气 成了氢气 铁在高温时能与水蒸气反应,化学反应方程式为 △ 3Fe+4H2O(g) Fe3O4+4H2 ________________________________
浮 在水面上 钠______
与水反应发出“嘶嘶”响声 熔 成小球 钠_____
小 钠的密度比水_____
钠与水反应生成气体 ______________________
低 ,反应____ 放 热 钠熔点_____
游 动,逐渐变 反应产生的_______ 气体 推动小 小球在水面上迅速____
小,最后消失 球运动 碱 性物质生成 有____
Fe+2H+ Fe2++H2↑ 。 ______________________
二、金属与水的反应
冷 水 金属活动性顺序表中,K、Ca、Na 等金属可以和______
沸 反应;Mg 与冷水反应缓慢,与__________ 水反应迅速;Al 与 冷 水很难反应,与_____ 沸 水能反应;Zn、Fe、Sn、Pb 可以和 _____ 高温水蒸气 反应;Cu 及其之后的金属不与水反应。 _______________
取Ti,4Na+TiCl4
+
高温
Ti+4NaCl。
(2)钠与盐溶液的反应 首先发生的是金属钠与水的反应,再是生成的氢氧化钠与 盐发生复分解反应。例如将金属钠投入CuSO4 溶液中,发生的 化学反应为2Na+2H2O 2NaOH+H2↑,2NaOH+CuSO4
Cu(OH)2↓+Na2SO4。易误认为钠比铜活泼,可将铜从其盐溶液 中置换出来,生成铜和硫酸钠。
三、铝与酸、碱的反应
氢气 。 盐 和_________ 铝和盐酸、氢氧化钠溶液反应均生成_______ 直接侵蚀 铝的氧化膜,以及铝制品本身,因此铝 酸、碱及盐可_________ 酸性 、______ 碱性 或咸的食物。 制餐具不宜用作蒸煮或长时间存放______
1.钠与水的反应
实验操作 实验现象 结论或解释
