淋巴细胞刺激指数
CCK—8法在淋巴细胞增殖检测中最佳实验条件的筛选

CCK—8法在淋巴细胞增殖检测中最佳实验条件的筛选目的筛选CCK-8法在淋巴细胞增殖检测中的最佳实验条件。
方法采用正交实验设计,对初始细胞浓度、培养时间、LPS浓度、显色时间这4个主要因素各水平对人外周血单个核细胞(PBMC)和小鼠脾细胞增殖的影响进行试验研究,对各实验组合测得的刺激指数进行方差分析。
结果CCK-8检测人PBMC 增殖试验的最佳条件:初始细胞浓度为2.5×106/mL,培养时间为48 h,LPS浓度为1 μg/mL,加入CCK-8后孵育4.5 h;检测小鼠脾细胞增殖试验的最佳条件:初始细胞浓度为5.0×106/mL,培养时间为48 h,LPS浓度为1 μg/mL,加入CCK-8后孵育4.5 h。
结论CCK-8法便捷、灵敏、重复性好,可作为检测淋巴细胞增殖的稳定方法。
本研究建立的CCK-8最佳实验条件可为免疫调节作用的药物体外筛选和免疫药理学作用的研究提供依据。
[Abstract] Objective To optimize the experimental conditions of CCK-8 in lymphocyte proliferation assays. Methods An orthogonal test was designed to investigate the influence of four major factors (cell density,culture period,concentration of LPS and duration of incubation with CCK-8)on cell proliferation of human PBMC and mouse splenocyte. ANOV A was carried out to analyze the stimulation indices of all experimental condition combinations. Results The optimal conditions for CCK-8 was as follows:for PBMC,cell density was 2.5×106/mL,culture period was 48 h,concentration of LPS was 1 μg/mL,and duration of incubation with CCK-8 was 4.5 h;and for splenocyte,cell density was 5.0×106/mL,culture period was 48 h,concentration of LPS was 1 μg/mL,and duration of incubation with CCK-8 was 4.5 h. Conclusion The optimized CCK-8 protocol is a sensitive,convenient and stable quantitative method to evaluate lymphocyte proliferation. This result can provide evidence in screening of immunomodulating drugs and investigation of their immunopharmacology.[Key words] CCK-8;PBMC;Lymphocyte proliferation;Orthogonal test檢测淋巴细胞增殖的方法主要有形态学检查法、放射性核素标记法和四氮唑盐比色法等。
过敏原对支气管哮喘患者外周血淋巴细胞增殖功能的影响

zl t zl m ( )cl i e yi 1 ai t wt l r cboc i s m asdb em t h gief r a o le aoi y tr u M几、 oo m t pt ns i aeg r h l t acue yD r ao aods ai e r r n 2 e h l i n aah p n
mL. Th Io e s fPB— c nc tai n o o enr to fDF.Th fP esIo BMC sd c e s d i h o c n rto fDF wa r h n 1 wa e r a e fte c n e tain o smo et a 0
( F .R s l Wh etec n e t t no F a 1 0 D ) eut s i o c nr i f t —1 l h ao D mL t I f B C w s n r s ga n i ce sd , h s M a ic ai l gw t i rae — e oP e n o hn
文献 标 识 码 : A
过 敏 原 对 支气 管 哮 喘 患者 外 周 血 淋 巴细 胞 增 殖 功 能 的影 响
郭J 仕 , 许 以平 寿 L
( 上海 交通 大学 医学 院附属 仁济 医院呼 吸科 , 上海 2 0 2 ) 0 17
摘要 : 的 目 探 讨 支气 管 哮 喘 患 者 外 周 血 淋 巴 细 胞 接触 特 异性 过 敏原 后 的增 殖 情 况 。方 法 采 用 四 甲 基偶
A t sudy o oie a in f p i r l blod m o nuce r c l c s d by al r e i br nc a a t a f pr lf r to o erphe a o no la el au e l g n n o hil shm s e
各免疫器官指数的英文表达

各免疫器官指数的英文表达
各免疫器官的指数通常在医学和生物学领域中使用,以下是一些常见免疫器官的指数及其英文表达:
1.胸腺指数(Thymic Index):表示胸腺大小和发育程度的指标。
2.脾指数(Spleen Index):表示脾脏大小和功能状态的指标。
3.淋巴结指数(Lymph Node Index):表示淋巴结的大小和活跃
程度的指标。
4.骨髓指数(Bone Marrow Index):表示骨髓中免疫细胞的活
跃程度和数量的指标。
5.白细胞计数(White Blood Cell Count):血液中白细胞的数量,
是一个免疫系统健康的常规指标。
6.免疫球蛋白(Immunoglobulin)水平:表示血液中特定免疫
蛋白的浓度,通常分为IgA、IgG、IgM等亚类。
这些指数和参数在医学诊断和研究中用于评估免疫系统的状态和功能。
需要注意的是,具体的免疫指数可能因医学研究领域的不同而有所变化,而且可能还有其他特定的免疫参数和标志物用于更详细的免疫分析。
淋巴细胞计数参考范围

淋巴细胞计数参考范围1.引言1.1 概述淋巴细胞计数是一种常规的临床检验项目,用于评估人体免疫功能的指标之一。
淋巴细胞是免疫系统中最重要的细胞类型之一,它们在人体的抗感染、抗肿瘤和免疫调节等方面发挥着重要的作用。
淋巴细胞计数的结果可以帮助医生了解患者的免疫状态,以及对某些特定疾病的诊断和治疗提供参考依据。
正常的淋巴细胞计数范围是通过大量的人群研究得出的,它可以作为判断患者免疫功能是否正常的标准。
本文将对淋巴细胞计数的参考范围进行探讨,并分析一些可能影响淋巴细胞计数的因素。
同时,我们还将探讨淋巴细胞计数在临床应用中的前景,以及对某些疾病的诊断和治疗的潜在意义。
通过深入研究淋巴细胞计数的参考范围以及其临床应用前景,我们可以更好地了解免疫系统的重要性,并在临床实践中更好地运用这一指标,为患者的健康提供更加精准的评估和治疗方案。
淋巴细胞计数的研究和应用,无疑是当今医学领域中的一个热门课题,在未来将会有更多令人期待的突破和进展。
1.2文章结构文章结构部分的内容可以根据需要来进行编写,可以包括以下内容:在本文中,我们将按照以下结构来展开讨论淋巴细胞计数的参考范围和其在临床应用中的前景。
首先,我们将在引言部分概述本文的主要内容和目的。
接着,在正文部分的第一部分,我们将详细介绍淋巴细胞计数的意义和作用,探讨其在免疫系统中的关键作用以及与疾病之间的关联。
我们将讨论淋巴细胞计数如何反映机体的免疫功能,并探讨其在临床诊断和治疗中的重要性。
在正文部分的第二部分,我们将探讨淋巴细胞计数的影响因素。
我们将介绍各种可能影响淋巴细胞计数的因素,包括年龄、性别、健康状况等。
我们将详细讨论这些因素如何对淋巴细胞计数产生影响,并分析它们对临床应用的潜在影响。
最后,在结论部分,我们将总结淋巴细胞计数的参考范围,并讨论其在临床应用中的前景。
我们将总结淋巴细胞计数的正常范围,并讨论异常计数可能意味着何种情况。
我们还将探讨淋巴细胞计数作为临床指标的潜在应用,包括其在疾病诊断、治疗监测和预后评估中的可能性。
淋巴细胞免疫12项解析

淋巴细胞免疫12项解析淋巴细胞免疫12项指的是人体免疫系统内特定的12项指标,可以检测气体交换、急性期反应、细胞免疫功能等方面的信息,是评估人体免疫功能状态的重要指标之一。
下面将针对每项指标进行解析。
1. 总淋巴细胞计数:是指人体内所有淋巴细胞的数量,包括T、B、NK细胞等。
通过该项指标的检测可以初步了解人体免疫系统的总体状态。
2. CD3+细胞计数:指的是具有CD3表面标志的T淋巴细胞数量,这类细胞在人体免疫系统中扮演了非常重要的角色。
CD3+细胞计数可以初步了解人体的细胞免疫状态。
3. CD4+/CD8+细胞计数:CD4+和CD8+分别是T细胞亚群的代表性分子,二者的比例可以反映人体免疫系统的平衡状态。
如果CD4+/CD8+的比值增高,则说明免疫力下降。
4. CD19+细胞计数:CD19+细胞是B淋巴细胞数量的代表,它的检测可以反映人体的体液免疫状态。
5. NK细胞计数:NK细胞是一种重要的免疫细胞,是人体体液免疫和细胞免疫中不可缺少的细胞。
NK细胞计数可以反映人体的免疫防御水平。
6. IFN-γ:是一种细胞因子,它参与了人体细胞的抗病毒和抗肿瘤防御。
IFN-γ水平的升高表明细胞免疫功能的增强。
7. IL-2:是一种促进T细胞增殖和增强细胞免疫功能的细胞因子,IL-2水平的升高可以反映出T细胞免疫功能的增强。
9. IL-6:是一个促炎性因子,参与了许多生理过程,如发热、急性期反应等。
IL-6水平的升高可以反映出机体免疫炎症反应的增强。
10. IL-10:是一种抗炎因子,它能够抑制细胞免疫和体液免疫反应,因此IL-10水平的升高表明机体正处于免疫抑制状态。
总的来说,淋巴细胞免疫12项检测可以反映出机体免疫系统的代谢、细胞免疫功能、体液免疫功能、免疫调节等方面的信息,对于了解机体的免疫状态起到了非常重要的作用。
同时,通过对这些指标的监测,还可以帮助医生制定合理的免疫调控方案,从而改善机体的免疫状态,提高身体的抗病能力。
长期递增负荷运动对大鼠脾淋巴细胞增殖活性、凋亡及凋亡相关基因表达的影响

长期递增负荷运动对大鼠脾淋巴细胞增殖活性、凋亡及凋亡相关基因表达的影响王雪芹;郝选明【摘要】目的:观察6周递增负荷运动对大鼠脾脏淋巴细胞增殖能力(SI)、线粒体膜电位(△Ψm)及Bax和Bcl-2 mRNA的影响.方法:将64只8周龄SPF级雄性SD 大鼠随机分为0周组(WK0)、2周组(WK2)、4周组(WK4)和6周组(WK6),进行递增负荷跑台训练6周,分别于第0、2、4、6周周末,利用JC-1染色流式细胞术检测脾脏淋巴细胞形成的单体(J-aggregate)和聚合体(J-monomer)的平均荧光强度(FL2,FL1),并计算线粒体膜电位(FL2/FL1,△Ψm),MTT法检测淋巴细胞刺激指数(SI),FQ-RT-PCR技术测定Bax mRNA和Bcl-2mRNA表达水平.结果:6周递增负荷运动过程中,WK2、WK4、WK6组大鼠的脾系数显著低于WK0;WK4、WK6组大鼠的脾脏淋巴细胞SI显著低于WK0和WK2;WK2、WK4、WK6组大鼠的线粒体膜电位显著低于WK0;WK4、WK6组大鼠的Bax mRNA表达明显增加,WK2、WK4、WK6组大鼠的Bcl-2 mRNA表达和Bcl-2/Bax比值明显降低.结论:6周递增负荷运动使大鼠脾脏淋巴细胞的增殖活性降低,凋亡增加,其机制可能是6周递增负荷运动改变了调控基因Bax mRNA和Bcl-2 mRNA的表达.【期刊名称】《中国体育科技》【年(卷),期】2013(049)006【总页数】5页(P100-104)【关键词】运动;运动免疫;脾脏;凋亡;刺激指数;膜电位;Bcl-2相关X蛋白;B细胞淋巴瘤基因-2;鼠;动物实验【作者】王雪芹;郝选明【作者单位】临沂大学体育学院,山东临沂276005;华南师范大学体育科学学院,广东广州510006【正文语种】中文【中图分类】G804.5运动免疫学研究业已证实,长期从事长时间大强度运动对免疫机能有非常强烈的负性影响[2],表现为淋巴细胞数量减少,亚群改变;细胞毒性降低,细胞免疫功能受损;主要免疫球蛋白及补体含量降低;中性粒细胞吞噬作用降低;大负荷运动降低巨噬细胞的抗原提呈及MHC的表达等,说明长期大强度运动训练对细胞和体液免疫都有明显的负性作用。
66.小鼠福利受损模型的建立及营养干预作用的研究_杨斐

小鼠福利受损模型的建立及营养干预作用的研究杨 斐,胡 樱, 许兰文(复旦大学实验动物科学部,上海200032)[摘要] 目的 探索建立实验小鼠的福利受损模型,并研究营养干预对模型小鼠福利的改善作用。
方法 以反复制动模拟常规实验处置对小鼠的福利损害,测定与福利相关的神经内分泌、免疫、生化、生长指标和饲料效价,评价其在实验中消耗的生物学代价;采用营养咬棒对模型小鼠同步干预,测定相关指标。
结果 制动小鼠体增重和饲料效价(FER)显著降低(P<0.01),血清促肾上腺皮质激素(ACTH)、皮质酮(CORT)、肾上腺素(EPI)、去甲肾上腺素(NE)水平显著升高(P<0.01),血清β-内啡肽(β-EP)、白介素-2(IL-2)水平、脾脏指数、外周血白细胞总数(WBC)、脾脏T 、B淋巴细胞增殖能力(SIT, SIB)显著降低(P <0.05, P <0.01)。
与模型对照组比较,营养咬棒组CORT、ACTH 、EPI 和NE显著降低(P<0.05),脾脏指数、脾脏T 、B 淋巴细胞增殖能力、IL-2 和WBC显著升高(P<0.05,P <0.01)。
结论 制动小鼠再现了福利损害时动物的神经内分泌紊乱、免疫抑制和生长抑制状况,可作为福利受损的动物模型,营养干预有助于改善制动小鼠的神经内分泌紊乱和免疫抑制。
[关键词] 动物福利;模型;生物学代价;营养干预;小鼠[中图分类号] Q95-33 [文献标识码] A [文章编号] 1004-8448(2008)02-0074-06[收稿日期] 2007-07-16[基金项目] 上海市科技发展基金项目 (064909011)[作者简介] 杨 斐(1968-), 男, 副研究员, 硕士生导师, 从事实 验动物学及比较医学的教学、科研和管理工作。
E-mail: yfdwbfd@[通讯作者] 许兰文(1945-), 女, 教授, 硕士研究生导师。
E-mail: LWXU@Shmu.edu.cn在实验动物福利技术研究领域,近年来越来越多的证据表明常规的实验处置手段能够引起动物的应激反应,如不予及时控制和干预,往往导致额外的福利损害[1],不仅降低了实验动物的福利水平,也在一定程度上干扰了科学研究。
药物淋巴细胞刺激试验(3H-TdR掺入法)建立及其在药物性肝病诊断中的应用

药物淋巴细胞刺激试验(3H-TdR掺入法)建立及其在药物性肝病诊断中的应用内科感染病学研究生陈高艳导师陈成伟程明亮教授【摘要】目的:建立药物淋巴细胞刺激试验(drug lymphocyte stimulation test,DLST),作为免疫特异质性药物性肝损伤(Drug-induced liver injury, DILI)的辅助诊断手段,提高DILI的诊断水平。
方法:对29例拟诊为DILI 的患者,通过分离其外周单个核细胞(Peripheral blood mononuclear cell ,PBMC),暴露于可疑药物,用3H-TdR掺入法检测,依据3H-TdR掺入值确定淋巴细胞被药物特异激活而增殖的程度。
实验同时设立药物试验组、阴性和阳性对照组。
预试验包括PHA最适剂量和药物最适浓度等。
试验同时设立25例健康组群,每次暴露于相同药物,同步检测。
结果:DILI组PBMC经敏感药物刺激后的增殖程度与经PHA刺激后增殖程度相当,DILI患者暴露目标药物后阳性者刺激指数(stmulation index,SI)大于1.8,本试验29例拟诊为DILI患者中19例为阳性(65.5%),SI在1.9-9.8之间,均值为4.3,健康组SI≤1.8,可见DILI 组SI显著高于健康组(分别为3.22±2.57/1.18±0.22,P<0.001)。
本试验具有较高的特异性(96%)及灵敏性(65.5%)。
结论:DLST对免疫特异质型DILI 患者的诊断具有较显著意义,反映了这部分患者的PBMC再次暴露于致敏药物后的增殖情况。
关键词:药物性肝病(DILI) 药物淋巴细胞刺激实验(DLST)3H-TdR诊断前言肝脏是药物转化和代谢的主要器官,也是药物损伤的主要靶器官。
药物性肝损(Drug-induced liver injury, DILI)发病率逐年上升,已开始引起人们和临床医师高度的重视[1,2]。
系统性红斑狼疮患者血清中b淋巴细胞刺激因子的检测

;淋巴细胞刺激因子!;2<.=’15<0,>0(.-2/017" ;?<@#是ABBB年发现的肿瘤坏死因子!C9D$家族的一个新成员%近年来研究显示;?<@能刺激;淋巴细胞增生&分化并调节抗体生成"在;淋巴细胞免疫中发挥重要作用’A(%系统性红斑狼疮)><>0,.(52-=-> ,7<0’,./01>->"@?E$是一种严重的自身免疫性疾病"其免疫特征是;细胞多克隆活化"产生大量的自身抗体%为探讨;?<@在@?E发病机制中的作用"我们对FG例@?E患者及FF名正常人对照组血清;?<@水平进行了检测"现将研究结果分析报告如下%!资料与方法A:A研究对象@?E患者均为!H"#年!月至!""#年I月我院门诊和住院患者"诊断符合美国风湿病协会!J+J$AB%!年修订的@?E诊断标准%共收集到临床资料较完整的@?E血清标本FG份"其中女性FK例"男性!例"年龄A"!KF岁"平均F"岁*病程!"L!AK年"平均FA:#个月%正常人对照组FF名"为健康体检者"无自身免疫病家族史"其中女性FA名"男性!名"年龄A%!#F岁"平均F"岁%两组在性别和年龄构成上差异无显著性%根据@?E疾病活动指数)@?E4JM$对@?E患者的疾病活动系统性红斑狼疮患者血清中;淋巴细胞刺激因子的检测郑舜华刘贞富陈志平梁智辉+摘要,目的检测系统性红斑狼疮!@?E$患者血清;淋巴细胞刺激因子!;?<@$水平"并探讨其在@?E发病中的意义%方法采用双抗体夹心酶联免疫吸附试验!E?M@J$法检测血清;?<@水平%结果! @?E患者血清;?<@’!B:I"!:F$)NO.2(显著高于正常人对照组’!#:""A:K$)NO.2(%"@?E患者中"血清;?<@水平活动组’P$$:$"!:!$)NO.2(高于非活动组’!%:$"$:!$)NO.2("抗L>49J抗体阳性组’!$H:B"!:!$ )NO.2(高于抗L>49J抗体阴性组’P%:$"$:#$)NO.2("高MNQ组’!$H:%"!:#$)NO.2(高于非高MNQ组’!%:F"$:F$ )NO.2("低&F组’!$H:!"!:K$)NO.2(高于非低&F组’!%:F"$:F$)NO.2("低&#组’!$H:$"!:F$)NO.2(高于非低&#组’!G:I"H:G$)NO.2("低血小板计数组’P$H:G"!:G$)NO.2(高于非低血小板计数组’!%:%"$:G$)NO.2(%# @?E患者血清;?<@水平与@?E疾病活动指数!@?E4JM$!!RH:KI""R$K:%B"#SH:H$$&MNQ!!RH:FF""R#:!H"#S H:HK$呈正相关*与&#!!RTH:#G""RAH:H#"#SH:HA$&血小板计数!!RTH:KF""RAF:%K"#SH:HA$呈负相关%结论;?<@可能参与@?E的发病%+关键词,红斑狼疮"系统性*;淋巴细胞*肿瘤坏死因子"#$#%$&’(’)*+,-./’%,$#0$&-1+2$’3&($/#0#32’).2$&#($04&$/0,0$#-&%+1.10#3,$/#-2$’010$%&’()*+,-*+./01234*5,-6+07%&’$*8-98,:012;’<4*8-*+8=>?59.!"@5,"A6?5!@."ABA:C0 D85*5%AE98".B0FA,:G8H5I8J.B7ABB5:50%+.K*A,:L,8M5!E8"C A6)J85,J5.,I F5J*,ABA:C0N+*.,#FHH!!3&’()/ &177,>=>)L()N/-00’17U4%O’<)*+,-*+.+560$32%$,768#%$&9#C1L,0,7.(),0’,>,7-.2,V,2>1W;2<.=’15<0,>0(.-2/017!;?<@$()=/0(,)0> X(0’><>0,.(52-=->,7<0’,./01>->!@?E$/)L()V,>0(N/0,0’,712,1W;?<@()0’,=/0’1N,),>(>1W@?E: :#$/’;0C’,>,7-.51)5,)07/0(1)1W;?<@X/>.,/>-7,L6<>/)LX(5’E?M@J()FG=/0(,)0>X(0’@?E/)L FF/N,T/)L>,YT./05’,L)17./251)0712>:<#01+$0!@,7-.2,V,2>1W;?<@()0’,@?E=/0(,)0>X,7,W1-)L 016,>(N)(W(5/)02<’(N’,70’/))17./251)0712>:"M)@?E=/0(,)0>"0’,;?<@2,V,2>X,7,./7Z,L2<()57,/>,L() =/0(,)0>X(0’/50(V,L(>,/>,/)L=1>(0(V,/)0(TL>49J/)0(61L<51.=/7,L X(0’0’1>,X(0’()/50(V,L(>,/>,/)L ),N/0(V,/)0(TL>49J/)0(61L<:;?<@2,V,2>X,7,/2>1()57,/>,L()@?E=/0(,)0>X(0’0’,W1221X()N/6)17T ./2(0(,>U()57,/>,L MNQ3L,57,/>,L&F3,V,2>/)L0’71.615<01=,)(/:#C’,7,X/>/>071)N=1>(0(V,5177,2/# 0(1)6,0X,,);?<@/)L@?E4JM>517,>:[(N’,72,V,2>1W;?<@X,7,/>>15(/0,L X(0’’(N’,72,V,2>1W MNQ:@,7-. 2,V,2>1W;?<@’/L),N/0(V,5177,2/0(1)X(0’,V,2/)L6211L=2/0,2,051-)0>:=’(%+10&’(0;?<@./<=2/< 5,70/()712,()0’,=/0’1N,),>(>1W@?E:;?<@./<=71V(L,/),WW,50(V,0’,7/=,-0(50/7N,0()’-./)@?E: +>#,4’3;0,?-=->,7<0’,./01>->3><>0,.(5\;T2<.=’15<0,>\C-.17),571>(>W/5017作者单位-#FHH!!武汉"华中科技大学同济医学院附属协和医院皮肤科华中科技大学同济医学院免疫学研究所通信作者-郑舜华万方数据程度进行评分!;<分判断为疾病活动期"!#!其中活动期$%例!非活动期$<例!活动期患者均未用过糖皮质激素治疗!非活动期患者经糖皮质激素治疗!剂量相当于泼尼松$=!!=.>?@$以尿蛋白!=:A>?!#’或%BBB&以上作为肾损害判断标准$$:!主要仪器与试剂酶标仪’C,5/)DE,507/F!($鼠抗人GHID单克隆抗体)生物素化羊抗人GHID多克隆抗体及重组人GHID均为英国J,E71C,5’K&H0@产品!过氧化物酶标记的链霉卵白素’D07,E0/L(@()FM+J(为G,)@,7公司产品!J-7(N(,@O1-P,Q>R$!S QP10IE,&1)0712为美国G(12,>,)@公司产品!均购自晶美生物工程有限公司$所有试剂均按说明书配制成工作液$$:T实验方法$:T:$标本采集*抽取DHK患者及正常人对照组静脉血约!.2!离心分离血清!置FU="冰箱冻存备测$ $:T:!血清GHID检测*采用双抗体夹心KHQDV法!参照文献"T#$主要操作步骤如下*鼠抗人GHID单克隆抗体稀释为!">?.2!加于<W孔酶标板中!$=="2?孔! #"过夜$加封闭液$X牛血清白蛋白’GDV(?磷酸盐缓冲液’JGD(!!=="2?孔!TU"!’$分别加入待测血清’按$#$=稀释(和各种稀释度的标准重组人G2ID! $=="2?孔!#"过夜$加入=:!">?.2生物素化的羊抗人GHID多克隆抗体!$=="2?孔!TU"!’$加入$$$==稀释的D07,E0/L(@()FM+J!$=="2?孔!TU"$’$加入底物T!T%!A3A%F甲基联苯胺’COG(!$=="2?孔!避光室温反应!=.()!加入!.12?H硫酸!A="2?孔!终止反应$为避免类风湿因子’+Y(的影响!用J-7(N(,@ O1-P,Q>R$3S QP10IE,&1)0712作为每个待测标本的本底控制$用酶标仪’波长#<!).(比色读数!绘制标准曲线!根据标准曲线求出待测标本GHID的含量$所有标本均为双孔检测$$:T:T其他项目检测*抗核抗体’V9V()抗@P49V抗体)抗D.抗体)抗+9J抗体)抗DDV抗体)抗DDG抗体)血常规)尿常规)Q>R)Q>O)Q>V)&T)&#)肝功能)肾功能等实验室指标按本院常规方法测定!结果均由本院实验室检查提供$$:#统计学方法所有数据均用DJDD$=:=统计软件处理$数据用!!"表示!组间比较采用#检验和方差分析!相关分析采用直线相关分析方法!显著性水平#Z=:=A$!结果!:[DHK患者与正常人对照组血清GHID水平*DHK 患者组血清GHID水平显著高于正常人对照组+经方差分析!DHK活动期患者组GHID水平显著高于非活动期组及对照组!而非活动期组与对照组差异无显著性!见表[$!:!DHK患者血清GHID水平与DHK4VQ的相关性分析*DHK患者血清GHID水平与DHK4VQ呈正相关’$Z=:A%!%Z[U:<[!&\=:=[($!:T DHK患者不同实验室指标对血清GHID水平影响*抗@P49V抗体阳性)高Q>R)低&T)低&#组和低血小板计数DHK患者GHID水平均高于上述实验室指标正常者+而肾损与非肾损)低白细胞计数与非低白细胞计数DHK患者之间血清GHID水平差异无显著性!见表!$!:#DHK患者血清GHID水平与某些实验室指标的相关性分析*DHK患者血清GHID水平与Q>R’$Z=:TT! %Z#:!=!&\=:=A(呈正相关+与&#’$ZF=:#U!%Z[=:=#! &\=:=[()血小板计数’$ZF=:AT!%Z[T:%A!&\=:=[(呈负相关$血清GHID水平与&T’&;=:=A(和白细胞计数’&;=:=A(无明显相关关系$"讨论表[DHK患者与对照组血清GHID水平的比较’!!"()>?.2组别例数正常人对照组TT#:=&[:A W:#W]DHK组TU<:W&!:T活动期[%[[:[&!:!A:T[’非活动期[<%:[&[:!注*]与DHK组比较&\=:=A+’与非活动期DHK比较&(=:=AG2ID%值表!DHK患者不同实验室指标与其血清GHID水平的比较’!!"()>?.2抗@P49V抗体阳性组[<[=:<&!:!#:!!]抗@P49V抗体阴性组[%%:[&[:#高Q>R组[<[=:%&!:#A:#W]非高Q>R组[%%:T&[:T低&T组!A[=:!&!:AA:=%]非低&T组[!%:T&[:T低&#组!<[=:[&!:TW:=!]非低&#组%U:W&=:U低血小板计数组[A[=:U&!:UW:[<]非低血小板计数组!!%:%&[:U肾损组[=[[:!&!:W[:[U 非肾损组!U<:=&[:<低白细胞计数组[U[=:!&!:#[:=T 非低白细胞计数组!=<:=&!:[注*两组比较]&\=:=A组别例数G2ID%值万方数据;<=>是近年发现的?9@家族的一个新型细胞因子!为!型跨膜蛋白!;<=>主要表达于髓样单核细胞系"单核细胞#巨噬细胞#树突状细胞$!;<=>能促进;淋巴细胞增生#分化和抗体生成%A&’过度表达;<=>可能导致大量自身反应性;淋巴细胞产生和自身抗体生成!推测;<=>可能与自身免疫性疾病的发生#发展有关(;<=>过表达与自身免疫性疾病><B之间存在关联已经通过C组小鼠体内实验证实)";<=>转基因小鼠外周血;淋巴细胞显著增加!转基因小鼠血清中球蛋白和循环免疫复合物显著增加!出现抗DE49F抗体!肾内免疫复合物沉积和蛋白尿(类似的变化也出现于注射了重组人;<=>的正常小鼠%#!G&(#狼疮模型小鼠9H;IJK@$和L+<M2N7I2N7血清中;<=>水平增高与小鼠肾损伤程度平行%O&($用;<=>拮抗剂治疗狼疮模型小鼠!可以延缓疾病进程!延长小鼠的存活时间%O&(这些研究表明;<=>表达增加可以引起模型小鼠自身免疫性疾病!提示;<=>在人><B发病中也可能发挥作用(H’/)P等%C&研究了;<=>与人><B发病的关系!采用双抗体夹心B<Q>F法检测#R例美国><B患者和C%名正常人血清;<=>水平!发现><B患者血清;<=>的水平显著高于正常人!但未发现><B患者血清;<=>水平与疾病活动性有相关性(最近!国内学者周琳等%S&和叶玉津等%%&从;2=>基因表达水平探讨;2=>与人><B发病的关系!研究发现><B患者外周血单个核细胞;2=>.+9F表达显著增高(本研究的实验结果显示><B患者血清;<=>水平显著高于正常人对照组!此结果与国外的报道一致%C&(但我们还发现><B活动期患者血清;<=>水平显著高于非活动期患者!且><B患者血清;<=>水平与><B4FQ呈强正相关(本实验结果还显示高QPT的><B 患者血清;<=>水平高于非高QPT患者!且;<=>水平与QPT呈正相关*抗DE49F阳性患者高于抗DE49F抗体阴性患者!;<=>水平的升高似乎与抗DE49F抗体的生成相关!推测;<=>可能参与><B患者自身抗体生成的发病过程(有学者提出;<=>并不能引起机体对自身抗原耐受性消退!但是在某些因素的诱导下><B患者自身耐受一旦遭到破坏!早已存在的天然自身抗原能持续刺激宿主免疫系统(随着;<=>水平增高!自身免疫反应加剧(对于><B患者!这种加剧的自身免疫反应能诱发和维持明显的临床症状(因此!;<=>过表达诱导的;淋巴细胞存活+分化和耐受性异常能够加剧><B自身免疫反应!可能是导致><B 发生#发展的主要原因(目前诱发;淋巴细胞免疫耐受消退和自身抗体生成的因子还不清楚!对于><B 患者;<=>水平增高的诱发因素还知之甚少!有待进一步研究(此外!低补体&C#低补体&#的><B患者;<=>水平均高于&C#&#正常的><B患者!其原因可能是;<=>水平的升高所导致的自身抗体生成的增加从而更多地消耗了大量补体(肾脏是><B最为常见的受累器官之一(本实验未发现肾损害><B患者血清;<=>水平高于非肾损害者!与>01’2等%U&的研究结果一致!推测体内大量;<=>蛋白因肾脏受累而随尿液流失所致(总之!本结果表明在人><B患者中;2=>水平增高!与其疾病活动性相关!而且在抗DE49F阳性患者增高显著!进一步说明;2=>参与><B的发病过程(参考文献A L117,VFW;,2X,D,7,Y3Y77F3,0/2:;<=>Z.,.6,71[0’,0-.17),571E(E[/5017[/.(2=/)D;2=.N’15=0,E0(.-2/017:>5(,)5,3 AUUU3!%GZ!ORM!OC:!;1.6/7D(,7&3T2/D./)443\71](0^L;W,0/2:4,7(X/0(1)1[0’, ><B4FQZ/D(E,/E,/50(X(0=()D,_[172-N-E N/0(,)0E:F70’7(0(E +’,-.W$UU!W CGZ OCRMO#R:C H’/)P*W+1E5’‘,8W;/‘,7aVW,0/2:&-00()P,DP,Z/712,[17;2=.N’15=0,E0(.-2/017()E=E0,.(52-N-E,7=0’,./01E-E:* Q..-)12W!RR$W$OOZ OM$R:#L/5‘/=@W J11D515‘>FW</]01)VW,0/2:L(5,07/)EP,)(5[17 ;F@@D,X,21N2=.N’15=0(5D(E17D,7E/21)P](0’/-01(..-), ./)([,E0/0(1)E:*B_N L,DW$UUUW$URZ$OUSM$S$R:G a’/7,>4W>/71E(QW b(/bHW,0/2:>,X,7,;5,22’=N,7N2/E(//)D/-01(..-),D(E,/E,()?F<<M$07/)EP,)(5.(5,:V7159/02F5/D >5(\>FW!RRRW USZ CCSRMCCSG:O T71EE*FW*1’)E01)*W L-D7(>W,0/2:?F&Q/)D;&LF/7, 7,5,N017E[17/?9@’1.121P-,(.N2(5/0,D();M5,22/-01(..-), D(E,/E,:9/0-7,W!RRRW#R#Z UUGMUUU:S周琳W许臻W范列英W等:自身免疫病患者外周血中;细胞激活因子基因表达水平的测定:中华风湿病学杂志W!RRCW$!Z S$CM S$S:%叶玉津W尹培达W余学清:系统性红斑狼疮患者外周血单个核细胞;细胞刺激因子的异常表达及其临床意义:中华风湿病学杂志W!RR#W%Z CU$MCU#:U>01’2JW L,0=/E>W?/)>LW,0/2:;2=.N’15=0,E0(.-2/017 1X,7,_N7,EE(1)()N/0(,)0E](0’E=E0,.(52-N-E,7=0’,./01E-EZ21)P(0-D()/216E,7X/0(1)E:F70’7(0(E+’,-.W!RRCW#%Z C#SGMC#%O:"收稿日期)!RR#MRSM$O$"本文编辑)张跃$万方数据系统性红斑狼疮患者血清中B淋巴细胞刺激因子的检测作者:郑舜华, 刘贞富, 陈志平, 梁智辉作者单位:430022,武汉,华中科技大学同济医学院附属协和医院皮肤科;华中科技大学同济医学院免疫学研究所刊名:中华风湿病学杂志英文刊名:CHINESE JOURNAL OF RHEUMATOLOGY年,卷(期):2004,8(12)被引用次数:4次1.Moore PA;Belvedere O;Orr A BLyS:member of the tumor necrosis factor family and B lymphocyte stimulator[外文期刊] 19992.Bombardier C;Gladman DD;Urowitz MB Derivation of the SLEDAI:a disease activity index for lupus patients 19923.Zhang J;Roschke V;Baker KP Cutting edge:a role for B lymphocyte stimulator in systemic lupus erythematosus[外文期刊] 2001(1)4.Mackay F;Woodcock SA;Lawton P Mice transgenic for BAFF develop lymphocytic disorders along with autoimmune manifestations[外文期刊] 1999(11)5.Khare SD;Sarosi I;Xia XZ Severe B cell hyperplasia and autoimmune disease in TALL-1 transgenic mice[外文期刊] 2000(7)6.Gross JA;Johnston J;Mudri S TACI and BCMA are receptors for a TNF homologue implicated in B-cell autoimmune disease [外文期刊] 20007.周琳;许臻;范列英自身免疫病患者外周血中B细胞激活因子基因表达水平的测定[期刊论文]-中华风湿病学杂志 2003(12)8.叶玉津;尹培达;余学清系统性红斑狼疮患者外周血单个核细胞B细胞刺激因子的异常表达及其临床意义[期刊论文]-中华风湿病学杂志 2004(7)9.Stohl W;Metyas S;Tan SM B lymphocyte stimulator overexpression in patients with systemic lupuserythematosus:longitudinal observations[外文期刊] 20031.付继承B淋巴细胞刺激因子与系统性红斑狼疮疾病活动相关性的研究[学位论文]20062.黄承芳.吴雄文.梁智辉血清可溶性白细胞抗原G的水平与早期妊娠情况的关联[期刊论文]-现代免疫学2005,25(6)3.王宝B淋巴细胞刺激因子相关生物制剂治疗系统性红斑狼疮研究进展[期刊论文]-临床合理用药杂志2011,04(27)4.边琪.胡伟新B淋巴细胞刺激因子与系统性红斑狼疮[期刊论文]-肾脏病与透析肾移植杂志2007,16(4)5.周琳.屠小卿.朱烨.陆慧琦.许臻.范列英.侯晓菁.孔宪涛.仲人前.ZHOU Lin.TU Xiao-qing.ZHU Ye.LU Hui-qi.XU Zhen.FAN Lie-ying .HOU Xiao-jing.KONG Xian-tao.ZHONG Ren-qian系统性红斑狼疮患者血清B细胞激活因子水平的检测[期刊论文]-中华风湿病学杂志2005,9(4)6.张丽君.李博.钟力.汪迅.李剑松.庄俊汉.叶志中系统性红斑狼疮患者外周血B淋巴细胞亚群与体液免疫功能的研究[期刊论文]-中华风湿病学杂志2005,9(1)7.翁秀芳.陈浩.吴雄文.梁智辉.韩军艳.黄亚非.龚非力可溶性HLA-A2-肽复合物的体外折叠与生物素化[期刊论文]-细胞与分子免疫学杂志2004,20(3)8.夏芳珍.吴雄文.钟茂华.褚利霞.翁秀芳.张彩娥.卢小玲.梁智辉可溶性HLA-G1-肽复合物的体外折叠和鉴定[期刊论文]-华中医学杂志2006,30(1)9.李晓冰.王振华.蔺玉霞.孙善会.肖东杰.汪运山淋巴细胞亚群变化在SLE发病中的临床意义[期刊论文]-中国麻风皮肤病杂志2005,21(1)10.徐亮.李志.张军.陆进明.XU Liang.LI Zhi.ZHANG Jun.LU Jin-rning血清B淋巴细胞刺激因子在系统性红斑狼疮中的意义[期刊论文]-中华风湿病学杂志2007,11(7)1.刘谓重组B淋巴细胞刺激因子对BALB/c狼疮鼠的病变的影响[学位论文]硕士 20052.王春淮.徐建华.翟志敏CD19和CD27标记系统性红斑狼疮患者外周血B细胞的亚群分析[期刊论文]-安徽医科大学学报 2006(2)3.杨曙梅.鞠少卿.倪红兵.王惠民系统性红斑狼疮患者B淋巴细胞刺激因子及其受体表达水平的研究[期刊论文]-中国误诊学杂志2006(21)4.刘才旺.倪红兵.鞠少卿血清B淋巴细胞刺激因子与SLE关联性的初步研究[期刊论文]-现代检验医学杂志 2007(3)引用本文格式:郑舜华.刘贞富.陈志平.梁智辉系统性红斑狼疮患者血清中B淋巴细胞刺激因子的检测[期刊论文]-中华风湿病学杂志2004(12)。
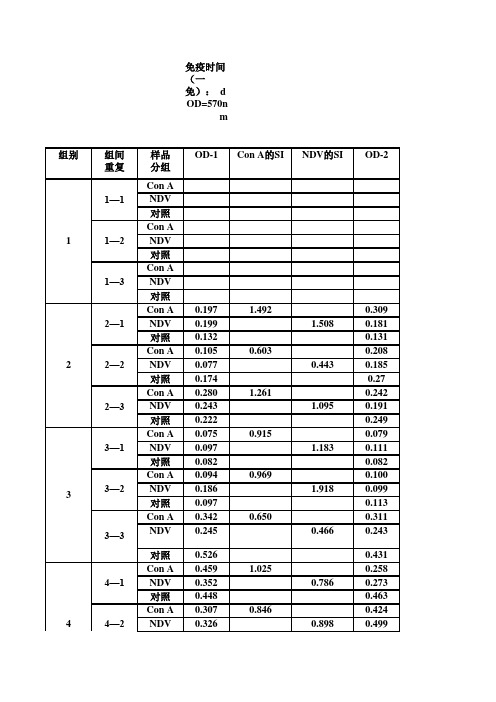
淋巴细胞增殖刺激指数用表
4
4—2
对照 0.363
Con A 0.267
2.405
4—3 NDV 0.256
对照 0.111
Con A 0.246
1.464
5—1
NDV
0.26
对照 0.168
Con A 0.223
0.826
5
5—2 NDV 0.183
对照 0.270
0.569 0.725 1.143 0.660
0.931
0.827 1.786 2.046 0.790 0.944 1.606 0.659 0.696 0.981
9
9—2 NDV 0.230
对照 0.113
Con A 0.272
9—3 NDV 0.836
对照 0.204
Con A 0.301
10—1 NDV 0.294
对照 0.248
Con A 0.096
10
10—2 NDV 0.126
对照 0.122
Con A 0.401
10—3
NDV 对照
0.306 0.230
0.685 2.035 4.098 1.185 1.033 1.330 0.839 0.414 0.817
0.257 0.292
0.389 0.234 0.203 0.090 0.404 0.210 0.217 0.216 0.237 0.401 0.085 0.110 0.127 0.253 0.297 0.100 0.119 0.186
Con A 0.289
1.074
5—3
NDV 对照
0.128 0.269
淋巴细胞表面标志的检测及亚群分类

粒细胞、肥大细胞、血小板等,
单纯参与免疫效应。
淋巴细胞
lymphocyte
构成机体免疫器官的基本单位,是
体内极为复杂的不均一细胞群体,包括
许多形态上相似而功能不同的亚群,功
能和表面标志各不相同,具有明显的异
质性。T细胞和B细胞是其中最主要的两
大群体。
表面标志(epitope): 淋巴细胞表面具有可供鉴别的特殊结构 在淋巴细胞的不同分化阶段,其各种 表面标志的表达也各不相同。淋巴细胞与 其它细胞之间、与周围环境中的分子间的 相互作用以及淋巴细胞识别抗原、活化、 辅助、抑制、杀伤等生物学作用均与其表 面标志有关。
T细胞主要的CD抗原
(1)CD2: 表达于全部T细胞和NK细胞表面;由3 种抗原性不同的分子组成(CD2-1,2,3) CD2-1,2表达于静止细胞表面,CD2-3表 达于活化的T细胞表面。CD2可与绵羊红细 胞(SRBC)结合,故又称绵羊红细胞受体 (E受体),它是粘附分子之一,在抗原提 呈过程中起辅助作用。
丢失。
有些还与细胞功能相关,如: CD21和CD35
是补体受体,CD23和CD32是Ig的Fc受体。
5. Fc受体
IgG的Fc受体(CD32),与B细胞 活性相关。Fc受体可与抗体包被的红细
胞相结合形成EAC花环,是鉴别B细胞
的传统方法之一。
其他表面标志:
丝裂原受体
EB病毒受体
细胞因子受体
小鼠红细胞受体
(2)CD3: 6肽复合分子,表达于全部T细胞表面, 是T细胞共有的表面标志。 CD3 与TCR非 共价结合形成完整的TCR-CD3复合体, CD3可将TCR与抗原结合所产生的活化信 号传递入T细胞内,使之活化、增殖。
(3)CD4/CD8: T细胞亚群的表面标志。 CD4+T细胞 辅助性T细胞(T helper , TH ),主要识别MHCⅡ类分子结合的外 源性多肽抗原,具有辅佐或诱导免疫应答 的功能,部分细胞也有杀伤和抑制功能; CD8+T细胞 细胞毒性T细胞(cytotoxic T cell, Tc),主要识别MHCⅠ类分子结合 的内源性多肽抗原,具有杀伤靶细胞和抑 制免疫功能。
TB淋巴细胞增殖能力测定NK细胞活性测定及T淋巴细胞亚群测定的方法

T、B淋巴细胞增殖能力测定、NK细胞活性测定及T淋巴细胞亚群测定的方法一、T、B淋巴细胞增殖能力测定无菌条件下取大鼠的脾脏,加适量Hank’s液研磨,以200目不锈钢网滤过,1500r/m离心5分钟,弃上清,加Hank’s液重复洗涤2次。
收集脾细胞,加适量RPMI 1640培养液混悬,以0.4%台盼兰拒染法计数,活细胞数不小于95%,加RPMI 1640完全培养液稀释,并调整细胞浓度至1×107个/mL。
于96孔微量板中,每孔加100 L脾细胞悬液(1×107 cell/mL)和等体积的ConA溶液(终浓度为5μg/mL)、LPS溶液(终浓度为10μg/mL)或RPMI1640培养液,重复3孔。
另设空白对照组。
37℃、5%CO2培养44h后,各孔加入50μL MTT溶液(2mg/mL),继续培养4h。
1000r/min离心5分钟,弃去各孔上清,分别加150μL酸性DMSO溶液,振荡,于室温暗处放置15min,以酶标仪于波长578nm处测定OD值,并按下式计算刺激指数(SI):SI(刺激指数)=加有丝分裂原培养物的OD值/不加有丝分裂原培养物的OD值。
二、NK细胞活性测定实验前24h将靶细胞YAC-1传代培养,应用前以Hank’s 液洗3次,用RPMI1640 完全培养液调整细胞浓度为2×105个/mL。
无菌取脾,制备脾细胞悬液,用Hank’s液洗2次,每次离心10 min(1000 r/min)。
弃上清将细胞浆弹起,加入0.5mL灭菌水裂解红细胞,20 s后再加入0.5 mL 2倍Hanks液及8 mL Hanks液,离心10 min(1000r/min),用1mL 含10 %小牛血清的RPMI1640 完全培养液重悬,用1 %冰醋酸稀释后计数,调整细胞浓度为1×107个/ mL 。
将靶细胞加入96孔培养板,每孔100μL,试验孔加入100μL 脾细胞(效靶比50:1),自然释放孔加入100μL培养液,最大释放孔加入100μL 2%NP40,37℃培养 4 h,离心,取上清100μL置96孔酶标板中,加入LDH 基质液100μL,反应8 min,以30μL 1mol/L的HCl终止反应,在酶标仪492nm 处测定OD值。
淋巴细胞的制备与检测

MTT法测脾淋巴细胞增殖实验主要原理:活细胞线粒体中的琥珀酸脱氢酶能使外源性的MTT还原为难溶性的蓝紫结晶物Formazan,并沉积在细胞中,而死细胞无此功能。
1.小鼠淋巴细胞制备材料:1.5mg/mL MTT(四甲基偶氮盐,Sino-American Biotechnology Co)溶液:称取50mgMTT(Sigma)粉末溶解于10mL0.01mol/LpH7.4 PBS中,配成浓度为5mg/mL的溶液,0.22 µm过滤除菌后置4℃避光保存(MTT有毒,配制时戴手套避光)。
2.RPMI1640培养液:RPMI1640干粉一袋,NaHCO3 1.5 g,HEPES 2.7 g溶于800 mL dddH2O,磁力搅拌器搅拌30 min,定容至1000 mL,无菌超净台内0.22 μm滤膜过滤除菌,分装,室温保存。
临用前加10%的小牛血清(杭州四季青生物制品厂),青霉素、链霉素各100 IU/mL。
3.0.14MNH4Cl:称取NH4Cl7.21g,ddH2O 1000.0mL,充分溶解后0.22µm 滤膜过滤除菌,4℃保存。
4.0.017MTris-HCl:称取Tris-HCl2.68g,ddH2O 1000.0mL,充分溶解后0.22µm 滤膜过滤除菌,4℃保存。
5.刀豆素球蛋白(ConA):将ConA溶解于RPMI1640培养液,配制成50µg/mL,0.22 μm微孔滤膜过滤除菌,分装成小管,置于-20℃备用。
6.十二烷基硫酸钠(SDS):SDS溶于0.01mol/L盐酸溶液,终浓度为100g/L。
7.匀浆器,无菌平皿,注射器,无菌眼科剪刀,镊子,无菌针头,1.5mL离心管,15mL离心管,10ml注射器,96孔细胞培养板,细胞培养箱,酶标仪。
方法:1.免疫6周的小鼠,摘眼球采血后,用颈椎脱位法处死,(血液用于分离血清)。
2.置75%的酒精中浸泡3-5min,全身消毒灭菌。
淋巴细胞功能检测T淋巴细胞转化试验3HTdR

=实验组cpm均值/对照cpm均值
参考值:SI < 2
二、T淋巴细胞转化试验:
—— 形态学观察法
步骤:肝素抗凝血+PHA孵育涂片Giemsa 染色 计数淋巴细胞,计算淋巴母细胞转化 率。
转化率 =
转化的淋巴细胞(X个)
%
计数的淋巴细胞总数(200 个)
正常参考值:60.1±7.6% 临床意义:转化率↓— 免疫缺陷性疾病
第六部分 淋巴细胞功能检测
一、T淋巴细胞转化试验: —— 3H-TdR掺入法
原理:T细胞+PHA(ConA) 淋巴母细胞,摄取大 量3H-TdR来合成新的DNA。
步骤:T 细胞 +PHA(ConA) 淋巴母细胞 + 3H标记 胸腺嘧啶核苷(3H-TdR) β-液体闪烁仪测 定cpm值
刺激指数(SLeabharlann )
nlm 指数

nlm 指数NLN指数(Normalized Lymphocyte Monocyte Ratio)是一种反映免疫系统功能的指标,它是通过将淋巴细胞计数除以单核细胞计数得出的。
在医学领域中,NLN指数被广泛应用于评估炎症反应、预测疾病预后以及指导治疗方案的制定。
本文将从五个大点出发,详细阐述NLN指数的相关内容。
引言:NLN指数作为一种简单、经济、有效的指标,被越来越多的研究者关注和应用。
它能够反映机体的免疫状态和炎症程度,对于疾病的诊断、预后以及治疗具有重要的临床意义。
接下来,我们将从以下五个大点来详细阐述NLN指数的相关内容。
一、NLN指数的计算方法1.1 淋巴细胞计数的测定方法1.2 单核细胞计数的测定方法1.3 NLN指数的计算公式二、NLN指数与炎症反应的关系2.1 NLN指数与急性炎症反应的关系2.2 NLN指数与慢性炎症反应的关系2.3 NLN指数在炎症性疾病中的应用三、NLN指数与疾病预后的关系3.1 NLN指数与肿瘤预后的关系3.2 NLN指数与心血管疾病预后的关系3.3 NLN指数与感染性疾病预后的关系四、NLN指数在临床中的应用4.1 NLN指数在肿瘤筛查和诊断中的应用4.2 NLN指数在心血管疾病中的应用4.3 NLN指数在感染性疾病中的应用五、NLN指数的局限性和未来发展5.1 NLN指数的局限性5.2 NLN指数的未来发展方向总结:NLN指数作为一种反映免疫系统功能的指标,具有重要的临床意义。
它能够反映机体的炎症程度和免疫状态,对于疾病的诊断、预后以及治疗具有指导意义。
然而,NLN指数仍然存在一些局限性,需要进一步的研究和发展。
相信随着科学技术的不断进步,NLN指数在临床中的应用将会越来越广泛,为人们的健康提供更好的保障。
淋巴细胞标准值

淋巴细胞标准值
淋巴细胞是人体免疫系统中的重要成分,负责防御病原体和其他有害物质。
淋巴细胞标准值是医学检查中用来评估患者免疫系统状态的一个指标。
正常情况下,成年人淋巴细胞百分比应在20-40%之间,淋巴细胞计数应在1.5-4.5 x 10^9/L之间。
如果淋巴细胞计数低于正常值,可能表明患者免疫系统功能受到抑制,需要进一步诊断和治疗。
另一方面,如果淋巴细胞计数超过正常范围,也可能表明存在某些疾病或感染,需要进一步检查和治疗。
因此,淋巴细胞标准值是评估人体免疫系统健康状况的重要指标之一。
- 1 -。
HLA细胞法分型试验

HLA细胞法分型试验HLA-D和DP位点的抗原须用细胞法分型进行鉴定,所以又称LD抗原(lymphocyted efinedantigen),其鉴定方法普遍采用混合淋巴细胞培养(mixedlymphocytecult ure,MLC),也称混合淋巴细胞反应(mixedlymphocytereaction,MLR)。
1.试验方法将分离的反应细胞(通常是患者的淋巴细胞)与刺激细胞(通常是供者或已知的标准淋巴细胞)配制成1×106/ml浓度的悬液,各加0.2ml到反应管中;放置37℃和5%CO2环境下培养5~6天。
培养结束后进行涂片染色,观察并计数转化的淋巴细胞;也可在培养结束前5~12小时加入3H-TdR,收获后用液体闪烁仪计数细胞的放射性。
试验结果的常用表示方式是刺激指数(SI)。
MLC分为双向法和单向法。
双向MLC是反应管中两种细胞都有应答能力,可以互为刺激细胞和反应细胞,试验结果是两种细胞反应之和。
SI=2×试验管cpm/(A对照cpm+B对照cpm)双向MLC只能反映两种细胞间LD的差别,结果比较模糊,也不能做LD抗原的分型。
单向MLC是将刺激细胞用丝裂霉素C(mitomycinC)或X线照射先行灭活,但细胞的抗原性保持不变,因此可作为刺激细胞而不能作为反应细胞,试验结果是待检测细胞的反应,使于结果分析。
SI=试验管cpm/自身对照cpm单向MLC可以用来进行HLD-D和DP位点的分型试验,常用的方法有两类:纯合子分型细胞(homozygoustypingcell,HTC)试验和预敏淋巴细胞分型(primedlymph ocytetyping,PLT)试验。
2.HTC试验HTC是指细胞内一对同源染色体上两个HLA单倍型完全相同,所以该位点在细胞表面只表达一种抗原;HTC可从近亲婚配的子代表中寻找。
将一组HTC经处理来活后作为刺激细胞,与待检细胞做单向MLC。
如果待检细胞与刺激细胞的LD 不同,就会发生反应;如果相同便不反应;所以试验又称为阴性分型法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
小鼠淋巴细胞刺激转化指数实验
1.小鼠淋巴细胞悬液的制备
1)小鼠脱臼处死,75%酒精浸泡2-3分钟。
减少污染。
2)将小鼠移入超净台内,仰卧固定在解剖盘,用眼科剪,镊子取出脾脏和胸腺(各1/2),放入装有2mL IMDM培养液的无菌平皿中。
3)将消毒好的纱布,3-4层覆盖到组织上,直头镊子固定,弯头镊子轻压组织,用移液枪反复吹打。
4)将悬液吸出,放入1.5mLEP管中,2000rpm,15-20min,吸取白色淋巴细胞层于无菌离心管中,用PBS缓冲液洗3遍。
2细胞计数
1)取上述制备好的细胞悬液混匀后,取出20mL,加到有980细mL胞计数液的EP管。
2)取20微升到细胞计数板,计数,数出四个大方格的细胞总数Y.则悬液的浓度为Y/4×104×50
3)用含有20%血清的培养液调细胞浓度至1×107/mL。
3.淋巴细胞培养
1)取含20%血清的IMDM 培养液(分别含有0g/mL,5mg/mL,10mg/mLConA)加入无菌96孔细胞培养板,每孔50mL)
2)青链霉素的浓度最终应为100单位/ml。
青霉素是160万单位(0.96g)/瓶,链霉素是100万单位(1g)/瓶,取青霉素0.06g,链霉素0.1g,加10ml灭菌双蒸水,配制成青链霉素1万单位的母液,过滤后分装在小EP管中。
使用时,可取1ml 母液放入100ml的培养液中,使青链霉素的浓度最终为100单位/ml。
3)再加入调好浓度的淋巴细胞悬液,50mL/孔
4)将上述培养板放入含有5%CO2的37℃培养箱中培养48-72h
4、MTT
1)结束培养前2h,在显微镜下观察细胞转化情况。
2)每孔加入MTT 5mg/mL,10mL/孔,将MTT和细胞混匀。
3)在培养箱中继续培养2h
4)取出后离心2000rpm,10min,弃去上清。
5)每孔加入100mL二甲基亚砜,将颗粒溶解,过夜。
6)用酶标仪测定OD值,波长570nm.。
