最常见的离子共存集锦
离子共存表大总结
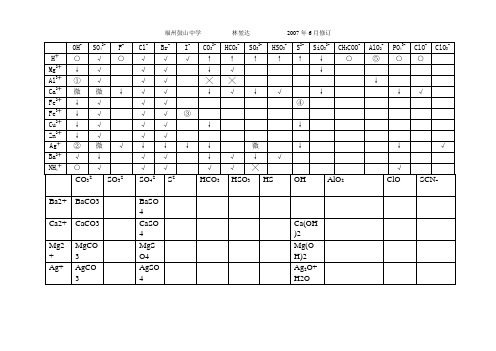
OH- SO42- F-Cl- Br- I-CO32- HCO3- SO32-HSO3-S2- SiO32- CH3COO-AlO2-PO43-ClO- ClO3-H╋○√○√√√↑↑↑↑↑↓○⑤○○Mg2╋↓√√√↓√↓Al3╋①√√√╳╳↓Ca2╋微微↓√√↓√↓√↓↓√Fe2╋↓√√√④Fe3╋↓√√√③Cu2╋↓√√√↓↓Zn2╋↓√√√Ag╋②微√↓↓↓↓微↓↓√Ba2╋√↓√√↓√↓√NH4╋○√√√√√╳√CO32-SO32-SO42-S2-HCO3-HSO3-HS-OH-AlO2-ClO-SCN-Ba2+ BaCO3 BaSO4Ca2+ CaCO3 CaSO4 Ca(OH )2Mg2 + MgCO3MgSO4Mg(OH)2Ag+ AgCO3 AgSO4Ag2O+H2OFe2 + Fe(OH)2+H2CO3Fe(OH)2+H2SO3Fe(OH)2+H2SFe(OH)2+H2CO3Fe(OH)2+H2SO3Fe(OH)2+H2SFe(OH)2Fe(OH)2+HAlO2Fe(OH)2+HClO不能共存Fe3 + Fe(OH)3+H2CO3Fe(OH)3+H2SO3Fe(OH)3+H2SFe(OH)3+H2CO3Fe(OH)3+H2SO3Fe(OH)3+H2SFe(OH)3Fe(OH)3+HAlO2Fe(OH)3+HClO血红色,不能共存Cu2 + Cu(OH)2+H2CO3Cu(OH)2+H2SO3Cu(OH)2+H2SCu(OH)2+H2CO3Cu(OH)2+H2SO3Cu(OH)2+H2SCu(OH)2Cu(OH)2+HAlO2Cu(OH)2+HClOAl3 + Al(OH)3+H2CO3Al(OH)3+H2SO3Al(OH)3+H2SAl(OH)3+H2CO3Al(OH)3+H2SO3Al(OH)3+H2SAl(OH)33AlO2-+3Al3++6H2O=4Al(OH)3↓Al(OH)3+HClOZn2 + Zn(OH )21.不能和H+大量共存:OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、CN-2.不能和OH-大量共存:HCO3-、HPO42-、HS-、H2PO4-、HSO3-、NH4+3.有色离子MnO4-,Fe3+,Fe2+,Cu2+,Fe(SCN)2+4.Fe2+与NO3-能共存,但在强酸性条件下(即Fe2+、NO3-、H+相遇)不能共存;MnO4-与Cl-在强酸性条件下也不能共存;S2-与SO32-在钠、钾盐时可共存,但在酸性条件下则不能共存。
离子共存知识点归纳高中

离子共存必考知识归纳1.所有的弱酸根离子:CH3COO-、F-、ClO-、AlO₂ ̄、SiO₃²¯、CN-与H+都不能大量共存。
2.酸式弱酸根离子如HCO₃ ̄、HS-、HSO₃ˉ-既不能与OH-大量共存,又不能与H+大量共存。
3.有沉淀生成包括有微溶物生成的离子不能大量共存,如Ba2+、Ca2+、Ag+等不能与SO₄²¯、CO₃²¯等大量共存,Mg2+不能与OH-、CO₃²ˉ大量共存。
4.一些容易发生水解的离子,在溶液中的存在是有条件的。
如AlO₂¯、S2-、CO₃²¯、C6H5O-等必须在碱性条件下才能在溶液中存在;如Fe2+、Al3+、Cu2+等必须在酸性条件下才能在溶液中存在;Fe3+必须在酸性较强的条件下才能在溶液中存在(常温下,pH=7时不能存在)。
5.能发生氧化还原反应的离子不能大量共存。
如S2-、HS-、SO₃²¯、I-和Fe3+不能大量共存;MnO₄¯、(NO₃¯、H﹢)、ClO-与S2-、HS-、SO₃²¯、HSO₃¯、I-、Fe2+等不能大量共存;SO₃²¯和S2-在碱性条件下可以共存,但在酸性条件下则由于发生2S2-+SO₃²¯+6H+===3S↓+3H₂O反应不能共存;H+与S₂O₃²¯不能大量共存。
6.溶液中能发生络合反应的离子不能大量共存。
如Fe3+与SCN-不能大量共存。
7.审题时应注意题中给出的附加条件。
(1)加入铝粉后放出可燃性气体的溶液、由水电离出的c(H+)或c(OH-)=1×10-10mol·L-1的溶液都有两种可能:酸溶液或碱溶液。
(2)无色溶液则没有MnO₄ ̄、Fe3+、Fe2+、Cu2+等有色离子。
澄清溶液即没有沉淀,与无色溶液不同。
高中离子共存知识汇总

离子共存问题一、 有色离子有色离子Cr 3+、CrO 72-、MnO 4-,Fe 3+,Fe 2+,Cu 2+,二、 酸碱性表述酸性:pH <7的溶液;能使紫色石蕊溶液呈红色;能使甲基橙呈红色;加入镁放出氢气 碱性:pH >7的溶液;能使pH 试纸变蓝;能使紫色石蕊溶液变蓝;能使酚酞呈红色可酸可碱:能在加入铝粉后放出可燃气体的溶液;由水电离出的H +或OH -=1×10-10mol/L 的溶液等。
三、 氧化还原反应不能共存具有较强还原性的离子不能与具有较强氧化性的离子大量共存。
氧化性:MnO 4-、Cr 2O 7-、NO 3-、ClO -、Fe 3+;还原性:S 2-、HS -、SO 32-、I -、HSO 3-、I -、Fe 2+MnO 4-(H +) S 2-、I -、Fe 2+、HS -、SO 32-、HSO 3-、Cl - Fe 2+与NO 3-能共存,但在强酸性条件下(即Fe 2+、NO 3-、H +相遇)不能共存;MnO 4-与Cl -在强酸性条件下也不能共存;S 2-与SO 32-在钠、钾盐时可共存,但在酸性条件下则不能共存。
Fe 3+(H +) S 2-、HS -、I - Cr 2O 7-(H +) S 2-、HS -、SO 32-、HSO 3-、I -、Fe 2+ NO 3-(H +) S 2-、HS -、I -、Fe 2+ ClO -(H +) S 2-、I -、Fe 2+、HS -、SO 32- ClO -(OH -) S 2- SO 32-和S 2-在碱性条件下可以共存,但在酸性条件下则由于发生2S 2-+SO 32-+6H +=3S↓+3H 2O 反应不能共在。
四、 生成气体、产生沉淀、有弱电解质1、 与H +不能共存OH-、CO 32-、SO 32-、S 2-、CH 3COO-、PO 43-、F -、ClO -、AlO2-、SiO 32-、CN -、C17H35COO -;HCO 3-、HSO 3-、HS -、HPO 42-、H 2PO 4-2、 与OH -不能共存Mg 2+、Fe 2+、Ag +、Al 3+、Zn 2+、Cu 2+、Fe 3+等; HCO 3-、HPO 42-、HS -、H 2PO 4-、HSO 3-等; NH 4+3、 金属阳离子与酸根离子如Ba 2+、Ca 2+、Mg 2+、Ag +等不能与SO 42-、CO 32-等大量共存;Mg 2+、Fe 2+、Ag +、Al 3+、Zn 2+、Cu 2+、Fe 3+等不能与OH -大量共存;Pb 2+与Cl -,Fe 2+与S 2-、Ca 2+与PO 43-、Ag +与I -不能大量共存。
化学离子共存问题归纳总结

化学离子共存问题归纳总结化学离子共存问题一直是化学研究中的重要课题之一。
当不同离子同时存在于溶液中时,它们之间的相互作用会引起一系列的现象和反应。
在这篇文章中,我们将对化学离子共存问题进行归纳总结,探讨其中的关键因素和常见情况。
一、离子共存的类型离子共存可以分为三种类型:同离子共存、异离子共存和复离子共存。
1. 同离子共存:指同种离子在溶液中同时存在的情况。
例如,钠离子(Na+)和氯离子(Cl-)在食盐溶液中形成同离子共存状态。
2. 异离子共存:指不同种离子在溶液中同时存在的情况。
例如,钠离子(Na+)和铜离子(Cu2+)在铜盐溶液中形成异离子共存状态。
3. 复离子共存:指由多个离子通过化学反应而形成的复合离子在溶液中同时存在的情况。
例如,氢氧根离子(OH-)和铝离子(Al3+)在氢氧化铝溶液中形成复离子共存状态。
二、离子共存的关键因素离子共存的现象和反应受到多个因素的影响,包括溶液中离子的浓度、溶解度积、配位数等。
1. 浓度:溶液中离子的浓度对离子共存的程度具有重要影响。
在低浓度情况下,离子的共存相对较容易;而在高浓度情况下,离子会发生竞争性吸附和沉淀现象,导致共存的困难增加。
2. 溶解度积:溶解度积是指在一定温度下,离子与其对应化合物溶解度的乘积。
离子共存的可能性与其溶解度积有密切关系。
当溶液中各离子的浓度适当,溶解度积小的离子相对容易共存;而溶解度积大的离子则较难共存。
3. 配位数:离子的配位数也会影响离子共存。
配位数较大的离子往往具有较强的亲合力和络合能力,容易形成稳定的配合物。
在离子共存时,配位数高的离子可能会与其他离子形成络合物,从而影响共存的结果。
三、常见的离子共存情况在实际的化学研究和应用中,一些离子共存情况比较常见且具有重要意义。
1. 锶和钙共存:当锶离子和钙离子共存于水溶液中时,它们往往会发生竞争性吸附和沉淀现象。
这在环境科学和地球化学领域中具有一定的研究价值。
2. 氧化还原离子的共存:在电化学和电池领域,氧化还原反应涉及到多种离子的共存问题。
高中化学——离子共存表
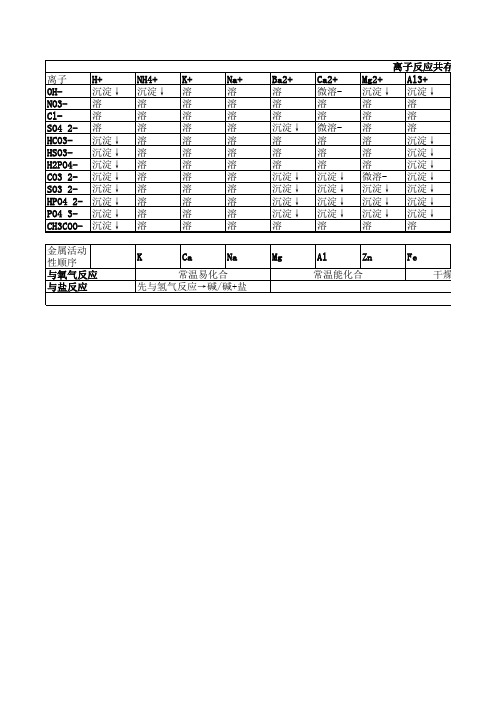
金属活动性顺序 与氧气反应 与盐反应
Ca Na 常温易化合 先与氢气反应→碱/碱+盐
Al Zn 常温能化沉淀↓ 溶 溶 溶 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 溶
Fe3+ 沉淀↓ 溶 溶 溶 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 溶
Hg+ 沉淀↓ 溶 沉淀↓ 溶 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ Pt
Ag+ 沉淀↓ 溶 沉淀↓ 微溶沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓
Sn Pb (H) Cu 干燥空气中难化合 直接与盐反应→新盐+新金
Hg Ag 加热能化合
Au 不反应
离子 OHNO3ClSO4 2HCO3HSO3H2PO4CO3 2SO3 2HPO4 2PO4 3CH3COO-
H+ 沉淀↓ 溶 溶 溶 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓
NH4+ 沉淀↓ 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 K
K+ 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 沉淀↓ 溶 溶 溶 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 溶 Mg
Ca2+ 微溶溶 溶 微溶溶 溶 溶 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 溶
Mg2+ 沉淀↓ 溶 溶 溶 溶 溶 溶 微溶沉淀↓ 沉淀↓ 沉淀↓ 溶
离子反应共存表 Al3+ 沉淀↓ 溶 溶 溶 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 溶 Fe
Sn2+ 沉淀↓ 溶 溶 溶 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 溶
离子大量共存规律总结

离子大量共存规律总结1.离子共存问题是离子反应条件所谓几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
2、熟记常考离子的性质注:“两性离子”指既能与酸反应又能与碱反应的离子,一般多元弱酸的酸式酸根离子3、离子间通常发生四种类型的反应,能互反应的离子不能大量共存。
(1)复分解反应①、有沉淀生成。
如Ba2+、Ca2+、Mg2+等不能与SO42-、CO32-等大量共存主要是由于Ba2++CO32-=CaCO3↓;Cu2+、Fe3+等不能与OH-大量共存也是因为Cu2++2OH-=Cu(OH)2↓,Fe3++3OH-=Fe(OH)3↓等。
②有气体产生。
如CO32-、S2-、HS-、HSO3-、等易挥发的弱酸的酸根与H+不能大量共存,主要是由于CO32-+2H+=CO2↑+H2O、HS-+H+=H2S↑。
③有弱电解质生成。
如OH-、CH3COO-、PO43-、HPO42-、H2PO4-( 一般除Cl-、SO42—、NO3-、I-、Br-、ClO4-外的阴离子)等与H+不能大量共存,主要是由于OH-+H+=H2O、CH3COO-+H+=CH3COOH;一些酸式弱酸根不能与OH-大量共存是因为HCO3-+OH-=CO32-+H2O、HPO42-+OH-=PO43-+H2O、NH4++OH-=NH3·H2O等。
(2)、发生氧化还原反应:具有较强还原性的离子不能与具有较强氧化性的离子大量共存常见的氧化性离子:MnO4、-、ClO-、Fe3+、NO3-(H+)常见的还原性离子:S2-(HS-)、SO32-(HSO3-)、I-、Br-、Fe2+注:Fe3+与Fe2+、Br-能大量共存(3)发生双水解反应:能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存。
常见的双水解:①Al3+、Fe3+和CO32(HCO3-)、S2-(HS-)、AlO2-、ClO-等②NH4+和SiO32-、AlO2-(4)络合反应:如Fe3+和SCN-、C6H5O-,由于Fe3++SCN-[Fe(SCN)]2+等络合反应而不能大量共存。
高中化学离子共存知识点总结8篇

高中化学离子共存知识点总结8篇第1篇示例:高中化学离子共存知识点总结在高中化学学习过程中,离子共存是一个非常重要的知识点,涉及到化学反应的进行和产物的判断。
离子共存是指在溶液中同时存在两种或两种以上的离子。
在实际生活和实验中,离子通常是以离子固体的形式存在,通过溶解可以形成溶液。
1. 离子溶液的电导性离子是带有电荷的粒子,因此溶解在水中形成的离子固体在水中会形成带电的离子溶液。
带电的离子会导致溶液的电导性增加,其中离子的浓度越高,电导性越强。
通过电导实验可以判断离子是共存还是单独存在。
2. 离子溶液的化学反应离子在溶液中会发生各种化学反应,例如酸碱中和反应、氧化还原反应、络合反应等。
不同离子之间的反应会产生不同的化学物质,这些化学物质的性质和溶液中的离子有关。
3. 离子共存的判断在观察一种溶液时,如果存在多种离子,则需要通过化学实验鉴定其中所含的离子种类。
通常使用的方法有析出法、沉淀法、鉴定法等。
通过这些方法可以准确地判断出溶液中所含的离子种类。
4. 常见的离子共存情况常见的离子共存情况有氯离子和硫酸根离子、氯离子和硝酸根离子、氢氧化物离子和硫酸根离子等。
这些共存情况在化学实验和生活中都有一定的应用,需要我们进行仔细的观察和分析。
5. 离子溶液的应用离子共存的知识在化学实验和工业生产中有着广泛的应用。
比如在水处理中,需要判断水中离子的种类和浓度,以确定水质的好坏;在矿产资源开发中,也需要通过分析离子种类来选择合适的提取方法等。
离子共存是化学学习中的一个重要知识点,需要我们掌握好离子的性质、化学反应和鉴定方法,才能更好地进行化学实验和问题解决。
希望以上内容对大家有所帮助,希望大家能够在学习中加深对离子共存知识的理解。
【文章字数已达上限,如需更多知识请继续咨询。
】第2篇示例:高中化学离子共存知识点总结在高中化学学习中,离子共存是一个重要的知识点。
离子是带电的原子或者分子,当两种或两种以上的离子在一起时,就会形成离子共存。
常见离子共存知识点总结

常见离子共存知识点总结一、离子的定义和性质1、离子的定义离子是原子或分子失去或得到一个或多个电子而形成的带电粒子。
正离子是失去了一个或多个电子的原子或分子,带有正电荷;负离子是得到了一个或多个电子的原子或分子,带有负电荷。
2、离子的性质离子在溶液中具有电导性,可以引起电解,具有极性,能够在电场中受到偏转等。
二、常见离子共存的情况1、Na+和Cl-氯化钠(NaCl)是最常见的离子共存的情况。
在水溶液中,Na+和Cl-离子会因为电解而分解成Na+和Cl-,从而形成导电现象。
2、Ca2+和CO32-碳酸钙(CaCO3)是由钙离子和碳酸根离子组成的。
在水溶液中,Ca2+和CO32-会结合在一起形成CaCO3的沉淀,这也是水中硬水的原因。
3、Fe2+和OH-氢氧化亚铁(Fe(OH)2)中存在铁离子和氢氧根离子。
在水溶液中,Fe2+和OH-会结合在一起形成Fe(OH)2的沉淀。
4、Cu2+和S2-硫化铜(CuS)中存在铜离子和硫离子。
在水溶液中,Cu2+和S2-会结合在一起形成CuS 的沉淀。
5、Ag+和Cl-氯化银(AgCl)中存在银离子和氯离子。
在水溶液中,Ag+和Cl-会结合在一起形成AgCl 的沉淀。
6、NH4+和NO3-硝酸铵(NH4NO3)中存在铵离子和硝酸根离子。
在水溶液中,NH4+和NO3-可以共存而不产生沉淀。
三、离子共存的影响1、沉淀反应当两种离子在水溶液中结合形成不溶性的化合物时,会发生沉淀反应。
例如Ca2+和CO32-结合形成CaCO3的沉淀。
2、电解和导电在水溶液中,离子可以进行电解,从而形成导电现象。
正如NaCl在水溶液中电解成Na+和Cl-。
3、影响酸碱性一些离子的存在会影响水溶液的酸碱性。
例如,NH4+离子会使水溶液呈酸性,而NO3-离子会使水溶液呈碱性。
4、化学反应某些离子的存在会影响化学反应的进行。
例如,Ag+离子会与Cl-离子反应形成沉淀,从而影响其他化学反应的进行。
四、离子共存的应用1、水处理领域在水处理领域,离子共存的情况会影响水的硬度、酸碱性等特性,因此需要根据离子的种类和含量进行水处理和净化。
离子共存专题(50道)

离子共存专题1、在pH=1的含有Mg2+、Al3+、Fe2+三种阳离子的溶液中,可能存在的阴离子是①Cl-、②NO3-、③SO42-、④S2-、⑤HCO3-()A、①②⑤B、②③④C、④⑤D、①③2、下列各组离子,在碱性溶液中能大量共存,且溶液呈无色透明的离子组是( )A、K+、MnO4-、Mg2+、Cl-B、Na+、Ba2+、HCO3-、NO3-C、Na+、NO3-、CO32-、Cl-D、K+、H+、Cl-、S2-3、对四种无色溶液进行所含离子的检验,结论如下,其中错误的是( )A、K+、Na+、Cl-、NO3-B、Cu2+、NO3-、OH-、Cl-C、CO32-、OH-、Cl-、K+D、MnO4-、K+、H+、Cl-4、下列各组离子在溶液中可以大量共存的是( )A、H+、SO32-、CO32-、SO42-B、Cu2+、Cl-、NO3-、CO32-C、Mg2+、H+、SO42-、Cl-D、Mg2+、OH-、CO32-、H+5、下列各组离子在水溶液中不能大量共存的是( )A、Ba2+、Cl-、NO3-、Ca2+B、H+、Na+、S2-、SO32-C、Na+、S2-、SO32-、K+D、Mg2+、Na+、CO32-、Cl-6、在溶液中能共存,加OH-有沉淀析出,加H+ 能放出气体的是()A、Na+、Cu2+、Cl-、SO42―B、Ba2+、K+、OH-、NO3―C、H+、Al3+、NH4+、CO32―D、Na+、Ca2+、Cl-、HCO3―7、在强酸性溶液中能大量共存,且溶液为无色透明的离子组是( )A、NH4+、S2-、Na+、SO32-B、K+、NO3-、Al3+、SO42-C、K+、NH4+、MnO4-、SO42-D、Cl-、Na+、HS-、K+8、因发生氧化还原反应,不能在溶液中大量共存的一组离子是:( ) A、Ag+、Na+、Br-、NO3- B、Ca2+、H+、Cl-、CO32-C、K+、H+、SO42-、OH-D、Na+、S2-、SO32-、H+9、在强碱性溶液里能大量共存,且溶液为无色透明的离子组是( )A、K+、Fe2+、Cl-、SO42-B、Na+、Cl-、NO3-、CO32-C、Na+、Ca2+、NO3-、SO42-D、Na+、HSO3-、S2-、Cl-10、在稀溶液中各离子能共存,加入碱溶液有沉淀析出,加入酸溶液有气体逸出的一组离子是( )A、Fe2+、S2-、Na+、Cl-B、SO42-、NH4+、Cl-、Na+C、HCO3-、Ca2+、K+、NO3-D、Mg2+、SO42-、HSO3-、K+11、在c(H+)=1mol/L的溶液中,可以大量共存的离子组是( )A、Na+、K+、S2-、Cl-B、Mg2+、Na+、NO3-、SO42-C、Na+、K+、ClO-、S2-D、Al3+、Cu2+、SO42-、Cl-12、下列各组离子的溶液中,加入过量盐酸产生沉淀,过滤除去沉淀,往滤液中通入H2S气体,又产生沉淀的是( )A、Na+、NH4+、Ag+B、K+、Cu2+、Ag+C、Ba2+、Al3+、Ca2+D、Fe2+、Mg2+、Ag+13、下列各组离子可以大量共存,并且溶液为蓝色的是()A、Na+、Mg2+、CO32-、Cl-B、Mg2+、Cu2+、SO42-、NO3-C、Cu2+、Na+、NO3-、OH-D、Fe2+、K+、Cl-、NO3-14、下列各组离子,在溶液中不能大量共存的是()A、K+、SO42-、Cl-、Cu2+B、K+、Cl-、NO3-、Na+C、H+、SO42-、Cl-、CO32-D、Fe3+、Cl-、OH-、SO42-15、下列各组离子在强碱性溶液中可以大量共存的是()A、K+、Na+、HSO3-、Cl-B、Na+、Ba2+、Cl-、NO3-C、H+、K+、Cl-、SO42-D、CO32-、Fe2+、Na+、Ba2+16、在能使pH试纸显红色的溶液中,下列各组离子因发生氧化还原而不能大量共存的是()A、Ag+、Ca2+、Cl-、CO32-B、Cl-、SO42-、K+、Na+C、Fe2+、Na+、NO3-、K+D、I-、K+、MnO4-、SO42-17、下列各组离子在水溶液中能大量共存的是( )A、Na+、Cu2+、Cl—、HS—B、Na+、K+、OH—、HS—C、K+、AlO2—、CO32—、Br—D、Na+、H+、Cl—、SO32—18、能大量共存于同一溶液中,但当溶液PH=0时会放出气体。
高中化学离子共存问题的知识点归纳

高中化学离子共存问题的知识点归纳1.由于发生复分解反应,离子不能大量共存。
(1)有气体产生。
如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
(2)有沉淀生成。
如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;Pb2+与Cl-,Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
(3)有弱电解质生成。
如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、CN-、C17H35COO-、等与H+不能大量共存;一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;NH4+与OH-不能大量共存。
(4)一些容易发生水解的离子,在溶液中的存在是有条件的。
如AlO2-、S2-、CO32-、C6H5O-等必须在碱性条件下才能在溶液中存在;如Fe3+、Al3+等必须在酸性条件下才能在溶液中存在。
这两类离子不能同时存在在同一溶液中,即离子间能发生“双水解”反应。
如3AlO2-+3Al3++6H2O=4Al(OH)3↓等。
2.由于发生氧化还原反应,离子不能大量共存。
(1)具有较强还原性的离子不能与具有较强氧化性的离子大量共存。
如S2-、HS-、SO32-、I-和Fe3+不能大量共存。
(2)在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。
如MnO4-、Cr2O7-、NO3-、ClO-与S2-、HS-、SO32-、HSO3-、I-、Fe2+等不能大量共存;SO32-和S2-在碱性条件下可以共存,但在酸性条件下则由于发生2S2-+SO32-+6H+=3S↓+3H2O反应不能共在。
H+与S2O32-不能大量共存。
3.能水解的.阳离子跟能水解的阴离子在水溶液中不能大量共存(双水解)。
高中化学——离子共存表全表

CO3 2- 气体↑ 溶
溶
PO4 3- 弱酸- 溶
溶
HPO4 2- 弱酸- 溶
溶
H2PO4- 弱酸- 溶
溶
SiO3 2- 沉淀↓ 无× 溶
MnO4- 溶 溶 溶
CH3COO- 弱酸- 溶
溶
水溶液中离子 共存性表
Na+ Ba2+ Ca2+ Mg2+ Al3+ Mn2+ Zn2+ Fe2+ Fe3+ Pb2+ Cu2+ Hg2+ Hg+ Ag+ Sn2+ 溶 溶 微溶- 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 无× 无× 无× 沉淀↓ 溶溶溶溶溶溶溶溶溶溶溶溶溶溶溶 溶 微溶- 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 微溶- 微溶- 微溶- 微溶- 微溶- 无× 无× 溶 溶
溶 溶 溶 溶 溶 溶 溶 溶 溶 微溶- 溶 弱盐- 弱盐- 沉淀↓ 溶 溶 溶 溶 溶 溶 溶 溶 溶 微溶- 溶 弱盐- 弱盐- 沉淀↓ 溶 溶 溶 溶 溶 溶,分 溶 溶 无× 沉淀↓ 无× 沉淀↓ 沉淀↓ 沉淀↓ 溶 无× 微,分 无× 无× 沉淀↓ 沉淀↓ 沉淀↓ 无× 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 溶 溶 溶,分 无× 无× 无× 无× 无× 无× 无× 无× 无× 无× 无× 沉淀↓ 溶 沉淀↓ 微溶- 溶 溶 溶 溶 溶 溶 沉淀↓ 溶 溶 溶 微溶- 溶 溶 沉淀↓ 沉淀↓ 微溶- 无× 沉淀↓ 沉淀↓ 沉淀↓ 无× 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 溶 溶 溶 溶 无× 无× 无× 无× 无× 无× 无× 无× 无× 无× 沉淀↓ 溶 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 微溶- 微溶- 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 微溶溶 溶 溶 溶 无× 溶,分 无× 溶,分 无× 无× 无× 无× 无× 无× 沉淀↓ 溶 沉淀↓ 沉淀↓ 微溶- 无× 沉淀↓ 沉淀↓ 沉淀↓ 无× 沉淀↓ 无× 无× 沉淀↓ 沉淀↓ 沉淀↓ 溶 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 溶 微溶- 微溶- 微溶- 无× 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 溶 溶 溶 溶 溶 溶 溶,分 溶 溶 沉淀↓ 溶 溶 未知? 微溶- 沉淀↓ 溶 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 沉淀↓ 无× 无× 沉淀↓ 无 溶 溶 溶 溶 沉淀↓ 微溶- 溶 无× 沉淀↓ 微溶- 微溶- 溶 未知? 微溶溶 溶 溶 溶 溶 溶 溶 溶 溶 弱盐- 弱盐- 未知? 未知? 微溶- 溶
中学化学中常见离子共存问题归纳

学习好资料欢迎下载中学化学中常见离子共存问题归纳:在溶液中离子共存问题的实质是:哪能些离子刘不能发生反应,能发生反应者不能共存。
主要的反应类型有四类;复分解反应、氧化还原反应、络合反应、双水解反应。
中学化学常见不能共存的离子组如下:1、看是否因发生氧化还原反应而不共存:常见的如下:Fe3+与S2-、I-不能共存;;;NO3-(H+)、MnO4-(H+)、ClO-(H+)、Cr2O72-(H+)、H2O2、等与S2-、I-、SO32-、Fe2+等不能共存。
;;;;;;;;;;另在酸性条件下,特殊离子间不共存并附离子方程式如下:①H+与S2O32-:②H+与SO32- 和S2-:③H+与ClO- 和Cl- :④H+与MnO4- 和Cl- :2、看是否发生复分解反应而不共存:具体又分三种情况:①生成难溶于混合体系的物质:(即常理解为生成沉淀的一大类)常见的如下:H+与SiO32-、AlO2-、C17H35COO- ;;;OH-与除NH4+之外的所有的弱碱金属阳离子均生成难溶的碱;Ag+与Cl-、OH-、S2-、I-、Br-、SO32-、CO32-、SiO32-、PO43-、SO42- 等;Pb2+与OH-、S2-、SO32-、CO32-、SiO32-、PO43-、SO42-等;Ba2+、Ca2+与SO32-、CO32-、SiO32-、PO43-、SO42-等;Fe2+、Cu2+、Mg2+、Zn2+等与OH-、S2-、SO32-、CO32-、SiO32-、PO43-等;S2-(H2S)与Ag+、Cu2+、Pb2+、Hg2+、Fe2+与S2-反应与H2S不反应。
②生成易挥发的物质:(即常理解为生成气体的一大类)常见的如下:H+与S2-(H2S)、SO32-(HSO3-)、CO32-(HCO3-)不共存,OH-与NH4+加热时生成氨气不共存;另外有些时侯也要特别注意HCl和HNO3的挥发性。
③生成难电离的物质:(即初中常理解为生成水的)除了生成水的以外主要就是H+与弱酸根离子生成难电离的弱酸以及OH-与NH4+常温时生成NH3·H2O难电离。
高中离子共存知识点归纳

高中离子共存知识点归纳一、离子的概念和基本特点离子是指由于原子或分子失去或获得电子而带有电荷的物质,可以是单个原子离子或多个原子结合产生的复合离子。
离子可以带正电荷的正离子,也可以带负电荷的负离子。
二、离子共存的条件离子共存是指不同离子在同一溶液或晶体中同时存在的现象。
离子共存需要具备以下条件:1. 存在可以离子化的物质:只有具备离子化倾向的物质才能在适当条件下形成离子。
2. 适当的溶剂:离子化物质需要溶解在适当的溶剂中,形成离子溶液或离子晶体。
3. 离子化物质的浓度:离子化物质浓度足够高,使得离子之间发生相互作用。
三、离子共存的类型1. 同种离子共存:指同一种离子在溶液或晶体中共存的情况。
例如,氯离子和氢氧根离子可以在溶液中共存。
2. 异种离子共存:指不同种离子在溶液或晶体中共存的情况。
例如,氯离子和钠离子可以在溶液中共存。
四、离子共存的影响因素离子共存会受到以下几个因素的影响:1. 离子电荷:离子的电荷大小会影响离子之间的相互作用力。
同种离子之间的相互作用力通常比异种离子之间的相互作用力强。
2. 离子半径:离子的半径大小会影响离子之间的空间排列和相互作用。
通常情况下,离子半径较小的离子会更容易共存。
3. 溶剂性质:溶剂的性质会影响离子的溶解度和稳定性。
不同离子在不同溶剂中的溶解度和稳定性可能会有所差异。
五、离子共存的实际应用离子共存的知识在生活和科学研究中有着广泛的应用。
一些常见的实际应用包括:1. 水处理:离子共存的知识可以帮助我们理解水中离子的含量和组成,从而进行水质检测和水处理。
2. 药物研究:离子共存的知识可以帮助药物研究人员理解药物与离子的相互作用,从而优化药物的性质和效果。
3. 电化学反应:离子共存的知识对于电化学反应的研究和应用具有重要意义,可以帮助我们理解电化学反应中离子的迁移和转化过程。
六、离子共存的实验技术在实验中,离子共存的研究通常需要使用一些特定的实验技术,例如:1. 离子色谱法:离子色谱法可以通过离子交换和分离技术,将离子从溶液中分离出来并进行定量分析。
关于离子共存问题的总结

关于离子共存问题的总结关于离子共存问题的总结:1.因发生复分解反应而不能大量共存:-2--2--2--2------H+:OH﹑SiO3﹑AlO2﹑CO3﹑HCO3﹑SO3﹑HSO3﹑S ﹑HS﹑CN﹑ClO﹑F﹑CH3COO﹑--3--HCOO﹑C6H5O﹑PO4﹑C17H35COO。
-2+3+2+2+3++2+--2--+OH:H+﹑Mg﹑Al﹑Cu﹑Fe﹑Fe﹑Ag﹑Ca(微溶)、HCO3﹑HSO3﹑HPO4﹑H2PO4﹑NH4。
+----3-2-2-2-2Ag :OH﹑Cl﹑Br﹑I﹑PO4﹑CO3﹑SiO3﹑SO3﹑SO4(微溶)。
2+2+3-2-2-2-2-Ca、Ba :PO4﹑CO3﹑SiO3﹑SO3﹑SO4。
2-2+2++2+2+S:Fe﹑Cu﹑Ag﹑Pb﹑Hg。
2+-2-2-2-Mg :OH﹑SiO3﹑CO3﹑SO3.2. 因发生氧化还原反应而不能大量共存:3+-2-Fe (氧化性):I﹑S。
--2--+2-2-2+-MnO4﹑ClO﹑Cr2O7﹑NO3(H)具有强氧化性,SO3﹑S﹑Fe﹑I具有强还原性,两类离子不共存。
3. 因发生双水解反应而不能大量共存:3+2--2---Al:CO3﹑HCO3﹑S﹑HS﹑AlO2。
3+2---Fe:CO3﹑HCO3﹑AlO2。
+2--NH4:SiO3﹑AlO2。
1/ 33+4. 因发生络合反应而不能大量共存:Fe:SCN-(以上内容记在名师金典名目下第2页背诵)关于离子共存问题的总结:1.因发生复分解反应而不能大量共存:-2--2--2--2------H+:OH﹑SiO3﹑AlO2﹑CO3﹑HCO3﹑SO3﹑HSO3﹑S ﹑HS﹑CN﹑ClO﹑F﹑CH3COO﹑--3--HCOO﹑C6H5O﹑PO4﹑C17H35COO。
-2+3+2+2+3++2+--2--+OH:H+﹑Mg﹑Al﹑Cu﹑Fe﹑Fe﹑Ag﹑Ca(微溶)、HCO3﹑HSO3﹑HPO4﹑H2PO4﹑NH4。
中学化学中常见离子共存问题归纳

中学化学中常见离子共存问题归纳:在溶液中离子共存问题的实质是:哪能些离子刘不能发生反应,能发生反应者不能共存。
主要的反应类型有四类;复分解反应、氧化还原反应、络合反应、双水解反应。
中学化学常见不能共存的离子组如下:1看是否因发生氧化还原反应而不共存:常见的如下:Fe3+与S2-、I-不能共存;_________________________ ; ________________________ ;________ N03-(H+)、MnO4-(H+)、CIO-(H+)、C^O?2-(H+)、H2O2、等与S2-、「、SO32-、Fe2+等不能共存。
①H+与S2O32-: ____________________________________________________________________________________________②H+与SO32-和S2-: _______________________________________________________________________________________③H+与CIO-和CI- : _____________________________________________________________________________________④H+与MnO4-和Cl- : _____________________________________________________________________________________2、看是否发生复分解反应而不共存:具体又分三种情况:①生成难溶于混合体系的物质:(即常理解为生成沉淀的一大类)常见的如下:H+与SiQ2、AIO 2、C仃H35COO ;_________________________ ;___________________ ;____ OH-与除NH4+之外的所有的弱碱金属阳离子均生成难溶的碱;Ag+与Cl-、OH-、S2-、I-、Br-、SO32-、CO32-、SQ32-、PO43-、SO42-等;Pb2+与OH-、S2-、SO32-、CO32-、SQ32-、PO43-、SO42-等;Ba2+、Ca2+与SO32-、CO32-、SiO32-、PO43-、SO42-等;Fe2+、Cu2+、Mg2+、Zn2+等与OH-、S2-、SO32-、CO32-、SQ32-、PO43-等;S2-(H2S)与Ag +、Cu2+、Pb2+、Hg2+、Fe2+与s2-反应与H2S不反应。
离子共存

离子共存问题总结一:①在强酸性溶液中不能大量存在弱酸根离子:如碳酸根(CO 3 2-)、碳酸氢根(HCO 3-)、硫离子(S 2-)、硫氢根离子(HS -)、亚硫酸根离子(SO 3 2-)、硅酸根离子(SiO 3 2-)、偏铝酸根离子(AlO 2-)、氟离子(F -)等,也不能有大量的氢氧根(OH -)。
②强碱性溶液中不能大量存在弱碱金属离子。
如:镁离子(Mg 2+)、亚铁离子(Fe 2+)、铁离子(Fe 3+)、铝离子(Al 3+)、铜离子(Cu 2+)及铵根离子(NH 4+)等,也不能大量存在氢离子(H +)及酸式根离子:HCO 3-、HSO 3-、HS -、H 2PO 4-等。
③能发生氧化还原反应的离子也不能共存:如:Fe 3+与I -,Cu 2+与I -,H +、Fe 2+与NO 3-,H+与SO 32-,ClO -与S 2-,ClO -与Fe 2+,H +、I -与NO 3-,H +、I -与SO 32-或S 2-等。
④能形成络离子的也不能共存:如:Fe 3+与SCN -,Ag +与SO 32-,Fe 3+与C 6H 5O -等。
二:1.同一溶液中若离子间符合下列任意一个条件就会发生离子反应,离子之间便不能在溶液中大量共存。
⑴生成难溶物或微溶物:Ba 2+与CO 32-、Ag +与Br -、Ca 2+与SO 42-等不能大量共存。
⑵生成气体或挥发性物质:如NH 4+与OH -,H +与CO 32-、HCO 3-、SO 32-、OH -、HSO 3-等不能大量共存。
⑶生成难电离的物质:如H +与CH 3COO -(即醋酸根离子)、CO 32-、S 2-、SO 32-等生成弱酸;OH -与NH 4+、Cu 2+、Fe 3+等生成弱碱;H +与OH -生成水,这些离子不能大量共存。
⑷发生氧化还原反应:氧化性离子(如Fe 3+、NO 3-、ClO -、MnO 4-等)与还原性离子(如S 2-、I -、Fe 2+、SO 32-等)不能大量共存。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
离子共存
1.下列各组离子,在强碱性溶液中可以大量共存的是
A.I-、AlO2-、Cl-、S2-B.Na+、K+、NH4+、Ba2+
C.Br-、S2-、Cl-、CO32-D.SO32-、NO3-、SO42-、HCO3-
2.下列离子在溶液中因发生氧化还原反应而不能大量共存的是
A.H3O+、NO3-、Fe2+、Na+B.Ag+、NO3-、Cl-、K+
C.K+、Ba2+、OH-、SO42-D.Cu2+、NH4+、Br-、OH-
3.若溶液中由水电离产生的c(OH-)=1×10-14mol·L-1,满足此条件的溶液中一定
..可以大量共存的离子组是A.Al3+ Na+ NO-3Cl-B.K+Na+ Cl-NO3-
C.K+Na+Cl-AlO2-D.K+NH4+ SO42-NO3-
4.对某酸性溶液(可能含有Br-,SO42-,H2SO3,NH4+)分别进行如下实验:①加热时放出的气体可以使品红溶液褪色;②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;③加入氯水时,溶液略显黄
色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸,对于下列物质不能
..确认其在溶液中是否存在的是A.Br-B.SO42-C.H2SO3D.NH4+
5.在含有I-且能使酚酞变红的无色溶液中,可大量存在的离子组是
A.Na+、Cu2+、Br-、Cl-B.AlO2-、K+、NH4+、Na+
C.K+、Na+、NO3-、H+D.K+、S2-、SO42-、OH-
6.某溶液由水电离出的c(H+)=10—12mol/L,则此溶液中可能大量共存的离子组是
A.HCO3—、Cl—、NH4+、Mg2+ B.Na+、K+、NO3—、Cl—
C.K+、Ba2+、I—、NO3—D.Ba2+、Na+、Cl—、SO42—
7.下列各组离子在溶液中不能大量共存,且加入过量NaOH溶液或过量稀盐酸均能得到澄清溶液的是A.Fe3+、CI-、Na+、SO42-B.AI3+、Na+、CO32-、NO3-
C.Ag+、Na+、SO42-、NO3-D.AIO2-、CO32-、K+、Na+
8.某能使石蕊试液变红的溶液中,能大量存在的离子是
A.Al3+NH4+SO42- CI-B.Na+Mg2+HCO3-NO3-
C.K+Na+AlO2- Cl-D.Fe2+ K+NO3-Cl-
9.在pH=0的无色透明溶液中,因发生氧化还原反应而不能大量共存的离子组是
A Na K MnO Cl
B Cl S O K Na 42.、、、.、、、++----++32
C Na Cl CH COO K
D K I Na ClO 3.、、、.、、、+--+
+-+- 10.常温下测得某无色溶液中由水电离出的113L m ol 101]H [--+⋅⨯=水,又知该溶液中还有-3NO 、-+、Cl Na ,那么该溶液中还一定..
存在的离子是 A .--ClO AlO 2、 B .-
+242SO Mg 、 C .++22、Cu Fe D .+2Ba 、+K 11.下列各组中的离子,能在溶液中大量共存的是:
A .K +、Ag +、NO 3-、Cl -
B .Ba 2+、Na +、CO 32-、OH -
C .Mg 2+、Ba 2+、OH -、NO 3-
D .H +、K +、CO 32-、SO 42-
E .Al 3+、Fe 3+、SO 42-、Cl -
F .K +、H +、NH 4+、OH -
12.在pH =1的无色透明溶液中,不能大量共存的离子组是:
A .Al 3+、Ag +、NO 3-、I -
B .Mg 2+、NH 4+、NO 3-、Cl -
C .NH 4+、K +、S 2-、Br -
D .Zn 2+、Na +、NO 3-、SO 42-
13.下列各组离子,在强碱性溶液中可以大量共存的是:
A .K +、Na +、HSO 3-、Cl -
B .Na +、Ba 2+、AlO 2-、NO 3-
C .NH 4+、K +、Cl -、NO 3-
D .K +、Na +、ClO -、S 2-
14.下列各组离子在水溶液中能大量共存的是:
(1)I -、ClO -、NO 3-、H + (2)K +、NH 4+、HCO 3-、OH - (3)SO 32-、SO 42- 、Cl -、OH -
(4)Fe 3+、Cu 2+、SO 42- 、Cl - (5)H +、K +、AlO 2-、HSO 3- (6)Ca 2+、Na +、SO 42- 、CO 32-
A .(1)和(6)
B .(3)和(4)
C .(2)和(5)
D .(1)和(4)
15.下列各组离子,能够在溶液中大量共存的是:
A .Na +、Al 3+、NO 3-、AlO 2-
B .Na +、Ca 2+、HCO 3-、HSO 4-
C .Cu 2+、K +、NO 3-、OH -
D .S 2O 32-、Na +、H +、SO 42-
E .Fe 3+、Cl -、SCN -、K +
F .Fe 3+、NH 4+、Cl -、NO 3-
G .Fe 2+、Cl -、NO 3-、
H + H .Na +、Al 3+、SO 42-、HCO 3-。
