大学化学分子结构
分子的结构与性质

分子的结构与性质一、分子的结构1.分子的几何构型分子的几何构型是指分子中原子之间的相对位置和空间分布。
分子的几何构型直接影响了分子的性质,如形状、极性等。
常见的分子几何构型有线性、平面三角形、四面体、平面四方形等。
以水分子(H2O)为例,它的分子几何构型是平面三角形。
氧原子呈现出sp3杂化,形成两对孤对电子,与两个氢原子通过共价键结合在一起。
水分子的这种构型使得分子呈现出极性,其中氧原子带负电荷,两个氢原子带正电荷,从而赋予了水分子诸多的性质,如高沸点、强的化学活性等。
2.分子的键的属性分子中的原子之间通过共价键、离子键或金属键等方式结合在一起。
不同类型的键对分子的性质具有不同的影响。
共价键是由两个非金属原子共享一对电子而形成的化学键。
共价键使得分子具有稳定的结构,并且能够保持一定的角度和长度。
共价键的强度与键的键能有关,键能越大,共价键越强,分子越稳定。
举例来说,氧气(O2)分子就是由两个氧原子通过共价键结合而成的,其键能很高,因此氧气分子稳定且不容易被分解。
离子键是由正负电荷之间的静电吸引力形成的。
离子键通常形成在金属和非金属之间。
离子键的强度较大,分子通常具有高熔点和高沸点。
比如氯化钠(NaCl)是由钠离子(Na+)和氯离子(Cl-)通过离子键结合在一起的,因此具有高熔点(801℃)和高溶解度。
金属键是金属原子通过金属键结合在一起形成的。
金属键的特点是金属原子中的电子活动,在整个金属中自由流动,形成电子云。
金属键使得金属具有良好的导电性和导热性,以及高延展性和可塑性。
二、分子的性质分子的性质与其结构密切相关,不同的分子结构决定了不同的性质。
1.物理性质分子的物理性质包括物质的密度、沸点、熔点、溶解度等。
这些性质与分子的结构以及分子之间的相互作用有关。
以碳酸氢钠(NaHCO3)为例,它的分子结构是一个氢氧根离子(HCO3-)与一个钠离子(Na+)通过离子键结合而成的。
由于离子的排列比较紧密,分子间作用力较大,因此碳酸氢钠的熔点(156℃)和沸点(851℃)都比较高。
大学无机化学分子结构 ppt课件

现代价键理论
■ 1916年路易斯(Lewis)提出经典共价键理论
共价键是由成键原子双方提供电子组成 共用电子对所形成的。
现代价键理论
■ 1916年路易斯(Lewis)提出经典共价键理论
共价键是由成键原子双方提供自旋相反的单 电子组成共用电子对所形成的。
H + Cl
H Cl
现代价键理论
■ 1916年路易斯(Lewis)提出经典共价键理论
现代价键理论
4、键参数(bond parameter)
表征化学键性质的物理量
键参数
键能
(bond energy)
键长
(bond length)
键的极性
(bond polar)
键角
(bond angle)
现代价键理论
4、键参数(bond parameter)
(1) 键能 ——化学键的平均离解能
键能愈大,键愈牢固。
N
2s
2px 2py 2pz
现代价键理论
■ 例:N2分子形成示意图
2s
N
2px 2py 2pz
σ键
πZ
σ键 π键
πY
N
2s
2px 2py 2pz
现代价键理论
■ 例:N2分子形成示意图
2s 2px 2py 2pz
N
σ键 π键
πZ πY
σ
N
N
N
2s 2px 2py 2pz
现代价键理论
■ 例:N2分子形成示意图
1、成键的原理:
(1)电子配对原理 具有自旋相反的未成对电子的两个原子 相互接近,可以形成稳定的共价键
(2)原子轨道最大重叠原理 成键电子的电子云重叠的越多,核间电子云 密度越大,形成的共价键越牢固
分子结构和化学键

分子结构和化学键分子结构和化学键是化学中两个重要的概念。
分子结构描述了分子中原子的相对位置和连接方式,而化学键则是连接原子的力。
一、分子结构分子结构是描述分子中原子相对位置和连接方式的方式。
目前最常用的描述方法是路易斯结构和空间结构。
1. 路易斯结构路易斯结构由美国化学家吉尔伯特·路易斯提出,采用简单的点和线表示原子和电子。
在路易斯结构中,原子通过化学键连接,而电子以点的形式表示,用于补充原子的电子。
例如,氨分子(NH3)的路易斯结构中,一个氮原子和三个氢原子通过共价键连接在一起,氮原子周围有一个孤对电子。
2. 空间结构空间结构是描述分子三维形状的方法。
根据VSEPR理论(分子形状理论),分子的最稳定状态是使电子对排斥最小的状态。
根据电子对的排列情况,分子的形状可以分为线性、角形、平面三角形、四面体等多种形式。
二、化学键化学键是连接原子的力,可以分为离子键、共价键和金属键等不同类型。
1. 离子键离子键是由离子之间的电荷吸引力形成的。
当一个原子失去一个或多个电子时,形成正离子;当一个原子获得一个或多个电子时,形成负离子。
正离子和负离子之间发生静电作用,形成离子键。
例如,氯化钠(NaCl)中,钠离子失去一个电子形成正离子(Na+),氯原子获得一个电子形成负离子(Cl-),通过电荷吸引力形成离子键。
2. 共价键共价键是由共享电子形成的。
在共价键中,原子通过共享电子对相互连接。
共有单电子对形成单键,共享两对电子形成双键,共享三对电子形成三键。
例如,氢气(H2)中,两个氢原子通过共享一个电子对形成一个共价键。
3. 金属键金属键是金属原子之间的电子云形成的强力。
金属结构中,金属原子失去价层的一个或多个电子,形成阳离子,而这些电子形成了电子云,使金属原子之间产生强烈的吸引力。
金属键是金属物质特有的键。
总结:分子结构和化学键是化学中重要的概念。
分子结构描述了分子中原子的相对位置和连接方式,常用路易斯结构和空间结构表示。
大学化学分子结构习题带答案

1.离子晶体中的化学键都是离子键。
()1.错2.CO 分子含有配位键。
()2.对3.所有分子的共价键都具有饱和性与方向性,而离子键没有饱和性与方向性。
()3.错4. 中心原子所形成的杂化轨道数等于参加杂化的原子轨道数。
()4.对5. 原子轨道发生杂化后可以增强成键能力。
()5.对6. 杂化轨道具有能量相等、空间伸展方向一定的特征。
()6.对7. 凡是中心原子采取 sp3 杂化轨道成键的分子,其空间构型都是正四面体。
()7.错8. 在任何情况下,每一个 sp2 杂化轨道所含的 s、p 成分均相同。
()8.错9. 由分子轨道理论可推知 O2-、O22- 都比 O2 稳定。
()9.错10. 按照分子轨道理论,N2+ 和 N2- 的键级相等。
()10.对11. 色散力存在于一切分子之间。
()11.对12. 弱极性分子之间的分子间力均以色散力为主。
()12.对13. 氢键只存在于 NH3、H2O、HF 的分子之间,其它分子间不存在氢键。
()13.错14. 根据价层电子对互斥理论,分子或离子的空间构型取决于中心原子的价层电子对数。
()14.对15. 对 ABm 型分子 ( 或离子 ) 来说,当中心原子 A 的价电子对数为 m 时,分子的空间构型与电子对在空间的构型一致。
()15.对16. AsF5 是三角双锥形分子。
()16.错17. SO42-、ClO4-、PO43- 的空间构型相同。
()17.对18. 下列化合物中既有离子键又有共价键和配位键的是()。
18.D(A) KF; (B) H2SO4; (C) CuCl2; (D) NH4NO3。
19. 关于离子键的本性,下列叙述中正确的是()。
19.D(A) 主要是由于原子轨道的重叠; (B) 由一个原子提供成对共用电子;(C) 两个离子之间瞬时偶极的相互作用; (D) 正、负离子之间的静电吸引为主的作用力。
20. 下列各组卤化物中,离子键成分大小顺序正确的是()。
化学中的分子结构和空间构型

化学中的分子结构和空间构型分子结构和空间构型是化学中的重要概念,它们对于理解分子性质和反应机制具有重要意义。
在化学中,分子结构指的是分子中原子的相对位置和连接方式,而空间构型则描述了分子在三维空间中的排列方式。
本文将从分子结构和空间构型的基本概念、分子结构的表示方法和空间构型的分类等方面进行阐述。
首先,分子结构是指分子中原子之间的连接方式和排列。
原子之间的连接通过共价键或离子键实现,而原子之间的排列、相对位置则决定了分子的性质和反应行为。
分子结构的表示通常使用结构式、线角式、空间填充式等形式。
其中,结构式是一种常用的表示方法,它通过线段和点的连接来表达分子中的原子和它们之间的键。
线角式则通过将原子用线段表示,连接处的角度表示键的方向。
空间填充式则是以实心球来表示原子,通过球的大小来表示原子的大小,以及原子之间的空间关系。
这些表示方法可以有效地帮助我们理解分子结构和进行分子的模拟研究。
其次,空间构型描述了分子在三维空间中的排列方式。
分子的空间构型与原子的相对位置和取向有关,因此空间构型也影响着分子的性质和反应机制。
常见的空间构型包括线性构型、平面构型、三角锥构型、四面体构型等。
线性构型指的是分子中原子的排列呈直线状,如氨分子等。
平面构型指的是分子中原子排列在同一平面上,如苯分子等。
三角锥构型指的是分子中一个原子为顶点,其余原子排列在底面的三角形上,如三氯化硼分子等。
四面体构型指的是分子中一个原子为中心,三个原子排列在其周围的三个顶点上,如甲烷分子等。
空间构型的不同将导致分子具有不同的对称性和性质,进而影响分子的化学反应。
另外,化学中的分子结构和空间构型还涉及到立体化学的研究。
立体化学是研究分子空间构型和立体异构体的学科,它对于理解分子的构建和反应机理非常重要。
在研究立体化学时,我们常常使用斜角投影法和虚化键线法等技术来表示分子的三维构型。
斜角投影法是一种常用的表示方法,它使用斜线和角度表示分子中的原子和键,可以清晰地展示分子的空间构型。
分子结构与晶体结构大学化学

反应物浓度、取走产物等方法促进反应进行。
键参数。
键参数 键能。
在298K和100kPa条件下,气态分子断开1mol化学键所
需最低的能量(这里所说的是共价键的键能,不同类型的化
学键有不同的键能。离子键的键能叫晶格能,金属键的键
能叫内聚能)。 (表7.4)列举了一些常见共价键的键能数据。
键能数据不是直接测定的实验值,而是根据大量实验数
02
03
04
05
06
01
长,破坏水质;
可溶性肥料和洗涤剂中的磷酸盐可促使水域中藻类生
农药和冶炼厂排除的AsO2+,可使人体的肾功能衰退,神
CN-可以使人致命。这一切正引起人们的高度重视。
经紊乱;
Cd 2+会损害肾脏,引起骨痛病;
(表7.2)列举了一些重要的共价化合物和用途。
要描述分子中电子的运动状态,按理说应当解分子的
越高,硬度越大。
03
离子半径越小,所带电荷越多,则离子键越强,熔点
02
离子键的强弱应与离子所带电荷、离子半径等有关。
01
例如,NaF和CaO这两种典型离子晶体,前者正负离子
半径之和为0.23nm,后者为0.231nm很接近。谁的熔点高,
硬度大?为什么?
因离子所带电荷数后者比前者多,所以CaO的熔点
02
实际上只是打开π键,保留б键。
03
01
02
03
04
05
在化学反应的过程中,化学键的个数不变,但键能在改
01
变。例如当C=C双键改组成为两个C—C单键时,键能总是
02
了解化学反应过程中有无б键变为π键或π键变为б
04
增加,即:2EC—C>EC=C。
大学化学实验手册:分子结构的测定和分析

Introduction大学化学实验手册是大学化学实验室中的一本重要参考书,它提供了实验的详细步骤、原理和技术要点。
本文将讨论化学实验手册中的一个重要主题:分子结构的测定和分析。
在化学实验室中,分子结构的测定和分析是一项关键任务。
了解分子的结构可以帮助我们理解其性质和行为,从而指导我们在合成、反应和应用中的实际操作。
分子结构的测定和分析涉及到多种方法和技术,包括光谱学、色谱法、质谱法等。
在本文中,我们将介绍几种常用的方法,并探讨它们的原理和应用。
光谱学紫外可见光谱法紫外可见光谱法是一种常用的分子结构测定方法,它利用物质对紫外和可见光的吸收来揭示分子的结构信息。
通过测量物质在不同波长下的吸收光谱,我们可以确定其在分子中的化学键和官能团的存在,从而推断其结构。
紫外可见光谱法的原理是物质吸收光的能量,使得物质中的电子跃迁到高能级,形成吸收峰。
分子中不同化学键和官能团吸收的波长和强度是不同的,因此它们吸收的光谱也不同。
通过比较目标物质的吸收光谱与已知物质的光谱数据库,我们可以确定其结构。
例如,如果我们想确定一个化合物中是否存在双键,我们可以使用紫外可见光谱法。
双键通常会吸收较长的波长,因此我们可以通过测量化合物在紫外和可见光范围内的吸收来判断。
红外光谱法红外光谱法是另一种常用的分子结构测定方法,它利用物质对红外光的吸收来分析其分子结构。
红外光谱法基于物质的化学键振动和分子的旋转振动,通过测量物质在红外光波长范围内的吸收来确定分子的结构。
不同的化学键和官能团会在不同的波数下吸收红外光,形成特定的红外光谱图。
通过比较目标物质的红外光谱图与已知物质的光谱数据库,我们可以确定其结构。
例如,如果我们想确定一个化合物中是否存在羟基(OH官能团),我们可以使用红外光谱法。
羟基通常在3000-3600 cm^-1的波数范围内有明显的吸收峰,因此我们可以通过测量化合物在该波数范围内的吸收来判断。
色谱法色谱法是一种分离和分析化合物的方法,广泛应用于分子结构的测定和分析。
化学分子结构

化学分子结构化学分子结构是研究化学物质的构成和组成方式的重要内容之一。
它描述了化合物中原子之间的连接方式以及它们之间的空间排列关系。
通过了解分子结构,我们可以更深入地理解化学物质的性质和反应行为,为合成新的化合物、改良材料性能和探索新的科学领域开辟了道路。
一、分子结构的基本概念和组成要素化学物质由原子构成,而分子则由原子通过共价键连接而成。
分子结构描述了原子之间的连接方式和它们在空间中的相对位置。
分子结构的主要组成要素包括原子类型、原子间的键、键的角度和键的长度。
1. 原子类型不同种类的化学元素具有不同的原子类型。
每种原子类型都有特定的化学性质和价电子数,从而决定了其参与反应的方式和可能的结构。
常见的原子类型包括氢、氧、碳、氮等。
2. 原子间的键原子之间的连接通过化学键实现。
最常见的化学键类型是共价键,它是通过共享电子对来连接原子的。
共价键可以分为单键、双键和三键,取决于原子之间共享的电子对数量。
除了共价键,还有离子键、金属键和氢键等其他类型的化学键。
3. 键的角度和键的长度键的角度和键的长度也是分子结构的重要特征。
键的角度是指连接两个原子的键的方向相对于分子的相对角度。
键的长度则是指连接两个原子的键的实际长度,它决定了分子的几何形状和空间排列方式。
二、分子结构的表示方法为了更清晰地表达分子结构,化学家们发展了一系列的表示方法。
其中最常见的方法包括结构式、线角式和空间填充式。
1. 结构式结构式是一种二维图形表示方法,它通过化学键和原子符号来描述分子的连接方式。
结构式可以精确地表示化学键的类型、键的角度和键的长度。
其中最常见的结构式包括平面式、简化式和骨架式等。
平面式将分子中的原子和键都画在一个平面上,简化式通过简化分子结构的表示方式来减少图形的复杂性,骨架式则只画出分子的骨架结构。
2. 线角式线角式是一种简化的结构表示方法,它通过线段和角度来描述化学键的连接方式。
线段表示化学键,而角度则表示键的连接方向。
大学化学基础 第3章 分子结构2

HgCl2分子的成键过程: 不存在34, 大键。6p 与 3p轨道能量相差太大
大键对分子性质的影响: 大键的形成产生离域效应
⑴ 使分子稳定性增加 苯: 66 BF3 : 46
⑵
酸碱性改变
RCOOH 酸性大于ROH
因为:RCOO- 中存在34, 大键。H+易作为质子 酸电离。例:苯酚, 78 ;酰胺的碱性比胺 弱,是由于氮原子上孤对电子参与了34大
1S < 1S* < 2S < 2S* < 2Px < 2Py = 2Pz < 2Py*
= 2Pz* < 2Px*
2 py 2 py ( 1s )( 1s )( 2 s )( 2 s )( 2 px ) ( 2 px ) 2 pz 2 pz
O2, F2, Ne2的分子轨道
2Px*
2Py* 2Pz*
2P
2Py 2Pz 2Px 2S* 2S
2P
2S
2S 1S
1S*
1S
1S
C2, N2 分子轨道
2Px*
2P
2Py* 2Pz*
2Px 2Py 2Pz 2S* 1S*
2P
2S 1S
2S 1S
2S
1S
4、分子轨道理论的应用
3、同核双原子分子轨道的能级图 1)分子轨道能级图:H2
σ1s*
能级图(Energy-level-diagram) (a) 氢原子轨道 (b) 氢分子轨道
(1) H2分子的形成
电子排布:( 1s) 2 (2) H2+ :(1s)1 H2电离 出一个电子得到H2+
大学无机化学基础第02章分子结构

陕西师范大学无机化学精品课程陕西师范大学无机化学精品课程第2章 分子结构1.请指出以下各卤化物分子构型,并以化学键理论予以说明:CCl 4,PF 5,SF 6,PCl 3。
答:CCl 4—正四面体,PF 5—三角双锥,SF 6—正八面体,PCl 3—三角锥体。
—三角锥体。
CCl 4中中心碳原子采取sp 3杂化轨道,杂化轨道,与四个与四个Cl 原子形成四个σ键,原子形成四个σ键,成为正四成为正四面体型的分子。
面体型的分子。
PF 5中P 原子采取sp 3d 杂化轨道与5个F 原子形成5个σ,故其分子构型为三角双锥。
双锥。
SF 6中中心S 原子以sp 3d 2杂化轨道与6个F 原子形成6个σ键,故其分子构型为正八面体。
为正八面体。
PCl 3中P 原子采取不等性sp 3杂化轨道与三个氯原子形成三个σ键,另一个杂化轨道尚有一对孤对电子,其分子构型为三角锥型。
化轨道尚有一对孤对电子,其分子构型为三角锥型。
2.根据杂化理论回答下列问题:.根据杂化理论回答下列问题: (1)下表中各种物质中心原子是否杂化轨道成键?为什么?以何种类型杂化轨道成键?分子偶极矩是否为零?轨道成键?分子偶极矩是否为零?(2)NH 3、H 2O 的键角为什么比CH 4小?CO 2的键角为何是180°?乙烯为何取120°的键角?°的键角? 分子 CH 4H 2O NH3CO 2C 2H 4键角 109.5° 104.5° 107° 180° 120°答:(1)上述各物质中心原子均是以杂化轨道成键,因杂化后,原子轨道能更好地有效重叠,形成的分子更稳定。
各杂化类型见下表:地有效重叠,形成的分子更稳定。
各杂化类型见下表:分子 CH 4H 2O NH 3CO 2C 2H 4杂化类型 sp 3sp 3sp 3sp Sp2偶极矩 0大于零大于零大于零 0 0(2)虽然CH 4、H 2O 、NH 3分子中,中心体均采取了sp 3杂化,但在NH 3和H 2O 分子中的N 原子和O 原子上均有孤对电子,它们对成键电子的斥力较大,因而使键角变小。
大学化学 第十一章 分子结构

O2分子轨道能级示意图
O{1s22s22p4}
↿
* 2 p
↿
↿⇂ ↿ ↿
↿⇂ ↿ ↿
* 2 py
* 2 pz
2p 2p
AO
2 * 2 1s 2 * 2 2s
↿⇂
↿⇂
↿⇂ 2p MO
2 2 2
y
z
AO
* 1 2 py
( 1s ) ( ) ( 2s ) ( ) ( 2 px ) ( 2 py ) ( 2 pz ) (
+ •
* • + 1s
+
+
s- s • + •
1s
能 量
H:1s1
AO
s+s MO
σ键
π键
+ +
能 量
同核双原子分子
H2分子轨道能级图
2 1s
↿
AOBiblioteka 1*s↿↿⇂
AO
能 量 增 高
1s MO
MO
AO
2px 2py 2pz
* 2 p
* 2 py
x
AO
z
* 2 p
成键原子轨道间可以通过共享一对或几对 电子形成稳定分子,这种由共享电子对而 形成的化学键叫共价键
共价键的特征:
方向性 饱和性
键参数
键能:表示化学键强弱的物理量 键长:分子中两个原子核之间的距离 键角:分子中键与键之间的夹角 键级:表示原子间成键强度的物理量
成键电子数 反键电子数 键级 2
键矩:表示化学键极性或分子极性大小 的物理量(偶极矩)
大学无机化学《分子结构》 ppt课件
19
sp3杂化轨道示意图
CH4分子的空间结构
ppt课件
20
④ sp3d2杂化 1 ns + 3 np + 2 nd 6 sp3d2 六个sp3d2杂化轨道指向正八面体的六个顶点 sp3d2杂化轨道间的夹角 = 180或90
ppt课件
21
3p 3s
激发态
激发
SF6分子形成
杂化
3d
sp3d2杂化态
② 杂化前后轨道数目不变。
③ 杂化轨道可分为等性和不等性杂化轨道。 采用sp3杂化轨道成键的分子,其空间构型可 能为四面体型,V型或者三角锥型。
③ 单电子键 (如 H2+p)p,t课O件 2具有磁性
6
1927年, Heitler 和 London 应用量子力学研究 H2分子结构, 初步解答了共价键的本质.
1930年, Pauling 和 Slater 等发展出现代价键 理论(电子配对理论)、杂化轨道理论、 价层电子对互斥理论
1932年, 美国化学家密立根和德国化学家洪特 提出分子轨道理论
ppt课件
10
8.2.2 共价键的类型
(1)σ键:两原子的成键轨道沿键轴(或两 核间的连线)的方向,以“头碰头”的方式 发生轨道重叠,轨道重叠部分是沿着键轴呈 圆柱型对称,这样形成的共价键叫σ键。
++
x
s-s
—
++
x
px-s
—
++
—
x
ppt课件
px- px
11
(2)π键:两个原子轨道沿键轴的方向,通过键轴的
另一方有空轨道。
例:NH
4
H
HNH
H
BF4
CO
大学化学(无机类)第4化学键与分子结构(授课讲义)

键
Lb/pm E /kJ· mol-1
键
Lb/pm E /kJ· mol-1
4-1-3 键角
已知分子的键长和键角 , 键角:在分子中两个相邻化学键之间的夹角 ′ 就可确定分子的几何构型。 V形
′
6-1-3键角 直线形
′
三角锥形
正四面体形
第二节价键理论
第二节 共价键理论
4-2-1 路易斯理论
Lewis 认为,同种原子之间以及电负性相近的 原子之间可以通过共用电子对形成分子,通过共用
F F \ / ¨ →F–S–F [¨ ·S·] + 6[·F:] / \ ¨ ¨ F F
3s
3p
3d
3s
3p
3d
共价键特征
方向性:为满足最大重叠原理,成键时原 子轨道只能沿着轨道伸展的方向重叠。
+
+ +
-
+
-
+ +
原子轨道的重叠
原子轨道重叠的对称性原则
只有当原子轨道对称性相同的部分重叠,原子 间的概率密度才会增大,形成化学键。
键 Lb/pm C-C 154 金刚石 153 乙烷 154 丙烷 155
同一种键在不同分子中,键长基本是个定值。
键长越短,键能越大,化学键越牢固 。 C-C C=C C≡C 键
Lb/pm E /kJ· mol-1 154 356 N-N 146 160 C-N 147 285 134 598 N=N 125 418 C=N 132 616 120 813 N≡N 109.8 946 C≡N 116 866
+ _
+ _
杂化类型
sp杂化——1个s 轨道+1个p 轨道
大学化学必备知识点

大学化学必备知识点化学作为一门重要的自然科学学科,对于大学理工科学生来说是必修课程之一。
大学化学课程内容丰富多样,其中有一些知识点是学习化学必不可少的基础知识。
本文将从基本概念到实验技巧,为大家整理出大学化学必备的知识点。
一、化学基本概念1. 原子结构:原子由质子、中子和电子构成,质子和中子位于原子核内,电子绕核运动。
原子的核电荷数等于电子数,为中性。
2. 元素:由具有相同原子序数(即原子核内质子数)的原子组成,可以通过化学符号(如H、O、C等)来表示。
3. 化合物:由两种或两种以上不同的元素以固定比例结合而成的物质。
4. 分子:具有独立存在和化学性质的最小粒子。
5. 物质状态:包括气体、液体和固体。
二、化学键与分子结构1. 价键:原子通过共用电子对结合形成分子的化学键。
2. 共价键:形成于非金属之间,共享电子对。
3. 离子键:形成于金属和非金属之间,电子从金属原子转移到非金属原子形成带电离子。
4. 金属键:金属中的原子通过共享电子云相连。
5. 分子结构:分子的空间排列方式,包括线性、平面和立体结构。
三、化学反应与平衡1. 化学方程式:化学反应的化学平衡表示方式。
2. 摩尔比:表示反应物和生成物之间的摩尔比例关系。
3. 摩尔质量:指一个元素或化合物相对分子或原子质量。
4. 反应速率:指单位时间内反应物浓度的变化。
5. 化学平衡:反应物和生成物数量达到一定比例的状态。
四、溶液与溶剂1. 溶解度:指在一定温度下,溶质在溶剂中溶解成饱和溶液的最大量。
2. 浓度:溶液中溶质的质量或摩尔量与溶剂质量或体积的比值。
3. 饱和溶液:在一定温度下,溶解度达到最大的溶液。
4. 离子溶液:在水中可以电离成离子的溶质。
5. 非离子溶液:在水中不能电离成离子的溶质。
五、化学实验技巧1. 实验室安全:化学实验时需注意实验室安全常识,包括戴安全镜、穿实验服等。
2. 试剂的使用:实验中需准确使用试剂,按照实验要求称量和混合试剂。
大学无机化学~~~分子结构

19
● sp2杂化 2p 2s
excited
2p sp2 2s
2s2p轨道
hybridization three sp2 hybrid orbital
F B + 3F B
F
F
20
● sp杂化 2p 2s
excited
Configuration of Be in ground state Hybrid orbital
•
28
2 分子轨道的形成
一、原子轨道线性组合 例如两个原子A和B的原子轨道ψ a和ψ b 组成分子轨 道时,线性组合方式如下: Ψ A=ψ a+ψ b Ψ B=ψ a-ψ b 线性组合时,有多少个原子轨道,就组合成多少个分 子轨道。 Ψ B(反键轨道)
A
B
Ψ A(成键轨道)
29
从原子轨道到分子轨道
3
1 化学键分类
• 1) 化学键: 分子中原子结合在一起的 强烈的相互作用,称为化学键。 • 2 )化学键主要分为: • 离子键、共价键、配位键和金属键 四大类型。键的强弱可用键参数衡量。
4
离子键
离子键 —— 即成键原子得失电子后形 成正、负离子,正、负离子间靠静 电引力结合在一起而形成的化学键。 • 特点:无方向性,无饱和性。
具体地说就是: S-S S─Px Px─Px
Py
Pz
Py─Py
Pz─Pz
是对称性一致的。它们可以组合成分子轨道。
S─Py, Px─Py, Px─Pz
是对称性不一致的。
31
它们不能组合成分子轨道。
(2)、最大重叠原则──对称性一致的原子轨道
组合成分子轨道时,总是按照最大重叠方向进行组合。
大学无机化学第2章分子结构

sp 2个sp杂化轨道
sp杂化
上页
下页
回主目录
返回
hyzh@
BeCl2
Be:1s22s2
Cl:1s22s22p63s23p5
BeCl2 键角 θ=180° 直线型分子
上页 下页 回主目录 返回
hyzh@
(2)sp2杂化轨道:由1个s轨道和2个p轨道杂化得到 3个等同的sp2杂化轨道。每个轨道含有1/3 s和2/3 p的 成分,3个轨道处于同一平面,每个轨道间的夹角为 120º 。例如: BF3的形成 2p 2s 2 1 基态B价层电子排布: 2s 2p
1. s-p等性杂化 (1)sp杂化:1个s轨道和1个p轨道杂化得到两个等 同的sp杂化轨道。每个轨道含有0.5s和0.5p的成分,
两个轨道间的夹角为180º 。例如:BeCl2的形成
基态Be价层电子排布:2s2
2s
2p
在BeCl2分子形成中,Be原子轨道的杂化过程如下:
2s
2p
激发
2s
2p
激发态
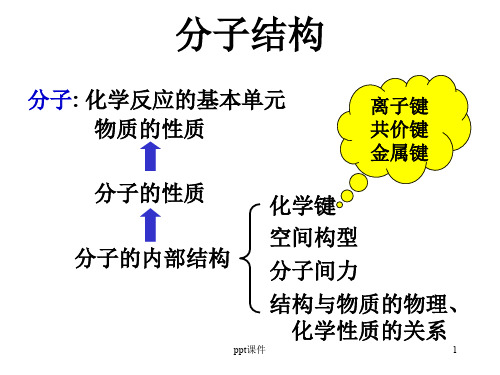
第二章 分子结构 Molecular structure
新乡医学院化学教研室 范 秉 琳
E-mail: yaoxuejianyan@
Password: yaojian2015
物质的性质
分子的性质
分子的结构
化学键(chemical
bond)
分子中直接相邻的原子间强的相互作用 称为化学键。
2. 共价键的方向性:因为各原子轨道在空间分布方
向是固定的,为了满足轨道的最大程度重叠,原子 间形成的共价键,当然要具有方向性。
(三)共价键的类型
1.键: •成键轨道沿键轴方向头碰头重叠 •轨道重叠部分沿键轴呈圆柱形对称 •是最大重叠,可旋转,稳定性高
大学有机化学分子结构教案

课时安排:2课时教学目标:1. 使学生掌握有机化学分子结构的基本概念和特点。
2. 培养学生运用有机化学知识分析和解决实际问题的能力。
3. 提高学生对有机化学分子结构的认识和兴趣。
教学内容:1. 有机化学分子结构的基本概念2. 常见有机分子结构的分类与特点3. 分子结构分析方法教学过程:第一课时一、导入1. 回顾有机化学的基本概念,引导学生思考有机化学分子结构的特点。
2. 提出问题:为什么有机化合物的种类如此繁多?它们之间有什么内在联系?二、有机化学分子结构的基本概念1. 有机化学分子结构是指有机化合物中原子之间的空间排列和连接方式。
2. 分子结构对有机化合物的性质和反应具有决定性作用。
三、常见有机分子结构的分类与特点1. 烃类分子结构:碳原子以单键相连,形成链状、环状或支链状结构。
2. 醇类分子结构:含有羟基(-OH)的有机化合物,羟基可以位于碳链的末端或中间。
3. 酚类分子结构:羟基直接连接在苯环上的有机化合物。
4. 醛类分子结构:含有醛基(-CHO)的有机化合物,醛基位于碳链的末端。
5. 酮类分子结构:含有酮基(>C=O)的有机化合物,酮基位于碳链的中间。
四、分子结构分析方法1. 红外光谱法:通过分析有机化合物分子中不同官能团的特征吸收峰,确定其分子结构。
2. 核磁共振氢谱(1H NMR):通过分析有机化合物分子中不同氢原子的化学位移,确定其分子结构。
3. 核磁共振碳谱(13C NMR):通过分析有机化合物分子中不同碳原子的化学位移,确定其分子结构。
第二课时一、巩固练习1. 让学生列举常见的有机分子结构类型,并简要介绍其特点。
2. 让学生分析给定的有机化合物,判断其分子结构类型。
二、案例分析1. 分析一个具体的有机化合物,通过红外光谱法、核磁共振氢谱和核磁共振碳谱等手段,确定其分子结构。
2. 引导学生思考如何运用所学知识解决实际问题。
三、总结1. 回顾有机化学分子结构的基本概念、分类与特点。
大学无机化学经典课件:分子结构

已知:F- 的半径 r = 133Pm
规律: rMn+< rM ; rMn- > rM rNa+ > rMg2+ > rAl3+
rF- < rCl- < rBrrFe3+ < rFe2+
键型过渡:成键两元素的电负性差值 越大,键的极性越强
32
离子键的强度通常用晶格能的大小来衡量。因为在离 子晶体中,既有相反电荷之间的库仑吸引力,又有相同电 荷之间的排斥力,所以离子化合物中离子键力是晶体中吸 引力和排斥力综合平衡的结果。
δ键:一个原子的d轨道与另一个原子相 匹配的d轨道以“面对面”的方式重
叠 (通过键轴有两个节面)
20
σ
π
键 , 键 的 不 同
21提供而形成的
形成配位键的必备条件: 1)一个原子价电子层有孤对电子 2)另一原子价电子层有空轨道。
如:CO分子
22
4 . 键的极性
价电子对排布方式为:当价电子对的数目为 2 时,呈 直线形;当价电子对的数目为 3 时,呈平面三角形;当价 电子对的数目为 4 时,呈正四面体形;当价电子对的数目 为 5 时,呈三角双锥形;当价电子对的数目为 6 时,呈八 面体形。
55
(3)对于只含共价单键的 ABn 型分子,若中心原子 的价层中有 m 个孤电子对,则其价层电子对总数是 n + m 对。
对数 型
子对的排
m ABnLm 布方式
0 AB5
1 AB4L
分子的
几何构 型
实例
三角 双锥 形
变形 四面 体
PF5,PCl5, AsF5
SF4,TeCl4
3 2 AB3L2
大学化学实践:分子结构模型制作教案

大学化学实践:分子结构模型制作教案1. 引言1.1 概述在大学化学教育中,实践是培养学生实际操作能力和科学思维的重要环节之一。
分子结构模型制作是化学实践中一项关键的技能,它能够帮助学生更好地理解和掌握分子结构,加深对其中化学原理的认识。
通过自己亲手制作分子结构模型,学生可以将抽象的化学概念具象化,提高自己的空间想象和创造力。
1.2 文章结构本文主要包括五个部分。
首先是引言部分,介绍了大学化学实践和分子结构模型制作教案的背景和意义。
其次是正文部分,详细阐述了本文讨论的主要内容及相关知识。
接下来,在第三部分将给出一个具体示例——分子结构模型制作教案,包括教学目标、实验步骤以及材料与仪器准备等内容。
然后,在第四部分将进行总结,并探讨该实践对于学生的启发和影响以及在实践过程中可能遇到的挑战和解决方法。
最后,在第五部分会对整篇文章进行总结,并展望未来可能的改进方向和研究方向。
1.3 目的本文的主要目的是以大学化学实践为背景,针对分子结构模型制作教案进行详细探讨。
通过引言部分,读者能够了解到这篇文章的整体框架、内容和目标。
本文旨在提供一个有关分子结构模型制作教案的全面指南,帮助教师设计出更有效、富有启发性的实践活动,并且对相关教育工作者、学生和研究人员具有一定的参考价值。
2. 正文:大学化学实践是化学教育中重要的一环,通过理论与实验相结合的方式,帮助学生更好地理解和应用所学的化学知识。
其中,分子结构模型制作教案是一种常见而有效的实践活动。
本节将详细介绍分子结构模型制作教案在大学化学实践中的意义、步骤、材料与仪器准备等方面内容。
2.1 分子结构模型制作教案的意义分子结构模型是一种以可视化形式展示分子结构和化学键之间关系的工具。
通过亲身参与分子结构模型制作,学生不仅能够深入理解分子间相互作用的规律,还可以巩固对有机化合物、无机离子等复杂结构的理解。
此外,制作分子结构模型还能培养学生观察、动手操作和团队合作能力,提高他们在实验中遇到问题时进行思考和解决问题的能力。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
形成条件:成键原子一方有 孤对电子,另一方有空轨道。
表示方法:用“→”表示, 箭头方向由给予 体指向接受体。
例:NH
4
H
H N H
H
上一页
下一页
本章目录
§7.3 杂化轨道理论
所谓杂化是指在形成分子时,由于原子的 相互影响,若干不同类型、能量相近的原子轨 道混合起来,重新组合成一组新轨道,这种轨 道重新组合的过程叫做杂化。所形成的新轨道 称为杂化轨道。
r(Na+) > r(Mg2+) > r(Al3+) r(F-) < r(O2-) ⑶同一元素负离子半径大于原子半径,正离
子半径小于原子半径,且正电荷越高半径 越小。如
r(S2-) > r(S) r(Fe3+) < r(Fe2+) < r(Fe)
上一页
下一页
本章目录
3.离子的电子构型:即形成离子后的电子构 型。
参加杂化的轨道s+p s+(2)p s+(3)p s+(3)p
杂化轨道数 2 3 4
4
成键轨道夹角 180o 120 109 o28' 90 o 109 28'
分子空间构型
实例 中心原子
直线形 三角形 四面体 三角锥 V型
BeCl2 BF3 CH4 HgCl2 BCl3 SiCl4
Be(ⅡA) B(ⅢA) C,Si
上一页
下一页
本章目录
例如: 两个原子轨道ψa,ψa组合得到两个 分子轨道ψⅠ, ψⅡ:
Ψ I CaΨa CbΨ b
Ψ II CaΨ a CbΨ b
式中:ψa,ψb—原子轨道 ψⅠ— 成键分子轨道; ψⅡ— 反键分子轨道
Ca,Cb—系数,表示原子轨道对分子轨道的贡 献程度
上一页
下一页
本章目录
本章目录
由离子键形成的化合物叫离子化合物,它们以 离子晶体存在,如NaCl。ⅠA、ⅡA金属阳离子(Be 除外)与ⅦA非金属阴离子可形成典型的离子型化合 物。
在离子晶体中无法 分辨出一个个独立的 “分子”。所以,NaCl、 KCl均为化学式,而非 分子式。
NaCl晶体结构 (红球-Na+ , 绿球-Cl-)
)2
(
2p
)2
或
KK
(
2s
)2
(
* 2s
)2
(
π
2
p
x
)2
(π2
p
y
)2
(
2
p
)
2
B.O = 1/2( 10 - 4 ) = 3
O2
(1s
)2
(1*s
)2
(
2s
)2
(
* 2s
)2
(
2p
)2
(π2px
)2
(π2py
)2
(π*2p
x
)1 (π*2p
y
)1
或
KK
(
2s
)2
(
* 2s
)2
(
2p
)2
(
π2px
上一页
下一页
本章目录
二、杂化轨道类型
1.sp杂化
2s 2p
Be:2s2
BeCl2的空间构型为直线形 Cl Be Cl
2p
2p
2s
激发 2s
sp sp杂化
Be采用sp杂化
生成BeCl2
上一页
下一页
本章目录
2.sp2杂化
BF3的空间构型 为平面三角形
F
B
F
F
B: 2s22p1
2p
2s
上一页
下一页
本章目录
杂化轨道与其他原子的原子轨道重叠形成 化学键。
上一页
下一页
本章目录
一、理论的基本要点: • 只有能量相近的轨道才能相互杂化。常见的
有ns np , ns np nd和(n-1)d ns np杂化。
• 杂化后轨道伸展方向、形状发生和能量改变, 成键能力增强。
• 一定数目的原子轨道杂化后,可得数目相 同、能量相等的杂化轨道。
第四章 物质结构
Ⅱ.分子结构
4.4 离子化合物 4.5 共价化合物 4.6 杂化轨道理论 4.7 分子间力和氢键
上一页
下一页
章本总章目目录录
学习要求:
1.掌握离子键理论的基本要点,理解决定离子化 合物性质的因素及离子化合物的特征;
2.掌握电子配对法及共价键的特征;
3.掌握、运用杂化轨道理论来解释一般分子的构 型;
2.离子半径:根据正、负离子的核间距即正、 负离子的有效半径之和测得。离子半径越小, 离子间吸引力越大,相应化合物熔点也越高。
上一页
下一页
本章目录
离子半径变化的规律: ⑴同族元素离子半径从上而下递增。如
r(Li+) < r(Na+) < r(K+) < r(Rb+) < r(Cs+) r(F-) < r(Cl-) < r(Br-) < r(I-) ⑵同周期正离子半径随离子电荷增加而减小, 负离子半径随电荷增加而增大。如:
又叫范德华力。
(1)色散力:由于瞬时偶极而产生的分子间 相互作用。
+_
一大段时间内的大体情况
+_ +_
每一瞬间
+_ +_
非极性分子的瞬时偶极之间 的相互作用
上一页
下一页
本章目录
(2)诱导力:由于诱导偶极而产生的分子 间相互作用力。
+_
+ _ +_
分子离得较远
分子靠近时
决定诱导作用强弱的因素:
• 极性分子的偶极矩: μ愈大,诱导作用愈强。
分子轨道的能量 高低目前主要是从光 谱数据测定的。
上一页
下一页
本章目录
第二周期同核双原子分子轨道能级示意图
上一页
下一页
本章目录
N2 电 子 排 布
上一页
下一页
本章目录
O2
电 子 排 布
上一页
下一页
本章目录
分子轨道电子排布式:
N2
(1s
)2
(1*s
)2
(
2s
)2
(
* 2s
)2
(π2px
)2
(π2py
- ++ -
上一页
下一页
本章目录
(2) 键——“肩并肩”
PZ - PZ
++ --
上一页
下一页
本章目录
键轨道重叠程度大于键,所以键较 键稳定, 键是化学反应的积极参与者。
两原子间形成的共价健,若为单键,必为 键;若为多重健,必有一条是键。如N2:
上一页
下一页
本章目录
(3)配位键 定义:由一个原子提供电子对为两个原子共
上一页
下一页
本章目录
二、离子键的特征
(1) 离子键的本质是静电引力 (2)无方向性和饱和性:
(3)键的离子性大小取决于电负性差值大小 电负性差值越大,相互作用越强。典
型的离子化合物也有共价成分。
上一页
下一页
本章目录
二、离子的特征
离子的性质很大程度上决定着离子型化合物 的性质。
1.离子电荷:离子电荷越高、静电引力越强, 则离子键越强,相应化合物熔点越高。
正、负电荷中心不重合者 分子有极性,极性分子
上一页
下一页
本章目录
分子极性的量度 —— 偶极矩μ
μ= q ·d
q:正(负)电荷中心(电荷集中点)的电量 d:正(负)电荷中心的距离
偶极矩是一个矢量,其方向是从正极到
负极。单位为C·m。μ=0,为非极性分子, μ越大,分子极性越大。
上一页
下一页
本章目录
化学键的极性与分子极性的关系
上一页
下一页
本章目录
§7.1 离子键
一、离子键的形成 离子键理论的基本要点:当电负性很小的
金属原子和电负性很大的非金属原子相互靠近 时,前者易失去电子形成具有稳定电子结构的 阳离子,后者易得到电子形成具有稳定电子结 构阴离子。而正、负离子靠静电引力作用结合 在一起,这种静电引力作用称为离子键。如 NaCl的形成。
对于双原子分子:键有极性、分子就有极性
(键的极性与分子的极性一致,而且键越强, 分子的极性也越强)。
HF>HCl>HBr>HI
对于多原子分子:含极性键的多原子分子不一定
是极性分子,还与分子的空间构型有关系
如:CH4 CCl4 无极性,
CHCl3 有极性
上一页
下一页
本章目录
二、分子间力 定义: 分子间的相互作用称为分子间力,
原子轨道与分子轨道的能量
上一页
下一页
本章目录
原子轨道与分子轨道的形状
上一页
下一页
本章目录
3.原子轨道线性组合成分子轨道的原则
①对称性匹配
②能量相近
③最大重叠
4.电子在分子轨道上的排布也遵循原子轨道 电子排布的三原则:
①保里不相容原理
②能量最低原理
③洪特规则
上一页
下一页
本章目录
二、 能级图
按照分子轨道对 称性不同,可将分子 轨道分为σ轨道和π 轨道。
➢(18+2 )电子构型[(n-1)S2(n-1)P6(n-1)d10nS2 ]: Pb2+ 、Sn2+
➢离子的电子构型不同,对键型及性质影响很大.
➢不同电子构型阳离子对同种负离子的作用力: 8e构型< 9~17 e构型 < 2e,18 e,(18+2 )e构型;
