新人教版高二化学选修3:3.1晶体常识(第2课时)教案 Word版
新人教版高二化学选修3:分子晶体(第2课时)教案 Word版

第二課時〖教學目標設定〗1、掌握原子晶體的概念,能夠區分原子晶體和分子晶體。
2、瞭解金剛石等典型原子晶體的結構特徵,能描述金剛石、二氧化矽等原子晶體的結構與性質的關係。
〖教學難點重點〗原子晶體的結構與性質的關係〖教學過程設計〗復習提問:1、什麼是分子晶體?試舉例說明。
2、分子晶體通常具有什麼樣的物理性質?引入新課:閱讀:P71 ,明確金剛石的晶型與結構歸納:1.原子晶體:相鄰原子間以共價鍵相結合而形成的空間網狀結構的晶體。
2.構成粒子:原子;3.粒子間的作用:共價鍵;展示:金剛石晶體結構4.原子晶體的物理性質熔、沸點_______,硬度________;______________一般的溶劑;_____導電。
思考:(1)原子晶體的化學式是否可以代表其分子式,為什麼?(2)為什麼金剛石的熔沸點很高、硬度很大?(3)閱讀:P72 ,討論“學與問 1 ”歸納:晶體熔沸點的高低比較①對於分子晶體,一般來說,對於組成和結構相似的物質,相對分子品質越大,分子間作用力越大,物質的熔沸點也越高。
②對於原子晶體,一般來說,原子間鍵長越短,鍵能越大,共價鍵越穩定,物質的熔沸點越高,硬度越大。
合作探究:(1)在金剛石晶體中,每個C與多少個C成鍵?形成怎樣的空間結構?最小碳環由多少個石中,含CC原子組成?它們是否在同一平面內?(2)在金剛石晶體中,C原子個數與C—C鍵數之比為多少?(3)12克金剛—C鍵數為多少N A?比較:CO2與SiO2晶體的物理性質閱讀:P72 ,明確SiO2的重要用途推斷:SiO2晶體與CO2晶體性質相差很大,SiO2晶體不屬於分子晶體展示:展示SiO2的晶體結構模型(看書、模型、多媒體課件),分析其結構特點。
引導探究:SiO2和C02的晶體結構不同。
在SiO2晶體中,1個Si原子和4個O原子形成4個共價鍵,每個Si原子周圍結合4個O原子;同時,每個O原子跟2個Si 原子相結合。
實際上,SiO2晶體是由Si原子和O原子按1:2的比例所組成的立體網狀的晶體。
147.新人教版高二化学选修3:3.3金属晶体(第2课时)教案 Word版

第二课时【教材内容分析】晶体知识和分子晶体、原子晶体已经做了介绍,学生对晶体内微粒的空间排列有了初步的认识。
学生自己探究金属晶体的结构有了可能。
【教学目标设定】1.了解金属晶体内原子的几种常见排列方式2.训练学生的动手能力和空间想象能力。
3.培养学生的合作意识【教学重点难点】金属晶体内原子的空间排列方式【教学方法建议】活动探究【教学过程设计】【引入】分子晶体中,分子间的范德华力使分子有序排列;原子晶体中,原子之间的共价键使原子有序排列;金属晶体中,金属键使金属原子有序排列。
今天,我们一起讨论有关金属原子的空间排列问题。
【分组活动1】利用20个大小相同的玻璃小球,有序地排列在水平桌面上(二维平面上),要求小球之间紧密接触。
可能有几种排列方式。
讨论每一种方式的配位数。
(配位数:同一层内与一个原子紧密接触的原子数)【学生活动1】学生分四组活动,各由一人汇报结果。
利用多媒体展示,学生排列结果主要介绍以下两种方式。
(配位数:同一层内与一个原子紧密接触的原子数)非密置层,配位数4 密置层,配位数6我们继续讨论,原子在三维空间的排列。
首先讨论非密置层这种情况。
【学生活动2】非密置层排列的金属原子,在空间内可能的排列。
汇总各类情况逐一讨论。
(一)简单立方体堆积这种堆积方式形成的晶胞是一个立方体,每个晶胞含1个原子,被称为简单立方堆积。
这种堆积方式的空间利用率太低,只有金属钋采取这种堆积方式。
(二)钾型如果是非密置层上层金属原子填入下层的金属原子形成的凹穴中,每层均照此堆积,如下图:这种堆积方式的空间利用率显然比简单立方堆积的高多了,许多金属是这种堆积方式,如碱金属,简称为钾型。
模块学习评价(时间:90分钟分值:100分)一、选择题(每小题3分,共54分)1.下列叙述正确的是()A.容量瓶、滴定管、蒸馏烧瓶、量筒等仪器上都具体标明了使用温度B.冷浓硫酸保存在敞口的铅制的容器中C.为了使过滤速率加快,可用玻璃棒在过滤器中轻轻搅拌,加速液体流动D.KNO3晶体中含有少量NaCl,可利用重结晶的方法提纯【解析】蒸馏烧瓶没有规定使用温度;铅不能被冷浓硫酸钝化,铅制容器不能用来盛放浓硫酸;过滤时不能用玻璃棒搅拌。
高中化学人教版选修三 物质结构与性质高中化学选修三3.1晶体常识 教案2

优质资料---欢迎下载江苏省兴化楚水实验学校高二化学集体备课教案 科目 化 学 年级 高二 班级 时间课题 第一节 晶体常识(第1课时 )(知识、能力、品德)教学目标 1、通过实验探究理解晶体与非晶体的差异。
2、学会分析、理解、归纳和总结的逻辑思维方法,提高发现问题、分析问题和解决问题的能力。
3、了解区别晶体与非晶体的方法,认识化学的实用价值,增强学习化学的兴趣。
(重点、难点) 教 材 分 析重点:1、晶体与非晶体的区别 2、晶体的特征 难点:1、晶体与非晶体的区别 2、晶体的特征板书设计示意框图 一、晶体与非晶体1、晶体与非晶体的本质差异2、晶体形成的一段途径:(1)熔融态物质凝固; (2)气态物质冷却不经液态直接凝固(凝华); (3)溶质从溶液中析出 3、晶体的特点:(1)有固定的几何外形;(2)有固定的熔点;(3)有各向异性。
4、晶体的定义:一、晶胞定义:晶体结构中的基本单元叫晶胞二、晶胞中原子个数的计算方法:位于晶胞顶点的微粒,实际提供给晶胞的只有1/8;位于晶胞棱边的微粒,实际提供给晶胞的只有1/4;位于晶胞面心的微粒,实际提供给晶胞的只有1/2;位于晶胞中心的微粒,实际提供给晶胞的只有1。
练习:1、现有甲、乙、丙、丁四种晶胞(如图2-8所示),可推知:甲晶体中A 与B的离子个数比为;乙晶体的化学式为;丙晶体的化学式为______;丁晶体的化学式为______。
2、钙-钛矿晶胞结构如图2-9所示。
观察钙-钛矿晶胞结构,求该晶体中,钙、钛、氧的微粒个数比为多少?3、晶体硼的基本结构单元都是由硼原子组成的正二十面体,其中含有20个等边三角形的面和一定数目的顶角,每个顶角各有一个硼原子。
如图2-10所示,回答:(1)键角____;(2)晶体硼中的硼原子数____个;B—B键____条?4、在碳单质的成员中还有一种混合型晶体——石墨,如图2-11所示。
它是层状结构,层与层之间依靠作用力相结合。
新人教版高二化学选修3:3.1晶体常识(第2课时)教案 word版

前言我们分析每年考上清华北大的北京考生的成绩,发现能够考上清北的学生化学的平均分都在95分以上,先开始我们认为,学习能力强的孩子化学一定学得好。
可是在分析没有考上清北的学生的成绩的时候发现,很多与清北失之交臂的学生,化学的平均分要略低,数学物理的分数却不相上下。
我们仔细讨论其中的缘由,通过对学生的调查研究发现一个令人惊讶的结论:化学学的好的学生更容易在理综上考得高分!这是因为化学学的好的学生,能够用更快的速度在理综考试中解决100分的分值,之后孩子可以用更多的时间去处理没有见过的物理难题。
物理的难题在充分的时间中得到更多考虑的空间,使得考生在理综总分上能够有所突破。
所以想上好大学,化学必须学好,化学的使命就是在高考当中帮助考生提速提分。
因此这份资料提供给大家使用,主要包含有一些课件和习题教案。
后序中有提到一些关于学习的建议。
第二课时一、晶胞定义:晶体结构中的基本单元叫晶胞二、晶胞中原子个数的计算方法:位于晶胞顶点的微粒,实际提供给晶胞的只有1/8;位于晶胞棱边的微粒,实际提供给晶胞的只有1/4;位于晶胞面心的微粒,实际提供给晶胞的只有1/2;位于晶胞中心的微粒,实际提供给晶胞的只有1。
练习:1、现有甲、乙、丙、丁四种晶胞(如图2-8所示),可推知:甲晶体中A与B的离子个数比为;乙晶体的化学式为;丙晶体的化学式为______;丁晶体的化学式为______。
2、钙-钛矿晶胞结构如图2-9所示。
观察钙-钛矿晶胞结构,求该晶体中,钙、钛、氧的微粒个数比为多少?3、晶体硼的基本结构单元都是由硼原子组成的正二十面体,其中含有20个等边三角形的面和一定数目的顶角,每个顶角各有一个硼原子。
如图2-10所示,回答:(1)键角____;(2)晶体硼中的硼原子数____个;B—B键____条?4、在碳单质的成员中还有一种混合型晶体——石墨,如图2-11所示。
它是层状结构,层与层之间依靠作用力相结合。
每层内部碳原子与碳原子之间靠作用力相结合,其键角。
高中化学人教版选修3教案-3.1 晶体的常识
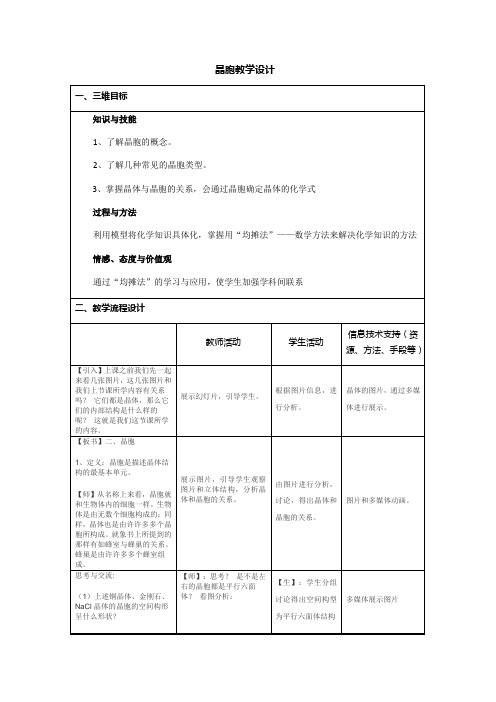
(1)上述铜晶体、金刚石、NaCl晶体的晶胞的空间构形呈什么形状?
(2)在上述晶体中,晶胞是如何排列的?晶胞之间是否存在空隙?
【师】:思考?是不是左右的晶胞都是平行六面体?看图分析:
【生】:学生分组讨论得出空间构型为平行六面体结构
【生】:不是所有的晶胞都是平行六面体,应该是大多数是平行六面体。
多媒体展示图片
【板书】2、晶胞的特点:
(1)大多是平行六面体。
(2)排列方式:“无隙并置”
【板书】3、计算晶体化学式或晶胞中粒子数的一般方法——均摊法
下面我们一起来看一个小视频来分析一下。
【师】:通过视频我们可以明显的看出顶点的原子是被八个晶胞所拥有,所以我们可以得出结论:
【板书】⑴顶点——同时为8个晶胞所共有——每一个晶胞拥有:1/8;
【随堂练习】
练习1:现在我们一起再来回顾一下在一个氯化钠晶胞里是13个钠离子,多少14氯离子?
生:不是
氯离子:8*1/8+6*1/2=4
钠离子:1+12*1/4=4
【学与问】
金属钠:8×1/8+1 =2
金属锌:8×1/8+1 = 2
晶体碘:(8×1/8+6×1/2)×2 = 8
金刚石:8×1/8+6×1/6+4 = 8
【师】:在立方晶胞中,粒子可能出现在到下这几个位置:
【师】:当原子位于顶点时这个原子将被八个晶胞所共用,就像我手中的八个晶胞模型一样,每一个晶胞只拥有该原子的1/8.
【生】:氯离子:8个顶点各有一个,6个面上各有一个,一共是14个铜原子。
钠离子:12在棱的中点1个在体心
共13个
顶点:1/8
棱上:?
面心:?
晶胞教学设计
一、三维目标
新人教版高二化学选修3:3.2分子晶体(第2课时)教案 Word版

第二课时〖教学目标设定〗1、掌握原子晶体的概念,能够区分原子晶体和分子晶体。
2、了解金刚石等典型原子晶体的结构特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。
〖教学难点重点〗原子晶体的结构与性质的关系〖教学过程设计〗复习提问:1、什么是分子晶体?试举例说明。
2、分子晶体通常具有什么样的物理性质?引入新课:阅读:P71 ,明确金刚石的晶型与结构归纳:1.原子晶体:相邻原子间以共价键相结合而形成的空间网状结构的晶体。
2.构成粒子:原子;3.粒子间的作用:共价键;展示:金刚石晶体结构4.原子晶体的物理性质熔、沸点_______,硬度________;______________一般的溶剂;_____导电。
思考:(1)原子晶体的化学式是否可以代表其分子式,为什么?(2)为什么金刚石的熔沸点很高、硬度很大?(3)阅读:P72 ,讨论“学与问 1 ”归纳:晶体熔沸点的高低比较①对于分子晶体,一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔沸点也越高。
②对于原子晶体,一般来说,原子间键长越短,键能越大,共价键越稳定,物质的熔沸点越高,硬度越大。
合作探究:(1)在金刚石晶体中,每个C与多少个C成键?形成怎样的空间结构?最小碳环由多少个石中,含CC原子组成?它们是否在同一平面内?(2)在金刚石晶体中,C原子个数与C—C键数之比为多少?(3)12克金刚—C键数为多少N A?比较:CO2与SiO2晶体的物理性质阅读:P72 ,明确SiO2的重要用途推断:SiO2晶体与CO2晶体性质相差很大,SiO2晶体不属于分子晶体展示:展示SiO2的晶体结构模型(看书、模型、多媒体课件),分析其结构特点。
引导探究:SiO2和C02的晶体结构不同。
在SiO2晶体中,1个Si原子和4个O原子形成4个共价键,每个Si原子周围结合4个O原子;同时,每个O原子跟2个Si 原子相结合。
实际上,SiO2晶体是由Si原子和O原子按1:2的比例所组成的立体网状的晶体。
人教版高中化学选修三教案-3.1 晶体的常识

第三章晶体的结构与性质第一节晶体的常识【教学目标】1、了解晶体的初步知识,知道晶体与非晶体的本质差异,学会识别晶体与非晶体的结构示意图。
2、知道晶胞的概念,了解晶胞与晶体的关系,学会通过分析晶胞得出晶体的组成。
3、培养空间想象能力和进一步认识“物质结构觉得物质性质”的客观规律。
【教学重点】晶体、晶胞的概念。
【教学难点】计算晶胞的化学式。
【教学过程】[导入]走进化学实验室,你能见到许多固体,如蜡状的白磷(P4)、黄色的硫黄、紫黑色的碘(I2)和高锰酸钾(KMnO4)、蓝色的硫酸铜(CuSO4·5H20)、白色的碳酸钙等。
放眼世界,自然界中绝大多数矿物也都是固体。
你一定还能说出生活中常见的更多的固体,如金属、玻璃、陶瓷、砖瓦、水泥、塑料、橡胶、木材……你是否知道固体有晶体和非晶体之分?绝大多数常见的固体是晶体,只有如玻璃之类的物质属于非晶体(又称玻璃体)。
晶体与非晶体有什么本质的差异呢?今天我们开始学习…。
[板书] 第三章晶体的结构与性质第一节晶体的常识[投影]常见的晶体(或展示实物):[思考]晶体规则的几何外型与组成晶体的微粒在空间的存在什么关系?[投影]表3-1晶体与非晶体的本质差异[讲解]即自动发生的过程。
不过,“自发”过程的实现,仍需要一定的条件。
例如,水能白发地从高处流向低处,但不打开拦截水流的闸门,水库里的水就不能下泻。
晶体呈现自范性的条件之一是晶体生长的速率适当。
熔融态物质冷却凝固,有时得到晶体,但凝固速率过快,常常只得到看不到多面体外形的粉末或没有规则外形的块状物。
[板书]1、晶体的自范性即晶体能白发地呈现多面体外形的性质。
[投影]图3-1天然水晶球里的玛瑙和水晶。
[讲述]最有趣的例子是天然的水晶球。
水晶球是岩浆里熔融态的Si02侵入地壳内的空洞冷却形成的。
剖开水晶球,常见它的外层是看不到晶体外形的玛瑙,内层才是呈现晶体外形的水晶。
其实,玛瑙和水晶都是二氧化硅晶体,不同的是,玛瑙是熔融态Si02快速冷却形成的,而水晶则是热液缓慢冷却形成的。
2021年新人教版高二化学选修3:3.3金属晶体(第2课时)教案 Word版

第二课时【教材内容分析】晶体常识和分子晶体、原子晶体现已做了介绍,学生对晶体内微粒的空间摆放有了开始的知道。
学生自己探求金属晶体的结构有了或许。
【教育方针设定】1.了解金属晶体内原子的几种常见摆放方法2.练习学生的着手才能和空间幻想才能。
3.培育学生的协作认识【教育重点难点】金属晶体内原子的空间摆放方法【教育方法主张】活动探求【教育进程规划】【引进】分子晶体中,分子间的范德华力使分子有序摆放;原子晶体中,原子之间的共价键使原子有序摆放;金属晶体中,金属键使金属原子有序摆放。
今日,咱们一同评论有关金属原子的空间摆放问题。
【分组活动1】使用20个巨细相同的玻璃小球,有序地摆放在水平桌面上(二维平面上),要求小球之间严密触摸。
或许有几种摆放方法。
评论每一种方法的配位数。
(配位数:同一层内与一个原子严密触摸的原子数)【学生活动1】学生分四组活动,各由一人报告成果。
使用多媒体展现,学生摆放成果首要介绍以下两种方法。
(配位数:同一层内与一个原子严密触摸的原子数)非密置层,配位数4 密置层,配位数6咱们持续评论,原子在三维空间的摆放。
首要评论非密置层这种状况。
【学生活动2】非密置层摆放的金属原子,在空间内或许的摆放。
汇总各类状况逐个评论。
(一)简略立方体堆积这种堆积方法构成的晶胞是一个立方体,每个晶胞含1个原子,被称为简略立方堆积。
这种堆积方法的空间使用率太低,只要金属钋采纳这种堆积方法。
(二)钾型如果是非密置层上层金属原子填入基层的金属原子构成的凹穴中,每层均照此堆积,如下图:这种堆积方法的空间使用率明显比简略立方堆积的高多了,许多金属是这种堆积方法,如碱金属,简称为钾型。
新人教版高二化学选修3:晶体常识(第2课时)教案 Word版
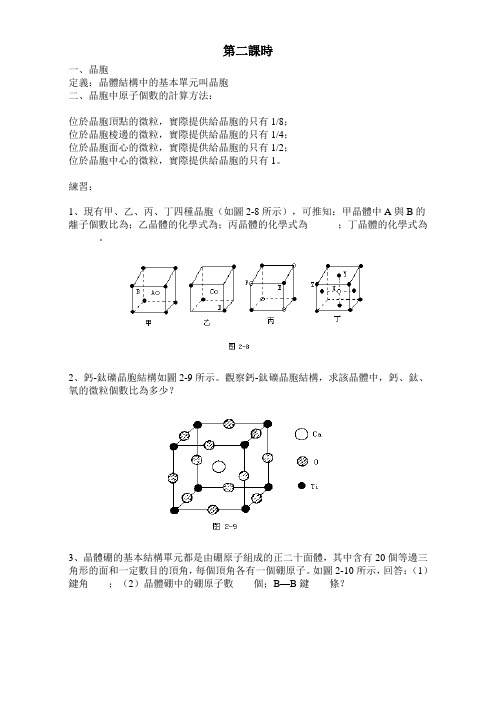
第二課時
一、晶胞
定義:晶體結構中的基本單元叫晶胞
二、晶胞中原子個數的計算方法:
位於晶胞頂點的微粒,實際提供給晶胞的只有1/8;
位於晶胞棱邊的微粒,實際提供給晶胞的只有1/4;
位於晶胞面心的微粒,實際提供給晶胞的只有1/2;
位於晶胞中心的微粒,實際提供給晶胞的只有1。
練習:
1、現有甲、乙、丙、丁四種晶胞(如圖2-8所示),可推知:甲晶體中A與B的離子個數比為;乙晶體的化學式為;丙晶體的化學式為______;丁晶體的化學式為______。
2、鈣-鈦礦晶胞結構如圖2-9所示。
觀察鈣-鈦礦晶胞結構,求該晶體中,鈣、鈦、氧的微粒個數比為多少?
3、晶體硼的基本結構單元都是由硼原子組成的正二十面體,其中含有20個等邊三角形的面和一定數目的頂角,每個頂角各有一個硼原子。
如圖2-10所示,回答:(1)鍵角____;(2)晶體硼中的硼原子數____個;B—B鍵____條?
4、在碳單質的成員中還有一種混合型晶體——石墨,如圖2-11所示。
它是層狀結構,層與層之間依靠作用力相結合。
每層內部碳原子與碳原子之間靠作用力相結合,其鍵角。
分析圖中每個六邊形含有個碳原子。
5、C70分子是形如橢球狀的多面體,該結構的建立基於以下考慮:
(1)C70分子中每個碳原子只跟相鄰的3個碳原子形成化學鍵;
(2)C70分子中只含有五邊形和六邊形;
(3)多面體的頂點數、面數和棱邊數的關係遵循歐拉定理:頂點數+面數-棱邊數=2。
根據以上所述確定:(1)C70分子中所含的單鍵數和雙鍵數;(2)C70分子中的五邊形和六邊形各有多少?。
高二化学导教案:3..1 晶体的常识(第2课时)(新人教版选修三)

《选修三第三章第一节晶体的常识》导学案<第2课时)【课标要求】知识与技能要求:1.掌握晶胞的定义2.掌握晶胞中原子个数的计算方法:【知识回顾与思考】 1.晶体有什么特征? 2.如何来区别晶体和非晶体?【阅读】P63 -64 1.晶体结构的基本单元? 2. 图晶胞与晶体关系?并完成:1.晶胞是。
一般说来,晶胞都是,整块晶体可看作是数量巨大的晶胞而成;即指所有晶胞都是的,相同。
V3QLMsDk9W2.晶体化学式的确定主要采用均摊法,均摊法是指每个晶胞平均拥有的粒子数目,如某个粒子为n个晶胞所共用,则该粒子对一个晶胞的贡献为1/n。
V3QLMsDk9W⑴长方体形<或正方体形)晶胞中,不同位置的粒子对该晶胞的贡献<即晶胞对该粒子的均摊结果):V3QLMsDk9W①处于顶点的粒子,同时为个晶胞共有,每个粒子对该晶胞的贡献为。
V3QLMsDk9W②处于棱上的粒子,同时为个晶胞共有,每个粒子对该晶胞的贡献为。
V3QLMsDk9W③处于面上的粒子,同时为个晶胞共有,每个粒子对该晶胞的贡献为。
V3QLMsDk9W④处于体内的粒子,则完全属于该晶胞,每个粒子对该晶胞的贡献为。
⑵非长方体晶胞粒子对晶胞的贡献视情况而定,如石墨晶胞<P71),每一层内碳原子排成正六边形,其顶点<一个碳原子)对六边形的贡献为。
V3QLMsDk9W【典例解悟】如图所示的甲、乙、丙三种晶体试写出:(1>甲晶体的化学式(X为阳离子>为。
(2>乙晶体中A、B、C三种粒子的个数比是。
(3>丙晶体中每个D周围结合E的个数是个。
【练习】现有甲、乙、丙、丁四种晶胞<如图2-8所示),可推知:甲晶体中A与B的离子个数比为;乙晶体的化学式为______;丙晶体的化学式为______;丁晶体的化学式为______。
V3QLMsDk9W2、钙-钛矿晶胞结构如图2-9所示。
观察钙-钛矿晶胞结构,求该晶体中,钙、钛、氧的微粒个数比为多少?【学与问】教材p64 下图依次是金属钠(Na>、金属锌(Zn>、碘(I2>、金刚石(C>晶胞的示意图,数一数,它们分别平均含几个原子?V3QLMsDk9W【本堂小结】晶胞及与晶体的关系<以计算为主)【对点练习】下列有关晶胞的叙述,正确的是( >A.晶胞是晶体中的最小的结构重复单元 B.不同的晶体中晶胞的大小和形状都相同C.晶胞中的任何一个粒子都属于该晶胞 D.已知晶胞的组成就可推知晶体的组成4.某晶体中含有A、B、C三种元素,其排列方式如图所示,晶体中A、B、C的原子个数之比依次为( >A.1∶3∶1 B.2∶3∶1C.8∶6∶1 D.4∶3∶15.现有甲、乙、丙三种晶体的晶胞(甲中X处于晶胞的中心,乙中A处于晶胞的中心>,可推知:甲晶体中X与Y的个数比是__________,乙中A与B的个数比是______________,丙晶胞中有______个C离子,有________个D离子。
人教版高中化学选修三 教案3.1 晶体的常识 教案2
"四川省德阳五中高中化学第三章-第一节-晶体的常识-第一课时新人教版选修3 "课题晶体的常识(第一课时)课型新知识课授课人授课班级教材分析学生分析本节内容是安排在原子结构、分子结构以及结构决定性质的内容之后来学习,对于学生的学习有一定的理论基础。
结合前两章已学过的有关物质结构知识,学生能够比较全面地认识物质的结构及结构对物质性质的影响,提高分析问题和解决问题的能力。
运用观察、分析、对比、讨论等教学策略引导学生自主学习,让学生主动参与学习活动。
教学目标【知识与技能】(1)知道获得晶体的几种途径(2)理解晶体的特点和性质及晶体与非晶体的本质区别【过程与方法】(1)收集生活素材,结合已有知识和生活经验对晶体与非晶体进行分类(2)学生通过观察、实验等方法获取信息(3)学会运用比较、分类、归纳、概括等方法对获取的信息进行加工【情感态度与价值观】(1)培养学生科学探究的方法(2)培养学生的动手能力、观察能力、自主学习的能力,保持对生活中化学的好奇心和探知欲,增强学生学习化学的兴趣。
教学重点1、晶体与非晶体的区别2、晶体的特征教学难点晶体与非晶体的区别教学媒体多媒体教学策略观察、分析、对比、讨论.任务4.3:介绍X—射线衍射实验板块5:总结晶体的特点总结思考交流学与问幻灯投影晶态SiO2和非晶态SiO2X—衍射粉末图谱对比总结重难点幻灯投影随堂练习阅读课本p64,总结晶体特点思考,讨论练习巩固知识板书:一、晶体与非晶体有规则几何外形的固体称之为晶体,而另一些没有规则几何外形的固体称之为非晶体。
二、自范性这种自发地形成规则几何外形的性质称之为自范性三、晶体形成途径凝固凝华结晶四、晶体与非晶体本质差异五、晶体的特点附表:自范性微观结构晶体有原子在三维空间里呈周期性有序排列非晶体没有原子排列相对无序。
新人教版高二化学选修3:分子晶体(第2课时)教案 Word版 (2)
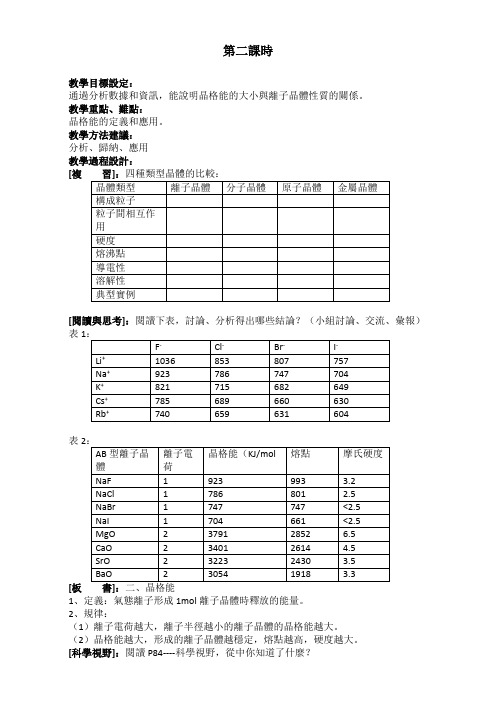
第二課時
教學目標設定:
通過分析數據和資訊,能說明晶格能的大小與離子晶體性質的關係。
教學重點、難點:
晶格能的定義和應用。
教學方法建議:
分析、歸納、應用
教學過程設計:
[複
[閱讀與思考]:閱讀下表,討論、分析得出哪些結論?(小組討論、交流、彙報)表1
表2
[板
1、定義:氣態離子形成1mol離子晶體時釋放的能量。
2、規律:
(1)離子電荷越大,離子半徑越小的離子晶體的晶格能越大。
(2)晶格能越大,形成的離子晶體越穩定,熔點越高,硬度越大。
[科學視野]:閱讀P84----科學視野,從中你知道了什麼?
[板書]:3、岩漿晶出規則:晶格能高的晶體,熔點較高,更容易在岩漿冷卻過程中先結晶析出。
(美國礦物學家鮑文)
教學習題設計:
1、下列大小關係正確的是
A、晶格能:NaCl<NaBr
B、硬度:MgO>CaO
C、熔點:NaI>NaBr
D、熔沸點:CO2>NaCl
2
三種氟化物的晶格能的遞變原因是。
3
(1)橄欖石和雲母晶出的順序是。
(2)石英總是在各種矽酸鹽析出後才晶出的原因是。
(3)推測雲母和橄欖石的熔點順序為,硬度大小為。
4、下表列出了鈉的鹵化物和矽的鹵化物的熔點:
(1)鈉的鹵化物的熔點比相應的矽的鹵化物的熔點高很多,其原因
是。
(2)NaF 的熔點比NaBr的熔點高的原因
是。
SiF4的熔點比SiBr4的熔點低的原因
是。
(3)NaF和NaBr的晶格能的高低順序為,硬度大小為。
新人教版高二化学选修3:金属晶体(第2课时)教案 Word版

第二課時【教材內容分析】晶體知識和分子晶體、原子晶體已經做了介紹,學生對晶體內微粒的空間排列有了初步的認識。
學生自己探究金屬晶體的結構有了可能。
【教學目標設定】1.瞭解金屬晶體內原子的幾種常見排列方式2.訓練學生的動手能力和空間想像能力。
3.培養學生的合作意識【教學重點難點】金屬晶體內原子的空間排列方式【教學方法建議】活動探究【教學過程設計】【引入】分子晶體中,分子間的範德華力使分子有序排列;原子晶體中,原子之間的共價鍵使原子有序排列;金屬晶體中,金屬鍵使金屬原子有序排列。
今天,我們一起討論有關金屬原子的空間排列問題。
【分組活動1】利用20個大小相同的玻璃小球,有序地排列在水準桌面上(二維平面上),要求小球之間緊密接觸。
可能有幾種排列方式。
討論每一種方式的配位數。
(配位數:同一層內與一個原子緊密接觸的原子數)【學生活動1】學生分四組活動,各由一人彙報結果。
利用多媒體展示,學生排列結果主要介紹以下兩種方式。
(配位數:同一層內與一個原子緊密接觸的原子數)非密置層,配位數4 密置層,配位數6我們繼續討論,原子在三維空間的排列。
首先討論非密置層這種情況。
【學生活動2】非密置層排列的金屬原子,在空間內可能的排列。
匯總各類情況逐一討論。
(一)簡單立方體堆積這種堆積方式形成的晶胞是一個立方體,每個晶胞含1個原子,被稱為簡單立方堆積。
這種堆積方式的空間利用率太低,只有金屬釙採取這種堆積方式。
(二)鉀型如果是非密置層上層金屬原子填入下層的金屬原子形成的凹穴中,每層均照此堆積,如下圖:這種堆積方式的空間利用率顯然比簡單立方堆積的高多了,許多金屬是這種堆積方式,如鹼金屬,簡稱為鉀型。
2020人教版高中化学选修三3.1晶体的常识word学案

第一节晶体的常识教材分析:本节内容是安排在原子结构、分子结构以及结构决定性质的内容之后来学习,对于学生的学习有一定的理论基础。
本节内容主要是通过介绍各种各样的固体为出发点来过渡到本堂课的主题——晶体和非晶体。
而晶体和非晶体的学习是以各自的自范性和微观结构比较为切入点,进而得出得到晶体的一般途径以及晶体的常见性质和区分晶体的方法。
[学习目标]1.晶体的自范性即______________________________________________________.晶体呈自范性的条件之一是____________________________________________________.2.得到晶体一般有三条途径:(1)____________,(2)___________________________,(3)_________________________3. 自范性微观结构晶体非晶体4. 晶体的熔点较__________,而非晶体的熔点_______________,区分晶体与非晶体最可靠的科学方法是______________________________________________.二、晶胞5._________________________________ _________________是晶胞。
[方法导引]晶胞中粒子数的计算方法:晶体结构类习题最常见的题型就是已知晶胞的结构而求晶体的化学式。
解答这类习题首先要明确一个概念:由晶胞构成的晶体,其化学式不一定是表示一个分子中含有多少个原子,而是表示每个晶胞中平均含有各类原子的个数,即各类原子的最简个数比。
解答这类习题,通常采用分摊法。
在一个晶胞结构中出现的多个原子,这些原子并不是只为这个晶胞所独立占有,而是为多个晶胞所共有,那么,在一个晶胞结构中出现的每个原子,这个晶体能分摊到多少比例呢。
这就是分摊法。
分摊法的根本目的就是算出一个晶胞单独占有的各类原子的个数。
人教版化学选修3第三章第一节《晶体的常识》word教案设计

泰兴市第三高级中学编号:205001 高二年级化学集体备课教案(选修)第三章第一节晶体常识备课组长:陈学富教学目标:1、通过实验探究理解晶体与非晶体的差异。
2、学会分析、理解、归纳和总结的逻辑思维方法,提高发现问题、分析问题和解决问题的能力。
3、了解区别晶体与非晶体的方法,认识化学的实用价值,增强学习化学的兴趣。
教学重难点:1、晶体与非晶体的区别2、晶体的特征教学过程设计:[新课引入]:前面我们讨论过原子结构、分子结构,对于化学键的形成也有了初步的了解,同时也知道组成千万种物质的质点可以是离子、原子或分子。
又根据物质在不同温度和压强下,物质主要分为三态:气态、液态和固态,下面我们观察一些固态物质的图片。
[投影]:1、蜡状白磷; 2、黄色的硫磺; 3、紫黑色的碘; 4、高锰酸钾[讲述]:像上面这一类固体,有着自己有序的排列,我们把它们称为晶体;而像玻璃这一类固体,本身原子排列杂乱无章,称它为非晶体,今天我们的课题就是一起来探究晶体与非晶体的有关知识。
[板书]:一、晶体与非晶体[板书]:1、晶体与非晶体的本质差异[提问]:在初中化学中,大家已学过晶体与非晶体,你知道它们之间有没有差异?[回答]:学生:晶体有固定熔点,而非晶体无固定熔点。
[讲解]:晶体有固定熔点,而非晶体无固定熔点,这只是晶体与非晶体的表观现象,那么他们在本质上有哪些差异呢?[投影]晶体与非晶体的本质差异[板书]:自范性:晶体能自发性地呈现多面体外形的性质。
[解释]:所谓自范性即“自发”进行,但这里得注意,“自发”过程的实现仍需一定的条件。
例如:水能自发地从高处流向低处,但不打开拦截水流的闸门,水库里的水不能下泻。
[板书]:注意:自范性需要一定的条件,其中最重要的条件是晶体的生长速率适当。
[投影]:通过影片播放出,同样是熔融态的二氧化硅,快速的冷却得到玛瑙,而缓慢冷却得到水晶过程。
[设问]:那么得到晶体的途径,除了用上述的冷却的方法,还有没有其它途径呢?你能列举哪些?[板书]:2、晶体形成的一段途径:(1)熔融态物质凝固;(2)气态物质冷却不经液态直接凝固(凝华);(3)溶质从溶液中析出。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二课时
一、晶胞
定义:晶体结构中的基本单元叫晶胞
二、晶胞中原子个数的计算方法:
位于晶胞顶点的微粒,实际提供给晶胞的只有1/8;
位于晶胞棱边的微粒,实际提供给晶胞的只有1/4;
位于晶胞面心的微粒,实际提供给晶胞的只有1/2;
位于晶胞中心的微粒,实际提供给晶胞的只有1。
练习:
1、现有甲、乙、丙、丁四种晶胞(如图2-8所示),可推知:甲晶体中A与B 的离子个数比为;乙晶体的化学式为;丙晶体的化学式为______;丁晶体的化学式为______。
2、钙-钛矿晶胞结构如图2-9所示。
观察钙-钛矿晶胞结构,求该晶体中,钙、钛、氧的微粒个数比为多少?
3、晶体硼的基本结构单元都是由硼原子组成的正二十面体,其中含有20个等边三角形的面和一定数目的顶角,每个顶角各有一个硼原子。
如图2-10所示,回答:(1)键角____;(2)晶体硼中的硼原子数____个;B—B键____条?
4、在碳单质的成员中还有一种混合型晶体——石墨,如图2-11所示。
它是层状结构,层与层之间依靠作用力相结合。
每层内部碳原子与碳原子之间靠作用力相结合,其键角。
分析图中每个六边形含有个碳原子。
5、C70分子是形如椭球状的多面体,该结构的建立基于以下考虑:
(1)C70分子中每个碳原子只跟相邻的3个碳原子形成化学键;
(2)C70分子中只含有五边形和六边形;
(3)多面体的顶点数、面数和棱边数的关系遵循欧拉定理:顶点数+面数-棱边数=2。
根据以上所述确定:(1)C70分子中所含的单键数和双键数;(2)C70分子中的五边形和六边形各有多少?。
