2020年高考化学二轮复习-化学计量-专题练习(三)
山西省2020-2021年高考化学二轮专题 03 化学中的常用计量

山西省2020-2021年高考化学二轮专题 03 化学中的常用计量姓名:________ 班级:________ 成绩:________一、单选题 (共14题;共28分)1. (2分)某原子可用符号919X一个该原子的基本微粒(质子、中子、电子)的总数是()A . 29B . 28C . 19D . 92. (2分) (2017高二下·商丘期末) 将106 g Na2 CO3溶于1 L水所得溶液与1 mol Na2CO3溶于水稀释成1 L的溶液相比,下列各量一定相等的是()A . 物质的量浓度B . 溶液的密度C . 溶质的质量D . 溶质的质量分数3. (2分)已知链式炔碳C300经过适当处理可得含多个(不含)的链状化合物C300H298 ,则含的个数为()A . 70B . 72C . 74D . 764. (2分) (2019高一上·吉林月考) 下列叙述正确的是()A . 1 molH2O的质量为18g/molB . 含有3.01×1023个氧原子的SO2分子的质量约为16gC . CH4的摩尔质量为16gD . 标准状况下,1mol任何物质体积均为22.4L5. (2分)实验室用如下图所示装置制取甲烷并与氯气在光照条件下反应,试管中发生的反应是CH3COONa+NaOHCH4↑+Na2CO3 ,集气瓶中收集满混合气体后停止通入气体并对集气瓶进行光照。
下列关于实验的说法错误的是()A . 组装好仪器后要先检验装置的气密性,然后再装药品进行实验B . 装置Y的作用之一是通过观察气泡产生的快慢调节气体流速C . 对收集好的混合气体光照时,用强光直射以加快反应速率D . 对集气瓶进行光照时,水槽中会有少量晶体析出6. (2分) (2018高一上·石家庄期中) 相对分子质量为M的某物质在室温下溶解度为Sg,此时测得饱和溶液的密度为dg·mL-1 ,则该饱和溶液的物质的量浓度是()A . mol·L-1B . mol·L-1C . mol·L-1D . mol·L-17. (2分) (2016高一上·中江期中) 下列溶液中的c(Cl﹣)与50mL1mol•L﹣1 氯化铝溶液中的c(Cl﹣)相等的是()A . 150mL1mol•L﹣1氯化钠溶液B . 75mL2mol•L﹣1氯化铵溶液C . 150mL3mol•L﹣1氯化钾溶液D . 75mL2mol•L﹣1氯化钡溶液8. (2分)引燃密闭容器中的己烷和氧气的混合气体,使其发生不完全燃烧.在120℃时测得反应前后气体的压强分别为1.8×105帕和2.6×105帕,根据上述实验数据,确定己烷与氧气反应的化学方程式是()A . C6H14+9O2CO+5CO2+7H2OB . C6H14+8O23CO+3CO2+7H2OC . C6H14+9O25CO+CO2+7H2OD . C6H14+15O28CO+4CO2+14H2O9. (2分) (2019高一上·上海期末) 如图是硫酸试剂标签上的部分内容,下列说法正确的是()A . 该硫酸的物质的量浓度为9.2mol/LB . 该硫酸中溶剂、溶质分子数目之比为9:2C . 配置200mL4.6mol/L的稀硫酸,需取该硫酸50mLD . 该硫酸与等体积的水混合所得溶液的物质的量浓度等于9.2mol/L10. (2分) (2016高一下·长安期中) 某核素可形成HmX型氢化物,则 a g HmX 含有()A . mol质子B . mol电子C . mol中子D . mmol HmX11. (2分) (2017高一上·镇原期中) 标准状况下,具有下列量的物质,其体积最大的是()A . 11.2LH2B . 44gCO2C . 2molFeD . 2molH2O12. (2分) (2016高一上·秦安期中) 有一种气体的质量是14.2g,体积是4.48L(标准状况),该气体的摩尔质量是()A . 28.4B . 71g•mol﹣1C . 28.4g•mol﹣1D . 7113. (2分)设NA为阿伏加德罗常数的值,下列说法错误的是()A . 32 g O2所含的原子数目为NAB . 0.5 mol H2O含有的原子数目为1.5 NAC . 1 mol SO2含有的SO2分子数目为NAD . 0.5 NA个Cl2的物质的量是0.5 mol14. (2分) (2016高一上·银川期中) 设NA为阿伏伽德罗常数的数值,下列说法不正确的是()A . 常温常压下,1.7g NH3含有NA个电子B . 标准状况下,22.4L水中含H2O分子NA个C . 1molNa完全反应生成NaCl时,失去NA个电子D . 常温常压下,22.4LCO2中含有的CO2分子数小于NA个二、填空题 (共2题;共11分)15. (3分) (2017高一上·湖南期中) 质量相等的SO2和SO3所含分子数之比为________,所含氧原子数之比为________.16. (8分)已知在标准状况下,4.48LCO和4.4gCO2组成的混合气体.此混合物中CO和CO2的物质的量比是________ ,CO和CO2的碳原子之比是________ ,CO和CO2的氧原子之比是________;此混合物中C和O的原子个数比是________ ,混合气体的总质量是________三、综合题 (共4题;共33分)17. (21分) (2018高一上·长春期中) 现有73gHCl气体,计算:(1)该气体为________ mol。
新教材适用2024版高考化学二轮总复习第1部分新高考选择题突破专题2化学计量及其应用微专题3物质组成
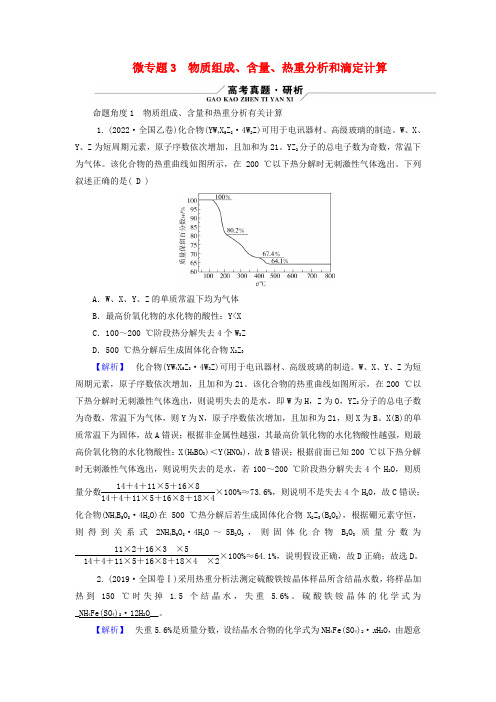
微专题3 物质组成、含量、热重分析和滴定计算命题角度1 物质组成、含量和热重分析有关计算1. (2022·全国乙卷)化合物(YW4X5Z8·4W2Z)可用于电讯器材、高级玻璃的制造。
W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21。
YZ2分子的总电子数为奇数,常温下为气体。
该化合物的热重曲线如图所示,在200 ℃以下热分解时无刺激性气体逸出。
下列叙述正确的是( D )A.W、X、Y、Z的单质常温下均为气体B.最高价氧化物的水化物的酸性:Y<XC.100~200 ℃阶段热分解失去4个W2ZD.500 ℃热分解后生成固体化合物X2Z3【解析】化合物(YW4X5Z8·4W2Z)可用于电讯器材、高级玻璃的制造。
W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21。
该化合物的热重曲线如图所示,在200 ℃以下热分解时无刺激性气体逸出,则说明失去的是水,即W为H,Z为O,YZ2分子的总电子数为奇数,常温下为气体,则Y为N,原子序数依次增加,且加和为21,则X为B。
X(B)的单质常温下为固体,故A错误;根据非金属性越强,其最高价氧化物的水化物酸性越强,则最高价氧化物的水化物酸性:X(H3BO3)<Y(HNO3),故B错误;根据前面已知200 ℃以下热分解时无刺激性气体逸出,则说明失去的是水,若100~200 ℃阶段热分解失去4个H2O,则质量分数14+4+11×5+16×814+4+11×5+16×8+18×4×100%≈73.6%,则说明不是失去4个H2O,故C错误;化合物(NH4B5O8·4H2O)在500 ℃热分解后若生成固体化合物X2Z3(B2O3),根据硼元素守恒,则得到关系式2NH4B5O8·4H2O~5B2O3,则固体化合物B2O3质量分数为11×2+16×3×514+4+11×5+16×8+18×4×2×100%≈64.1%,说明假设正确,故D正确;故选D。
2020届高考化学二轮专题辅导与测试:化学常用计量【要点透析、提升训练】

5 / 11
知识像烛光,能照亮一个人,也能照亮无数的人。--培根
的物质的量为14
mg
m
g·mol-1=14
mol,故
m
g
混合物中含有14NA 个碳
原子,A
项正确;每个氢原子形成
1
个碳氢键,m
g
m 混合物中共含有7
m mol 氢原子,所含碳氢键数目为7NA,B 项错误;1 个 C2H4 中共用电子
②溶液中“粒子之间电荷守恒”(溶液呈电中性)。
③质量守恒。
【提升训练】
1.标准状况下,5.6 L O2 中含有 N 个氧原子,则阿伏加德罗常
数的值为( )
A.4N
N B.4
C.2N
N D.2
解析:选 C
2×5.6 L N 根据题意知,22.4 L·mol-1=NA,故
NA=2N
mol-1,
C 项正确。
4 / 11
知识像烛光,能照亮一个人,也能照亮无数的人。--培根
解析:选 D 物质的量浓度与溶液的体积无关,100 mL 0.5 mol·L -1NaCl 溶液中 c(Cl-)=0.5 mol·L-1,而 A、B、C、D 项中,c(Cl-)
分别为 1 mol·L-1、0.75 mol·L-1、1 mol·L-1、0.5 mol·L-1,D
项错误。
9.同温同压下,甲容器中充满 35Cl2,乙容器中充满 37Cl2,下列 叙述不正确的是( )
A.若两种气体体积相等,则甲、乙两容器中气体密度之比为 35∶
37
8 / 11
知识像烛光,能照亮一个人,也能照亮无数的人。--培根
B.若两种气体体积相等,则甲、乙两容器中气体分子数之比为 35∶37
2020高考化学决胜二轮新高考省份专用版:专题三化学常用计量及其应用含答案

了解物质的量及其相关物理量的涵义和应用.体会定量研究对化学科学的重要作用。
(3)Na2O2、KO2中的阴、阳离子个数比.前者为1∶2.后者为1∶1;熔融的Na HSO4中的阳离子数目(阳离子只有Na+)。
(4)等物质的量的羟基与氢氧根离子所含质子、电子或原子数目。
(5)等质量的最简式相同的有机物(如烯烃)、同素异形体、N2与CO、NO2与N2O4等含有的原子、分子数目。
(6)注意特殊物质的摩尔质量.如D2O、18O2、H37Cl等。
(7)一定物质的量的有机物中共价键的数目(苯环、萘环中无碳碳双键).如C n H2n+2中共价键的数目为3n+1。
(8)1 mol金刚石、石墨中的C—C键数目分别为2N A、1.5N A;1 molSiO2中Si—O键数目为4N A;1 mol P4中的P—P键数目为6N A。
3.与氧化还原反应相关的N A的应用(1)歧化反应类:Na2O2与CO2、H2O的反应.Cl2与NaOH(冷稀、热浓)、H2O 的反应。
(2)变价金属(Fe、Cu)与强、弱氧化剂(Cl2/Br2、S/I2)反应类。
(3)Fe与浓、稀硝酸.Cu与浓、稀硝酸反应类。
(4)足量、不足量Fe与稀硝酸.足量Fe与浓硫酸反应类。
(5)足量KMnO4与浓盐酸.足量MnO2与浓盐酸.足量Cu与浓硫酸反应类。
(6)注意氧化还原的顺序.如向FeI2溶液中通入Cl2.首先氧化I-.再氧化Fe2+。
4.与可逆反应相关的N A的应用在N A的应用中.常涉及以下可逆反应:(1)2SO2+O2错误!2SO3PCl3+Cl2PCl52NO2N2O4N2+3H2错误!2NH3(2)Cl2+H2O HCl+HClO(3)NH3+H2O NH3·H2O NH+4+OH-5.与电解质溶液中粒子数目判断相关的N A的应用审准题目要求.是突破该类题目的关键。
(1)溶液中是否有“弱粒子”.即是否存在弱电解质或能水解的“弱离子”.如1 L 1 mol·L-1的乙酸或1 L 1 mol·L-1乙酸钠溶液中CH3COO-数目均小于N A。
2020届高考化学二轮复习常考题型大通关(3)化学计量与化学计算(含解析)

化学计量与化学计算1、已知N A是阿伏加德罗常数的值,下列说法错误的是( )A.3g 3He含有的中子数为1N APO-数目为0.1N AB.1 L 0.1 mol·L−1磷酸钠溶液含有的34C.1 mol K2Cr2O7被还原为Cr3+转移的电子数为6N AD.48 g正丁烷和10 g异丁烷的混合物中共价键数目为13N A2、N A代表阿伏加德罗常数的值。
下列说法正确的是( )A.常温常压下,124 g P4中所含P—P键数目为4N AB.100 mL 1 mol•L-1FeCl3溶液中所含Fe3+的数目为0.1 N AC.标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2 N AD.密闭容器中,2 mol SO2和1mol O2催化反应后分子总数为2 N A3、阿伏加德罗常数的值为N A。
下列说法正确的是( )NH+的数量为0.1N AA.1 L 0.1 mol·L-1 NH4Cl溶液中,4B.2.4 g Mg与H2SO4完全反应,转移的电子数为0.1N AC.标准状况下,2.24 L N2和O2的混合气体中分子数为0.2N AD.0.1 mol H2和0.1 mol I2于密闭容器中充分反应后,其分子总数为0.2N A4、下列说法中正确的是(N A为阿伏加德罗常数的值)( )A.O2-的电子式为,则O2-核外有8个电子B.1 m o l N H4Cl中含有的H—C1键的数目为N AC.CrO5中Cr元素的化合价为+6价,每个CrO5分子中存在两个过氧键D.20 g Na2O和Na2O2的混合物中,所含阴阳离子数目之比无法确定5、设N A表示阿伏加德罗常数的值,下列说法正确的是( )A.饱和碳酸钠溶液中析出1.06 g晶体,该晶体中含有2N A个Na+B.1 mol乙酸与足量的乙醇发生酯化反应,生成乙酸乙酯分子数为N AC.某温度下,1 L pH=2的H2SO4溶液中,硫酸和水电离的H+总数为0.01N AD.常温常压下,NO2与N2O4的混合气体46 g,分子总数为N A6、设N A为阿伏加德罗常数,下列有关说法正确的是( )A. 常温下,48 g CT3CO18OCH2CH3含电子数24N A、中子数24 N AB. 标况下,11.2 L氮气和足量的氧气在高温条件下可以生成46 g NO2C. 常温下,1 L pH=9的CH3COONa溶液中,发生电离的水分子数为1×10-9 N AD. 常温下,5.6 mol/L的10 mL氯化铁溶液滴到100 mL沸水中,生成0.056 N A个氢氧化铁胶粒7、设N A为阿伏加德罗常数的值。
2020年高考化学二轮复习考点学与练专题02 化学常用计量(含解析)

专题02 化学常用计量1.了解相对原子质量、相对分子质量的定义,并能进行有关计算。
2.理解物质的量的含义,并能用于进行简单的化学计算。
3.了解物质的量的单位——摩尔(mol)、摩尔质量、气体摩尔体积,物质的量浓度、阿伏加德罗常数的含义。
4.根据物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系进行有关计算。
5.能运用化学方程式和离子方程式进行有关计算。
6.了解溶液的组成。
理解溶液中溶质的质量分数的概念,并能进行有关计算。
7.能根据要求配制一定溶质质量分数、物质的量浓度的溶液。
知识点一、阿伏加德罗常数的应用阿伏加德罗常数的常见考查内容和设错形式:对阿伏加德罗常数的考查往往以选择题的形式,渗透于高中各个知识点中进行考查,试题的知识覆盖面较大,但难度较小,该类试题的特点就是“容易忽视”,即容易落入命题者设置的“陷阱”中,因此明确命题者的考查方向和设错方式有利于我们快速、准确地作出选择。
同时要求同学们在解决该类试题时一定要细心、仔细。
1.考查气体体积与物质的量、微粒数目等关系时,故意忽略标准状况条件或给出常温常压条件。
2.物质状态问题。
考查气体摩尔体积时,常常用标准状况下非气态的物质来迷惑考生,如水、三氧化硫、己烷、三氯甲烷等。
3.结合氧化还原反应考查电子转移的数目问题,特别是歧化反应的电子转移数目,如过氧化钠与水反应、氯气与水的反应等。
4.结合物质结构的有关知识考查物质的微粒数目(如分子、原子、质子、中子、电子等)、化学键数目等。
此处常常涉及的物质有稀有气体(单原子分子)、Na2O2(阴阳离子个数比)、SiO2、Si、P4、CO2(化学键数目)、特殊物质的质量与微粒数间的关系,如D2O、18O2等。
5.考查溶液中离子数目时故意忽视盐类的水解,弱电解质的电离等。
6.结合化学平衡考查时,故意忽视可逆反应不能进行到底的特点。
【特别提醒】阿伏加德罗常数应用题常设的五大“陷阱”。
(1)“标准状况”“常温常压”等外界条件。
2020年高考化学二轮复习专题能力训练1 化学常用计量 Word版含答案

专题能力训练1化学常用计量(时间:45分钟满分:100分)一、选择题(共8小题,每小题6分,共48分。
每小题只有1个选项符合题意)1.(2015上海模拟)用N A表示阿伏加德罗常数的值。
下列叙述正确的是()A.1.0 L 1.0 mol·L-1的Na2SO4水溶液中含有的氧原子数为4N AB.1 mol Na2O2固体中含离子总数与1 mol CH4中所含共价键数目相等C.1 mol NaClO固体中所有ClO-的电子总数为26N AD.标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1N A2.(2015四川检测)N A为阿伏加德罗常数的值,下列叙述正确的是()A.标准状况下,2.8 L丙烷中含有的极性共价键数为N AB.在反应KIO3+6HI KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6N AC.已知CH3COONH4溶液的pH=7,则1 L 0.1 mol·L-1的CH3COONH4溶液中,CH3COO-数为0.1N AD.39 g Na2O2和Al(OH)3的混合物中阴、阳离子的总数为2N A3.(2015湖北武汉检测)设N A为阿伏加德罗常数的值。
下列说法正确的是()A. 64 g铜被氧化,失去的电子数一定为2N AB.室温下,pH=13的氨水中,由水电离的OH-浓度为0.1 mol·L-1C.在标准状况下,22.4 L C4H10中共价键数目一定为13N AD.200 mL 1 mol·L-1 Fe2(SO4)3溶液中,Fe3+和S离子数的总和是N A4.将V L NH3(折算成标准状况下)通入1 L水中,形成密度为ρ g·cm-3的氨水,质量分数为w,其中含N的物质的量为a mol,下列说法正确的是()A.溶质的物质的量浓度c= mol·L-1B.溶质的质量分数w=×100%C.溶液中c(OH-)= mol·L-1D.上述溶液中再通入与原溶液等体积的水,所得溶液的质量分数大于0.5w5.下列叙述中正确的是()①标准状况下,1 L HCl和1 L H2O的物质的量相同②标准状况下,1 g H2和14 g N2的体积相同③28 g CO的体积为22.4 L④两种物质的物质的量相同,则它们在标准状况下的体积也相同⑤在同温同体积时,气体的物质的量越大,则压强越大⑥同温同压下,气体的密度与气体的相对分子质量成正比A.①②③B.②⑤⑥C.②③⑥D.④⑤⑥6.下列说法中,正确的是()A.1 L水中溶解了40 g NaOH后,所得溶液浓度为1 mol·L-1B.从1 L 2 mol·L-1的NaCl溶液中取出0.5 L,该溶液的浓度为1 mol·L-1C.将2.24 L HCl气体通入水中制成100 mL溶液,所得溶液的物质的量浓度为1 mol·L-1D.将80 g SO3溶于水并配成1 L的溶液,则所得溶液的浓度为1 mol·L-17.下列有关配制溶液的做法中,正确的是()A.在托盘天平两托盘上各放一片大小相同的纸,然后将NaOH放在纸片上进行称量B.称取7.68 g硫酸铜,加入500 mL水来配制480 mL 0.1 mol·L-1的硫酸铜溶液C.定容时不小心水加多了,重新配制D.用量筒量取的浓盐酸倒入容量瓶中加水至刻度线8.(2013课标全国Ⅱ)N0为阿伏加德罗常数的值。
专题03 第9题阿伏加德罗常数(强化训练)-2020高考化学二三轮复习题型大突破系列(解析版)

专题03 第9题阿伏加德罗常数(强化训练)1.N A代表阿伏加德罗常数,下列说法正确的是A.分子数为N A的CO、C2H4混合气体体积约为22.4 L,质量为28 gB.已知2CO(g)+O2(g)2CO2(g);△H=-akJ﹒mol-1将2N A个CO与N A个O2混合充分反应放出akJ的热量。
C.用石灰乳完全吸收l mol Cl2时,转移电子的数目是N AD.常温下,0.1mol/LNa2CO3溶液中,含有阴离子的总数大于0.1N A【答案】C【解析】A、没说标况下,分子数为N A气体不一定为22.4 L, 错误;B、可逆反应,进行不彻底, 不能放出akJ的热量,错误;C、2 Cl2+2Ca(OH)2,="Ca" Cl2+ Ca(ClO)2+ 2H2O,l molCa(OH)2需要l molCl2;Cl0→Cl-;Cl0→ClO-,电子转移数为N A,正确。
D、没有溶液体积,无法求离子总数, 错误。
2.设N A为阿伏加德罗常数的值。
下列说法正确的是A.标准状况下,0.1molCl2溶于水,转移的电子数目为0.1N AB.常温下,22gCO2和N2O混合气体中,含有的原子数目为1.5N AC.标准状况下,2.24L甲醇中含有C—H键的数目为0.3N AD.a mol·L—1的氯化铁溶液中,若Fe3+的数目为N A,则Cl—的数目为3N A【答案】B【解析】A、Cl2与H2O的反应为可逆反应,所以标准状况下,0.1molCl2溶于水,转移的电子数目小于0.1N A,错误;B、CO2和N2O的摩尔质量均为44g/mol,所以22gCO2和N2O混合气体物质的量为0.5mol,则含有的原子数目为1.5N A,正确;C、甲醇在标准状况下是液体,不能用22.4L/mol求物质的量,错误;D、Fe3+发生水解反应,所以若Fe3+的数目为N A,则Cl—的数目大于3N A,错误。
2020届高考理综化学考前基础回归专题——03化学计量

2020届届届届届届届届届届届届届届届——03届届届届1.已知N A是阿伏加德罗常数的值,下列说法正确的是()A. 32gS8与S6()的混合物中所含共价键数目为N AB. 1L0.1mol⋅L−1H2C2O4溶液中含C2O42−离子数为0.1N AC. 2molNO与2molO2在密闭容器中充分反应,转移的电子数为8N AD. 标准状况下22.4L氯气与甲烷的混合气体,光照时充分反应生成HCl分子数为N A2.设[aX+bY]为a个X微粒和b个Y微粒组成的一个微粒集合体,N(z)为微粒z的数量,N A为阿伏加德罗常数的值。
下列说法一定不正确的是()C(石墨)+A. C(石墨)+O2(g)=CO2(g)△H=−390kJ⋅mol−1,则每1mol[131O2(g)]完全燃烧放热130kJ3B. Cu与1mol/L的硝酸溶液充分反应,若生成22.4L气体,则转移电子数为3N ALC. 标准状况下1.6g氧气含分子数为0.05N A,且平均每个O2分子的体积约为22.4N AD. 1molCl2与稀NaOH溶液完全反应,则反应后的溶液中N(ClO−)+N(HClO)=1N A3.设N A为阿伏加德罗常数的值,下列说法正确的是()A. 1molFeBr2与1molCl2完全反应后,转移电子数为2N AB. 16.2ng淀粉[(C6H10O5)n]中含有0.1N A葡萄糖单元C. 将lmolNH3完全溶于水,所得溶液中N(NH3⋅H2O)+N(NH4+)=N AD. 若5.6LN2中含有n个氮分子,则N A=4n4.设N A为阿伏加德罗常数,下列有关说法正确的是()A. 常温常压下,1.8g甲基(−CD3)中含有的中子数为N AB. 标准状况下,11.2L乙烯和环丙烷(C3H6)的混合气体中,共用电子对的数目为3N AC. 2.8g的聚乙烯中含有的碳原子数为0.2N AD. 1mol 苯中含有碳碳双键的数目为3 N A5.设N A是阿伏加德罗常数的值,下列说法正确的是()A. 46gC2H6O完全燃烧,有5N A个C−H键断裂B. 电解精炼铜时,阳极质量减轻64g时转移的电子数为2N AC. 2.6gNaT与足量水反应,生成的氢气中含有中子数为0.1N AD. 56g Fe粉与1molCl2充分反应,转移电子数为2N A6.N A代表阿伏加德罗常数的值,下列叙述正确的是()A. 1mol H2O2中含有N A个B. 4.6g分子式为C2H6O的有机物中碳氢键数目一定是0.5N AC. 电解精炼铜中转移1mol电子,阳极质量减少32gD. 将含0.1molFeCl3的饱和溶液滴入沸水中,形成的胶体粒子的数目少于0.1N A7.已知N A是阿伏加德罗常数的值,下列说法正确的是A. 11g硫化钾和过氧化钾的混合物,含有的离子数目为0.4N AB. 28g聚乙烯()含有的质子数目为16N AC. 将标准状况下224mL SO2溶于水制成100mL溶液,H2SO3、HSO3−、SO32−三者数目之和为0.01ND. 含63g HNO3的浓硝酸与足量铜完全反应,转移电子数目为0.50N A8.氮化硅(Si3N4)是一种重要的结构陶瓷材料,可用作LED的基质材料,通过等离子法由SiH4(沸点−111.9℃)与氨气反应制取的方程式如下:3SiH4+4NH3=Si3N4+ 12H2。
2020高考化学二轮对对练:题型二化学计量 Word版含解析

题型二化学计量高考命题规律命题角度1N正误判断——侧重于微粒组成和结构的考查A高考真题体验·对方向1.(2019全国Ⅱ,8)已知N A是阿伏加德罗常数的值,下列说法错误的是()A.3 g 3He含有的中子数为1N AB.1 L 0.1 mol·L-1磷酸钠溶液含有的P-数目为0.1N AC.1 mol K2Cr2O7被还原为Cr3+转移的电子数为6N A10 g异丁烷的混合物中共价键数目为13N AHe的相对原子质量是3,每个3He原子含有1个中子,所以3 g 3He含有的中子数为1N A,A 项正确;磷酸钠溶液中磷酸根离子发生水解,导致溶液中磷酸根离子数目减少,1 L 0.1 mol·L-1磷酸钠溶液中的磷酸根离子数目小于0.1N A,B项错误;K2Cr2O7中Cr的价态为+6价,变为Cr3+降了3价,故1 mol K2Cr2O7被还原为Cr3+转移的电子数为6N A,C项正确;正丁烷和异丁烷互为同分异构体,1个正丁烷分子和1个异丁烷分子中所含共价键数相同,即1个正丁烷分子和1个异丁烷分子中均含有13个共价键,58 g正丁烷和异丁烷的混合物的总物质的量为1 mol,所以含有的共价键数为13N A,D项正确。
2.(2018全国Ⅱ,11)N A代表阿伏加德罗常数的值,下列说法正确的是()A.常温常压下,124 g P4中所含P—P键数目为4N AB.100 mL 1 mol·L-1 FeCl3溶液中所含Fe3+的数目为0.1N AC.标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2N A,2 mol SO2和1 mol O2催化反应后分子总数为2N A答案 C解析124 g P4的物质的量为1 mol,根据P4的结构可知,1个P4分子中含有6个P—P键,1 mol P4中含有6N A个P—P键,A项错误;因为Fe3+会发生水解生成Fe(OH)3,故100 mL 1 mol·L-1 FeCl3溶液中N(Fe3+)小于0.1N A,B项错误;根据化学式可知,1 mol CH4和1 mol CH2CH2中均含有4mol氢原子,标准状况下,11.2 L混合气体的物质的量为0.5 mol,所含氢原子的物质的量为2 mol,即所含氢原子数目为2N A,C项正确;SO2和O2的反应为可逆反应,2 mol SO2和1 mol O2不能全部转化成2 mol SO3,故分子总数大于2N A,D项错误。
2020年高三化学二轮复习(二模备考):《化学常用计量》专题增分训练【答案+解析】

2020年高三化学二轮复习(二模备考):《化学常用计量》专题增分训练1.标准状况下,5.6 L O 2中含有N 个氧原子,则阿伏加德罗常数的值为( ) A .4N B.N 4C .2ND.N2解析:选C 根据题意知,2×5.6 L 22.4 L ·mol -1=NN A ,故N A =2N mol -1,C 项正确。
2.N A 代表阿伏加德罗常数的值。
已知C 2H 4和C 3H 6的混合物的质量为m g ,则该混合物( )A .所含碳原子总数为m14N AB .所含碳氢键数目为3m14N AC .所含共用电子对数目为⎝ ⎛⎭⎪⎫m 14+1N AD .完全燃烧时消耗的O 2一定是33.6m14L解析:选A C 2H 4和C 3H 6的最简式均为CH 2,m g 混合物中“CH 2”的物质的量为m g 14 g ·mol -1=m 14 mol ,故m g 混合物中含有m 14 mol 碳原子,A 项正确;每个氢原子形成1个碳氢键,m g 混合物中共含有m7mol 氢原子,所含碳氢键数目为m 7N A ,故B 项错误;1个C 2H 4中共用电子对数为6,1个C 3H 6中共用电子对数为9,故m g 混合物中共用电子对数为3m14N A ,C 项错误;未指明O 2所处的条件,故无法计算m g 混合物完全燃烧时消耗的氧气的体积,D 项错误。
3.下列有关操作或判断正确的是( )A .配制一定物质的量浓度的溶液时,定容时仰视刻度线会导致所配溶液浓度偏高B.用托盘天平称取25.20 g NaClC.用100 mL的量筒量取5.2 mL的盐酸D.用浓盐酸配制一定物质的量浓度的稀盐酸,量取浓盐酸时仰视量筒的刻度线会导致所配溶液浓度偏高解析:选D 定容时仰视刻度线,导致所配溶液的体积偏大,使所配溶液的浓度偏低,A不正确;托盘天平的精确度是0.1 g,无法称取25.20 g NaCl,B 不正确;应用10 mL量筒量取5.2 mL的盐酸,C不正确;量取浓盐酸时仰视量筒的刻度线,所取的浓盐酸比应取的量多,溶质的物质的量增加,会导致所配溶液浓度偏高,D正确。
河北省2020-2021年高考化学二轮专题 03 化学中的常用计量

河北省2020-2021年高考化学二轮专题 03 化学中的常用计量姓名:________ 班级:________ 成绩:________一、单选题 (共14题;共28分)1. (2分)我国的“神舟”系列载人飞船已多次发射成功,“嫦娥”探月工程也已初步成功。
据科学家预测,月球的土壤中吸附着数百万吨的32He,每百吨32He核聚变所释放出的能量相当于目前人类一年消耗的能量。
在地球上,氦元素主要以42He的形式存在。
下列说法正确的是A . 32He和42He互为同位素B . 42He原子核内含有4个质子C . 32He原子核内含有3个中子D . 42He的最外层电子数为2,具有较强的金属性2. (2分)将标准状况下的aLHCl气体溶于1000g的水中,得到的盐酸密度为d g/cm3 ,则该盐酸的物质的量浓度为()A . mol/LB . mol/LC . mol/LD . mol/L3. (2分) (2018高二上·丰台月考) 设阿伏伽德罗常数为NA ,则下列说法正确的是()A . 15g甲基(-CH3)所含有的电子数是10NAB . 常温常压下,4g氦气所含有的原子数目为NAC . 标准状况下,1L戊烷充分燃烧后生成的气态产物的分子数为(5/22.4)NAD . 常温常压下,1mol丙烷所含有的共价键数为12NA4. (2分)物质的量相同的下列物质中,含原子数最多的是()A . O2B . NH3C . COD . CH45. (2分)常温下把体积相同的甲烷和氯气充入一个无色的集气瓶中,光照一段时间后,发现气体的黄绿色变浅,集气瓶上有淡黄绿色液滴,此时集气瓶中含有有机产物的种类是()A . 3种B . 4种C . 5种D . 6种6. (2分) (2018高一上·石家庄期中) 相对分子质量为M的某物质在室温下溶解度为Sg,此时测得饱和溶液的密度为dg·mL-1 ,则该饱和溶液的物质的量浓度是()A . mol·L-1B . mol·L-1C . mol·L-1D . mol·L-17. (2分)下列溶液中Cl﹣的物质的量最大的是()A . 10 mL 0.1 mol•L﹣1的AlCl3溶液B . 20 mL 0.1 mol•L﹣1的CaCl2溶液C . 30 mL 0.2 mol•L﹣1的KCl溶液D . 100 mL 0.25 mol•L﹣1的NaCl溶液8. (2分) (2017高一上·河北期中) 如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是()A . 所含原子数相等B . 气体密度相等C . 气体质量相等D . 摩尔质量相等9. (2分) (2016高一上·福州期中) 关于2mol•L﹣1 K2SO4溶液的下列说法正确的是()A . 溶液中含有2mol K2SO4B . 可将2mol K2SO4溶于1L水中制得C . 溶液中c(K+ )=4 mol•L﹣1D . 1L 溶液中含4molK+ , 4molSO42﹣10. (2分)(2018·新余模拟) 设NA为阿伏加德罗常数的值,下列说法正确的是()A . 氢氧燃料电池正极消耗22.4 L气体时,负极消耗的气体分子数目为2NAB . 2.0gD2O中含有的质子数、电子数均为NAC . 向含有FeI2的溶液中通入适量氯气,当有1molFe2+被氧化时,该反应转移电子数目一定为3NAD . 14g分子式为CnH2n的烃中含有的共价键的数目一定为2NA11. (2分) (2017高一上·昆明期中) 1molCO和1molCO2具有相同的()①分子数②原子数③C原子数④O原子数.A . ①④B . ②④C . ①③D . ①②③12. (2分) (2016高一上·会宁期中) 下列各组物质中所含原子数相同的是()A . 2 L CO和2 L O2B . 同温同压下,2LO2和N2与NO的混合气体2LC . 0.2 mol H2和4.48 L HClD . 标准状况下2 mol CO2和44.8 L水13. (2分) (2018高一上·新疆期中) 相同质量的H2SO4与H3PO4中的氢原子数之比为()A . 2: 3B . 3: 2C . 1:2D . 2:114. (2分)(2016·成都模拟) 设NA为阿伏加德罗常数的值,下列说法一定错误的是()A . 分子数为0.1NA 的N2 和NH3 混合气体,原子间含有的共用电子对数目为0.3NAB . 2 mol SO2 和1 mol O2 在一定条件下充分反应后,所得混合气体的分子数大于2NAC . 1.5 mol NO2 与足量水反应,转移的电子数为1.5NAD . 常温条件下,分子数为NA 的CO,N2混合气体质量为28 g二、填空题 (共2题;共11分)15. (3分) (2015高一上·涡阳月考) 下列物质中,物质的量最大的是________,摩尔质量最大的是________,标准状况下体积最大的是________,含氢原子个数最多的是________,质量最大的是________.A.6gH2B.0.8mol CH4C.1.204×1024个H2S分子D.147g H3PO4E.27mL水.16. (8分)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途.CuH的晶体结构如图所示,若CuH的密度为d g•cm﹣3 ,阿伏加德罗常数的值为NA ,则该晶胞的边长为________ cm(用含d和NA 的式子表示).三、综合题 (共4题;共33分)17. (21分) (2017高一上·岐山期中) 在标准状况下,将224.00L氯化氢气体溶于635.00mL的水(密度为1.00g/cm3)中,所得盐酸的密度为1.18g/cm3 .(要求有解题过程)(1)该盐酸的质量分数是多少?(2)取这种盐酸100.00mL,稀释到500.00mL,所得的稀盐酸的物质的量浓度为多少?18. (3分) (2018高二上·永年开学考) 金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca,并含有3.5%(质量分数)CaO.(1) Ca与最活跃的非金属元素A形成化合物D,D的电子式为________,D的沸点比A与形成的化合物E 的沸点________.(填“高”或“低”)(2)配平用钙线氧脱鳞的化学方程式:__P+ __FeO+__CaO __Ca3(PO4)2+__Fe(3)将钙线试样溶于稀盐酸后,加入过量溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色 .则金属M为________(填元素符号);检测溶液中含有的方法是________.(4)取1.6g钙线试样,与水充分反映,生成224mL (标准状况),在此溶液中通入适量的,最多能得到 ________g.19. (2分) (2018高一上·菏泽期中) 氮及其化合物与生产生活关系密切。
黑龙江省2020-2021年高考化学二轮专题 03 化学中的常用计量

黑龙江省2020-2021年高考化学二轮专题 03 化学中的常用计量姓名:________ 班级:________ 成绩:________一、单选题 (共14题;共28分)1. (2分) 92235U是一种重要的核燃料,其中“92”是指该原子的()A . 中子数B . 质子数C . 电子数D . 质量数2. (2分)某盐酸的物质的量浓度为12.0mol/L,其密度为1.19g/cm3 ,现有该浓度的盐酸100mL,则用于吸收HCl气体形成该盐酸的水的体积为()A . 75.2mLB . 85.5mLC . 90.8mLD . 100mL3. (2分)石墨晶体是层状结构,在每一层里,每一个碳原子都跟其它3个碳原子相结合.如图是石墨的晶体结构俯视图,图中每个黑点表示1个碳原子,而两黑点间的连线表示1个共价键,则石墨晶体中碳原子个数与共价键个数之比为()A . 1:3B . 2:3C . 2:1D . 3:24. (2分)下列物质中所含原子数按从多到少的顺序排列正确的是()①0.5mol NH3②标准状况下22.4L He ③4℃时18mL水④0.8mol H3PO4 .A . ①④③②B . ④③②①C . ②③④①D . ④③①②5. (2分) (2018高二下·台州期中) A~D是几种烃分子的球棍模型(如图所示),下列说法正确的是()A . A的二氯取代物只有一种,说明A为立体结构B . B不能使酸性高锰酸钾溶液褪色C . C中的碳氢质量比为6:1D . D能使溴水因反应而褪色6. (2分) (2018高一上·石家庄期中) 相对分子质量为M的某物质在室温下溶解度为Sg,此时测得饱和溶液的密度为dg·mL-1 ,则该饱和溶液的物质的量浓度是()A . mol·L-1B . mol·L-1C . mol·L-1D . mol·L-17. (2分) (2016高二上·邓州开学考) 把1.0mol/L CuSO4溶液、1.0mol/L Fe2(SO4)3溶液两种溶液等体积混合(假设混合后液体的体积等于混合前两种溶液的体积之和),向溶液中加入足量铁粉,经足够长的时间后,铁粉有剩余.此时溶液中Fe2+的物质的量浓度为()A . 1.0mol/LB . 2.0mol/LC . 3.0mol/LD . 4.0mol/L8. (2分)一气球若放在空气中静止不动,那么在相同条件下该气体放在下列气体中会下沉的是()A . CH4B . SO2C . CO2D . O29. (2分) (2016高一上·桐乡期中) 将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3﹣的物质的量浓度是()A . mol/LB . mol/LC . mol/LD . mol/L10. (2分)(2018·南昌模拟) 用NA表示阿伏加德罗常数的值,下列叙述中正确的是()A . 1L0.1mol/L的Na2CO3溶液中含阴离子总数为0.1 NA个B . 0.1mol的2H35Cl分子的中子数是2NAC . 1mol Na2O2与足量CO2充分反应转移的电子数目为2NAD . 加热条件下,含0.2mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数小于0.1NA11. (2分) (2018高一下·葫芦岛开学考) 设阿伏加德罗常数的值为NA ,则下列说法不正确的是()A . 1mol氯气参加氧化还原反应时电子转移数一定为2NAB . 3.2g SO2与2.3g NO2所含有的氧原子数相等C . 1molNaO2与足量水反应后转移的电子数为NAD . 1L0.1mol/L MgCl2溶液中Cl-离子数为0.2NA12. (2分)下列说法中正确的是()A . NA个N2分子和NA个CO分子的质量之比为1:1B . 水的摩尔质量等于NA个水分子的相对分子质量之和C . 分别由NA个水分子组成的水、冰、水蒸气的质量各不相同D . 1 mol N2的质量等于NA个氮原子的质量13. (2分) (2018高一上·黑龙江月考) 0.25mol A的质量是16g,则A的相对分子质量(或相对原子质量)是()A . 32g/molB . 64×10-3kg/molC . 32D . 6414. (2分) (2017高一上·腾冲期末) 用NA表示阿伏伽德罗常数的值,下列说法正确的是()A . 5.6g铁与足量的盐酸反应转移的电子数为0.3NAB . 常温常压下,11.2L甲烷中含有的氢原子数为2NAC . 标准状况下,22.4L氦气与22.4L氟气所含原子数均为2NAD . 常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA二、填空题 (共2题;共11分)15. (3分) (2015高一上·北京月考) 现有ag某气体,它由双原子分子构成,它的相对原子质量为M,若阿伏加德罗常数用NA表示,则该气体的物质的量为________ mol.将ag该气体溶于水中形成VmL溶液,其物质的量浓度为________ mol/L.16. (8分) (2016高一上·乐山期中) a g O2中含N个氧原子,则阿伏伽德罗常数为________.三、综合题 (共4题;共33分)17. (21分) (2017高一上·岐山期中) 在标准状况下,将224.00L氯化氢气体溶于635.00mL的水(密度为1.00g/cm3)中,所得盐酸的密度为1.18g/cm3 .(要求有解题过程)(1)该盐酸的质量分数是多少?(2)取这种盐酸100.00mL,稀释到500.00mL,所得的稀盐酸的物质的量浓度为多少?18. (3分) (2018高一上·吉林期中)(1)等质量的氧气和臭氧(O3),它们的物质的量之比为 ________;,原子的个数之比为 ________。
2020届高考化学二轮专题复习之难点突破 专题3 陌生离子方程式的书写技巧(解析版)

2020届高考化学二轮专题复习之难点突破专题3陌生离子方程式的书写技巧【考题回顾】1.(1)月球含有H 、He 、N 、Na 、Mg 、Si 等元素,是人类未来的资源宝库。
月球上某矿石经处理得到MgO 中含有少量SiO 2,除去SiO 2的离子方程式为________________。
(2)取少量铝粉和Fe 2O 3做铝热反应后所得的固体混合物,将其溶于足量稀H 2SO 4,滴加KSCN 溶液无明显现象,________(填“能”或“不能”)说明固体混合物中无Fe 2O 3,理由是________________________(用离子方程式说明)。
答案(1)SiO 2+2OH -===SiO 2-3+H 2O (2)不能Fe 2O 3+6H +===2Fe 3++3H 2O 、2Fe 3++Fe===3Fe 2+2.(1)Na 2CO 3溶液能和HCN 反应:Na 2CO 3+HCN===NaHCO 3+NaCN ,则向NaCN 溶液中通入少量CO 2时反应的离子方程式:_______________________________________________________。
(2)铈是一种重要的稀土金属元素,以下是其重要化合物Ce(OH)4的一种制备方法:铈矿石――→硫酸酸浸高铈硫酸稀土溶液――→硫酸钠除杂高铈硫酸盐溶液――→H 2O 2/H +还原硫酸铈钠溶液――→氨水Ce OH 3悬浊液――→O 2氧化Ce(OH)4(注:高铈是指溶液中Ce 为+4价)①写出加入氨水时发生反应的离子方程式________________________________________________________________。
②“氧化”过程若用NaClO 代替O 2,写出该反应的离子方程式____________________________________________________。
(3)金属Mg 与CH 3Cl 在一定条件下反应可生成CH 3MgCl ,CH 3MgCl 是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体和沉淀生成。
2020高考化学决胜二轮新高考省份专用版:专题三专题强化训练含答案

的电子数大于3N A.错误。
D项.标准状况下.CH2Cl2是液体.不能用气体摩尔体积计算其物质的量.错误。
9.用N A表示阿伏加德罗常数的值.下列说法不正确的是( )A.(20xx·高考海南卷)1 mol的CO和N2混合气体中含有的质子数为14N A B.(20xx·高考全国卷Ⅲ)0.1 mol的11B中.含有0.6N A个中子C.(20xx·高考全国卷Ⅲ)pH=1的H3PO4溶液中.含有0.1N A个H+D.14 g乙烯和丙烯混合气体中的氢原子数为2N A答案:C二、选择题:每小题有一个或两个选项符合题意。
10.(20xx·泰安高三模拟)用N A表示阿伏加德罗常数的值.下列说法正确的是( )A.1 mol 甲烷完全燃烧转移的电子数为8N AB.1 mol Fe溶于过量硝酸.电子转移数为2N AC.1 mol乙烷和1 mol乙烯中.化学键数相同D.1 mol 乙烯分子中含有的碳氢键数为4N A答案:AD11.用N A表示阿伏加德罗常数的值.下列说法正确的是( )A.电解精炼铜时.当外电路中通过N A个电子.阳极质量减少32 gB.反应3H2(g)+N2(g)2NH3(g) ΔH=-92 kJ·mol-1.当放出热量9.2 kJ时转移电子0.6N AC.1 mol·L-1的氯化镁溶液中.若Cl-的数目为2N A.则Mg2+的数目为N AD.标准状况下.NO和O2各11.2L混合充分反应.所得气体的分子总数为0.75N A解析:选B。
阳极反应中除铜失电子外.还有锌、铁等杂质失去电子.A项错误;由热化学方程式可知.该反应转移6 mol电子时.放出热量92 kJ.故放出热量9.2 kJ时.转移0.6 mol电子.B项正确;Mg2+能水解.故其数目小于N A.C 项错误;该反应过程中存在可逆反应2NO2N2O4.D项错误。
12.设N A为阿伏加德罗常数的值.下列有关叙述不正确的是( )A.标准状况下.2.24 L HF与1.8 g H2O所含电子数目均为N AB.标准状况下.V L气态烯烃(C n H2n)含中子的数目为3VnNA 11.2数为4N A.B项正确;该电池总反应的化学方程式为2Ag2O+HCHO===4Ag+CO2+H2O.C项正确;根据电子转移守恒可知.消耗1 mol HCHO时.转移4 mol 电子.可以把4 mol Fe3+还原为Fe2+.D项不正确。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
五华县横陂中学2020年高考化学二轮复习专题练习(三)化学计量一、练高考1.【2016年高考海南卷】利用太阳能分解制氢,若光解0.02 mol 水,下列说法正确的是( ) A .可生成2H 的质量为0.02 gB .可生成氢的原子数为232.40810⨯个C .可生成2H 的体积为0.224 L (标准情况)D .生成2H 的量理论上等于0.04 mol Na 与水反应产生2H 的量2.【2016年高考江苏卷】下列说法正确的是( )A .氢氧燃料电池工作时,2H 在负极上失去电子B .0.1 mol/L 23Na CO 溶液加热后,溶液的pH 减小C .常温常压下,22.4 L 2Cl 中含有的分子数为236.0210⨯个D .室温下,稀释0.1 mol/L 3CH COOH 溶液,溶液的导电能力增强3.【2016年高考上海卷】某铁的氧化物(X Fe O )1.52 g 溶于足量盐酸中,向所得溶液中通入标准状况下112 ml 2Cl ,恰好将2Fe +完全氧化。
x 值为( )A .0.80B .0.85C .0.90D .0.934.【2015新课标Ⅱ卷理综化学】A N 代表阿伏加德罗常数的值。
下列叙述正确的是( ) A .60 g 丙醇中存在的共价键总数为10A NB .1 L0.1 -mol L 的3NaHCO 溶液中3HCO -和23CO -离子数之和为0.1A NC .钠在空气中燃烧可生成多种氧化物,23 g 钠充分燃烧时转移电子数为1A ND .235 g 核互23592U 发生裂变反应:23592U +1901361038540n Sr U 10n −−−→++裂变,净产生的中子10n 数为10A N 5.【2015新课标Ⅰ卷理综化学】A N 为阿伏伽德罗常数的值。
下列说法正确的是( ) A .18 g 2D O 和18 g 2H O 中含有的质子数均为10A NB .2 L0.5 mol/L 亚硫酸溶液中含有的H +两种数为2A NC .过氧化钠与水反应时,生成0.1 mol 氧气转移的电子数为0.2A ND .密闭容器中2 mol NO 与1 mol 2O 充分反应,产物的分子数为2A N6.【2015上海化学】将2O 和3NH 的混合气体448 mL 通过加热的三氧化二铬,充分反应后,再通过足量的水,最终收集到44.8 mL 气体。
原混合气体中2O 的体积可能是(假设氨全部被氧化;气体体积均已换算成标准状况)( )A .231.5 mLB .268.8 mLC .287.5 mLD .313.6 mL7.【2015四川理综化学】设A N 为阿伏加德罗常数的值,下列说法正确的是( )A .2.0 g 182H O 与2D O 的混合物中所含中子数为A NB .常温常压下,4.4 g 乙醛所含σ键数目为0.7A NC .标准状况下,5.6 L 2CO 与足量22Na O 反应转移的电子数为0.5A ND .50 ml12 mol/L 盐酸与足量2MnO 共热,转移的电子数为0.3A N8.【2015广东理综化学】设A N 为阿伏伽德罗常数的数值,下列说法正确的是( )A .23g A N 与足量2H O 反应完全后可生成A N 个2H 分子B .1 mol Cu 和足量热浓硫酸反应可生成A N 个3SO 分子C .标准状况下,22.4 L 2N 和2H 混合气中含8A N 个原子D .3 mol 单质Fe 完全转变为Fe 3O 4,失去8A N 个电子9.【2015海南化学】下列指定微粒的数目相等的是( )A .等物质的量的水与重水含有的中子数B .等质量的乙烯和丙烯中含有的共用电子对数C .同温、同压同体积的CO 和NO 含有的质子数D .等物质的量的铁和铝分别于足量氯气完全反应时转移的电子数10.【2015上海化学】(本题共14分)氨碱法制纯碱包括石灰石分解、粗盐水精制、氨盐水碳酸化等基本步骤。
完成下列计算:(1)3CaCO 质量分数为0.90的石灰石100 kg 完成分解产生2CO ________L (标准状况)。
石灰窑中,该石灰石100 kg 与焦炭混合焙烧,产生2CO 29 120 L (标准状况),如果石灰石中碳酸钙完全分解,且焦炭完全燃烧,不产生CO ,则焦炭的物质的量为__________mol 。
(2)已知粗盐水含2MgCl 6.80 3mol/m ,含2C a C l 3.00 3mol/m 向粗盐水中加入2Ca(OH)除镁离子:2MgCl +2Ca(OH)→2Mg(OH)↓+2CaCl 然后加入23Na CO 除钙离子。
处理上述粗盐10 3m ,至少需要加23Na CO __________g 。
如果用碳酸化尾气(含3NH 体积分数为0.100、2CO 体积分数0.040)代替碳酸钠,发生如下反应:32+4223+2NH +CO +H C O a aCO H C +2N →↓处理上述103m 粗盐水至少需要通入多少L (标准状况)碳酸化尾气?列式计算。
(3)某氨盐水含氯化钠1 521 kg ,通入二氧化碳后析出碳酸氢钠晶体,过滤后溶液中含氯化铵1 070 kg 。
列式计算:①过滤后溶液中氯化钠的质量。
②析出的碳酸氢钠晶体的质量11.【2016年高考新课标Ⅰ卷】(3)在化学分析中采用24K CrO 为指示剂,以3AgNO 标准溶液滴定溶液中的Cl -,利用Ag +与24CrO -生成砖红色沉淀,指示到达滴定终点。
当溶液中Cl -恰好完全沉淀(浓度等于5-1.010mol L -⨯)时,溶液中c (Ag +)为_______-mol L ,此时溶液中c (24CrO -)等于__________-mol L (已知24Ag CrO 、AgCl 的SP K 分别为122.010-⨯和102.010-⨯)。
12.【2016年高考新课标Ⅱ卷】联氨(又称联肼,24N H ,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:(5)联氨是一种常用的还原剂。
向装有少量AgBr 的试管中加入联氨溶液,观察到的现象是_________________________。
联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。
理论上1 kg 的联氨可除去水中溶解的2O ______kg ;与使用23Na SO 处理水中溶解的2O 相比,联氨的优点是_______________________________________________。
13.【2016年高考上海卷】(本题共14分)2CO 是重要的化工原料,也是应用广发的化工产品。
2CO 与过氧化钠或超氧化钾反应可产生氧气。
完成下列计算:(1)2CO 通入氨水生成43NH HCO ,43NH HCO 很容易分解。
2.00 mol 43NH HCO 完全分解,分解产物经干燥后的体积为_________L (标准状况)。
(2)某H 2中含有2.40 mol 2CO ,该混合气体通入2.00 L NaOH 溶液中,2CO 被完全吸收。
如果NaOH 完全反应,该NaOH 溶液的浓度为_______。
(3)2CO 和2KO 有下列反应:2223224KO 2CO K CO 3O ++→222324KO 4CO 2H O 34KHCO O →+++若9 mol 2CO 在密封舱内和2KO 反应后生成9 mol 2O ,则反应前密封舱内2H O 的量应该是多少?列式计算。
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:422CH H O CO 3H ∆+−−−→+催化剂 已知:23CO 2H CH OH ∆+−−−→催化剂 2232CO 3H CH OH H O ∆+−−−→+催化剂 300 molCH 4完全反应后的产物中,加入100 mol 2CO 后合成甲醇。
若获得甲醇350 mol ,残留氢气120 mol ,计算2CO 的转化率。
二、练模拟1.【百强校·2016届贵阳市第六元月月考】设表示阿伏加德罗常数的值。
下列叙述正确的是( ) A .13.8 g 2NO 与足量水反应,转移电子数目为0.2A NB .标准状况下,22.4 L 溴苯中含有氢原子数目为5A NC .500 mL 2 mol/L 43NH NO 溶液中,含有+4NH 数目为A N D .用惰性电极电解足量4GuSO 溶液,生成22.4 L 气体时转移电子数目为4A N2.【百强校·2016届日照一中期末】A N 表示阿伏加德罗常数的值。
下列说法中正确的是( ) ①常温下,0.1 mol 2Cl 与足量NaOH 溶液反应,转移的电子数目为0.2A N②l mol 羟基(OH —)与17 g 3NH 所含电子数分别为9A N 和10A N③将100 mL0.1 -mol L 3FeCl 溶液滴入沸水中可制得3Fe(OH)胶粒0.01A N④在反应322KIO 6HI KI 3I 3H O +++€中,每生成3 mol 2I 转移的电子数为5A NA .①④B .②④C .②⑤D .③④ A N-mol L3FeCl溶液中,阴、阳离子总数.一定条件下,将1 mol SO48HCl=KCl +1.A N 为阿伏加德罗常数的值,下列说法正确的是( )A .常温常压下,2.24 L 2SO 所含有的分子数小于0.1A NB .1 L1-mol L 3FeCl 溶液完全水解产生的3Fe(OH)胶体粒子数为A NC .氢氧燃料电池正极消耗22.4 L 气体时,电路中通过的电子数目为4A ND .28.6 g 232Na CO 10H O g 溶于水配成1 L 溶液,该溶液中阴离子数目为0.1A N2.将11.2 g 铜粉和镁粉的混合物分成两等份,其中一份加入200 mL 的稀硝酸中并加热,固体和硝酸恰好完全反应,并产生标准状况下的NO 2.24 L ;将另一份在空气中充分加热,最后得到mg 固体。
下列有关说法:①-3c(HNO )2mol L =g ②(-3(HNO )0.5mol L =g )③m =8.0④m =7.2其中正确的是( )A .①④B .①③C .②④D .②③3.用A N 表示阿伏加德罗常数的值,下列叙述正确的是( )A .2Na O 和22Na O 的混合物共1 mol ,阴离子数目在A N ~2A N 之间B .1 mol OH -和1 mol OH -(羟基)中含有的质子数均为9A NC .铁做电极电解食盐水,若阴极得到A N 个电子,则阳极产生11.2 L 气体(标准状况下)D .某密闭容器盛有0.1 mol 2N 和0.3 mol 2H ,在一定条件下充分反应,转移电子的数目为0.6A N 4.下列叙述正确的是( )A .1.00 mol NaCl 中含有236.0210⨯个NaCl 分子B .欲配制1.00 L1.00 mol·L -1的NaCl 溶液,可将58.5 g NaCl 溶于1.00 L 水中C .1.00 mol NaCl 中,所有+Na 的最外层电子总数为238 6.0210⨯⨯D .电解58.5 g 熔融的NaCl ,能产生22.4 L 氯气(标准状况)、23.0 g 金属钠5.某溶液中(假定不考虑水解因素)仅含有K +、2Mg +、24SO -、3NO -四种离子,其中K +与2Mg +的个数之比为4∶5,则3NO -与24SO -的物质的量浓度之比一定不是( )A .8∶3B .3∶2C .2∶3D .1∶3。
