2020-2021备战高考化学化学能与电能(大题培优易错试卷)
2020-2021备战高考化学化学能与电能(大题培优 易错 难题)附详细答案

2020-2021备战高考化学化学能与电能(大题培优易错难题)附详细答案一、化学能与电能1.电解原理在化学工业中有广泛应用。
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
请回答以下问题。
若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,则:(1)电解池中X极上的电极反应式是____________,在X极附近观察到的现象是_________________。
(2)Y电极上的电极反应式是____________,检验该电极反应产物的方法是____________。
【答案】2H++2e-=H2↑放出气体,溶液变红 2Cl--2e-=Cl2↑把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝【解析】【详解】由题意或图像可知,此池为电解池,X极为阴极,Y极为阳极。
电极为惰性电极,饱和NaCl溶液中存在Na+、Cl-、H+、OH-,在阴极上,H+放电能力强于Na+,故阴极上发生的电极反应式为2H++2e-=H2↑,因而导致X极附近有气体放出,溶液呈碱性,溶液颜色由无色变为红色;在阳极上,Cl-放电能力强于OH-,故阳极上发生的电极反应式为2Cl--2e-=Cl2↑。
2.现需设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积(约6 mL)和检验氯气的氧化性(不应将多余的氯气排入空气中)。
(1)试从上图图1中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是:A接______,B接______。
(2)碳棒上发生的电极反应为_______。
(3)能说明氯气具有氧化性的实验现象是_______。
(4)假定装入的饱和食盐水为50 mL(电解前后溶液体积变化可忽略),当测得的氢气为5.6 mL(已折算成标准状况)时,溶液的pH为____。
(5)工业上采用离子交换膜法电解饱和食盐水,如上图图2,该离子交换膜是__(填“阳离子”或“阴离子”)交换膜,溶液A是_______(填溶质的化学式)【答案】G、F、I D、E、C 2Cl--2e-=Cl2↑淀粉-KI溶液变成蓝色 12 阳离子 NaOH 【解析】【分析】(1)实验的目的是电解饱和食盐水,并测量电解产生的氢气的体积(约6 mL)和检验氯气的氧化性,结合装置的作用来连接装置;(2)实验目的生成氢气和氯气,所以铁应为阴极,碳棒为阳极;(3)氯气具有氧化性,能氧化碘离子生成碘单质,使淀粉碘化钾溶液变蓝色说明;(4)电解饱和食盐水的方程式:2NaCl+2H2O 2NaOH+H2↑+Cl2↑,利用公式c=nV来计算NaOH的物质的量浓度,然后求出氢离子的浓度,最后求出pH;(5)氢气在阴极生成,则b为阴极,a为阳极,阳离子向阴极移动,则离子交换膜允许阳离子通过;a极上氯离子失电子,生成氯气同时溶液中生成NaOH。
2020-2021备战高考化学化学能与电能(大题培优 易错 难题)含答案解析

2020-2021备战高考化学化学能与电能(大题培优易错难题)含答案解析一、化学能与电能1.方法与规律提炼:(1)某同学利用原电池装置证明了反应Ag++Fe2+=Ag+Fe3+能够发生,设计的装置如下图所示。
为达到目的,其中石墨为_________极,甲溶液是____________,证明反应Ag++Fe2+=Ag +Fe3+能够发生的实验操作及现象是_________________________(2)用零价铁(Fe)去除水体中的硝酸盐(NO)已成为环境修复研究的热点之一。
Fe还原水体中NO3-的反应原理如图所示。
上图中作负极的物质是___________。
正极的电极反应式是______________。
(3)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:阴极区的电极反应式为_______________。
电路中转移1 mol电子,需消耗氧气_______L(标准状况)。
(4)KClO3也可采用“电解法”制备,装置如图所示。
写出电解时阴极的电极反应式___________________电解过程中通过阳离子交换膜的离子主要为_________,其迁移方向是_____________(填a→b或b→a)。
学法题:通过此题的解答,请归纳总结书写电极反应式的方法____【答案】负 FeSO4或FeCl2溶液分别取电池工作前与工作一段时间后左侧烧杯中溶液,同时滴加KSCN溶液,后者红色加深铁 NO3-+8e-+10H+=NH4++3H2O Fe3++e-= Fe2+ 5.6L 2H++2e-= H2 ↑ K+a→b原电池中先确定原电池的正负极,列出正负极上的反应物质,并标出相同数目电子的得失;注意负极反应生成的阳离子与电解质溶液中的阴离子是否共存。
电解池中电极反应式的书写看阳极材料,如果阳极是惰性电极(Pt、Au、石墨),则应是电解质溶液中的离子放电,应根据离子的放电顺序进行书写。
2020-2021备战高考化学培优易错试卷(含解析)之化学能与电能及答案

2020-2021备战高考化学培优易错试卷(含解析)之化学能与电能及答案一、化学能与电能1.硝酸是氧化性酸,其本质是NO3-有氧化性,某课外实验小组进行了下列有关NO3-氧化性的探究(实验均在通风橱中完成)。
实验装置编号溶液X实验现象实验Ⅰ 6 mol·L-1稀硝酸电流计指针向右偏转,铜片表面产生无色气体,在液面上方变为红棕色。
实验Ⅱ15 mol·L-1浓硝酸电流计指针先向右偏转,很快又偏向左边,铝片和铜片表面产生红棕色气体,溶液变为绿色。
(1)实验Ⅰ中,铝片作____________(填“正”或“负”)极。
液面上方产生红棕色气体的化学方程式是____________。
(2)实验Ⅱ中电流计指针先偏向右边后偏向左边的原因是________________。
查阅资料:活泼金属与1 mol·L-1稀硝酸反应有H2和NH4+生成,NH4+生成的原理是产生H2的过程中NO3-被还原。
(3)用上图装置进行实验Ⅲ:溶液X为1 mol·L-1稀硝酸溶液,观察到电流计指针向右偏转。
① 反应后的溶液中含NH4+。
实验室检验NH4+的方法是________。
② 生成NH4+的电极反应式是________。
(4)进一步探究碱性条件下NO3-的氧化性,进行实验Ⅳ:① 观察到A中有NH3生成,B中无明显现象。
A、B产生不同现象的解释是________。
②A中生成NH3的离子方程式是________。
(5)将铝粉加入到NaNO3溶液中无明显现象,结合实验Ⅲ和Ⅳ说明理由________。
【答案】负 2NO+O2=2NO2 Al开始作电池的负极,Al在浓硝酸中迅速生成致密氧化膜后,Cu作负极取少量待检溶液于试管中,加入浓NaOH溶液,加热,若产生使湿润的红色石蕊试纸变蓝的气体,则溶液中含NH4+ NO3-+8e-+10 H+=NH4++3H2O Al与NaOH溶液反应产生H2的过程中可将NO3-还原为NH3,而Mg不能与NaOH溶液反应 8Al+3NO3-+5OH-+2H2O=3NH3↑+8AlO2-因为铝与中性的硝酸钠溶液无生成H2的过程,NO3-无法被还原【解析】【分析】【详解】(1)实验Ⅰ中,由于Al的金属活动性比Cu强,因此Al做负极。
2020-2021备战高考化学易错题精选-化学能与电能练习题含答案
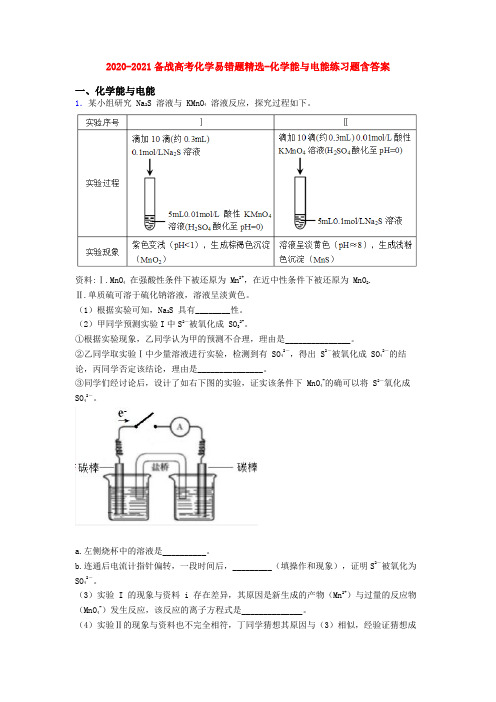
2020-2021备战高考化学易错题精选-化学能与电能练习题含答案一、化学能与电能1.某小组研究 Na2S 溶液与 KMnO4溶液反应,探究过程如下。
资料:Ⅰ.MnO4在强酸性条件下被还原为 Mn2+,在近中性条件下被还原为 MnO2.Ⅱ.单质硫可溶于硫化钠溶液,溶液呈淡黄色。
(1)根据实验可知,Na2S 具有________性。
(2)甲同学预测实验I中S2-被氧化成 SO32-。
①根据实验现象,乙同学认为甲的预测不合理,理由是_______________。
②乙同学取实验Ⅰ中少量溶液进行实验,检测到有 SO42-,得出 S2-被氧化成 SO42-的结论,丙同学否定该结论,理由是_______________。
③同学们经讨论后,设计了如右下图的实验,证实该条件下 MnO4-的确可以将 S2-氧化成SO42-。
a.左侧烧杯中的溶液是__________。
b.连通后电流计指针偏转,一段时间后,_________(填操作和现象),证明S2-被氧化为SO42-。
(3)实验 I 的现象与资料 i 存在差异,其原因是新生成的产物(Mn2+)与过量的反应物(MnO4-)发生反应,该反应的离子方程式是______________。
(4)实验Ⅱ的现象与资料也不完全相符,丁同学猜想其原因与(3)相似,经验证猜想成立,他的实验方案_______。
(5)反思该实验,反应物相同,而现象不同,体现了物质变化不仅与其自身的性质有关,还与__________因素有关。
【答案】还原溶液呈紫色.说明酸性KMnO4溶液过量SO32-能被其继续氧化KMnO4溶液是用H2SO4酸化的,故溶液中检测出SO42-不能证明一定是氧化新生成的0.1mol/LNa2S溶液取左侧烧杯中的溶液,用盐酸酸化后, 滴加BaCl2溶液.观察到有白色沉淀生成2MnO4-+3Mn2++2H2O=5MnO2↓+H+将实验I中生成的MnO2分离洗涤后(或取MnO2),加入0.1mol/LNa2S 溶液.观察到有浅粉色沉淀.且溶液呈淡黄色F证明新生成的MnO2与过量的S 反应.故没得到MnO2 沉淀用量、溶液的酸碱性【解析】(1)根据实验I可知,高锰酸钾溶液的紫色变浅,说明Na2S 具有还原性,故答案为:还原;(2)①根据实验现象,溶液呈紫色,说明酸性KMnO4溶液过量,SO32-能被其继续氧化,因此甲的预测不合理,故答案为:溶液呈紫色,说明酸性KMnO4溶液过量,SO32-能被其继续氧化;②KMnO4溶液是用H2SO4酸化的,故溶液中检测出SO42-不能证明一定是氧化新生成的,因此S2-被氧化成 SO42-的结论不合理,故答案为:KMnO4溶液是用H2SO4酸化的,故溶液中检测出SO42-不能证明一定是氧化新生成的;③a.根据图示,左侧烧杯中发生氧化反应,为原电池的负极,根据题意,要达到MnO4-将S2-氧化成SO42-的目的,左侧烧杯中的溶液可以是0.1mol/LNa2S溶液,右侧烧杯中的溶液可以是0.1mol/LKMnO4溶液,故答案为:0.1mol/LNa2S溶液;b.连通后,高锰酸钾与硫化钠溶液发生氧化还原反应,电流计指针偏转,一段时间后,取左侧烧杯中的溶液,用盐酸酸化后,滴加BaCl2溶液,观察到有白色沉淀生成,证明 S2-被氧化为 SO42-,故答案为:取左侧烧杯中的溶液,用盐酸酸化后,滴加BaCl2溶液,观察到有白色沉淀生成;(3)Mn2+与过量的MnO4-反应生成二氧化锰沉淀,反应的离子方程式为2MnO4-+3Mn2++2H2O=5MnO2↓+H+,故答案为:2MnO4-+3Mn2++2H2O=5MnO2↓+H+;(4)实验Ⅱ的现象与资料也不完全相符,丁同学猜想其原因与(3)相似,经验证猜想成立,实验方案可以为:将实验I中生成的MnO2分离洗涤后(或取MnO2),加入0.1mol/LNa2S溶液.观察到有浅粉色沉淀.且溶液呈淡黄色F证明新生成的MnO2与过量的S 反应.故没得到MnO2 沉淀,故答案为:将实验I中生成的MnO2分离洗涤后(或取MnO2),加入0.1mol/LNa2S溶液.观察到有浅粉色沉淀.且溶液呈淡黄色F证明新生成的MnO2与过量的S 反应.故没得到MnO2 沉淀;(5)反思该实验,反应物相同,而现象不同,体现了物质变化不仅与其自身的性质有关,还与反应物的用量、溶液的酸碱性等因素有关,故答案为:反应物的用量、溶液的酸碱性。
2020-2021备战高考化学化学能与电能(大题培优易错试卷)附详细答案

2020-2021备战高考化学化学能与电能(大题培优易错试卷)附详细答案一、化学能与电能1.研究小组进行图所示实验,试剂A为0.2 mol·L−1 CuSO4溶液,发现铝条表面无明显变化,于是改变实验条件,探究铝和CuSO4溶液、CuCl2溶液反应的影响因素。
用不同的试剂A进行实验1~实验4,并记录实验现象:实验序号试剂A实验现象10.2 mol·L−1 CuCl2溶液铝条表面有气泡产生,并有红色固体析出20.2 mol·L−1 CuSO4溶液,再加入一定质量的NaCl固体开始铝条表面无明显变化,加NaCl后,铝条表面有气泡产生,并有红色固体析出3 2 mol·L−1 CuSO4溶液铝条表面有少量气泡产生,并有少量红色固体4 2 mol·L−1 CuCl2溶液反应非常剧烈,有大量气泡产生,溶液变成棕褐色,有红色固体和白色固体生成(1)实验1中,铝条表面析出红色固体的反应的离子方程式为_________。
(2)实验2的目的是证明铜盐中的阴离子Cl−是导致实验1中反应迅速发生的原因,实验2中加入NaCl固体的质量为_________ g。
(3)实验3的目的是_________。
(4)经检验知,实验4中白色固体为CuCl。
甲同学认为产生白色固体的原因可能是发生了Cu + CuCl 22CuCl的反应,他设计了右图所示实验证明该反应能够发生。
① A极的电极材料是_________。
② 能证明该反应发生的实验现象是_________。
(5)为探究实验4中溶液呈现棕褐色的原因,分别取白色CuCl固体进行以下实验:实验序号实验操作实验现象i加入浓NaCl溶液沉淀溶解,形成无色溶液ii加入饱和AlCl3溶液沉淀溶解,形成褐色溶液iii向i所得溶液中加入2 mol·L-1 CuCl2溶液溶液由无色变为褐色查阅资料知:CuCl难溶于水,能溶解在Cl-浓度较大的溶液中,生成[CuCl2]-络离子,用水稀释含[CuCl2]-的溶液时会重新析出CuCl沉淀。
2020-2021备战高考化学化学能与电能(大题培优易错试卷)附答案

2020-2021备战高考化学化学能与电能(大题培优易错试卷)附答案一、化学能与电能1.某小组同学利用如图所示装置进行铁的电化学腐蚀原理的探究实验:装置分别进行的操作现象i.连好装置一段时间后,向烧杯中滴加酚酞ii.连好装置一段时间后,向烧杯中滴加K3[Fe(CN)6]溶液铁片表面产生蓝色沉淀(1)小组同学认为以上两种检验方法,均能证明铁发生了吸氧腐蚀。
①实验i中的现象是___。
②用电极反应式解释实验i中的现象:___。
(2)查阅资料:K3[Fe(CN)6]具有氧化性。
①据此有同学认为仅通过ii中现象不能证明铁发生了电化学腐蚀,理由是___。
②进行下列实验,在实验几分钟后的记录如下:实验滴管试管现象0.5mol·L-1K3[Fe(CN)6]溶液iii.蒸馏水无明显变化iv.1.0mol·L-1NaCl溶液铁片表面产生大量蓝色沉淀v.0.5mol·L-1Na2SO4溶液无明显变化以上实验表明:在有Cl-存在条件下,K3[Fe(CN)6]溶液可以与铁片发生反应。
为探究Cl-的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验iii,发现铁片表面产生蓝色沉淀。
此补充实验表明Cl-的作用是___。
(3)有同学认为上述实验仍不够严谨。
为进一步探究K3[Fe(CN)6]的氧化性对实验ii结果的影响,又利用(2)中装置继续实验。
其中能证实以上影响确实存在的是__(填字母序号)。
实验试剂现象A酸洗后的铁片、K3[Fe(CN)6]溶液(已除O2)产生蓝色沉淀(4)综合以上实验分析,利用实验ii中试剂能证实铁发生了电化学腐蚀的实验方案是:连好装置一段时间后,___(回答相关操作、现象),则说明负极附近溶液中产生了Fe2+,即发生了电化学腐蚀。
【答案】碳棒附近溶液变红 O2+4e-+2H2O=4OH- K3[Fe(CN)6]可能氧化Fe生成Fe2+,会干扰由于电化学腐蚀负极生成Fe2+的检验 Cl-破坏了铁片表面的氧化膜 AC 取铁片(负极)附近溶液于试管中,滴加K3[Fe(CN)6]溶液,若出现蓝色沉淀【解析】【分析】(1)①实验i中,发生吸氧腐蚀,在碳棒附近溶液中生成OH-,使酚酞变色。
2020-2021高考化学培优易错试卷(含解析)之化学能与电能及答案解析

2020-2021高考化学培优易错试卷(含解析)之化学能与电能及答案解析一、化学能与电能1.氯化亚砜又称亚硫酰氯,其分子式为 SOCl2,常温常压下为淡黄色液体,遇水易水解。
国内的氯化亚砜主要应用于医药、农药、染料等行业。
实验室用干燥纯净的 Cl2、SO2和SCl2制备 SOCl2的部分装置如图所示:已知:①SOCl2沸点为 78.8℃,SCl2 的沸点为 50℃,且两种液体可互溶。
②SOCl2遇水剧烈反应,液面上产生白雾,并有气体产生。
请回答:(1)实验室制取 SOCl2的反应方程式为____________(2)写出丙中发生的离子反应_____________(3)仪器 e 的名称是___________,实验仪器的连接顺序为a→_________(仪器可以重复使用)。
(4)仪器 f 的作用是 ____________(5)实验结束后,将三颈烧瓶中混合物分离的实验操作名称是______。
(6)工业上常用 ZnCl2·2H2O 与 SOCl2共热制取 ZnCl2。
写出用惰性电极电解ZnCl2和盐酸的混合溶液的总反应离子反应式为_______。
甲同学认为 SOCl2还可用作FeCl3·6H2O 制取无水FeCl3的脱水剂,但乙同学对此提出质疑,可能的原因是____【答案】SO2+Cl2+SCl22SOCl22MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O球形冷凝管c→d→c→d→b吸收SO2、Cl2,防止外界水蒸气进入装置分馏(或蒸馏)2H++2Cl—H2↑+Cl2↑SOCl2可能会与Fe3+发生氧化还原反应【解析】【分析】由实验装置图可知,丙装置中浓盐酸与高锰酸钾反应制备氯气,因氯气中混有氯化氢和水蒸气,所以先将气体通过盛有饱和食盐水的乙装置除去氯化氢,再通过盛有浓硫酸的乙装置除去水蒸气,干燥的氯气、二氧化硫和SCl2在三颈烧瓶中,在活性炭作催化剂作用下,反应制得SOCl2,二氯化硫(SCl2)的沸点低,甲装置中球形冷凝管的作用是起冷凝回流SCl2的作用,干燥管中碱石灰的作用是防止有毒的氯气与二氧化硫逸出污染环境,同时防止空气中的水蒸气进入烧瓶中使氯化亚砜水解。
2020-2021备战高考化学 化学能与电能 培优 易错 难题练习(含答案)

2020-2021备战高考化学化学能与电能培优易错难题练习(含答案)一、化学能与电能1.方法与规律提炼:(1)某同学利用原电池装置证明了反应Ag++Fe2+=Ag+Fe3+能够发生,设计的装置如下图所示。
为达到目的,其中石墨为_________极,甲溶液是____________,证明反应Ag++Fe2+=Ag +Fe3+能够发生的实验操作及现象是_________________________(2)用零价铁(Fe)去除水体中的硝酸盐(NO)已成为环境修复研究的热点之一。
Fe还原水体中NO3-的反应原理如图所示。
上图中作负极的物质是___________。
正极的电极反应式是______________。
(3)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:阴极区的电极反应式为_______________。
电路中转移1 mol电子,需消耗氧气_______L(标准状况)。
(4)KClO3也可采用“电解法”制备,装置如图所示。
写出电解时阴极的电极反应式___________________电解过程中通过阳离子交换膜的离子主要为_________,其迁移方向是_____________(填a→b或b→a)。
学法题:通过此题的解答,请归纳总结书写电极反应式的方法____【答案】负 FeSO4或FeCl2溶液分别取电池工作前与工作一段时间后左侧烧杯中溶液,同时滴加KSCN溶液,后者红色加深铁 NO3-+8e-+10H+=NH4++3H2O Fe3++e-= Fe2+ 5.6L 2H++2e-= H2 ↑ K+a→b原电池中先确定原电池的正负极,列出正负极上的反应物质,并标出相同数目电子的得失;注意负极反应生成的阳离子与电解质溶液中的阴离子是否共存。
电解池中电极反应式的书写看阳极材料,如果阳极是惰性电极(Pt、Au、石墨),则应是电解质溶液中的离子放电,应根据离子的放电顺序进行书写。
2020-2021高考化学培优易错试卷(含解析)之化学能与电能含答案

2020-2021高考化学培优易错试卷(含解析)之化学能与电能含答案一、化学能与电能1.某小组设计不同实验方案比较Cu2+、Ag+ 的氧化性。
查阅资料:Ag+ + I-= AgI↓ K1=1.2×1016;2Ag+ + 2I-= 2Ag↓+ I2K2= 8.7×108(1)方案1:通过置换反应比较向酸化的AgNO3溶液插入铜丝,析出黑色固体,溶液变蓝,说明氧化性Ag+>Cu2+。
反应的离子方程式是___________________________________________________。
(2)方案2:通过Cu2+、Ag+ 分别与同一物质反应进行比较实验试剂编号及现象试管滴管1.0 mol/LKI溶液1.0 mol/L AgNO3溶液Ⅰ.产生黄色沉淀,溶液无色1.0 mol/L CuSO4溶液Ⅱ.产生白色沉淀A,溶液变黄①经检验,Ⅰ中溶液不含I2,黄色沉淀是________。
②经检验,Ⅱ中溶液含I2。
推测Cu2+做氧化剂,白色沉淀A是CuI。
确认A的实验如下:a.检验滤液无I2。
溶液呈蓝色说明溶液含有________(填离子符号)。
b.白色沉淀B是________。
c.白色沉淀A与AgNO3溶液反应的离子方程式是___________,说明氧化性Ag+>Cu2+。
(3)分析方案2中Ag+ 未能氧化I- ,但Cu2+氧化了I-的原因,设计实验如下:编号实验1实验2实验3实验KI溶液KI溶液 AgNO3溶液a bKI溶液 CuSO4溶液c d(电极均为石墨,溶液浓度均为 1 mol/L,b、d中溶液pH≈4)①a中溶液呈棕黄色的原因是___________________________(用电极反应式表示)。
②“实验3”不能说明Cu2+氧化了I-。
依据是空气中的氧气也有氧化作用,设计实验证实了该依据,实验方案及现象是_____________________________。
2020-2021高考化学培优易错试卷(含解析)之化学能与电能及答案

2020-2021高考化学培优易错试卷(含解析)之化学能与电能及答案一、化学能与电能1.电解原理在化学工业中有广泛应用。
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
请回答以下问题。
若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,则:(1)电解池中X极上的电极反应式是____________,在X极附近观察到的现象是_________________。
(2)Y电极上的电极反应式是____________,检验该电极反应产物的方法是____________。
【答案】2H++2e-=H2↑放出气体,溶液变红 2Cl--2e-=Cl2↑把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝【解析】【详解】由题意或图像可知,此池为电解池,X极为阴极,Y极为阳极。
电极为惰性电极,饱和NaCl溶液中存在Na+、Cl-、H+、OH-,在阴极上,H+放电能力强于Na+,故阴极上发生的电极反应式为2H++2e-=H2↑,因而导致X极附近有气体放出,溶液呈碱性,溶液颜色由无色变为红色;在阳极上,Cl-放电能力强于OH-,故阳极上发生的电极反应式为2Cl--2e-=Cl2↑。
2.硝酸是氧化性酸,其本质是NO3-有氧化性,某课外实验小组进行了下列有关NO3-氧化性的探究(实验均在通风橱中完成)。
实验装置编号溶液X实验现象实验Ⅰ 6 mol·L-1稀硝酸电流计指针向右偏转,铜片表面产生无色气体,在液面上方变为红棕色。
实验Ⅱ15 mol·L-1浓硝酸电流计指针先向右偏转,很快又偏向左边,铝片和铜片表面产生红棕色气体,溶液变为绿色。
(1)实验Ⅰ中,铝片作_____(填“正”或“负”)极。
液面上方产生红棕色气体的化学方程式是_________。
(2)实验Ⅱ中电流计指针先偏向右边后偏向左边..........的原因是____________________。
2020-2021高考化学化学能与电能(大题培优 易错 难题)含详细答案

2020-2021高考化学化学能与电能(大题培优易错难题)含详细答案一、化学能与电能1.二氧化氯(ClO2)具有强氧化性,在工业上常用作水处理剂、漂白剂。
ClO2是一种易溶于水的黄绿色气体,其体积分数超过10%时易引起爆炸。
某研究小组欲用以下三种方案制备ClO2,回答下列问题:(1)以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2,黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42-,写出制备ClO2的离子方程式__。
(2)用过氧化氢作还原剂,在硫酸介质中还原NaClO3制备ClO2,并将制得的ClO2用于处理含CN-废水。
实验室模拟该过程的实验装置(夹持装置略)如图所示。
①装置A的名称是__,装置C的作用是__。
②反应容器B应置于30℃左右的水浴中,目的是__。
③通入氮气的主要作用有3个,一是可以起到搅拌作用,二是有利于将ClO2排出,三是__。
④ClO2处理含CN-废水的离子方程式为__,装置E的作用是__。
(3)氯化钠电解法是一种可靠的工业生产ClO2的方法。
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。
某次除杂操作时,往粗盐水中先加入过量的__(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。
②用石墨做电极,在一定条件下电解饱和食盐水制取ClO2,工作原理如图所示,写出阳极产生ClO2的电极反应式__。
【答案】FeS2+15ClO3-+14H+=15ClO2+Fe3++2SO42-+7H2O 恒压漏斗安全瓶提高化学反应速率,同时防止过氧化氢受热分解稀释ClO2,防止其爆炸 2CN-+2ClO2=2CO2+N2+2Cl-吸收ClO2等气体,防止污染大气 BaCl2 Cl--5e-+2H2O=ClO2↑+4H+【解析】【分析】二氧化氯(ClO2)具有强氧化性,在工业上常用作水处理剂、漂白剂。
分别利用无机反应和电解原理制备二氧化氯,三种方法均利用了氧化还原反应。
2020-2021高考化学 化学能与电能 培优易错试卷练习(含答案)附答案解析

2020-2021高考化学化学能与电能培优易错试卷练习(含答案)附答案解析一、化学能与电能1.(1)利用原电池装置可以验证Fe3+与Cu2+氧化性相对强弱,如下图所示。
该方案的实验原理是自发进行的氧化还原反应可以设计为原电池。
写出该氧化还原反应的离子方程式:__________。
该装置中的负极材料是______(填化学式),正极反应式是_______。
(2)某研究性学习小组为证明2Fe3++2I-⇌2Fe2++I2为可逆反应,设计如下两种方案。
方案一:取5mL0.1mol/LKI溶液,滴加2mL0.1mol/L的FeCl3溶液,再继续加入2mLCCl4,充分振荡、静置、分层,再取上层清液,滴加KSCN溶液。
①方案一中能证明该反应为可逆反应的现象是______。
②有同学认为方案一设计不够严密,即使该反应为不可逆反应也可能出现上述现象,其原因是(用离子方程式表示)_____。
方案二:设计如下图原电池...装置,接通灵敏电流计,指针向右偏转(注:灵敏电流计指针总是偏向电源正极),随着时间进行电流计读数逐渐变小,最后读数变为零。
当指针读数变零后,在右管中加入1mol/L FeCl2溶液。
③方案二中,“读数变为零”是因为____________.④“在右管中加入1mol/L FeCl2溶液”后,观察到灵敏电流计的指针______偏转(填“向左”、“向右”或“不”),可证明该反应为可逆反应。
【答案】Cu+2Fe3+=Cu2++2Fe2+ Cu Fe3+ + e- = Fe2+下层(CCl4层)溶液呈紫红色,且上层清液中滴加KSCN后溶液呈血红色 4Fe2++O2+4H+=2H2O+4Fe3+该可逆反应达到了化学平衡状态向左【解析】【分析】(1)验证Fe3+与Cu2+氧化性强弱时,应将反应Cu+2Fe3+=Cu2++2Fe2+设计成原电池,原电池中铜作负极发生氧化反应被损耗,选用金属性弱于铜的金属或非金属C作正极,电解质溶液为可溶性的铁盐;(2)方案一:如该反应为可逆反应,加入四氯化碳,四氯化碳层呈紫红色,上层清液中滴加KSCN后溶液呈血红色;但在振荡过程中,Fe2+离子易被空气中氧气生成Fe3+,不能证明Fe3+未完全反应;方案二:图中灵敏电流计的指针指向右,右侧烧杯为正极,当指针读数变零后,在右管中加入1mol/LFeCl2溶液,如为可逆反应,可发生2Fe2++I2⇌2Fe3++2I-,I2被还原,指针应偏向左。
2020-2021备战高考化学 化学能与电能 培优易错试卷练习(含答案)附答案解析

2020-2021备战高考化学 化学能与电能 培优易错试卷练习(含答案)附答案解析一、化学能与电能1.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。
请回答下列问题:(1)上述实验中发生反应的化学方程式有__________________________________; (2)硫酸铜溶液可以加快氢气生成速率的原因是____________________________; (3)实验室中现有24Na SO 、4MgSO 、24Ag SO 、24K SO 等4中溶液,可与实验中4CuSO 溶液起相似作用的是______________________________________;(4)要加快上述实验中气体产生的速率,还可采取的措旌有________(答两种);(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。
将表中所给的混合溶液分别加入到6个盛有过量Zn 粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中:V 1=______,V 6=______,V 9=______;②该同学最后得出的结论为:当加入少量4CuSO 溶液时,生成氢气的速率会大大提高。
但当加入的4CuSO 溶液超过一定量时,生成氢气的速率反而会下降。
请分析氢气生成速率下降的主要原因________________________________________________________【答案】Zn+CuSO 4=ZnSO 4+Cu ,Zn+H 2SO 4=ZnSO 4+H 2↑ CuSO 4与Zn 反应产生的Cu 与Zn 形成铜锌原电池,加快了氢气产生的速率 Ag 2SO 4 升高反应温度、适当增加硫酸的浓度(答案合理即可) 30 10 17.5 当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积【解析】【详解】(1)在稀硫酸中加入硫酸铜后发生了两个反应:CuSO 4+Zn===ZnSO 4+Cu 、Zn +H 2SO 4=ZnSO 4+H 2↑。
2020-2021备战高考化学 化学能与电能 培优易错试卷练习(含答案)含答案

2020-2021备战高考化学化学能与电能培优易错试卷练习(含答案)含答案一、化学能与电能1.某实验小组对FeCl3分别与Na2SO3、NaHSO3的反应进行探究。
(甲同学的实验)装置编号试剂X实验现象I Na2SO3溶液(pH≈9)闭合开关后灵敏电流计指针发生偏转II NaHSO3溶液(pH≈5)闭合开关后灵敏电流计指针未发生偏转(1)怎样配制FeCl3溶液?________________________________________________________。
(2)甲同学探究实验I的电极产物。
①取少量Na2SO3溶液电极附近的混合液,加入_________________________________,产生白色沉淀,证明产生了SO42-。
②该同学又设计实验探究另一电极的产物,其实验方案为_______________________________。
(3)实验I中负极的电极反应式为______________________________________________________。
乙同学进一步探究FeCl3溶液与NaHSO3溶液能否发生反应,设计、完成实验并记录如下:装置编号反应时间实验现象III 0~1 min产生红色沉淀,有刺激性气味气体逸出1~30 min沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色30 min后与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色(4)乙同学认为刺激性气味气体的产生原因有两种可能,用离子方程式表示②的可能原因。
① Fe3++3HSO3-垐?噲? Fe(OH)3 +3SO2;②_____________________________________________。
(5)查阅资料:溶液中Fe 3+、SO 32-、OH -三种微粒会形成红色配合物并存在如下转化:2+4+5O 2+2-224HOFe S O HOFeO S O Fe +SO −−→垐?噲? 从反应速率和化学平衡两个角度解释1~30 min 的实验现象:______________________________。
2020-2021高考化学 化学能与电能 培优易错试卷练习(含答案)含答案解析

2020-2021高考化学化学能与电能培优易错试卷练习(含答案)含答案解析一、化学能与电能1.(1)利用原电池装置可以验证Fe3+与Cu2+氧化性相对强弱,如下图所示。
该方案的实验原理是自发进行的氧化还原反应可以设计为原电池。
写出该氧化还原反应的离子方程式:__________。
该装置中的负极材料是______(填化学式),正极反应式是_______。
(2)某研究性学习小组为证明2Fe3++2I-⇌2Fe2++I2为可逆反应,设计如下两种方案。
方案一:取5mL0.1mol/LKI溶液,滴加2mL0.1mol/L的FeCl3溶液,再继续加入2mLCCl4,充分振荡、静置、分层,再取上层清液,滴加KSCN溶液。
①方案一中能证明该反应为可逆反应的现象是______。
②有同学认为方案一设计不够严密,即使该反应为不可逆反应也可能出现上述现象,其原因是(用离子方程式表示)_____。
方案二:设计如下图原电池...装置,接通灵敏电流计,指针向右偏转(注:灵敏电流计指针总是偏向电源正极),随着时间进行电流计读数逐渐变小,最后读数变为零。
当指针读数变零后,在右管中加入1mol/L FeCl2溶液。
③方案二中,“读数变为零”是因为____________.④“在右管中加入1mol/L FeCl2溶液”后,观察到灵敏电流计的指针______偏转(填“向左”、“向右”或“不”),可证明该反应为可逆反应。
【答案】Cu+2Fe3+=Cu2++2Fe2+ Cu Fe3+ + e- = Fe2+下层(CCl4层)溶液呈紫红色,且上层清液中滴加KSCN后溶液呈血红色 4Fe2++O2+4H+=2H2O+4Fe3+该可逆反应达到了化学平衡状态向左【解析】【分析】(1)验证Fe3+与Cu2+氧化性强弱时,应将反应Cu+2Fe3+=Cu2++2Fe2+设计成原电池,原电池中铜作负极发生氧化反应被损耗,选用金属性弱于铜的金属或非金属C作正极,电解质溶液为可溶性的铁盐;(2)方案一:如该反应为可逆反应,加入四氯化碳,四氯化碳层呈紫红色,上层清液中滴加KSCN后溶液呈血红色;但在振荡过程中,Fe2+离子易被空气中氧气生成Fe3+,不能证明Fe3+未完全反应;方案二:图中灵敏电流计的指针指向右,右侧烧杯为正极,当指针读数变零后,在右管中加入1mol/LFeCl2溶液,如为可逆反应,可发生2Fe2++I2⇌2Fe3++2I-,I2被还原,指针应偏向左。
2020-2021备战高考化学培优 易错 难题(含解析)之化学能与电能含答案解析

2020-2021备战高考化学培优易错难题(含解析)之化学能与电能含答案解析一、化学能与电能1.如图所示,E为浸有Na2SO4溶液的滤纸,并加入几滴酚酞。
A、B均为Pt片,压在滤纸两端,R、S为电源的电极。
M、N为惰性电极。
G为检流计,K为开关。
试管C、D和电解池中都充满KOH溶液。
若在滤纸E上滴一滴紫色的KMnO4溶液,断开K,接通电源一段时间后,C、D中有气体产生。
(1)R为电源的__,S为电源的__。
(2)A极附近的溶液变为红色,B极的电极反应式为__。
(3)滤纸上的紫色点移向__(填“A极”或“B极”)。
(4)当试管C、D中的气体产生到一定量时,切断外电源并接通开关K,经过一段时间,C、D中气体逐渐减少,主要是因为_,写出有关的电极反应式:__。
【答案】负极正极 2H2O-4e-=4H++O2↑ B极氢气和氧气在碱性环境下发生原电池反应,消耗了氢气和氧气 2H2+4OH--4e-=4H2O(负极),O2+2H2O+4e-=4OH-(正极)【解析】【分析】(1)根据电极产物判断电解池的阴阳极及电源的正负极;(2)根据电解池原理及实验现象书写电极反应式;(3)根据电解池原理分析电解质溶液中离子移动方向;(4)根据燃料电池原理分析解答。
【详解】(1)断开K,通直流电,电极C、D及氢氧化钾溶液构成电解池,根据离子的放电顺序,溶液中氢离子、氢氧根离子放电,分别生成氢气和氧气,氢气和氧气的体积比为2:1,通过图象知,C极上气体体积是D极上气体体积的2倍,所以C极上得氢气,D极上得到氧气,故R是负极,S是正极,故答案为:负极;正极;(2)A极是阴极,电解高锰酸钾时,在该极上放电的是氢离子,所以该极上碱性增强,酚酞显红色,B极是阳极,该极附近发生的电极反应式为:2H2O-4e-=4H++O2↑,故答案为:2H2O-4e-=4H++O2↑;(3)浸有高锰酸钾的滤纸和电极A、B与电源也构成了电解池,因为R是负极,S是正极,所以B极是阳极,A极是阴极,电解质溶液中的阴离子高锰酸根离子向阳极移动,紫色点移向B极,故答案为:B极;(4)当C、D里的气体产生到一定量时,切断外电源并接通开关K,构成氢氧燃料电池,氢气和氧气在碱性环境下发生原电池反应,消耗了氢气和氧气;在燃料电池中,燃料氢气为负极,在碱性环境下的电极反应式为:2H2+4OH--4e-=4H2O,C中的电极作负极,D中的电极作正极,电极反应式为O2+2H2O+4e-=4OH-,故答案为:氢气和氧气在碱性环境下发生原电池反应,消耗了氢气和氧气;2H2+4OH--4e-=4H2O(负极),O2+2H2O+4e-=4OH-(正极)。
2020-2021【化学】化学化学能与电能的专项培优易错试卷练习题(含答案)含答案

2020-2021【化学】化学化学能与电能的专项培优易错试卷练习题(含答案)含答案一、化学能与电能1.钨是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,有“光明使者”的美誉。
钨在自然界主要以钨 (+6价) 酸盐的形式存在。
有开采价值的钨矿石是白钨矿和黑钨矿。
白钨矿的主要成分是钨酸钙(CaWO4);黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写成(FeWO4和MnWO4),钨酸(H2WO4)酸性很弱,难溶于水。
已知:①CaWO4与碳酸钠共热发生复分解反应。
②钨在高温下可与焦炭(C)反应生成硬质合金碳化钨(WC)。
(1)74W在周期表的位置是第_______周期。
(2)写出黑钨矿中FeWO4与氢氧化钠,空气熔融时的化学反应方程式________________________________;白钨矿粉与碳酸钠共热的化学反应方程式_______________。
(3)工业上,可用一氧化碳、氢气或铝还原WO3冶炼W。
理论上,等物质的量的CO、H2、Al作还原剂,可得到W的质量之比为______。
用焦炭也能还原WO3,但用氢气更具有优点,其理由是_____________________________________。
(4)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。
下图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线,则T1时K sp(CaWO4)=_________(mol/L)2。
将钨酸钠溶液加入石灰乳得到大量钨酸钙,发生反应的离子方程式为_____________________________,T2时该反应的平衡常数为__________。
(5)工业上,可用电解法从碳化钨废料中回收钨。
碳化钨作阳极,不锈钢作阴极,盐酸为电解质溶液,阳极析出滤渣D并放出CO2。
写出阳极的电极反应式_______________。
【答案】六 4 FeWO4+8NaOH+O 22Fe2O3+4Na2WO4+4H2OCaWO4+Na2CO 3CaCO3+Na2WO4 2∶2∶3 焦炭为固体,得到的金属钨会混有固体杂质,并且用焦炭还可能产生CO等有污染的尾气 1×10-10 WO42-+ Ca(OH)2=CaWO4+ 2OH-1×103 mol/L WC-10e-+6H2O= H2WO4+CO2+ 10H+【解析】(1)W为74号元素,第五周期最后一种元素为56号,第六周期最后一种元素为84号,因此74号在元素周期表的第六周期,故答案为:六;(2)FeWO4中的铁为+2价,与氢氧化钠在空气熔融时被空气中的氧气氧化,反应的化学反应方程式为4 FeWO4+8NaOH+O 22Fe2O3+4Na2WO4+4H2O;白钨矿粉与碳酸钠共热的化学反应方程式为CaWO4+Na2CO 3CaCO3+Na2WO4,故答案为:4FeWO4+8NaOH+O 22Fe2O3+4Na2WO4+4H2O;CaWO4+Na2CO 3CaCO3+Na2WO4;(3)工业上,可用一氧化碳、氢气或铝还原WO3冶炼W。
2020-2021高考化学知识点过关培优易错试卷训练∶化学能与电能含答案

2020-2021高考化学知识点过关培优易错试卷训练∶化学能与电能含答案一、化学能与电能1.电解原理在化学工业中有广泛应用。
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
请回答以下问题。
若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,则:(1)电解池中X极上的电极反应式是____________,在X极附近观察到的现象是_________________。
(2)Y电极上的电极反应式是____________,检验该电极反应产物的方法是____________。
【答案】2H++2e-=H2↑放出气体,溶液变红 2Cl--2e-=Cl2↑把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝【解析】【详解】由题意或图像可知,此池为电解池,X极为阴极,Y极为阳极。
电极为惰性电极,饱和NaCl溶液中存在Na+、Cl-、H+、OH-,在阴极上,H+放电能力强于Na+,故阴极上发生的电极反应式为2H++2e-=H2↑,因而导致X极附近有气体放出,溶液呈碱性,溶液颜色由无色变为红色;在阳极上,Cl-放电能力强于OH-,故阳极上发生的电极反应式为2Cl--2e-=Cl2↑。
2.电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。
Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。
阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。
某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示。
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。
此时,应向污水中加入适量的__________。
a.H2SO4 b.BaSO4 c.Na2SO4 d.NaOH(2)电解池阳极发生了两个电极反应,电极反应式分别是Ⅰ.___________________;Ⅱ._________________;(3)电极反应Ⅰ和Ⅱ的生成物反应得到Fe(OH)3沉淀的离子方程式是__________________;(4)该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极。
2020-2021高考化学培优 易错 难题(含解析)之化学能与电能附答案

2020-2021高考化学培优易错难题(含解析)之化学能与电能附答案一、化学能与电能1.现需设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积(约6 mL)和检验氯气的氧化性(不应将多余的氯气排入空气中)。
(1)试从上图图1中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是:A接______,B接______。
(2)碳棒上发生的电极反应为_______。
(3)能说明氯气具有氧化性的实验现象是_______。
(4)假定装入的饱和食盐水为50 mL(电解前后溶液体积变化可忽略),当测得的氢气为5.6 mL(已折算成标准状况)时,溶液的pH为____。
(5)工业上采用离子交换膜法电解饱和食盐水,如上图图2,该离子交换膜是__(填“阳离子”或“阴离子”)交换膜,溶液A是_______(填溶质的化学式)【答案】G、F、I D、E、C 2Cl--2e-=Cl2↑淀粉-KI溶液变成蓝色 12 阳离子 NaOH 【解析】【分析】(1)实验的目的是电解饱和食盐水,并测量电解产生的氢气的体积(约6 mL)和检验氯气的氧化性,结合装置的作用来连接装置;(2)实验目的生成氢气和氯气,所以铁应为阴极,碳棒为阳极;(3)氯气具有氧化性,能氧化碘离子生成碘单质,使淀粉碘化钾溶液变蓝色说明;(4)电解饱和食盐水的方程式:2NaCl+2H2O 2NaOH+H2↑+Cl2↑,利用公式c=nV来计算NaOH的物质的量浓度,然后求出氢离子的浓度,最后求出pH;(5)氢气在阴极生成,则b为阴极,a为阳极,阳离子向阴极移动,则离子交换膜允许阳离子通过;a极上氯离子失电子,生成氯气同时溶液中生成NaOH。
【详解】(1)产生的氢气的体积用排水量气法,预计H2的体积6ml左右,所以选I不选H,导管是短进长出,所以A接G,用装有淀粉碘化钾溶液的洗气瓶检验氯气时,导管要长进短出,所以B接D,氯气要进行尾气处理,即E接C;(2)实验目的生成氢气和氯气,所以铁应为阴极,连接电源负极,碳棒为阳极,所以炭棒接直流电源的正极,电极反应:2Cl--2e-═Cl2↑;(3)氯气具有氧化性,能氧化碘离子生成碘单质,碘单质遇到淀粉变蓝色,使淀粉碘化钾溶液变蓝色说明氯气具有氧化性;(4)因电解饱和食盐水的方程式:2NaCl+2H2O2NaOH+H2↑+Cl2↑,当产生的H2的体积为5.6mL时,物质的量n=35.610L22.4L/mol-⨯=2.5×10-4mol,生成氢氧化钠的物质的量为5×10-4mol,所以溶液中NaOH的物质的量浓度=4510mol0.05L-⨯═0.01mol/L,所以氢离子的浓度=14100.01-mol/L=1×10-12mol/L,pH=12;(5)氢气在阴极生成,则b为阴极,a为阳极,阳离子向阴极移动,则离子交换膜允许阳离子通过,所以离子交换膜为阳离子交换膜;a极上氯离子失电子,生成氯气同时溶液中生成NaOH,所以溶液A是NaOH。
2020-2021高考化学 化学能与电能 培优 易错 难题练习(含答案)附答案解析

2020-2021高考化学 化学能与电能 培优 易错 难题练习(含答案)附答案解析一、化学能与电能1.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。
请回答下列问题:(1)上述实验中发生反应的化学方程式有__________________________________; (2)硫酸铜溶液可以加快氢气生成速率的原因是____________________________; (3)实验室中现有24Na SO 、4MgSO 、24Ag SO 、24K SO 等4中溶液,可与实验中4CuSO 溶液起相似作用的是______________________________________;(4)要加快上述实验中气体产生的速率,还可采取的措旌有________(答两种);(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。
将表中所给的混合溶液分别加入到6个盛有过量Zn 粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中:V 1=______,V 6=______,V 9=______;②该同学最后得出的结论为:当加入少量4CuSO 溶液时,生成氢气的速率会大大提高。
但当加入的4CuSO 溶液超过一定量时,生成氢气的速率反而会下降。
请分析氢气生成速率下降的主要原因________________________________________________________【答案】Zn+CuSO 4=ZnSO 4+Cu ,Zn+H 2SO 4=ZnSO 4+H 2↑ CuSO 4与Zn 反应产生的Cu 与Zn 形成铜锌原电池,加快了氢气产生的速率 Ag 2SO 4 升高反应温度、适当增加硫酸的浓度(答案合理即可) 30 10 17.5 当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积【解析】【详解】(1)在稀硫酸中加入硫酸铜后发生了两个反应:CuSO 4+Zn===ZnSO 4+Cu 、Zn +H 2SO 4=ZnSO 4+H 2↑。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2020-2021备战高考化学化学能与电能(大题培优易错试卷)一、化学能与电能1.(1)利用原电池装置可以验证Fe3+与Cu2+氧化性相对强弱,如下图所示。
该方案的实验原理是自发进行的氧化还原反应可以设计为原电池。
写出该氧化还原反应的离子方程式:__________。
该装置中的负极材料是______(填化学式),正极反应式是_______。
(2)某研究性学习小组为证明2Fe3++2I-⇌2Fe2++I2为可逆反应,设计如下两种方案。
方案一:取5mL0.1mol/LKI溶液,滴加2mL0.1mol/L的FeCl3溶液,再继续加入2mLCCl4,充分振荡、静置、分层,再取上层清液,滴加KSCN溶液。
①方案一中能证明该反应为可逆反应的现象是______。
②有同学认为方案一设计不够严密,即使该反应为不可逆反应也可能出现上述现象,其原因是(用离子方程式表示)_____。
方案二:设计如下图原电池...装置,接通灵敏电流计,指针向右偏转(注:灵敏电流计指针总是偏向电源正极),随着时间进行电流计读数逐渐变小,最后读数变为零。
当指针读数变零后,在右管中加入1mol/L FeCl2溶液。
③方案二中,“读数变为零”是因为____________.④“在右管中加入1mol/L FeCl2溶液”后,观察到灵敏电流计的指针______偏转(填“向左”、“向右”或“不”),可证明该反应为可逆反应。
【答案】Cu+2Fe3+=Cu2++2Fe2+ Cu Fe3+ + e- = Fe2+下层(CCl4层)溶液呈紫红色,且上层清液中滴加KSCN后溶液呈血红色 4Fe2++O2+4H+=2H2O+4Fe3+该可逆反应达到了化学平衡状态向左【解析】【分析】(1)验证Fe3+与Cu2+氧化性强弱时,应将反应Cu+2Fe3+=Cu2++2Fe2+设计成原电池,原电池中铜作负极发生氧化反应被损耗,选用金属性弱于铜的金属或非金属C作正极,电解质溶液为可溶性的铁盐;(2)方案一:如该反应为可逆反应,加入四氯化碳,四氯化碳层呈紫红色,上层清液中滴加KSCN后溶液呈血红色;但在振荡过程中,Fe2+离子易被空气中氧气生成Fe3+,不能证明Fe3+未完全反应;方案二:图中灵敏电流计的指针指向右,右侧烧杯为正极,当指针读数变零后,在右管中加入1mol/LFeCl2溶液,如为可逆反应,可发生2Fe2++I2⇌2Fe3++2I-,I2被还原,指针应偏向左。
【详解】(1)Fe3+氧化性比Cu2+强,可发生2Fe3++Cu=2Fe2++Cu2+反应,反应中Cu被氧化,Cu电极为原电池的负极,负极反应式为Cu-2e-=Cu2+,选用金属性弱于铜的金属或石墨作正极,正极上Fe3+发生还原反应,电极反应式为Fe3++e-=Fe2+,故答案为Cu+2Fe3+=Cu2++2Fe2+;Cu;Fe3+ + e- = Fe2+;(2)①若该反应为可逆反应,反应中有碘单质生成,但不足量的Fe3+不能完全反应,溶液中依然存在Fe3+,则证明有碘单质和Fe3+存在的实验设计为:向反应后的溶液再继续加入2mLCCl4,充分振荡、静置、分层,下层(CCl4层)溶液呈紫红色,再取上层清液,滴加KSCN溶液,溶液呈血红色,故答案为下层(CCl4层)溶液呈紫红色,且上层清液中滴加KSCN后溶液呈血红色;②在振荡过程中,Fe2+离子易被空气中氧气生成Fe3+,不能证明反应可逆,反应的化学方程式为4Fe2++O2+4H+=2H2O+4Fe3+,故答案为4Fe2++O2+4H+=2H2O+4Fe3+;③若该反应为可逆反应,“读数变为零”说明该可逆反应达到了化学平衡状态,故答案为该可逆反应达到了化学平衡状态;④当指针读数变零后,在右管中加入1mol/LFeCl2溶液,如为可逆反应,可发生2Fe2++I2⇌2Fe3++2I-,I2被还原,灵敏电流计指针总是偏向电源正极,指针应偏向左,故答案为向左。
【点睛】本题考查化学反应原理的探究,侧重于分析问题和实验能力的考查,注意把握发生的电极反应、原电池工作原理,注意可逆反应的特征以及离子检验的方法为解答的关键。
2.硝酸是氧化性酸,其本质是NO3-有氧化性,某课外实验小组进行了下列有关NO3-氧化性的探究(实验均在通风橱中完成)。
实验Ⅱ15 mol·L-1浓硝酸电流计指针先向右偏转,很快又偏向左边,铝片和铜片表面产生红棕色气体,溶液变为绿色。
(1)实验Ⅰ中,铝片作_____(填“正”或“负”)极。
液面上方产生红棕色气体的化学方程式是_________。
(2)实验Ⅱ中电流计指针先偏向右边后偏向左边..........的原因是____________________。
查阅资料:活泼金属与1 mol·L-1稀硝酸反应有H2和NH4+生成,NH4+生成的原理是产生H2的过程中NO3-被还原。
(3)用上图装置进行实验Ⅲ:溶液X为1 mol·L-1稀硝酸溶液,观察到电流计指针向右偏转。
①反应后的溶液中含NH4+。
实验室检验NH4+的方法是______________________________。
②生成NH4+的电极反应式是_____________________________________________。
(4)进一步探究碱性条件下NO3-的氧化性,进行实验Ⅳ:①观察到A中有NH3生成,B中无明显现象。
A、B产生不同现象的解释是_______________。
②A中生成NH3的离子方程式是_______________________________。
(5)将铝粉加入到NaNO3溶液中无明显现象,结合实验Ⅲ和Ⅳ说明理由_________________。
【答案】负2NO+O2=2NO2Al开始作电池的负极,Al在浓硝酸中迅速生成致密氧化膜后,Cu作负极取少量待检溶液于试管中,加入浓NaOH溶液,加热,若产生使湿润的红色石蕊试纸变蓝的气体,则溶液中含NH4+NO3-+8e-+10H+=NH4++3H2O Al与NaOH溶液反应产生H2的过程中可将NO3-还原为NH3,而Mg不能与NaOH溶液反应8Al+3NO3-+5OH-+2H2O=3NH3↑+8AlO2-因为铝与中性的硝酸钠溶液无生成H2的过程,NO3-无法被还原【解析】【分析】(1)根据实验现象可知,实验1电流计指针向右偏转,铜片表面产生无色气体,在液面上方变为红棕色,说明在原电池中铝作负极,发生氧化反应,铜做正极,硝酸根离子被还原成一氧化氮,在空气中被氧化成二氧化氮;(2)实验2中电流计指针先向右偏转,很快又偏向左边,铝片和铜片表面产生红棕色气体,溶液变为绿色,说明开始铝是负极,同实验1,铜表面有二氧化氮产生,很快铝被浓硝酸钝化,铜做负极,发生氧化反应,生成硝酸铜,溶液呈绿色,硝酸根离子在铝电极被还原成二氧化氮,据此答题;(3)溶液X为1mol•L-1稀硝酸溶液,反应后的溶液中含NH4+,说明硝酸根离子被还原成了铵根离子,原电池中铝做负极,铜做正极,硝酸根离子在正极还原成铵根离子;(4)Al与NaOH溶液反应产生H2的过程中可将NO3-还原为NH3,根据电荷守恒和元素守恒可写出离子方程式,而镁与碱没有反应;(5)铝粉在中性溶液中不产生氢气,也就不与硝酸钠反应,据此分析。
【详解】(1)根据实验现象可知,实验1电流计指针向右偏转,铜片表面产生无色气体,在液面上方变为红棕色,说明在原电池中铝作负极,发生氧化反应,铜做正极,硝酸根离子被还原成一氧化氮,在空气中被氧化成二氧化氮,反应方程式为2NO+O2=2NO2;(2)实验2中电流计指针先向右偏转,很快又偏向左边,铝片和铜片表面产生红棕色气体,溶液变为绿色,说明开始铝是负极,同实验1,铜表面有二氧化氮产生,很快铝被浓硝酸钝化,铜做负极,发生氧化反应,生成硝酸铜,溶液呈绿色,硝酸根离子在铝电极被还原成二氧化氮;(3)溶液X为1mol•L-1稀硝酸溶液,反应后的溶液中含NH4+,说明硝酸根离子被还原成了铵根离子,原电池中铝做负极,铜做正极,硝酸根离子在正极还原成铵根离子,①实验室检验NH4+的方法是取少量待检溶液于试管中,加入浓NaOH溶液,加热,若产生使湿润的红色石蕊试纸变蓝的气体,则溶液中含NH4+;②生成NH4+的电极反应式是NO3-+8e-+10 H+=NH4++3H2O;(4)①Al与NaOH溶液反应产生H2的过程中可将NO3-还原为NH3;根据电荷守恒和元素守恒可写出离子方程式,而镁与碱没有反应;②碱性条件下铝将硝酸根还原生成氨气,反应的离子方程式为8Al+3NO3-+5OH-+2H2O=3NH3↑+8AlO2-;(5)铝与中性的硝酸钠溶液无生成H2的过程,也就不与硝酸钠反应,所以无明显现象。
【点睛】原电池中失电子发生氧化反应的一极一定是负极,得电子发生还原反应的一极一定是正极;电子流出的一极一定是负极、电子流入的一极一定是正极。
3.某小组设计不同实验方案比较Cu2+、Ag+ 的氧化性。
(1)方案1:通过置换反应比较向酸化的AgNO3溶液插入铜丝,析出黑色固体,溶液变蓝。
反应的离子方程式是_______,说明氧化性Ag+>Cu2+。
(2)方案2:通过Cu2+、Ag+ 分别与同一物质反应进行比较实验试剂编号及现象试管滴管1.0 mol/LKI溶液1.0mol/LAgNO3溶液Ⅰ.产生黄色沉淀,溶液无色1.0 Ⅱ.产生白色沉淀A,溶液变黄mol/LCuSO 4溶液①经检验,Ⅰ中溶液不含I 2,黄色沉淀是________。
②经检验,Ⅱ中溶液含I 2。
推测Cu 2+做氧化剂,白色沉淀A 是CuI 。
确认A 的实验如下:a .检验滤液无I 2。
溶液呈蓝色说明溶液含有________(填离子符号)。
b .白色沉淀B 是________。
c .白色沉淀A 与AgNO 3溶液反应的离子方程式是____,说明氧化性Ag +>Cu 2+。
(3)分析方案2中Ag + 未能氧化I - ,但Cu 2+氧化了I -的原因,设计实验如下:编号 实验1 实验2 实验3实验 现象 无明显变化 a 中溶液较快变棕黄色,b 中电极上析出银;电流计指针偏转 c 中溶液较慢变浅黄色; 电流计指针偏转(电极均为石墨,溶液浓度均为 1 mol/L ,b 、d 中溶液pH≈4)① a 中溶液呈棕黄色的原因是_______(用电极反应式表示)。
② “实验3”不能说明Cu 2+氧化了I -。
依据是空气中的氧气也有氧化作用,设计实验证实了该依据,实验方案及现象是_______。
③ 方案2中,Cu 2+能氧化I -,而Ag +未能氧化I -的原因:_______。
(资料:Ag + + I - = AgI↓ K 1 =1.2×1016;2Ag + + 2I - = 2Ag↓+ I 2 K 2 = 8.7×108)【答案】Cu+2Ag +=2Ag+Cu 2+ AgI Cu 2+ AgCl CuI+2Ag +=Cu 2++Ag+AgI 222I e I ---= 将d 烧杯内的溶液换为pH≈4的1 mol/L 24Na SO 溶液,c 中溶液较慢变浅黄,电流计指针偏转 K 1>K 2,故Ag +更易与I -发生复分解反应,生成AgI 2Cu 2+ + 4I - = 2CuI + I 2 ,生成了CuI沉淀,使得2Cu +的氧化性增强【解析】(1)向酸化的AgNO 3溶液插入铜丝,析出黑色固体,溶液变蓝,说明铜置换出了金属银,反应的离子方程式为222Cu Ag Ag Cu +++=+,说明氧化性Ag +>Cu 2+,故答案为222Cu Ag Ag Cu +++=+;(2)① 经检验,Ⅰ中溶液不含I 2,黄色沉淀是碘离子与银离子形成的碘化银沉淀,故答案为AgI ;②Ⅱ中溶液含I 2,说明Cu 2+做氧化剂,将碘离子氧化,本身被还原为Cu +,因此白色沉淀A 是CuI 。
