高中酸碱盐溶解度表与元素周期表
(完整word)高中阶段常见酸碱盐溶解性表

NO3ˉ
Clˉ
SO42ˉ
S2ˉ
SO32ˉ
CO32ˉ
SiO32ˉ
PO43ˉ
H+
溶、挥
溶、挥
溶Байду номын сангаас
溶、挥
溶、挥
溶、挥
难
溶
NH4+
溶、挥
溶
溶
溶
溶
溶
溶
—
溶
K+
溶
溶
溶
溶
溶
溶
溶
溶
溶
Na+
溶
溶
溶
溶
溶
溶
溶
溶
溶
Ba2+
溶
溶
溶
难
—
微
难
难
难
Ca2+
微
溶
溶
微
—
难
难
难
难
Mg2+
难
溶
溶
溶
—
微
微
难
难
Al3+
难
溶
溶
溶
—
—
—
难
难
Mn2+
难
溶
溶
溶
难
难
难
难
难
Zn2+
难
溶
溶
溶
难
难
难
难
难
Cr3+
难
溶
溶
溶
—
—
—
难
难
Fe2+
难
溶
溶
溶
难
难
难
难
难
Fe3+
高三高考化学知识点汇总

高三高考化学知识点汇总一、化学元素与元素周期表1. 元素周期表的组成及布局2. 原子结构、电子排布和元素周期律3. 常见元素的符号、名称及其性质二、化学键与化合物1. 化学键的类型与特点2. 共价键与离子键的形成及特性3. 分子式与化合物的命名规则4. 有机化合物的命名与结构三、溶液与溶解性1. 溶质、溶剂、溶解度和溶解度规律2. 溶液的浓度计算及相关性质3. 溶解过程中的能量变化和溶解度的影响因素四、化学反应与化学平衡1. 化学反应的类型与化学方程式的写法2. 化学平衡的概念、平衡常数及其计算3. 影响化学平衡的因素与平衡移动的原理五、氧化还原反应1. 氧化还原反应的基本概念与过程2. 氧化态与氧化数的判定方法3. 氧化还原反应的平衡、电量计算和应用六、酸碱与盐类化合物1. 酸碱盐的基本性质与离子反应2. 酸碱中和反应的计算与应用3. 盐类的命名与性质七、化学能量与化学动力学1. 化学能量的基本概念与热化学方程式的计算2. 化学动力学的基本概念与反应速率的影响因素3. 反应速率与速率常数的计算八、电化学与电解与腐蚀1. 电解质溶液的电离、导电及电解与电解产物2. 电化学反应的电子转移过程与电化学方程式3. 金属腐蚀的特点及防腐措施九、有机化学基础知识1. 有机物与无机物的区别与特点2. 烃、醇、酚、酮、醛、酸及酯的基本结构与性质3. 有机物的官能团、同分异构与命名规则十、高分子化合物与化学工业1. 高分子材料的结构、性质与应用2. 塑料、纤维、橡胶的制备原理与特点3. 重要化学工业原料的性质与应用以上所列化学知识点为高三化学课程的核心内容,涵盖了基本理论、化合物分类及性质、化学反应与平衡、化学能量与动力学、电化学、有机化学和化学工业等重要方面。
对这些知识的全面掌握将有助于学生在高考化学考试中获得优异的成绩。
在复习过程中,建议学生结合教材、习题及模拟试卷进行有针对性的训练,加强对重要概念和公式的记忆,并通过解题巩固知识点的理解与应用能力。
化学元素周期表记忆口诀

化学元素周期表记忆口诀化学元素周期表记忆口诀初高中化学都要求大家掌握元素周期表的规律与排列,以下是店铺整理的化学元素周期表记忆口诀,仅供参考,大家一起来看看吧。
化学元素周期表口诀口诀A、按周期分:第一周期:氢氦——侵害第二周期:锂铍硼碳氮氧氟氖——鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩——那美女桂林留绿牙(那美女鬼流露绿牙)第四周期:钾钙钪钛钒铬锰铁钴镍铜锌镓锗——铁姑捏痛新嫁者砷硒溴氪——生气休克第五周期:铷锶钇锆铌——如此一告你钼锝钌——不得了铑钯银镉铟锡锑——老把银哥印西堤碲碘氙——地点仙第六周期:铯钡镧铪——(彩)色贝(壳)蓝(色)河钽钨铼锇——但(见)乌(鸦)(引)来鹅铱铂金汞砣铅——一白巾供它牵铋钋砹氡——必不爱冬(天)第七周期:钫镭锕——防雷啊!B、按族分:氢锂钠钾铷铯钫——请李娜加入私访铍镁钙锶钡镭——媲美盖茨被雷硼铝镓铟铊——碰女嫁音他碳硅锗锡铅——探归者西迁氮磷砷锑铋——蛋临身体闭氧硫硒碲钋——养牛西蹄扑氟氯溴碘砹——父女绣点爱氦氖氩氪氙氡——害耐亚克先动规律一、元素周期表中元素及其化合物的递变性规律1、原子半径(1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小;(2)同一族的元素从上到下,随电子层数增多,原子半径增大。
2、元素化合价(1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族—4递增到—1(氟无正价,氧无+6价,除外);(2)同一主族的元素的最高正价、负价均相同。
3、单质的熔点(1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减;(2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增。
4、元素的金属性与非金属性(1)同一周期的元素从左到右金属性递减,非金属性递增;(2)同一主族元素从上到下金属性递增,非金属性递减。
5、最高价氧化物和水化物的酸碱性元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,最高价氧化物的水化物的酸性越强。
高中化学必修一知识点归纳总结

高中化学必修一知识点归纳总结一、基本概念与定义1. 物质的量:表示一定数量粒子的集合体,单位是摩尔(mol)。
2. 阿伏伽德罗常数:1摩尔物质中所含有的粒子数,约为6.022 x 10^23。
3. 物质的量浓度:单位体积溶液中所含物质的量,单位是摩尔每升(mol/L)。
4. 溶液的pH值:表示溶液酸碱性的量度,pH = -log[H+]。
5. 氧化还原反应:一种化学反应,其中电子从一个物质转移到另一个物质。
二、元素周期表1. 元素周期律:元素的性质随原子序数的增加呈现出周期性变化。
2. 周期表的分区:分为s区、p区、d区、ds区和f区。
3. 主族元素:周期表中s区和p区的元素。
4. 过渡元素:周期表中d区的元素。
5. 稀有气体:周期表中最后一组元素,化学性质稳定。
三、化学键1. 离子键:正负离子之间的静电吸引力。
2. 共价键:两个或多个原子共享电子对形成的化学键。
3. 金属键:金属原子间的电子共享,形成“电子海”。
4. 氢键:分子间的一种较弱的相互作用力。
四、化学反应原理1. 化学反应速率:单位时间内反应物质的消耗速度或生成物质的生成速度。
2. 化学平衡:反应物和生成物浓度不再变化的状态。
3. 莱-夏特列原理:当一个处于平衡状态的系统受到外部条件改变时,系统会自发地调整,使得这种改变被抵消。
4. 酸碱理论:布朗斯特-劳里酸碱理论,酸是质子(H+)的供体,碱是质子的受体。
五、溶液与电解质1. 溶液:一种或几种物质分散在另一种物质中形成的均一混合物。
2. 饱和溶液:在一定温度下,溶质在溶剂中的溶解达到最大值的溶液。
3. 电解质:在水溶液或熔融状态下能导电的物质。
4. 非电解质:在水溶液或熔融状态下不导电的物质。
六、常见物质的性质与变化1. 酸碱盐的性质:酸能与碱反应生成盐和水,盐能与酸或碱反应。
2. 氧化还原反应的特征:氧化剂得到电子被还原,还原剂失去电子被氧化。
3. 沉淀反应:两种溶液混合时生成不溶于水的固体(沉淀)的反应。
高中化学盐溶解性表及元素周期表
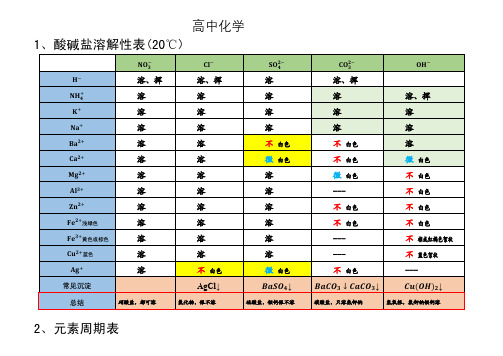
高中化学盐溶解性表及元素周期表
1、酸碱盐溶解性表(20℃)
−
−
−
−
−
−
溶、挥
溶、挥
溶
溶、挥
+
溶
溶
溶
溶
溶、挥
+
溶
溶
溶
溶
溶
+
溶
溶
溶
溶
溶
+
溶
溶
不
白色
不
白色
溶
&色
不
白色
微
白色
+
溶
溶
溶
微
白色
不
白色
+
溶
溶
溶
---
不
白色
+
溶
溶
溶
不
白色
不
白色
+ 浅绿色
溶
溶
溶
不
白色
不
白色
+ 黄色或棕色
溶
溶
溶
---
不
棕或红褐色絮状
+ 蓝色
溶
溶
溶
---
不
蓝色絮状
溶
不
不
---
+
AgCl↓
常见沉淀
总结
白色
硝酸盐,都可溶
2、元素周期表
氯化物,银不溶
微
白色
↓
酸碱盐溶解度表Be 版

43
77
难溶
40
54
难溶
1.04 57.5
易溶 易溶
难溶 0.02 难溶 难溶 难溶 易溶 易溶 55.5 可溶 可溶 微溶 微溶
100(12℃)
难溶
易溶
难溶
1.5
1.1
难溶
易溶
易溶
易溶
可溶 150 难溶
难溶 易溶 145 难溶 难溶 难溶
易溶
Fe(ClO4)3 Fe2(SO4)3·9H2O
Gd(NO3)3 GeCl4 GeO2 H3AsO4
80 0.160 0.028 31.9 0.013 3.89 0.035 223 8.9 72.8 0.003 反应 336 0.015 2.42*10^-4
7.0*10^-7
1.6*10^-8 难溶 微溶 难溶
6.0*10^-6 1.5*10^-6
0.2 3.8
难溶
0.003 2.1 难溶
难溶 反应
(NH4)2CO3•H2O
一水合碳酸铵
NH4ClO3 NH4Cl (NH4)2PtCl6 (NH4)2CrO4 (NH4)2Cr2O7 NH4H2PO4 NH4F (NH4)2SiF6 HCOONH4 (NH4)2HPO4 NH4HC4H4O6 NH4IO3 NH4I NH4NO3 (NH4)2C2O4 NH4ClO4 NH4NO2 (NH4)3PO4 (NH4)2SeO4 (NH4)2SO4 NH4Al(SO4)2•12H2O (NH4)2Fe(SO4)2•6H2O (NH4)2SO3 (NH4)2C4H4O6 NH4SCN (NH4)2S2O3 NH4VO3
溴酸镉 溴化镉 碳酸镉 氯酸镉 氯化镉 氰化镉 氟化镉 甲酸镉 氢氧化镉 碘酸镉 碘化镉 硝酸鎘 草酸镉·3水 高氯酸镉 磷酸镉 硒酸镉 硫酸镉 硫化镉 氯化铈 氢氧化铈 硝酸铈 硫酸铈 乙酸铯 叠氮化铯 碳酸氢铯 溴酸铯 溴化铯 碳酸铯 氯酸铯 氯化铯 铬酸铯 氟化铯 氟硼酸铯 甲酸铯 碘酸铯 碘化铯 氢氧化铯 硝酸铯 草酸铯 高氯酸铯 高锰酸铯 硫酸铯 硝酸铬 高氯酸铬 硫酸铬 三氧化铬 溴酸钴
高中化学手抄知识点总结

高中化学手抄知识点总结一、原子与分子1. 原子结构- 原子由原子核和电子组成。
- 原子核包含质子和中子。
- 电子在核外绕核运动,分布在不同的能级上。
2. 元素周期表- 元素周期表按照原子序数排列元素。
- 元素周期表分为7个周期和18个族。
- 同一族的元素具有相似的化学性质。
3. 分子- 分子是由两个或多个原子通过化学键结合而成的。
- 分子的化学式表示分子中各种元素的原子比例。
- 常见分子有氧气(O2)、水(H2O)和二氧化碳(CO2)。
二、化学键1. 离子键- 离子键是由正负离子之间的静电吸引力形成的。
- 通常在金属和非金属之间形成。
- 例如,食盐(NaCl)中的钠离子(Na+)和氯离子(Cl-)通过离子键结合。
2. 共价键- 共价键是由两个原子共享一对电子形成的。
- 常见于非金属元素之间。
- 例如,氢气(H2)分子中的两个氢原子通过共价键结合。
3. 金属键- 金属键是金属原子之间的一种特殊类型的化学键。
- 金属原子释放价电子形成正离子,这些电子在金属晶格中自由移动,形成“电子海”。
三、化学反应1. 反应类型- 合成反应:两种或两种以上的物质反应生成一种新物质。
- 分解反应:一种物质分解成两种或两种以上的物质。
- 置换反应:一种元素与一种化合物反应,取代其中的一种元素。
- 双置换反应:两种化合物交换成分,形成两种新的化合物。
2. 化学方程式- 化学方程式用化学符号表示化学反应的过程。
- 方程式要平衡,即反应物和生成物的原子数相等。
3. 反应条件- 温度、压力、催化剂等因素会影响化学反应的速率和方向。
四、酸碱与盐1. 酸和碱- 酸是能够提供质子(H+)的物质。
- 碱是能够接受质子的物质。
- 常见的酸有硫酸(H2SO4)、盐酸(HCl)等;常见的碱有氢氧化钠(NaOH)、氢氧化钾(KOH)等。
- pH值是表示溶液酸碱性的量度。
- pH值为7表示中性,小于7表示酸性,大于7表示碱性。
3. 盐- 盐是酸和碱反应生成的物质。
酸碱盐的溶解性表
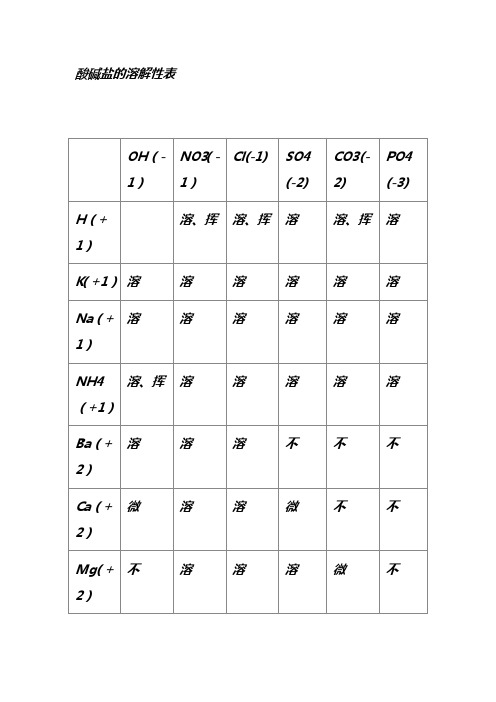
酸碱盐的溶解性表说明:此为20℃时的情况。
“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“---”表示那种物质不存在或遇到水就分解了背诵口诀1.钾钠铵盐都可溶,氯化物不溶氯化银硫酸盐钙银微溶钡不溶硝酸盐遇水影无踪碳酸盐除钾钠铵都不溶钾钠钡钙碱可溶红褐铁,蓝絮铜其它沉淀白色呈注:1.初中用够了,红褐铁,代表铁盐沉淀为红褐色【f e(oh)2氢氧化亚铁除外】,蓝絮铜代表,铜盐为蓝色絮状沉淀。
2.氯化银【不溶酸】,碳酸钙,碳酸钡,硫酸钡【不溶酸】,氢氧化铝,氢氧化镁,为白色沉淀。
氢氧化铁(红褐色)氢氧化铜(蓝色)说明【】内为前一物质的特点2.钾钠铵盐全都溶碳酸除镁是微溶其他全都不能溶AgCl、BaSO4酸也不溶磷酸盐,更不溶一、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg + O2 点燃2MgO2. 铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O43. 铜在空气中受热:2Cu + O2 加热2CuO4. 铝在空气中燃烧:4Al + 3O2 点燃2Al2O35. 氢气中空气中燃烧:2H2 + O2 点燃2H2O6. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O2 点燃2P2O57. 硫粉在空气中燃烧:S + O2 点燃SO28. 碳在氧气中充分燃烧:C + O2 点燃CO29. 碳在氧气中不充分燃烧:2C + O2 点燃2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2 点燃2CO211. 甲烷在空气中燃烧:CH4 + 2O2 点燃CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃2CO2 +3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验2HgO 加热Hg+ O2 ↑14.加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2 + O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应:H2O2 MnO22H2O+ O2 ↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电2H2↑+ O2 ↑17.生石灰溶于水:CaO + H2O == Ca(OH)218.二氧化碳可溶于水:H2O + CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg + O2 点燃2MgO20.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu 21.氢气还原氧化铜:H2 + CuO 加热Cu + H2O22. 镁还原氧化铜:Mg + CuO 加热Cu + MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2 点燃CO224.木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑25.焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C + O2 点燃CO227.煤炉的中层:CO2 + C 高温2CO28.煤炉的上部蓝色火焰的产生:2CO + O2 点燃2CO2 (3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3 + 2HCl == CaCl2 + H2O + CO2↑30.碳酸不稳定而分解:H2CO3 == H2O + CO2↑31.二氧化碳可溶于水:H2O + CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3 高温CaO + CO2↑33.石灰水与二氧化碳反应(鉴别二氧化碳):Ca(OH)2 + CO2 === CaCO3 ↓+ H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO2 35.一氧化碳的可燃性:2CO + O2 点燃2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 + 2O2 点燃CO2 + 2H2O 38.酒精在空气中燃烧:C2H5OH + 3O2 点燃2CO2 + 3H2O39.氢气中空气中燃烧:2H2 + O2 点燃2H2O六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg + O2 点燃2MgO 41.铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O442. 铜在空气中受热:2Cu + O2 加热2CuO43. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3 (2)金属单质+ 酸-------- 盐+ 氢气(置换反应)44. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑45. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑46. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑47. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑48. 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑49. 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑50. 镁和稀盐酸Mg+ 2HCl == MgCl2 + H2↑51.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑(3)金属单质+ 盐(溶液)------- 新金属+ 新盐52. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu53. 锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg(3)金属铁的治炼原理:55.3CO+ 2Fe2O3 高温4Fe + 3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸+ 金属-------- 盐+ 氢气(见上)(2)酸+ 金属氧化物-------- 盐+ 水56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O57. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O58. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O59. 氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O (3)酸+ 碱-------- 盐+ 水(中和反应)60.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 +2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O63. 硫酸和烧碱反应:H2SO4 + 2NaOH == Na2SO4 +2H2O(4)酸+ 盐-------- 另一种酸+ 另一种盐64.大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑65.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑67. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl2、碱的化学性质(1)碱+ 非金属氧化物-------- 盐+ 水68.苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O69.苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O70.苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O71.消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3 ↓+ H2O72. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3 ↓+ H2O(2)碱+ 酸-------- 盐+ 水(中和反应,方程式见上)(3)碱+ 盐-------- 另一种碱+ 另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH3、盐的化学性质(1)盐(溶液)+ 金属单质------- 另一种金属+ 另一种盐74. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu (2)盐+ 酸-------- 另一种酸+ 另一种盐75.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑(3)盐+ 碱-------- 另一种碱+ 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH(4)盐+ 盐----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 == AgCl↓+ NaNO378.硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓+ 2NaCl钾钠硝铵均可溶,盐酸盐不溶AgCl,硫酸盐不溶BaSO4 ,碳酸盐能溶钾钠铵,钾钠钙钡可溶碱。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
阳离子
溶,挥
溶,挥
溶
溶,挥
溶,挥
溶,挥
微
溶
溶,挥
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
不
-
不
不
不
不
微
溶
溶
微
-
不
不
不
不
不
溶
溶
溶
-
微
微
不
不
不
溶
溶
溶
-
-
-
不
不
不
溶
溶
溶
不
不
不
不
不
不
溶
溶
溶
不
不
不
不
不
不
溶
溶
溶
-
-
―
不
不
不
溶
溶
溶
不
不
不
不
不
不
溶
溶
溶
-
-
不
不
不
不
溶
溶
溶
不
-
-
-
不
不
溶
微
不
不
不
不
锑
121.7
52 Te
碲
127.6
53 I
碘
126.905
54 Xe氙
131.3
55 Cs
铯
132.905
56 Ba
钡
137.33
57-71
La-Lu
镧系
72 Hf
铪
178.4
73 Ta
钽
180.947
74 W
钨
183.8
75 Re
铼
186.207
76 Os
锇
190.2
77 Ir
铱
192.2
78 Pt
106
Sg
(263)
107
Bh
(262)
108
Hs
(265)
109
Mt
(266)
110
Uun
(269)
111
Uuu
(272)
112
Uub
(277)
113
Uut
114
Uuq38 Sr锶来自87.6239Y
钇
88.906
40 Zr
锆
91.22
41 Nb
铌
92.9064
42 Mo
钼
95.94
43 Tc
锝
99
44 Ru
钌
101.07
45 Rh
铑
102.906
46 Pd
钯
106.42
47 Ag
银
107.868
48 Cd
镉
112.41
49 In
铟
114.82
50 Sn
锡
118.6
51 Sb
铂
195.08
79 Au
金
196.967
80 Hg
汞
200.5
81 Tl
铊
204.3
82 Pb
铅
207.2
83 Bi
铋
208.98
84 Po
钋
(209)
85 At
砹
(201)
86 Rn
氡
(222)
87Fr
钫
(223)
88 Ra
镭
226.03
89-103
Ac-Lr
锕系
104
Rf
(261)
105
Db
(262)
不
不
不
溶
-
溶
不
不
不
-
不
不
溶
溶
溶
不
不
不
不
不
-
溶
不
微
不
不
不
-
不
-
溶
溶
溶
不
不
不
-
不
-
溶
不
微
不
不
不
不
不
1 H
氢
1.0079
化学元素周期表
2He
氦
4.0026
3Li
锂
6.941
4 Be
铍
9.0122
5 B
硼
10.811
6 C
碳
12.011
7 N
氮
14.007
8O
氧
15.999
9F
氟
18.998
10 Ne
氖
20.17
11Na
钠
22.9898
12 Mg
镁
24.305
13 Al
铝
26.982
14 Si
硅
28.085
15 P
磷
30.974
16S
硫
32.06
17 Cl
氯
35.453
18 Ar
氩
39.94
19K
钾
39.098
20 Ca
钙
40.08
21Sc
钪
44.956
22 Ti
钛
47.9
23 V
钒
50.9415
24 Cr
铬
51.996
25 Mn
锰
54.938
26 Fe
铁
55.84
27 Co
钴
58.9332
28 Ni
镍
58.69
29 Cu
铜
63.54
30 Zn
锌
65.38
31 Ga
镓
69.72
32 Ge
锗
72.5
33 As
砷
74.922
34 Se
硒
78.9
35 Br
溴
79.904
36 Kr
氪
83.8
37Rb
铷
85.467
