ds_实验报告(模板)
韦氏成人智力测试实验报告

韦氏成人智力测试实验报告一.实验目的和要求➢目的:掌握韦氏成人智力测验的实施、记分及结果解释方法。
➢要求:本测验施测时一般注意事项与其他智力测试的要求相同。
测试应当在适宜的场所进行,要求光线适宜,安静无噪声,周围无人物图画,桌椅的大小高低恰当。
主试注意与被试的合作、建立融洽的关系。
以适当的信息让被试被试明确测验的任务。
严格按照施测程序和指导语施测。
二.实验内容和原理➢原理和内容智力(Intelligence)是指生物一般性的精神能力。
指人认识、理解客观事物并运用知识、经验等解决问题的能力,包括记忆、观察、想象、思考、判断等。
这个能力包括以下几点:理解、计划、解决问题, 抽象思维, 表达意念以及语言和学习的能力。
智力在狭窄的定义中是以智力测验来衡量(见智商)。
这些测验是最准确的(可靠及有效的)心智量度测验,但是它们不是用来量度创造力、个性、性格或智慧。
智力测验有很多方式,但全都是量度相同的智力。
韦氏成人智力量表(简称WAIS)由美国心理学家大卫.韦克斯勒编,1949年出版。
这是继比奈测验之后在世界上影响最大、应用最广泛的智力量表。
中国修订韦氏成人智力量表(WAIS-RC)是以WAIS为蓝本,保持原测验的结构,只对某些不适合中国文化背景的项目作了修改,并通过全国取样,制定了域、乡两套常模。
韦氏成人智力量表包括十一个分量表。
(言语量表六个:常识29项、理解14项、算术14项、相似13项、背数19项、词汇40项;操作量表五个:填图21项、积木10项、图法排列8项、数字符号90项、图形拼凑4项)。
➢关于测验分数和等级的说明:1.被测试者在本测验中的原始总分为11个分测验分数及其合,由于所有各个原始分数都是未经标准化的,因此不同测试者的原始分数之间的比较是没有意义的。
2.被测试者的量表分体现的是被测试者的实际智力水平在同龄人中所处的位置,量表分是经过标准化的,因此可以在同龄和不同龄的人之间直接进行比较。
3.被测试者的智力等级定性的说明了被测试者的智商水平。
ds区元素实验报告

ds区元素实验报告DS区元素实验报告导言:DS区(Discovered and Studied Zone)是指科学家们在研究中发现并深入研究的区域。
在这个实验报告中,我们将探索DS区中的元素,了解它们的性质和特点,以及它们在自然界和人类生活中的应用。
一、氢元素的探索和性质氢是宇宙中最常见的元素之一,它在地球上以气体的形式存在。
氢具有轻质、可燃、无色无味等特点,是一种非常重要的元素。
在实验中,我们通过电解水的方法制取氢气,并观察了氢气的燃烧现象。
氢气的燃烧产生的唯一产物是水,这使得氢成为一种清洁的能源选择。
二、氧元素的探索和性质氧是地球上最常见的元素之一,它占据了地球大气中的大部分。
氧是一种无色、无味、无臭的气体,对于维持生命至关重要。
在实验中,我们通过加热高锰酸钾制取氧气,并观察了氧气对燃烧的促进作用。
氧气是一种强烈的氧化剂,许多物质在氧气中能够燃烧。
此外,氧气还广泛应用于医疗、工业和冶金等领域。
三、碳元素的探索和性质碳是地球上最丰富的元素之一,它存在于各种有机物中。
碳具有多种形态,如石墨、金刚石等。
在实验中,我们通过加热蔗糖制取活性炭,并观察了活性炭对吸附的作用。
碳具有良好的导电性和热导性,因此被广泛应用于电池、电子产品和高温材料等领域。
四、铁元素的探索和性质铁是地球上最常见的金属元素之一,它广泛存在于地壳和岩石中。
铁具有良好的导电性和磁性,是一种重要的结构材料。
在实验中,我们通过还原铁矿石制取铁,并观察了铁的磁性。
铁在建筑、交通工具和机械制造等领域有着广泛的应用。
五、硫元素的探索和性质硫是地球上一种常见的非金属元素,它存在于地壳、水体和生物体中。
硫具有黄色,有刺激性的气味,以及较低的熔点和沸点。
在实验中,我们通过加热硫磺制取硫酸,观察了硫酸的酸性反应。
硫在化学工业、农业和医药领域有着广泛的应用。
结论:通过对DS区中的元素进行实验探索,我们深入了解了它们的性质和特点,以及它们在自然界和人类生活中的应用。
实验报告模板 (1)

A4: CALLSHOW;调用SHOW子程序
INCSI;SI指针自加1
MOVDL,20H;将要输出的字符放入DL
MOVAH,02H;使用AH=02H号功能调用:显示单个字符输出
INT21h;21号中断,启动调用
LOOPA4;循环A4程序段
MOVAH,02H
INT21H
MOVAL,[SI]
ANDAL,0FH;取低4位
CMPAL,0AH;是否是A以上的数
JBC3
ADD AL,07H ;如果是A以上的数,则需要+37H才能得到其显示码
C3:ADDAL,30H ;如果是A以内的数,则只需要+30H就能得到其显示码
MOVDL,AL;显示字符
MOVAH,02H
MOVAX,4C00H;使用AH=4C号系统功能,返回DOS系统
INT21H;启动调用
SHOW PROCNEAR;以下皆为SHOW子程序段,NEAR表示近调用
MOVAL,DS:[SI];将DS段SI偏移地址上的数据转入AL
ANDAL,0F0H;取高4位
SHRAL,4;对AL中数据逻辑右移4位//???
2、(第二小节)
3、(第三小节)
……
三、实验结果:
(所有的实验结果贴图放到一起)
四、实验总结
(认真写出自己在实验中遇到的问题、解决方法,以及实验的体会、收获等)
;A7-2.asm
;用功能调用实现子程序设计
STACK1 SEGMENT STACK;定义堆栈段
DW 256 DUP(?);256个字空间
STACK1 ENDS
MOV[DI],AL;把AL中数据移至目的地址的内存区
无机化学实验报告-D

无机化学实验报告-DS区元素实验11 ds 区元素(铜、银、锌、镉、汞)的性质一、实验目的1、掌握铜、锌氢氧化物的酸碱性;2、掌握铜、银、锌、汞的配合物的生成和性质; 6、掌握铜、银、锌、汞离子的分离与鉴定方法。
二、实验原理IB IIBCu Zn Cu (+2,+1) Zn(+2) Ag Cd Ag (+1) Cd(+2) Au Hg Au (+1,+3) Hg(+2,+1) 蓝色的Cu(OH)2呈现两性,在加热时易脱水而分解为黑色的CuO 。
AgOH 在常温下极易脱水而转化为棕色的Ag 2O 。
Zn(OH)2呈两性,Cd(OH)2显碱性,Hg(I, II)的氢氧化物极易脱水而转变为黄色的HgO(II)和黑色的Hg 2O(I)。
易形成配合物是这两副族的特性,Cu 2+、Ag +、Zn 2+、Cd 2+与过量的氨水反应时分别生成[Cu(NH 3)4]2+、[Ag(NH 3)2]+、[Zn(NH 3)4]2+、[Cd(NH 3)4]2+。
但是Hg 2+和Hg 22+与过量氨水反应时,如果没有大量的NH 4+存在,并不生成氨配离子。
如:HgCl 2 + 2NH 3 = Hg(NH 2)Cl↓白+ 2 NH 4Cl Hg 2Cl 2 + 2NH 3 = Hg(NH 2)Cl↓白+ Hg↓黑+NH 4Cl(观察为灰色)Cu 2+具有氧化性,与I -反应,产物不是CuI 2,而是白色的CuI :Cu2++ I - = 2CuI↓白 + I 2将CuCl 2溶液与铜屑混合,加入浓盐酸,加热可得黄褐色[CuCl 2]-的溶液。
将溶液稀释,得白色CuCl 沉淀:Cu + Cu2++ 4Cl - = 2[CuCl 2]-[CuCl 2]-←稀释→CuCl↓白 + Cl -卤化银难溶于水,但可利用形成配合物而使之溶解。
例如:AgCl + 2NH 3 = [Ag(NH 3)2]++ Cl -红色HgI 2难溶于水,但易溶于过量KI 中,形成四碘合汞(II)配离子:HgI 2 + 2I -= [HgI 4]2-黄绿色Hg 2I 2与过量KI 反应时,发生歧化反应,生成[HgI 4]2-和Hg :Hg 2I 2+ 2I - = [HgI 4]2-+ Hg↓黑三、实验内容 1、氧化物的生成和性质(1) C u 2O 的生成和性质Cu 2+ + 2OH - =Cu(OH)2↓ 蓝色 Cu(OH)2 + 2OH - = [Cu(OH)4]-2- 蓝色2[Cu(OH)4]2-+ C 6H 12O 6 (葡萄糖) =Cu 2O↓(红) + 4OH -+C 16H 12O 7+2H 2O或:2Cu 2+ + 5OH - +C 6H 12O 6 = Cu 2O↓+ C 6H 11O 7- + 3H 2O (须加热)分析化学上利用此反应测定醛,医学上利用此反应检查糖尿病。
ds区元素化合物的性质实验报告

ds区元素化合物的性质实验报告实验目的:通过实验,探究DS区元素化合物的性质,理解其化学性质和物理性质。
实验原理:DS区元素化合物是指以硫、硒、碲为主元素所形成的化合物。
DS区元素具有典型的金属和非金属的特征,同时也具有一定的半导体特性。
DS区元素化合物的性质与其化学键的性质密切相关。
硫化物中的硫原子具有六个孤对电子,形成-2 价离子和两性离子;碲化物中的碲原子具有四个孤对电子,形成 +2 价离子和 -2 价离子;硒化物中的硒原子则可以彩蝶为+2 价或-2 价离子,也可以形成六配位的复合离子。
实验步骤:1、实验前准备将所需的DS区元素化合物样品称取好,准备好所需的实验设备和试剂。
2、测量熔点取一定量的DS区元素化合物样品,放入实验室专用的熔融点测定仪中,升温至样品融化,记录下样品的熔点。
3、测量电导率将一定量的DS区元素化合物样品溶解在水中,用电导仪测定其电导率。
记录下测得的电导率值。
4、测量硬度取一定量的DS区元素化合物样品,用硬度仪进行硬度测量。
记录下所测得的硬度值。
实验结果:以硫、碲、硒为主元素所形成的DS区元素化合物,其熔点各不相同。
这些化合物一般都是固体,不易溶于水,但它们的电导性却存在一定的差异。
硫化物具有较佳的电导性,碲化物的电导性极低,而硒化物的电导性介于它们之间。
此外,不同的DS区元素化合物具有不同的硬度。
硫化物比较硬,碲化物则相对较软。
硒化物的硬度介于它们之间。
实验结论:DS区元素化合物具有一定的半导体特性,其电导性能与硫、碲、硒之间的化学键种类密切相关。
DS区元素化合物的物理性质也各有不同,其硬度值与其它硫族元素化合物差别不大。
DS区元素化合物的性质实验结果为我们深入了解这类元素化合物提供了具体的实验数据支持。
2021年ds区元素实验报告

Hg(NO3)2+过量SnCl2
Hg2Cl2+ SnCl2=2Hg↓+ SnCl4
(2)Zn2+、Cd2+、Hg2+混合液分离判定
上述溶液+KI
Ag++I-=AgI↓
沉淀+NaCN
沉淀溶解
AgI+2CN-=[Ag(CN)2]-+I-
HgI生成和溶解
Hg(NO3)2+适量KI
Hg2++2I-=HgI2↓
Hg(NO3)2+过量KI
HgI2+2I-=[HgI4]2-
上述溶液+NaOH+NH4Cl
结论
银配合物稳定性是[Ag(CN)2]-> [Ag(S2O3)2]3->[Ag(NH3)2]+,HgI能溶于过量KI中生成配合物↓+H2O
Hg2O=HgO↓+Hg↓
沉淀+饱和NaOH,加热
沉淀+HNO3
HgO+2H+=Hg2++H2O
结论
Zn(OH)2两性, Cu(OH)2两性以碱性为主, Cd(OH)2、Ag2O、HgO碱性,银、汞、亚汞氢氧化物不稳定,极易脱水生成氧化物, Hg2O易发生歧化反应。
2、配合物生成和性质
(1)氨配合物
项目
试验步骤
试验现象
解释和/或反应式
Cu2+
CuSO4+适量NH3水
Cu2++2OH-=Cu(OH)2↓
CuSO4+过量NH3水
DS18B20数字温度计设计实验报告(1)【范本模板】

单片机原理及应用课程设计报告书题目:DS18B20数字温度计姓名: 李成学号:133010220指导老师:周灵彬设计时间: 2015年1月目录1. 引言 (3)1。
1.设计意义31.2。
系统功能要求32。
方案设计 (4)3. 硬件设计 (4)4. 软件设计 (8)5。
系统调试106. 设计总结 (11)7. 附录 (12)8. 参考文献 (15)DS18B20数字温度计设计1.引言1.1. 设计意义在日常生活及工农业生产中,经常要用到温度的检测及控制,传统的测温元件有热电偶和热电阻。
而热电偶和热电阻测出的一般都是电压,再转换成对应的温度,需要比较多的外部硬件支持。
其缺点如下:●硬件电路复杂;●软件调试复杂;●制作成本高.本数字温度计设计采用美国DALLAS半导体公司继DS1820之后推出的一种改进型智能温度传感器DS18B20作为检测元件,测温范围为—55~125℃,最高分辨率可达0。
0625℃。
DS18B20可以直接读出被测温度值,而且采用三线制与单片机相连,减少了外部的硬件电路,具有低成本和易使用的热点。
1.2. 系统功能要求设计出的DS18B20数字温度计测温范围在0~125℃,误差在±1℃以内,采用LED数码管直接读显示.2. 方案设计按照系统设计功能的要求,确定系统由3个模块组成:主控制器、测温电路和显示电路.数字温度计总体电路结构框图如4。
1图所示:图4.13。
硬件设计温度计电路设计原理图如下图所示,控制器使用单片机AT89C2051,温度传感器使用DS18B20,使用四位共阳LED 数码管以动态扫描法实现温度显示。
AT89C51 主 控制器 DS18B20 显示电路 扫描驱动主控制器单片机AT89C51具有低电压供电和小体积等特点,两个端口刚好满足电路系统的设计需要,很适合便携手持式产品的设计使用.系统可用两节电池供电。
AT89C51的引脚图如右图所示:VCC:供电电压。
ds碰撞实验报告

ds碰撞实验报告DS碰撞实验报告一、引言DS碰撞实验是一项重要的科学研究工作,通过模拟和观察碰撞过程,可以深入了解物质的性质和行为。
本报告旨在总结DS碰撞实验的过程、结果和意义,为科学家们提供参考和启示。
二、实验设计1. 实验目的DS碰撞实验的主要目的是研究物体在碰撞过程中的能量转化、动量守恒和形变等现象。
通过观察和测量实验结果,可以验证和完善碰撞理论,为物理学的发展做出贡献。
2. 实验装置实验中采用了一台高速相机和一套精密的碰撞装置。
高速相机可以捕捉到碰撞瞬间的细节,而碰撞装置则能够控制碰撞速度和角度,确保实验的准确性和可重复性。
3. 实验步骤首先,选择合适的实验样本,例如金属球和塑料球。
然后,将样本放置在碰撞装置中,调整碰撞速度和角度。
接下来,启动高速相机,记录碰撞瞬间的图像。
最后,对实验结果进行分析和解读。
三、实验结果1. 能量转化实验结果显示,在碰撞过程中,能量会从一个物体转移到另一个物体。
例如,当金属球和塑料球碰撞时,金属球的动能会转化为塑料球的动能,而金属球则减速或停止运动。
这说明能量在碰撞中是守恒的。
2. 动量守恒根据实验数据分析,碰撞前后物体的总动量保持不变。
即使在碰撞瞬间,物体之间的相互作用力也不会改变总动量。
这一结果与动量守恒定律相吻合,验证了碰撞理论的可靠性。
3. 形变现象实验中观察到,在碰撞过程中,物体可能发生形变。
例如,金属球在碰撞后可能会变形,而塑料球则可能发生压缩或弹性变形。
这些形变现象反映了物体在碰撞中所受到的力和压力。
四、实验意义DS碰撞实验的意义在于深入了解物质的性质和行为,并为碰撞理论的研究提供实验依据。
通过实验结果的分析和解读,可以推动物理学的发展,拓展人们对于物质世界的认识。
此外,DS碰撞实验还具有广泛的应用价值。
例如,在交通事故的调查中,可以借助碰撞实验来还原事故现场,分析事故的原因和过程。
此外,碰撞实验还可以用于材料工程领域,研究材料的强度和耐久性。
实验报告1

实验报告1实验五正负数据分流程序设计一、实验目的1.掌握汇编语言程序的编写方法。
2.学习汇编语言程序的编辑、组装、连接、调试和运行的全过程。
3.掌握分支程序结构和循环程序结构的编程二、实验内容使用缓冲区的第一个地址设置内存缓冲区,以存储16个数字(字节)。
尝试将数据块中的正数(包括0)存储到起始地址为正的缓冲区中,将负数存储到起始地址为负的缓冲区中。
数据为F5H、46h、78h、4f、0bch、0dah、0abh、02h、12h、56h、0d5h、0ach、34h、89h、45h、0c3h。
三、实验步骤1.输入源程序,建立asm文件。
程序的编辑d:\\masm5>edit文件名.asm2.使用MASM宏汇编程序汇编源文件并生成目标文件obj。
程序汇编d:\\masm5>masm文件名;3.使用链接连接程序形成执行文件exe。
程序链接D:\\masm5>链接文件名;4.实施程序。
程序运行D:\\masm5>文件名5程序调试D:\\masm5>调试文件名Exe(或D:>debugd:\\masm5\\filename.Exe)四、思考题1.使用调试软件(.EXE文件形式)调试程序。
不执行任何命令,就可以使用D命令(dds:0)查看数据段的原始数据吗?为什么?2.如果汇编语言源程序通过汇编和链接,是否正确?为什么?5、实验报告1.画出程序流程图。
2.写出源程序清单。
数据段bufferdb0f5h,46h,78h,4fh,0bch,0dah,0abh,02h,12h,56h,0d5h,0ach,34h,89h,45h,0c3h plusdb16dup(?)minusdb16dup(?)dataendscodesegment假设:代码,ds:datastart:movax,datamovds,axmovcx,16movsi,offsetbufferleadi,plusleabx,minuslop:moval,[si]testal,80hjnzl1莫夫[di],艾尔incdijmpagainl1:mov[bx],alincbxjmpagain:印西looplopmovah,4chint21hcodeendsendstart3.回答思考问题1.首先用t命令顺序执行用户程序的前几条直到寄存器ds/es已预置为用户的数据段。
ds区金属元素实验报告

ds区金属元素实验报告【引言】金属元素是化学中重要的一类元素,其具有良好的导电性、导热性和延展性等特点,被广泛应用于工业、建筑、电子等领域。
本实验旨在通过对不同金属元素的实验研究,探究它们的性质和特点,为深入理解金属元素提供实验依据。
【实验一:金属元素的导电性】首先,我们选取了几种常见的金属元素,包括铜、铁、铝和锌。
通过将它们分别连接到电池的两极,我们可以观察到它们是否能够导电。
实验结果显示,铜和铁能够很好地导电,灯泡发出明亮的光;而铝和锌的导电性较差,灯泡只发出微弱的光。
这是因为铜和铁具有较好的导电性能,而铝和锌的导电性能较差。
【实验二:金属元素的导热性】接下来,我们进行了金属元素的导热性实验。
我们选取了相同大小和形状的铜、铁、铝和锌棒,并将它们的一端依次置于火焰中加热。
实验结果显示,铜棒迅速传导热量,火焰附近的部分迅速变热;铁棒次之,传热速度较慢;铝棒传热速度更慢,火焰附近的部分变热较慢;而锌棒传热速度最慢,火焰附近的部分几乎没有明显变化。
这说明铜具有较好的导热性能,而锌的导热性能较差。
【实验三:金属元素的延展性】我们进一步研究了金属元素的延展性。
选取了铜、铁、铝和锌的薄片,并使用锤子进行敲击。
实验结果显示,铜薄片在敲击后没有明显的变形,仍然保持原来的形状;铁薄片稍微有些变形,但仍能保持较好的形状;而铝薄片和锌薄片则发生了明显的变形,形状不再规则。
这说明铜具有较好的延展性能,而铝和锌的延展性能较差。
【实验四:金属元素的化学性质】最后,我们研究了金属元素的化学性质。
我们选取了铜、铁、铝和锌的片状样品,并将它们分别放入盛有酸性溶液的试管中。
实验结果显示,铜片和铁片没有明显的变化;而铝片在酸性溶液中发生了剧烈的反应,产生了气体并迅速腐蚀;锌片也发生了类似的反应,但稍微缓慢一些。
这说明铝和锌具有较强的化学活性,而铜和铁的化学活性较低。
【结论】通过以上实验,我们得出了一些关于金属元素的结论。
铜具有良好的导电性、导热性和延展性,化学活性较低;铁具有较好的导电性和导热性,延展性较好,化学活性较低;铝的导电性和导热性较差,延展性较差,但化学活性较高;锌的导电性、导热性和延展性均较差,但化学活性较高。
无机化学实验报告

无机化学实验报告以下是给大家整理收集的无机化学实验报告,仅供参考。
无机化学实验报告1Ds区元素(铜、银、锌、镉、汞)【学习目标】认知目标:把握铜、银、锌、镉、汞的氢氧化物或氧化物的酸碱性,硫化物的溶解性及配位性。
技能目标:把握Cu+ \ Cu2+及Hg22+\ Hg2+相互转化条件,正确使用汞;思想目标:培养学生观察现象、思考题目的能力。
【教学安排】一课时安排:3课时二实验要点:1、铜、银、锌、镉、汞氢氧化物或氧化物的天生和性质;2、锌、镉、汞硫化物的天生和性质;3、铜、银、锌、汞的配合物;4、铜、银、汞的氧化还原性。
【重点、难点】Cu+ \ Cu2+及Hg22+\ Hg2+相互转化条件;这些元素的氢氧化物或氧化物的酸碱性,硫化物的溶解性及配位性。
【教学方法】实验指导、演示、启发【实验指导】一、铜、银、锌、镉、汞氢氧化物或氧化物的天生和性质1、铜、锌、镉操纵:0.5mL 0.2 mol;L-1MSO4;2 mol;L-1NaOH;; ;2 mol;L-1H2SO4; ;;2 mol;L-1 NaOH指导:离子Cu2+实验现象H2SO4NaOH溶解释及原理Cu2+ +OH-=Cu(OH)2; Cu(OH)2+2H+=Cu2++2H2O Cu(OH)2++OH-=[Cu(OH)4]2-Zn2+ +OH-=Zn(OH)2;方程式同上溶溶浅蓝; 溶Zn2+Cd2+结论白; 白; 溶不溶Cd2+ +OH-=Cd(OH)2; Zn(OH)2、Cu(OH)2具有两性,以碱性为主,能溶于浓的强碱中天生四羟基合M(Ⅱ)酸根配离子。
Cd(OH)2碱性比Zn(OH)2强,仅能缓慢溶于热浓强碱。
2、银、汞氧化物的天生和性质操纵::0.5 mL 0.1 mol;L-1 AgNO3 ;2 mol;L-1NaOH;;;+ 2 mol;L-1HNO3(2 mol;L-1 NH3;H2O):0.5 mL 0.2 mol;L-1 Hg(NO3)2 ; 2 mol;L-1NaOH;;;+ 2 mol;L-1HNO3(40% NaOH) 指导:离子实验现象解释及原理Ag+Ag2O褐;HNO3溶溶无色氨水溶NaOH 不溶Ag2O+ 4NH3 + H2O =2Ag(NH3)2+ +2OHHgO + 2H+=Hg2+ +H2O-Hg2+HgO 黄;结论AgOH、Hg(OH)2沉淀极不稳定,脱水天生成碱性的Ag2O、HgO。
1-2元素性质实验-实验报告
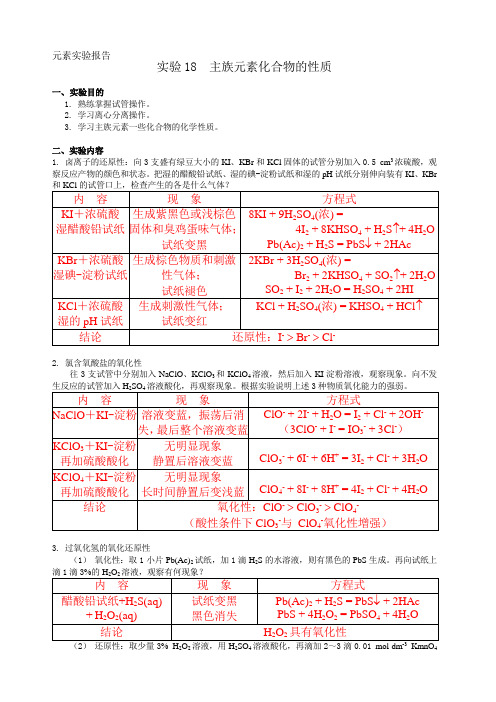
元素实验报告实验18 主族元素化合物的性质一、 实验目的1. 熟练掌握试管操作。
2. 学习离心分离操作。
3. 学习主族元素一些化合物的化学性质。
二、实验内容1. 卤离子的还原性:向3支盛有绿豆大小的KI 、KBr 和KCl 固体的试管分别加入0.5 cm 3浓硫酸,观察反应产物的颜色和状态。
把湿的醋酸铅试纸、湿的碘-淀粉试纸和湿的pH 试纸分别伸向装有KI 、KBr2. 氯含氧酸盐的氧化性 往3支试管中分别加入NaClO 、KClO 3和KClO 4溶液,然后加入KI 淀粉溶液,观察现象。
向不发3. 过氧化氢的氧化还原性(1) 氧化性:取1小片Pb(Ac)2试纸,加1滴H 2S 的水溶液,则有黑色的PbS 生成。
再向试纸上222444. 过硫酸盐的氧化性向盛有2滴 0.002 mol·dm-3MnSO4溶液的试管中加入5 cm3 3 mol·dm-3H2SO4、2~3 滴AgNO3溶液,再加入少量K2S2O8固体,小心加热,观察现象;另取1支试管,不加AgNO3, 进行同样实验。
5. 亚硝酸的氧化还原性请利用0.5 mol·dm-3NaNO2、0.1 mol·dm-3KI、0.02 mol·dm-3KMnO4、1 mol·dm-3H2SO4试剂,6. 硝酸根的检出取少量FeSO4·7H2O固体于试管中,滴加1滴0.5 mol·dm-3NaNO3溶液及1滴浓H2SO4,静置,观察现象。
反应式为:2+-+3+2+2-7. 磷酸根、焦磷酸根和偏磷酸根的鉴别(1)分别向0.1 mol·dm-3Na2HPO4、Na4P2O7和NaPO3溶液中滴加0.1 mol·dm-3AgNO3溶液,观察发生的现象。
生成的沉淀溶于2 mol·dm-3HNO3溶液吗?(2)以2 mol·dm-3HAc溶液酸化磷酸盐溶液、焦磷酸盐溶液和偏磷酸盐溶液,再分别加入蛋白溶液,各发生什么现象?3-4--PO43-、P2O74-和PO3-的鉴别方法:8. Sn2+、Pb2+、Sb3+、Bi3+氢氧化物的酸碱性现有0.1 mol·dm-3的SnCl2、Pb(NO3)2、SbCl3和Bi(NO3)3,2 mol·dm-3NaOH、6 mol·dm-3NaOH 和40%的NaOH试剂。
学年论文创新实验DS证据理论与数据挖掘

本科创新实验报告实验题目:DS证据理论与数据挖掘学生:胜达学号:专业:计算机科学与技术武警国防生指导教师:肖清评分(百分制):2012年 6 月25 日目录本科创新实验报告 (1)实验目的 (3)实验容 (3)实验平台及语言 (3)实验原理 (3)实验步骤 (7)实验结果 (8)实验小结 (12)参考文献 (13)实验目的实现D-S证据理论基本算法,并验证其对不确定性的影响。
随机赋予基本概率分配bpa后求得(质量函数)m,进一步求出(信任函数(置信函数))bel和似然函数pls,即概率上限和概率下限,将原来信息的不确定性转换成不确定区间的形式进行表达。
实验容一.实现程序从文本文件、excel文件和数据库中读写数据。
二.D-S证据理论的基本算法1.实现动态数组;2.求指定集合的幂集;3.求两集合的交并差集和子集;4.为幂集中的每个集合给定一个基本概率分配bpa,将其标准化后作为质量函数;5.求幂集中的每个集合的信任函数及似然函数,获得不确定区间。
三.D-S证据理论与数据挖掘将证据理论引入数据挖掘领域中挖掘带不确定数据的关联规则。
这一模块的实验容正在进行当中。
实验平台及语言平台:Microsoft Visual C++ 6.0语言:C++实验原理一.D-S证据理论Dempster -Shafer证据理论也称D-S证据理论或“信念函数理论”(The D-S theory of evidence) ,起源于Dempster早期提出的由多值映射导出的所谓上限概率和下限概率,由于该理论满足比概率论更弱的公理体系比概率推理理论中的更为直观、更容易获得,能够区分“不确定”与“不知道”的差异并能够处理由未知引起的不确定性, 具有较大的灵活性从而受到人们的重视。
基本理论:设D是变量x所有可能取值的集合,且D中的元素是互斥的,在任一时刻x都取且只能取D中的某一个元素为值,则称D为x的样本空间,也称D为辨别框。
在证据理论中,D的任何一个子集A都对应于一个关于x的命题,称该命题为“x的值在A中”。
实验报告

南通大学计算机科学与技术学院微机原理实验报告书班级:智控151学号:***********名:***南通大学计算机类课程实验报告南通大学计算机科学与技术学院微机原理实验报告书班级:智控151学号:1512042022姓名:王建棋南通大学计算机类课程实验报告六、实验结果<一><二>七、实验存在问题和解决办法程序一:检查发现第16行的“ADD AL,20H”将数字0写成了大写字母O,排除错误后可正常运行。
字符串后忘了加$,导致转换为小写字母后出现如下乱码:字符串后加结束符$后乱码消除。
程序二:分析表明第28行“CMP BL,0FFH”中FFH前要加0八、实验心得和建议南通大学计算机科学与技术学院微机原理实验报告书班级:智控151学号:1512042022姓名:王建棋南通大学计算机类课程实验报告ADD AL,30HMOV DL,ALMOV AH,2INT 21HMOV AX,4C00HINT 21HCODE ENDSEND START(如不够,请另附纸)六、实验结果七、实验存在问题和解决办法分析表明错误原因如下:(1)O写成0;(2)相对寻址只限于用SI、DI、BX、BP,而程序中却用了其它寄存器。
修改后仍有错误如下:错误原因:使用“INC BYTE PTR[BX+2]”忘了加BYTE PTR修改后仍得不到正确结果,错误如下:错误原因:“CMP [DI],'0'”应改成“CMP BYTE PTR[DI],'0'”错误全部修改后得到所要的结果八、实验心得和建议南通大学计算机科学与技术学院微机原理实验报告书班级:智控151学号:1512042022姓名:王建棋南通大学计算机类课程实验报告MOV AX,4C00HINT 21HCODE ENDSEND START(如不够,请另附纸)六、实验结果七、实验存在问题和解决办法出错原因:(1)DEC,DW 是保留字;(2)“MOV CL,10000”中10000超过范围CL的最大范围。
ds区金属元素实验报告

ds区金属元素实验报告ds区金属元素实验报告引言:金属元素是化学中的重要组成部分,它们具有良好的导电性、导热性和延展性等特点,广泛应用于工业生产和科学研究中。
本次实验旨在研究ds区金属元素的性质和特点,以期对其应用领域和未来发展方向有更深入的了解。
实验方法:1. 实验器材准备:试剂瓶、试管、电子天平、酒精灯、显微镜等。
2. 实验步骤:a. 依据实验需求,选取ds区金属元素进行研究。
b. 使用电子天平准确称量所需金属元素。
c. 将金属元素置于试管中,加热至一定温度,观察其物理性质变化。
d. 利用显微镜观察金属元素的晶体结构。
e. 进行相关实验数据的记录和分析。
实验结果与讨论:1. 物理性质变化观察:a. 随着温度的升高,金属元素逐渐熔化,并呈现出液态状态。
不同金属元素的熔点各异,这是由其原子结构和相互作用力决定的。
b. 在一定温度范围内,金属元素呈现出流动性和可塑性,可以通过挤压、拉伸等方式改变其形状,这是金属元素的延展性和塑性的表现。
c. 通过显微镜观察,我们可以发现金属元素的晶体结构呈现出规则的排列和重复性,这是由于金属元素中的原子具有相似的尺寸和电子排布特点所致。
2. 实验数据分析:a. 通过实验测得的金属元素的熔点和密度等数据,我们可以对其物理性质进行定量分析和比较,从而了解不同金属元素之间的差异。
b. 结合实验结果和已有的相关知识,我们可以进一步探讨金属元素的导电性、导热性等特点,以及其在电子、材料等领域的应用。
结论:通过本次实验,我们对ds区金属元素的性质和特点有了更深入的了解。
金属元素具有良好的导电性、导热性和延展性等特点,这使得它们在电子、材料等领域有着广泛的应用前景。
未来,我们可以进一步研究和开发ds区金属元素的新型应用,以满足社会发展的需求。
致谢:感谢实验中提供的相关设备和材料,以及指导老师的指导和帮助。
本次实验取得了较好的结果,也让我们对金属元素有了更加深入的认识和理解。
无机化学实验报告-ds区元素

无机化学实验报告-ds区元素实验名称:ds区元素实验实验目的:通过实验了解ds区元素的性质,并掌握ds区元素的化学反应。
实验步骤:1. 实验前准备:取出实验器材和试剂,清洗干净。
2. 实验1:铑(Rh)和铱(Ir)颜色对比实验。
将Rh和Ir放在白纸上比较颜色的不同。
Rh呈现银白色,而Ir呈现黄色,可以清晰地区分这两种元素。
先将Rh粉磨成粉末状,并称取一定量的Rh,加入200毫升的盐酸中。
在加热的过程中,观察Rh在盐酸中的反应。
Rh在盐酸中反应,生成RhCl3的无色溶液,并放出氢气。
反应方程式:2Rh + 6HCl → 2RhCl3 + 3H2。
4. 实验3:铱(Ir)的化学反应实验。
将Ir和硫在空气中加热时,会发生强烈的反应,生成黑色的IrS2。
IrS2是一种比较稳定的化合物,可以在空气中保存。
反应方程式:2Ir + 3S → IrS2。
实验结果及分析:通过这些实验,我们可以发现ds区元素的某些性质和化学反应式。
Rh和Ir颜色的对比实验,让我们比较容易地区分这两种元素。
在Rh的化学反应实验中,我们可以清晰地看到Rh粉末加入盐酸中反应时,生成RhCl3的无色溶液,同时放出氢气。
而在Ir的实验中,我们可以发现,在空气中加热Ir和硫时,会形成黑色的IrS2,是一种比较稳定的化合物,可以在空气中保存。
结论:通过本次实验,我们了解了ds区元素的某些性质和化学反应式,学会了如何区分Rh和Ir的颜色差别,并掌握了Rh和Ir的化学反应过程。
同时,通过实验过程中的观察和分析,将理论知识和实际操作紧密结合起来,有助于更好地理解和掌握相关科学知识。
逻辑数字电路实验报告

一、实验目的1. 理解并掌握基本逻辑门电路(与门、或门、非门、异或门)的功能和特性。
2. 学会使用基本逻辑门电路搭建组合逻辑电路。
3. 熟悉逻辑分析仪的使用方法,观察和分析逻辑电路的输出波形。
4. 培养动手实践能力和逻辑思维能力。
二、实验原理逻辑数字电路是数字电路的基础,它由基本逻辑门电路组成,可以完成各种逻辑运算。
本实验主要涉及以下基本逻辑门电路:1. 与门(AND gate):当所有输入端都为高电平时,输出才为高电平,否则输出为低电平。
2. 或门(OR gate):当至少一个输入端为高电平时,输出就为高电平,否则输出为低电平。
3. 非门(NOT gate):将输入信号取反,即输入高电平时输出低电平,输入低电平时输出高电平。
4. 异或门(XOR gate):当输入信号不同时,输出为高电平,否则输出为低电平。
三、实验器材1. 逻辑分析仪2. 74LS00(四路2-3-3-2输入与或非门)3. 74LS20(四路2-输入与非门)4. 74LS86(四路2-输入异或门)5. 连接线6. 电源四、实验步骤1. 搭建与门电路:- 使用74LS00搭建一个2输入与门电路。
- 通过逻辑分析仪观察输入和输出波形,验证与门电路的功能。
2. 搭建或门电路:- 使用74LS00搭建一个2输入或门电路。
- 通过逻辑分析仪观察输入和输出波形,验证或门电路的功能。
3. 搭建非门电路:- 使用74LS20搭建一个非门电路。
- 通过逻辑分析仪观察输入和输出波形,验证非门电路的功能。
4. 搭建异或门电路:- 使用74LS86搭建一个2输入异或门电路。
- 通过逻辑分析仪观察输入和输出波形,验证异或门电路的功能。
5. 搭建组合逻辑电路:- 使用上述基本逻辑门电路搭建一个组合逻辑电路,例如二进制加法器。
- 通过逻辑分析仪观察输入和输出波形,验证组合逻辑电路的功能。
五、实验结果与分析1. 与门电路:- 输入端都为高电平时,输出为高电平;输入端有一个或多个为低电平时,输出为低电平。
ds 金属 实验报告

ds 金属实验报告DS金属实验报告引言在现代工业领域,金属材料是不可或缺的基础材料之一。
DS金属是一种新兴的金属材料,具有出色的性能和广泛的应用前景。
本实验旨在探究DS金属的制备方法、物理性质以及在工业领域中的应用。
一、DS金属的制备方法1.1 真空熔炼法真空熔炼法是制备DS金属的常用方法之一。
通过将金属样品置于真空熔炼炉中,加热至高温状态,使金属样品熔化并去除其中的杂质。
随后,通过控制冷却速率,使金属样品在凝固过程中形成细小的晶粒结构,从而获得高强度和高塑性的DS金属。
1.2 电弧熔炼法电弧熔炼法是另一种常用的制备DS金属的方法。
该方法利用电弧高温熔化金属样品,然后通过控制冷却速率,使金属样品在凝固过程中形成细小的晶粒结构。
电弧熔炼法制备的DS金属具有均匀的组织结构和优异的性能。
二、DS金属的物理性质2.1 强度和塑性DS金属具有优异的强度和塑性。
由于其细小的晶粒结构,DS金属的晶界强化效应明显,使其具有较高的屈服强度和抗拉强度。
同时,DS金属的晶界还可以阻碍位错的移动,提高材料的塑性,使其具有良好的可加工性。
2.2 耐腐蚀性DS金属具有良好的耐腐蚀性能。
由于其均匀的组织结构和高纯度的成分,DS 金属在各种腐蚀介质中都表现出较高的稳定性。
这使得DS金属在化工、海洋工程等领域中得到广泛应用。
2.3 导电性能DS金属具有良好的导电性能。
其高电导率使得DS金属在电子器件、电力传输等领域中得到广泛应用。
此外,DS金属还具有良好的热导性能,可用于制造散热器等热传导设备。
三、DS金属的应用3.1 航空航天领域由于DS金属具有优异的强度和塑性,以及良好的耐腐蚀性能,因此在航空航天领域有广泛的应用。
DS金属可用于制造飞机结构件、发动机零部件等,提高航空器的性能和可靠性。
3.2 汽车制造领域DS金属在汽车制造领域也有重要应用。
其高强度和良好的可加工性使得DS金属成为制造汽车车身、底盘等关键部件的理想材料。
同时,DS金属的耐腐蚀性能也能够提高汽车零部件的使用寿命。
ds区金属实验报告

ds区金属实验报告实验目的,通过实验探究不同金属在ds区的性质和反应规律,为金属材料的应用提供实验数据支持。
实验原理,ds区是指金属的d轨道和s轨道的混合区域,金属在这个区域的电子结构和化学性质具有特殊性。
通过对ds区金属的实验研究,可以更好地理解金属的性质和应用。
实验步骤:1. 准备实验所需的金属样品,包括铜、铁、锌等常见金属。
2. 将每种金属样品分别放入硫酸溶液中,观察其溶解情况和产生的气体。
3. 将金属样品分别加热至一定温度,观察其颜色变化和可能产生的氧化物。
4. 使用电解质溶液进行电化学实验,测定不同金属的电极电位和电化学活性。
实验结果与分析:1. 在硫酸溶液中,铜和铁能够产生氢气,而锌则无明显反应产生气体。
这表明铜和铁在酸性条件下能够与酸发生反应,而锌则相对稳定。
2. 加热金属样品后,铜会产生黑色氧化物,铁会产生红色氧化物,而锌则不会发生明显颜色变化。
这说明不同金属在加热条件下会产生不同的氧化物,反映了它们的化学性质差异。
3. 电化学实验结果显示,铜的电极电位较高,电化学活性较强,而锌的电极电位较低,电化学活性较弱。
这与金属在酸性条件下的反应规律相符合。
实验结论,通过对ds区金属的实验研究,我们发现不同金属在酸性条件下的溶解性、加热条件下的氧化物产生以及电化学活性存在明显差异。
这些差异反映了金属在ds区的特殊性质,为金属材料的应用提供了重要参考依据。
实验意义,ds区金属的实验研究有助于深入理解金属的电子结构和化学性质,为金属材料的设计、合金的制备以及电化学领域的应用提供了重要的实验数据支持。
同时,也为金属材料的性能优化和应用拓展提供了新的思路和方法。
总结,通过本次实验,我们深入探究了ds区金属的性质和反应规律,发现不同金属在酸性条件下的溶解性、加热条件下的氧化物产生以及电化学活性存在显著差异。
这些结果为金属材料的应用提供了重要的实验数据支持,具有重要的理论和实际意义。
希望通过这些研究成果,能够为金属材料领域的进一步发展和应用提供有益的参考和指导。
水准测量的实验报告

水准测量的实验报告篇一:水准测量的实验报告1.了解DS 3型水准仪的大体构造,认清其要紧部件的名称,性能和作用。
2.练习水准仪的正确安置、对准和读数。
3.把握一般水准测量的施测、记录、计算、闭合差调整及高程计算的方式。
1.实验时数安排为2学时。
2.实验小组由8人组成:4人操作,2人记簿,2人扶尺。
2. 实验设备:DS3水准仪1台,双面水准尺2根,尺垫2个,记录纸2张,三角架1个;铅笔1根。
水准仪器组合:(一)水准仪的熟悉与利用1.安置仪器:先将三脚架张开,使其高度适当,架头大致水平,并将架腿踩实,再开箱掏出仪器,将其固连在三脚架上。
2.熟悉仪器:指出仪器各部件的名称和位置,了解其作用并熟悉其利用方式。
同时弄清水准尺的分划注记。
3.粗略整平:双手食指和拇指各拧一只脚螺旋,同时对向(或反向)转动,使圆水准器气泡向中间移动;再拧另一只脚螺旋,使气泡移至圆水准器居中位置。
假设一次不能居中,可反复进行。
(练习并体会脚螺旋转动方向与圆水准器气泡移动方向的关系。
)4.水准仪的操作:对准——转动目镜调焦螺旋,使十字丝清楚,松开制动螺旋,转动仪器,用照门和准星对准水准尺,拧紧制动螺旋,转动微动螺旋,使水准尺位于视场中央,转动物镜调焦螺旋,排除视差使目标清楚(体会视差现象,练习排除视差的方式)。
精平——转动微倾螺旋,使符合水准管气泡两头的半影像吻合(成圆弧状),即符合气泡严格居中。
读数——从望远镜中观看十字丝横丝在水准尺上的分划位置,读取四位数字,即直读出米、分米、厘米的数值,估读毫米的数值。
5.观测练习:在仪器双侧各立一根水准尺,别离进行观测(对准,精平,读数),记录并计算高差。
不动水准尺,改变仪器高度,同法观测。
或不动仪器,改变两立尺点位置同法观测。
检查是不是超限。
(二)一般水准测量1.选定一条闭合水准线路,其长度以安置4~6个测站为宜。
确信起始点及水准线路的前进方向。
2.在起始点和第一个待定点别离立水准尺,在距该两点大致等距离处安置仪器,别离观测黑面水准尺,取得后视读数 a黑和前视读数 b黑;然后再观测前视水准尺红面,取得读数b红,旋转水准仪对准后视水准尺红面,取得读数a红;检查所测数据是不是超限,如超限重测,不超限那么计算平均高差 h1,然后进行下一站观测,依次推动测出h、h3、h4。
