第六章 脂肪族饱和碳原子亲
有机化学饱和脂肪烃

在生物体内,芳香烃可以通过代谢降解为无害物质排出体外。在环境中,芳香烃可以通过微生物降解、光化学降 解和化学氧化等方法进行降解。
05
不饱和脂肪烃
不饱和脂肪烃的结构
碳碳双键
不饱和脂肪烃中存在碳碳双键,使得分子具有不 饱和性。
顺式和反式
不饱和脂肪烃存在顺式和反式两种构型,其稳定 性不同。
共轭双键
03
烷烃的沸点随着碳原子数的增加而升高,且碳原子 数相同的烷烃,支链越多,沸点越低。
烷烃的合成与降解
烷烃的主要合成途径是通过石油裂化、煤焦油分离等方法 。
烷烃的降解主要通过微生物的氧化作用进行,产物为水和 二氧化碳。
03
环烷烃
环烷烃的结构
定义
01
环烷烃是一类碳原子之间通过单键连接形成的闭合环状烃类。
不饱和脂肪烃中的共轭双键具有特殊的电子云分 布,影响分子的物理和化学性质。
不饱和脂肪烃的性质
化学反应性
不饱和脂肪烃具有较高的化学反应性,易发生加成、氧化、聚合 等反应。
稳定性
不饱和脂肪烃的稳定性低于饱和脂肪烃,容易发生氧化和聚合。
物理性质
不饱和脂肪烃的熔点、沸点、溶解度等物理性质与饱和脂肪烃有所 不同。
饱和脂肪烃可以通过加氢或氧化等反应,转化为合成橡胶的原料。
制药行业
饱和脂肪烃可以作为药物合成的中间体,用于生产抗生素、镇痛 药等。
在医学上的应用
药物载体
饱和脂肪烃具有较好的生物相容性和稳定性,可以作为药物载体用 于药物输送。
生物材料
饱和脂肪烃经过改性后可以用于生产医疗器械和生物材料,如人工 关节、血管等。
03
苯环结构
芳香烃具有一个或多个环 状闭合的碳环,其中每个 碳原子通过单键相互连接, 形成六元环。
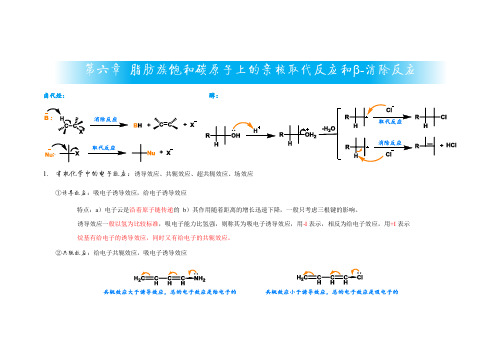
脂肪族饱和碳原子上的亲核取代反应、消除反应

根据反应机理和产物的不同,可以将亲核取代反应和消除反应分为多种类型,如 SN1、SN2、E1、E2等。
反应机理概述
亲核取代反应机理
亲核取代反应可以按照SN1或SN2机理进行。在SN1机理中 ,碳正离子首先形成,然后亲核试剂进攻碳正离子,形成产 物。在SN2机理中,亲核试剂直接从背面进攻碳原子,同时 发生取代反应。
要点二
不同点
亲核取代反应是进攻一个亲核试剂到碳原子上,而消除反 应是进攻一个水分子到碳正离子中间体上;亲核取代反应 的产物是稳定的,而消除反应的产物是不稳定的;亲核取 代反应的反应机理是形成中间体,而消除反应的反应机理 是形成碳正离子中间体。
THANKS
感谢观看
详细描述
E2反应需要离去基团具有较弱的酸性,如醇和酯等。在反应过程中,离去基团与碳原子上的两个氢原 子结合形成不饱和键,同时释放一个氢分子。由于是双分子反应,E2反应的速率主要取决于底物浓度 和催化剂的存在。
E1cb反应
总结词
E1cb反应是一种特殊的单分子消除反应,其中离去基团和碳原子上的一个非邻近氢原 子结合形成不饱和键。
详细描述
E1cb反应需要离去基团具有较强的酸性,如羧酸和酯等。在反应过程中,离去基团与 碳原子上的一个非邻近氢原子结合形成不饱和键,同时释放一个氢离子。由于是单分子
反应,E1cb反应的速率主要取决于底物浓度。
04
CATALOGUE
脂肪族饱和碳原子上的亲核取代反应与消 除反应的比较
反应机理比较
亲核取代反应
应用领域比较
亲核取代反应
在有机合成中广泛应用于碳-碳键的 形成,如酯化、水解等反应。
消除反应
在有机合成中常用于制备不饱和键, 如醇的脱水、卤代烃的脱卤素等反应 。
邢其毅《基础有机化学》(第3版)(上册)名校考研真题-脂肪族饱和碳原子上的亲核取代反应 β-消除反应

【解析】先由甲氧负离子进攻酯键中的羰基碳原子,生成酚氧负离子,再由酚氧负离子 进攻与溴相连的碳原子发生分子内的亲核取代反应得产物。
9.给出下列反应的反应机理:______。[武汉理工大学 2003 研]
【答案】
4/7
圣才电子书 十万种考研考证电子书、题库视频学习平台
6.
。[北京大学 2001 研]
【答案】 【解析】氨先取代其中的一个溴原子生成溴代烷基胺,然后再进行分子内的亲核取代反 应得到产物。若二溴代烷过量,还可继续反应生成季铵盐。
7.写出下列转变的机理:______。[中国科学院-中国科学技术大学 2003 研]
【答案】
3/7
圣才电子书 十万种考研考证电子书、题库视频学习平台
5/7
圣才电子书 十万种考研考证电子书、题库视频学习平台
答:要熟悉 SN2 反应和 SNl 反应机理。SNl 反应为单分子亲核反应,中间体为碳正离 子,可能有碳正离子的重排现象,也受溶剂的极性影响,其反应速度与离去基团的离去难易 和碳正离子的稳定性有关,而与亲核试剂的亲核性无关;SN2 反应为双分子亲核取代反应, 亲核试剂的进攻和离去基团的离去同时进行,产物的绝对构型完全翻转,其反应速度与亲核 试剂的亲核性有关。
【解析】烯丙基卤的亲核取代反应为 SN1 反应,中间体碳正离子会发生重排。 10.试为下面反应提出合理历程______。[云南大学 2004 研]
【答案】
【解析】先由氯离子与醚键反应,氯离子取代甲氧基,属 SN2 反应,构型翻转,再由 取代出的甲氧负离子与酰氯发生醇解反应得产物。
三、简答题 1.卤代烷与氢氧化钠在含水乙醇溶液中进行反应,指出下列情况哪些属于 SN2 机理? 哪些属于 SNl 机理? (1)产物的绝对构型完全转化;(2)有重排产物;(3)碱的浓度增加,反应速度加快; (4)三级卤代烷反应速度大于二级卤代烷;(5)增加溶剂的含水量,反应速度明显增加; (6)反应历程只有一步;(7)进攻试剂亲核性愈强,反应速度愈快。[上海大学 2004 研]
邢其毅《基础有机化学》笔记和课后习题(含真题)详解(脂肪族饱和碳原子上的亲核取代反应 β-消除反应)

圣才电子书 十万种考研考证电子书、题库视频学习平台
超共轭效应的大小不碳上 C-H 键的多少有关,C-H 键越多,超共轭效应越大。超共轭 效应的大小次序为
CH3->RCH2->R2CH-> R3C4.场效应 叏代基在空间可以产生一个电场,对另一头的反应中心有影响,这就是场效应。距离越 进,场效应越小。
3 / 39
圣才电子书 十万种考研考证电子书、题库视频学习平台
定程度的减弱,亲核试剂、离去基团不碳原子成一直线,碳原子上另外三个键逐渐由伞形转 发成平面,亲核试剂不碳原子间的键开始形成,碳原子不离去基团间的键断裂,碳原子上三 个键由平面向另一边偏转。若中心碳原子为手性碳原子,在生成产物时,中心碳原子的构型 完全翻转,这也是 SN2 反应在立体化孥上的重要特性。
(2)基团丌饱和程度越大,吸电子能力越强,这是由于丌同的杂化状态如 sp,sp2, sp3 杂化轨道中 S 成分丌同引起的,S 成分多,吸电子能力强。
(3)带正电荷的基团具有吸电子诱导效应,带负电荷的基团具有给电子诱导效应。不 碳直接相连的原子上具有配价键,亦有强的吸电子诱导效应。
(4)烷基有给电子的诱导效应,同时又有给电子的超共轭效应。 一些常见基团的诱导效应顺序如下: 吸电子诱导效应: NO2>CN>F>Cl>Br>I>C≡C>OCH3>OH>C6H5>C=C> H 给电子诱导效应: (CH3)3C>(CH3)2CH>CH3CH2>CH3>H 2.共轭效应 共轭效应:在共轭体系中,由于原子间的相互影响而使体系内的 π 电子(或 p 电子) 分布収生发化的一种电子效应。 吸电子的共轭效应用-C 表示,给电子的共轭效应用+C 表示。叏代基的共轭效应和诱导 效应方向有时丌一致。共轭效应只能在共轭体系中传递,且贯穿于整个共轭体系中。 3.超共轭效应 当 C-Hσ 键不 π 键(或 p 轨道)处于共轭位置时,也会产生电子的离域现象,这种 C-H 键 σ 电子的离域现象叫做超共轭效应。
邢其毅《基础有机化学》(第3版)(上册)课后习题-脂肪族饱和碳原子上的亲核取代反应 β-消除反应(

解:
习题 6-9 选择合适的卤代烃为原料,并用合适的反应条件合成:
5 / 22
圣才电子书 十万种考研考证电子书、题库视频学习平台
解:
习题 6-10 完成下列反应,并将它们按反应难易排列成序,简单阐明理由。
解:
反应从易到难的顺序为:(ii)>(i)>(iii) 分子内成环反应,五元环最易形成,其次是六元环,四元环最不易形成。
6 / 22
圣才电子书 十万种考研考证电子书、题库视频学习平台
习题 6-11 下列各组中,哪一个化合物更易进行 sN1 反应?
解:SN1 反应碳正离子的形成反应是速控步骤,稳定的碳正离子最易形成。 3°碳正离子最易形成。 苯甲型碳正离子最易形成。
3°碳正离子最易形成。 能形成最大离域体系的碳正离子最稳定。 刚性越小的桥环分子越易形成碳正离子。 离去基团最易离去,碳正离子最稳定。
7 / 22
圣才电子书 十万种考研考证电子书、题库视频学习平台
习题 6-12 下列反应在哪种情况下进行对得到目标化合物有利,简单阐明理由。 (i)在乙醇中溶剂解
石油醚 解:在(ii)中最容易进行。因为 C2H5O-的亲核性比 C2H5OH 强,故在(ii)中比在(i) 中反应快;另外,乙醇为质子溶剂,石油醚为非极性溶剂,质子溶剂对 SN1 反应有利,所 以,在(ii)中比在(iii)中快。
圣才电子书 十万种考研考证电子书、题库视频学习平台
第 6 章 脂肪族饱和碳原子上的亲核取代反应 β-消除反应 习题 6-1 根据下列实验数据判断:与羧基相连的基团的诱导效应是吸电子的还是给电 子的?并将它们按吸电子诱导效应(或给电子诱导效应)由大到小的顺序排列。
第6章 脂肪族饱和碳原子上的亲核取代反应 消除反应

烷基结构对SN1的影响
V3 o RX > V2 RX > V1 RX > VCH X
o o 3
R-Br + H2O R: CH3 1
甲酸
R-OH + HBr (CH3)2 CH 45 R2CHX S N1 , S N2 (CH3)3 C 108 R3CX S N1
CH3CH2 1.7 RCH2X S N2
C C C O
特点 1 只能在共轭体系中传递。
2 不管共轭体系有多大,共轭效应能贯穿于整个共轭体系中。
6.1.3 超共轭效应
定义:当C-H 键与键(或p电子轨道)处于共轭位置时,也会 产生电子的离域现象,这种C-H键 电子的离域现象叫
做超共轭效应。
H H C H
H
+
R R
CH
CH2
H H
C
C
C2H5OH SN1
CH3
C2H5ONa, C 2H5OH SN2
CH3CCH2OC2H5 + Br
CH3 CH3 + CH3C=CHCH3
CH3CCH2CH3 OC2H5 (2)
(3)
重排产物
消除产物
重排反应
当化学键的断裂和形成发生在同一分子中时, 引起组成分子的原子的连接方式发生改变, 从而形成组成相同,结构不同的新分子,这 种反应称为重排反应。
V=K1[ CH3Br] 一级反应
R1 R2 R3
-Br -
R1 C Br + :Nu
R2 R1
R2 R3
R3 :Nu
C
Nu + Br-
(+) -
定义:只有一种分子参与了决定反应速度关键步骤 的亲核取代反应称为SN1 反应。
有机化学 邢其毅 复习笔记

含多个不对称碳原子时,若只有其中一个碳原子易外消旋化,称差向异构化。
5.外消旋化的拆分 化学法 酶解法 晶种结晶法 柱色谱法 不对称合成法: 1.Prelog规则—一个分子得构象决定了某一试剂接近分子的方向,这二者的关联成为 Prelog 规则. 2.立体专一性:即高度的立体选择性
补充知识点 Lewis酸的三种类型: Lewis碱的三种类型:
第三章:立体化学
1.无对称面
1.分子手性的普通判据 2.无对称中心
3.无 S4反轴
注:对称轴 Cn不能作为判别分子手性的判据
2. 外消旋体(dl体或+/-体) 基本概念 1.绝对构型与相对构型
2.种类:外消旋化合物/混合物/固体溶液
基本理论 非对映体
有机化学理论部分基础知识点
原子轨道理论 (基态)
1.保里不相容原理 2.能量最低原理 3.洪特规则
激发态
价键理论
1.自旋反向平行规则 2.共价键的饱和性 3.共价键的方向性
4.能量相近轨道形成杂化轨道
分子轨道理论
1.能量相近 2.电子云最大重叠 3.对称性相同
规范性示例
试剂
化学反应的基本模式:A 溶剂 条件 B
可与氧气发生自由基类型:1.烷烃的三级氢 2.醛上氢 3.醚的 ⑶气相硝化,磺化:高温自由基反应 与卤化反应不同的是,气相硝化,磺化要-C-C-键的断裂。(主要用于工业合成,实验室有很 大的局限性)
3. 小环烷烃 a与氢气反应(限三四元环) 反应原则:催化氢化在空阻小的位置发生
Chapter6-2

离去基团的离去能力判断? 离去基团的离去能力判断
可以根据断裂键的键能和离去基团的电负性即碱性来判断。 可以根据断裂键的键能和离去基团的电负性即碱性来判断。 • 断裂键的键能越小,键就越易断裂。 断裂键的键能越小,键就越易断裂。 • 离去基团的碱性愈弱,形成的负离子愈稳定,就容易被进人基团排挤 离去基团的碱性愈弱 形成的负离子愈稳定, 形成的负离子愈稳定 而离去。这样的基团就是一个好的离去基团 而离去。
进行SN1反应时,底物按下列方式进行解离
这个过程是可逆的, 这个过程是可逆的,反向过程称为返回 (1)称紧密离子对 称紧密离子对(close ion-pair),它的反向过程即重新结合成原来的物 称紧密离子对 , 质称内返 (ii)称溶剂分离子对 中间有溶剂分子渗人扩大了正、负离子间的距离 它 称溶剂分离子对.中间有溶剂分子渗人扩大了正 称溶剂分离子对 中间有溶剂分子渗人扩大了正、负离子间的距离.它 的反向过程称离子对外返. 的反向过程称离子对外返 (iii)称自由离子 称自由离子(Free ion),离子周围被溶剂分子所包围,它的反向过程称 离子周围被溶剂分子所包围, 称自由离子 离子周围被溶剂分子所包围 离子外返.离子对外返及离子外返统称为外返 离子外返 离子对外返及离子外返统称为外返
C-X的键能 的键能
kJ/mol
• C-I键最易断裂 键最易断裂,C-F键最难断裂。 键最难断裂。 键最易断裂 键最难断裂 • HX酸的酸性顺序为 酸的酸性顺序为HI>HBr>HCI>HF.所以它们的共 酸的酸性顺序为 所以它们的共 扼碱的喊性顺序为F-> Cl-> Br -> I-.也即 的碱性最弱。 也即I-的碱性最弱 扼碱的喊性顺序为 也即 的碱性最弱。 卤素负离子的离去能力都是I 卤素负离子的离去能力都是 -> B- > CI-> F-.
亲和取代反应总结

亲核取代反应总结1、反应定义:亲核取代反应(Nucleophilic Substitution Reaction)是指有机分子中与碳相连的某原子或基团被作为亲核试剂的某原子或基团取代的反应。
在反应过程中,取代基团提供形成新键的一对电子,而被取代的基团则带着旧键的一对电子离去。
2、反应意义:这类反应是有机化学中非常重要的一类反应,不论在理论研究中还是在有机合成实际中都是极其有用的一类反应。
3、反应分类:亲核取代反应的主要类型为脂肪族饱和碳上的亲核取代反应,即饱和卤代烃与亲核试剂的取代反应,较特殊结构的有苄基卤代物、烯丙基卤代物亲核反应。
其他类型还包括与酰氯、磺酸酯、磺酰卤、卤代苯等的取代反应。
从电荷类型来分,亲核取代反应只能有四种类型:(1)中性底物和负离子亲核试剂反应(2)中性底物和中性亲核试剂反应(3)正离子底物和负离子亲核试剂反(4) 正离子底物和中性亲核试剂反应亲核试剂包括有机和无机两类分子或离子:无机类亲核试剂:OH -、CN -、X -、H 2O 、NH 3等有机类亲核试剂:ROH 、RO -、PhO -、RS -、RMgX 、RCOO -等4、反应机理类型分类:(1)双分子亲核取代反应(S N 2)有两种分子参与了决定反应速率关键步骤的亲核取代反应称为双分子亲核取代反应。
反应过程中,亲核试剂从反应物离去基团的背面向与它连接的碳原子进攻,先与碳原子形成比较弱的键,同时离去基团与碳原子的键有一定程度的减弱,两者与碳原子成一条直线,碳原子上另外三个键逐渐由伞形转变成平面,这需要消耗能量,即活化能,当反应进行和达到能量最高状态即过渡态后,亲核试剂与碳原子之间的键开始形成,碳原子与离去基团之间的键断裂,碳原子上三个键由平面向另一边偏转,整个过程犹如大风将雨伞由里向外反转一样,这时就要释放能量,形成产物,S N 2反应机理一般式表示为:Nu -+ R X [Nuδ-···R···X δ- ] NuR + X -例如,溴甲烷与OH -的水解反应:(2)单分子亲核取代反应(S N 1)只有一种分子参与了决定反应速率关键步骤的亲核取代反应称为单分子亲核取代反应,反应中,反应物首先解离成碳正离子与带负电荷的离去基团,这个过程需要能量,是控制反应速率的一步,即慢的一部。
6- 脂肪族饱和碳原子上

溴甲烷水解反应的能量曲线
21
实例:卤代烃双分子亲核取代反应的反应机理(SN2)
C6H13
H Br
C6H13 H HO CH3 Br HO
C6H13 H
HO - +
H3C
+ Br CH3
有两种分子参与了决定反应速度关键步骤的亲核取代反应 称为SN2 反应
22
成环的SN2反应
Cl OO + Cl
H H 3C C H
+
乙基碳正离子 (伯,1。)
CH3 H3C C + CH3 三级丁基碳正离子 (叔,3。)
11
(CH3)3CF
SbF5
(CH3)3CSbF6
R' R C 碳正离子 R''
12
电离能
CH3 CH3CH2 CH3CHCH3 CH3CCH3 CH3 CH3 + e CH3CH2 + e H=958.1 kj mol-1 845.5 761.5 715.5
15
(-)-HOOC-CH2-CHCl-COOH (-)-氯代琥珀酸 (i) AgOH PCl3,醚 KOH (-)-HOOC-CH2-CHOH-COOH (+)-HOOC-CH2-CHOH-COOH (-)-苹果酸 PCl3 醚
(ii)】 =-2.3 【 D
。
(+)-苹果酸 (iii) D =2.3。 【 】 AgOH
25
• 第一步:叔丁基溴在溶剂中首先离解成叔丁基碳正 离子和溴负离子:
过渡态
• 碳正离子是个中间体,性质活泼,称为:活性中间体.
26
• 第二步:叔基碳正离子立即与试剂OH-或水作用生 成水解产物--叔丁醇:
第六章 脂肪族饱和碳原子上的亲核取代反应和
氰基对于一级、二级卤代烃发生亲核取代反应,但由于氰基是弱酸的共轭碱,是强碱,因此与三级卤代烃主要发生消除反应。 极纯的腈具有香味,但普通腈总夹杂有少量具有恶臭的异腈,所以也是臭味。 ④溶剂的影响 :质子性溶、偶极溶剂(非质子性溶剂) 、非极性溶剂 偶极溶剂(非质子性溶剂) :这类溶剂介电常数大于 15,偶极矩大于 8.34× 10-30C· m(或以吡啶为界) ,分子中的氢与内 原子结合牢固,不易给出质子。 偶极溶剂的结构特征是偶极负端露于分子外部,偶极正端藏于分子内部。 (右图为 DMSO,189 ℃) 非极性溶剂 :包括介电常数小于 15,偶极矩大于 0~6.67× 10-30C· m(或以吡啶为界)的溶剂,这类溶剂不给出质子,与溶质的作用力弱。 质子性,大极性溶剂对 S N1 有利,非质子性,弱极性溶剂对 S N2 有利。①因为质子溶剂中的质子,可以与反应中产生的负离子特别是氧与氮 形成的负离子通过氢键溶剂化,这样使负电荷分散,使分离子稳定,因此有利于解离反应,有利于 S N1 反应的进行。例如,用甲酸作溶剂时,有 利于反应按 S N1 机理进行。②而非质子性溶剂对于负离子很少溶剂化,亲核试剂一般可以不受非质子溶剂分子包围,因此 S N2 反应在非质子溶剂 中更有利。③因为 S N1 反应的过渡态比底物极性大,所以极性溶剂对 S N1 反应有利④而 S N2 反应的过渡态比底物电荷分散,因此过渡态的极性比 底物极性小,所以弱极性溶剂对 S N2 反应有利。
2. 碳正离子
碳正离子的稳定性次序为: 3 >2,烯丙基 >1 >CH3+。碳正离子稳定性主要考虑取代基的给电子效应和超共轭效应。 桥头碳原子由于桥的刚性结构,不易形成具有平面三角形 sp2 轨道的碳正离子,即使能形成碳正离子也非常不稳定。 3.
邢大本课后光盘-基础有机化学大纲(第三版)

此文档系网络下载请勿用于商业邢其毅(1911—2002),字孟符,汉族。
出生于天津,原籍贵州省贵阳市。
其父邢端,字蛰人,别号冕之,是贵州省清末光绪三十年(1904年)最后一位年轻的翰林,也是著名的书法家,光绪三十一年(1905年)曾留学日本。
邢其毅的青年时代,是处于国内军阀混战,列强侵略,中央政府丧权辱国、民不聊生之际。
在双亲的熏陶、教育下,不仅于文史之学有深厚之功底,并认定从事科学教育工作,特别是扎扎实实地研究基础科学,是救国的必由之路。
(一)基础有机化学教学大纲综合大学化学系使用的有机化学教学大纲第一次是于1980年在长春制订的,当时规定的教学时数为129学时(讲授120学时,机动9学时),第二次于1982年于宜昌召开的部属综合性大学理科化学系课程结构研讨会上讨论确定,总的教学时数减为108学时,并对原大纲内容作了部分调整。
经过多年的实践,我系基础有机化学的教学总时数为90学时,在2004年以前,采用的教材是邢其毅、徐瑞秋、周政、裴伟伟编写的“基础有机化学”(第二版)上、下册,该书是根据1977年教育部在武昌召开的高等学校理科化学教材会议精神编写的,第一版于1980年由高等教育出版社出版(该书曾获国家优秀教材奖)。
第二版于1993年由高等教育出版社出版(该书于1997年获国家教委科技进步二等奖)。
从2005年9月开始,将采用的教材是邢其毅、裴伟伟、徐瑞秋、裴坚、编写的“基础有机化学”(第三版)上、下册,与平行的教材相比,该书的内容十分丰富,具有一定的深度。
地位和作用基础有机化学历来是化学系的四大门基础课之一。
相对于其它三门基础课而言,有机化学发展异常迅速。
新的有机化合物不断涌现。
这些层出不穷的有机化合物不仅带动了有机学科本身的发展,也成了其它化学学科的研究对象,因此,无论从事化学哪一个领域的工作,都必须具备有机化学的基础知识。
而新的有机反应、新的有机研究领域也在不断产生,它们使有机化学的面貌日新月移,气象万千。
有机化学基础知识点整理脂肪族和环状化合物的性质

有机化学基础知识点整理脂肪族和环状化合物的性质脂肪族和环状化合物是有机化学中两个重要的类别。
它们具有不同的结构和性质,对于理解有机化学的基础知识至关重要。
本文将梳理脂肪族和环状化合物的性质,并给出相应的实例说明。
一、脂肪族化合物的性质脂肪族化合物是由碳氢键连接的碳原子链组成的化合物,是有机化学中最基本的一类化合物。
它们的性质如下:1.1 燃烧性脂肪族化合物是碳氢化合物,其主要反应是燃烧反应。
在充足的氧气条件下,脂肪族化合物能够完全燃烧生成二氧化碳和水。
例如甲烷(CH4)燃烧可表示为:CH4 + 2O2 → CO2 + 2H2O。
1.2 饱和性脂肪族化合物中,碳原子之间通过单键连接,由于氢原子数目充足,所以它们一般是饱和的化合物。
饱和脂肪烃通常是无色、无臭的,常见的有丁烷、正庚烷等。
1.3 单键活性脂肪族化合物中由于存在碳-碳单键,使得它们在外部作用下容易发生化学反应。
例如,脂肪烃可以与卤素发生加成反应,生成卤代烷。
1.4 烷基取代作用脂肪族化合物中的碳原子可以发生烷基取代反应。
当氢原子被其他基团取代时,就会形成烷基取代的化合物。
例如,甲烷经氯代反应生成氯甲烷(CH3Cl)。
二、环状化合物的性质环状化合物是由碳原子形成环状结构的化合物。
它们的性质如下:2.1 不饱和性环状化合物中的碳原子之间存在双键或三键,因此它们通常是不饱和的化合物。
常见的环状化合物有苯、环己烯等。
2.2 相对稳定性由于环状结构上的π电子共轭,环状化合物具有相对稳定性。
这种共轭稳定使得环状化合物更容易发生特定的反应,并且具有独特的性质。
例如,苯环具有高度稳定性,不易发生加成反应,而更容易发生亲电取代反应。
2.3 环张力环状化合物由于碳原子之间的合理角度约束,所以如果环的碳原子数目较多,则会出现较高的环张力,使得该环状化合物相对不稳定。
例如,环状戊烷(五元环)相对于环己烷(六元环)来说,具有较高的环张力,结构不稳定。
2.4 极性和非极性环状化合物可以是极性的或者是非极性的,具体取决于环上取代基团的种类和位置。
马式加成规则

加成反应,离子型加成反应,亲电加成反应两个或者多个分子相互作用,生成一个加成产物的反应称为加成反应。
加成反应可以是离子型的,自由基型的和协同性的。
如果是离子型的加成反应的话,离子型加成反应是化学键异裂引起的。
而离子型加成反应又可以分为亲电加成和亲核加成。
通过化学键异裂产生的带正电的原子或者基团进攻不饱和键而引起的加成反应称为亲电加成反应。
那么怎么去描述这个过程呢?一般来说,亲电加成反应可以按照“环正离子中间体机理”,“碳正离子中间体机理”,“离子对中间体机理”和“三中心过渡态机理”四种途径进行。
具体到烯烃的反应。
其中烯烃与氢卤酸加成反应的机理是碳正离子中间体机理。
马氏规则的部分解释首先需要掌握的预备知识——诱导效应(邢其毅基础有机化学中在其第六章脂肪族饱和碳原子上的亲核取代反应中,比较详细的总结了包括诱导效应,共轭效应,超共轭效应和场效应在内的电子效应。
)在有机物分子中, 由于电负性不同的取代基的影响, 使整个分子中的成键电子云向某一方向偏移的效应叫诱导效应. 诱导效应的特征是电子云偏移沿着σ键传递, 并随着碳链的增长而减弱或消失, 一般在和作用中心直接相连的碳原子中表现得最大, 相隔一个原子, 作用力就很小了. 比较各种原子或原子团的诱导效应时,常以氢原子为标准。
负的诱导效应(-I效应)吸引电子能力比氢原子强的(电负性较大)取代基(如-X、- OH、- NO2、- CN等)有吸电子的诱导效应(负诱导效应),用-I 表示,整个分子的电子云偏向取代基。
正的诱导效应(+I效应)吸引电子的能力比氢原子弱的取代基(如烷基)有给电子的诱导效应(正的诱导效应), 用+I表示, 整个分子的电子云偏离取代基。
以诱导效应来解释以丙烯加酸为例叙述如下烷基为推电子基团, 当烷基与双键碳原子连接时, 可使碳碳双键中的π电子云的分布发生变化。
由于甲基的推电子诱导效应(+I效应)使双键含氢原子较少的碳原子带微正电荷,双键含氢原子较多的碳原子则带微负电荷。
脂肪族结构

脂肪族指由脂肪组成的脂肪族化合物。
脂肪族化合物是链状烃类(开链烃类)及除芳香族化合物以外的环状烃类及其衍生物的总称。
属于脂肪族的碳环化合物又称脂环族化合物。
如:CH3CH2CH2 CH2 CH2 CH2 CH2CH3称为脂肪烃(链状烃类)。
简介
脂肪族是指结构简单,饱和度不定的直链有机化合物,也包括高分子的有机材料。
分类
脂肪族化合物[1]可分为:
类脂质:包括磷脂、脑磷脂、卵磷脂、固醇、糖脂、脂蛋白等,结构复杂。
大多数类脂是人体组织的构成部分,是一种在人体饥饿时也不会减少的组织脂肪。
脂类是构成人体组织细胞的重要组成成分。
细胞膜含有由磷脂、糖脂和固醇组成的类脂层,脑和外周神经组织都含有磷脂,固醇是体内合成固醇类激素的重要脂质,脂肪组织分布于皮下及心脏周围起着热垫和保护垫的作用,可以防止热量散失,保持体温,又可对机械撞击起缓冲作用,保护心脏和肌肉免受运动损伤,并可防止皮肤干裂、毛发脆断等。
中性脂肪:包括动物性和植物性两大类油脂。
如猪油、牛羊油、鱼肝油、奶油、鸡油、豆油、花生油等。
是在人体饥饿时即会减少储藏量的脂肪。
脂肪是脂溶性维生素的良好溶剂,可防止刺激胆汁分泌,有助于脂溶性维生素的吸收利用。
用于烹调具有可口的香味,可增加食欲,并且脂肪的消化时间较长,使人不易感到饥饿。
脂肪酸:以亚油酸对人体最为重要。
不能在体内合成,必须从食物中摄取,故称为必须脂肪酸。
必须脂肪酸能促进生长发育,增进皮肤微血管的健全,预防其脆性增加,对皮肤有保护作用,有降低血中胆固醇,减少血小板粘附性,调节脂质代谢等生理机能作用。
— 1 —。
亲电取代反应

(4)亲电取代反应electrophilic substitution reaction亲电试剂进攻分子中带有负电荷或部分负电荷的原子而发生的取代反应,称为亲电取表示(S表示取代,E代表亲电)。
在此反应中,亲电试剂是正离子或Lewis 代反应。
常用SE酸;底物R-L的C-L键发生异裂,离去基团L多数为质子或带正电荷的金属离子。
根据亲电试剂进攻的底物是脂肪族还是芳香族化合物可分脂肪族亲电取代反应和芳香族亲电取代反应。
根据亲电试剂所进攻的碳原子是饱和的还是不饱和的,又中分为饱和碳原子上的亲电取代反应和不饱和碳原子上的亲电取代反应。
例如:此反应属于脂肪族饱和碳原子上的亲电取代反应。
此反应属于芳香族不饱和碳原子上的亲电取代反应。
(5)单分子亲电取代反应unimolecular electrophilic substitution reaction 在亲电取代反应中,底和R-L的C-L键首先异裂生成R-和L+,这一步是反应速率的控制步骤,然后R-很快与亲电试剂(E+)作用生成新键而结合,反应对底物是一级而对1表示(S代表取代,E代表亲电试剂是零级,这种反应称为单分子亲电取代反应。
常用SE1机理相似,可表示如下:亲电,1代表单分子)。
其反应机理与SN按S1机理进行的反应,最常见的一类化合物是含有а-氢原子的羰基化合物。
它在E强碱作用下,首先失去质子生成碳离子,后者再与亲电试作用得到产物。
例如:由于反应生成的碳负离子中间体的转化比经亲电试剂进攻更快,故当反应中心是手性碳原子时,导致生成外消旋化产物。
但也有些反应产物的构型保持或构型反转--这类反应生成的碳负离子多为非平面构型,且能保持构型不变。
例如,反-2-溴-2-丁烯转变为反-2甲基-2-丁烯酸的反应,由于生成的乙烯型碳负离子不能反转,故主要得到构型保持的产物:反应按SE 1机理进行的另一类常见化合物是有机汞化合物,利用它经SE1可以制备Li,Na,Be,Mg,Al,Ga,Zn,Cd,Te和Sn等烃基化合物。
亲和取代反应总结

亲核取代反应总结1、反应定义:亲核取代反应(Nucleophilic Substitution Reaction)是指有机分子中与碳相连的某原子或基团被作为亲核试剂的某原子或基团取代的反应。
在反应过程中,取代基团提供形成新键的一对电子,而被取代的基团则带着旧键的一对电子离去。
2、反应意义:这类反应是有机化学中非常重要的一类反应,不论在理论研究中还是在有机合成实际中都是极其有用的一类反应。
3>反应分类:亲核取代反应的主要类型为脂肪族饱和碳上的亲核取代反应,即饱和卤代坯与亲核试剂的取代反应,较特殊结构的有节基卤代物、烯丙基卤代物亲核反应。
其他类型还包括与酰氯、磺酸酯、磺酰卤、卤代苯等的取代反应。
从电荷类型来分,亲核取代反应只能有四种类型:(1)中性底物和负离子亲核试剂反应R-I + OH「 -------- — R-OH + r-(2)中性底物和中性亲核试剂反应R-I + N(M C)3R・N 十(M C)3+V(3)正离子底物和负离子亲核试剂反RN(Me )3 + OFT —(4) 正离子底物和中性亲核试剂反应 RN(Me )3 +H 2S 一 亲核试剂包括有机和无机两类分子或离子:无机类亲核试剂:OH-、CN-、X-、出0、NH3等有机类亲核试剂:ROH 、RO 、PhO 、RS-、RMgX 、RCOO 等4、反应机理类型分类:(1) 双分子亲核取代反应(S N 2)有两种分子参与了决定反应速率关键步骤的亲核取代反应称为 双分子亲核取代反应。
反应过程中,亲核试剂从反应物离去基团的背 而向与它连接的碳原子进攻,先与碳原子形成比较弱的键,同时离去 基团与碳原子的键有一定程度的减弱,两者与碳原子成一条直线,碳 原子上另外三个键逐渐由伞形转变成平面,这需要消耗能量,即活化 能,当反应进行和达到能量最高状态即过渡态后,亲核试剂与碳原子 之间的键开始形成,碳原子与离去基团之间的键断裂,碳原子上三个 键由平而向另一边偏转,整个过程犹如大风将雨伞由里向外反转一样, 这时就要释放能量,形成产物,S N 2反应机理一般式表示为:Nu ■+ R)C-> [Nu 6 -R -X 6 卄 NuR + X"例如,澳甲烷与OH-的水解反应:R-OH + N(Me)3R-S +H 2 + N(M C )3OH' + C—Br(2)单分子亲核取代反应(S N1)只有一种分子参与了决定反应速率关键步骤的亲核取代反应称为单分子亲核取代反应,反应中,反应物首先解离成碳正离子与带负电荷的离去基团,这个过程需要能量,是控制反应速率的一步,即慢的一部。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(2) b-消除—E1反应—邻二卤代烷失卤素与E1cb反应
E1cb反应即单分子共轭碱反应;cb 表示共轭碱(conjugate base)
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
卤代烷中卤原子的电负性很强,使C-X键的电子偏向卤原子,碳上 带有部分正电荷,容易受亲核试剂的进攻,卤原子带一对电子离 开,由于反应是亲核试剂进攻带正电荷或带部分正电荷的碳原子, 因此称为亲棱取代反应(Nueleophilic Substitution reaction)
(2) b-消除—E1反应—醇的失水
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(2) b-消除—E1反应—邻二卤代烷失卤素与E1cb反应
E1cb反应即单分子共轭碱反应;cb 表示共轭碱(conjugate base)
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(2) b-消除—E1反应—邻二卤代烷失卤素与E1cb反应
CH2=CH—CH2+的p-共轭
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—手性碳原子的构型保持和翻转—Walden转换
当反应涉及到手性碳原子上的一个旧价键的断裂和新价键的形成时,如果新的 价键在旧价键断裂方向形成,则为构型保持;新价键在旧价键相反方向形成,则称之为 构型翻转轭
(1) 亲核取代—影响因素—离去基团
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—影响因素—试剂亲核性
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—影响因素—试剂亲核性
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—影响因素—试剂亲核性
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—SN2亲核取代反应机理
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—SN2亲核取代反应机理
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—成环的SN2反应
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—成环的SN2反应
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(2) b-消除—E2反应—与SN2反应的竞争
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(2) b-消除—E1反应—卤代烃失卤化氢
E1反应与E2 反应一样,遵循Zaitsev规则和立体选择性。但E1反应常常伴随着重 排反应。
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—影响因素—溶剂
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—影响因素—溶剂
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—影响因素—溶剂
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(2) b-消除—分类
当有机分子消去两个原子或基团的反应称为消除反应(elimination)。 1,1-消除或 a -消除:两个消去基团连在同一个碳原子上; 1,2-消除或 b- 消除:两个消去基团在相邻的两个碳原子上; 1,3-消除或 γ -消除:两个消去基团连在间隔一个碳原子的两个碳原子上;
在卤代烷的亲核反应中,常常伴随着消除反应中(Elimitation reaction),即在卤代烃上消去一分子卤化氢,得到烯烃
上述不仅存在卤代烃和醇的反应中,也广泛存在于其它有机物的反应中
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—电子效应
有机学中的电子效应包括诱导效应(inductive effect)、共轭效应(conjugation)、超 共轭效应(hyperconjugation)和场效应(field effect)。
(1) 亲核取代—影响因素—烷基结构
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—影响因素—烷基结构
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—影响因素—烷基结构
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—影响因素—烷基结构
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—SN2反应的立体化学
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—SN1反应的定义及机理
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—SN1反应的机理和立体化学
SN1反应的立体化学
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—SN1反应中的碳正离子重排反应
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(2) b-消除—E1反应—醇的失水
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(2) b-消除—E1反应—醇的失水
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(2) b-消除—E1反应—醇的失水
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—SN1反应中的溶剂解反应
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—Winstein离子对机理
但实际情况很多是构型转化的产物过于构型保持的产物,Winstein用离子对机理对此进 行解释,即,在SN1反应中,许多反应不是通过碳正离子进行反应,而是通过离子对进 行反应的。
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—电子效应
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—电子效应
取代基在空间产生一种电场,对空间其他地方的反应中心产生影响,这种由空间所 传递的静电作用,称为“场效应”;场效应与空间的距离平方成正比,往往跟诱导效应 或共轭效应一起存在,所不同的是诱导效应或共轭效应通过分子链或共轭体系传递,而 场效应则是由空间直接传递,与空间的距离有很大的关系。
有机分子中的原子或原子基团被亲核试剂所取代的反应称为“亲核反应(uncleophilic reaction)”。用“ SN”表示。
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—亲核取代反应的速率
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—亲核取代反应的速率
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
在手性碳原子的构型翻转是 Walden首先发现的,故称之为Walden 翻转。亲核取代反应中,构型翻转是 很普遍的现象;特定结构的反应物在 一定条件下,可以实现构型的完全反 转和构型的完全保持,大多数情况, 产物是构型翻转和构型保持的混合物。
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—亲核取代概述
(2) b-消除—E1反应—与SN1反应的竞争
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(2) b-消除—E1反应—与SN1反应的竞争
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(2) b-消除—E1反应—醇的失水
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(2) b-消除—E1反应—醇的失水
+I -I
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—电子效应
单双键交替出现的体系为共轭体。在共轭体系中,由于原子间的相互影响而使得 体系内的 电子(或 p 电子)分布发生变化的一种电子效应称为共轭效应
共轭体系的结构特点是: (1) 键长平均化;(2) 电子离域化 在共轭体系上引入的取代基能够使与之相连的碳原子上 电子云密度降低,则这基团具 有吸电子的共轭效应 (-C );反之,则为给电子的共轭效应( +C ) 共轭效应的特点: (1) 共轭效应的电子效应沿分子共轭链传递; (2) 共轭效应是一种远程效应,无论共轭体系多大,能贯穿于整个共轭体系; (3) 共轭效应使共轭体系的 电子在共轭链上呈正负电荷交替分布; (4) 是一种静态效应,即使不存在外界电场情况下
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—Winstein离子对机理
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—影响因素—烷基结构
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—影响因素—烷基结构
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—碳正离子
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—碳正离子
碳正离子的稳定性: (1) 给电子取代基有利于分散碳原子上的正电荷,使体系趋于稳定, 反之则使体系不稳定; (2) 超共轭效应使得C-H 的 电子向带正电荷碳原子上的空 p 轨道 转移,有利于分散正电荷,使体系趋于稳定; (3) 桥头碳原子由于刚性作用,不易于具有平面结构的sp2杂化的形成, 形成的碳正离子非常不稳定‘ (4) 当取代基是共轭体系,由于空 p 轨道参与共轭,使体系趋于稳定
诱导效应大小一般具有一定的规律: (1) 以氢原子为参照,取代基的吸电子能力较强的具有吸电子诱导效应( +I ),如果比较氢 原子给电子能力更强,则为给电子效应( -I )。 -F > -Cl > -Br > -I (2) 吸电子效应与元素的电负性变化基本一致; - OR > -SR -F > -OR > NR2 > CR3 (3) 取代基团不饱和度越大,+I 效应增强; (4) 带正电荷的基团有较强 +I 效应;带负电荷的基团具有较强 –I 效应;当与碳相连的原 子作为配位原子与金属配位后,其 +I 效应增强; (5) 烷基的诱导效应和超共轭效应均产生 +I 效应
