有机成环反应小汇
有机合成方法学环化反应

有机合成方法学环化反应有机合成方法学是有机化学中的重要分支,主要研究如何有效地合成有机分子,以满足人类对化学品的需求。
在有机合成中,环化反应是一类常用且重要的反应,它可以将直链分子合成为环状分子,或者在已有环状结构上进行进一步的环化。
一、环化反应的定义环化反应是将分子中的直链结构转化为环状结构的化学反应。
环化反应可以在不同的条件下进行,如加热、光照、催化剂存在等。
根据反应类型的不同,环化反应可以分为碳-碳键形成的环化反应和碳-杂原子键形成的环化反应。
二、碳-碳键形成的环化反应1. Diels-Alder 反应Diels-Alder 反应是一种重要的环化反应,它可以将二烯与烯丙基化合物通过一个环加成反应合成出环状化合物。
这个反应常用于合成大环化合物和复杂天然产物。
2. 化学诱导的双键内运动反应化学诱导的双键内运动反应是一类通过双键内的旋转、迁移和扭转等运动实现环化的反应。
这类反应可以通过光照或者催化剂的存在加速反应速度。
3. 金属催化的碳-碳键形成反应金属催化的碳-碳键形成反应是一类以金属催化剂为催化剂,通过金属与碳原子之间的配位来促进碳-碳键形成的反应。
这类反应通常能够实现选择性高、反应底物广泛的特点。
三、碳-杂原子键形成的环化反应1. 氧杂原子环化反应氧杂原子环化反应是一类以氧原子为杂原子,实现碳-氧键形成的环化反应。
这类反应多用于合成含氧杂环化合物,如环醚、环酮等。
2. 氮杂原子环化反应氮杂原子环化反应是一类以氮原子为杂原子,实现碳-氮键形成的环化反应。
这类反应常用于合成含氮杂环化合物,如吡咯、噻吩等。
3. 硫杂原子环化反应硫杂原子环化反应是一类以硫原子为杂原子,实现碳-硫键形成的环化反应。
这类反应常用于合成含硫杂环化合物,如噻吩、噻唑等。
四、环化反应在有机合成中的应用环化反应在有机合成中具有广泛的应用价值,可以用于构建复杂的有机分子骨架,合成天然产物和药物等。
比如,利用环化反应可以高效地合成多糖类抗生素链霉素;又如,通过金属催化的环化反应可以构建二氢吲哚类化合物,用于药物的合成。
有机合成 第八章 环化反应

8.2 单边环化的分子内反应
➢ 其他违反Baldwin规则的例子:
形成亚
5-endo-trig
胺鎓盐
Baldwin禁止
烯醇负离子的环化规则:扩展的Baldwin
烯醇负离子的环化规则
王鹏
8.2 单边环化的分子内反应
➢ 额外的参数:
烯醇负离子的内式:enolendo,双键在内部 烯醇负离子的外式: enolexo ,双键在外部
王鹏
8.2 单边环化的分子内反应
➢ 烯烃复分解反应:
烯烃复分解反应不仅可以用于合成新的双键化合物, 也是合成含双键环状化合物的好方法,合成大多通 过催化剂存在下的闭环复分解反应进行
反应历程:
反应以脱去 乙烯结束
王鹏
8.2 单边环化的分子内反应
催化剂:金属卡宾配合物(如钌催化剂)效果最好, 应用最广
➢ 利用阳离子中间体进行合环的环化反应 ➢ 该类环和的应用较广泛,萜类化合物和甾体的
合成中很多都是通过阳离子环化制备的 ➢ 阳离子常使用碳正离子,其容易重排生成更稳
定的化合物,因此能形成稳定的叔碳正离子及 其他稳定的正离子的产物的产率较高
80%HOAc-H2O
叔碳正离子,已经
王鹏
处于ቤተ መጻሕፍቲ ባይዱ定状态,不再重排
王鹏
8.2 单边环化的分子内反应
Baldwin规则:
➢ 受空间影响,相同条件下,有的反应可以发生
而有的则相反,可用Baldwin规则预测反应能
否发生
Baldwin规则
王鹏
8.2 单边环化的分子内反应
➢ Baldwin总结了立体和电子效应的影响,认为 大多数环化反应受三个因素的影响:
环的大小:目标环的大小 杂化方式:亲电碳原子属于哪种杂化类型? 断键方式:进攻原子进攻官能团的内侧还是外侧
精细有机合成—构成环状化合物的反应

由Knorr合成法得到的产物可水解脱羧,生成取代吡咯。许多其 他吡咯,尤其是用于卟啉合成中的吡咯,也是利用这一方法制备, 不过改变不同的取代基而已。为了方便地脱去烷氧羰基,在Knorr合 成中,用苯基和叔丁基酯取代了乙酯基。如原料中的氨苯上有烃基, 则可得到N-烃基吡咯。
α,β-不饱和羰基化合物是极活泼的亲二烯体系,并且代表了该合成方 法中最有价值的组分,其典型的例子有丙烯醛、丙烯酸及其酯、顺丁烯 二酸及其酸酐和丁炔二酸:
+ +
+
+
(2) Robinson增环反应 活泼亚甲基化合物与α,β-不饱和酮、酯、腈等起Michael反应,然后起
醇醛缩合反应称之为Robinson增环反应,常用于合成环状化合物。在合 成六元环烃,特别在甾体化合物的合成上具有重要作用。这种方法分两个 阶段进行。先起Michael加成反应,接着起分子内的羟醛缩合反应,增环 生成环己酮。一般采用催化量的碱,主要得到1,4-加成产物,采用当量碱 则主要得到环合产物.这样可以利用两步合一的反应方便地合成六元环。
二卤环丙烷用AgNO3处理,可转化为烯丙基化合物,这是用卡 宾增长碳链的另一种方法。
卡宾与杂环体系的烯键加成,形成扩环产物,这在合成上十分有用:
3.1.2 四元环衍生物 用1,3-二卤代烷对活性亚甲基化合物进行分子内烷基化,例如
在强碱存在下,丙二酸酯与1,3二溴丙烷成环,生成环丁烷衍生物。
四元环除由丙二酸酯法合成外,还可以由[2+2]环加成反应合成。[2+2] 环加成是由两个烯分子组成四元环的反应。简单的烯烃在加热时不能生成 环丁烷衍生物,丙烯腈容易二聚成顺-和反-1,2—二氰基环丁烷:
有机化学基础知识点整理环化反应和开环反应

有机化学基础知识点整理环化反应和开环反应有机化学基础知识点整理:环化反应和开环反应有机化学是研究碳元素化合物的结构、性质和转化的学科。
其中,环化反应和开环反应是有机化学中的重要概念和反应类型。
本文将对环化反应和开环反应进行整理和概述,以加深读者对有机化学基础知识的理解。
一、环化反应环化反应是指分子中的一个或多个链状结构发生内部结合,形成环状结构的化学反应。
环化反应具有广泛的应用领域,常用于有机合成、药物研发等。
在有机化学中,环化反应可以分为多个类型,下面将介绍其中几种常见的环化反应。
1. 环加成反应环加成反应是通过两个官能团的相互作用,使其发生内部结合形成环的反应。
环加成反应常见的类型包括Diels-Alder反应、1,3-环加成反应等。
其中,Diels-Alder反应是有机化学中最重要的环加成反应之一,通常由一对底物——双烯与二烯酮、烯醇等加成反应,形成六元环的产物。
2. 环新增反应环新增反应是通过在分子中引入新的原子或基团,使其发生内部结合形成环的反应。
常见的环新增反应包括环酮反应、环氧化反应等。
环新增反应在有机合成中具有重要的应用价值,可用于构建复杂的环状结构。
3. 环断裂反应环断裂反应是指环状分子中的键发生断裂,生成线性或分立的化学物质。
环断裂反应在有机合成中常常用于合成高效药物、天然产物等。
环断裂反应的典型例子包括环酯水解反应、环醇缩合反应等。
二、开环反应开环反应是指环状结构发生断裂,生成线性或分立化合物的化学反应。
开环反应是一种重要的有机转化过程,常见于天然产物的代谢以及有机化学合成中。
下面将介绍几种常见的开环反应。
1. 开环断裂反应开环断裂反应是指环状结构的键发生断裂,生成线性化合物的反应。
开环断裂反应常用于合成长链分子、有机材料等。
常见的开环断裂反应有氧化反应、酸催化反应等。
2. 开环新增反应开环新增反应是指在环状结构上引入新的原子或基团,打开环形结构的反应。
开环新增反应在有机合成中具有重要的应用,常见的反应类型包括开环酮醇互变异构反应、开环酮酯互变异构反应等。
有机成环反应

有机成环反应
(1)有机成环反应规律
①有机成环方式一种是通过加成反应、聚合反应来实现的,另一种是含有两个相同或不同官能团
的有机物分子(如多元醇、羟基酸、氨基酸)通过分子内或分子间脱去小分子水或氨等而成环。
②成环反应生成的环上含有5个或6个碳原子的比较稳定。
(2)有机成环反应类型
①双烯合成环。
共轭二烯烃与含有C=C的化合物能进行1,4加成反应生成六元环状化合物。
如:
②聚合反应成环。
如:
乙炔的聚合:
醛的聚合:甲醛、乙醛等容易聚合而成环状化合物。
③脱水反应成环
A:多元醇分子内脱水成环。
如:
B:多元醇分子间脱水成环。
如:
C:多元酸脱水成环:如:
④酯化反应成环。
A:多元醇与多元酸酯化反应生成环状酯。
如
B:羟基羧酸分子间脱水成环。
如C:羟基羧酸分子内酯化成环。
如:
⑤缩合反应成环。
氨基酸可以分子内缩合生成内酰胺,也可分子间缩合生成交酰胺。
分子内缩合。
如:
分子间缩合:如:
⑥烷烃的环化(石油催化重整)
⑦烯烃的氧化成环。
如
⑧醛的低聚合成环。
如
⑨卤代烃在钠作用下成环。
有机反应-成环反应(精选)54页文档

▪
27、只有把抱怨环境的心情,化为上进的力量,才是成功的保证。——罗曼·罗兰
▪
28、知之者不如好之者,好之者不如乐之者。——孔子
▪
29、勇猛、大胆和坚定的决心能够抵得上武器的精良。——达·芬奇
▪
30、意志是一个强壮的盲人,倚靠在明眼的跛子肩上。—Байду номын сангаас叔本华
谢谢!
54
16、云无心以出岫,鸟倦飞而知还。 17、童孺纵行歌,斑白欢游诣。 18、福不虚至,祸不易来。 19、久在樊笼里,复得返自然。 20、羁鸟恋旧林,池鱼思故渊。
有机反应-成环反应(精选)
▪
26、要使整个人生都过得舒适、愉快,这是不可能的,因为人类必须具备一种能应付逆境的态度。——卢梭
精细有机合成构成环状化合物的反应
卡宾与杂环体系的烯键加成,形成扩环产物,这在合成上十分有用:
3.1.2 四元环衍生物 用1,3-二卤代烷对活性亚甲基化合物进行分子内烷基化,例如
在强碱存在下,丙二酸酯与1,3二溴丙烷成环,生成环丁烷衍生物。
四元环除由丙二酸酯法合成外,还可以由[2+2]环加成反应合成。[2+2] 环加成是由两个烯分子组成四元环的反应。简单的烯烃在加热时不能生成 环丁烷衍生物,丙烯腈容易二聚成顺-和反-1,2—二氰基环丁烷:
O
O
3.2 杂环化合物的合成
3.2.1 五元杂环化台物合成 呋喃很容易由糠醛去羰基制得。糠醛可用农副产品稻糠、玉米
芯等以热酸处理得到。
1) 2) 3)
4) 5)
克诺尔(Knorr)合成法是合成吡咯环的重要方法,也是应用最广的 方法,原理是用一个α- 氨基酮与一个含活性亚甲基化台物缩合而得到 吡咯环。例如:
由l,3-二羰基化合物与肼或羟胺反应,可以合成吡唑和异噁唑环 等1,2-唑:
1,3-唑可用在链中带钉杂原于的l,3-二羰基化合物在合适条件下脱 水环化得到:
1,2-二羰基化合物如邻二酮是合成咪唑、噁唑环的重要原料。例如: α-卤代醛酮是合成1,3-唑最重要的原料:
3.2.2 六元杂环化合物合成
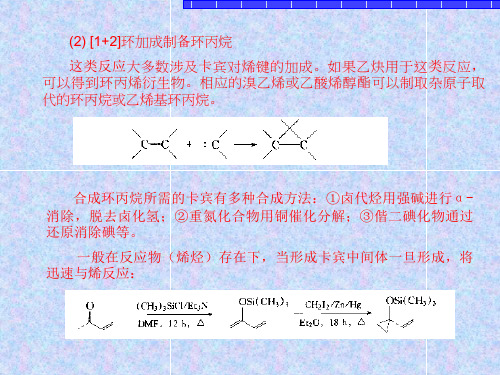
一般在反应物(烯烃)存在下,当形成卡宾中间体一旦形成,将 迅速与烯反应:
由于环丙烷衍生物作为合成中问体具有独到之处,这种碳环具 有类似烯烃的性质,所以它在合成中的重要性还在不断增加。环丙 烷还可以发生氢解开环,在环上催化剂最容易接近的键和共扼取代 基活化得最厉害的键,在反应过程中选择性优先断裂。这种反应作 为c=c双键的氢化甲基化在合成上是相当有用的,双键经卡宾化物 的加成,然后氢化开环而发生氢化甲基化,在双键碳上引入了一个 甲基:
有机反应成环反应

O COOC2H5
Dieckman RXN
O
O
C2H5OOC
NaH
O 1,4
茚二酮的制备
COOC2H5 + CH3COOC2H5
COOC2H5
O H
H O
(2)四元环扩环 通过重氮盐的重排
C6H5
C H
CH2
Zn/Cu + Cl2C C O
O
CH2 N N Cl
C6l +
Cl
反应类型: 烯烃复分解反应包括: 开环复分解聚合(ROMP,用于合成聚合物);
闭环复分解反应(RCM,用于成环);
开环复分解反应(ROM,用于合成链状烯烃)
交叉复分解反应(用于合成链状烯烃
前三种反应容易进行,后一种变化的关键是避 免两种原料烯烃的自身解反应。最近的发展已 使之可以选择性地进行,成为有合成价值的反 应。
+ COOMe
COOMe
桥环化合物以内型为主
+ COOMe 25oC
+ H
COOMe 74%
COOMe
H 26%
S-顺式
S-反式
虽然S-反式构象比S-顺式稳定,但在进行反应 时,S -反式需转变成S-顺式才能进行反应。如果 S-顺式不能形成,则反应不能进行。这就说明了 为什么下列二烯(I)和(II)在D-A反应中不能 作为二烯进行反应,而(III)则可进行反应。
单边环化:
1.阴离子环化 最常用的成环的方法:分子内的亲核反应: 取代;缩合
2.阳离子环化:分子内的亲电反应。 3.自由基的环化:酯偶联反应 4.有机金属化合物催化的环化反应
(1)钯催化的环化反应
过渡金属催化的环化反应是一类应用前景广阔的环 化反应,钯、锆、钴、铑、钉、银、汞等过渡金属 配合物均可催化这类环化。因为许多分子间反应可 发展成为分子内反应,从而用于环的合成。 最常见的反应是钯催化的分子内Heck反应
最新有机成环.doc

一·Combes 喹啉合成法Combes合成法是合成喹啉的另一种方法,是用芳胺与1,3-二羰基化合物反应,首先得到高产率的β-氨基烯酮,然后在浓硫酸作用下,羰基氧质子化后的羰基碳原子向氨基邻位的苯环碳原子进行亲电进攻,关环后,再脱水得到喹啉。
反应机理在氨基的间位有强的邻、对位定位基团存在时,关环反应容易发生;但当强邻、对位定位基团存在于氨基的对位时,则不易发生关环反应。
反应实例Elbs反应羰基的邻位有甲基或亚甲基的二芳基酮,加热时发生环化脱氢作用,生成蒽的衍生物:由于这个反应通常是在回流温度或高达400-450 °C的温度范围内进行,不用催化剂和溶剂,直到反应物没有水放出为止,在这样的高温条件下,一部分原料和产物发生碳化,部分原料酮被释放出的水所裂解,烃基发生消除或降解以及分子重排等副反应,致使产率不高。
反应机理本反应的机理尚不清楚。
反应实例Hantzsch 合成法两分子b-羰基酸酯和一分子醛及一分子氨发生缩合反应,得到二氢吡啶衍生物,再用氧化剂氧化得到吡啶衍生物。
这是一个很普遍的反应,用于合成吡啶同系物。
反应机理反应过程可能是一分子b-羰基酸酯和醛反应,另一分子b-羰基酸酯和氨反应生成b-氨基烯酸酯,所生成的这两个化合物再发生Micheal加成反应,然后失水关环生成二氢吡啶衍生物,它很溶液脱氢而芳构化,例如用亚硝酸或铁氰化钾氧化得到吡啶衍生物:反应实例Paal-Knorr 反应1,4-二羰基化合物在无水的酸性条件下脱水,生成呋喃及其衍生物。
1,4-二羰基化合物与氨或硫化物反应,可得吡咯、噻吩及其衍生物。
反应机理反应实例Pschorr 反应重氮盐在碱性条件下发生分子内的偶联反应:反应机理一般认为,本反应是通过自由基进行的,在反应时,原料的两个苯环必须在双键的同一侧,并在同一个平面上。
反应实例Robinson 缩环反应含活泼亚甲基的环酮与a,b-不饱和羰基化合物在碱存在下反应,形成一个二并六员环的环系:反应机理本反应分为两步,第一步是Micheal加成反应,第二步是羟醛缩合反应。
有机合成环化反应(与“反应”相关文档共47张)

➢ 阳离子环化、阴离子环化、自由基环化、金属 有机催化下的环化和卡宾插入
王鹏
第3页,共47页。
8.2 单边环化的分子内反应
阴离子环化原理:
➢ 阴离子环化主要是指环化反应中涉及阴离子中 间体的反应
➢ 该类反应包含了碳负离子和其他阴离子参与的 亲核环化反应,如酯基、氨基、羟基、巯基等 官能团的反应
王鹏
第28页,共47页。
近年来新的合成方法
这种三键的分解反应与环合反应共同作用得到 新的类似萘、蒽的结构,是合成芳香稠环的另 一好方法,比如:
王鹏
第29页,共47页。
五元环的形成
五元环是仅次于六元环的稳定环状体系,合 成时一般通过两种反应方式:
➢ 3+2环加成 ➢ 3+2分步环加成
3+2环加成也称为1, 3-偶极环加成,是通过 偶极体与烯、炔、亚胺等亲偶极体反应得到 环状结构的反应。
利2 单用边三环键化偶的合分法子合内成连反大应环)的环化反应,主要是亚胺鎓离子、酰亚胺
成环反应得到了广泛的关注,双分子反应对于六元环和五元环等稳定体系有着成熟的方法,对于四元和三元环则仅能合成部分化合物。
鎓离子、氧鎓离子的反应 2 单边环化的分子内反应
两种反应物“轨道系数”最大的位置相互作用,使加成具有区域选择性。
自由基环化近年来得到了广泛关注,许多天然产物的合成反应利用了该类反应
其他稳定的正离子的产物的产率较高 多分子成环反应及建筑块思想
Diels-Alder反应 Alder发现的,由双烯体与亲双烯体发生协同反应得到六元环状化合物的反应,也称为双烯合成 ,属环加成反应 虽非叔碳正离子,但成稳定环的要求使其不进行重排 受空间影响,相同条件下,有的反应可以发生而有的则相反,可用Baldwin规则预测反应能否发生
有机化学 成环反应

1. 研究发现,烯烃在合适催化剂作用下可双键断裂,两端基团重新组合为新的烯烃。
若CH2=C(CH3)CH2CH3与CH2=CHCH2CH3的混合物发生该类反应,则新生成的烯烃有几种()A.2种B.3种C.4种D.5种2. 描述CH3-CH=CH-C≡C-CF3分子结构的下列叙述正确的是()A.6个碳原子有可能都在一条直线上B.6个碳原子不可能在一条直线上C.6个碳原子有可能都在同一平面上D.6个碳原子不可能都在同一平面上3. 环己烯可以通过丁二烯与乙烯发生狄-阿反应得到:4.下列说法错误的是:A.一定条件下,环己烯可以发生氯代,加成反应,且能使酸性高锰酸钾褪色B. 狄-阿反应属于加成反应C 两分子的1,3-丁二烯发生环加成反应可得到D.两分子2-甲基-1,3-丁二烯发生狄-阿反应生成的不同有机物有2种5. 三位科学家因在烯烃复分解反应研究中的杰出贡献而荣获2005年度诺贝尔化学奖,烯烃复分解反应可示意如下:6.下列化合物中,经过烯烃复分解反应可以生成的是()A .B .C .D .A.6个碳原子有可能都在一条直线上B.6个碳原子不可能在一条直线上C.6个碳原子有可能都在同一平面上D.6个碳原子不可能都在同一平面上7.已知两个羟基同时连在同一碳原子上的结构是不稳定的,它会发生脱水反应:同一个碳原子连接有三个羟基,同样因为以上的原因,脱去一分子水形成羧酸:R R| |HO-C-OH → O = C -OH + H2O|OH(1)写出丙炔与HBr按1:2加成的产物(氢原子加在含氢较多的碳上也叫马氏加成规则)完全水解后产物的结构简式:________________________(2)写出三氯甲烷完全水解后的产物的结构简式已知甲醛可以发生三聚反应,生成如下结构的三聚甲醛:O(3)乙醛也能发生类似的反应,试写出三聚乙醛的结构简式:。
8.已知以下信息:①A的核磁共振氢谱表明其只有一种化学环境的氢;②③化合物F苯环上的一氯代物只有两种;④通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
《有机反应成环反应》课件

寻找新的品种合成化合物
发现新化合物和新药物的方法之一是利用多样性策略和高通量策略,对产品 进行分析和优化。
环化反应应用于材料合成的案例
纳米颗粒的合成和形貌调控中,在实现分散均匀的同时,制备具有特殊功能 的纳米材料较为广泛。
环化反应的发展趋势和研究展望
实例
对硝基苯和咪唑在氢氧化钠存在下反应,形成偶 氮酚盐后,再用盐酸进行酸化,就可得到咪唑衍 生物。
烯酮双键的环化反应
羰基烯醇反应合成环状酯
反应条件温和,对配位基、取代基宽容度大。
迈克尔加成反应
以无机碱或碱性氧化剂为催化剂,环合成多肽、天 然产物等化合物的前体。茚、噻吩的扩环反应是 Cope反应,无溶剂条件下进行。
芳香环化反应
电荷不稳定
芳香族化合物含不饱和稠环,用Br2不能发生加 成反应。可加热(或加有硝基的氧化剂)产生氮 酸盐,再加酸得到带芳香酰基的羧酸。
常用反应条件
芳香环化反应需要高温高压和催化剂(如CuCl 或FeCl3)等条件,需要严格控制反应条件。
重要性
芳香环化反应是有机合成中最常用的方法之一, 可以制备出众多重要的芳香族化合物,如间苯二 酚、对苯二酚等。
Biox-PS合成法
这种方法使用无菌条件合成七元环,其光学纯度比合成得到的大多数天然生物英类似化合物 高。
化学合成中产生的戊二酸、合成色环以及 生物活性天然产物的有机合成
二羧酐通过Gille口反应合成色环
该方法可以合成多种罕见色环物质,具有高效、高 选择性和环境友好等特点。
动态制备戊二酸
这种方法是通过一套催化剂体系实现的,其中涉 及一些普遍具有环境友好性和广泛应用的配体和 前驱体。
亲核反应法
包括环全加成和带薪的环开放反应。方法优点是 反应条件温和,易于量规控制。
有机化学中的环化反应与环化反应机理

有机化学中的环化反应与环化反应机理在有机化学中,环化反应是指将直链烷烃或非环化合物转化为环状化合物的化学反应过程。
环化反应的机理涉及分子内的化学键的重新排列以及原子的重组。
环化反应是有机合成中常用的重要转化方式,具有广泛的应用价值。
一、环化反应的分类环化反应可以根据反应的条件和产物的结构分类。
根据反应条件,环化反应可以分为热环化反应和光环化反应。
热环化反应是在高温条件下进行的,例如Fischer环化反应和Smiles重排反应。
光环化反应是利用光作为能量引发的反应,例如凯拉尔环化反应和光加成环化反应。
根据产物的结构,环化反应可以分为环状化合物的形成和杂环化合物的形成。
环状化合物的形成是指将非环状分子转化为环状分子,例如五元环化反应、六元环化反应等。
杂环化合物的形成是指在环化反应中引入异原子,例如噻唑化合物的合成、噻吩化合物的合成等。
二、环化反应的常见机理1. 离子型环化反应机理离子型环化反应是指环化反应过程中涉及离子中间体的反应。
例如当有机溴化物与氢氧化钠反应时,生成的醇通过环化反应得到环状醚。
该反应具有SN2机理,首先发生的是溴离子与氧负离子的亲核取代反应,然后形成环状结构。
2. 自由基环化反应机理自由基环化反应是指环化反应过程中涉及自由基中间体的反应。
例如当烷基溴与过量的氨基中的氢气发生反应时,生成的胺通过自由基链反应发生环化反应,得到环状化合物。
该反应具有自由基亲核取代机理。
3. 亲核加成环化反应机理亲核加成环化反应是指通过亲核试剂与底物之间的反应发生环化形成环状产物。
例如当巯基与醛反应时,巯基亲核攻击醛中电子不足的碳原子,形成五元环噻唑类化合物。
该反应具有亲核加成环化机理。
三、环化反应的应用1. 有机合成中的环状化合物合成环状化合物具有独特的结构和性质,广泛应用于有机化学和药物化学领域。
环化反应为合成环状化合物提供了有效的方法,例如通过环化反应合成噻唑、噻吩、吡咯等杂环化合物。
2. 医药领域的药物设计环化反应在药物设计中起着重要的作用。
09第四章成环反应

一些常见的分子内环化反应: (1)烷基化反应 (2)酰基化反应 (3)缩合反应 (4)芳香族化合物亲电取代反应
化学与材料科学学院
对于三元环、四元环有张力的小环,用分子内碳负离子 烷基化反应或用γ —消除、δ —消除的方法较有用。此外三 元环还可通过碳烯对双键的加成,四元环可通过丙二酸二乙 酯来合成。 对于五元环、六元环有张力的环,常用傅克反应、羟 醛缩合、酯缩合、狄克曼反应、双烯合成等方法,麦克尔反 应与羟醛缩合结合起来是向六元环上并联另一个六元环的方 法,叫缩环反应。
CH2 CH CH
ClOOC
O
化学与材料科学学院
环丙烷类:
CH3 CH3 C Cl Cl CH3 CH3 Cl Cl CHCl3 NaOH C Cl2 Cl C Cl Cl
CH3 CH3
CH2
CH3 CH3
:CH2 为碳烯中间体
CH2I2 Cu Zn CH2
:CCl2为卤代碳烯中间体。
R1 C=C R2 CH2OH R3 CH2I2 Cu Zn R1 R2 CH2OH R3
双烯体种类: 脂肪族链状共轭双烯化合物:丁二烯 脂肪族环状共轭双烯化合物:环戊二烯 芳香族化合物:蒽 杂环化合物:呋喃 化学与材料科学学院
亲双烯体种类:
CH2=CH—、ArCH=CH—、—CH=CH—、—C≡C— —CHO、—COOH、—COOC2H5、—CN、—X、—H
+
CH2
Cl
CH2Cl
化学与材料科学学院
EtOOC EtOOC
O CH3CCH3 OH OH H
O EtOOC EtOOC O O OH CH3 H2O CH3 H2O O O O O CH3 CH3
高中有机化学归纳—链状有机物变成环状有机物
高中有机化学归纳—链状有机物变成环状有机物
能不能根据中学课本的有机化学知识,经过化学反应把链状化合物转变为环状化合物呢?有如下几种方法是可行的:
1.乙炔三聚合产生苯
2.乙醛三聚合产生三聚乙醛
3.乙烯催化氧化产生环氧乙烷
4.二元醇脱水
分子内脱水
分子间脱水
5.羟基酸酯化
γ-羟基酸分子内酯化:
α-羟基酸分子间脱水酯化:
6.二元醇与二元酸酯化
7.氨基酸脱水
分子内脱水
分子间脱水
在以上成环的各反应中,乙炔、乙烯、二元醇、二元羧酸、氨基酸等都属于重要的代表物,羟基酸则属于多官能团化合物,是羟基和羧基知识的综合应用。
各反应的类型属于加成、氧化、脱水、酯化等基本反应类型。
根据分析可知,成环反应的一般规律为:分子中含碳碳不饱和键或含双官能团的有机物在一定条件下可形成环状化合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H2SO 4 2CH3 CH COOH v
OH
CH 2
CH 2 O + 2H2 O
CH 2
O
CH2 CH2 1. 3HCHO y
OO
CH 2
C H 2Br
CH 2
2. CH2
+ 2Na y CH2 CH2 + 2N aBr
C H 2Br
m 61 m
催化剂 4CH CH v 、加压
4. 双烯的聚合( diels- Alder 反应)
CH 2
CH 2
CH
CH2 催化剂 CH CH2
+
CH
CH 2
CH CH2
O
CO
CH3 CH
CH CH3 + H2O
OC
O
O
O
C C
OH +
OH
HO CH2 HO CH2
H 2S O4 v
O O
C C
CH 2 + 2H2O
一、烷、烯、炔烃的成环 1. 烷烃的环化( 石油催化重整)
CH 3
催化剂 CH3( CH2) 5CH3
+ H2
2. 烯烃的氧化
Ag 2CH2 CH2 + O2 200 e ~ 300 e
2CH2 CH2 O
O
催化剂
RCH CHRc + O2
RCH CHRc
3. 炔烃的聚合
OO
催化剂 3CH CH
500 e
CHБайду номын сангаас2
O
O
3. 羧基 ) 羧基缩合成环
O
C OH C OH
催化剂
O
4. 羧基 ) 氨基缩合成环
O C
O + H2O C
O
NH2
2CH3 CH CO OH y O
H NC
CH3 CH
CH CH3 + 2H2O
C NH
O 三、其他成环
CH 2 二、烃的衍生物的缩合成环 1. 羟基 ) 羟基缩合成环
CH 2 催化剂 2HOCH2CH2 OH v O
2001 年第 1~ 2 合期
中学化学教学参考
总第 209~ 210 期
有机成环反应小汇
江苏省滨海中学 薛兆建
文章编号: 1002- 2201( 2001) 01~ 02-0061- 01
中图分类号: O621. 25
文献标识码: E
在很多测试及高考 的试题 中, 常 涉及到 有机 成环 反应。这些反应在 有机合 成、信息给 予等题 型中 往往 起着关键的作用。现将常见的有机成环反应类型小汇 于下。
