【CN109836386A】瑞舒伐他汀钙的合成工艺【专利】
瑞舒伐他汀钙的合成方法[发明专利]
![瑞舒伐他汀钙的合成方法[发明专利]](https://img.taocdn.com/s3/m/63a5232e6137ee06eef91897.png)
专利名称:瑞舒伐他汀钙的合成方法专利类型:发明专利
发明人:黄庆云,吴俊
申请号:CN200510038203.0
申请日:20050119
公开号:CN1807418A
公开日:
20060726
专利内容由知识产权出版社提供
摘要:一种他汀类降血脂药瑞舒伐他汀钙的合成方法,以4-(4-氟苯基)-6-异丙基-2-(N-甲基-N-甲磺酰胺基)嘧啶-5-甲醛为起始原料,首先将其甲醛基腈基化、再醛基化后扩侧链,将侧链上酮基还原后得到中间体IV取代嘧啶-5-二羟基庚烯酸乙酯,最后将乙酯基转化为钙盐即瑞舒伐他汀钙。
本方法合成路线短,各步反应不需用毒性大的原料,也不需要复杂的分离设备,而且各步中间体大都为固体,易纯化,产品纯度好,光学纯度ee>99%,收率高,五步收率达56.8%。
申请人:安徽省庆云医药化工有限公司
地址:231131 安徽省合肥市双凤大道中市工业区
国籍:CN
代理机构:安徽省合肥新安专利代理有限责任公司
代理人:吴启运
更多信息请下载全文后查看。
一种含瑞舒伐他汀钙的片剂及其制备工艺[发明专利]
![一种含瑞舒伐他汀钙的片剂及其制备工艺[发明专利]](https://img.taocdn.com/s3/m/fd568d40f342336c1eb91a37f111f18583d00ce3.png)
(10)申请公布号 CN 101766578 A (43)申请公布日 2010.07.07C N 101766578 A*CN101766578A*(21)申请号 201010123744.4(22)申请日 2010.02.09A61K 9/20(2006.01)A61K 31/505(2006.01)A61K 47/38(2006.01)A61K 47/26(2006.01)A61P 3/06(2006.01)(71)申请人鲁南贝特制药有限公司地址276005山东省临沂市红旗路209号(72)发明人赵志全 王洪臣(54)发明名称一种含瑞舒伐他汀钙的片剂及其制备工艺(57)摘要本发明属医药领域,具体涉及一种瑞舒伐他汀钙的片剂及其制备工艺。
本发明的瑞舒伐他汀钙片选用重量比为1∶1-2.5∶1的乳糖和羟丙基环糊精作填充剂,生产过程中加入遮光剂药用氧化铁红。
本发明采用粉末直接压片法压片,制得的瑞舒伐他汀钙片具有长期贮藏稳定、崩解速度快、溶出度高、生物利用度高的特点。
(51)Int.Cl.(19)中华人民共和国国家知识产权局(12)发明专利申请权利要求书 1 页 说明书 13 页权 利 要 求 书CN 101766578 A1/1页1.一种瑞舒伐他汀钙片剂,其特征在于含有如下重量份的组分:瑞舒伐他汀钙 5~35%填充剂 50~90%交联聚乙烯吡咯烷酮 3~10%硬脂酸镁(润滑剂) 1~5%药用氧化铁红(遮光剂) 0.1%所述填充剂为可溶性和增溶性辅料,其中可溶性辅料为乳糖,增溶性辅料为羟丙基环糊精。
2.如权利要求1所述的瑞舒伐他汀钙片剂,其特征在于填充剂中乳糖和羟丙基环糊精的比例为1∶1~2.5∶1。
3.如权利要求1-2任一所述的瑞舒伐他汀钙片剂,其特征在于由如下重量份的组分组成:瑞舒伐他汀 10%乳糖 50.9%羟丙基环糊精 30%交联聚乙烯吡咯烷酮 8%硬脂酸镁 1%药用氧化铁红 0.1%。
一种含瑞舒伐他汀钙的片剂及其制备工艺技术领域[0001] 本发明属医药领域,具体涉及一种瑞舒伐他汀钙的片剂及其制备工艺,瑞舒伐他汀钙片采用粉末直接压片法压片,具有崩解快、溶出度高,生物利用度高的特点,是高效、安全的血脂调节药。
一种瑞舒伐他汀钙片及其制备方法[发明专利]
![一种瑞舒伐他汀钙片及其制备方法[发明专利]](https://img.taocdn.com/s3/m/94e56833a7c30c22590102020740be1e640ecc7c.png)
(10)申请公布号 CN 102860994 A(43)申请公布日 2013.01.09C N 102860994 A*CN102860994A*(21)申请号 201110185616.7(22)申请日 2011.07.04A61K 9/36(2006.01)A61K 9/30(2006.01)A61K 31/505(2006.01)A61P 3/06(2006.01)A61P 9/10(2006.01)(71)申请人石药集团中奇制药技术(石家庄)有限公司地址050035 河北省石家庄市黄河大道226号(72)发明人赫玉霞 白敏 杜旭召 陈素锐王蒙 吴欢欢 金晓利 刘英帝陈亚平 郝卫华(54)发明名称一种瑞舒伐他汀钙片及其制备方法(57)摘要本发明涉及一种瑞舒伐他汀钙片剂及其制备方法,所述片剂由片芯和包衣层组成,所述片芯由瑞舒伐他汀钙、乳糖、微晶纤维素、崩解剂和润滑剂组成,所述乳糖为喷雾干燥乳糖或颗粒乳糖,所述微晶纤维素为流通蒸汽干燥微晶纤维素或喷雾干燥微晶纤维素。
本发明瑞舒伐他汀钙片不需要加入稳定剂或微粉硅胶、或制备成特殊制剂,通过直接压片法,得到了稳定性良好、溶出、含量均匀性均较优的瑞舒伐他汀钙制剂,工艺简单,成本低,更适合于规模化生产。
(51)Int.Cl.权利要求书2页 说明书18页(19)中华人民共和国国家知识产权局(12)发明专利申请权利要求书 2 页 说明书 18 页1.一种瑞舒伐他汀钙片,由片芯和包衣层组成,其特征在于:所述片芯由瑞舒伐他汀钙、乳糖、微晶纤维素、崩解剂和润滑剂组成,所述乳糖为喷雾干燥乳糖或颗粒乳糖,所述微晶纤维素为流通蒸汽干燥微晶纤维素或喷雾干燥微晶纤维素。
2.如权利要求1所述的瑞舒伐他汀钙片,其特征在于:所述乳糖粒径范围为150~212μm。
3.如权利要求1所述的瑞舒伐他汀钙片,其特征在于:所述微晶纤维素粒径范围为50~250μm。
4.如权利要求3所述的瑞舒伐他汀钙片,其特征在于:所述微晶纤维素粒径范围为90~250μm。
瑞舒伐他汀钙的生产工艺与进展
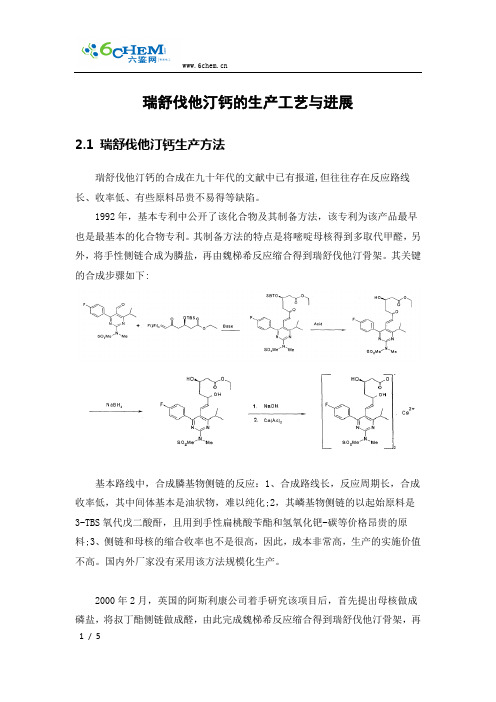
瑞舒伐他汀钙的生产工艺与进展2.1 瑞舒伐他汀钙生产方法瑞舒伐他汀钙的合成在九十年代的文献中已有报道,但往往存在反应路线长、收率低、有些原料昂贵不易得等缺陷。
1992年,基本专利中公开了该化合物及其制备方法,该专利为该产品最早也是最基本的化合物专利。
其制备方法的特点是将嘧啶母核得到多取代甲醛,另外,将手性侧链合成为膦盐,再由魏梯希反应缩合得到瑞舒伐他汀骨架。
其关键的合成步骤如下:基本路线中,合成膦基物侧链的反应:1、合成路线长,反应周期长,合成收率低,其中间体基本是油状物,难以纯化;2,其嶙基物侧链的以起始原料是3-TBS氧代戊二酸酐,且用到手性扁桃酸苄酯和氢氧化钯-碳等价格昂贵的原料;3、侧链和母核的缩合收率也不是很高,因此,成本非常高,生产的实施价值不高。
国内外厂家没有采用该方法规模化生产。
2000年2月,英国的阿斯利康公司着手研究该项目后,首先提出母核做成磷盐,将叔丁酯侧链做成醛,由此完成魏梯希反应缩合得到瑞舒伐他汀骨架,再脱保护,碱水解并转钙盐得到目标产物。
其关键的合成步骤如下:其中,叔丁酯侧链醛早在1988年,就有专利采用(R)-4-溴-3-羟基丁酸乙酯通过缩合得到含手性羟基的二羰物酯。
再用硼氢化钠和硼烷进行手性还原,然后上丙酮叉保护,再将卤素基团(氯或溴)乙酰化,再将乙酰基水解得到侧链醇,最后由DMSO经草酰氯氧化得到叔丁酯侧链醛,再连接母核,其合成步骤如下:在该路线方法中,侧链的方法已经得到了改良,中间体也出现了几步固体化合物。
但是,该方法采用(R)-4-溴-3-羟基丁酸乙酯作为起始原料,该原料不易制备,且起始成本较高,另外,碳链延长的缩合反应采用α-锂代-乙酸叔丁酯作为原料,该原料采用深度冷冻,在设备上也有非常高的要求,制备价格较高;另外,卤素溴转化成乙酰氧基团时,收率非常低;更重要的是,在母核配体的选择上,采用了二苯基乙氧膦,由于该配体的母核活性低,导致缩合反应收率降低,最终生产成本比较高。
瑞舒伐他汀钙片的制备与质量考察评价

瑞舒伐他汀钙片的制备与质量考察评价刘建军【摘要】制备瑞舒伐他汀钙片,用HPLC建立溶出度测定方法,考察样品质量稳定性及不同pH条件下的溶出度,并与原研药进行对比评价.经处方筛选,利用直压法制备瑞舒伐他汀钙片,采用高效液相色谱法检测溶出度,计算相似因子,同时绘制三维曲面图,对比自制样品与原研药的溶出特性.自制的三批样品,在不同溶出介质中的相似因子均在50以上.自制片剂与原研药体外溶出相似,自制产品质量稳定,接近原研药水平.%Rosuvastatin calcium tablets were prepared, and a HPLC method for the dissolution determination was established.The sample quality stability and the release of different pH conditions were investigated and compared with the original product to evaluate its performance.Direct compression technique was used to prepare rosuvastatin calcium tablets after the prescription screening.HPLC was used for testing the releasing, and the similarity factor method was applied for its comparison, simultaneously, drawing three-dimensional releasing spectrogram to compare the dissolution characteristics of the self-made samples and the original drugs.The similarity factor between the self-made tablet and the original product was above 50%.It was relevant between the two tablets in vitro dissolution.The self-made rosuvastatin calcium tablets were stable in quality, close to the level of the original drugs.【期刊名称】《哈尔滨商业大学学报(自然科学版)》【年(卷),期】2017(033)004【总页数】4页(P399-402)【关键词】瑞舒伐他汀钙片;溶出度;三维释放曲线;相似因子法【作者】刘建军【作者单位】哈药集团三精制药有限公司研发中心,哈尔滨 150069【正文语种】中文【中图分类】R943瑞舒伐他汀钙是阿斯利康公司于2002年在欧洲获得上市批准的最新他汀类药物,是媒体评价的“超级他汀”,并已于2003年8月在美国获得批准上市.本品具有强力的HMG-CoA还原酶抑制活性,并具肝细胞作用选择性,半衰期约20 h,每天服1次即可.本品降低LDL-C,增加HDL-C的作用优于已上市的其他各他汀类药物,瑞舒伐他汀10 mg即可降低LDL-C达46%,这一结果相当于40 mg阿托伐他汀、80 mg辛伐他汀所达到的疗效.目前,国产品种与进口品种市场份额相差较大,主要原因是国产品种在质量上还未达到进口水平,临床医生用药倾向于进口产品.因此,有必要对产品进行工艺改进,使产品质量达到原研药水平.Agilent1100 高效液相色谱仪(安捷伦科技有限公司),RC806溶出试验仪(天大天发科技有限公司),XS205十万分之一天平(梅特勒-托利多国际股份有限公司),瑞舒伐他汀钙对照品(批号:101028-201202,中国食品药品检定研究院),瑞舒伐他汀钙原料药(批号:DK65-1206081,厂家:上虞京新药业有限公司),乳糖(广州市天润药业有限公司),磷酸三钙、微晶纤维素、交联聚维酮(山西百威昂药业有限公司),羟丙甲纤维素、欧巴代(上海卡乐康包衣技术有限公司),淀粉、羟丙纤维素、硬脂酸镁(安徽山河药用辅料有限公司),磷酸、乙腈、磷酸二氢钾(天津市科密欧化学试剂有限公司,分析纯),盐酸(哈尔滨试剂化工厂,分析纯).2.1 溶出度测定2.1.1 测定方法的选择由于瑞舒伐他汀钙溶解度极低:在25 ℃水中,溶解度为41mg/L,在乙醇、甲醇及0.1 mol/L盐酸中也几乎不溶;而且其遇光及在酸中不稳定,容易降解[1-2],因此拟定以水为溶出介质,参考进口注册标准的色谱条件,检测方法如下:色谱条件及系统适用性:十八烷基硅烷键和硅胶为填充剂,水-乙腈-磷酸(600∶400∶1)为流动相.流速1.0 mL/min;检测波长为242 nm,柱温为室温.瑞舒伐他汀峰的拖尾因子不得过1.5.溶出度检查方法:避光操作,取本品,照溶出度测定法(《中国药典》2015年版四部通则0931第二法[3]),以水900 mL为溶剂,转速50 r/min,依法操作,经30 min时,取溶液10 mL,用0.45 μm滤膜滤过,取续滤液作为供试品溶液;另取瑞舒伐他汀钙对照品适量,精密称定,置100 mL量瓶中,加20 mL乙腈超声使溶解,用水稀释至刻度,摇匀,精密吸取5 mL,置50 mL量瓶中,加水稀释至刻度,摇匀,作为对照品溶液.分别量取供试品溶液和对照品溶液各10 μL,注入高效液相色谱仪,记录色谱图,按外标法以峰面积计算每片的溶出量.2.1.2 方法学研究专属性:采用溶出度测定的HPLC方法,对瑞舒伐他汀钙对照品溶液(10 μg/mL)、片剂供试品溶液及空白辅料溶液进行测定,考察空白辅料对本品的溶出度测定是否有干扰.结果显示,对照溶液及供试品溶液出峰时间均为15.4 min,空白辅料在出峰处没有色谱峰出现,对样品测定没有干扰.线性试验:避光操作,精密称取瑞舒伐他汀钙对照品10.0 mg,置于100 mL量瓶中,加入乙腈适量,超声震荡10 min,加水稀释至刻度,摇匀,即得0.1mg/mL的储备液.分别精密吸取储备液1、2、3、4、5、6 mL置25 mL量瓶中,加水稀释至刻度,摇匀,配成质量浓度为4、8、12、16、20、24 μg/mL的溶液,照本品溶出度测定项下的方法,精密量取上述溶液各10 μL,分别注入高效液相色谱仪,记录色谱图,以质量浓度为横坐标,峰面积为纵坐标,作线性回归,考察线性关系.结果表明:瑞舒伐他汀钙在4.0~24.0 μg/mL质量浓度范围内线性关系良好,线性方程为y=0.024 87x-0.000 06,r=0.999 95.溶液稳定性试验:避光操作,按溶出度检测方法,取瑞舒伐他汀钙片供试品溶液,在室温下放置0.5、1、2、3 h,分别进样测定含量.结果表明:本品水溶液在3 h内稳定性良好, RSD值为1.2%,证明样品溶液在3 h内稳定,可用于溶出度测定.回收率及精密度:避光操作,精密称取瑞舒伐他汀钙对照品各约5、8、10 mg(大约为标示量的50%、80%、100%),每样3份,分置100 mL量瓶中,再按处方量加入相应量的辅料,加入乙腈适量,超声震荡10 min,加水稀释至刻度,摇匀,过滤,精密吸取续滤液1 mL,置10 mL量瓶中,加水稀释至刻度,摇匀,作为供试品溶液.另取瑞舒伐他汀钙对照品10 mg,精密称定,置100 mL量瓶中,加乙腈适量,超声10 min,加水稀释至刻度,摇匀,精密吸取1 mL,置10 mL量瓶中,加水稀释至刻度,摇匀,作为对照品溶液.分别取供试品溶液和对照品溶液各10 μL,照高效液相色谱法(《中国药典》2015年版四部通则0512)测定含量,计算出每个样品的回收率,结果见表1.以水为溶出介质,相当于标示量50%、80%和100%的回收率均较高,精密度亦符合规定,平均为99.3%,RSD=0.47%.2.2 处方筛选处方1为参考原研药品英文说明书的辅料种类制定的初始处方,处方2~处方5为参照国内文献[2, 4]调整辅料后的处方,采用直接压片工艺,进行处方筛选.从表2可以看出,处方2和处方4添加的少量羟丙甲纤维素对产品的崩解时限没有影响;而添加了国产辅料淀粉及羟丙纤维素的处方3、4、5,片剂硬度较低,可能为原辅料间的结合力较差所致.依据以上筛选实验结果,经过进一步实验,通过对崩解剂比例、粘合剂比例的筛选,最终制定处方工艺为:按处方量分别称取瑞舒伐他汀钙10 g、乳糖92 g、磷酸三钙11 g、微晶纤维素32 g、羟丙甲纤维素3 g、交联聚维酮1.5 g、硬脂酸镁1.5 g,按等量递增法混合均匀,Φ7浅凹冲压片,采用欧巴代®遮光包衣粉包衣,即得.3.1 制备工艺总结从表3可以看出,按所研究的处方工艺制备的三批样品,工艺稳定,批间质量均一.3.2 溶出特性总结按照国家局发布的“普通口服固体制剂溶出度试验技术指导原则[5]”,对所制备的样品进行了初步的溶出试验,分别取自制样品和原研药“可定”,以pH=1.0盐酸溶液、pH=4.0醋酸盐缓冲液、pH=6.65磷酸盐缓冲液和水为溶出介质,按溶出度测定方法测定药品在不同时间的溶出度.利用Matlab软件通过距离差值演算法绘制得到pH-时间-累积溶出度的三维图像.见图1.从图1三维溶出对比图可以直观的观察出:自制样品与原研药在不同pH溶出介质中的释放趋势相同,但是自制样品的溶出度受pH的影响较小,溶出更均一彻底.3.3 相似因子采用美国FDA推荐的相似因子法[6-7]对检测数据进行分析,从图2可知:在四种溶出介质中,自制样品与原研制剂对比的f2值均大于50,可以认为两制剂的体外释药行为相似.1)由于瑞舒伐他汀钙在酸性条件下易降解,因此,在不同pH条件下测得的溶出度会有较大差别,尤其在较低pH条件下,测得的药物溶出度会比水中要低.无论是原研药还是自制样品均具有此特性.2)在研制初期,对湿法制粒、干法制粒及直接压片三种不同制备方法进行了对比,发现只有直接压片工艺所制备的样品批间均一性良好,药物溶出曲线接近原研药.湿法制粒工艺所制备的样品,在前5 min时的溶出过快;而干法制粒工艺的片子硬度较低,与原研制剂的属性相差较大.3)根据NICHD和美国食品药品管理局研究归纳的BCS分类及BDDCS分类检索,瑞舒伐他汀钙属于生物药剂学分类系统中的3类即高溶解性低通透性药物.FDA发布的口服固体制剂溶出度试验技术指导原则规定:某些情况下的此类药物,其溶出度在0.1N HCl 中15 min时为85%即可保证药物的生物利用度不受溶出的限制,但是,在进行三维溶出考察时发现,只有pH≥6时,此药物才满足此要求,在较低pH下,随着药物溶解度改变及药物降解的原因,实际检出量根本达不到85%以上,蔡垠等[1]研究发现,只有把所有降解的产物全部碱中和处理并校正计算后,才能达到与水中溶出相似的情况.综上分析,为了能进一步了解药物属性,全面对比与原研药的质量差距,因此,在相同溶出条件下,分别进行了自制样品与原研药的f2因子对比.4)通过三维溶出对比曲线结果可知:原研药在缓冲盐体系中,比自制样品的溶出度要低5%~10%,可能是其所用原辅料与自制样品有所区别而导致的结果,即使是同种规格型号,国内与国外的原辅料也存在着区别差异;但是,通过对比试验证明,所制备的样品与国外原研药的溶出具有相似性,产品质量稳定、含量均一、符合各项质量标准的要求.【相关文献】[1] 蔡垠, 苗艳, 武利, 等. 瑞舒伐他汀钙片溶出度研究[J]. 中国药物警戒, 2014, 11(10): 596-600.[2] 高原, 张丽娟, 连天雁, 等. 瑞舒伐他汀钙片剂的处方工艺及稳定性[J].第二军医大学学报, 2015, 36(9): 1029-1033.[3] 国家药典委员会. 中国药典2015年版(四部)[M].北京: 中国医药科技出版社, 2015. 121-124.[4] 吴燕, 张福成, 郭双艳. 瑞舒伐他汀钙片的制备工艺研究[J].解放军药学学报, 2015, 31(6): 527-529.[5] 国家食品药品监督管理总局. 食品药品监管总[2015]第3号普通口服固体制剂溶出度试验技术指导原则[S].2015[6] 夏锦辉, 刘昌孝. 固体药物制剂的体外溶出度的统计学评价分析[J].中国药学杂志, 2000, 35(2): 130-131.[7] 刘建军,王群,李伟,等.吲达帕胺缓释片的研制及与原研药的释放评价[J].哈尔滨商业大学学报:自然科学版,2017,33(2):145-148.。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(19)中华人民共和国国家知识产权局
(12)发明专利申请
(10)申请公布号 (43)申请公布日 (21)申请号 201910190296.0
(22)申请日 2019.03.13
(71)申请人 浙江永太药业有限公司
地址 317016 浙江省台州市化学原料药基
地临海园区
(72)发明人 何匡 夏海建 王学进
(74)专利代理机构 北京精金石知识产权代理有
限公司 11470
代理人 刘先荣
(51)Int.Cl.
C07D 239/42(2006.01)
(54)发明名称
瑞舒伐他汀钙的合成工艺
(57)摘要
本发明提供了一种瑞舒伐他汀钙的合成工
艺,以联烯为原料制备双分子瑞舒伐他汀钙侧链
中间体,两分子的联烯原料与环己二酮反应形成
双分子侧链中间体,由于空间位阻原因,该中间
体在Wittig反应中不易形成顺式瑞舒伐他汀钙,
因此,有效提高了产品的光学纯度,产物中几乎
不存在顺式瑞舒伐他汀钙。
权利要求书2页 说明书7页 附图1页CN 109836386 A 2019.06.04
C N 109836386
A
1.一种瑞舒伐他汀钙的合成工艺,包括如下步骤:
1)式I化合物与1,4-环己二酮在钯催化剂、膦配体、助剂存在下反应得到式II化合物;
2)式II化合物在低温条件下经臭氧氧化得式III化合物;
3)式III化合物与式IV化合物反应生成式V化合物;
4)式V化合物水解得式VI化合物;
5)式VI化合物先在盐酸存在条件下水解(2-4小时),然后加入磷酸继续反应得式VII化合物;
6)式VII化合物水解成盐得瑞舒伐他汀钙;
反应路线如下:
其中,R 1选自烷基;R 2选自P +(Ph)3X -或PO(Ph)2,X -表示卤离子。
2.根据权利要求1的合成工艺,其特征在于:R 1选自C 1-6烷基;优选甲基、乙基、丙基、异丙基、叔丁基;最优选甲基、乙基。
3.根据权利要求1-2任一项的合成工艺,其特征在于:R 2为P +(Ph)3Br -。
4.根据权利要求1-3任一项的合成工艺,其特征在于:步骤1)所述钯催化剂选自Pd (PPh 3)4、Pd(PPh 3)2Cl 2、Pd(OAc)2或Pd(acac)2。
5.根据权利要求1-4任一项的合成工艺,其特征在于:步骤1)所述膦配体选自(S)-(-)-
权 利 要 求 书1/2页2CN 109836386 A。
