新药研发的过程 ppt课件
合集下载
药品开发PPT课件

提供完整、准确的药物研发数据和资料。
药品注册的流程与要求
确保药物的安全性和有效性。 符合国家药品标准和质量要求。
药品审批的流程与要求受理审查国家药品监管部门对注册申请进行受理审查,核实申请资料 的真实性、完整性和规范性。
技术审查
对申请资料进行技术审查,评估药物的安全性、有效性、质 量可控性等方面的数据和资料。
产品差异化
通过研发创新,提供具有独特疗效或 优势的药品,以区别于竞争对手。
价格策略
根据市场需求、竞争状况以及产品定 位,制定合理的药品价格,以吸引消 费者并保持利润。
渠道管理
选择合适的销售渠道,如医院、药店、 电商平台等,以便将药品送达目标消 费者。
药品推广的方式与技巧
广告宣传
促销活动
通过电视、广播、报纸、网络等多种媒体 进行广告宣传,提高药品的知名度和美誉 度。
根据生产需求,选择符合质量 要求的原料,并进行采购。
生产工艺设计
根据药品的理化性质和生产要 求,设计合理的生产工艺流程 。
生产过程控制
在生产过程中,对各项工艺参 数进行监控,确保符合工艺要 求。
成品检验与放行
对生产出的药品进行质量检验 ,合格后放行进入市场。
药品生产的设备与技术
01
02
03
制药设备
THANKS FOR WATCHING
感谢您的观看
在细胞水平上对候选药物进行活性 筛选,评估其对细胞功能的影响。
药物临床前研究阶段
药效学研究
药代动力学研究
毒理学研究
制剂学研究
评估药物在动物模型上 的疗效及作用机制。
研究药物的吸收、分布、 代谢和排泄过程。
评估药物的安全性及毒 性,确定最大耐受剂量。
药品注册的流程与要求
确保药物的安全性和有效性。 符合国家药品标准和质量要求。
药品审批的流程与要求受理审查国家药品监管部门对注册申请进行受理审查,核实申请资料 的真实性、完整性和规范性。
技术审查
对申请资料进行技术审查,评估药物的安全性、有效性、质 量可控性等方面的数据和资料。
产品差异化
通过研发创新,提供具有独特疗效或 优势的药品,以区别于竞争对手。
价格策略
根据市场需求、竞争状况以及产品定 位,制定合理的药品价格,以吸引消 费者并保持利润。
渠道管理
选择合适的销售渠道,如医院、药店、 电商平台等,以便将药品送达目标消 费者。
药品推广的方式与技巧
广告宣传
促销活动
通过电视、广播、报纸、网络等多种媒体 进行广告宣传,提高药品的知名度和美誉 度。
根据生产需求,选择符合质量 要求的原料,并进行采购。
生产工艺设计
根据药品的理化性质和生产要 求,设计合理的生产工艺流程 。
生产过程控制
在生产过程中,对各项工艺参 数进行监控,确保符合工艺要 求。
成品检验与放行
对生产出的药品进行质量检验 ,合格后放行进入市场。
药品生产的设备与技术
01
02
03
制药设备
THANKS FOR WATCHING
感谢您的观看
在细胞水平上对候选药物进行活性 筛选,评估其对细胞功能的影响。
药物临床前研究阶段
药效学研究
药代动力学研究
毒理学研究
制剂学研究
评估药物在动物模型上 的疗效及作用机制。
研究药物的吸收、分布、 代谢和排泄过程。
评估药物的安全性及毒 性,确定最大耐受剂量。
新药研发与设计的过程【共28张PPT】

产品,它不包括现存化合物的新型盐类、前药、代 谢物和酯类,也不包括组合产品
一.新药研发的概述
头孢菌素:从第一代发展到第四代,其抗菌范围和抗菌活性也不断扩大和增强。
• 我国共开发40多个一类新药 当今世界药品研发正逐步成为制药企业的核心竞争力
在II期临床试验期间,最终的剂型被选择和开发作III期临床使用并代表了提交FDA上市申请的处方。 各行业研发支出占销售额的比例
2006 2008F
四.国内新药研发情况
成功药物
临床试验药
动物试验药 活性物质
国际通行研发模式
*
资料来源:
中国通行研发模式
28
合成
体外活性筛选 特异性疾病动物模型筛
• 分子改造
– 头孢菌素:从第一代发展到第四代,其抗菌范围和抗菌活性也不断扩 大和增强。
1.新化合物实体的发现
新结构药物发现日趋困难
过去的10年中,有20个新的抗菌药物批准上 市, 其中结构修饰类18个,全新结构的2个
喹喏酮类:7个
结构修饰的类
β-内酰胺类:7个 大环内酯类:2个 四环类:1个
理学家、统计学家等参与共同完成。
生物学特性——药理学
• 评价化学物质的生物活性和确定药物作用 机理。
• 体外细胞培养和酶系统
– 离体动物组织试验 – 整体动物试验(啮齿动物和非啮齿动物)
生物学特性——药理学
体外筛选: ■体外细胞培养和酶系统 ■离体动物组织试验
生物学特性——毒理学1
生殖研究——包–括:急抚养性和交毒配行性为、研胚胎究早期—、早—产和单产后剂发育量、多和代影/响或和致多畸性剂。 量短期给药。给药剂量向一 定范围增加,以确定试验化合物不产生毒性的最大剂量、发生 I期临床试验期间,对于口服给药,直接应用仅含活性药物无其他药用辅料的胶囊剂。
一.新药研发的概述
头孢菌素:从第一代发展到第四代,其抗菌范围和抗菌活性也不断扩大和增强。
• 我国共开发40多个一类新药 当今世界药品研发正逐步成为制药企业的核心竞争力
在II期临床试验期间,最终的剂型被选择和开发作III期临床使用并代表了提交FDA上市申请的处方。 各行业研发支出占销售额的比例
2006 2008F
四.国内新药研发情况
成功药物
临床试验药
动物试验药 活性物质
国际通行研发模式
*
资料来源:
中国通行研发模式
28
合成
体外活性筛选 特异性疾病动物模型筛
• 分子改造
– 头孢菌素:从第一代发展到第四代,其抗菌范围和抗菌活性也不断扩 大和增强。
1.新化合物实体的发现
新结构药物发现日趋困难
过去的10年中,有20个新的抗菌药物批准上 市, 其中结构修饰类18个,全新结构的2个
喹喏酮类:7个
结构修饰的类
β-内酰胺类:7个 大环内酯类:2个 四环类:1个
理学家、统计学家等参与共同完成。
生物学特性——药理学
• 评价化学物质的生物活性和确定药物作用 机理。
• 体外细胞培养和酶系统
– 离体动物组织试验 – 整体动物试验(啮齿动物和非啮齿动物)
生物学特性——药理学
体外筛选: ■体外细胞培养和酶系统 ■离体动物组织试验
生物学特性——毒理学1
生殖研究——包–括:急抚养性和交毒配行性为、研胚胎究早期—、早—产和单产后剂发育量、多和代影/响或和致多畸性剂。 量短期给药。给药剂量向一 定范围增加,以确定试验化合物不产生毒性的最大剂量、发生 I期临床试验期间,对于口服给药,直接应用仅含活性药物无其他药用辅料的胶囊剂。
浅谈新药研发四课件

Me-too的基本(jīběn)含义是“我要模仿” me-new的基本含义是“我要新的”
浅谈新药研发(四)
me-better的基本含义(hányì)是“我要好些” 第二十二页,共四十八页。
1、新药研发(yán fā)中的me-too类创新
• me-too类创新活动
• 仿制药,也即非专利药的研发可以说是典型的me-too类创新活动
浅谈新药研发(四)
第二十三页,共四十八页。
? 一个仿制(fǎngzhì)药大国可能成为制药强国吗 我们不能成为世界制药强国(qiánɡ ɡuó)的主要问题是:
我们的企业在做太多的那些附加值低、环境污
1
染严重的低端仿制药或医药中间体
我们的企业在进行着太多的恶性竞争
2
我们还不能提供足够多的高端仿制药
3
• 主要特征:
• 关键技术突破和集成创新,即运用一些公知的、成熟的理论和技术,以及已
有的装备和材料等,去研发出“价廉质优”的已有产品
• 衡量标准:
• 制造成本 • 产品质量 • 环境友好
• 目的意义:
• 降低对进口的依赖程度
• 迫使进口产品降价 • 出口竞争国际市场
• 利用世界文明成果,做好仿制药,是世界各国解决广大(guǎngdà)老百姓看病难、看病 贵的基本途径,当今中国更是如此
• 一般而言,由于这类新药的作用靶标没有改变,其临床 风险较小,且很多新药已经确立了它们在临床中的地位, 具有较好的市场(shìchǎng)表现
• 因此,由于这类新药的公众认可度较高,其市场研发成本 也相应地较低
浅谈新药研发(四)
第二十六页,共四十八页。
新结构药物(yàowù)发现日趋困难
me-better类创新成为主流
浅谈新药研发(四)
me-better的基本含义(hányì)是“我要好些” 第二十二页,共四十八页。
1、新药研发(yán fā)中的me-too类创新
• me-too类创新活动
• 仿制药,也即非专利药的研发可以说是典型的me-too类创新活动
浅谈新药研发(四)
第二十三页,共四十八页。
? 一个仿制(fǎngzhì)药大国可能成为制药强国吗 我们不能成为世界制药强国(qiánɡ ɡuó)的主要问题是:
我们的企业在做太多的那些附加值低、环境污
1
染严重的低端仿制药或医药中间体
我们的企业在进行着太多的恶性竞争
2
我们还不能提供足够多的高端仿制药
3
• 主要特征:
• 关键技术突破和集成创新,即运用一些公知的、成熟的理论和技术,以及已
有的装备和材料等,去研发出“价廉质优”的已有产品
• 衡量标准:
• 制造成本 • 产品质量 • 环境友好
• 目的意义:
• 降低对进口的依赖程度
• 迫使进口产品降价 • 出口竞争国际市场
• 利用世界文明成果,做好仿制药,是世界各国解决广大(guǎngdà)老百姓看病难、看病 贵的基本途径,当今中国更是如此
• 一般而言,由于这类新药的作用靶标没有改变,其临床 风险较小,且很多新药已经确立了它们在临床中的地位, 具有较好的市场(shìchǎng)表现
• 因此,由于这类新药的公众认可度较高,其市场研发成本 也相应地较低
浅谈新药研发(四)
第二十六页,共四十八页。
新结构药物(yàowù)发现日趋困难
me-better类创新成为主流
新药研制与开发PPT课件

先导化合物发现途径 Nhomakorabea01
高通量筛选
虚拟筛选
02
03
组合化学
利用高通量技术从大量化合物库 中筛选出具有活性的先导化合物。
基于计算机模拟技术预测化合物 与靶点的相互作用,提高筛选效 率。
通过化学合成方法制备具有结构 多样性的化合物库,增加发现机 会。
候选药物优化策略
结构优化
01
通过化学修饰、构效关系分析等手段提高候选药物的活性及选
新药分类
中药、天然药物注册分类,化学 药品注册分类,生物制品注册分 类。
国内外新药研发现状
国内新药研发现状
近年来我国新药研发虽取得显著进展 ,但创新能力仍显不足,药品研发低 水平重复现象比较严重,存在“多、 小、散、乱”的状况。
国外新药研发现状
发达国家由于药品研发基础好、技术 先进,在新药研发领域处于领先地位 ,其研发的新药数量和质量都远高于 我国。
保密技术运用
采用加密技术、访问控制技术等手段, 确保商业秘密不被泄露。
泄密应急处理
制定泄密应急预案,及时采取补救措 施,降低损失。
市场推广策略制定
市场调研
产品定位
了解目标市场、竞争对手、客户需求等信 息,为制定推广策略提供依据。
根据产品特点和市场需求,明确产品的目 标用户和市场定位。
推广渠道选择
营销策略制定
辅料选择
选择适宜的辅料,提高制剂的稳 定性和生物利用度,同时降低不 良反应的发生。
处方优化
通过对比实验和数据分析,对制 剂处方进行优化,提高产品质量 和生产效率。
质量标准建立及稳定性考察
1 2
质量标准制定
根据药物的性质和临床需求,制定合理的质量标 准,包括鉴别、检查、含量测定等项目。
高通量筛选
虚拟筛选
02
03
组合化学
利用高通量技术从大量化合物库 中筛选出具有活性的先导化合物。
基于计算机模拟技术预测化合物 与靶点的相互作用,提高筛选效 率。
通过化学合成方法制备具有结构 多样性的化合物库,增加发现机 会。
候选药物优化策略
结构优化
01
通过化学修饰、构效关系分析等手段提高候选药物的活性及选
新药分类
中药、天然药物注册分类,化学 药品注册分类,生物制品注册分 类。
国内外新药研发现状
国内新药研发现状
近年来我国新药研发虽取得显著进展 ,但创新能力仍显不足,药品研发低 水平重复现象比较严重,存在“多、 小、散、乱”的状况。
国外新药研发现状
发达国家由于药品研发基础好、技术 先进,在新药研发领域处于领先地位 ,其研发的新药数量和质量都远高于 我国。
保密技术运用
采用加密技术、访问控制技术等手段, 确保商业秘密不被泄露。
泄密应急处理
制定泄密应急预案,及时采取补救措 施,降低损失。
市场推广策略制定
市场调研
产品定位
了解目标市场、竞争对手、客户需求等信 息,为制定推广策略提供依据。
根据产品特点和市场需求,明确产品的目 标用户和市场定位。
推广渠道选择
营销策略制定
辅料选择
选择适宜的辅料,提高制剂的稳 定性和生物利用度,同时降低不 良反应的发生。
处方优化
通过对比实验和数据分析,对制 剂处方进行优化,提高产品质量 和生产效率。
质量标准建立及稳定性考察
1 2
质量标准制定
根据药物的性质和临床需求,制定合理的质量标 准,包括鉴别、检查、含量测定等项目。
新药研发过程PPT(共 38张)

人文关怀、专注药研—黄从海博士与大家共勉
新药的分类(SFDA)
生物制品注册分类
1. 未在国内外上市销售的生物制品。 2. 单克隆抗体。 3. 基因治疗、体细胞治疗及其制品。 4. 变态反应原制品。 5. 由人的、动物的组织或者体液提取的,或者通过发酵制备的具有生物活性的多组份制品。 6. 由已上市销售生物制品组成新的复方制品。 7. 已在国外上市销售但尚未在国内上市销售的生物制品。 8. 含未经批准菌种制备的微生态制品。 9. 与已上市销售制品结构不完全相同且国内外均未上市销售的制品(包括氨基酸位点突变、缺 失,因表达系统不同而产生、消除或者改变翻译后修饰,对产物进行化学修饰等)。 10. 与已上市销售制品制备方法不同的制品(例如采用不同表达体系、宿主细胞等)。 11. 首次采用DNA重组技术制备的制品(例如以重组技术替代合成技术、生物组织提取或者发 酵技术等)。 12. 国内外尚未上市销售的由非注射途径改为注射途径给药,或者由局部用药改为全身给药的 制品。 13. 改变已上市销售制品的剂型但不改变给药途径的生物制品。 14. 改变给药途径的生物制品(不包括上述12项)。 15. 已有国家药品标准的生物制品。
人文关怀、专注药研—黄从海博士与大家共勉
新药开发的一般程序
待测样品(天然、合成或生物工程产物) 初筛
有活性
生物型(体外、体内) 无活性
化学部分
工艺路线 质量标准
药效学
临床前药理
制剂部分
一般药理学 毒理学
剂型、含量标准、 稳定性、溶出度 药动学 生物利用度
临床试验评价
Ⅰ期
Ⅱ期
Ⅲ期
Ⅳ期
人文关怀、专注药研—黄从海博士与大家共勉
人文关怀、专注药研—黄从海博士与大家共勉
新药的分类(SFDA)
生物制品注册分类
1. 未在国内外上市销售的生物制品。 2. 单克隆抗体。 3. 基因治疗、体细胞治疗及其制品。 4. 变态反应原制品。 5. 由人的、动物的组织或者体液提取的,或者通过发酵制备的具有生物活性的多组份制品。 6. 由已上市销售生物制品组成新的复方制品。 7. 已在国外上市销售但尚未在国内上市销售的生物制品。 8. 含未经批准菌种制备的微生态制品。 9. 与已上市销售制品结构不完全相同且国内外均未上市销售的制品(包括氨基酸位点突变、缺 失,因表达系统不同而产生、消除或者改变翻译后修饰,对产物进行化学修饰等)。 10. 与已上市销售制品制备方法不同的制品(例如采用不同表达体系、宿主细胞等)。 11. 首次采用DNA重组技术制备的制品(例如以重组技术替代合成技术、生物组织提取或者发 酵技术等)。 12. 国内外尚未上市销售的由非注射途径改为注射途径给药,或者由局部用药改为全身给药的 制品。 13. 改变已上市销售制品的剂型但不改变给药途径的生物制品。 14. 改变给药途径的生物制品(不包括上述12项)。 15. 已有国家药品标准的生物制品。
人文关怀、专注药研—黄从海博士与大家共勉
新药开发的一般程序
待测样品(天然、合成或生物工程产物) 初筛
有活性
生物型(体外、体内) 无活性
化学部分
工艺路线 质量标准
药效学
临床前药理
制剂部分
一般药理学 毒理学
剂型、含量标准、 稳定性、溶出度 药动学 生物利用度
临床试验评价
Ⅰ期
Ⅱ期
Ⅲ期
Ⅳ期
人文关怀、专注药研—黄从海博士与大家共勉
人文关怀、专注药研—黄从海博士与大家共勉
新药研发与设计的过程

6、上市及监测
• IV期临床研究和上市后监测
– 理解药物的作用机理和范围; – 研究药物可能的新的治疗作用;
• 说明需要补充的剂量规格 • 上市后的药物副作用(Adverse drug reaction,
ADR)报告
– 发现并在15个工作日内报告FDA
• 年度报告
三、国内外新药研发概况
新结构药物发现日趋困难
过去的10年中,有20个新的抗菌药物批 准上市, 其中结构修饰类18个,全新 结构的2个
喹喏酮类:7个
结构修饰的类
β-内酰胺类:7个 大环内酯类:2个 四环类:1个
链阳性菌素类:1个
R7
7 8
D
9 10
OH
R6'
R6
H
6
C
11
O
R5
N(CH3)2
H
5
4
3
B
A
12 2
12
1
OH
OH CONHR2
• 2.3 处方前研究
– 物化性质 – 最初的处方设计
2.2 生物学特性
• 目的: 判断一个化合物是否具有适当的安全性和足够的有效
性,使之继续成为一个有前景的新药,必须获得有关如何 吸收、在体内的整个分布、积蓄、代谢和排泄的情况以及 如作用于机体的细胞、组织和器官。 • 范围:
普通生物学家、微生物学家、分子生物学家、生物化 学家、遗传学家、药理学家、生理学家、药物动力学家、 病理学家、毒理学家、统计学家等参与共同完成。
性质和药理学。 – 药物从体内消除的比例及消除的速率和途径
2.3 处方前研究
• 物化性质 – 溶解度 – 分配系数 – 溶解速率 – 物理形态 – 稳定性
药物化学--新药的研究与开发简介 ppt课件

能写出新药开发基本途径,先导化合物、 前药、软药的定义,先导化合物发掘的基 本途径与优化的基本方法,有机药物化学 结构修饰的目的与基本方法
学习目标
能应用结构修饰的基本原理与方法解决药 物临床应用出现的问题
能解释药物结构修饰前后的不同点和对其 临床应用的意义
本章结构图
新药的研究与开发简介 先导化合物的发掘 先导化合物的优化
第一节 先导化合物的发掘
科学合理地发现或发明新药的首要过程是药物分子设 计:指通过科学的构思和科学的方法,提出具有特定药 理活性的新化学实体(new chemical entities, NCE) 或新化合物结构,即新分子实体(new molecular entilies, NME),因此先导化合物的发掘便成为现代 新药研究的出发点。
有机药物的化学结构修饰 同步测试 实训项目
药物化学研究的中心问题之一,是设计并合成 具有预期药理作用的化合物,即研制新药。其基本 思路是:在提高筛选命中率的前提下,发现活性化 合物,运用药物构效关系规律,寻求新的显效结构 或结构类型,预计和获得高效低毒的新药。研究这 些问题的内容和方法,便是新药研发的基本途径和 方法,简称新药设计(Drug Design)。
从海洋生物发现生物活性物质获得先导化合物
这是取得天然活性物质的重要途径。例如从海洋 中采集的海鞘类、贝类、海绵等的海洋无脊椎动物, 以及硅藻、蓝藻、绿藻类的海洋浮游生物,生息在海 洋里面的菌类等等都是科学家寻求生物活性物质的很 好材料。
从微生物的代谢产物中 发现生物活性物质获得先导化合物
这也是一条非常普遍和重要的发现先导化合物的途径。 自1928年弗莱明发现青霉素以来,数以千计的微生物代 谢产物被发现有生物活性物质,如洛伐他汀 (Lovastatin)是从土曲霉菌的发酵产物中分离出的一 种胆固醇生物合成抑制剂。尤其在当今的后基因组时代, 科学家能够利用微生物的基因情报对微生物进行改良, 从而能够控制微生物的发酵过程,最有效的产生出所需 要种类的发酵产物。
《新药研发与申报》课件

06
新药研发的未来展望
新药研发技术的发展趋势
基因组学和蛋白质组学技术
01
随着基因组学和蛋白质组学技术的不断进步,将有助于发现更
多潜在的药物靶点,加速新药的研发进程。
人工智能与机器学习
02
人工智能和机器学习技术在新药研发中的应用将越来越广泛,
能够提高药物筛选和预测的准确性,缩短研发周期。
免疫疗法
03
新型疫苗
针对新型传染病和肿瘤等疾病,需要研发更加安全、有效的疫苗 ,为预防和治疗提供有力支持。
国际合作与交流在推动新药研发中的作用
跨国合作
国际合作与交流有助于跨国制药企业共享资源、技术和经验,加速 新药的研发进程。
学术交流
国际学术交流活动能够促进科研人员之间的合作与知识共享,推动 新药研发领域的创新。
Ⅲ期临床试验
总结词
大规模验证
详细描述
Ⅲ期临床试验是新药研发的 最后阶段,目的是进一步验 证新药在治疗目标疾病中的
有效性和安全性。
总结词
广泛招募志愿者
详细描述
Ⅲ期临床试验通常会广泛招募患有相关疾 病的志愿者,涉及数千至数万人的规模, 以获得更可靠的数据支持。
总结词
全面评估药物效果
详细描述
Ⅲ期临床试验会对新药的疗效、安全性、 使用方法等进行全面评估,为新药的上市 申请提供支持。
通过生物学、化学和遗传学手段 ,确定潜在的药物作用靶点。
申报与审批
完成临床试验后,将药物申报资 料提交给药品监管部门进行审批 。
新药研发的挑战与机遇
挑战
新药研发成本高、周期长、成功率低,需要克服技术、法律、伦理和市场等多 方面的挑战。
机遇
随着科技的不断进步和人类对疾病认识的深入,新药研发领域也在不断涌现新 的机遇和挑战。例如基因治疗、免疫疗法等新型治疗方法的出现,为新药研发 提供了更多的可能性。
《新药研发的流程》课件

上市后监测
即使药物已经上市,监管机构仍需对其安全性和有效性进行持续 监测,以确保公众安全。
06
新药上市后监测与监管
上市后安全性监测
监测目的
评估药品在上市后的安全性,发现新的不良反应或潜在风险,保 障公众用药安全。
监测方法
通过收集药品使用后的不良事件报告、临床研究、流行病学调查等 多种方式进行监测。
药物合成工艺研究
优化药物的合成工艺,提高药物的产量和纯度。
药物稳定性研究
评估药物在不同环境下的稳定性,确保药物的有效期和储存条件。
药效学研究
药效学实验设计
根据药物的作用机制和靶点,设计药效学实验, 验证药物的疗效。
药效学评价
通过动物模型和体外实验等方法,对药物的药效 进行评价。
药效学比较研究
比较不同药物的药效,为新药的研发提供参考。
目的
新药研发的目的是为了发现和开发新的药物,以治疗疾病、改善患者生活质量 。
新药研发的重要性
满足医疗需求
随着疾病种类的不断增加和医疗技术的不断进步,对新药的 需求也不断增长。新药研发能够满足医疗需求,为患者提供 更有效、更安全的治疗手段。
推动经济发展
新药研发是一个高投入、高风险、高回报的产业,对经济发 展具有重要推动作用。同时,新药研发还能够带动相关产业 的发展,如生物技术、医疗器械等。
药代动力学研究
药物吸收、分布、代谢和排泄研究
01
了解药物在体内的吸收、分布、代谢和排泄过程,为药物的剂
型选择和给药方案提供依据。
药代动力学参数测定
02
通过实验测定药物在体内的药代动力学参数,如半衰期、清除
率等。
药代动力学模型建立
03
建立药代动力学模型,预测药物在不同个体内的表现。
即使药物已经上市,监管机构仍需对其安全性和有效性进行持续 监测,以确保公众安全。
06
新药上市后监测与监管
上市后安全性监测
监测目的
评估药品在上市后的安全性,发现新的不良反应或潜在风险,保 障公众用药安全。
监测方法
通过收集药品使用后的不良事件报告、临床研究、流行病学调查等 多种方式进行监测。
药物合成工艺研究
优化药物的合成工艺,提高药物的产量和纯度。
药物稳定性研究
评估药物在不同环境下的稳定性,确保药物的有效期和储存条件。
药效学研究
药效学实验设计
根据药物的作用机制和靶点,设计药效学实验, 验证药物的疗效。
药效学评价
通过动物模型和体外实验等方法,对药物的药效 进行评价。
药效学比较研究
比较不同药物的药效,为新药的研发提供参考。
目的
新药研发的目的是为了发现和开发新的药物,以治疗疾病、改善患者生活质量 。
新药研发的重要性
满足医疗需求
随着疾病种类的不断增加和医疗技术的不断进步,对新药的 需求也不断增长。新药研发能够满足医疗需求,为患者提供 更有效、更安全的治疗手段。
推动经济发展
新药研发是一个高投入、高风险、高回报的产业,对经济发 展具有重要推动作用。同时,新药研发还能够带动相关产业 的发展,如生物技术、医疗器械等。
药代动力学研究
药物吸收、分布、代谢和排泄研究
01
了解药物在体内的吸收、分布、代谢和排泄过程,为药物的剂
型选择和给药方案提供依据。
药代动力学参数测定
02
通过实验测定药物在体内的药代动力学参数,如半衰期、清除
率等。
药代动力学模型建立
03
建立药代动力学模型,预测药物在不同个体内的表现。
创新药研发流程ppt课件

有关物质、残留溶剂、I类重金属检测方法等。
需以附件形式提交关键研究批次(包括用于安全性研究、稳定性研究、临
床前研究等)的分析数据。
另结合原料药的相关研究信息,附件形式提交杂质质谱分析结果。
提供稳定性研究概述,列明稳定性研究的批次、批号、考察条件、(已完
成)考察时间、考察项目变化趋势以及初步结论。列明初步的包装储存条
➢ For example Ivosidenib (AG-120)
Ivosidenib (AG-120)是由Agios Pharmaceuticals研发的一款IDH1抑制剂。 拟用于治疗胆管癌和复发、难治性急性髓性白血病。目前美国FDA已经授予 Ivosidenib 孤儿药以及快速审评资格。2018年7月20正式美国上市。
列出可能与制剂性能相关的原料药的晶型、溶解度、渗透性、粒度等,理
原料药关键理化特性 化性质。
如可能,请列明不同介质(如不同的PH)中的具体溶解度数据。
项目
方法
限度
原料药质量控制
关键批次分析数据 原料药稳定性总结
2020/6/10
简述方法,如HPLC
对于涉及安全的关键项目需列出具体的检查方法和方法学验证总结,例如
对于涉及安全性以及制剂学特性的关键项目需列出具体的检查方法和方法
学验证总结,比如有关物质检查、溶出度、释放度检查等。
需以附件形式提交关键研究批次(包括用于安全性研究、稳定性研究、临
床前研究等)的分析数据。
另结合原料药的相关研究信息,附件形式提交杂质质谱分析结果。
提供稳定性研究概述,列明稳定性研究的批次、批号、考察条件、(已完
➢ IND申请
受理号
原料药受理号: 制剂受理号:
申请人 化合物名称
创新药物研发过程介绍PPT课件

结构优化
针对活性化合物的结构特点,进 行结构优化,提高化合物的药效 学和药代动力学性质。
03
临床前研究
Chapter
药理学研究
确定药物作用靶点
通过基因测序、蛋白质组学等技术手 段,确定药物作用的生物大分子靶点 。
建立药效学评价模型
剂量效应关系研究
在不同剂量下观察药物的效应,确定 最佳用药剂量范围。
已知药物组合
将两种或多种已知药物进行组合,产生新 的治疗作用或降低副作用的药物。
分类
根据创新程度不同,创新药物可分为以下 几类
已知结构类型
已知化学结构,但具有新作用机制或新适 应症的药物。
全新结构类型
具有全新化学结构、全新作用机制的药物 。
国内外创新药物研发现状
国内现状
近年来,我国创新药物研发取得显著进展,多个具 有自主知识产权的创新药物成功上市。政府加大对 创新药物研发的扶持力度,推动医药产业转型升级 。
主要关注药物的疗效、安全性、 生活质量等,同时收集药物经济 学数据。
05
生产与质量控制
Chapter
生产工艺开发与优化
工艺路线设计
01
根据药物特性,设计合理的合成或提取工艺路线,确保产品质
量和收率。
工艺参数优化
02
通过试验确定关键工艺参数,如温度、压力、时间等,提高生
产效率和产品质量。
中间体控制
稳定性试验设计
根据药物特性和剂型,设计合理的稳定性试验方案。
稳定性数据收集与分析
定期收集稳定性试验数据,对数据进行统计分析,评估产品稳定性 。
有效期确定
根据稳定性试验结果,确定药物的有效期,确保产品在有效期内质 量稳定。
06
针对活性化合物的结构特点,进 行结构优化,提高化合物的药效 学和药代动力学性质。
03
临床前研究
Chapter
药理学研究
确定药物作用靶点
通过基因测序、蛋白质组学等技术手 段,确定药物作用的生物大分子靶点 。
建立药效学评价模型
剂量效应关系研究
在不同剂量下观察药物的效应,确定 最佳用药剂量范围。
已知药物组合
将两种或多种已知药物进行组合,产生新 的治疗作用或降低副作用的药物。
分类
根据创新程度不同,创新药物可分为以下 几类
已知结构类型
已知化学结构,但具有新作用机制或新适 应症的药物。
全新结构类型
具有全新化学结构、全新作用机制的药物 。
国内外创新药物研发现状
国内现状
近年来,我国创新药物研发取得显著进展,多个具 有自主知识产权的创新药物成功上市。政府加大对 创新药物研发的扶持力度,推动医药产业转型升级 。
主要关注药物的疗效、安全性、 生活质量等,同时收集药物经济 学数据。
05
生产与质量控制
Chapter
生产工艺开发与优化
工艺路线设计
01
根据药物特性,设计合理的合成或提取工艺路线,确保产品质
量和收率。
工艺参数优化
02
通过试验确定关键工艺参数,如温度、压力、时间等,提高生
产效率和产品质量。
中间体控制
稳定性试验设计
根据药物特性和剂型,设计合理的稳定性试验方案。
稳定性数据收集与分析
定期收集稳定性试验数据,对数据进行统计分析,评估产品稳定性 。
有效期确定
根据稳定性试验结果,确定药物的有效期,确保产品在有效期内质 量稳定。
06
新药研究及开发概述PPT学习课件

药品的注册申请还包括对已有国家标准药品的 申请。
化学药品的注册分类分为六大类
31
(一)未在国内外上市销售的药品
1.通过合成或半合成的方法制得的原料药及 其制剂;
2.天然物质中提取或者通过发酵提取的新的 有效单体及其制剂;
3.用拆分或者合成等方法制得的已知药物中 的光学异构体及其制剂;
4.将已上市销售的多组分药物制备为较少组 分的药物;
5.新的复方制剂。
32
(二)改变给药途径且尚未在国 内外上市销售的制剂
33
(三)已在国外上市销售但尚未 在国内上市销售的药品
1.已在国外上市销售的原料药及其制剂; 2.已在国外上市销售的复方制剂; 3.改变给药途径并已在国外上市销售的制剂。
因此要求药物在治疗剂量范围内,不产生严重 的毒性反应,不产生或较少产生副作用。
24
(二)药物的纯度
药物有效成分的含量是反映药物纯度的重 要标志,而药物中存在的杂质直接影响到药物 的疗效和并可能导致毒副作用的产生。
25
药物的杂质(Impurity of Drugs)
指在生产、贮存过程中引进或产生的药物 以外的其它化学物质,包括由于分子手性的存 在而产生的非治疗活性的光学异构体。
11
临床前研究需解决的问题有
(1)所研究的药物有确定的药效学作用; (2)在动物中进行了药物的吸收试验且其结果
可行; (3)动物中进行的药物吸收、代谢和排泄研究
和人体中所预期的结果相似; (4)药物有较少的活性代谢物; (5)有明确的新药代谢的动力学研究; (6)三致试验和急性、亚急性、长期毒理试验,
5
新药研究与开发过程
研究计划的确立-药源-筛选-临床前研 究(I,II)-IND(investigating new drug) 申请-I期临床-II期临床-III期临床-新药申 请(NDA)- 获批,注册上市
化学药品的注册分类分为六大类
31
(一)未在国内外上市销售的药品
1.通过合成或半合成的方法制得的原料药及 其制剂;
2.天然物质中提取或者通过发酵提取的新的 有效单体及其制剂;
3.用拆分或者合成等方法制得的已知药物中 的光学异构体及其制剂;
4.将已上市销售的多组分药物制备为较少组 分的药物;
5.新的复方制剂。
32
(二)改变给药途径且尚未在国 内外上市销售的制剂
33
(三)已在国外上市销售但尚未 在国内上市销售的药品
1.已在国外上市销售的原料药及其制剂; 2.已在国外上市销售的复方制剂; 3.改变给药途径并已在国外上市销售的制剂。
因此要求药物在治疗剂量范围内,不产生严重 的毒性反应,不产生或较少产生副作用。
24
(二)药物的纯度
药物有效成分的含量是反映药物纯度的重 要标志,而药物中存在的杂质直接影响到药物 的疗效和并可能导致毒副作用的产生。
25
药物的杂质(Impurity of Drugs)
指在生产、贮存过程中引进或产生的药物 以外的其它化学物质,包括由于分子手性的存 在而产生的非治疗活性的光学异构体。
11
临床前研究需解决的问题有
(1)所研究的药物有确定的药效学作用; (2)在动物中进行了药物的吸收试验且其结果
可行; (3)动物中进行的药物吸收、代谢和排泄研究
和人体中所预期的结果相似; (4)药物有较少的活性代谢物; (5)有明确的新药代谢的动力学研究; (6)三致试验和急性、亚急性、长期毒理试验,
5
新药研究与开发过程
研究计划的确立-药源-筛选-临床前研 究(I,II)-IND(investigating new drug) 申请-I期临床-II期临床-III期临床-新药申 请(NDA)- 获批,注册上市
新药研发PPT幻灯片课件

8
从海洋生物发现生物活性物质获得先导化合物
这是取得天然活性物质的重要途径。例如从海洋 中采集的海鞘类、贝类、海绵等的海洋无脊椎动物, 以及硅藻、蓝藻、绿藻类的海洋浮游生物,生息在 海洋里面的菌类等等都是科学家寻求生物活性物质 的很好材料。
9
从微生物的代谢产物中 发现生物活性物质获得先导化合物
这也是一条非常普遍和重要的发现先导化合物的途径。自 1928年弗莱明发现青霉素以来,数以千计的微生物代谢产物 被发现有生物活性物质,如洛伐他汀(Lovastatin)是从土 曲霉菌的发酵产物中分离出的一种胆固醇生物合成抑制剂。 尤其在当今的后基因组时代,科学家能够利用微生物的基因 情报对微生物进行改良,从而能够控制微生物的发酵过程, 最有效的产生出所需要种类的发酵产物。
6
从天然活性物质中 筛选获得先导化合物
在药物发展的早期阶段,利用天然产物作为治疗手 段几乎是唯一的源泉。时至今日,甚至是药 物的重要组成部分。因所获得天然活性物质的来源不同, 又划分为三种途径:
从陆地上动植物体内提取、分离天然活性物质获得先导化 合物
02
03
04
05
06 Regulatory
concept
approval
靶点选择 Target selec
先导发现 Lead finding
临床前开发 Preclinical development
药物发明
开发
4
Discovery
Development
先导化合物
又称原型药,是指通过各种途径和方法 得到的具有独特结构且具有一定生物活性 的化合物。
13
实例分析
吲哚美辛类非甾体抗炎药的发现过程
分在析人:体炎炎症症的的重重要要介介质质55-羟色胺的功功能能被被揭揭示示后后,, 人可类以希考望虑能以以5-此羟作色为胺出作发为点先寻导找化治合疗物各,种从原因寻引找起其的拮炎抗 症物的为药出物发。点特开别发是药发物现。风而湿拮性抗关物节的炎结病构人应的尿与中5-,羟有色大胺 量相的似色,氨特酸别的是代发谢现产风物湿,性便关合节成炎了病大人量的含尿吲中哚环,的有化大合量 物的,色从氨中酸筛的选代出谢吲产哚物美,辛更(I进nd一om步et证ha实ci设n 计消拮炎痛抗)物作应为以 解含热吲镇哚痛环和化关合节物炎为治先疗导药物。,为于了是消合除成或了减大轻对量胃含肠吲道哚刺环 激的的化副合作物用,,选经择结出构吲改哚造美,辛又。开消发除了或吲减哚轻美辛吲类哚的美舒辛林的 酸副(作Su用li,nd但ac不)。能分改析变这其样活工性作,的必基须本保思留路其。基本结构, 所以开发了吲哚美辛的电子等排物舒林酸。
从海洋生物发现生物活性物质获得先导化合物
这是取得天然活性物质的重要途径。例如从海洋 中采集的海鞘类、贝类、海绵等的海洋无脊椎动物, 以及硅藻、蓝藻、绿藻类的海洋浮游生物,生息在 海洋里面的菌类等等都是科学家寻求生物活性物质 的很好材料。
9
从微生物的代谢产物中 发现生物活性物质获得先导化合物
这也是一条非常普遍和重要的发现先导化合物的途径。自 1928年弗莱明发现青霉素以来,数以千计的微生物代谢产物 被发现有生物活性物质,如洛伐他汀(Lovastatin)是从土 曲霉菌的发酵产物中分离出的一种胆固醇生物合成抑制剂。 尤其在当今的后基因组时代,科学家能够利用微生物的基因 情报对微生物进行改良,从而能够控制微生物的发酵过程, 最有效的产生出所需要种类的发酵产物。
6
从天然活性物质中 筛选获得先导化合物
在药物发展的早期阶段,利用天然产物作为治疗手 段几乎是唯一的源泉。时至今日,甚至是药 物的重要组成部分。因所获得天然活性物质的来源不同, 又划分为三种途径:
从陆地上动植物体内提取、分离天然活性物质获得先导化 合物
02
03
04
05
06 Regulatory
concept
approval
靶点选择 Target selec
先导发现 Lead finding
临床前开发 Preclinical development
药物发明
开发
4
Discovery
Development
先导化合物
又称原型药,是指通过各种途径和方法 得到的具有独特结构且具有一定生物活性 的化合物。
13
实例分析
吲哚美辛类非甾体抗炎药的发现过程
分在析人:体炎炎症症的的重重要要介介质质55-羟色胺的功功能能被被揭揭示示后后,, 人可类以希考望虑能以以5-此羟作色为胺出作发为点先寻导找化治合疗物各,种从原因寻引找起其的拮炎抗 症物的为药出物发。点特开别发是药发物现。风而湿拮性抗关物节的炎结病构人应的尿与中5-,羟有色大胺 量相的似色,氨特酸别的是代发谢现产风物湿,性便关合节成炎了病大人量的含尿吲中哚环,的有化大合量 物的,色从氨中酸筛的选代出谢吲产哚物美,辛更(I进nd一om步et证ha实ci设n 计消拮炎痛抗)物作应为以 解含热吲镇哚痛环和化关合节物炎为治先疗导药物。,为于了是消合除成或了减大轻对量胃含肠吲道哚刺环 激的的化副合作物用,,选经择结出构吲改哚造美,辛又。开消发除了或吲减哚轻美辛吲类哚的美舒辛林的 酸副(作Su用li,nd但ac不)。能分改析变这其样活工性作,的必基须本保思留路其。基本结构, 所以开发了吲哚美辛的电子等排物舒林酸。
新药理5新药药效学-新药研究与开发PPT课件

业的合法权益。
新药研发的风险与投资
01
02
03
04
风险评估与管理
对新药研发过程中可能 出现的风险进行评估和 管理,降低风险对项目 的影响。
投资回报分析
对新药研发项目的投资 回报进行评估,确保项 目的经济可行性。
融资渠道
为新药研发项目提供多 元化的融资渠道,包括 政府资助、企业自筹、 风险投资等。
合作与联盟
通过与其他企业和研究 机构的合作与联盟,共 同分担新药研发的风险 和成本,提高项目的成 功率。
05
新药的药效学研究展望
新药药效学研究的未来发展方向
精准医疗
随着基因组学、蛋白质组学和代 谢组学等研究的深入,新药药效 学研究将更加精准,针对特定基 因型或表型的患者进行个性化治 疗。
免疫疗法
免疫疗法是新药研发的重要方向, 通过调节人体免疫系统来治疗疾 病,具有广阔的应用前景。
数据分析
对实验数据进行统计分析,运用统计学方法对实验结果进行科学评估。数 据分析应包括数据的描述性统计、方差分析、回归分析等方法的应用。
结果解读
根据数据分析结果,结合实验目的和评价指标,对药物的药效 进行评价和解读,为药物的进一步研究和开发提供科学依据。
04
新药的研发过程与管理
新药研发的流程与阶段
新药理5新药药效学新药研究与开发ppt课件 Nhomakorabea目录
• 新药药效学概述 • 新药的发现与筛选 • 新药的药效学评价 • 新药的研发过程与管理 • 新药的药效学研究展望
01
新药药效学概述
新药药效学的定义与重要性
定义
新药药效学是新药研究与开发过程中, 对药物作用机制、药效特性以及药物 与机体相互作用的研究。
新药研发的风险与投资
01
02
03
04
风险评估与管理
对新药研发过程中可能 出现的风险进行评估和 管理,降低风险对项目 的影响。
投资回报分析
对新药研发项目的投资 回报进行评估,确保项 目的经济可行性。
融资渠道
为新药研发项目提供多 元化的融资渠道,包括 政府资助、企业自筹、 风险投资等。
合作与联盟
通过与其他企业和研究 机构的合作与联盟,共 同分担新药研发的风险 和成本,提高项目的成 功率。
05
新药的药效学研究展望
新药药效学研究的未来发展方向
精准医疗
随着基因组学、蛋白质组学和代 谢组学等研究的深入,新药药效 学研究将更加精准,针对特定基 因型或表型的患者进行个性化治 疗。
免疫疗法
免疫疗法是新药研发的重要方向, 通过调节人体免疫系统来治疗疾 病,具有广阔的应用前景。
数据分析
对实验数据进行统计分析,运用统计学方法对实验结果进行科学评估。数 据分析应包括数据的描述性统计、方差分析、回归分析等方法的应用。
结果解读
根据数据分析结果,结合实验目的和评价指标,对药物的药效 进行评价和解读,为药物的进一步研究和开发提供科学依据。
04
新药的研发过程与管理
新药研发的流程与阶段
新药理5新药药效学新药研究与开发ppt课件 Nhomakorabea目录
• 新药药效学概述 • 新药的发现与筛选 • 新药的药效学评价 • 新药的研发过程与管理 • 新药的药效学研究展望
01
新药药效学概述
新药药效学的定义与重要性
定义
新药药效学是新药研究与开发过程中, 对药物作用机制、药效特性以及药物 与机体相互作用的研究。
新药研发过程

Ⅲ期临床试验:大规模多中心临床试验
扩大样本量和试验范围
在Ⅲ期临床试验阶段,新药将被测试在更大规模的人群中, 且通常会在多个医疗机构进行。这一阶段旨在进一步验证药 物的疗效和安全性。
为药物上市申请提供依据
最后阶段的临床试验结果将为新药的上市申请提供关键依据 。如果新药在Ⅲ期临床试验中表现出良好的疗效和安全性, 监管机构通常会批准其上市。
近年来,免疫疗法、基因疗法等新兴领域的发展为新药研发提供了新的思路和方法,这些技术有可能引领未来新药研发的 走向。
06
案例分享
新药研发成功案例介绍
01
药物名称:泰诺福韦酯
02
03
04
研发背景:针对丙型肝炎病毒 (HCV)感染,市场对安全、 有效的抗病毒药物需求迫切。
研发过程:通过化合物的筛选 、细胞水平抗病毒活性测试、 体内药效评价等环节,发现泰 诺福韦酯具有高效的抗HCV活 性,并能有效降低肝纤维化和 肝癌的发生率。
新药研发过程
xx年xx月xx日
目录
• 新药发现阶段 • 临床前研究阶段 • 临床研究阶段 • 新药上市和市场推广 • 新药研发的挑战与未来发展 • 案例分享
01
新药发现阶段
疾病概述和药物靶点确认
疾病类型和症状
对目标疾病进行详细分类和了 解其症状,为新药研发提供基
础。
病理机制
研究疾病的病理机制,包括疾病 发生、发展和转归的全过程。
临床前研究总结与新药申请
临床前研究总结
对临床前研究的结果进行总结和评价,评估药物的疗效和安 全性,确定药物的临床试验方案和剂量。
新药申请
向国家药品监督管理部门提交新药申请,申请进行临床试验 或生产销售,并提交相关的技术资料和样品。
新药研发过程

•
人文关怀、专注药研—黄从海博士与大家共勉
CH3 HS CH2 CH CO N COOH
巯甲丙脯酸 (Captopril)
CH3 CH2 CH2 CH NH CH CO N COOC2H5 CH3 CH2 CH2 CH NH CH CO N H H CH NH CH CO N COOC2H5 CH3 COOH COOH COOH COOH
•
•
药效关系研究:化学结构相似或立体结构相似的化合物,可能具有相似或相反的生物 活性。 (图1-1,1-2);
新方法、新技术:评价生物活性的新方法、新技术,对于发现新的活性物质致关重要; 如对高通量筛选的反思、对现有评价思路的反思和发展(药效、药代效果甚至制剂方 法等的综合考量); 偶然发现。建立在大量的研发工作和细心全面的总结的基础上,如“伟哥”的发现。
人文关怀、专注药研—黄从海博士与大家共勉
新药开发的一般程序
待测样品(天然、合成或生物工程产物) 初筛 生物模型(体外、体内)
有活性
无活性
化学部分 工艺路线 质量标准
临床前药理
制剂部分 剂型、含量标准、 稳定性、溶出度 生物利用度
药效学
一般药理学 毒理学
药动学
临床试验评价ຫໍສະໝຸດ Ⅰ期Ⅱ期Ⅲ期
Ⅳ期
人文关怀、专注药研—黄从海博士与大家共勉
人文关怀、专注药研—黄从海博士与大家共勉
新药的分类(SFDA)
生物制品注册分类
1. 未在国内外上市销售的生物制品。 2. 单克隆抗体。 3. 基因治疗、体细胞治疗及其制品。 4. 变态反应原制品。 5. 由人的、动物的组织或者体液提取的,或者通过发酵制备的具有生物活性的多组份制品。 6. 由已上市销售生物制品组成新的复方制品。 7. 已在国外上市销售但尚未在国内上市销售的生物制品。 8. 含未经批准菌种制备的微生态制品。 9. 与已上市销售制品结构不完全相同且国内外均未上市销售的制品(包括氨基酸位点突变、缺 失,因表达系统不同而产生、消除或者改变翻译后修饰,对产物进行化学修饰等)。 10. 与已上市销售制品制备方法不同的制品(例如采用不同表达体系、宿主细胞等)。 11. 首次采用DNA重组技术制备的制品(例如以重组技术替代合成技术、生物组织提取或者发 酵技术等)。 12. 国内外尚未上市销售的由非注射途径改为注射途径给药,或者由局部用药改为全身给药的 制品。 13. 改变已上市销售制品的剂型但不改变给药途径的生物制品。 14. 改变给药途径的生物制品(不包括上述12项)。 15. 已有国家药品标准的生物制品。
创新药研发流程ppt课件

新药研发的风险与不可预测性
I期 IND 提交
II 期
III 期
NDA 提交
10,000 个化合物
2Байду номын сангаас0 个 化合物
5 Compounds 5 个化合物 20 – 100 名志 愿者 100 – 500名 志愿者 6年 $414.7MM 1,000 – 5,000 名志愿者
1 个FDA 审批药 物
5年 $323.5MM
创新药研发流程
我国新旧药品注册分类比较-旧版
1.未在国内外上市销售的药品:
(1)通过合成或者半合成的方法制得的原料药及其制剂; (2)天然物质中提取或者通过发酵提取的新的有效单体及其制剂; (3)用拆分或者合成等方法制得的已知药物中的光学异构体及其制剂; (4)由已上市销售的多组份药物制备为较少组份的药物; (5)新的复方制剂; (6)已在国内上市销售的制剂增加国内外均未批准的新适应症。
组合生物合成和组合生物催化
基于临床副作用观察产生先导物 虚拟筛选
分子的多样性(diversity)是先导物发现 的物质基础
先导化合物(lead compound)
在药物设计时,分子的多样性、互补性和相似性构成了
设计方法的策略基础
分子的多样性
分子的互补性 分子的相似性
基于生物大分子结构和作用机理 的药物分子设计 反义寡核苷酸 分子的互补性(complementarity)是分 子识别和受体-配体结合的基础和推动力
Nominate)
先导化合物的发现(lead Identification)
先导化合物(lead compound),是指新发现的对某种靶标或 生物模型呈现药理活性的化合物。 由于其活性不强,选择性低,吸收性差,或毒性较大等缺点,通常 不能直接药用。但作为新的结构类型和线索物质,对先导物进 行结构变换和修饰,可得到具有优良药理作用的药物。 获得先导化合物可有多种途径:
中药新药研发流程基础知识PPT课件

10/25/201数据统计,确定研发新品处方及剂型 。 2.2、运用中医理论、临床经验和现代科学技术进行中药新药发现, 通过经方、验方、祖传秘方等临床有效处方,科研方和天然药物的 挖掘整理,科学分析,为创新药物发现提供处方来源。
2.3、以处方中药材的性质及服用量来确定剂型。
皮肤、粘膜、肌肉等)刺激性、依赖性等主要与局部、全身给药相 关的特殊安全性试验资料和文献资料。
25.遗传毒性试验资料及文献资料。 26.生殖毒性试验资料及文献资料。 27.致癌试验资料及文献资料。 28.动物药代动力学试验资料及文献资料。
10/25/2019
12
6、临床研究
每一种候选药物或疫苗在获得使 用批准之前,必须在志愿者中间进行 严格的系统性测试以对新产品是否可 以应用于更广泛的人群进行评估
。 12.生产工艺的研究资料、工艺验证资料及文献资料,辅料来源
及质量标准。 13.化学成份研究的试验资料及文献资料。 14.质量研究工作的试验资料及文献资料。 15.药品标准草案及起草说明,并提供药品标准物质及有关资料
。 16.样品检验报告书。 17.药物稳定性研究的试验资料及文献资料。 18.直接接触药品的包装材料和容器的选择依据及质量标准。
14
Ⅲ期:在此阶段,将 候选药物扩大到大规 模的患者人群(1,0003,000人),进一步测试 其效果,监测其副作 用。在某些情况下, 如可行,将与治疗标 准进行对比。
10/25/2019
Ⅳ期:在药物或治疗 经过有关政府与监管 部门批准上市销售后 ,可以在更长时间段 、更大规模人群中对 其安全性与效果进行 研究,也可以继续对 部分已上市销售的产 品的新适应症进行研 究。之后,通常有成 千上万人参加五期试 验。
15
新药研发的过程PPT演示课件
Ⅳ期临床试验目的是考察在广泛使用的条件下药物的疗效和
不良反应,评价新药在普通或特征人群中使用的利益与风险
关系,改进给药剂量。2004年默克公司的万络和辉瑞公司的
塞来考昔,抗关节炎药物被公司自动收回。
•6
•7
•8
•9
•10
•ቤተ መጻሕፍቲ ባይዱ1
•12
•13
•14
3)基于结构药物设计:活性构象、药效构象、药效基团、
分子模拟、QSAR方法、虚拟筛选方法等等。
二、先导化合物的优化
基团替换;结构简化;模仿药物;前药、软药、孪药原理;
拼合原理、生物电子等排、骨架迁越、五倍率等。
三、临床前药理、药代等
四、临床
•3
1)先导化合物的发现
通过各种途径、方法或手段获
得的具有一定生物活性的新的
结构类型化学物。
2)先导化合物结构优化
对先导化合物做进一步的结构
进行修饰和改造 ,提高活性和
特异性,改善药代动力学特性,
衍生出选择性高、安全性好、
活性大 性大的新的药物。
•4
3)新药临床前研究
需要做普通的、全面的、必需的试验
研究内容包括:
1)药物的理化性质
2)药理学、
3)药效动力学
4)药代动力学
•1
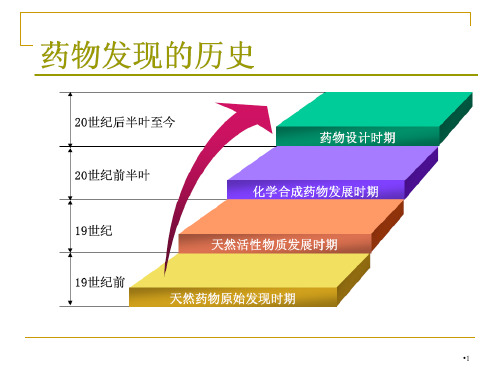
新药研发的过程
1)先导化合物的发现
2)先导化合物的优化
3)新药临床前研究
4)新药临床研究与应用
•2
一、先导化合物的发现
1、传统方法:随机筛选/偶然发现;天然来源/合成物的随
机筛选与意外发现;药理筛选与意外发现等等。
2、现代方法——合理药物设计法
1)组合化学与高通量筛选。
不良反应,评价新药在普通或特征人群中使用的利益与风险
关系,改进给药剂量。2004年默克公司的万络和辉瑞公司的
塞来考昔,抗关节炎药物被公司自动收回。
•6
•7
•8
•9
•10
•ቤተ መጻሕፍቲ ባይዱ1
•12
•13
•14
3)基于结构药物设计:活性构象、药效构象、药效基团、
分子模拟、QSAR方法、虚拟筛选方法等等。
二、先导化合物的优化
基团替换;结构简化;模仿药物;前药、软药、孪药原理;
拼合原理、生物电子等排、骨架迁越、五倍率等。
三、临床前药理、药代等
四、临床
•3
1)先导化合物的发现
通过各种途径、方法或手段获
得的具有一定生物活性的新的
结构类型化学物。
2)先导化合物结构优化
对先导化合物做进一步的结构
进行修饰和改造 ,提高活性和
特异性,改善药代动力学特性,
衍生出选择性高、安全性好、
活性大 性大的新的药物。
•4
3)新药临床前研究
需要做普通的、全面的、必需的试验
研究内容包括:
1)药物的理化性质
2)药理学、
3)药效动力学
4)药代动力学
•1
新药研发的过程
1)先导化合物的发现
2)先导化合物的优化
3)新药临床前研究
4)新药临床研究与应用
•2
一、先导化合物的发现
1、传统方法:随机筛选/偶然发现;天然来源/合成物的随
机筛选与意外发现;药理筛选与意外发现等等。
2、现代方法——合理药物设计法
1)组合化学与高通量筛选。
相关主题
